糖尿病预防或改善剂的制作方法
本发明涉及糖尿病预防或改善剂、代谢综合征预防或改善剂、HOMA-IR的升高抑制或改善剂、脂肪蓄积抑制或改善剂、餐后血糖值的升高抑制剂、糖分解抑制剂、α-葡糖苷酶活性抑制剂、淀粉酶活性抑制剂、脂质排出(排泄)促进剂、脂肪酶活性抑制和脂质代谢提高剂。
背景技术:
近年来,热量摄取过多成为生活习惯病的病因。特别是认为抑制以淀粉为代表的碳水化合物的消化吸收对肥胖的预防和治疗有效。
作为中美洲原产灌木的番石榴,其果实、根和叶在民间作为生药被用于治疗糖尿病或止泻,但最近发现了:将其叶用水或亲水性溶剂进行提取而获得的提取物具有α-淀粉酶活性抑制作用,被用作健康饮料(专利文献1)或膳食饮食品(diet foods and drinks) (专利文献2)。
另外,还确认到将玉米的淀粉焙烧并用淀粉酶水解后提取出难消化性成分调制而成的水溶性食物纤维即难消化性糊精具有抑制餐后血糖值升高的作用(非专利文献1),被用作特定保健用食品的材料。
另一方面,关于作为茶树(Tea tree)的山茶(Camellia sinensis)的植物体成分,报道了茶儿茶精类具有抑制胆固醇升高的效果(专利文献3)、非聚合体儿茶精类具有促进蓄积体脂肪的燃烧、促进饮食性脂肪的燃烧、促进肝脏β氧化基因的表达等各种效果(专利文献4)。
现有技术文献
专利文献
专利文献1:日本特公昭60-36746号公报;
专利文献2:日本特开平7-59539号公报;
专利文献3:日本特开昭60-156614号公报;
专利文献4:日本特开2002-326932号公报;
非专利文献
非专利文献1:健康、营养食品研究(健康·栄養食品研究), 第2卷, No. 4, 1999。
技术实现要素:
发明所要解决的课题
但是,关于山茶的植物体成分具有有效地抑制餐后血糖值升高的作用等与糖尿病预防或改善有关的作用的报道尚属未知。本发明的目的在于找到可有效发挥下述的各种作用、并且安全的成分:改善胰岛素抵抗性、抑制或改善HOMA-IR的升高、抑制或改善高血糖的恶化、抑制餐后血糖值的升高、抑制α-葡糖苷酶活性、抑制淀粉酶活性、抑制脂肪酶活性、提高脂质代谢、促进脂质排出、抑制或改善脂质蓄积、预防或改善糖尿病等。
用于解决课题的手段
本发明人在对山茶的近缘属种的植物体成分进行各种研究时发现:山茶与其近缘属种即大理茶(Camellia taliensis)的杂交种的植物体成分具有改善胰岛素抵抗性的效果,另外还具有抑制餐后血糖值等的血糖值升高的作用、以及抑制α-葡糖苷酶活性的作用。而且,还发现该植物体成分具有淀粉酶活性抑制效果、脂质排出促进效果,并具有脂肪酶活性抑制作用、脂质代谢的提高作用,完成了本发明。
本发明提供以下方案。
[1] 糖尿病预防或改善剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[2] 代谢综合征预防或改善剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[3] HOMA-IR的升高抑制或改善剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[4] 脂肪蓄积抑制或改善剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[5] 餐后血糖值的升高抑制剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[6] 糖分解抑制剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[7] α-葡糖苷酶活性抑制剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[8] 淀粉酶活性抑制剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[9] 脂质排出促进剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[10] 脂肪酶活性抑制和脂质代谢提高剂,其以山茶与大理茶的杂交种植物体的成分作为有效成分。
[11] [1]~[10]中任一项所述的药剂,其中,山茶与大理茶的杂交种为Sunrouge (サンルージュ,Camellia sinensis (L.) Kuntze sp Sunrouge)。
[12] [1]~[11]中任一项所述的药剂,其包含山茶与大理茶的杂交种植物体的茶叶提取物。
[13] [12]所述的药剂,其中,茶叶提取物是相对于茶叶提取物的干燥重量含有0.13重量%以上的飞燕草素(Delphinidin)或其糖苷的茶叶提取物。
[14] 改善或预防糖尿病的方法,该方法包括:给对象使用包含山茶与大理茶的杂交种植物体的成分作为有效成分的药剂或组合物来改善或预防对象的糖尿病。
发明效果
根据本发明,提供糖尿病预防或改善剂、代谢综合征预防或改善剂、HOMA-IR的升高抑制或改善剂、脂肪蓄积抑制或改善剂、餐后血糖值的升高抑制剂、糖分解抑制剂、α-葡糖苷酶活性抑制剂、淀粉酶活性抑制剂、脂质排出促进剂、以及脂肪酶活性抑制和脂质代谢提高剂。由于本发明的各药剂是以一直以来作为茶饮用的山茶与大理茶的杂交种植物体的成分作为有效成分,因此即使长期摄取,其安全性也高,可以日常摄取。
附图说明
图1是显示试验例1中的小鼠睾丸周边脂肪重量的测定结果的图。
图2是显示试验例1中的HOMA-IR的图。
图3是显示试验例2中的餐后血糖值的AUC (0分钟~150分钟)的图。
图4是显示试验例2中的餐后血糖值的AUC (0分钟~30分钟)的图。
图5是显示试验例3中的α-葡糖苷酶活性抑制率的图。
图6是显示试验例6中的餐后血糖值的AUC (0分钟~30分钟)的图。
图7是显示试验例10中的飞燕草素的残留率的图。
具体实施方式
本发明的药剂以山茶(Camellia sinensis)与大理茶(Camellia taliensis)的杂交种植物体的成分作为有效成分。
山茶与大理茶的杂交种是将属于山茶的植物体与属于大理茶的植物体组合进行繁殖而获得的品种。繁殖可以是人工繁殖也可以是自花受粉等自然繁殖。可以是第1代(杂种第1代)及其子孙(例如杂种第1代的自然杂交种)的任一种。山茶也称作茶树。山茶优选为绿茶用品种(Yabukita (やぶきた,薮北)、Okumusashi (おくむさし)等),更优选为Okumusashi。大理茶是山茶科植物,是山茶的近缘属种,也称作红芽(Akame)。
关于大理茶和大理茶的杂交种,作为杂交种,优选“Sunrouge” (Camellia sinensis (L.) Kuntze、农林水产省 品种登记号:21262)、F95181 (茶中间母本农6号),更优选“Sunrouge”。
作为本发明的药剂,例示胰岛素抵抗性改善剂、糖分解抑制剂、α-葡糖苷酶活性抑制剂、脂肪酶活性抑制和脂质代谢提高剂、淀粉酶活性抑制剂、餐后血糖值的升高抑制剂、脂质排出促进剂、脂质蓄积抑制或改善剂、代谢综合征预防或改善剂、HOMA-IR的升高抑制或改善剂、高血糖的恶化抑制或改善剂、以及糖尿病预防或改善剂。
本发明的糖尿病预防或改善剂可以预防或改善糖尿病(通常是指II型糖尿病)和代谢综合征。代谢综合征是指以内脏脂肪型肥胖作为共同因素引起了高血糖、脂质异常、高血压的状态。
预防是指抑制患病。作为糖尿病的预防,例如包括:防止对象的血糖值指标(空腹时血糖值、餐后血糖值(餐后30分钟血糖值、餐后2小时血糖值等)、口服葡萄糖负荷试验中的血糖值、血红蛋白(Hb) A1c值等)向糖尿病型转变(例:防止由正常型向临界型转变、维持正常型不变、维持临界型不变、由临界型向正常型转变)。
改善是指虽然已经患病但会改善、缓和其症状或者抑制其症状恶化。具体而言,例如包括:虽然对象的血糖值指标为糖尿病型,但使其接近正常值(例:向临界型或正常型的值转变、虽然没有超出正常型的范围但提高至临界型附近)。
作为代谢综合征的预防或改善,例如除了上述糖尿病的预防和改善的例子以外,还包括脂质异常的正常化和血压的正常化。
糖尿病的预防或改善效果只要依据选自以下的一种以上的确认即可:确认发挥胰岛素抵抗性改善效果、确认抑制或改善HOMA-IR的升高、确认发挥餐后血糖值升高抑制效果、确认发挥α-葡糖苷酶活性抑制效果、确认发挥淀粉酶活性的抑制效果、确认发挥脂肪酶活性的抑制效果、确认发挥提高脂质代谢的效果、确认发挥促进脂质排出的效果、和确认发挥抑制或改善脂质蓄积的效果。
糖尿病预防或改善剂的对象可以是糖尿病患者、糖尿病预备军、具有罹患糖尿病的风险的人,但也可以是健康的人(例:高龄者、肥胖者、高血压者、其他考虑想要预防糖尿病的人)。对象包括人和人以外的动物(宠物(例:狗、猫、鹦鹉)、家畜(例:牛、猪、山羊、绵羊、马)、家禽(例:鸡、鹌鹑、火鸡)、实验动物(例:小鼠、大鼠、仓鼠、豚鼠、兔))。
本发明的药剂可以改善胰岛素抵抗性。胰岛素抵抗性是指胰岛素不易起效。改善胰岛素抵抗性是指使胰岛素抵抗性接近正常值、以及保持在正常值的范围。胰岛素抵抗性的确认可以通过HOMA-IR (HOMA-R指数、homeostasis model assessment RATIO (稳态模型评价比)、homeostasis model assessment as an index of insulin resistance (稳态模型评价作为胰岛素抵抗性的指数))、葡萄糖钳夹技术、稳态血糖(stedy state plasma glucose,SSPG)法、由空腹时的血清胰岛素值和血糖值进行的推测等方法来进行,其中优选根据HOMA-IR进行的测定。胰岛素抵抗性得到改善可以通过HOMA-IR的升高得到抑制、或者HOMA-IR维持在低水平来确认。因此,本发明的药剂可以抑制或改善HOMA-IR的升高。另外,当胰岛素抵抗性有所改善时,血糖值的升高也会得到抑制,因此胰岛素抵抗性得到改善可以通过血糖值的升高得到抑制来确认。
本发明的药剂可以抑制餐后血糖值的升高。抑制血糖值的升高是指抑制血糖值的升高、或者维持血糖值在正常值的状态。血糖值可以通过测定血中的葡萄糖来确认,确认血糖值的升高得到抑制可以通过确认血中葡萄糖的测定值是否在正常值的范围内来实现。
抑制餐后血糖值的升高是指抑制餐后血糖值的升高、或者维持餐后血糖值在正常值的状态。餐后只要是进餐结束后即可,但优选进餐结束后0~30分钟。餐后血糖值可以通过血糖下面积(AUC、Area Under The Curve,曲线下面积)来确认。餐后血糖值升高的改善可以通过AUC的减少来确认。
本发明的药剂可以促进脂质排出。促进脂质排出是指使脂质排出量较通常有所增加。脂质排出量例如可以通过测定粪便中的脂质排出量来确认。另外,脂质排出得到促进可以根据粪便中的脂质排出量较通常有所增加来确认。另外,通过促进脂质排出,体重减少、或者体脂肪减少,因此根据体重减少或者体脂肪减少,也可以确认脂质排出得到促进。
脂质排出得到促进的结果,本发明的药剂抑制体重增加、发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化、并预防或改善糖尿病。
本发明的药剂可以抑制或改善脂质蓄积。抑制或改善脂质蓄积是指减少新蓄积的脂质量、以及减少已经蓄积的脂质。关于脂质蓄积得到抑制或改善,可通过体脂肪量得以维持、体脂肪量减少来确认。作为体脂肪量的替代,根据体重得到维持、体重减少,也可以确认脂质蓄积得到抑制或改善。另外,通过确认脂肪排出得到促进,也可以确认脂肪蓄积得到抑制或改善。
抑制或改善脂质蓄积的结果,本发明的药剂抑制体重增加,发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化,预防或改善糖尿病。
本发明的药剂可以抑制糖分解。抑制糖分解通常通过抑制与糖分解有关的酶的活性来进行。作为所述的酶,例示α-葡糖苷酶、淀粉酶。
本发明的药剂可以抑制α-葡糖苷酶活性。α-葡糖苷酶是切断α-1,4糖苷键的酶,与糖的分解有关。通过抑制α-葡糖苷酶活性,可以防止糖在体内分解、抑制糖的吸收,因此可以抑制血糖值的升高。抑制血糖值升高的结果,抑制体重增加,发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化,预防或改善糖尿病。活性抑制是指降低酶的活性或使其消失。活性抑制的方式可以是底物抑制、竞争(拮抗)抑制、非竞争(非拮抗)抑制、不竞争(不拮抗)抑制、或这些抑制中的两种以上的组合(混合型抑制)的任一种方式。α-葡糖苷酶活性可以通过测定与底物作用后的分解物的量来确认,当分解物的量减少时,可以确认发生了活性抑制。在α-葡糖苷酶活性的测定中,可以使用QuantiChrom (注册商标) α-葡糖苷酶测定试剂盒(BioAssay Systems公司制造)等比色测定试剂盒。另外,当α-葡糖苷酶活性被抑制时,血糖值的升高也被抑制,因此α-葡糖苷酶活性受到抑制可以通过血糖值的升高受到抑制来确认。
本发明的药剂可以抑制淀粉酶活性。淀粉酶是水解淀粉的酶。通过抑制淀粉酶,可以抑制淀粉在体内分解成糖,其结果,可以抑制糖在体内的吸收,因此可以抑制血糖值的升高。抑制血糖值升高的结果,可抑制体重增加,发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化,预防或改善糖尿病。
淀粉酶活性可以通过以往公知的方法来测定,例如,可以使用MaxDiscovery (注册商标)淀粉酶测定试剂盒(Bioo Scientific Corporation制造)等。
本发明的药剂可以抑制脂肪酶活性。脂肪酶是将甘油酯水解而使脂肪酸游离的酶。脂肪酶可以是来自生物体的任一个组织的脂肪酶,例如可以列举来自胰腺的胰脂肪酶。本发明的药剂特别是可以抑制胰脂肪酶活性。通过抑制脂肪酶,脂质的分解得到抑制,脂质在体内的吸收得到抑制,其结果,促进脂质排出到体外。利用所述的作用,抑制体重增加,发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化,预防或改善糖尿病。
本发明的药剂可以提高脂质代谢。通过提高脂质代谢,抑制脂质在生物体内蓄积,促进脂质排出到体外。利用所述的作用,抑制体重增加,发挥抗肥胖作用,其结果,期待着抑制或改善高血糖状态的恶化,预防或改善糖尿病。脂质代谢提高例如可以根据在肝脏内与脂质代谢途径有关的至少一部分基因的表达量升高来确认。基因的表达量例如可以通过微阵列分析(Agilent公司制造、全小鼠基因组寡DNA微阵列试剂盒 2.0版)来进行分析。
本发明的α-葡糖苷酶活性抑制剂的对象可以是糖尿病患者、餐后高血糖患者、耐糖能力异常者、高脂血症患者、高血压患者、这些疾病的预备军或有风险的人,但也可以是健康的人(例:高龄者、肥胖者、其他不想让餐后血糖值升高的人、考虑想要抑制上述疾病的发生的人)。对象包括人和人以外的动物。
本发明的淀粉酶活性抑制剂的对象可以是糖尿病患者、餐后高血糖患者、耐糖能力异常者、高脂血症患者、高血压患者、这些疾病的预备军或有风险的人,但也可以是健康的人(例:高龄者、肥胖者、其他不想让餐后血糖值升高的人、考虑想要抑制上述疾病的发生的人)。对象包括人和人以外的动物。
本发明的餐后血糖值升高抑制剂的对象可以是餐后高血糖患者(往往还是耐糖能力异常者、糖尿病患者、动脉硬化患者)、餐后高血糖预备军、具有餐后高血糖风险的人,但也可以是健康的人(例:高龄者、肥胖者、其他考虑想要抑制餐后高血糖的发生的人)。对象包括人和人以外的动物。
本发明的脂质蓄积抑制或改善剂的对象可以是代谢综合征的患者、糖尿病患者、高脂血症患者、高血压患者,但也可以是健康的人。对象包括人和人以外的动物。
本发明的代谢综合征预防或改善剂的对象除了糖尿病患者、代谢综合征患者以外,还可以是健康的人(例:高龄者、肥胖者、其他考虑想要抑制代谢综合征的发生的人)。对象包括人和人以外的动物。
本发明的胰岛素抵抗性改善剂、HOMA-IR的升高抑制或改善剂的对象可以是胰岛素抵抗性患者(往往还是糖尿病、高血压、高脂血症、代谢综合征的患者)、具有该风险的人,但也可以是健康的人(例:高龄者、肥胖者、其他考虑想要抑制胰岛素抵抗性的发生的人)。对象包括人和人以外的动物。
本发明的高血糖的恶化抑制或改善剂的对象可以是糖尿病患者、耐糖能力异常者、这些疾病的预备军或有风险的人,但也可以是健康的人(例:高龄者、肥胖者、其他不想让血糖值升高的人、考虑想要抑制上述疾病的发生的人)。对象包括人和人以外的动物。
本发明的脂肪酶活性抑制和脂质代谢提高剂的对象可以是代谢综合征患者、糖尿病患者、高脂血症患者、高血压患者,但也可以是健康的人。对象包括人和人以外的动物。
本发明的脂质排出促进剂的对象可以是代谢综合征患者、糖尿病患者、高脂血症患者、高血压患者,但也可以是健康的人。对象包括人和人以外的动物。
植物体的成分只要是植物体的至少一部分所包含的成分即可。作为植物体的一部分,例如可以列举:根、茎、叶、花、果实、枝、种子、芽等。其中优选为包含茎和/或叶的部分,更优选为茎和/或叶。对山茶与大理茶的杂交种植物体的成分的调制方法没有特别限定,例示由植物体进行的提取、纯化等。本发明的药剂优选以该植物体的叶(茶叶)提取物的形式包含山茶与大理茶的杂交种植物体的成分。
本发明的药剂以山茶与大理茶的杂交种植物体的成分作为有效成分。作为该成分,例示花青苷(Anthocyanin)、飞燕草素、飞燕草素的糖苷、儿茶精类(例如表没食子儿茶精没食子酸酯)、咖啡因、氨基酸、氨基酸的盐、水解型单宁(例如strictinin)、theogallin、theogallin衍生物等。这些成分可以是单独的一种,也可以是两种以上的组合。
在本发明中,山茶与大理茶的杂交种植物体的成分优选至少包含飞燕草素或其糖苷,更优选至少包含飞燕草素和/或其糖苷和儿茶精类,优选至少包含飞燕草素和/或其糖苷和儿茶精类、以及选自咖啡因、氨基酸、氨基酸的盐、水解型单宁、theogallin和theogallin衍生物的1种以上。当本发明的药剂包含两种以上的成分时,本发明的药剂可以说成是组合物。
飞燕草素是构成花青苷的花青素(Anthocyanidin)的一种。花青素分为飞燕草素(Delphinidin)、矢车菊素(Cyanidin)、花葵素(Pelargonidin)、橙苷色素(Aurantinidin)、木樨黄定(Luteolinidin)、芍药色素(Peonidin)、锦葵花素(Malvidin)、矮牵牛素(Petunidin)、欧天芥菜色素(Europinidin)、松香色素(Rosinidin)等。飞燕草素是3,5,7-三羟基-2-(3,4,5-三羟基苯基)-1-苯并吡喃鎓(C15H11O7)。飞燕草素的糖苷是指飞燕草素中所含的1个以上的羟基的氢原子被取代成其他取代基而获得的化合物。取代部位优选3位或6位。作为其他取代基的例子,可以列举:从半乳糖、葡萄糖等糖中除去了1个氢原子而获得的基团。作为飞燕草素的糖苷的例子,可以列举:飞燕草素-3-O-(6-反式-对香豆酰)-β-半乳糖苷(DCGa)、飞燕草素-O-β-半乳糖苷(D3Ga)和飞燕草素-3-β-葡萄糖苷(D3G)。本发明的药剂可以包含一种飞燕草素或其糖苷,也可以包含飞燕草素及其糖苷的组合、或飞燕草素与两种以上的糖苷的组合。
本发明的药剂中的飞燕草素或其糖苷的含量相对于有效成分(当本发明的药剂含有茶叶提取物时是指茶叶提取物)的干燥重量优选为0.13重量%以上,更优选为0.16重量%以上,进一步优选为0.19重量%以上。对上限没有特定,但通常是0.5重量%以下。
当本发明的药剂包含飞燕草素以外的花青苷时,飞燕草素或其糖苷的含量在花青苷的含量中所占的比例优选为50重量%以上,更优选为60重量%以上。对上限没有特别特定,但通常为90重量%以下。
花青苷的含量是指花青苷相对于有效成分(当本发明的药剂包含茶叶提取物时是指茶叶提取物)的干燥重量的含量。飞燕草素或其糖苷的含量是指飞燕草素或其糖苷相对于本发明药剂的干燥重量的含量。
飞燕草素或其糖苷相对于本发明药剂的干燥重量的含量可以通过高效液相色谱法(HPLC)来测定。花青苷相对于本发明药剂的干燥重量的含量可以通过HPLC来测定。
作为儿茶精类,可以列举:儿茶精(C)、没食子儿茶精(GC)、儿茶精没食子酸酯(CG)、没食子儿茶精没食子酸酯(GCG)、表儿茶精(EC)、表没食子儿茶精(EGC)、表儿茶精没食子酸酯(ECG)和表没食子儿茶精没食子酸酯(EGCG)、表没食子儿茶精-3-(3”-O-甲基)没食子酸酯(EGCG3”Me)、表儿茶精-3-(3”-O-甲基)没食子酸酯(ECG3”Me)。
儿茶精的含量可以通过HPLC或比色法来测定。
咖啡因是一种具有嘌呤环的嘌呤生物碱。咖啡因包含在咖啡、可乐、绿茶、红茶、乌龙茶、可可脂、巧克力、营养饮料等饮食品中,茶中所含的咖啡因因与单宁结合而使其效果被抑制,因此像咖啡这样的兴奋作用是轻微而缓慢地起作用。
本发明的药剂中的咖啡因含量相对于有效成分(当本发明的药剂包含茶叶提取物时是指茶叶提取物)的干燥重量优选为5.4重量%以下,更优选为5.2重量%以下,进一步优选为5.1重量%以下。对下限没有特别特定,但在不进行低咖啡因处理时,通常为2.5重量%以上。
咖啡因的含量可以通过HPLC来测定。
氨基酸是具有氨基和羧基这两种基团的化合物。作为氨基酸的例子,可以列举:茶氨酸、甘氨酸、精氨酸、赖氨酸、丙氨酸、谷氨酰胺、谷氨酸、组氨酸、苏氨酸、天冬酰胺、天冬氨酸、苯丙氨酸、亮氨酸、缬氨酸、色氨酸、脯氨酸、半胱氨酸、丝氨酸、酪氨酸、异亮氨酸、甲硫氨酸。作为氨基酸的盐的例子,可以列举:碱金属盐、碱土金属盐、铵盐、无机酸盐、有机酸盐等。
本发明的药剂中的氨基酸或其盐的含量相对于有效成分(当本发明的药剂含有茶叶提取物时是指茶叶提取物)的干燥重量优选为1.0重量%以上,优选为1.3重量%以上,更优选为1.5重量%以上。对上限没有特别特定,但通常为4.5重量%以下。
氨基酸或其盐相对于本发明药剂的干燥重量的含量可以通过HPLC来测定。
本发明的药剂通过包含水解型单宁而可以发挥抗过敏的效果。作为水解型单宁的例子,可以列举strictinin等,优选为strictinin。Strictinin是1,2-二-O-没食子酰基-4,6-O-(S)-六羟基二苯羰基-β-D-吡喃葡萄糖。
本发明的药剂中的水解型单宁的含量相对于有效成分(当本发明的药剂含有茶叶提取物时是指茶叶提取物)的干燥重量优选为1.7重量%以下,更优选为1.5重量%以下,进一步优选为1.4重量%以下。对下限没有特别特定,但通常为0.6重量%以上。
Strictinin等水解型单宁的含量可以通过HPLC来测定。
通过包含theogallin或其衍生物,可获得抗过敏的效果。Theogallin是三羟基苯甲酸的糖苷,也被称作(1S)-1β,3β,4β-三羟基-5α-(没食子酰氧基)环己烷羧酸。
Theogallin或其衍生物的含量相对于有效成分(当本发明的药剂含有茶叶提取物时是指茶叶提取物)的干燥重量优选为5.0重量%以下,更优选为3.0重量%以下,进一步优选为1.6重量%以下。对下限没有特别特定,但通常为0.7重量%以上。
Theogallin的含量可以通过HPLC来测定。
本发明的药剂优选包含山茶与大理茶的杂交种植物体的茶叶提取物,更优选包含该茶叶提取物作为有效成分。由此,可以均衡地包含上述的有效成分,可以显著发挥各种效能。
与以往已知的花青苷相比,茶叶提取物中所含的飞燕草素或其糖苷的稳定性高。稳定性可以用在温度100℃、时间120分钟的条件下加热茶叶提取物时茶叶提取物中的飞燕草素或其糖苷的残留率来表示。该残留率优选为90重量%以上。飞燕草素或其糖苷的残留率通过式(1)来计算。
式(1):
飞燕草素或其糖苷的残留率(%)=
{(在温度100℃、时间120分钟的条件下加热茶叶提取物后的飞燕草素或其糖苷的含量)/(上述加热前的茶叶提取物的飞燕草素或其糖苷的含量)}×100
对茶叶提取物的提取条件没有特别限定。例如,可以提取山茶与大理茶的杂交种植物体的茶叶而获得。
茶叶在提取前通常会制茶。作为制茶的茶叶的例子,可以列举:绿茶、红茶、乌龙茶等,优选绿茶。作为绿茶的茶叶的例子,可以列举:煎茶(Sencha)、玉露(Gyokuro)、日本粗茶(Bancha)、茎茶(Kukicha)、芽茶(Mecha)、粉茶(Konacha)、烤茶(Houjicha)、糙米茶(Genmaicha)、碾茶(Tencha)、釜炒茶(Kamairicha)、包种茶(Hoshucha)等。
在提取前可以对茶叶中的至少一部分进行粉碎处理,优选进行粉碎处理。粉末的粒径优选10mm以下,更优选5mm以下,进一步优选1mm以下。在粉碎处理中可以使用破碎机(例如,Multi-beads Shocker(注册商标、安井器械株式会社)、石磨、陶瓷磨、球磨机、锤磨机等。
作为提取溶剂,可以列举:水或乙醇水溶液,优选水。另外,乙醇水溶液中的乙醇浓度可以设定在不损害本发明效果的范围内,通常相对于乙醇水溶液整体为70重量%以下。用水进行提取时,提取温度优选70~100℃,更优选70~80℃。提取时间优选为5~60分钟,更优选5~10分钟。关于水与茶叶的重量比,相对于茶叶1,优选使用茶叶干燥重量的10倍以上的水,更优选使用茶叶干燥重量的10倍~100倍量的水。当提取温度高于100℃、且提取时间大于60分钟时,儿茶精的含量增加,因此苦味和涩味变强,适口性有可能变差。另外,用乙酸这样的有机溶剂进行提取时,虽然提取效率高,但因儿茶精类的含量增加,因此苦味和涩味强,适口性有可能变差。提取时可以进行搅拌。
茶叶提取物优选为在茶叶干燥重量的10倍量以上的水中、在温度70~100℃、时间5~60分钟的条件下进行提取而获得的茶叶提取物。
在提取处理后,可以通过过滤、离心分离、过筛等处理除去固体成分(固液分离)。过滤可以进行1次,也可以进行2次以上。过滤时可以使用滤纸、线性过滤器(Line Filter)等装置。离心分离可以以100g~15,000g的离心力来进行,时间可以设为1~60分钟。还可以进行浓缩(减压浓缩、反渗透膜处理等)、干燥(喷雾干燥、冷冻干燥等)等处理,优选进行浓缩和干燥两者。优选进行浓缩使浓缩物达到处理前的提取物重量的0.05倍,优选进行干燥使干燥物达到茶叶物重量的0.2倍。在浓缩和/或干燥后可以进行过滤、过筛。
对本发明的药剂的形态没有特别限定。作为形态的例子,可以列举:液体(胶囊、软胶囊等)、浆液(糖浆等)、半固体(膏、糊等)、固体(片剂、粉末(颗粒、细粒等)),优选为固体,优选为粉末。对本发明的药剂的剂型没有限定。作为剂型的例子,可以列举:丸剂、片剂、颗粒剂、悬浮剂、乳剂、散剂、糖浆剂、糖锭剂。
对本发明的药剂的给药方式没有特别限定,有口服给药、胃肠外给药(经肺给药、皮下给药、静脉内给药、髓腔内给药、经皮给药等)、舌下给药、吸入给药等,但通常为口服给药。
本发明的药剂可以包含有效成分以外的成分。当本发明的药剂包含有效成分以外的成分时,本发明的药剂还可以说成是组合物。作为有效成分以外的成分,例示各种添加剂。作为添加剂的具体例子,可以列举以下物质:调味品;酸味剂(枸橼酸、琥珀酸等);保存剂(抗坏血酸、乙酸盐、ε-聚赖氨酸等);pH调节剂;乳化剂(蔗糖脂肪酸酯、甘油脂肪酸酯、有机酸单甘油酯、卵磷脂等);香料;色素;增稠剂(卡拉胶、黄原胶等);膨胀剂;蛋白(大豆蛋白、乳蛋白等);糖类(淀粉、蔗糖、果糖、还原淀粉糖化物、赤藓糖醇、木糖醇等);甜味剂(三氯半乳蔗糖、奇甜蛋白等);维生素类(维生素A、维生素C、维生素E、维生素K等);矿物质类(铁、钙等)。
本发明的药剂可以用作饮食品、或饮食品添加剂。作为饮食品的例子,可以列举:饮料(清凉饮料、碳酸饮料、营养饮料、粉末饮料、果汁饮料、乳饮料、果冻饮料、啤酒、日本酒、洋酒、中国酒、药酒等);米饭类(饭、粥等);面包类;调味料(沙司、味噌、酱油、蛋黄酱、起酥油、调味汁、佐料汁、香辛料等);大豆食品(纳豆、豆腐、油炸豆腐等);水产加工食品(鱼糕(Kamaboko)、鱼肉山芋方形蒸饼(Hanpen)、鱼卷(Chikuwa)、鱼肉剁碎制成的熟食品(Fish Cakes)等);食肉加工品(火腿、香肠、维也纳香肠等);农产加工食品(蔬菜、水果等);泡菜类;面条类(面条、荞麦面条、意大利式细面条等);汤类(粉末汤、液体汤等);乳制品(奶酪、酸乳、奶油等);点心类(果子冻、小吃、口香糖、糖果、巧克力、蛋糕等);健康食品(功能性食品、营养辅助食品(补品)、特定保健用食品);特定对象的饮食品(医疗用食品、患者用食品、婴儿用食品、介护用食品、高龄者用食品)等。饮食品添加剂所针对的饮食品的例子也和上述具体例子相同。而且,本发明的药剂可以用作饲料或饲料用添加剂。饲料的对象只要是人以外的动物即可。
对本发明的药剂的给药时期没有特别限定,当为餐后血糖值升高抑制剂、糖分解抑制剂、α-葡糖苷酶活性抑制剂、淀粉酶活性抑制剂时,优选在餐前(例如进餐开始30分钟前~进餐开始)、进餐中或餐后(例如进餐结束~30分钟后)进行给药,进一步优选在进餐中进行给药。
对本发明的药剂的给药量没有特别限定,可以根据给药对象的年龄、体重、健康状态等适当调整。本发明的药剂的每一天的给药量以茶叶计优选0.5g以上,更优选1.0g以上,进一步优选1.5g以上。本发明的药剂的每一天的给药量没有上限,通常以茶叶计为50g以下。
本发明的药剂(当本发明的药剂包含两种以上的成分时是指组合物)可以给对象使用以改善或预防对象的糖尿病。因此,由本说明书掌握给对象使用本发明的药剂或组合物以改善或预防对象的糖尿病的方法。在该方法中,对象的范围、所能使用的药剂或组合物、所能使用的药剂或组合物的优选的给药量、优选的给药时期、给药方式的例子和优选的例子与在本发明的药剂中已说明的例子相同。
实施例
试验例1 代谢综合征预防的评价
[实施例1]
作为茶叶,使用了在采集2012年产“Sunrouge”茶叶后将蒸的叶干燥而获得的Sunrouge干燥茶叶(荒茶(未加工的茶叶))。
使用碾磨机(Tiger公司制造)将Sunrouge荒茶粉碎至5mm左右,加入原料粉碎物的20倍量(w/w)的70℃的热水,在70℃±2℃下搅拌10分钟,之后用100筛目进行固液分离,得到了提取液。将提取液以700g的离心力离心分离10分钟,回收上清,之后使用真空冷冻干燥机(LABCONCO公司制造、FZ-12CS型、BTD棚式干燥室)进行处理,之后进行冷冻干燥,得到了粉末状Sunrouge茶叶提取物样品。
在饲料中添加1重量%的所得的Sunrouge茶叶提取物样品进行混合。饲料组成见表1。
[表1]
表1 试验例1中的饲料组成
确认了实施例1中所得的Sunrouge茶叶提取物样品的组成,结果如下。需要说明的是,以下的量显示相对于茶叶提取物的干燥重量的含量。
[Sunrouge茶叶提取物样品的组成]
作为Sunrouge茶叶提取物样品给药组(n=6),使用了12周龄的雄性小鼠C57BL/6J。预饲养给药组的小鼠7天后,让它们自由摄取添加有Sunrouge茶叶提取物样品的饲料使每只小鼠1天进食4克,饲养了8周。饲养期间结束后,让小鼠绝食16小时,之后采集血液。采血后解剖小鼠,测定了睾丸周边脂肪重量。小鼠的睾丸周边脂肪重量的测定结果见图1。
由采集的血液调制血清,将所得血清加载到葡萄糖CII-Test wako (和光纯药公司制造)中测定了血糖值。再将所得血清加载到超高灵敏度小鼠胰岛素测定试剂盒(森永生科学研究所制造)中测定了胰岛素量。由所得数据算出了HOMA-IR (计算式:{空腹时的血中胰岛素浓度(μU/mL)×空腹时血糖值(mg/dl)}/405)。结果见图2。
[比较例1]
除了使用在采集2013年产“Yabukita”茶叶后将蒸的叶干燥而获得的Yabukita干燥茶叶来代替Sunrouge干燥茶叶以外,进行了与实施例1相同的操作。饲料组成见表1,结果见图1和图2。
[比较例2]
除了在饲料中没有添加茶叶提取物以外,进行了与实施例1相同的操作。饲料组成见表1,结果见图1和图2。
如图1所示,与添加了Yabukita茶叶提取物样品的比较例1、未添加茶叶提取物样品的比较例2相比,添加了Sunrouge茶叶提取样品的实施例1的饲料的脂肪重量较少。
如图2所示,与添加了Yabukita茶叶提取物样品的比较例1、未添加茶叶提取物样品的比较例2相比,添加了Sunrouge茶叶提取物样品的实施例1的饲料的HOMA-IR的升高得到显著抑制。这显示本发明的药剂能够发挥胰岛素抵抗性改善效果。
肥胖和胰岛素抵抗性均为代谢综合征的症状,试验例1的结果显示:本发明的药剂能够发挥预防或改善代谢综合征的效果。
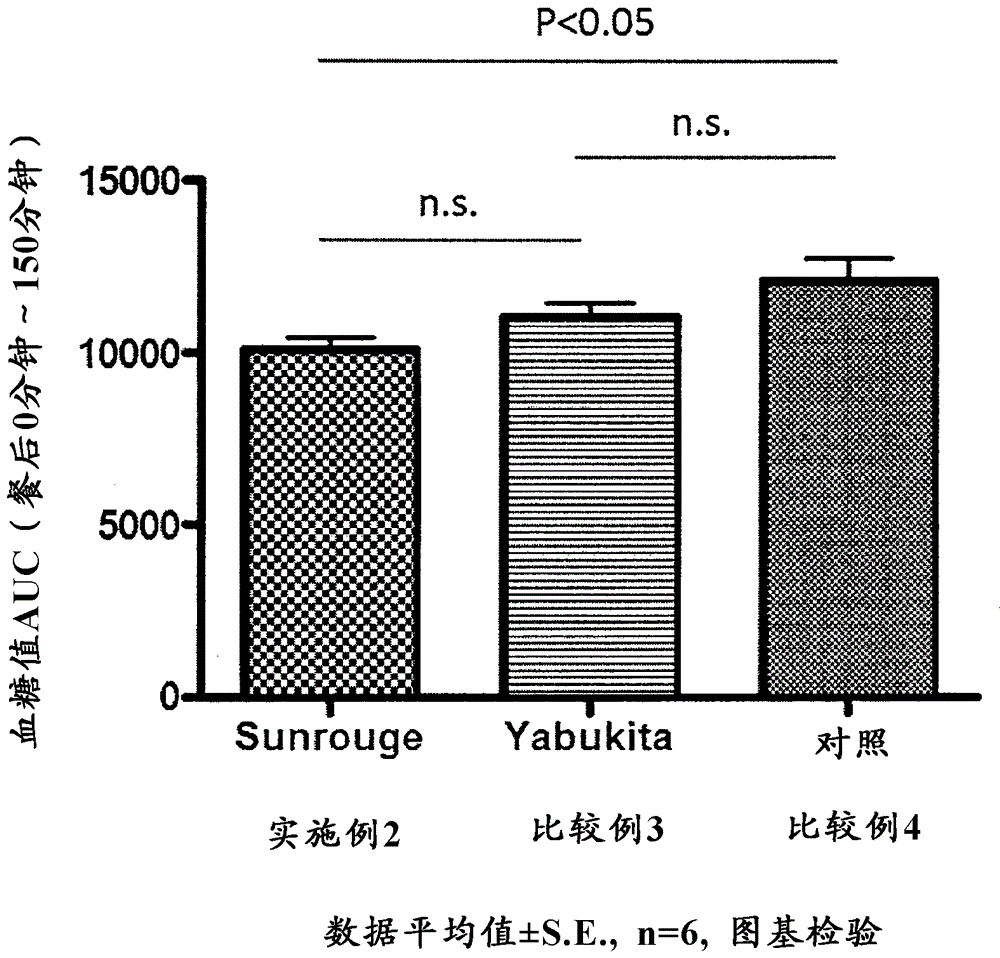
试验例2 餐后血糖值的升高抑制评价
[实施例2]
作为Sunrouge茶叶提取物样品给药组(n=6),使用了6周龄的雄性ICR小鼠。预饲养各小鼠3周后,让其绝食16小时,之后采集了血液。然后,混合与实施例1相同的Sunrouge茶叶提取物样品和可溶性淀粉(和光纯药公司制造),使分别达到500mg/kg小鼠体重和2000mg/kg小鼠体重,对小鼠胃内进行探头(Sonde)给药。
给予茶叶提取物样品和可溶性淀粉后,每经过30分钟、60分钟、120分钟、150分钟由各小鼠采集血液,利用Medisafe Mini (TERUMO公司制造)和Medisafe Chip (TERUMO公司制造)测定了血糖值。算出了0分钟~150分钟的餐后血糖值的AUC。结果见图3。另外,还算出了0分钟~30分钟的餐后血糖值的AUC。结果见图4。
[比较例3]
除了使用与比较例1相同的Yabukita茶叶提取物样品来代替Sunrouge茶叶提取物样品以外,进行了与实施例2相同的操作。结果见图3和图4。
[比较例4]
除了使用生理盐水来代替Sunrouge茶叶提取物样品以外,进行了与实施例2相同的操作。结果见图3和图4。
关于从进餐开始到150分钟后的AUC,如图3所示,与给予了生理盐水的比较例4的AUC相比,给予了Sunrouge茶叶提取物样品的实施例2的AUC明显小。另一方面,与比较例4的AUC相比,给予了Yabukita茶叶提取物样品的比较例3的AUC只不过是稍小而已,也没有确认到显著差异。
另外,关于从进餐开始到30分钟后的AUC,如图4所示,与比较例3和比较例4的各AUC相比,实施例2的AUC明显低。比较例3的AUC倒是较比较例4的AUC大。
上述结果显示:本发明的药剂可以发挥抑制餐后血糖值等的血糖值升高的效果。
试验例3 α-葡糖苷酶活性抑制率的评价(其1)
[实施例3]
稀释与实施例1相同的Sunrouge茶叶提取物样品,使其终浓度达到100mg/L。稀释α-葡糖苷酶(和光纯药公司制造)使其终浓度达到100U/L。使用所得的各稀释液和QuantiChrom (注册商标) α-葡糖苷酶测定试剂盒(BioAssay Systems公司制造),测定了Sunrouge茶叶提取物样品的α-葡糖苷酶活性抑制率。结果见图5。
[比较例5]
除了使用与比较例1相同的Yabukita茶叶提取物样品来代替Sunrouge茶叶提取物样品以外,进行了与实施例3相同的操作。结果见图5。
如图5所示,与使用了Yabukita茶叶提取物样品的比较例5相比,使用了Sunrouge茶叶提取物样品的实施例3显示出显著高的α-葡糖苷酶活性抑制效果。该结果显示:本发明的药剂可以发挥α-葡糖苷酶活性抑制效果。
试验例4 α-葡糖苷酶活性抑制率的评价(其2)
[实施例4]
在Sunrouge的20mg干燥茶叶粉末中添加1.0mL的蒸馏水,在100℃、10分钟的条件下进行提取。以1700g的离心力离心分离10分钟,使用0.2μm的滤器(Whatman公司制造)进行处理,得到了Sunrouge干燥茶叶的提取液。通过使用Multi-beads Shocker (安井器械公司制造)将荒茶粉碎,制成了干燥茶叶粉末。
将α-葡糖苷酶(和光纯药公司制造)稀释,使其终浓度达到100U/L。使用所得的提取样品、稀释液和QuantiChrom (注册商标) α-葡糖苷酶测定试剂盒(BioAssay Systems公司制造),测定了Sunrouge茶叶提取物样品的α-葡糖苷酶活性抑制率。结果见表2。
[实施例5]
除了使用作为Sunrouge的亲本株的茶中间母本农6号的干燥茶叶来代替Sunrouge的干燥茶叶以外,进行了与实施例4相同的操作。结果见表2。
[比较例6]
除了使用表2所示的50种各干燥茶叶代替Sunrouge的干燥茶叶以外,进行了与实施例4相同的操作。结果见表2。
[表2]
表2 茶叶提取物样品的α-葡糖苷酶活性抑制率
如表2所示,使用了Sunrouge干燥茶叶粉末提取物样品的实施例4和使用了茶中间母本农6号茶叶粉末提取物样品的实施例5与使用了其他茶叶粉末提取物样品的比较例6相比显示出了高的α-葡糖苷酶活性抑制效果。
该结果显示:本发明的药剂不受提取条件等的影响,可以稳定地发挥α-葡糖苷酶活性抑制效果。
上述实施例的结果显示:本发明的药剂发挥α-葡糖苷酶活性抑制效果的结果是能够抑制餐后血糖值的升高,其结果,可预防或改善肥胖,能够抑制高血糖的恶化或改善高血糖,可以发挥预防、抑制糖尿病的效果。
试验例5 淀粉酶活性抑制的评价
[实施例6]
在20mg Sunrouge的干燥茶叶粉末中添加1.0mL的蒸馏水,在100℃、10分钟的条件下进行了提取。以1700g的离心力离心分离10分钟,使用0.2μm的滤器(Whatman公司制造)进行处理,得到了Sunrouge干燥茶叶的提取液。通过使用Multi-beads Shocker (安井器械公司制造)将荒茶粉碎,制成了干燥茶叶粉末。
调制来自猪胰腺的淀粉酶(Sigma公司制造)使其终浓度达到800U/L,得到了淀粉酶溶液。使用MaxDiscovery (注册商标)淀粉酶测定试剂盒(Bioo Scientific Corporation制造)分别测定了“A:Sunrouge干燥茶叶的提取液与淀粉酶溶液的混合液的淀粉酶活性”和“B:淀粉酶溶液的淀粉酶活性”,用A除以B,求出了Sunrouge干燥茶叶提取液的淀粉酶活性抑制率。结果见表3。
[实施例7]
除了使用茶中间母本农6号的干燥茶叶来代替Sunrouge的干燥茶叶以外,进行了与实施例6相同的操作。
[比较例7]
除了使用表3所示的50种茶叶来代替Sunrouge的干燥茶叶以外,进行了与实施例6相同的操作。结果见表3。
[表3]
表3 茶叶提取液样品的淀粉酶活性抑制率
如表3所示,使用了Sunrouge茶叶干燥粉末提取液样品的实施例6和使用了茶中间母本农6号茶叶干燥粉末提取液样品的实施例7与使用了其他茶叶干燥粉末提取液样品的比较例7相比显示出了高的淀粉酶活性抑制效果。特别是使用了Sunrouge茶叶干燥粉末提取液样品的实施例6显示出了显著高的淀粉酶活性抑制效果。
试验例6 人的餐后血糖值的升高抑制效果的评价
[实施例8]
如下所示,依照日本Glycemic Index研究会的规程,测定了人的餐后血糖值。
以6名无耐糖能力异常者作为受试者。在血糖值测定日的前一天禁止受试者进行剧烈运动以及午后8点以后进食。另外,在血糖值测定日的前一天还禁止受试者暴饮暴食和大量饮酒以及熬夜。
在血糖值测定日禁止受试者摄入早餐,从上午9点开始测定了血糖值。从受试者的指尖采血,使用Medisafe血糖测定试剂盒(TERUMO公司制造)测定了血糖值,作为空腹时的血糖值。
接着,让受试者同时摄取了0.5g作为评价样品的Sunrouge的干燥茶叶粉末(2014年德之岛产、由日本制纸株式会社供应)和50mL蒸馏水。通过使用碾磨机(Tiger公司制造)将荒茶粉碎,得到了Sunrouge的干燥茶叶粉末。摄取后立即摄取了130g米饭(包装米(Packed Rice)、佐藤的米饭 简单一顿 新泻县产越光牌、佐藤食品制造(サトウのごはん かるーく一膳 新潟県産コシヒカリ、サトウ食品製))。受试者摄取米饭的时间为8分钟~10分钟,受试者一口米饭咀嚼30次。在摄取米饭期间,让受试者将100mL蒸馏水分成小份饮用。餐后禁烟、杜绝饮食,禁止了受试者过度运动。
从开始摄取米饭时(作为0分钟。)起经过30分钟后,从受试者的指尖采血,利用Medisafe血糖测定试剂盒(TERUMO公司制造)测定了血糖值,作为餐后30分钟的血糖值。算出开始摄取后0分钟~30分钟的血糖值的AUC,算出了餐后血糖值的升高量。采用空腹时的血糖值作为开始摄取后0分钟的血糖值。结果见图6。
[实施例9]
除了受试者人数为15名、且以1.0g的Sunrouge干燥茶叶粉末作为评价样品以外,进行了与实施例8相同的操作来进行试验。结果见图6。
[实施例10]
除了以1.5g的Sunrouge干燥茶叶粉末作为评价样品以外,进行了与实施例8相同的操作来进行试验。结果见图6。
[比较例8]
除了受试者人数为15名、且没有摄取评价样品以外,进行了与实施例8相同的操作来进行试验。结果见图6。
[比较例9]
除了受试者人数为15名、且以含有难消化性糊精的补品(商品名:贤者的食卓(注册商标), 1包6g, 1包中混合5g难消化性糊精, 大塚制药制造、特定保健用食品)作为评价样品以外,进行了与实施例8相同的操作来进行试验。结果见图6。
如图6所示,与比较例8和比较例9相比,在摄取了0.5g Sunrouge干燥茶叶粉末的实施例8中餐后血糖值的升高量减少。与比较例8相比,在摄取了1.0g以上的Sunrouge干燥茶叶粉末的实施例9和实施例10中餐后血糖值的升高得到显著抑制,升高抑制的效果与实施例8同等或其以上。试验例6的结果显示:本发明的药剂即使在人体内也显示出抑制餐后血糖值的升高,抑制餐后血糖值升高的结果,可预防或改善肥胖以能够抑制高血糖的恶化或改善高血糖,能够发挥优异的糖尿病预防或抑制效果。
试验例7 在小鼠中的脂质排出促进效果和体重增加抑制效果的评价
将在试验例1之胰岛素抵抗性的评价中调制的与实施例1、比较例1、比较例2中的配比相同的配比的饲料分别作为饲料1、饲料2、饲料3用于以下的试验。
需要说明的是,与给予小鼠的普通饲料相比,饲料1~3的糖含量和脂肪含量高。
[实施例11]
以12周龄的雄性小鼠C57BL/6J(n=6)作为饲料1的给药组。预饲养给药组的小鼠7天后,让其自由摄取饲料1使达到每只每天4g,饲养了8周。摄取6周后,用2周的时间采集了小鼠粪便。将所采集的粪便风干后作为用于测定脂质量的样品。
通过以下所示的索氏提取法提取粪便中所含的脂质并进行了测定。
(索氏提取法)
充分清洗脂肪定量瓶,在105℃下干燥12小时,求出了恒重。精密称取3g在105℃下干燥了12小时的粪便,将其装入圆筒滤纸中。在圆筒滤纸的上部塞入脱脂棉,再插入索氏提取器的提取管中,将求出了恒重的脂肪定量瓶与提取管连接。从提取管的上部加入了80mL乙醚。在提取器上连接冷凝管,将提取器安装在电加热装置上,让冷凝水流入冷凝管中。使乙醚在60℃~70℃下循环,提取了12小时。从提取管中取出圆筒滤纸,之后,继续加热直至脂肪定量瓶中的乙醚全部转移到提取管中。将取掉了上部的脂肪定量瓶在热水浴上加热,使乙醚完全蒸发。将脂肪定量瓶用105℃的干燥器干燥3小时后,在干燥器中放置冷却30分钟,精密称量。反复进行干燥、放置冷却和精密称量,直至达到恒重。
粪便中的脂质量的测定结果见表4。
[比较例10]
除了给予饲料2来代替饲料1以外,进行了与实施例11相同的操作来进行试验。结果见表4。
[比较例11]
除了给予饲料3来代替饲料1以外,进行了与实施例11相同的操作来进行试验。结果见表4。
[表4]
表4 在小鼠中的脂质排出促进效果和体重增加抑制效果
由表4的结果可知:与摄取了包含Yabukita茶叶提取物样品的饲料2的比较例10的小鼠组或摄取了不含评价样品的空白的饲料3的比较例11的小鼠组相比,摄取了包含Sunrouge茶叶提取物样品的饲料1的实施例11的小鼠组的粪便中的脂质比例高,饲料1所含的Sunrouge茶叶提取物具有优异的脂质排出促进效果。另外,与摄取了饲料2的比较例10的小鼠组或摄取了饲料3的比较例11的小鼠组相比,摄取了饲料1的实施例11的小鼠组在宰杀时的体重最少,可知饲料1所含的Sunrouge茶叶提取物具有优异的体重增加抑制效果。
以上的结果显示:本发明的药剂发挥优异的脂质排出促进效果和体重增加抑制效果,能够预防或改善肥胖以抑制高血糖的恶化或改善高血糖,能够发挥优异的糖尿病预防或抑制效果。
试验例8 脂质分解抑制效果的评价
[实施例12]
在20mg Sunrouge的干燥茶叶粉末中添加1.0mL的蒸馏水,在100℃、10分钟的条件下进行了提取。以1700g的离心力离心分离10分钟,用0.2μm的滤器(Whatman公司制造)进行处理,得到了Sunrouge干燥茶叶提取液。通过使用Multi-beads Shocker (安井器械公司制造)将荒茶粉碎,制成了干燥茶叶粉末。
调制来自猪胰腺的脂肪酶(Sigma公司制造)使其终浓度达到102U/L。使用脂肪酶试剂盒S (DS Pharma Biomedical公司制造)分别测定“A:Sunrouge茶叶提取液和脂肪酶溶液的混合液的脂肪酶活性”和“B:脂肪酶溶液的脂肪酶活性”,通过用A除以B,求出了Sunrouge干燥茶叶提取物的脂肪酶活性抑制率。结果见表5。
[比较例12]
除了使用Yabukita的干燥茶叶来代替Sunrouge的干燥茶叶以外,进行了与实施例12相同的操作。结果见表5。
[表5]
表5 胰脂肪酶活性抑制率
如表5所示可知:与使用了Yabukita的茶叶干燥粉末提取液样品的比较例12相比,使用了Sunrouge茶叶干燥粉末提取液样品的实施例12显示出高的脂肪酶活性抑制效果,具有优异的脂质分解抑制效果。
试验例9 提高脂质代谢的效果的评价
[实施例13]
摘取试验例1的实施例1中宰杀的小鼠的肝脏,进行了微阵列分析(Agilent公司制造Whole Mouse Genome寡DNA微阵列试剂盒 2.0版)。
作为比较,摘取试验例1的比较例2中宰杀的小鼠的肝脏,进行了微阵列分析。
关于所得的基因表达量的数据,选取了在实施例1/比较例2中表达量达到2.0以上的基因作为表达提高基因。
对于所选取的基因的ENTREZ GENE ID进行DAVID (http://david.abcc.ncifcrf.gov/home.jsp)的功能注释分析后,从Kegg-路径中选取了显著包含表达升高基因的路径。结果见表6。
[比较例13]
除了将实施例13中使用的实施例1的小鼠变换成比较例1的小鼠以外,进行了与实施例13相同的操作。结果见表6。
[表6]
表6
由表6的结果可知:摄取了包含Sunrouge茶叶提取物样品的饲料的小鼠在表6所示的脂质代谢途径中代谢均有所提高。
由试验例8和试验例9的评价结果推测:Sunrouge茶叶提取物样品通过脂质分解抑制作用和代谢提高作用来发挥优异的脂质排出促进效果。
试验例10 茶叶提取物的热稳定性评价
[实施例14]
按照以下的条件得到了茶叶提取物。
・茶叶:采集2012年产“Sunrouge”茶叶后将蒸的叶干燥而获得的茶叶;
・前处理:使用Multi-beads Shocker (注册商标、安居器械株式会社)进行粉碎处理(平均粒径:309μm);
・温度:70℃;
・时间:10分钟;
・提取溶剂与液量:使蒸馏水(DW)相对于茶叶干燥重量达50倍重量。
按照文献(Mari Maeda-Yamamoto等人., Chemical analysis and acetylcholinesterase inhibitory effect of anthocyanin-rich red leaf tea (cv. Sunrouge). J Sci Food Agric 92:2379-2386(2012).)中记载的条件,通过HPLC分析所得的茶叶提取物的每单位干燥重量的飞燕草素或其糖苷的含量和儿茶精的含量时,分别为0.2重量%、18.5重量%。
将茶叶提取物浓缩后,使用喷雾干燥机(Yamato科学株式会社制造、商品名:Pulvis Mini-Spray GA-32)将其粉末化,制成了茶叶提取物的粉末。将其在温度100℃下加热处理120分钟,测定了处理后的飞燕草素残留率。
[比较例14]
采用了来自作为富含飞燕草素的现有流通品的马基莓的提取物粉末(ORYZA油化公司制造、商品名:Maqui Berry Extract)的基准值。
实施例14、比较例14的结果见图7。
与含有飞燕草素的马基莓提取物粉末(比较例14)相比,茶叶提取物粉末的热稳定性(实施例14)优异。
- 还没有人留言评论。精彩留言会获得点赞!