含芍药根或其与甘草混合物的提取物作为活性成分用于预防或治疗血管性水肿的药物组合物的制作方法
本发明涉及用于预防或治疗诸如视网膜水肿、黄斑变性和静脉曲张的血管性水肿的组合物,其包含芍药根的提取物或芍药根和甘草的混合提取物作为活性成分。
背景技术:
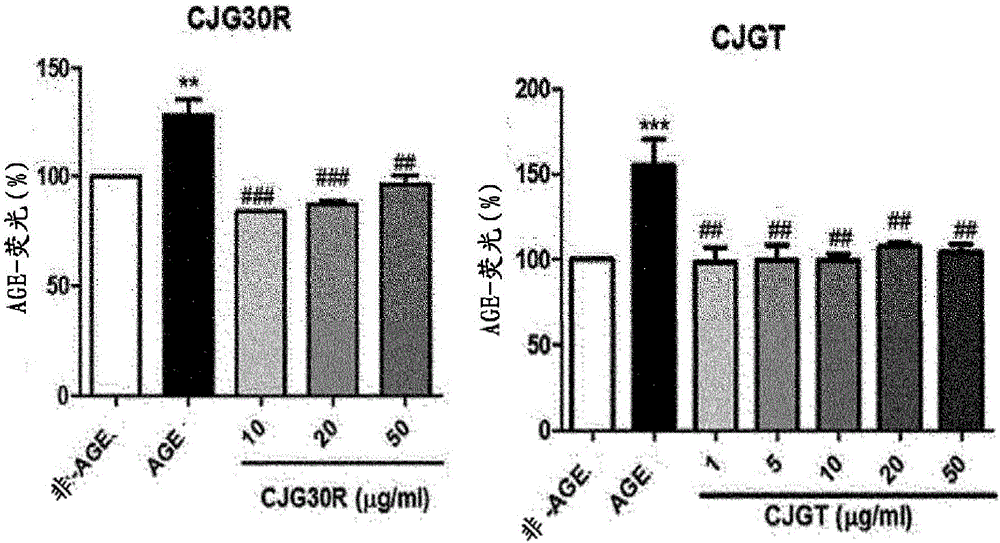
:血管性水肿是指由于皮肤最深处的凹陷中或皮肤下或粘膜下方的血管的通透性升高,流体从血管流出并在周围组织中汇集(即,引起水肿)导致的疾病,并且通常发生在相对疏松的组织中,其中在眼或嘴唇周围或在手中是常见的,并且还发生在舌、口、喉、粘膜如胃肠道壁中,特别是血-视网膜屏障由于血管性水肿而损坏,引起黄斑水肿、视网膜水肿或黄斑变性,或静脉曲张。黄斑变性(年龄相关性黄斑变性:AMD)是不可逆的疾病之一,其是老年人并发的代表性眼科疾病,并导致失明。由于世界范围内的人口老龄化,发达国家的发病率尤其升高。在美国,黄斑变性是失明的主要原因,并且还受环境因素和遗传因素的影响,并且尤其是吸烟被报导为最致命的疾病因素。除此之外,肥胖和过量摄取抗氧化剂和膳食脂肪也引起黄斑变性和影响进一步发展。因此,健康的饮食摄入、体重控制、适度运动和不吸烟减少黄斑变性的发病。在美国,早期(干性)黄斑变性的患病率在40-50年龄组中为约3.9%,但在超过75岁的年龄组中为22.8%,其显示具有非常高的发病率(BeaverDamEyeStudy)。此外,在超过75岁的老年组中的发病率为5.4%,其中7.1%为终末黄斑变性。1.9%的居住在澳大利亚的高加索人是终末黄斑变性患者,在55岁或以下的青年组中显示0%的发病率,但在五年中在超过85岁的老年组中显示18.5%的发病率。此外,对于亚洲的马来人也是类似的(BlueMountainEyeStudy)(Progressinretinalandeyeresearch,1-15,2014)。对于韩国,韩国视网膜学会(KoreanRetinaSociety)报导在过去的一年,湿性黄斑变性患者增加了7.4倍,并且在40、50岁的中年和老年人中的发病率增加了9倍(2011)。但最严重的是没有黄斑变性治疗剂。来自瑞士Novartis的Lucentis是抗体治疗剂并且非常昂贵,并且不可能使疾病进展停止到恢复视力的程度。黄斑变性分为干性黄斑变性和湿性黄斑变性。干性黄斑变性是由于损伤的黄斑而并发的,所述损伤的黄斑是由于废物质玻璃疣堆积在黄斑上,破坏脉络膜和黄斑上部之间的代谢连接,从而损伤黄斑。如果该进展继续,其进展到湿性黄斑变性。也就是说,由于血管通过在黄斑区域积累废物而不起作用,从而不提供诸如营养物的必需品,则其开始产生新的异常血管(脉络膜新生血管:CNV)。这些产生的血管具有非常薄弱的壁,将血管中的蛋白或红血细胞渗漏到黄斑区域和视网膜中,由此最终由于血管出血,发生各种因素如杀死视杆和视锥感光细胞和视网膜色素上皮细胞,最终导致失明(NutritionResearch,34,95-105,2014;Plosone,8,e71064,2013)。视网膜色素上皮细胞(RPE)通过维持非增殖状态并支持布鲁赫膜(BrM)而在维持健康的眼睛中起重要作用。由视网膜色素上皮细胞分泌的胱抑素C是强力的半胱氨酸蛋白酶抑制剂,并且在正常控制蛋白在BrM中的循环中起重要作用,等等。然而,如果晚期糖基化终产物过度积累,则胱抑素C蛋白的表达和分泌降低,导致RPE基底部分中的蛋白水解作用的不平衡,致使黄斑变性发生(IOVS,2014,55(2),926-34)。因此,当晚期糖基化终产物的产生被抑制时,也可以预防(治疗)黄斑变性。VEGF(血管内皮生长因子)由视网膜色素上皮细胞层分泌,以正常调节布鲁赫膜(BrM)周围的部分,并控制脉络膜毛细血管内皮细胞的生长和紧密度。在正常条件下,VEGF分泌是非常严格地被调节的,以防止血管生成。然而,如果VEGF分泌未被严格调节,则其充当导致黄斑变性的终末期的关键因素。如果VEGF分泌异常升高,则出现在黄斑变性中的异常和薄弱的血管产生并被破坏(J.Cell.Mol.Med.,17,7,833-843,2013)。视网膜水肿是这样发生的,当视网膜毛细血管壁在异常环境中损伤使存在于视网膜毛细血管中的蛋白、红血细胞等渗漏到视网膜中,所述蛋白、红血细胞在视网膜中汇集导致水肿。静脉曲张是静脉出现在皮肤外部的疾病,其中分布在手臂和腿中的静脉被分类为位于肌肉之间的大深静脉、出现在皮肤下面的浅静脉和连接这两种静脉的交通静脉,意味着其中浅静脉伸展并且看起来突出皮肤外,并且所述静脉曲张是这样患上的:当使静脉内部的血流总是朝向心脏保持恒定的瓣膜被破坏时,当静脉曲张中的压力升高时静脉壁变薄弱,从而通向心脏的血液回流使静脉伸张。芍药根是毛茛科(Ranunculaceae)的多年生植物,其中白芍(Radixpaeoniaealba)和赤芍(Radixpaeoniaerubra)通过壳的存在或不存在来确定,其中具有壳的称为赤芍,且壳被剥去的另一种称为白芍(Altern.Med.Rev.6(5),495-499,2001)。白芍与赤芍具有对胃肠平滑肌和子宫平滑肌的收缩的抑制作用,冠状动脉扩张作用以及预防血管疾病的动脉粥样硬化、降低血压和改善血流的作用。芍药根提取物的这些作用似乎源自抗氧化作用(J.Ethnopharmacol.67,111-119,1999)、血小板抗聚集作用(PlantaMed,65,595-599,1999)、抗血栓作用(Chem.Pharm.Bull,35(2),849-852,1987)、高脂血症预防(Fitoterapia,75(1),45-49,2004)等。此外,据报导,芍药根的一些组分糖苷在治疗脑梗塞中有效(ZhongYaoCai,23(2),95-97,2000)。甘草是光果甘草(Glycyrrhizaglabra)和乌拉尔甘草(G.uralensis)和其他同属植物的干燥根和根茎,其为属于豆科的草本多年生植物,并且包含黄酮类化合物作为主要成分,如甘草苷,包括三萜皂苷的甘草甜素。药理作用包括肾上腺皮质激素样作用、抗胃溃疡功效、平滑肌松弛作用、肝保护作用、抗炎、抗过敏作用、抗病毒作用(Orientalmedicinepharmacology,JipmoonDang,434-436,2001)。此外,目前施用的抗体(蛋白质)药物仅部分调节抑制引起黄斑变性或视网膜水肿的许多因素的新血管的机制。此外,众所周知的事实是,它们不能完全控制该机制。对于包含芍药根提取物或芍药根和甘草的提取物的组合的天然提取物材料是未知的,其可以克服目前施用的治疗剂的局限,并且同时控制与视网膜水肿和黄斑变性相关的病因。因此,本发明人已经努力开发了用于预防和治疗包括视网膜水肿、黄斑变性和静脉曲张的血管性水肿的组合的天然提取物材料,因此发现芍药根提取物或芍药根和甘草的混合提取物抑制晚期糖基化终产物的产生,抑制在各种动物模型中导致视网膜水肿的血-视网膜屏障破坏,保护或治疗导致干性黄斑变性的视网膜下区域,抑制导致湿性黄斑变性的血管生成,因此所述提取物可以有效地用作用于预防和治疗包括黄斑变性、黄斑水肿、视网膜水肿或静脉曲张的血管性水肿的组合物的活性成分,并完成了本发明。发明详述技术问题本发明的目的是提供用于预防和治疗血管性水肿的组合物,其包含芍药根提取物或芍药根和甘草的混合提取物作为活性成分。技术方案为了实现以上目的,本发明提供了用于预防和治疗血管性水肿的药物组合物,其包含芍药根提取物或芍药根和甘草的混合提取物作为活性成分。此外,本发明提供了用于预防和改善血管性水肿的健康功能食品,其包含芍药根提取物或芍药根和甘草的混合提取物作为活性成分。此外,本发明提供了用于治疗血管性水肿的方法,包括给予患有血管性水肿的个体药学有效量的芍药根提取物或芍药根和甘草的混合提取物的步骤。此外,本发明提供了用于改善血管性水肿的方法,包括给予患有血管性水肿的个体药学有效量的芍药根提取物或芍药根和甘草的混合提取物。此外,本发明提供了芍药根提取物或芍药根和甘草的混合提取物用作用于预防和治疗血管性水肿的药物组合物的用途。此外,本发明提供了芍药根提取物或芍药根和甘草的混合提取物用作用于预防和改善血管性水肿的健康功能食品的用途。发明效果根据本发明的芍药根提取物或芍药根和甘草的混合提取物抑制晚期糖基化终产物的过度产生,抑制在各种动物模型中导致视网膜水肿的血-视网膜屏障破坏,保护或治疗导致干性黄斑变性的视网膜下区域,抑制导致湿性黄斑变性的血管生成,因此可以有效地用作用于预防和治疗包括黄斑变性、黄斑水肿、视网膜水肿或静脉曲张的血管性水肿的组合物的活性成分。附图简要描述图1是显示通过HPLC(高效液相色谱)测量的芍药根和甘草的混合提取物的色谱图的图表(CJG30R(a)和CJGT(b))。图2是确定用糖醛处理的ECM(细胞外基质)中的晚期糖基化终产物产生的抑制作用的图表。图3是确定在高血糖环境下在人视网膜色素上皮细胞系中芍药根和甘草的混合提取物(CJG30R)对晚期糖基化终产物产生的抑制作用的图表。图4是确定在动物模型引起视网膜水肿的血-视网膜屏障破坏的抑制作用的图表:Nor:正常对照组;VEGF:VEGF(血管内皮生长因子)治疗组;CJGT-lμg/ml:使用lμg/ml本发明的芍药根和甘草的热水提取物的治疗组;CJGT-50μg/ml:使用50μg/ml本发明的芍药根和甘草的热水提取物的治疗组;和CJGT-100μg/ml:使用100μg/ml本发明的芍药根和甘草的热水提取物的治疗组。图5是在MNU(N-甲基-N-亚硝基脲)诱导的黄斑变性动物模型中通过感光细胞的损伤预防来确定黄斑变性的预防作用的图表:NOR:C57BL/6正常小鼠;MNU:MNU诱导的黄斑变性动物模型;CJGT-50:MNU诱导的黄斑变性动物模型+CJGT50mg/kg/天给药组;和CJGT-100:MNU诱导的黄斑变性动物模型+CJGT100mg/kg/天给药组。图6是在NaIO3动物模型中通过视网膜色素上皮细胞的损伤预防来确定黄斑变性的预防作用的图表:NOR:C57BL/6正常小鼠;NaIO3:NaIO3诱导的动物模型;CJG30R-50:NaIO3诱导的动物模型+CJG30R50mg/kg/天给药组;CJG30R-100:NaIO3诱导的动物模型+CJG30R100mg/kg/天给药组;CJGT-50:MNU诱导的动物模型+CJGT50mg/kg/天给药组;和CJGT-100:MNU诱导的动物模型+CJGT100mg/kg/天给药组。图7是确定在Vldlr-/-黄斑变性动物模型中的视网膜血管损伤的抑制作用的图表:NOR:C57BL/6正常小鼠;Vldlr-/-:湿性黄斑变性小鼠;和CJG30R-100:NaIO3诱导的动物模型+CJG30R100mg/kg/天给药组。图8是确定在Vldlr-/-黄斑变性动物模型中的视网膜新血管生成的抑制作用的图表:NOR:C57BL/6正常小鼠;Vldlr-/-:湿性黄斑变性小鼠;和CJG30R-100:NaIO3诱导的动物模型+CJG30R100mg/kg/天给药组。图9是确定在Vldlr-/-黄斑变性动物模型中的色素上皮细胞损伤的抑制作用的图表:NOR:C57BL/6正常小鼠;Vldlr-/-:湿性黄斑变性小鼠;和CJG30R-100:NaIO3诱导的动物模型+CJG30R100mg/kg/天给药组。图10是确定在Vldlr-/-小鼠的视网膜中的VEGF表达(深紫色染色:由箭头表示)的抑制作用的图表:Nor:C57BL/6正常小鼠;Vldlr-/-:湿性黄斑变性小鼠;和CJG30R-100:Vldlr-/-小鼠+CJG30R100mg/kg/天给药组。图11是确定在激光诱导的脉络膜新生血管(CNV)大鼠模型中的视网膜新血管生成的抑制作用的图表:CNV:使用激光处理的湿性黄斑变性小鼠模型;和CJG30R:使用激光处理的湿性黄斑变性小鼠模型+CJG30R100mg/kg/天给药组。图12是比较和分析CGJ30R和芍药苷(PF)在MNU-诱导的年龄相关性黄斑变性啮齿动物模型中的黄斑变性的预防和治疗的图表:NOR:C57BL/6正常小鼠;MNU:N-甲基-N-亚硝基脲(MNU)诱导的动物模型;CGJ30R-100:MNU诱导的动物模型+CGJ30R100mg/kg/天给药组;和PF-6.5:MNU诱导的动物模型+芍药苷(PF)6.5kg/天给药组。发明的实施方式在下文中,将详细描述本发明。本发明提供了用于预防和治疗血管性水肿的药物组合物,其包含芍药根提取物或芍药根和甘草的混合提取物作为活性成分。所述芍药根提取物或芍药根和甘草的混合提取物显示以下作用:抑制晚期糖基化终产物的过度产生,抑制在各种动物模型中导致视网膜水肿的血-视网膜屏障破坏,保护或治疗导致干性黄斑变性的视网膜下区域,抑制导致湿性黄斑变性的血管生成。此外,所述血管性水肿优选地为选自黄斑变性、黄斑水肿、视网膜水肿和静脉曲张中的任一种,但不限于此。所述芍药根提取物或芍药根和甘草的混合提取物优选地通过包括以下步骤的制备方法制备,包括但不限于:1)通过将提取溶剂添加到芍药根或芍药根和甘草来提取的步骤;2)过滤步骤1)的提取物的步骤;和3)在减压下浓缩步骤2)的过滤的提取物后,对其进行干燥的步骤。在该方法中,作为步骤1)中的芍药根和甘草,可以没有限制地使用栽培的那些或市售的那些。作为所述芍药根,白芍和赤芍二者是可用的。所述芍药和甘草优选地以10:1至1:1的重量比,更优选地以10:1、8:1和4:1的重量比,和最优选地以2:1的重量比混合。作为提取溶剂,优选地使用水、醇或其混合物。作为所述醇,优选地使用C1至C2低级醇,并且作为低级醇,优选地使用30%乙醇、50%乙醇、70%乙醇或甲醇。优选地,提取方法包括减压和高温提取、沸水提取、回流提取、热水提取、冷提取、常温提取、超声提取或蒸汽提取,但不限于此。优选的是添加芍药根和甘草的量的1至10倍的提取溶剂用于提取。提取温度优选地为30至100℃,但不限于此。此外,提取时间优选地为2至48小时,但不限于此。此外,提取次数优选地为2至5次,但不限于此。在该方法中,步骤3)的减压下浓缩使用真空减压浓缩器或真空旋转蒸发器,但不限于此。此外,干燥包括优选地减压干燥、真空干燥、泡腾干燥、喷雾干燥或冻干,但不限于此。在本发明的具体实施例中,考虑到氨基胍作为阳性对照组是合成的单一化合物,本发明人已经使用热水和乙醇制备了芍药根提取物或芍药根和甘草的混合提取物,然后测定了晚期糖基化终产物产生的抑制作用,并因此发现本发明的芍药根提取物或芍药根和甘草的混合提取物显示比阳性对照组更显著的晚期糖基化终产物产生的抑制作用,并且特别地具有非常优异的晚期糖基化终产物产生的抑制作用(参见表2、图2和图3)。此外,证实了通过验证提取物抑制在各种动物模型中导致视网膜水肿的血-视网膜屏障破坏,保护或治疗导致干性黄斑变性的视网膜下区域和抑制导致湿性黄斑变性的血管生成的事实,其可以有效地用作用于预防和治疗血管性水肿的组合物的活性成分(图2至图6)。包含本发明的提取物或混合提取物的组合物除了以上成分以外可以包含一种或多种显示相同或相似功能的活性成分。本发明的组合物还可以包含药学上可接受的添加剂,其中作为药学上可接受的添加剂,可以使用淀粉、糊化淀粉、微晶纤维素、乳糖、聚维酮、胶体二氧化硅、磷酸氢钙、乳糖、甘露醇、太妃糖、阿拉伯树胶、预胶化淀粉、玉米淀粉、粉末纤维素、羟丙基纤维素、欧巴代、羟基乙酸淀粉钠、,巴西棕榈蜡、合成硅酸铝、硬脂酸、硬脂酸镁、硬脂酸铝、硬脂酸钙、蔗糖等。优选地相对于所述组合物以0.1至90重量份包含根据本发明的药学上可接受的添加剂,但不限于此。也就是说,当在实践中临床给予时,本发明的组合物可以以各种口服或肠胃外剂型给予,并且当配制时使用稀释剂或赋形剂,如普通填充剂、增量剂、粘合剂、润湿剂、崩解剂和表面活性剂配混。用于口服给予的固体制剂包括片剂、丸剂、粉剂、颗粒剂、胶囊剂等,并且这样的固体制剂可以通过将混合提取物与至少一种或多种赋形剂,例如淀粉、碳酸钙、蔗糖、乳糖或明胶等混合来配混。此外,除了简单的赋形剂以外,还可以使用润滑剂如硬脂酸镁和滑石。用于口服给予的液体制剂包括混悬剂、内服溶液剂、乳剂和糖浆剂,其中可以包含除了作为简单稀释剂的水或液体石蜡以外的各种赋形剂,例如,润湿剂、甜味剂、芳香剂和防腐剂。用于肠胃外给予的制剂可以包括无菌水溶液、非水溶剂、混悬剂、乳剂、冻干制剂和栓剂。在非水溶剂和用于悬浮的溶剂中,可以使用丙二醇、聚乙二醇、植物油如橄榄油、可注射的酯如油酸乙酯等。作为栓剂的基质,可以使用witepsol、macrogol、tween61可可脂、sevumlaurin、甘油明胶等。本发明的组合物可以根据希望的方法经口给予或肠胃外给予,并且优选选择皮肤外用或腹膜内注射、直肠内注射、皮下注射、静脉内注射、肌内注射或胸腔内注射的注射方法。根据患者的体重、年龄、性别、健康状况、饮食、给药时间、给药方法、排泄率和疾病严重程度,剂量具有各种范围。根据患者的体重、年龄、性别、健康状况、饮食、给药时间、给药方法、排泄率和疾病严重程度,本发明的组合物的剂量具有各种范围,其中每日剂量可以基于本发明的提取物或混合提取物的量为0.0001至100mg/kg,优选地0.001至10mg/kg,并且可以每天给予1-6次。本发明的组合物可以单独使用,或与手术、放射治疗、激素治疗、化学治疗和使用生物反应调节剂的方法组合使用,用于预防和治疗血管性水肿。此外,本发明提供了用于预防和改善血管性水肿的健康功能食品,其包含芍药根提取物或芍药根和甘草的混合提取物作为活性成分。在优选地以10:1至1:1的重量比,更优选地以10:1、8:1和4:1的重量比和最优选地以2:1的重量比混合所述芍药根和甘草之后制备混合提取物,但不限于此。血管性水肿优选地为选自黄斑变性(水肿)、视网膜水肿和静脉曲张中的任一种,但不限于此。所述芍药根提取物或芍药根和甘草的混合提取物抑制晚期糖基化终产物的产生(表2、图2和图3),抑制在各种动物模型中导致视网膜水肿的血-视网膜屏障破坏,保护或治疗导致干性黄斑变性的视网膜下区域,以及抑制导致湿性黄斑变性的血管生成,因此显示抗血管性水肿作用,使得所述提取物可以有效地用作用于预防和治疗血管性水肿的组合物的活性成分(图4至图10)。在下文中,将通过实施例和实验实施例详细描述本发明。然而,以下实施例和实验实施例仅用于详细说明本发明,本发明的内容不受其限制。实施例1芍药根和甘草的混合提取物和芍药根提取物的制备为了制备芍药根和甘草的混合提取物,2013年3月从BaekjeDang(Daejeon,Korea)购买和使用芍药根和甘草,并储存在韩国东方医学研究所(KoreaInstituteofOrientalMedicine)(Daejeon,Korea)的糖尿病并发症研究组的冷冻室中。1-1芍药根和甘草的30%乙醇提取物的制备通过混合6g芍药根和3g甘草(2:1),将总共9g添加到54ml的30%乙醇中,并在50℃下在3小时内回流两次重复提取,来制备芍药根和甘草在30%乙醇中的混合提取物(CJG30R)。1-2芍药根和甘草的50%乙醇提取物的制备通过混合6g芍药根和3g甘草(2:1),将总共9g添加到54ml的50%乙醇中,并在50℃下在3小时内回流两次重复提取,以与以上实施例1-1相同的方式来制备芍药根和甘草在50%乙醇中的混合提取物(CGJ50R)。1-3芍药根和甘草的70%乙醇提取物的制备通过混合6g芍药根和3g甘草(2:1),将总共9g添加到54ml的70%乙醇中,并在50℃下在3小时内回流两次重复提取,以与以上实施例1-1相同的方式来制备芍药根和甘草在70%乙醇中的混合提取物(CGJ70R)。产率为23.5%。1-4芍药根和甘草的热水提取物的制备为了制备芍药根和甘草的热水提取物,将6g芍药根和3g甘草(2:1)混合,将10倍的蒸馏水添加到总共9g中,然后通过高速真空冷浓缩提取器或煎煮装置振荡约2小时以减压浓缩,干燥,制得芍药根和甘草的热水提取物(CJGT)。1-5芍药根提取物的制备为了制备芍药根的热水提取物,将约6倍的蒸馏水添加到芍药根中,通过煎煮装置振荡约2小时以减压浓缩,干燥,制得芍药根的热水提取物(CJ)。实施例2通过HPLC分析芍药根和甘草的混合提取物中的指标成分(CJG30R和CJGT)为了分析芍药根和甘草的混合提取物中的指标成分(CJG30R和CJGT),从CJG30R和CJGT中各取10微升,注入柱中并进行HPLC(高效液相色谱)以获得色谱图。使用的HPLC系统配备有来自Agilent的1200HPLC、DAD检测器和Chemstation软件,以及来自PhenomenexInc.的Luna5C-18(4.0x250mm)分析柱。使用样品自动进样器注射样品,流动相使用水和甲醇的混合溶液,流速为1.0ml/min,并且波长设置在230和250nm下。梯度从水:甲醇(70:30)开始,并且35分钟后必须是水:甲醇(0:100),用100%甲醇洗脱10分钟。所有使用的分析溶剂均为HPLC级溶剂(Fisherscientific)。因此,如表1和图1所示,确证CJG30R和CJGT的指标成分为没食子酸、氧化芍药苷、白芍苷、芍药苷、甘草苷、苯甲酸、甘草甜素(图1)。表1通过HPLC分析得到的CJG30R和CJGT中的芍药苷的含量芍药苷含量(%)CJG30R6.5CJGT6.1实验实施例1对晚期糖基化终产物(AGE)产生的抑制作用的确定为了确定芍药根提取物或芍药根和甘草的混合提取物对晚期糖基化终产物产生的抑制作用,本发明人分别使用10mg/ml溶于50mM磷酸盐缓冲液(pH7.4)的牛血清蛋白(Sigma,St.Louis,MO,USA)作为蛋白质源,以及0.2M果糖和0.2M葡萄糖的混合液作为糖源。将实施例1的提取物和阳性对照组(氨基胍)溶于30μl的0.2%DMSO,然后再溶于15%的tween80中。将蛋白质源、糖源和如上制备的本发明的提取物混合并配混成总共1ml,然后各自在37℃下培养7天以允许糖基化。此时向其中添加0.02%的叠氮化物(叠氮化钠)以防止在培养期间产生细菌。在培养后,测量荧光(荧光分光检测器;Bio-TEK,SynergyHT,USA;Ex:350nm;Em:450nm)并然后使用以下公式1计算,结果示于表2中。公式1(FS为荧光强度)因此,如下表2所示,证实了与阳性对照组的氨基胍(AG)相比,在芍药根和甘草的热水提取物的晚期糖基化终产物产生的抑制作用优异1.2倍。还证实了与阳性对照组相比,芍药根和甘草的30%、50%和70%乙醇提取物的作用分别优异1.7倍至2.3倍,并且实施例1-5的芍药根提取物的作用优异12倍(表2)。因此,考虑到作为阳性对照组的氨基胍是合成的单一化合物,证实了本发明的混合提取物对晚期糖基化终产物产生具有非常优异的抑制作用。表2样品IC50(μg/ml)实施例1-1的提取物(CJG30R)46.77±0.88实施例1-2的提取物(CJG50R)41.66±1.22实施例1-3的提取物(CJG70R)35.26±1.16实施例1-4的提取物(CJGT)69.44±1.66实施例1-5的提取物(CJ)6.84±0.09氨基胍(AG:阳性对照组)81.38±2.70实验实施例2在使用糖醛处理的ECM中的晚期糖基化终产物产生的抑制作用在使用糖醛处理后,证实了在上述实施例1中制备的CJG30R和CJGT的晚期糖基化终产物产生的抑制作用。以10μg/cm2分配细胞外基质(ECM,Sigma-Aldrich,目录号c-3867),然后在4℃下包被过夜。第二天,将包被的板的ECM去除,在室温下完全干燥,然后与具有预稀释的不同浓度(1、5、10、20、50μg/ml)的100mM糖醛(Sigma-Aldrich)和CJG30R和CJGT一起配制成100μl的总量,并在37℃下反应4小时,借以证实是否抑制晚期糖基化终产物(AGE)的产生。在阳性对照组中,通过仅添加100mM乙醇醛(Sigma-Aldrich)证实AGE的产生。将所得物用PBS洗涤两次,然后向其中添加100μl的50mM硼氢化钠(Sigma-Aldrich)以中和剩余的醛基5分钟。中和后,使用PBS洗涤所得物两次,并使用荧光分析仪(Ex.370nm/Em440nm)确证,同时再次添加100μlPBS。在使用Prism5.0程序(GraphPad)的统计学处理中,p<0.05或更大的值是有义值。因此,如图2所示,证实了CJG30RCJGT以浓度依赖性方式显著抑制晚期糖基化终产物产生(**p<0.01vs非-AGE;***p<0.001vs非GE;##p<0.01vsAGE;###p<0.001vsAGE;图2)。实验实施例3CJG30R在高血糖环境下在人视网膜色素上皮细胞系中对晚期糖基化终产物产生的抑制作用的确定证实了在上述实施例1中制备的CJG30R在高血糖环境下在人视网膜色素上皮细胞系中显示晚期糖基化终产物产生的抑制作用。具体地,使用杜氏改良伊格尔培养基(DMEM,Gibco,USA)在5%CO2-培养箱中培养在高血糖环境下的人视网膜色素上皮细胞系(ARPE-19:ATCC号CRL-2302)。在500μg/ml的BSA的终浓度下以及在25mM的高血糖条件下培养后,在(10、20μg/ml)浓度下处理本发明的CJG30R。此外,使用氨基胍(AG,10mM)处理阳性对照组。使用1xPBS洗涤样品,使用Laemmli样品缓冲液(目录号161-0737,Bio-RadLaboratories,CA,USA)处理,在100℃下煮沸5分钟,使用BCA(PierceBiotechnology,IL,USA)定量蛋白质,然后使用。蛋白在包含SDS的10%聚丙烯酰胺凝胶(PAGE)中进行电泳(120V,2小时)后,使用转移缓冲液(0.25MTris,1.92M甘氨酸,pH8.3-8.4)(250mA,1.5)将蛋白转移到PVDF膜(Bio-RadLaboratories,CA,USA)。在使用5%脱脂牛奶封闭TBS-T(200mMTris,1.37MNaCl,0.05%Tween20)溶液后,在4℃下反应AGE抗体(抗-AGE单克隆Ab,克隆号6D12)。在洗涤后,使HRP-缀合的第二抗体反应,再次洗涤,然后使用增强的化学发光(ECL)反应,使用LAS-3000(Fujifilm,JPN)分析,然后使用GraphPadPrism5(SanDiego)进行统计学处理。因此,如图3所示,证实了本发明的CJG30R浓度依赖性地(10μg/ml,20μg/ml)抑制晚期糖基化终产物产生,甚至在高血糖环境下的人视网膜色素上皮细胞中抑制晚期糖基化终产物产生(##P<0.01vsHG)(图3)。实验实施例4晚期糖基化终产物的交联断裂能力的确定证实了上述实施例1中制备的混合提取物(CJG30R,CJGT)对基质蛋白与晚期糖基化终产物的交联的断裂效应。使用的阳性对照组为ALT-711(AlteonInc.,Ramsey,NJ)。具体地,将1.0μgAGE-BSA(TransgenicInc.,Kobe,Japan)分配到胶原包被的96孔微量滴定板(GreinerBio-One,Germany),并随后在37℃下培养4小时以交联AGE-BSA和胶原。在通过洗涤0.05%PBST三次去除未结合的AGE-BSA后,向其添加混合提取物和ALT-711并在37℃下培养4小时。然后,用0.05%PBST洗涤所得物,并检测与胶原交联的剩余的AGE-BSA,将小鼠单克隆抗-AGE-BSA抗体(6D12,TransgenicInc.,Kobe,Japan)以1:250稀释,分配,然后在37℃下培养1小时。1小时后,使用0.05%PBST洗涤所得物,并使HRP-连接的山羊抗小鼠IgG抗体(SantaCruz,USA)反应以使用基质染色TΜΒ(3,3',5,5-四甲基联苯胺),然后在450nm下测量吸光度。AGE-BSA的交联的断裂效应(%)如以下等式2计算。等式2因此,如表2所示,证实了与阳性对照组的ALT-711相比,芍药根和甘草的热水提取物的晚期糖基化终产物的交联断裂能力优异2198倍,芍药根和甘草的30%、50%和70%乙醇提取物的作用分别为53.5倍、66.8倍和72.9倍,并且与阳性对照组的ALT-711相比,芍药根提取物的作用也是16891倍(表3)。表3总之,证实了本发明的材料抑制晚期糖基化终产物的产生,抑制包被有糖醛的ECM中的晚期糖基化终产物的产生,还使基质蛋白与已经产生的晚期糖基化终产物的交联断裂,并显著抑制在高血糖环境下在人视网膜色素上皮细胞系中晚期糖基化终产物的产生。实验实施例5在动物模型中由血-视网膜屏障的破坏引起的视网膜水肿的抑制作用的确定5-1实验动物育种和实验设计作为实验动物,出生后使7周龄雄性SD大鼠适应环境并使用。自由进食饲料和饮用水。为了诱导血-视网膜屏障破坏,将大鼠VEGF蛋白(血管内皮生长因子,R&Dresearch,USA)给予左眼,并将对照组或本发明的CJGT注射到右眼中。在给药后24小时麻醉大鼠,并将50mg/ml荧光素-葡聚糖注射到左心室中。10分钟后,摘出眼睛并分离视网膜。将分离的视网膜使用水性封固剂封固,然后观察并分析。为了定量分析,在将50mg/ml荧光素-葡聚糖注射到左心室之后抽血,在以60ml/min的速率除去血管中剩余的荧光素-葡聚糖后摘出眼睛并分离视网膜。测量分离的视网膜的重量并在离心后使用ELISA酶标仪测量上清液的荧光。5-2实验结果如图4所示,证实了在正常组中没有观察到荧光的渗漏现象,但在VEFG给药组的所有个体中,荧光材料由于血-视网膜屏障破坏而显著(P<0.05)流出血管(血-视网膜屏障破坏越多,看起来就越亮)。然而,在给予100μg/ml的上述实施例1制备的CJGT的组中,由于血-视网膜屏障破坏的抑制而产生的血管性水肿的作用通过显著(P<0.05)抑制VEFG引起的荧光材料从血管的渗漏现象得到证实(图4)。实验实施例6MNU-诱导的年龄相关性黄斑变性的预防性和治疗性作用的确定6-1实验动物育种和实验设计在适应1周后使用6周龄雄性C57BL/6小鼠。为了诱导在黄斑变性中出现的视网膜组织的形态学变化中的感光细胞损伤和变性,将1%(0.05%乙酸)N-甲基-N-亚硝基脲(MNU,Sigma,USA)经腹膜内注射到7周龄雄性C57BL/6小鼠中(60mg/kg)。将相同量的0.05%乙酸经腹膜注射到正常组。将测试药物悬浮并配混在0.5%羧甲基纤维素钠(CMC)中,在MNU给药之前一天以50mg/kg和100mg/kg的浓度口服给予一次,并在MNU给药之后每天口服给予一次,持续7天。仅将相同量的0.5%CMC口服给予MNU-诱导组和正常组。在完成测试药物的给予后,通过对小鼠进行尸体解剖来摘出眼,然后封固在10%中和福尔马林中一天,并包埋在石蜡中,以制备载玻片切片。使用苏木精&曙红(H&E)对载玻片切片染色,并在光学显微镜下观察。通过视网膜组织的外核层的厚度变化测量和评价感光细胞的损失和变性。6-2实验结果如在图5的视网膜切片图中,证实了由感光细胞的核紧凑组成的外核层的厚度变薄,这是因为细胞数量由于MNU给药引起的损伤降低。然而,证实了测试药物CGJT-50和CGJT-100通过显著抑制MNU对感光细胞的损伤来抑制(治疗)黄斑变性的诱导(#p<0.05vsMNU:图5)。实验实施例7在NaIO3诱导的动物模型中的视网膜色素上皮细胞损伤的预防性作用7-1实验动物育种和实验设计在适应1周后使用6周龄雄性SD大鼠。为了诱导作为在黄斑变性中出现的视网膜组织的形态学变化之一的视网膜色素上皮细胞损伤和变性,将3.5%的NaIO3(Sigma,USA)注射到7周龄大鼠的舌下静脉中(35mg/kg)。仅将相同量的生理盐水给予正常组和NaIO3诱导组。将测试药物(CJG30R、CJGT)悬浮并配混在0.5%羧甲基纤维素钠(CMC)中,在NaIO3给药之前一天以50mg/kg和100mg/kg的浓度口服给予一次,并在NaIO3给药之后每天口服给予一次,持续7天。仅将相同量的0.5%CMC口服给予正常组和对照组。通过对大鼠进行尸体解剖来摘出眼,然后封固在10%中和福尔马林中并包埋在石蜡中,以制备载玻片切片。使用苏木精&曙红(H&E)对载玻片切片染色,并在光学显微镜下观察和评价视网膜组织的外核层的折叠数。7-2实验结果色素上皮细胞由于NaIO3给予而损伤,使得目视观察到恰好位于色素上皮细胞上方的由感光细胞的核紧凑组成的外核层弯曲的现象。然而,测试药物CGJ30R-50、CGJ30R-100、CGJT-50和CGJT-100均抑制NaIO3诱导的色素上皮细胞的损伤,从而显著抑制弯曲外核层的现象(图6)。实验实施例8在VLDLR9(极低密度脂蛋白受体)敲除小鼠中的黄斑变性的治疗作用8-1实验动物育种和实验设计显示作为湿性黄斑变性的临床征兆的视网膜下新血管形成的模型动物Vldlr-/-小鼠购自Jacksonlaboratory,并育种以获得2周龄幼龄小鼠,其用于实验。作为正常动物,使用相同周龄的C57BL/6小鼠。将测试药物(CGJ30R)悬浮并配混在0.5%羧甲基纤维素钠(CMC)中,以100mg/kg的浓度每天口服给予一次,持续7天。仅将相同量的0.5%CMC口服给予正常组和对照组。8-2视网膜血管肿胀的测量在尸体解剖中,通过以3:2的比例混合Zoletil50(Virbac30mg/kg)和Rompun(BayerKorea,10mg/kg)并稀释混合物10倍(盐水),然后腹膜内注射50μl来麻醉小鼠。切开腹部后,将5mg异硫氰酸荧光素-葡聚糖(FD40S-lG,sigma)溶解在PBS中的100μl溶液注入心脏,并在5分钟后摘出眼,其中将一只眼封固在10%中和福尔马林中,用于制备视网膜组织切片,并且将另一只眼封固在4%多聚甲醛中10分钟,从其中分离视网膜以制备平面封固的视网膜载玻片,在荧光显微镜下观察(BX51,Olympus,Japan)。8-3染色和观察在从尸体解剖摘出的眼组织中分离视网膜后,将结膜组织封固在4%多聚甲醛中3小时,使用PBS洗涤并在包含5%TritonX-100和1%BSA的PBS中搅拌3小时。再次对其进行洗涤后,将其在4℃下用以1mg/ml溶解在PBS中的凝集素(L2140,sigma)孵育,以1:50稀释。在使用含0.05%Tween20的PBS洗涤2小时后,使其与链霉亲和素TRITC反应,以在37℃下以1:500稀释4小时,使用PBS洗涤30分钟,并使用荧光显微镜观察(BX51,Olympus,Japan)。8-4组织病理学评价将在尸体解剖时封固在10%中和福尔马林中一天的眼包埋在石蜡中以制备载玻片切片。使用苏木精&曙红(H&E)对载玻片切片染色,并在光学显微镜下定量分析视网膜下位点的新血管形成病变。8-5实验结果(1)Vldlr-/-小鼠中的视网膜血管损伤的抑制作用使用视网膜组织切片证实了抑制视网膜毛细血管损伤的现象,因此荧光材料大部分从Vldlr-/-小鼠的视网膜血管流出。然而,这样的损伤视网膜血管的现象被CJG30R给药显著抑制(图7)。(2)视网膜下新血管形成的抑制作用使用视网膜组织切片证实了黄斑变性中出现的视网膜下位点中的新血管形成现象,因此在Vldlr-/-小鼠中观察到通过在外核层以下的视网膜下位点中产生新血管而向上弯曲视网膜组织的现象。然而,这样的血管生成被CJG30R给药显著抑制(图8)。(3)对视网膜色素上皮细胞损伤的抑制作用为了评价视网膜色素上皮细胞的完整性,评价细胞的形态学结构是否改变。使用ZO-1对正常小鼠的视网膜色素上皮细胞染色,并观察为均匀排列的形式,而Vldlr-/-小鼠细胞被损伤并且新血管生长,使得观察到许多改变的位点(箭头)。然而,视网膜色素上皮细胞的变性被CJG30R的给予显著抑制(图9)。(4)对视网膜中的VEGF表达的抑制作用的确定使用上述的实验实施例8-1的动物模型,以与上述实验实施例8-4相同的方式制备载玻片切片。使用H&E对载玻片切片染色,并在光学显微镜下定量分析视网膜下位点的新血管形成病变。因此,如图10所示,通过观察作为参与新血管和血管的通透性的重要因子的VEGF在Vldlr-/-小鼠中重度表达(染成深紫色),而通过给予本发明的CJG30R显著抑制所述表达的事实,证实了本发明的CJG30FR显示对视网膜中的VEGF表达的抑制作用(图10)。实验实施例9CJG30R对激光诱导的脉络膜新生血管大鼠模型中的新血管形成的抑制作用9-1实验动物育种和实验设计通过腹膜内注射Zoletil50(Virbac30mg/kg)和Rompun(BayerKorea,10mg/kg)来麻醉7周龄雄性Long-Evans大鼠(SLCJapan,Tokyo,Japan)。然后,使用1%托吡卡胺滴眼液使瞳孔扩大,使用二极管激光器(波长:532nm,直径:100μm,功率:150mW,持续时间:0.1sec)在视神经乳头周围的四个位置处形成光凝固点。通过形成特征气泡证实了布鲁赫膜的破坏。将从麻醉恢复的大鼠随机分组以给药。将测试药物悬浮并配混在0.5%羧甲基纤维素钠(CMC)中,以100mg/kg的浓度每天口服给予一次,持续10天。在对照组中仅口服给予相同量的0.5%CMC。9-2脉络膜新生血管的评价10天后,在尸体解剖中,通过腹膜内注射比例为3:2的Zoletil50(Virbac30mg/kg)和Rompun(BayerKorea,10mg/kg)的混合溶液来麻醉大鼠。切开腹部后,将5mg异硫氰酸荧光素-葡聚糖(MW2x106,sigma)溶解在PBS中的100μl溶液注入心脏,并在10分钟后摘出眼并封固在4%多聚甲醛中10分钟,从其中分离视网膜,并将含有视网膜下位点的结膜组织制备成平面封固的载玻片,在荧光显微镜下观察(BX51,Olympus,Japan)。使用ImageJ软件(NIH,USA)分析新血管形成位点的尺寸。9-3对视网膜下新血管形成的抑制作用使用视网膜组织切片证实了在黄斑变性中出现的视网膜下位点中的新血管形成的现象,因此CJG30R显示抑制新血管形成的倾向(图11)。实验实施例10CGJ30R和芍药苷(PF)在MNU-诱导的年龄相关性黄斑变性模型中的预防和治疗作用的比较实验已经报导,由于芍药苷(PF)在人视网膜色素上皮细胞系(ARPE-19)中对由于H2O2和氧化应激引起的细胞死亡具有抑制作用,因此其在眼部疾病如黄斑变性中将是有效的(MolecularVision2011;17:3512-3522)。然而,未证实其在动物模型中是否具有黄斑变性的预防和治疗作用,但仅在视网膜色素上皮细胞系中,仅在添加作为毒性物质的H2O2而不是作为黄斑变性的一般原因的老化条件后证实抗氧化作用和细胞死亡抑制,因此未在动物模型中证实其是否确实对黄斑变性有作用。因此,虽然在本发明人发明的材料中包含芍药苷,但是为了证实本发明的材料不仅仅具有芍药苷的单一作用的事实,对芍药苷(PF-6.5)进行了实验,其具有包含在如下的100mg的CJG30R和CJG30R(100mg)的含量。10-1实验动物育种和实验设计在适应1周后使用6周龄雄性C57BL/6小鼠。为了诱导在黄斑变性中出现的视网膜组织的形态学变化中的感光细胞损伤和变性,将1%(0.05%乙酸)N-甲基-N-亚硝基脲(MNU,Sigma,USA)经腹膜内注射到7周龄雄性C57BL/6小鼠中(60mg/kg)。将相同量的0.05%乙酸经腹膜给予正常组。将作为测试药物的CGJ30R(100mg/kg)和PF-6.6(6.5mg/kg)悬浮并配混在0.5%羧甲基纤维素钠(CMC)中,在MNU给药之前一天口服给予,并在MNU给药之后每天口服给予一次,持续7天。将相同量的0.5%CMC口服给予正常组和MNU-诱导组。10-2组织病理学评价在完成测试药物的给予后,通过对小鼠进行尸体解剖来摘出眼,然后封固在10%中和福尔马林中一天,并包埋在石蜡中,以制备载玻片切片。使用苏木精&曙红(H&E)对载玻片切片染色,并在光学显微镜下观察。通过视网膜组织的外核层的厚度变化测量和评价感光细胞的损失和变性。10-3实验结果与MNU给药组相比,证实了CGJ30R给药组的显著作用,但具有包含在100mgCGJ30R中的芍药苷的含量的给药组(PF-6.5)根本没有作用(表4和图12)。也就是说,如图11的视网膜切片图那样,在视网膜中的由感光细胞的核紧凑组成的外核层的损伤程度中,MNU给药组恶化了几乎50%或更多(1.99±0.21->0.92±0.17AU:*p<0.05vsNOR)。但在CJG30R给药组中,作用与MNU给药组相比提高了35%(0.92±0.17AU->1.19±0.29AU:#p<0.05vsMNU),但是本身是单一化合物的芍药苷(PF-6.5)根本没有作用(参见表4和图11)。表4CGJ30R对MNU-诱导的动物模型中的外核层(ONL)损伤的抑制作用组ONL厚度(AU)ONL厚度(%)NOR1.99±0.21100.00±27.72MNU0.92±0.17*0.00±25.55*CJG30R1.19±0.29#35.27±14.86#PF-6.50.96±0.173.52±16.11(*p<0.05vsNOR;#p<0.05vsMNU)虽然CJG30R和CJGT分别包含含量为6.5%和6.1%的芍药苷(PF),但是证实CJG30R和CJGT的作用不仅是由于芍药苷的单一化合物,而是由于存在于CJG30R和CJGT中的许多单一成分的协同作用。工业适用性本发明不仅在药学上可用作有效预防和治疗血管性水肿的天然提取物组合物,而且还有效地用作健康功能食品。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1