体外生长的感染性疟原虫子孢子的制作方法
本申请要求2014年5月2日提交的美国临时申请第61/987,834号和2014年6月25日的美国临时申请第62/016,981号的优先权,每一临时申请的内容由此都以全文引用的方式并入。
技术领域
本发明大体上涉及寄生虫学领域、疟疾研究和疟疾疫苗开发。更确切地说,其涉及人类宿主范围的疟原虫子孢子和体外培养人类宿主范围感染性疟原虫寄生虫的蚊期,尤其子孢子期,和体外培养的疟原虫子孢子作为疫苗与其它试剂的免疫原性组分的用途。
背景技术:
每年,恶性疟原虫(Plasmodium falciparum,Pf)疟疾造成>2亿临床病例,超过600,000人死亡,并且造成非洲国内生产总值损失超过$12B[1-3]。疟疾也是旅行者和军事人员的重大隐患。在2010-2011期间,在来自英国的旅行者中,疟疾病例的数目增加了30%[4]。在2011年,美国的疟疾病例比过去40年中任一年都多[5,6]。在过去150年中美国在疟疾高发区的所有军事活动中,美国军队死于疟疾的人比死于敌方炮火的人更多[7]。在全球健康市场中,高效疫苗将对大致25亿“有风险的”个体具有显著影响。
世界团体现在每年花费大致$20亿来通过使用杀虫剂浸渍的蚊帐、杀虫剂和抗疟疾药物来控制疟疾。对出生在非洲的每个儿童,这相当于每年大致$80,并且在一些地方,所花费的是所述金额的5到10倍。这些方法在许多区域具有极佳效果。然而,耐药性和耐杀虫剂性仍在发展,并且捐助人和地方政府维持此努力的能力有限。显然,在高传播区消除疟疾将需要新工具。如在2010年社论中所描述,高效疫苗将是用于在世界范围内预防、控制和消除疟疾的理想工具:
“仍需要的是曾真正克服任何传染病的唯一工具:有效的……经济上可承受的疫苗……在这方面,全球疟疾团体太自满了……葛兰素史克公司(GlaxoSmithKline)的RTS,S加佐剂AS01是具有适度和时间受限功效的第一代红细胞前期疫苗……我们无法承受下一代……疫苗要再等20年……”
-匿名,柳叶刀(The Lancet),2010年4月24日
并且如2011年malERA倡议报告中所描述,理想的疫苗将是红细胞前期疫苗,其预防寄生虫离开肝脏进入血流,由此预防疾病以及传播[8]。这已经被称为“中断疟疾传播的疫苗”(‘VIMT’)。
葛兰素史克公司已经开发出被称为RTS,S/AS01的疫苗候选物,其使用重组蛋白(其与具有B型肝炎表面抗原的Pf环子孢子蛋白质(circumsporozoite protein,CSP)的一部分融合)与强佐剂(AS01)。最近在5-27月人类龄中的3期试验[9-12]展现,疟疾发生率在一年内减少36%,并且获得疟疾的速率在第一年内降低56%,并且严重疟疾在第一年内减少47%。不利的是,在婴儿中的结果没有这么强。在6-12周龄人类中,所述疫苗展现,疟疾发生率在一年内减少16%,获得疟疾的速率在第一年内降低31%,并且严重疟疾在第一年内减少36%(按有意向治疗计,26%)。这些结果已经令人失望,并且将无法认为此疫苗是高效或像VIMT一样。
在过去十年中,开发高效VIMT疟疾疫苗的焦点已经部分地转移到利用疟原虫的全寄生虫子孢子(sporozoite,SPZ)期作为疫苗免疫原。在国家过敏症和传染病研究院(National Institute of Allergy and Infectious Disease,NIAID)疫苗研究中心(VRC)最近完成的研究中,通过静脉内(IV)注射投与由辐射减毒Pf SPZ构成的 PfSPZ疫苗,并且保护了6名接受最高剂量的志愿者中的6人(100%)。关于保护功效存在剂量反应(9名以下一个较低总剂量受保护者中的6人),并且在抗体针对Pf SPZ的效价与保护之间存在显著相关性。因此,可论证地, PfSPZ疫苗在人类中具有强效和高保护性。这些历史结果在2013年8月在科学(Science)中线上出版,并且在2013年9月印刷出版[13]。
SPZ也正用作称为 PfSPZ-CVac的疫苗接种的感染与治疗方法的寄生虫组分,其中在无性生殖红细胞期抗疟疾药(如氯喹)存在下投与活感染性疟原虫SPZ[14]。
最后,活感染性Pf SPZ正作为用于测试疟疾疫苗和其它治疗剂的手段用于受控人类疟疾感染(CHMI)[15,16]。
由从蚊子中提取的唾液腺制备并且在培养物中生长的基本上纯化的疟原虫子孢子描述于美国专利8,043,625中,其以引入的方式并入本文中。
目前,在上文所描述的疫苗和试剂中所用的全寄生虫Pf SPZ已经通过以下来获得:饲养无菌按蚊属(Anopheles)蚊子,用无菌Pf配子母细胞使其感染,准许Pf寄生虫经由在蚊子中进行体内孢子生殖来进展到子孢子期,并且接着从蚊子中人工解剖唾液腺并分离和纯化无菌子孢子(美国专利7,229,627;美国专利8,367,810)[17]。虽然此制造方法能够产生足够量的经过无菌纯化的活Pf SPZ以用于这些产物的所有临床试验中,但所述方法是劳动力密集的并且需要用于昆虫饲养和寄生虫解剖的大量资源。确切地说,由蚊子唾液腺解剖是产生Pf SPZ和其它人类宿主范围疟原虫物种SPZ中专业并且耗时的步骤。
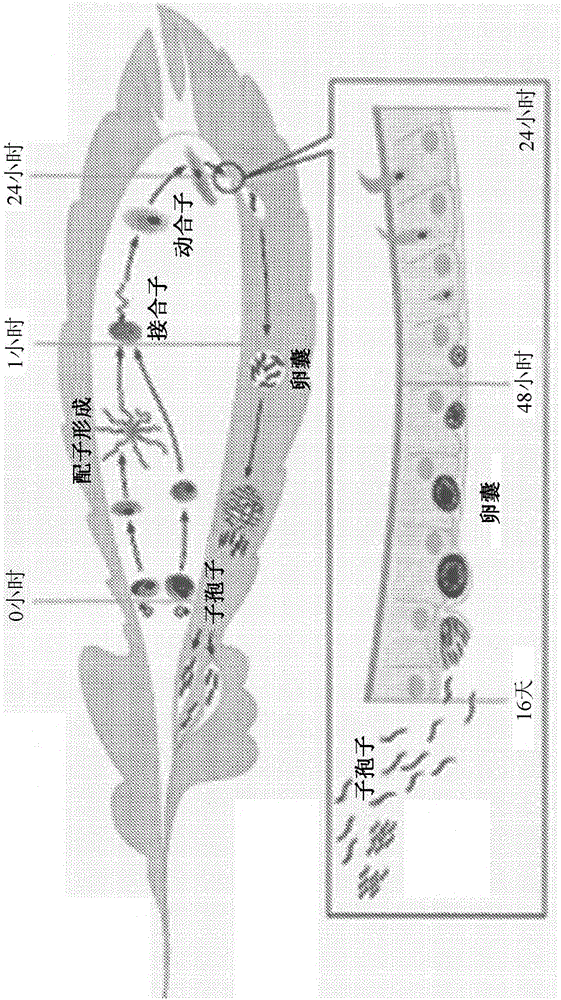
疟原虫寄生虫发育的蚊子宿主期展示于图1中。虽然体外确立疟原虫生命周期的无性生殖部分(脊椎动物宿主期)的努力已经获得成功[18],也已经为了对有性生殖部分(蚊子宿主期)和孢子生殖部分实现相同结果而进行大量努力,但这些成果对于产生临床上相关的人类宿主范围的感染性疟原虫子孢子(尤其Pf SPZ)不成功。鸡疟原虫(P.gallinaceum)(禽类宿主范围)和Pf动合子的体外转型得到低数目的卵囊和SPZ,但从未展现这些子孢子的感染性[19-20]。伯氏疟原虫(P.berghei)(啮齿动物宿主范围)的体外转型产生卵囊和SPZ,但所述SPZ的感染性比蚊源性SPZ小得多[21]。
技术实现要素:
本文提供体外饲养的人类宿主范围感染性疟原虫子孢子(SPZ),尤其恶性疟原虫(Pf)SPZ,其中从配子母细胞期到子孢子期的孢子生殖在蚊子外部进行。在一些实施例中,体外饲养的感染性疟原虫子孢子不具有任何伴随蚊类物质。
另外提供体外饲养的人类宿主范围疟原虫寄生虫的培养物,尤其Pf寄生虫的培养物,其中所述寄生虫已经进行体外孢子生殖发育。在一些实施例中,培养物不具有任何伴随蚊类物质。
另外提供在人类宿主范围疟原虫子孢子的孢子生殖发育期间体外培养所述子孢子的方法,所述方法包含在小配子形成培养基中在红细胞存在下培养人类宿主范围疟原虫配子母细胞,使用凝集素使红细胞凝集,收集包含接合子、配子、配子母细胞和凝集细胞的混合物(例如团块),在包含基质的衬底(substrate)上并在动合子培养基中培养所收集的混合物(例如团块),更换培养基并在卵囊培养基中继续培养,和采集由此产生的疟原虫子孢子。
还提供用于相对于在蚊子中由相等数目人类宿主范围疟原虫配子母细胞的卵囊产生而增加人类宿主范围疟原虫卵囊产生的方法,其包含在小配子形成培养基中培养人类宿主范围疟原虫配子母细胞,收集包含接合子、配子、配子母细胞和凝集细胞的混合物(例如团块),在包含基质的衬底上并在动合子培养基中培养所收集的混合物(例如团块),更换培养基并在卵囊培养基中继续培养,和对疟原虫卵囊数目进行量化,其中与在蚊子中由相等数目疟原虫配子母细胞发育的相同物种卵囊相比较,所述方法产生更多的体外发育的卵囊。
还提供在个体中诱导针对疟原虫物种特异性抗原的免疫反应的方法,其包含向所述个体投与人类宿主范围的疟原虫饲养子孢子。
还提供包含体外饲养的人类宿主范围疟原虫子孢子的疫苗组合物。在一些实施例中,疫苗不具有任何伴随蚊类物质。
本文所公开的本发明提供例如以下创新:i)与在蚊子中并且由相等数目V期配子母细胞发育的相同疟原虫物种卵囊相比较,得到平均39倍的体外发育的卵囊;ii)产生体外饲养的感染性Pf SPZ;及iii)由体外产生的Pf SPZ达到至少与蚊子产生的Pf SPZ同样高效的人类肝细胞感染性。
此工作的突出之处在于,在由既定数目的配子母细胞体外产生的Pf SPZ数量方面和在体外产生的Pf SPZ展现全功能感染活性方面具有独特性。举例来说,本文描述体外产生的Pf SPZ成功地侵入人类肝细胞株HC-04[24,25],并且发育成表达裂体性孢子表面蛋白质1(Pf MSP1)(一种展现感染性的蛋白质)的裂殖体;并且展现此体外感染性至少与蚊子产生的Pf SPZ的感染性同样高效。
附图说明
图1绘示恶性疟原虫在蚊子中的孢子生殖发育。
图2A-2B提供体外产生的恶性疟原虫的接合子后期发育的样本图像。(A)展示早期瓶状体(retort)、中期瓶状体和晚期瓶状体(从左到右),并且(B)展示成熟动合子。在诱导后第18天时从配子母细胞培养物中取得寄生虫。在动合子培养起始之后约14小时时首先发现早期瓶状体,并且在24小时时发现动合子。展示培养物的吉姆沙(Giemsa)染色涂片。
图3A-B展示使用针对血型糖蛋白A和Pfs25的抗体对(A)配子母细胞和(B)动合子的免疫染色。针对血型糖蛋白A(指向红色染色的空心箭头)的抗体和针对Pfs25(指向绿色染色的实心箭头)的抗体。
图4展示体外发育的Pf卵囊的IFA和亮视野图像。展示使用抗Pfs25和抗PfCSP mAb通过IFA所检测的3天(上部图)和8天(下部图)卵囊。对8天培养物进行透化以用于IFA。在8天卵囊中的点状染色表明出芽的Pf SPZ。中间图展示在培养物中发育的7到8天卵囊。箭头指示卵囊。
图5A-B展示(A)体外和(B)在汞溴红染色的蚊子中肠中的7天卵囊。
图6A-B展示体外产生的Pf SPZ:(A)在使培养物孔固定之后所检测的在培养物孔中发育的Pf SPZ和(B)所提取的Pf SPZ。两者都使用荧光标记的抗Pf CSP mAb通过IFA检测。
图7绘示体外3D培养系统的一个实例。
图8A-C展示通过离心提取的来自跨孔插入物(transwell insert)改性3D基质的卵囊的样本图像:(A和B)在用于量化的细胞计数仪中的卵囊相位衬度图像和(C)使用荧光标记的抗Pf CSP mAb的所提取卵囊在悬浮液(未经透化)中的IFA。
图9A-B展示体外产生和蚊子产生的Pf SPZ在HC-04细胞中的发育。在用(A)体外产生的Pf SPZ(上部图)或(B)蚊子产生的无菌、经过纯化、冷冻保存Pf SPZ(底部图)感染后,在HC-04细胞中6天肝脏期的共焦显微图。
具体实施方式
定义
如关于寄生虫发育本文所用,“体外”意味着不依赖于完整宿主生物体(也被称作全宿主生物体)并且在其外部进行。举例来说,人类宿主范围疟原虫寄生虫的体外发育包括培养经由在活动物宿主(例如蚊子)外部进行并且不依赖于其的发育期发展的寄生虫。
如本文所用,“饲养(rearing)”或“饲养的(reared)”意味着促进和支持疟原虫生长和发育的有序与个体发育性进展。
如本文所用,“孢子生殖”(或孢子生殖发育)意味着疟原虫发育经由特征性有性生殖期从配子母细胞到子孢子的有序与个体发育性进展。
如本文所用,“人类宿主范围的疟原虫物种”(与人类宿主范围疟原虫物种、人类宿主范围的疟原虫寄生虫和人类宿主范围疟原虫寄生虫可互换使用)包括以下物种的疟原虫:恶性疟原虫(P.falciparum)、间日疟原虫(P.vivax)、卵形疟原虫(P.ovale)、三日疟原虫(P.malariae)和诺氏疟原虫(P.knowlesi)。
如本文所用,“培养物”在体外饲养人类宿主范围疟原虫寄生虫的情形下意味着在活动物宿主(例如蚊子)外部进行的包含培养基和人类宿主范围疟原虫寄生虫的系统。在某些实施例中,培养物进一步包含衬底。
如本文所用的“衬底”意味着生长表面。在一些实施例中,衬底包含细胞培养物基质,例如包含聚苯乙烯基质和/或基质胶(Matrigel)[27,28]。
如本文所用的“培养基”意味着营养组合物。在某些实施例中,培养基是小配子形成培养基,其促进由配子母细胞生成配子,所述配子接着进行繁殖成为接合子,例如通过模拟吸血之后的蚊子内腔条件。在某些实施例中,所述培养基是动合子培养基,其促进接合子分化为动合子。在某些实施例中,培养基是卵囊培养基,其提供用于体外孢子生殖达到子孢子期的营养物。
如本文所用的“适合于人类医药使用”是指具有足以用于在人类中批准临床使用的数量、灭菌性(无菌性)和纯度,例如根据FDA或USP标准可接受。
如本文所用的“无菌”意味着不引入或存在可检测的微生物污染,如细菌、真菌、病理性病毒等。子孢子制备的无菌方法得到子孢子的灭菌制剂,其不含任何其它类型的微生物或感染物。临床和医药使用需要灭菌组合物的无菌制剂。用于监测无菌方法的微生物分析评定存在或不存在污染。其包括(但不限于)以引入的方式并入本文中的微生物限制测试(目前USP<61>)和灭菌性测试(目前USP<71>)。
如本文所用的“伴随物质”是指子孢子培养物或制剂中的物质,其不是培养基或培养基组分或载体或赋形剂并且对子孢子本身不具有特异性。在某些实施例中,伴随物质包括例如生物碎片。在一些实施例中,伴随物质是用以产生子孢子的手段的结果。
如本文所用的“伴随蚊类物质”是来源于蚊子并对蚊子具有特异性的生物物质或碎片。
如本文所用的“赋予保护性免疫”是指向群体或宿主(即,个体)提供产生针对由病原体(例如恶性疟原虫)造成的疾病(例如疟疾)进行保护的免疫反应的能力,以使得在攻击时,宿主中疾病的临床表现、病理学或症状与未经治疗的宿主相比减轻,或以使得在群体内出现感染、或疾病的临床表现、病理学或症状的速率与未经治疗的宿主相比降低。
如本文所用的“免疫反应”在疟原虫特异性抗原的情形下意味着在接受者中对引入子孢子的反应,其特征一般在于(但不限于)产生抗体和/或细胞免疫反应。一般来说,免疫反应可以是细胞反应,如对疟原虫物种抗原决定基具有特异性的CD4+T细胞或CD8+T细胞的诱导或活化;对疟原虫特异性抗体产生增加的体液反应;或细胞和体液反应两者。关于疟疾疫苗,由包含子孢子的疫苗确立的免疫反应包括(但不限于)在寄生虫进入宿主细胞(尤其肝细胞和单核细胞,如树突状细胞)之后,对由细胞外子孢子所表达或由寄生虫其它期所表达的蛋白质的反应和/或对所述寄生虫的组分的反应。在本发明的一个实施例中,免疫反应是针对子孢子特异性抗原的可测量抗体和/或细胞反应。在其它实施例中,在由感染性生物体后续攻击时,免疫反应预防病原性寄生虫发育到造成疾病的红细胞期。
如本文所用的“疫苗”是包含免疫原性药剂和药学上可接受的稀释剂(可能与赋形剂、佐剂和/或添加剂或保护剂组合)的制剂。免疫原可以包含全感染物或所述感染物的分子子集(由所述感染物合成地或重组地产生)。当向个体投与疫苗时,免疫原刺激将在用感染物后续攻击时保护个体不生病或减轻由所述感染物造成的病理学、症状或临床表现的免疫反应。治疗性(治疗)疫苗在感染之后给予,并且打算减轻或遏制疾病进展。预防性(preventive/prophylactic)疫苗打算预防初始感染或降低感染的速率或负荷。在针对寄生虫疾病(如疟疾)的疫苗中所用的药剂可以是完整的死(无活性)寄生虫、活寄生虫、活减毒寄生虫(不能完全进展通过其生命周期)、或经过纯化或人工制造的与寄生虫相关联的分子,例如重组蛋白、合成肽、DNA质体和表达疟原虫蛋白质的重组病毒或细菌。如所属领域的技术人员将容易理解的,疫苗可以包含子孢子以及其它组分,如赋形剂、稀释剂、载体、防腐剂、佐剂或其它免疫增强剂或其组合。
如本文所用的“减毒”意味着对生物体(如疟原虫寄生虫)进行基因改变或突变以使得其失去其完成其正常生命周期的能力,而使其停滞在特定发育期。在本发明的疟原虫生物体中,辐射减毒寄生虫或基因减毒寄生虫(genetically attenuated parasite,GAP)的一或多种基因的功能受到破坏,以使得减毒突变体保留感染宿主和侵入肝脏内肝细胞的能力但在肝脏期使发育停滞。
如本文所用的“肝细胞侵入”是指子孢子期的疟原虫寄生虫在初始引入到宿主循环系统中之后寻求并进入特定目标细胞的能力,在此情况下,所述目标细胞是宿主肝细胞,即培养物中的肝细胞[24,25]或体内肝细胞。非减毒寄生虫将接着进行进一步时期特异性发育。
如本文所用的“代谢活性”意味着存活并且能够进行生命维持功能和一些寿命周期过程。关于减毒子孢子,这包括(但不限于)能够侵入培养物中和体内的肝细胞、潜在地具有有限的在肝脏内分裂并进展通过一些发育期的能力、并且重新表达时期特异性蛋白质的子孢子。
体外子孢子
公开体外饲养的活感染性子孢子,尤其疟原虫子孢子(减毒子孢子以及病原性子孢子)的组合物。在某些实施例中,本申请是有关体外饲养的人类宿主范围疟原虫子孢子的培养物,其中从配子母细胞期到子孢子期的孢子生殖在蚊子外部进行。在一些实施例中,体外饲养的感染性疟原虫子孢子不具有任何伴随蚊类物质。在某些实施例中,从配子母细胞期到子孢子期的孢子生殖已经在蚊子外部进行。
在一些实施例中,体外饲养的疟原虫子孢子对人类肝细胞的感染性是在蚊子中饲养的人类宿主范围疟原虫子孢子的至少70%、80%或90%。在一些实施例中,体外饲养的疟原虫子孢子对人类肝细胞的感染性是在蚊子中饲养的人类宿主范围疟原虫子孢子的70%-100%、80%-100%或90%-100%之间。在一些实施例中,在体外或体内测量感染性。
在一些实施例中,使用体外Pf 6天肝细胞效力分析来测量感染性,所述分析用于测定体外Pf SPZ感染HC-04(1F9)细胞(人类肝细胞株)[24,25]并且发育成表达PfMSP-1的肝脏晚期寄生虫[15]的能力。此类方法的一个实例可以包括:
a.ECL涂布的Lab-Tek载玻片的细胞培养和接种。在37±2℃下用ECL细胞附着基质涂布8孔Permanox Lab-Tek腔式载玻片持续1-2小时。用完全DMEM/F-12培养基(CM)稀释HC-04(1F9)细胞,以每孔0.3mL中4×104个活细胞接种。洗涤,并且在37±2℃和5±2%CO2下培育24±4小时;
b.感染和每孔所添加SPZ数目的计算:在22±2℃下使用固定角度转子以13,200rpm(相对离心力16,100)离心体外产生的Pf子孢子持续2分钟。弃去上清液,并且将团块再悬浮于CM中。从Lab Tek载玻片的每一孔中抽吸并弃去培养基。一式三份地添加每孔50μL体外SPZ悬浮液。在CM中1:10稀释感染性子孢子悬浮液,并且使用细胞计数仪(Cellometer)和相位衬度显微镜对子孢子数目进行计数,并且计算每孔添加的SPZ数目。在37±2℃和5±2%CO2下培育腔式载玻片持续3小时±10分钟。通过使用1000μL移液管尖端从每一孔轻轻地抽吸含有子孢子的过量培养基来用0.3mL DMEM/F-12完全培养基洗涤单层3次,小心避免用Pf SPZ污染对照孔。在最终洗涤之后,向每一孔中添加0.3mL DMEM/F-12完全培养基;
c.培养物的维持:每日更换培养基以确保肝脏期成功发育并维持培养物。在感染后6天时用冰冷甲醇固定腔式载玻片培养物。在4±2℃下储存;
d.染色用于间接免疫荧光分析(IFA):从载玻片弃去PBS,接着向每一孔中添加2-3滴图像iT-FX信号增强剂,并且在37±2℃下培育30±3分钟。弃去图像增强剂溶液,并且用PBS洗涤培养物3次。向一式三份的孔中添加100μL经过稀释的抗PfMSP-1单克隆小鼠抗体,并且在37±2℃下培育60-70分钟。在培育时段结束时,弃去抗体溶液并且用PBS洗涤。以1:200将Alexa Fluor 488抗小鼠IgG稀释于含0.02%伊文氏蓝(Evan's blue)的PBS中。向一式三份的孔中添加100μL经过稀释的Alexa 488小鼠IgG。在37±2℃下培育载玻片60-70分钟。使用含DAPI的Vectashield封固剂(mounting medium)封固盖玻片,并且远离光线储存在2℃-8℃下,直到观察时间为止;以及
e.Pf肝脏期的评估和计数:以400×放大率使用落射荧光显微镜,评估每孔中展示抗体反应性的Pf肝脏期并且记录其数目。对所有三个孔中的肝脏期寄生虫数目进行计数,并且报告平均值。
在一些实施例中,体外饲养的疟原虫子孢子是无菌的。在一些实施例中,体外饲养的疟原虫子孢子受来自宿主生物体(例如蚊子)的伴随物质污染的风险降低(如可能是从宿主蚊子唾液腺解剖的子孢子的情况)。
在一些实施例中,体外饲养的疟原虫子孢子是人类宿主范围的。在一些实施例中,体外饲养的疟原虫子孢子的物种是恶性疟原虫。
在一些实施例中,体外饲养的疟原虫子孢子适合于医药使用。在一些实施例中,体外饲养的疟原虫子孢子用于疫苗中。在一些实施例中。体外饲养的疟原虫子孢子是减毒的。
测试体外饲养的Pf SPZ在培养物中侵入人类肝细胞并在其中发育的能力。也可以体内测试体外饲养的PfSPZ完成Pf生命周期的能力。这可以通过使用输注有人类血液的人类肝脏嵌合小鼠来进行。
培养物
在某些实施例中,本申请是有关体外饲养的人类宿主范围疟原虫寄生虫的培养物,其中所述寄生虫进行或已经进行体外孢子生殖发育。
在某些实施例中,所述培养物包含处于孢子生殖发育等效期的人类宿主范围疟原虫寄生虫。在某些实施例中,所述培养物能够维持人类宿主范围疟原虫寄生虫的持续孢子生殖发育。
在一些实施例中,所述寄生虫已经到达发育的子孢子期。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子的肝细胞感染性是在蚊子中饲养的相同物种疟原虫子孢子的至少70%、80%或90%。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子的人类肝细胞感染性是在蚊子中饲养的相同物种疟原虫子孢子的70%-100%、80%-100%或90%-100%之间。在一些实施例中,在HC-04细胞中测量感染性,在一些实施例中,通过体内肝感染测量感染性。
一些实施例是针对体外饲养的人类宿主范围感染性疟原虫子孢子的培养物,其中所述培养物不具有任何伴随蚊类物质,并且其中所述体外饲养的疟原虫子孢子的人类肝细胞感染性是在蚊子中饲养的相同物种的人类宿主范围疟原虫子孢子的至少70%、80%或90%。在一些实施例中,体外饲养的疟原虫子孢子的人类肝细胞感染性是在蚊子中饲养的相同物种的人类宿主范围疟原虫子孢子的70%-100%、80%-100%或90%-100%之间。
在一些实施例中,所述培养物包含第一(称为小配子形成)培养基,其促进由配子母细胞生成配子,例如通过模拟吸血之后的蚊子内腔条件。在一些实施例中,小配子形成培养基包含胎牛血清(FBS)、葡萄糖、碳酸氢钠和黄尿酸(xanthruenic acid)。在一些实施例中,小配子形成培养基包含10%-30%、15%-25%或18%-22%FBS。在一些实施例中,小配子形成培养基包含0.05%到0.5%、0.075%到0.5%或0.075%到0.25%葡萄糖。在一些实施例中,小配子形成培养基包含0.05%到0.5%、0.075%到0.5%或0.075%到0.25%碳酸氢钠。在一些实施例中,小配子形成培养基包含0.01%到0.05%、0.01%到0.04%或0.02%到0.04%黄尿酸。在一些实施例中,小配子形成培养基包含FBS、0.05%到0.5%葡萄糖(例如0.1%)、0.05%到0.5%碳酸氢钠(例如0.1%)和0.01%到0.05%黄尿酸(例如0.022%)。
在一些实施例中,去除第一培养基,并且培养物包含第二(称为动合子)培养基,其促进接合子分化为动合子和动合子侵入至3D基质衬底中。在一些实施例中,动合子培养基包含FBS、RPMI和海藻糖。在一些实施例中,动合子培养基包含10%-30%、15%-25%或18%-22%FBS。在一些实施例中,动合子培养基包含0.1%到0.5%、0.15%到0.3%或0.2%到0.3%海藻糖。在一些实施例中,动合子培养基包含0.1%到0.5%、0.15%到0.3%或0.2%到0.3%右旋糖。在一些实施例中,动合子培养基包含0.01%到0.08%、0.02%到0.06%、0.03%到0.05%碳酸氢钠。在一些实施例中,动合子培养基进一步包含抗生素。在一些实施例中,抗生素是青霉素、链霉素或其组合。在一些实施例中,动合子培养基包含1到50单位/毫升、1到40单位/毫升、5到30单位/毫升或10到20单位/毫升的抗生素。在一些实施例中,动合子培养基包含1到50μg/mL、1到40μg/mL、5到30μg/mL或10到20μg/mL的抗生素。在一些实施例中,动合子培养基由含有10%-30%FBS(例如20%)、0.1%到0.5%海藻糖(例如0.25%)、0.1%到0.5%右旋糖(例如0.25%)、0.01%到0.08%碳酸氢钠(例如0.04%)、1到50单位/毫升青霉素(例如10单位/毫升)和1到50μg/mL链霉素(例如10μg/mL)的RPMI培养基组成。
在一些实施例中,去除第二培养基,并且培养物包含第三(称为卵囊)培养基,其提供用于疟原虫寄生虫体外孢子生殖达到子孢子期的营养物。在一些实施例中,卵囊培养基包含施奈德氏果蝇培养基(Schneider's Drosophila medium)[26]、FBS、碳酸氢钠、海藻糖、次黄嘌呤、HEPES、必需氨基酸、对氨基苯甲酸(PABA)、抗生素(例如青霉素和链霉素)、脂蛋白、胆固醇和维生素。在一些实施例中,卵囊培养基包含10%-30%、15%-25%或18%-22%FBS。在一些实施例中,卵囊培养基包含0.01%到0.08%、0.02%到0.06%、0.03%到0.05%碳酸氢钠。在一些实施例中,卵囊培养基包含0.1%到0.5%、0.15%到0.3%或0.2%到0.3%海藻糖。在一些实施例中,卵囊培养基包含10到100μg/mL、20到100μg/mL、25到75μg/mL或40到60μg/mL次黄嘌呤。在一些实施例中,卵囊培养基包含0.05M到0.25M、0.075M到0.2M或0.075M到1.5M HEPES。在一些实施例中,卵囊培养基包含0.01%到0.08%、0.02%到0.06%、0.03%到0.05%PABA。在一些实施例中,卵囊培养基进一步包含抗生素。在一些实施例中,抗生素是青霉素、链霉素或其组合。在一些实施例中,卵囊培养基包含1到50单位/毫升、1到40单位/毫升、5到30单位/毫升或10到20单位/毫升的抗生素。在一些实施例中,卵囊培养基包含1到50μg/mL、1到40μg/mL、5到30μg/mL或10到20μg/mL的抗生素。在一些实施例中,卵囊培养基包含0.05%到0.5%、0.075%到0.5%或0.075%到0.25%脂蛋白。在一些实施例中,卵囊培养基包含0.05%到0.5%、0.075%到0.5%或0.075%到0.25%胆固醇。在一些实施例中,卵囊培养基包含施奈德氏果蝇培养基、10%-30%FBS(例如20%)、0.01%到0.08%碳酸氢钠(例如0.04%)、0.1%到0.5%海藻糖(例如0.25%)、10到100μg/mL次黄嘌呤(例如50μg/mL)、0.05M到0.25M HEPES(例如0.1M)、必需氨基酸(例如1×,吉毕科公司(GIBCO))、0.01%到0.08%对氨基苯甲酸(PABA,例如0.04μg/mL)、1到50单位/毫升青霉素(例如10单位/毫升)和1到50μg/mL链霉素(例如10μg/mL)、0.05%到0.5%脂蛋白(例如1.5%)、0.05%到0.5%胆固醇(例如0.1%)和维生素(例如1×,吉毕科公司)。
在一些实施例中,培养衬底包含3D培养基质。在一些实施例中,3D培养基质预接种有果蝇施奈德S2细胞[26]。在一些实施例中,培养物基质包含涂布有基质胶的聚苯乙烯基质(例如英国AMS生物技术有限公司(AMS Biotechnology Ltd,UK))[27,28]。举例来说,聚苯乙烯基质可以涂布有基质胶,其通过将1mg/mL基质胶小心地层叠在聚苯乙烯基质的顶部上,接着在37℃下培育来进行。在一些实施例中,培养基质包含聚苯乙烯基质、基质胶和果蝇施奈德S2细胞。在一些实施例中,基质涂布有细胞外基质蛋白质,例如层粘连蛋白、胶原蛋白或其组合。
在一些实施例中,培养物是无菌的。在一些实施例中,来源于培养物的子孢子适合于医药使用。
培养疟原虫寄生虫的方法
公开培养疟原虫寄生虫和/或制造体外饲养的活感染性疟原虫子孢子的培养物的方法,以及培养和/或制造体外饲养的减毒疟原虫子孢子的组合物的方法。
在某些实施例中,本申请时有关在人类宿主范围疟原虫寄生虫的孢子生殖发育期间体外培养所述寄生虫的方法,其包含:
a.在小配子形成培养基中在红细胞存在下培养人类宿主范围疟原虫配子母细胞,
b.使用凝集素使红细胞凝集,
c.收集包含接合子、配子、配子母细胞和凝集细胞的混合物(在一些实施例中,这通过离心和收集团块来实现),
d.在包含基质的衬底上并在动合子培养基中培养所述混合物,其中所述寄生虫分化为动合子,并且所述动合子进入所述基质并分化到卵囊期,
e.用卵囊培养基替换所述动合子培养基,和
f.采集由此产生的疟原虫子孢子期寄生虫。
举例来说,用于培养的方法可以包括:(a)将V期配子母细胞悬浮于小配子形成培养基中(1小时)(在此步骤中,雄性和雌性配子由小配子母细胞和大配子母细胞生成,并且相互作用(繁殖)以形成接合子);(b)通过添加凝集素使红细胞凝集,例如麦胚凝集素,一种由小麦纯化的凝集素(1小时);(c)离心培养物悬浮液以收集团块,其含有接合子、红细胞碎片和任何未进行分化的配子母细胞和配子;(d)将团块悬浮于动合子培养基中并且接种到预接种有果蝇施奈德S2细胞的3D细胞培养基质上[26]。在8孔培养板中或在其它组织培养小瓶或跨孔培养插入物中使用基质胶使3D培养基质发育[27,28]。经过发育的动合子接着在接下来的20-24小时内侵入基质中,这是因为所述动合子是运动性的(与不具运动性的配子母细胞、配子和接合子不同);(e)20-24小时后,洗涤跨孔插入物或8孔培养板以去除任何未已侵入基质中的动合子以及残余配子母细胞、配子和接合子(其未发育成动合子),并且用卵囊培养基替换所述培养基。在侵入之后12-24小时内。基质中的动合子转型为卵囊。(f)每2-3天更换卵囊培养基一次;(g)在起始培养后第7天、第8天和第11天测定第7、8和11天卵囊;(h)在培养起始后第15、18和21天从培养基中采集SPZ,其通过从8孔或跨孔培养板上收集培养基,接着湿磨来进行。使用细胞计数仪对PfSPZ进行计数;可以接着将所采集的SPZ接种在HC-04细胞上以用于使用6天肝细胞效力分析来确定效力。
在某些实施例中,人类宿主范围疟原虫配子母细胞来源于人类宿主范围疟原虫在红细胞(red blood cell/erythrocyte)中的培养物,例如特拉格(Trager)W和延森(Jensen)JB.科学193:673-675,1976中所公开的,其以引入的方式并入本文中。
疟原虫卵囊产生增加的方法
在某些实施例中,本申请是有关一种用于与相同物种并在蚊子中由相等数目人类宿主范围疟原虫配子母细胞发育的卵囊相比较,增加疟原虫卵囊产生的体外方法,其包含:
a.在小配子形成培养基中在红细胞存在下培养人类宿主范围疟原虫配子母细胞,
b.使用凝集素使所述红细胞凝集,
c.收集包含接合子、配子、配子母细胞和凝集细胞的混合物(在一些实施例中,这通过离心和收集团块来实现),
d.在包含基质的衬底上并在动合子培养基中培养所述混合物,其中所述寄生虫分化为动合子,并且所述动合子进入所述基质并分化到卵囊期,
e.用卵囊培养基替换所述动合子培养基,
f.通过每40-80小时(较佳地,48-72小时)用含有S2细胞(添加S2细胞以补充细胞在培养基更换期间的损失)的卵囊培养基替换所述卵囊培养基来继续寄生虫培养,和
g.对人类宿主范围卵囊期疟原虫寄生虫进行定量;
h.其中与在蚊子中由相等数目人类宿主范围疟原虫配子母细胞发育的相同物种卵囊相比较,所述方法产生更多的体外发育的人类宿主范围疟原虫卵囊。
在某些实施例中,人类宿主范围疟原虫配子母细胞来源于人类宿主范围疟原虫在红细胞中的培养物,例如特拉格(1976)中所公开的。
在一些实施例中,V期配子母细胞体外转型为动合子的效率在1%-25%、5%-25%、5%-21%或8%-21%范围内。
在一些实施例中,V期配子母细胞体外转型为第7、8或11天卵囊的效率在1%-15%、2%-14%、2%-25%或2.4%-12.5%范围内。
在一些实施例中,与在蚊子中由相等数目V期配子母细胞发育的卵囊相比较,体外发育至少10到20、10到30、10到39或10到60倍的卵囊。在一些实施例中,与在蚊子中由相等数目V期配子母细胞发育的卵囊相比较,体外发育10到20、10到30、10到39或10到60倍的卵囊。
使用方法
公开使用体外饲养的疟原虫子孢子和减毒的体外饲养的疟原虫子孢子的方法(参见例如:U.S.7,229,627;USSN 61/783,326,其两者都以引入的方式并入本文中),其作为免疫原在疫苗中预防疟疾。还公开使用体外饲养的病原性寄生虫的方法,其适用于评定抗疟疾药物和疫苗的有效性,并且与抗疟疾药剂(尤其以疟原虫感染的无性生殖红细胞期为目标的抗疟疾药,如氯喹)结合适用于赋予保护性免疫的疫苗疗程。
在某些实施例中,本申请的体外饲养的人类宿主范围疟原虫子孢子用于疫苗组合物中。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子是减毒的。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子是未减毒的。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子是未减毒的并且与抗疟疾药剂(例如氯喹)一起使用。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子在人类个体中诱导免疫反应。在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子产生针对相应疟原虫子孢子的免疫反应,并且在一些实施例中,体外饲养的人类宿主范围疟原虫子孢子为人类个体提供保护性免疫。
实例
实例1
用于可再现地体外产生和纯化较大数目恶性疟原虫动合子的优化方法
评定来自不同年龄的配子母细胞培养物并且在高配子母细胞密度和低配子母细胞密度下的动合子产生。在配子母细胞诱导后14-22天时由高密度和低密度培养物可再现地产生动合子和晚期瓶状体(图2A-2B)(表1)。瓶状体是寄生虫在其由接合子发育成动合子期间的中间形式,并且动合子和晚期瓶状体两者(图2A-2B)在蚊子中转型为卵囊。在诱导后第18天时从配子母细胞培养物中取得寄生虫。在动合子培养起始之后约14小时时首先发现早期瓶状体(图2A),并且在24小时时发现动合子。通过光学显微镜检查培养物的吉姆沙染色涂片展示圆形大配子和接合子以及新月形配子母细胞和动合子在培养物中的混合物。接合子由于存在突出的核而与大配子区分。动合子由于存在突出的核以及缺少周围红细胞膜而与配子母细胞区分。两种其它方法用于提供转化率和纯化率的估算值。首先,筛选针对寄生虫不同时期所表达的以下分子的单克隆抗体(mAb):在成熟大配子母细胞和大配子上表达的Pfs 48/45,在大配子和接合子上的Pfs 230,在配子和动合子上的Pfs25,以及在动合子和PfSPZ上的PfCelTOS(未展示数据)。Pfs230定位于配子母细胞和大配子上,而Pfs48/45定位于配子和瓶状体。Pfs25可变地定位于配子母细胞,但在瓶状体和动合子上大量表达。通过分别用针对Pfs25(指向绿色染色的实心箭头))和红细胞抗原血型糖蛋白A(指向红色染色的空心箭头)的抗体标记所培养的寄生虫(图3A-3B),基于存在或不存在红细胞膜来区分配子母细胞与动合子。
进行若干方法以从未感染的红细胞中纯化和富集出所培养的动合子。可以使用Lympholyte-H梯度离心去除大致90%的未感染红细胞,但动合子与配子母细胞、配子和接合子一起共纯化。开发3步骤程序来纯化和富集。此程序是成功的并且实现>70%富集。V期配子母细胞体外转型为动合子的平均效率是13%(范围=8%-21%,表1)。
实例2
由动合子体外产生恶性疟原虫子孢子
第一步是高效地产生卵囊。简言之,将V期配子母细胞从体外培养物转移到小配子形成培养基(FBS、0.1%葡萄糖、0.1%碳酸氢钠和0.022%黄尿酸)中,并且在培育之后,将接合子转移到改性动合子培养基(20%FBS、RPMI培养基、0.25%海藻糖、0.25%右旋糖、0.04%碳酸氢钠、10单位/毫升青霉素和10μg/mL链霉素)中并且层叠到改性基质胶涂布的8孔载玻片上。为了涂布8孔载玻片,用RPMI培养基稀释基质胶,并且将其倒入8孔载玻片中。将这些载玻片在37℃下培育2小时,并且去除过量培养基。通过在基质胶顶部上接种果蝇施奈德S2细胞,随后层叠接合子来对基质胶涂布的载玻片进行改性。分化的动合子侵入基质胶中。在培育之后24小时时,在将动合子培养基更换为卵囊培养基(施奈德氏果蝇培养基、20%FBS、0.04%碳酸氢钠、0.25%海藻糖、50μg/mL次黄嘌呤、0.1M HEPES、必需氨基酸(1×,吉毕科公司)、0.04μg/mL对氨基苯甲酸(PABA)、10单位/毫升青霉素和10μg/mL链霉素、1.5%脂蛋白、0.1%胆固醇和维生素(1×,吉毕科公司))期间洗掉未侵入基质胶中的未分化接合子和动合子。在动合子和卵囊培养基两者中,添加S2细胞(图4)。展示使用抗Pfs25和抗PfCSP mAb通过IFA所检测的3天(图4,上部图)和8天(图4,下部图)卵囊。对八天培养物进行透化以用于IFA。在8天卵囊中的点状染色表明出芽的PfSPZ。在中间图(图4)中,箭头指示在培养物中发育的7到8天卵囊。在初始实验之后,改变培养条件,如用于涂布的基质胶浓度和向每一孔中接种的接合子数目,以显著地增加V期配子母细胞发育成8天卵囊的转型效率。使用此改变的体外培养方案,始终实现V期配子母细胞向8天卵囊的2.4%到12.5%(平均8.3%)转型(表2)。对于在改变体外培养方案之前最初记录的0.13%,这是大改进。在萨那利亚公司(Sanaria)进行的74个独立膜喂饲分析中,V期配子母细胞在蚊子中向卵囊的转型效率是0.22%(李(Li)等人的制备)。此转型效率与文献中所报告的效率相当[22,23]。8.3%体外转型效率是在蚊子中所观察到的39倍(表2、3)。体外(图4、5A、8A-C)和在蚊子中(图5B)发育的卵囊的大小和结构类似。图5A展示用抗PfCSP mAb染色的体外培养的7天卵囊和汞溴红染色的蚊子中肠7天卵囊(图5B)的IFA。
在第15天和/或第18天通过从孔中收集包括未附着的S2细胞的培养物上清液来采集体外培养物。在细胞计数仪中对形态上发育的PfSPZ的数目进行计数,并且使用荧光抗PfCSP mAb对等分试样染色以用于确认(图6B,表4)。在使用荧光抗Pf CSP mAb染色的孔固定之后,检测培养孔中发育的Pf SPZ(图6A)。在7个独立实验中,每批来自十个8孔载玻片的采集物产生介于180,000与350,000个之间的成熟Pf SPZ。在所有实验中,存在两种形态上不同形式的Pf SPZ。形态上成熟的Pf SPZ看起来与唾液腺Pf SPZ一致,具有运动性,10-13μm长并且对抗Pf CSP mAb具有高度反应性(图6A-B,表4)。短形、不成熟的Pf SPZ<10μm长,但仍具有运动性并且对抗Pf CSP mAb具有高度反应性。在所报告的所有实验中,仅量化形态上成熟的Pf SPZ。在第15和18天从相同培养物采集使收率增加到每十个载玻片约500,000个PfSPZ。
随后,测试3D跨孔系统。在两个使用此途径的独立培养物实验中,从一个6孔培养板培养物中采集到228,000个和208,000个形态上成熟的Pf SPZ。最初,使用被发现适合于体外培养卵囊的两种可商购的3D基质。3D Life水凝胶(德国赛兰德斯有限公司(Cellendes GmbH,Germany))用于在仿生3D环境中培养细胞,而AlgiMatrixTM 3D培养系统(吉毕科公司/英杰公司(Invitrogen))是促进3D细胞培养的无动物来源生物骨架。两者都支持Pf孢子生殖。3D Life水凝胶需要半乳糖苷酶消化以用于从基质中释放Pf SPZ,而成熟Pf SPZ截留在Algimatrix基质中。因此,作为一个替代方案,我们基于与Alvetex3D培养技术(英国AMS生物技术(欧洲)有限公司)结合的培养系统开发一种跨孔插入物。跨孔插入物在其插入到培养板孔中时允许双隔室培养(图7)。在此系统中,将涂布有基质胶的惰性200μm厚多孔聚苯乙烯骨架放置在插入物的多孔膜上。接种到此3D基质上的接合子分化为动合子,侵入基质胶涂布的聚苯乙烯骨架,并且转型为卵囊。上部隔室接种有S2细胞。卵囊在此基质中发育,并且PfSPZ释放到下部隔室中并从下部隔室中收集。在初步实验中,此系统支持Pf孢子生殖发育(表5),并且卵囊发育和保留与腔室载玻片培养极类似(表2、3)。为了评定孢子生殖发育,移出多孔膜以及基质,并且通过离心收集卵囊。V期配子母细胞向7天和11天卵囊(图8A-C)的转型效率分别是10.3%(范围9%-11.5%)和9.0%(范围7.8%-10.7%)(表5)。11天卵囊的数目表示极大增加,并且指示卵囊在培养期间显著保留此外,所提取的卵囊在外观上类似于在蚊子中肠中发育11天的卵囊,并且这些体外形成的卵囊表达PfCSP(图8C)。图8A-B展示在用于量化的细胞计数仪中的卵囊相位衬度图像(图8A和B)和使用荧光标记的抗Pf CSP mAb的所提取卵囊在悬浮液(未经透化)中的IFA(图8C)。卵囊的染色在未经透化的悬浮液中进行,并且因此,PfCSP染色的卵囊具有均匀而非点状的PfCSP表达图案(图8C)。
在两个独立培养实验中,从一个使用6个改性插入物的6孔培养板培养物中采集到228,000个和208,000个形态上发育的PfSPZ。与用8孔载玻片获得的数目相比较,这是最低3倍收率增加(表4、5)。确切地说,表4展示8孔培养物的结果,而表5展示跨孔培养的结果。此跨孔插入物培养条件提供若干优点,这是由于其:i)减少基质胶在培养基更换期间的损失,ii)准许从单个培养物中重复采集PfSPZ,iii)能够用不同细胞外基质蛋白质(如层粘连蛋白和胶原蛋白)涂布基质,和iv)适合于使用合适的液体处理系统来按比例放大和自动化。
与先前实验相比,此结果表示从卵囊采集的成熟Pf SPZ数目的最低3倍增加。
实例3
展现体外饲养的恶性疟原虫子孢子和在斯氏按蚊(Anopheles stephensi)中发育的恶性疟原虫子孢子以类似效率各自侵入人类肝细胞细胞株(HC-04)并在其中发育。
测试体外饲养的PfSPZ在6天肝细胞分析中的感染性,所述分析常规地用于评定效力。分析通常用冷冻保存前后的Pf SPZ进行。新鲜和冷冻保存的Pf SPZ产生在形态上一致的6天肝脏期寄生虫,但由于冷冻保存而存在5%-25%效力损失[5]。体外饲养的PfSPZ更类似于新鲜蚊子源性PfSPZ,因此相对于来自在制造活动期间产生的新鲜PfSPZ的读数进行比较。在7个连续产生活动中,由50,000只蚊子产生的新鲜Pf SPZ发育出20.7-32.7的表达Pf MSP-1的成熟6天寄生虫(表4)。将体外饲养的PfSPZ接种到3个接种有HC-04细胞(一种对体内产生的Pf SPZ的感染展示支持的人类肝细胞)的孔中[24,25],并且培育6天(图9A上部图,表4)。图9A-9B展示在用体外饲养的Pf SPZ(图9A上部图)或蚊子产生的无菌、经过纯化、冷冻保存Pf SPZ(图9B下部图)感染后,在HC-04细胞中6天肝脏期的共焦显微图。在4个独立6天肝细胞分析中,以56,598±7,294Pf SPZ/孔接种的体外产生的Pf SPZ产生28.6±7.0Pf MSP1表达性6天寄生虫(表4)。这与用新鲜、无菌、经过纯化的Pf SPZ在此分析中所见的25.7±4.1Pf MSP1表达性寄生虫(表4)相当,并且略微超过用冷冻保存Pf SPZ的情况(数据未展示)。这些数据还表明18天体外产生的Pf SPZ比15天体外饲养的Pf SPZ更具感染性。在HC-04细胞中由体外和体内(蚊子)产生的Pf SPZ发育的6天寄生虫的大小类似(图9A-9B)。作为显微照片的阳性对照,在HC-04细胞中培育来自蚊子唾液腺的无菌、经过纯化、冷冻保存Pf SPZ,并且评定其Pf MSP1表达(图9B)。这些数据展现,体外产生的Pf SPZ在肝细胞培养物中的感染性与新鲜蚊子产生的Pf SPZ相同。
ND;未测定。6天肝细胞分析正在进行中。
这些结果展示用于以在蚊子中产生卵囊的39倍效率体外产生Pf卵囊的方法。体外饲养的Pf SPZ以与从宿主蚊子新鲜解剖的Pf SPZ至少同样良好的效率侵入并发育成表达Pf裂体性孢子表面蛋白质1的成熟6天肝脏期裂殖体。
在前文中,已经参考合适的实施例描述本发明,但这些实施例仅用于理解本发明的目的,并且各种改变或修改都是可能的。
参考文献
1.萨克斯(Sachs)J和玛兰尼(Malaney)P.疟疾的经济与社会负荷(The economic and social burden of malaria).自然(Nature)415:680-685,2002。
2.莫雷(Murray)CJ等人1980年与2010年之间的全球疟疾死亡率:系统分析(Global malaria mortality between 1980and 2010:a systematic analysis).柳叶刀(Lancet)379:413-431,2012。
3.世界卫生组织(World Health Organization).全球疟疾项目(Global Malaria Programme).2013年世界疟疾报告:世界卫生组织(World Malaria Report 2013:World Health Organization)2013。
4.英国健康保护署(Health Protection Agency;HPA)新闻稿.2011年4月25日.疟疾病例在两年内上升几乎30%,并且揭露大多数病例没有服用抗疟疾药片。
5.马里(Mali)S,卡楚(Kachur)SP和阿尔金(Arguin)PM.2010年美国疟疾监控(Malaria surveillance--United States,2010).发病率和死亡率周报监控概述(MMWR Surveill Summ)61:1-17,2012。
6.卡伦(Cullen)KA,阿尔金PM和全球卫生中心疾病防治中心(Center for Global Health C.D.C.)寄生虫疾病与疟疾分部(Division of Parasitic DM),2011年美国疟疾监控(Malaria surveillance-United States,2011).发病率和死亡率周报监控概述62增刊5:1-17,2013。
7.比德尔(Beadle)C和霍夫曼(Hoffman)SL.美国海军战时疟疾史:从第一次世界大战到越南战争(History of malaria in the United States Naval Forces at war:World War I through the Vietnam conflict).临床传染病(Clin Infect Dis)16:320-329,1993。
8.阿隆索(Alonso)PL等人疟疾根除研究议程:疫苗(A research agenda for malaria eradication:vaccines).公共科学图书馆医学(PLoS Med)8:e1000398,2011。
9.凯斯特(Kester)KE等人恶性疟疾疫苗RTS,S/AS01B和RTS,S/AS02A在未曾患有疟疾的成人中的随机、双盲、2a期试验:保护的安全性、功效和免疫相关性(Randomized,double-blind,phase 2a trial of falciparum malaria vaccines RTS,S/AS01B and RTS,S/AS02A in malaria-naive adults:safety,efficacy,and immunologic associates of protection).传染病杂志(J Infect Dis)200:337-346,2009。
10.阿格南蒂(Agnandji)ST等人RTS,S/AS01疟疾疫苗在非洲儿童中的3期试验最初结果(First results of phase 3trial of RTS,S/AS01malaria vaccine in African children).新英格兰医学杂志(N Engl J Med)365:1863-1875,2011。
11.阿格南蒂S等人RTS,S/AS01疟疾疫苗在非洲婴儿中的3期试验(A phase 3trial of RTS,S/AS01malaria vaccine in African infants).新英格兰医学杂志367:2284-2295,2012。
12.奥罗图(Olotu)A等人.RTS,S/AS01E四年功效和其与疟疾暴露的相互作用(Four-year efficacy of RTS,S/AS01E and its interaction with malaria exposure).新英格兰医学杂志368:1111-1120,2013。
13.西都尔(Seder)RA等人通过用非复制型子孢子疫苗静脉内免疫接种来预防疟疾(Protection against malaria by intravenous immunization with a nonreplicating sporozoite vaccine).科学341:1359-1365,2013。
14.姆塔匹(Mutapi)F,比林斯利(Billingsley)PF,塞科尔(Secor)WE.成功寄生虫疫苗的感染和治疗免疫接种(Infection and treatment immunizations for successful parasite vaccines).寄生虫学趋势(Trends Parasitol.)2013年3月;29(3):135-41。
15.罗森伯格(Roestenberg)M等人通过皮内注射冷冻保存的恶性疟原虫子孢子来进行的受控人类疟疾感染(Controlled Human Malaria Infections by Intradermal Injection of Cryopreserved Plasmodium falciparum Sporozoites).美国热带医学与卫生学杂志(Am J Trop Med Hyg)88:5-13,2013。
16.希伊(Sheehy)SH等人.使用通过针头和注射器投与的冷冻保存的寄生虫来优化受控人类疟疾感染研究(Optimising Controlled Human Malaria Infection Studies Using Cryopreserved Parasites Administered by Needle and Syringe).公共科学图书馆·综合(PLoS One)8:e65960,2013。
17.霍夫曼SL等人开发代谢活性、非复制型子孢子疫苗以预防恶性疟原虫疟疾(Development of a metabolically active,non-replicating sporozoite vaccine to prevent Plasmodium falciparum malaria).人类疫苗(Hum Vaccin)6:97-106,2010。
18.特拉格(Trager)W和延森(Jensen)JB.连续培养物中的人类疟疾寄生虫(Human malaria parasites in continuous culture).科学193:673-675,1976。
19.瓦尔堡(Warburg)A和米勒(Miller)LH.疟疾寄生虫的体外孢子生殖发育(Sporogonic development of a malaria parasite in vitro).科学255:448-450,1992。
20.瓦尔堡A和施奈德I.恶性疟原虫蚊期的体外培养(In vitro culture of the mosquito stages of Plasmodium falciparum).实验寄生虫学(Exp Parasitol)76:121-126,1993。
21.阿尔-奥拉扬(Al-Olayan)EM,比兹玛(Beetsma)AL,布彻(Butcher)GA,辛登(Sinden)RE和赫德(Hurd)H.疟疾寄生虫蚊期的体外完全发育(Complete development of mosquito phases of the malaria parasite in vitro).科学295:677-679,2002。
22.沃格汉(Vaughan)JA,诺顿(Noden)BH和贝尔(Beier)JC.在实验室饲养的按蚊属蚊子的六个物种中培养的恶性疟原虫的孢子生殖发育(Sporogonic development of cultured Plasmodium falciparum in six species of laboratory-reared Anopheles mosquitoes).美国热带医学与卫生学杂志51:233-243,1994。
23.普拉德尔(Pradel)G.疟疾寄生虫有性生殖期的蛋白质:表达、功能和用于传播阻断策略的潜力(Proteins of the malaria parasite sexual stages:expression,function and potential for transmission blocking strategies).寄生虫学(Parasitology)134:1911-1929,2007。
24.普拉琼斯里(Prachumsri),J.和N.伊玛努阿楚克(Yimamnuaychok),美国专利7,015,036,2006年3月21日。
25.萨塔伯恩克特(Sattabongkot)J,伊玛努阿楚克(Yimamnuaychoke)N,利劳都里皮(Leelaudomlipi)S,拉萨梅索拉(Rasameesoraj)M,简维西苏克(Jenwithisuk)R,科尔曼(Coleman)RE,乌都桑佩奇(Udomsangpetch)R,崔(Cui)L,布鲁尔(Brewer)TG.(2006)建立支持疟疾寄生虫恶性疟原虫和间日疟原虫红细胞外期体外发育的人类肝细胞株(Establishment of a human hepatocyte line that supports in vitro development of the exo-erythrocytic stages of the malaria parasites Plasmodium falciparum and P.vivax).美国热带医学与卫生学杂志74(5):708-15,2006。
26.施奈德I.(1972)来源于黑腹果蝇胚胎晚期的细胞株(Cell lines derived from late embryonic stages of Drosophila melanogaster).胚胎学与实验形态学杂志(J Embryol Exp Morphol.)1972年4月;27(2):353-65。
27.休斯(Hughes),C.S.,博斯妥维(Postovit),L.M.,拉乔伊(Lajoie),G.A.(2010).“基质胶:细胞培养物最佳生长所需的复杂蛋白混合物(Matrigel:a complex protein mixture required for optimal growth of cell culture)”.蛋白质组研究(Proteomics)10(9):1886-90。
28.本顿(Benton),G.,乔治(George),J.,克莱曼(Kleinman),H.K.,阿诺托瓦(Arnaoutova),I.(2009).“经由在衬底基质上进行3D培养的先进科学和技术(Advancing science and technology via 3D culture on basement membrane matrix)”.细胞生理学杂志(Journal of cellular physiology)221(1):18-25。
- 还没有人留言评论。精彩留言会获得点赞!