用于预防或治疗金黄色葡萄球菌感染的组合物的制作方法
本发明涉及用于预防或治疗金黄色葡萄球菌(Staphylococcus aureus)感染性疾病的组合物,更具体地涉及包含与壁磷壁酸连接的肽聚糖(wall teichoic acid-attached peptidoglycan,以下称为WTA-PGN)作为活性成分的组合物,使用所述组合物用于预防或治疗金黄色葡萄球菌感染性疾病的方法,以及用于制备可用作组合物中活性成分的可溶性WTA-PGN的方法。
背景技术:
金黄色葡萄球菌可在人皮肤、软组织和血流中引起严重的感染(Lowy FD,The New England journal of medicine,339:520-532,1998)。另外,金黄色葡萄球菌可变成耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)菌株,其耐甲氧西林(一种β-内酰胺类抗生素),并且这样的MRSA感染难以治疗并且具有不良预后,因此成为大的社会问题。特别地,在未住院的儿童等中已经出现了社区相关MRSA(community-associated MRSA,CA-MRSA),与常规的医院相关MRSA(hospital-associated MRSA,HA-MRSA)一起使得治疗更加困难。最近在美国传播的USA300 MRSA菌株已经在儿童或免疫抑制的人中诱导严重的疾病,因此需要开发具有预防和治疗MRSA感染之作用的新疫苗。
虽然由外国研究人员开发的金黄色葡萄球菌的疫苗候选物在临床试验中显示良好的预后,但它们都未能通过临床试验,因此迄今为止还没有开发出用于金黄色葡萄球菌的临床有效的疫苗。
最近的研究表明,体液和细胞免疫对于作为金黄色葡萄球菌疫苗起作用均是必需的,其中体液免疫通过产生对特定疫苗候选物质特异性的血清抗体加速调理吞噬作用,并且细胞免疫募集中性粒细胞并通过在MRSA感染的早期产生T细胞介导的IL-17A来加速吞噬作用,并且通过T细胞活化来加速吞噬细胞效应子功能可提供针对金黄色葡萄球菌感染的保护。此外,外国研究人员报道,金黄色葡萄球菌感染可以提高小鼠模型中记忆性γδ-T细胞的数量,从而表现出对感染的保护作用(J.Immunol.,192(8):3697-3708,2014)。该结果表明,暴露于金黄色葡萄球菌以类似于αβ T细胞的方式诱导γδ-T细胞的记忆性应答,并且产生IL-17A的记忆性γδ-T细胞的诱导可表现出抵抗金黄色葡萄球菌的强的宿主保护作用。然而,迄今为止尚未知道金黄色葡萄球菌的什么材料表现出这样的保护作用。
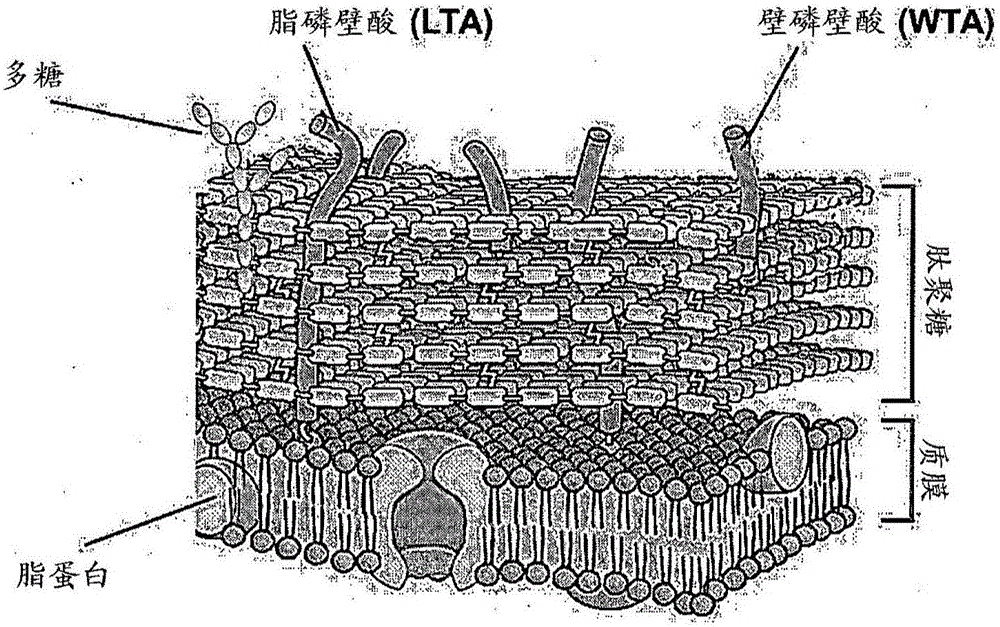
与革兰氏阴性菌不同,革兰氏阳性菌(例如金黄色葡萄球菌)的细胞壁主要由四种组分组成,包括肽聚糖(peptidoglycan,PGN)、壁磷壁酸(wall teichoic acid,WTA)、脂磷壁酸(lipoteichoic acid,LTA)和荚膜多糖(capsular polysaccharide,CP)。
通过宿主的生物防御蛋白迅速识别侵入性病原体,并通过选择性活化固有免疫如补体系统迅速去除病原体是非常重要的反应。然而,由宿主中的体内防御蛋白识别的细菌的配体材料尚未被清楚地鉴定,因此在预防和治疗由病原体引起的感染性疾病中存在困难。
特别地,作为金黄色葡萄球菌细胞壁组分的配体(例如WTA、LTA、PGN、CP和脂蛋白等)主要是具有复杂结构的糖聚合物,并且与其它材料一起被纯化,因此难以作为单一的材料分离/纯化。另外,由于多种类型的细胞壁组分暴露于外部,不容易鉴定哪些组分可作为宿主的体内防御蛋白的配体。
本发明的发明人已从金黄色葡萄球菌的特定突变菌株中分离WTA-PGN,并且已经证实WTA-PGN可用作能够诱导针对金黄色葡萄球菌感染的早期体内免疫应答的宿主的体内防御蛋白的配体,从而有效地用于预防和治疗金黄色葡萄球菌感染性疾病。
技术实现要素:
技术问题
因此,本发明的目的是提供用于预防或治疗金黄色葡萄球菌感染性疾病的组合物。
本发明的另一个目的是提供使用所述组合物用于预防或治疗金黄色葡萄球菌感染性疾病的方法。
本发明的另一个目的是提供用于制备可用作组合物中的活性成分的可溶性WTA-PGN的方法。
问题的解决方案
为了实现上述目的,本发明提供了用于预防或治疗金黄色葡萄球菌感染性疾病的组合物,其包含WTA-PGN作为活性成分。
另外,本发明提供了预防或治疗金黄色葡萄球菌感染性疾病的方法,其包括向有此需要的对象施用上述组合物。
此外,本发明提供了用于制备可溶性WTA-PGN的方法,其包括以下步骤:
(1)获得其中脂蛋白二酰基甘油转移酶(lgt)和O-乙酰转移酶(oatA)基因从野生型金黄色葡萄球菌中缺失的具有双突变的菌株;
(2)破坏所述带有双突变的菌株并从被破坏的菌株中获得不溶性WTA-PGN;
(3)用β-裂解酶处理所述不溶性WTA-PGN;
(4)从步骤(3)中经酶处理的产物中获得包含可溶性WTA-PGN的级分;
(5)用溶菌酶或变溶菌素处理所述包含可溶性WTA-PGN的级分;以及
(6)从步骤(5)中经酶处理的产物获得可溶性WTA-PGN。
附图简述
结合附图,通过下文对本发明的描述,本发明的上述目的和特征将变得显而易见,其中分别示出了:
图1是展示金黄色葡萄球菌的细胞壁结构的示意图。
图2是展示从具有RN4220Δlgt/Δoat突变的菌株中获得可溶性WTA-PGN、可溶性WTA和可溶性PGN的各过程的流程图。
图3示出了用β-裂解酶处理不溶性WTA-PGN后,通过HiTrap-Q柱分离的不溶性WTA-PGN的洗脱模式(A),和洗脱级分的凝胶迁移率(B);以及用溶解酶处理经β-裂解酶处理的WTA-PGN后通过HiTrap-Q柱分离的WTA-PGN的洗脱模式(C)和凝胶迁移率(D)。
图4示出了通过Sephacryl S-200HR柱分离的WTA-PGN的洗脱模式(A)和凝胶迁移率(B);以及在小鼠腹膜内注射WTA-PGN时IL-17A产生量的定量结果(C)。
图5示出了通过第一反相柱分离的WTA-PGN的洗脱模式(5A)和凝胶迁移率(5B);通过第二反相柱分离的WTA-PGN的洗脱模式(5C)和凝胶迁移率(5D);以及在小鼠腹膜内注射WTA-PGN时诱导的IL-17A产生量的定量结果(5E)。
图6示出了在用三氯乙酸(trichloroacetic acid,TCA)处理不溶性WTA-PGN之后,通过HiTrap-Q柱分离的WTA-PGN的洗脱模式(A)和凝胶迁移率(B)。
图7示出了通过Hitrap-Q柱分离的可溶性PGN的洗脱模式。
图8示出了通过Toyopearl HW 55S柱分离的可溶性PGN的洗脱模式。
图9分别示出了WTA-PGN和WTA的27%PAGE和硝酸银染色(A)、硅胶薄层色谱(B)和磷酸盐和GlcNAc的残余量(C)。
图10示出了WTA、PGN和WTA-PGN的3次腹膜内免疫接种的时间表;和MRSA(USA300)感染以用于观察γδ T细胞诱导的初始免疫应答(细胞免疫)和记忆免疫应答。
图11示出了根据多种浓度和时间的通过腹膜内注射PBS、WTA-PGN以及WTA和PGN的混合物诱导的小鼠中IL-17A(11A)和IL-1β(11B)的产生。
图12示出了注射WTA-PGN后随时间的IL-17A、IL-1β和IL-10产生。
图13示出了通过流式细胞术分析法分析注射PBS和WTA-PGN后能够产生IL-17A的γδ T细胞的分布率。
图14示出了注射PBS和WTA-PGN后由CD4+和CD8+ T细胞介导的IL-17A产生。
图15示出了用PBS、WTA-PGN以及WTA和PGN的混合物处理的野生型和Vγ2/4-/-小鼠中的IL-17A产生(15A)和IL-1β产生(15B)。
图16示出了在每只以PBS、WTA、PGN和WTA-PGN预处理的小鼠中,通过USA300菌株感染诱导的IL-17A(16A)、IL-1β(16B)、IL-23(16C)、IFNγ(16D)和IL-10(16E)的产生。
图17示出了用WTA-PGN预处理的小鼠的γδ T细胞中CD44和CD27(记忆性γδ T细胞标记物)的表达(17A);和这些记忆性γδ T细胞中IL-17A的表达水平(17B)。
图18示出了以PBS、WTA-PGN、PGN和WTA预处理的每只小鼠中记忆性γδ T细胞中的IL-17A表达,其为通过FACS测量的细胞内IL-17A产生量(18A)和通过ELISA测量的细胞外IL-17A产生量(18B)。
图19示出了用WTA-PGN预处理后CD4+、CD8+和γδ T细胞中IL-17A的表达。
图20示出了产生记忆性γδ T细胞时γδ TCR的亚群的分化结果。
图21示出了用WTA-PGN预处理的小鼠和未用WTA-PGN预处理的小鼠中的树突状细胞中的IL-23表达。
图22示出了用PBS、WTA、PGN和WTA-PGN预处理后,以USA300菌株感染的小鼠的腹膜内器官形状和脓肿形成的图像。
图23示出了在USA300感染后通过用WTA-PGN免疫接种诱导记忆性γδ T细胞的小鼠的存活。
图24示出了在用WTA-PGN免疫接种后用甲氧西林敏感金黄色葡萄球菌(MSSA)(金黄色葡萄球菌NRS184菌株)感染的小鼠中脓肿的形态(24A)和体积(24B)。
图25示出了在用WTA-PGN免疫接种后用MRSA感染的NZW兔中皮肤脓肿形成是否存在(25A)、皮肤坏死面积(25B)和脓肿体积(25C)。
图26示出了在用WTA-PGN免疫接种后NZW兔(A)和豚鼠(B)中皮肤脓肿形成是否存在、皮肤坏死面积和脓肿体积。
图27示出了MRSA感染后用WTA-PGN免疫接种的豚鼠腹膜中脓肿和溶血的图像。
图28示出了在用WTA-PGN免疫接种的野生型小鼠、具有TLR-9基因缺陷的小鼠和具有胱天蛋白酶-1(Caspase-1)基因缺陷的小鼠中IL-17A(28A)和IL-1β(28B)的产生。
图29示出了在用WTA-PGN预处理后获得的小鼠的巨噬细胞、树突状细胞和γδ T细胞中IL-17A(29A)、IL-1β(29B)、IL-23(29C)和IFNγ(29D)。
图30示出了通过WTA-PGN注射诱导的野生型小鼠和具有NLRP3基因缺陷的小鼠中的基因表达特征(30A至30J)。
图31示出了实验的时间表,其中将分别以WTA、PGN和WTA-PGN免疫接种的每只小鼠用MRSA USA 300感染到其尾静脉,以用于通过抗IgG的产生观察体液免疫应答。
图32分别示出了用WTA和WTA-PGN免疫接种的小鼠中抗IgG产生量。
图33示出了在USA300细胞感染一周后,分别用WTA、PGN和WTA-PGN免疫接种的小鼠的体重变化。
图34示出了分别用WTA、PGN和WTA-PGN免疫接种的小鼠的肾的图像和细菌负荷(CFU)。图34A表示分别用(i)PBS、(ii)WTA和(iii)WTA-PGN免疫接种的小鼠的肾的图像;且图34B表示分别用(i)PBS、(ii)WTA和(iii)WTA-PGN免疫接种的小鼠的肾中存在的MRSA菌株的CFU(在肾中CFU/g)。
图35示出了分别在用WTA、PGN和WTA-PGN免疫接种后通过血流感染MRSA(USA300)的小鼠的肾中的组织病理学图像。
发明详述
在下文中,通过实施例详细说明本发明。以下实施例旨在进一步举例说明本发明而不限制其范围。
在下文中,定义了本发明中使用的术语。
本文中使用的术语“壁胞壁酸(WTA)”作为金黄色葡萄球菌(S.aureus)的细胞壁组分之一,是指由N-乙酰甘露糖胺-(β-1,3)-N-乙酰基葡糖胺以及甘油磷酸酯重复单元和核糖醇磷酸酯重复单元组成的糖聚合物。
本文中使用的术语“肽聚糖”是指通过茎肽之间的键连接的N-乙酰胞壁酸(MurNAc)和N-乙酰葡糖胺(GlcNAc)的重复糖聚合物。
本文中使用的术语“与壁磷壁酸连接的肽聚糖(WTA-PGN)”是指其中壁磷壁酸和肽聚糖共价连接的结构,并且在本发明中,其与“WTA-PGN”可互换使用。
本发明提供含有WTA-PGN作为活性成分的用于预防或治疗金黄色葡萄球菌感染性疾病的组合物。
在本发明的一个示例性实施方案中,WTA-PGN可如以下通式1所示:
[通式1]
其中,在通式1中,n为10至50的整数;m为1至3的整数;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至5的整数;R1至R3各自独立地为羟基、四肽或五肽;且R4为羟基或N-乙酰胞壁酸(MurNAc)。
在本发明的另一个示例性实施方案中,WTA-PGN可如上述通式1所示,其中n为10至50的整数;m为1至3的整数;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至5的整数;R1至R3各自独立地为羟基、四肽或五肽;R4为羟基或N-乙酰胞壁酸(MurNAc);且A和B通过β位彼此连接。
还在本发明的另一个示例性实施方案中,WTA-PGN可如上述通式1所示,其中n为35至45的整数;m为3;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至3的整数;R1至R3各自独立地为羟基、四肽或五肽;且R4为羟基或N-乙酰胞壁酸(MurNAc)。
还在本发明的另一个示例性实施方案中,WTA-PGN可如上述通式1所示,其中n为40;m为3;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至5的整数;R1和R2各自独立地为四肽;R3为羟基、四肽或五肽;且R4为羟基或N-乙酰胞壁酸(MurNAc)。
还在本发明的另一个示例性实施方案中,WTA-PGN可如上述通式1所示,其中n为40;m为3;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至5的整数;R1和R2各自独立地为四肽;R3为羟基、四肽或五肽,其中四肽是-A1-A2-A3-A4,其中A1是Ala或Gly,A2是Glu或Asp,A3是Lys、Arg或His,且A4是Ala或Gly;且R4为羟基或N-乙酰胞壁酸(MurNAc)。
还在本发明的另一个示例性实施方案中,WTA-PGN可如上述通式1所示,其中n为40;m为3;A为N-乙酰甘露糖胺(ManNAc);B为N-乙酰葡糖胺(GlcNAc);O和P各自独立地为0至5的整数;R1和R2各自独立地为四肽;R3为羟基、四肽或五肽,其中四肽是-(L-Ala)-(D-Glu)-(L-Lys)-(D-Ala);且R4为羟基或N-乙酰胞壁酸(MurNAc)。
在本发明的另一个示例性实施方案中,WTA-PGN的R1至R3中的任一个可以与另一个WTA-PGN的R1至R3中的任何一个形成交联,因此,WTA-PGN可以以两个WTA-PGN连接在一起的二聚体的形式存在。
根据本发明的组合物可用于预防或治疗金黄色葡萄球菌感染性疾病,且诱导金黄色葡萄球菌感染性疾病的金黄色葡萄球菌可以是耐甲氧西林金黄色葡萄球菌(MRSA)、甲氧西林敏感金黄色葡萄球菌(MSSA)或致病性金黄色葡萄球菌。
金黄色葡萄球菌感染性疾病的实例可包括软组织感染、化脓性关节炎、化脓性骨髓炎、中耳炎、肺炎、脓毒症、急性呼吸道感染、导管相关感染、术后感染、菌血症、心内膜炎和食物中毒,但不限于此。
除了WTA-PGN之外,根据本发明的组合物还可包含可药用载体、稀释剂和/或辅料。
根据本发明的组合物还可含有可药用载体、稀释剂和/或辅料。
根据本发明的组合物中使用的载体可以基于施用方法和途径以及标准药物组合物来确定。例如,载体可以是载体蛋白(即牛血清白蛋白(bovine serum albumin,BSA)、卵白蛋白(ovalbumin,OVA)、人血清白蛋白(human serum albumin,HSA)和钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)、增溶剂(即乙醇、聚山梨酯和Cremophor ELTM)、等张剂、防腐剂、抗氧化剂、赋形剂(即乳糖、淀粉、结晶纤维素、甘露糖醇、麦芽糖、磷酸氢钙、轻质无水硅酸和碳酸钙)、黏合剂(即淀粉、聚乙烯吡咯烷酮、羟丙基纤维素、乙基纤维素、羧甲基纤维素和阿拉伯胶)、润滑剂(即硬脂酸镁、滑石、硬化油等),以及增溶剂(即乳糖、甘露糖醇、麦芽糖、聚山梨酯、macrosol、聚氧乙烯和硬化蓖麻油)。如果必需,可以含有甘油、二甲基乙酰胺、70%乳酸钠、表面活性剂或碱性物质(即氢氧化钠、乙二胺、乙醇胺、碳酸氢钠、精氨酸、MeglumineTM和三氨基甲烷)。具体而言,为了增强抗原性,可以将根据本发明的疫苗组合物与作为载体蛋白的已知KLH溶液(Calbiotec,125mg/mL 50%甘油溶液)组合。
用于根据本发明的组合物中的稀释剂基于施用方法和途径以及实际的标准药物组合物来选择。稀释剂的实例可包括水、盐水、磷酸缓冲盐水和碳酸氢盐溶液。
用于根据本发明的组合物中的辅料基于施用方法和途径以及实际的标准药物组合物来选择。辅料的实例可包括霍乱毒素、大肠杆菌(E.coli)的热不稳定内毒素(LT)、脂质体和免疫刺激复合物(immune stimulating complexe,ISCOM)。
施用途径可以根据具有金黄色葡萄球菌感染风险的待施用对象的年龄、体重、性别和一般健康状况而变化。然而,可以通过经口施用和肠胃外施用(例如静脉内施用、动脉施用和表面施用)中的任一种进行施用,并且优选肠胃外施用。
用于经口和肠胃外施用的制剂类型及其制备方法是本领域普通技术人员已知的。用于经口和肠胃外施用的制剂类型可以通过常规方法制备,例如通过与上述可药用载体混合。用于经口施用的制剂类型的实例可以包括固体或液体制剂,例如溶剂、片剂、颗粒剂、粉末药物或胶囊。用于肠胃外施用的制剂类型的实例可以包括溶剂、混悬剂、软膏剂、乳膏剂、栓剂、滴眼剂、滴鼻剂和滴耳剂。为了使本发明的制剂持续释放,可将可生物降解的聚合物(例如聚-D,L-丙交酯-共-乙交酯或聚乙交酯)添加到本体基质中(参考文献见美国专利5,417,986、4,675,381和4,450,150)。对于经口施用,可添加矫味剂和着色剂。用于它们的合适的药物载体、稀释剂和药学上必需的材料描述于Remington’s Pharmaceutical Sciences中。
根据本发明的组合物的施用剂量可以基于辅料的种类、施用方法和频率以及期望的效果来确定,并且一般对于成人每次施用的剂量可以是1μg至100mg WTA的量。当将辅料添加至本发明的组合物中时,对于成人每次施用的剂量一般可以是1μg至1mg WTA的量。如果必需,可以进行多次施用。例如,在以规则的间隔初次施用组合物后,为了补充目的,组合物可以再施用三次。选择性地,可以分别从第8周至第12周和从第16周至第20周使用相同制剂施用第一次和第二次补充的组合物。
另外,本发明提供了用于在对象中预防或治疗金黄色葡萄球菌感染性疾病的方法,其包括向有此需要的对象施用上述组合物。
如上所述,可以通过施用根据本发明的组合物来预防或治疗金黄色葡萄球菌感染性疾病,从而在对象中同时诱导调理吞噬作用和吞噬作用。
本发明的方法可以在施用组合物后24小时内提高对象中的γδ-T细胞的数量、IL-17A产生量和IL-1β产生量。另外,本发明的方法可以在施用组合物后12小时提高对象中的IL-10产生量。
此外,本发明提供了用于制备可溶性与壁磷壁酸连接的肽聚糖(WTA-PGN)的方法,其包括:
(1)获得其中脂蛋白二酰基甘油转移酶(lgt)和O-乙酰转移酶(oatA)基因从野生型金黄色葡萄球菌中缺失的双突变菌株;
(2)破坏带有双突变的所述菌株并从被破坏的菌株中获得不溶性WTA-PGN;
(3)用β-裂解酶处理所述不溶性WTA-PGN;
(4)从步骤(3)中经酶处理的产物中获得包含可溶性WTA-PGN的级分;
(5)用溶菌酶或变溶菌素处理所述包含可溶性WTA-PGN的级分;以及
(6)从步骤(5)中经酶处理的产物获得可溶性WTA-PGN。
在下文中,将详细描述用于制备根据本发明的可溶性WTA-PGN的方法。
在本发明的方法中,在步骤(1)中,获得具有双突变的菌株,其中脂蛋白二酰基甘油转移酶(lipoprotein diacylglycerol transferase,lgt)和O-乙酰转移酶(O-acetyl transferase,oatA)基因从野生型金黄色葡萄球菌中缺失。
步骤(1)中获得的双突变菌株ΔlgtΔoatA(其中脂蛋白二酰基甘油转移酶(lgt)和O-乙酰转移酶(oatA)基因缺失)由于缺失lgt基因而几乎不具有脂蛋白污染的可能性,因此可以容易地从其获得较纯的WTA-PGN。另外,步骤(1)中使用的双突变菌株由于oatA基因的缺失而在PGN的MurNAc残基中没有乙酰基,因此上述生产的WTA-PGN在步骤(2)中可以容易地被溶葡萄球菌素或β-裂解酶分解。
双突变菌株可通过传统上已知的野生型金黄色葡萄球菌(例如耐甲氧西林金黄色葡萄球菌(MRSA)、甲氧西林敏感金黄色葡萄球菌(MSSA)或致病性金黄色葡萄球菌)的常规诱变获得。例如,可使用噬菌体80作为介质,通过转化具有脂蛋白二酰基甘油转移酶(lgt)基因的缺失的T363菌株(Nakayama M等,Journal of Immunology 189:5903-591,2012),和具有红霉素抗性并具有O-乙酰转移酶(oatA)基因缺失的T0003菌株(Park KH等,Journal of Biological Chemistry 285,27167-27175,2010),来制备双突变菌株。
在本发明的方法中,在步骤(2)中,破坏双突变菌株,从被破坏的产物获得不溶性WTA-PGN。
步骤(2)可以参照参考文献中描述的方法进行[Park KH等,Journal of Biological Chemistry 285,27167-27175,2010;Jung DJ等,Journal of Immunology 2012,189:4951-4959,2012]。
例如,步骤(2)可以包括培养步骤(1)中获得的双突变菌株,破坏细胞,并从所得物中获得不溶性WTA-PGN。
在本发明的方法中,在步骤(3)中,用β-裂解酶处理不溶性WTA-PGN。
β-裂解酶发挥分解五甘氨酸((Gly)5)桥(其连接存在于步骤(2)中获得的不溶性WTA-PGN的MurNAc残基中的茎肽)的作用,从而将不溶性WTA-PGN转化成可溶性WTA-PGN。
β-裂解酶是市售的,或者可以根据参考文献中描述的方法分离和纯化[Li等,Journal of Biochemistry 122,772-778,1997]。β-裂解酶的实例可包括溶葡萄球菌素,但不限于此。
步骤(3)可以通过将步骤(2)中获得的不溶性WTA-PGN混悬在缓冲溶液中,添加β-裂解酶并使其在30至40℃的温度下在搅拌下反应10小时至14小时来进行。
在本发明的方法中,在步骤(4)中,从步骤(3)的经酶处理的产物获得含有可溶性WTA-PGN的级分。
在上述步骤中,将经β-裂解酶处理的产物通过高效液相色谱(high performance liquid chromatography,HPLC)以提供级分,并从级分中选择含有可溶性WTA-PGN的级分。
含有可溶性WTA-PGN的级分可通过使步骤(3)的经酶处理的产物通过HPLC来获得。在通过HPLC获得的级分中,含有可溶性WTA-PGN的级分可通过PAGE或硝酸银染色来确认。
用于HPLC纯化的柱的实例可包括HiTrap-Q(GE Healthcare),其是与WTA的核糖醇磷酸酯的阴离子结合的阴离子交换树脂,但不限于此。
在本发明的方法中,在步骤(5)中,用溶菌酶或变溶菌素处理含有可溶性WTA-PGN的级分。
上文使用的溶菌酶或变溶菌素可分解WTA-PGN中PGN的MurNAc和GlcNAc之间的结合,从而将多聚PGN转化为寡聚PGN。
步骤(5)可以通过将步骤(3)中获得的可溶性WTA-PGN混悬在缓冲溶液中,添加溶菌酶或变溶菌素并在30℃至40℃下搅拌10小时至14小时来进行。
在本发明的方法中,在步骤(6)中,从步骤(5)的经酶处理的产物获得可溶性WTA-PGN。
可溶性WTA-PGN可以通过使步骤(5)的经酶处理的产物通过HPLC来获得。
在上述步骤中,将经溶菌酶或变溶菌素酶处理的产物通过HPLC以提供级分,并且从上述级分中选择含有可溶性WTA-PGN的级分。可以基于将每个级分腹膜内注射到小鼠中后产生的IL-17A量来进行上述级分的选择。
在HPLC纯化中使用的柱的实例可包括HiTrap-Q(GE Healthcare),但不限于此。
用于制备根据本发明的可溶性WTA-PGN的方法还可包括步骤(6)之后对WTA-PGN的额外纯化。
WTA-PGN的额外纯化可以通过凝胶过滤色谱法或反相液相色谱进行。
在本发明的一个示例性实施方案中,步骤(6)中制备的可溶性WTA-PGN可通过使用Sephacryl S-200HR柱的凝胶过滤色谱或使用Symmetry ShieldTM RP18柱的反相液相色谱进一步纯化。
在本发明的另一个示例性实施方案中,步骤(6)中制备的可溶性WTA-PGN可以通过使用Sephacryl S-200 HR柱的凝胶过滤色谱和使用Symmetry ShieldTM RP18柱的两次反相液相色谱进一步纯化。
通过色谱的级分可以基于腹膜内注射到小鼠中后产生的IL-17A量来选择。
在下面提供的实施例中进一步描述和举例说明本发明,然而,这些实施例并不意在限制本发明的范围。
实施例1:制备用于获得WTA衍生物的菌株
对于WTA-PGN的分离,根据参考文献[Kazue Takahashi等,Plos One 8:e69739,2013]中描述的方法制备金黄色葡萄球菌T384菌株(RN4220ΔlgtΔoatA双突变体)。
简言之,使用噬菌体80作为介质,通过转化具有脂蛋白二酰基甘油转移酶(lgt)缺失的T363菌株(Nakayama M等,Journal of Immunology 189:5903-591,2012)和具有红霉素抗性并具有O-乙酰转移酶(oatA)基因缺失的T0003菌株(Park KH等,Journal of Biological Chemistry 285,27167-27175,2010)来制备金黄色葡萄球菌T384菌株。由于lgt基因的缺失,该菌株可用于分离WTA、WTA-PGN和PGN而没有脂蛋白污染,并且由于缺失oatA基因,在PGN MurNac残基6的位置的氧处不存在乙酰基,因而分离的PGN可以容易地被溶菌酶分解。
实施例2:可溶性WTA-PGN的分离和纯化
从实施例1中制备的Δlgt/ΔoatA突变株中获得不溶性WTA-PGN,从不溶性WTA-PGN中分离可溶性WTA并纯化(见图2)。
<2-1>不溶性WTA-PGN衍生物的分离和纯化
通过改变参考文献中描述的方法分离和纯化不溶性WTA-PGN[Park KH等,Journal of Biological Chemistry 285,27167-27175,2010;Jung DJ等,Journal of Immunology 2012,189:4951-4959,2012]。
具体而言,使用培养箱培养实施例1的ΔlgtΔoatA突变株,回收得到的细菌细胞。将回收的细菌细胞(10mL)混悬于20mM柠檬酸缓冲液(pH 4.5;30mL)中,将其中的50μL稀释400倍,使用分光光度计将其调整至OD600nm为0.8。然后,为了除去20mM柠檬酸盐缓冲液(pH4.7),使用高速离心机在4℃下以10,000rpm的速率离心所得物5分钟。随后,将细菌沉淀混悬于添加有1M NaCl(pH 4.5;30mL)的20mM柠檬酸盐缓冲液中,并将混悬液等分至含有玻璃珠(12g)的6个不锈钢破坏瓶中。用添加有1M NaCl(pH 4.7;20mL)的20mM柠檬酸盐缓冲液洗涤破坏瓶,使得每个瓶的总体积为20mL。为了防止过热,将破坏瓶保存在冰上,将破坏细菌2分钟并在冰上保存2分钟的过程重复7次。将被破坏的细菌转移到新鲜的50mL管中,并使用高速离心机在4℃下以3,000rpm离心15分钟。然后,将上清液转移到50mL锥形管中,并使用高速离心机在4℃下以15,000rpm的速率离心10分钟。将沉淀混悬在20mM柠檬酸盐缓冲液(pH 4.7;10mL)中,添加到含有1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的20mM柠檬酸盐缓冲液(pH 4.7;10mL)中,并调节至最终的SDS浓度为0.5%。将所得物在保持60℃的恒温水浴中热处理30分钟,并在4℃下以15,000rpm的速率离心5分钟,除去所得的上清液。在以作为阴离子表面活性剂的SDS处理后,观察到沉淀颜色变白的现象。为了除去SDS,将其混悬在20mM柠檬酸盐缓冲液(pH 4.7;20mL)中,并使用高速离心机在20℃下以15,000rpm的速率离心5分钟以除去上清液。用含有1M NaCl的20mM柠檬酸盐缓冲液(pH 4.7;30mL)洗涤沉淀。为了完全除去剩余的SDS,将沉淀混悬在注射用水中,将其加热至30℃,并在20℃下以15,000rpm的速率离心5分钟。重复洗涤直到当向沉淀中添加注射用水并摇动时不产生气泡。将无气泡状态的沉淀混悬于注射用水(10mL)中,并在室温下保存10分钟。将上清液转移到新鲜的50mL管中,同时防止沉降的玻璃珠的转移,并且在20℃下以15,000rpm的速率离心5分钟以制备沉淀。对于冻干,将沉淀用注射用水(15mL)混悬,在-80℃冷冻,并冻干,以得到不溶性WTA-PGN。
<2-2>β-裂解酶的制备
对于用于由不溶性WTA-PGN制备可溶性WTA-PGN的β-裂解酶的制备,参照参考文献中的方法[Li等,Journal of Biochemistry 122,772-778,1997]。
首先,将粗制无色肽酶(5g)溶解于10mM柠檬酸钠缓冲液(pH 6.0;500mL)中,并在4℃下以15,000rpm的速率离心15分钟。用10mM柠檬酸钠缓冲液(pH 6.0)平衡上清液后,通过将上清液加载到CM-Sepharose Fast Flow柱(3cm(长)×18cm(宽))中洗脱,随后进行线性梯度至0.5M NaCl的浓度。在280nm处测量洗脱溶液的吸光度,收集并浓缩显示出裂解活性的级分。使用含有200mM NaCl的10mM柠檬酸钠缓冲液(pH 6.0),在Sephacryl S-100柱(1.6cm(长)×87cm(宽))中对浓缩的样品进行尺寸排阻色谱。在280nm处测量滤液的吸光度,并收集显示高裂解活性的级分并浓缩。在这些级分中,基于Li等的结果选择β-裂解酶的级分(1997)。然后,通过在Superdex-75柱(1cm×30cm)中使用含有200mM NaCl的10mM柠檬酸钠缓冲液(pH 6.0)进行尺寸排阻色谱,获得β-裂解酶。
通过培养藤黄微球菌(Micrococcus luteus)(ATCC 9341)或PGN混悬液和来自于不溶性金黄色葡萄球菌的柱级分来确认由此获得的β-裂解酶的裂解活性或溶解活性。根据通过蛋白质测序仪(目录号491-0,Applied Biosystems,Stafford,TX,USA)对N末端序列进行分析的结果,其N末端序列被确认为S-P-N-G-L-L-Q-F-P-F,并且根据电泳的结果,观察到分子量为约25kDa的单一条带,由此证实由此获得的β-裂解酶是β-裂解酶。
<2-3>可溶性WTA-PGN的纯化
①β-裂解酶处理和HPLC
将在实施例<2-1>中冻干的不溶性WTA-PGN以(100mg/10mL)的比例混悬在20mM Tris-HCl(pH 7.0)中并通过离心除去上清液的过程重复3次,并确认上清液的pH为7.0。然后,以350μg的β-裂解酶/100mg WTA-PGN的比例向不溶性WTA-PGN中添加通过Bradford法定量的β-裂解酶,并使其在37℃的培养箱中在180rpm的速度搅拌下反应12小时。然后,将反应物置于具有60℃恒温的水浴中10分钟以使酶失活,并且在4℃下以15,000rpm的速率离心10分钟以获得上清液。将上清液通过0.45μm过滤器,将滤液加载到用20mM Tris-HCl(pH 7.0)平衡的Hitrap Q柱中,并通过线性梯度洗脱至含有1M NaCl的20mM Tris-HCl(pH7.0)中。作为洗脱的结果,如图3A所示,获得共3个峰。每个峰命名为A、B和C,并进行27%PAGE(图3B)。其中,将在电泳中以硝酸银染色的1号级分用丙酮沉淀并冻干以得到可溶性WTA-PGN。
②溶菌酶处理和HPLC
将冻干的可溶性WTA-PGN(100mg)溶于20mM Tris-HCl(pH 7.0;10mL),添加溶菌酶(目录号62970,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA;1.25mg),并在37℃的培养箱中反应12小时,同时以180rpm的速度搅拌。然后,将反应物置于具有60℃恒温的水浴中10分钟以使酶失活,并且在4℃下以15,000rpm的速率离心10分钟以获得上清液。将上清液通过0.45μm过滤器,将滤液加载到用20mM Tris-HCl(pH 7.0)平衡的Hitrap Q柱中,并用含有1M NaCl的20mM Tris-HCl(pH 7.0)通过线性梯度洗脱。作为洗脱的结果,如图3C所示,获得共4个峰。用丙酮沉淀这些峰,然后进行电泳(图3D)。其中,收集在电泳中用硝酸银染色的3号和4号级分并冻干以得到可溶性WTA-PGN。
③使用Sephacryl S-200HR柱纯化WTA-PGN
将分离的WTA-PGN通过Sephacryl S-200HR柱进一步纯化。在该步骤中,使用了HPLC装置(805MANOMETRIC MODULE,811C DYNAMIC MIXER,305PUMP,306PUMP,151UV/VIS Detector,Gilson,USA)和Sephacryl S-200HR,25μm至75μm柱(目录号17-0584-01,GE Healthcare Life Sciences,England)。
将先前分离的可溶性WTA-PGN(53.5mg)溶于蒸馏水(400μL)中,并添加到HPLC进样器中。在样品洗脱之前,将Sephacryl S-200HR柱连接到HPLC进样器,用蒸馏水洗涤并静置,并且为了防止由于实验期间杂质的流入而导致的错误,以0.3mL/分钟的流量、灵敏度2、峰宽度10.0秒和在220nm的UV吸光度下向其中流入溶剂,直到UV检测器变得稳定。当UV值稳定时,通过将进样器转化为加载模式缓慢进样,并且在洗脱开始时,将进样器转化为进样模式,从而流入柱中并获得洗脱液。该过程在与平衡相同的条件下进行。
作为洗脱的结果,如图4A所示,鉴定了共4个峰(A,B,C和D)。作为这些峰的PAGE分析的结果,如图4B所示,证实可溶性WTA-PGN存在于峰B、C和D中。
将每一个由此获得的4个峰的冻干并注射到小鼠的腹膜中。比较因此产生的IL-17A量,并且显示峰B具有最高活性(图4C),因此在随后的实验中使用B峰。
④使用C18反相柱纯化WTA-PGN
将分离的WTA-PGN通过C18反相柱进一步纯化。使用了HPLC装置(805 MANOMETRIC MODULE,811C DYNAMIC MIXER,305 PUMP,306 PUMP,151 UV/VIS Detector,Gilson,USA),Symmetry ShieldTM RP18(5μm,4.6mm×250mm)柱(目录号186000112,Waters,Ireland)和MFTM膜过滤器0.45μm(目录号HAWP04700,Merck,Germany)。另外,使用了Speed Vac(目录号CVE-100,EYELA,Japan),蒸发器(目录号CCA-1110,EYELA,Japan)和冷冻干燥器(目录号FDU-2200,EYELA,Japan)。
对于使用C18反相柱纯化WTA-PGN,将通过Sephacryl S-200柱分离的量为3mg的级分B(见图4)溶解在固定相溶剂(200μL)中,并用作样品。流量为1mL/分钟,并在202nm处测量UV吸光度。在灵敏度为1和柱温为40℃的条件下加载样品。通过将流动相的浓度梯度设定为0%经10分钟,41.7%经25分钟,100%经2分钟,和100%经10分钟来进行洗脱。作为洗脱的结果,如图5A所示,鉴定了6个峰(A至F)。将这些峰进行PAGE分析,结果示于图5B。用1M Tris-HCl将每个洗脱的峰的pH调节至约pH 6.5至7.5的中性pH,使用蒸发器浓缩至300μL,并添加冷的丙酮(900μL)并在冰上沉淀一小时。然后,将所得物在4℃下以15,000rpm离心25分钟以回收沉淀,并将剩余的丙酮通过speed vac干燥,溶解在蒸馏水(20μL)中,然后冻干。
通过将每个级分(2mg)再次加载到C18柱中来重新分离,从而获得进一步纯化的A、B、C、D和E级分(图5C)。将这些峰进行PAGE分析,结果示于图5D。另外,将A、B、C、D和E级分各自以20μg的量注射到小鼠的腹膜中。通过ELISA定量注射后6小时诱导的IL-17A量,结果示于图5E。如图5E所示,级分C显示具有最高量的IL-17A,因此将组分C用于后续实验。
实施例3:可溶性WTA的纯化
对于WTA的纯化,将不溶性WTA-PGN(80mg)混悬于20mM柠檬酸盐缓冲液(pH 4.5;19mL)中,并添加三氯乙酸(100mg/mL;1mL)至终浓度为5mg/mL。将混悬液在30℃的培养箱中反应12小时,同时以180rpm搅拌,然后在4℃下以10,000rpm离心10分钟。将上清液转移到50mL管中,用丙酮沉淀1小时,并在4℃下以15,000rpm离心25分钟。将所得沉淀转移至1.5mL微量离心管中以除去丙酮并混悬于20mM Tris-HCl缓冲液(pH 7.0;1mL)中。
然后,使用Hitrap-Q柱对所得物进行HPLC。将所有管线和柱用A缓冲液(其为20mM Tris-HCl(pH 7.0))洗涤,并将检测器设置为在1的灵敏度下检测并测量220nm处的吸光度,并平衡。用0.45μm过滤器过滤待加载样品并加载。将流量设定为0.5mL/分钟,使得样品可以与Hitrap-Q柱结合,并且洗涤Hitrap-Q柱以除去杂质,同时保持原始流量直到达到平衡。通过设定由20mM Tris-HCl和1M NaCl(pH7.0)组成的缓冲液B从0%变为100%所需的时间为50分钟,以施加梯度,并且当洗脱连接至Hitrap-Q柱上的WTA后,则从每个峰中回收样品。作为洗脱的结果,如图6(A)所示,得到两个峰(峰1和2)。将洗脱液等分到50mL锥形管中,使得在每个管中含有小于10mL,并用冷丙酮沉淀1小时。在丙酮沉淀中,峰1显示15mg的产率,且峰2显示0.88mg的产率。将洗脱液在15,000rpm离心25分钟以回收沉淀,通过蒸发除去所有丙酮,将沉淀溶解在注射用水中并冻干。将冻干产物制备成原液(10mg/mL),并以每种20μg的量通过27%PAGE分离,并用硝酸银染色。结果,预测峰1具有比峰2更高数量的核糖醇,并且还具有更高的量(图6(B)),因此将峰1用作可溶性WTA。
实施例4:可溶性PGN的纯化
<4-1>用于除去WTA的TCA处理
为了从冻干的不溶性WTA-PGN获得PGN,用三氯乙酸(TCA)除去WTA。添加用TCA处理以用于获得WTA的不溶性WTA-PGN,并重悬于20mM柠檬酸盐缓冲液(pH 4.5;19mL)中,并向其中添加TCA(100mg/mL;1mL)至终浓度为5mg/mL。所得物在30℃的培养箱中在180rpm搅拌下反应12小时,并在4℃下以10,000rpm离心10分钟。将所得沉淀混悬于无菌蒸馏水(30mL)中,并在4℃下以10,000rpm离心10分钟,5次,并通过重复整个过程洗涤以完全除去TCA。将所得物混悬在注射用水(15mL)中并冻干以得到不溶性PGN。
<4-2>用于将不溶性PGN纯化成可溶性PGN的β-裂解酶处理
将冻干的不溶性PGN(100mg)混悬在20mM Tris-HCl(pH 7.0;10mL)中至10mg/mL的浓度,并在4℃下以15,000rpm离心10分钟,并将所得沉淀用20mM Tris-HCl(pH 7.0;30mL)洗涤3次。将经洗涤的不溶性PGN混悬于20mM Tris-HCl(pH 7.0,20mL)中,并向每100mg不溶性PGN中添加350μg纯化的β-裂解酶,调节至pH 7.0,并在37℃培养箱中在180rpm搅拌下反应12小时。然后,为了失活,将所得物在100℃下热处理10分钟,在室温下冷却至少10分钟,并在4℃下以15,000rpm离心10分钟。所得上清液用0.45μm过滤器过滤并冻干。
<4-3>通过凝胶过滤色谱法纯化可溶性PGN
将冻干的可溶性PGN以20mg/mL的浓度溶解于注射用水中,加载到作为离子交换柱的HiTrap Q中,以除去痕量包含于其中的WTA和WTA-PGN。对于HPLC条件,用注射用水调节平衡(其为缓冲液A),添加20mg/mL,流量为1mL/分钟,吸光度为220nm,灵敏度为1,并用含有1M NaCl(其为缓冲液B)的注射水从0%至100%设定梯度30分钟。
洗脱结果示于图1。如图7所示,假定通过的溶液(级分A)是其中除去了WTA的含有可溶性PGN的级分,并且假定由含有1M NaCl的缓冲液B洗脱的级分(级分B)为其中WTA未被去除的WTA-PGN或WTA。因此,仅收集级分A并冻干。
然后,为了纯化具有预定长度的聚糖的可溶性PGN,将冻干产物以20mg/mL的浓度溶解于注射用水中,并加载到Toyopearl HW 55S(目录号14686,TOSOH Bioscience,Japan)柱上进行凝胶过滤。对于凝胶过滤条件,用注射用水调节平衡,以0.5mL/分钟的流量,215nm的吸光度,1的灵敏度进行平衡并操作50分钟。通过凝胶过滤的洗脱模式示于图8中。如图8所示,在凝胶过滤中确认了两个峰。在各峰之中,为了证实峰B是可溶的PGN,使用昆虫黄粉虫(Tenebrio molitor)的原酚氧化酶系统。将峰连续稀释至106倍。将β-1,3用作阳性对照,并且当以阴性对照的OD值作为基线进行比较时,证实在峰A和B两者中都显示出活性(图8)。因为低分子量材料由于Toyopearl HW 55S柱的特性而较晚出现,可以确认峰B是具有比峰A更低分子量(即具有少量糖)的可溶性PGN。分离峰B并冻干且用于随后的实验。
实施例4:WTA-PGN和WTA的生化特征的验证
为了验证分离/纯化的WTA-PGN和WTA的生物化学特征,进行27%PAGE和硝酸银染色。通过硅胶薄层色谱分析D-Ala的存在,并通过已知的分析方法定量WTA中存在的磷酸盐和GlcNAc残基的量。
具体而言,为了确认D-Ala的存在,将2μL量的用于鉴定的样品(10mg/mL)和1M NaOH(0.2μL)添加微量离心管中,并在37℃的培养箱中在180rpm搅拌下培养2小时。将薄层色谱膜切成5cm(长)×10cm(宽)的尺寸,将样品(2μL)从顶部加载约2cm,不直接接触TLC溶液,并使其显影1小时30分钟。然后,将薄层色谱膜完全干燥,用茚三酮喷雾试剂(1mL)喷雾,并在加热模块中热处理,直到出现紫红色斑点。
另外,为了定量磷酸盐,将样品(2μL至4μL)、蒸馏水(100μL)和消化试剂(175μL)添加到玻璃管中并涡旋。从外部加热管并确认样品颜色变为浓黄色后,再次加热管直至颜色变浅。将所得物在室温下冷却10分钟,添加蒸馏水(125μL)和1%钼酸铵(1mL),并搅拌。然后,向其中添加还原剂(50μL),在恒温水浴中加热10分钟,并使用分光光度计在750nm处测量OD值。作为标准材料,使用磷酸盐。
另外,对于GlcNAc的定量,添加通过微量离心分离的样品、蒸馏水和6.45N HCl至终体积为100μL,涡旋,并转移到小玻璃管(0.5cm(直径)×5cm(高))中,并且使用真空泵装置除去样品中包含的所有气泡。将所得物在100℃的烘箱中热处理3小时,并在室温下冷却。然后,使用巴斯德移液管将所得物转移到大玻璃管(直径1.8cm×高度18cm)中,并通过将其置于真空下,在制备真空状态的同时加热,从而干燥样品。随后,向每个试管中添加量为50μL的溶液(乙醇:蒸馏水:三甲胺=2∶2∶1)并干燥两次。如此,除去样品中含有的全部HCl,添加蒸馏水(100μL)、无水乙酸(20μL)和硼酸缓冲液(100μL)并混合,并在95℃的恒温水浴中煮沸8分钟,并在室温下冷却。添加对二甲基氨基苯甲醛试剂(750μL)和2-乙氧基乙醇(50μL),在20℃的恒温水浴中培养15分钟,使用分光光度计测定585nm的OD值。作为标准物质,使用N-乙酰葡糖胺。
结果,如图9A所示,纯化的WTA的凝胶迁移率显示为比纯化的WTA-PGN更快,这证实通过去除PGN,WTA具有比WTA-PGN更小的分子量。另外,如图9B所示,D-Ala残基显示与WTA-PGN和WTA两者均结合。另外,如图9C所示,在WTA-PGN中的磷酸盐含量显示为1.5nmol/μg,在WTA中为1.8nmol/μg,并且在WTA-PGN中显示GlcNAc含量为2.5nmol/μg,在WTA中显示为2.2nmol/μg。
实施例5:用于分析WTA-PGN效果的实验方法
<5-1>小鼠实验设计和育种
作为实验动物,从韩国生物科学和生物技术研究所(Korea Research Institute of Bioscience and Biotechnology,KRIBB)的生物医学小鼠资源中心获得5周龄无特定病原体(specific pathogen-free,SPF)的C57BL/6J雌性小鼠(体重15±0.5g)(Ohchang Campus,Chungcheongbuk-do,Korea,rea基因缺陷)。在实验之前,将实验动物适应于动物实验实验室环境(具有恒温恒湿的动物笼,目录号AAAC2051,JEIO TECH Co.,Ltd.,rea基因缺陷;在20℃至25℃,55%湿度)一周,同时向它们饲喂市售固体饲料(目录号5L79,Orient Bio Inc.,rea基因缺陷)。通过根据体重的完全随机设计将小鼠分成每组(6至12只小鼠/组),并将它们放入饲养笼(6只小鼠/组)中并自由采食地饲喂饮食和饮用水。每天测量一次实验动物的体重和饮食摄入量,以12小时间隔打开和关闭照明。
<5-2>制备用于研究体内感染的MRSA(金黄色葡萄球菌USA300菌株)和MSSA(金黄色葡萄球菌NRS184菌株)
MRSA(金黄色葡萄球菌USA300菌株)和MSSA(金黄色葡萄球菌NRS184菌株)由德国蒂宾根大学提供。将储存在-80℃下的甘油原液中的菌株平板接种在LB Broth LENNOX(目录号LBL405.1,Bioshop,Canada)上,并在37℃的培养箱中培养至少12小时。然后,将培养的平板保存在4℃。在使用菌株前一天,将BactoTM胰蛋白酶大豆培养基大豆酪蛋白消化培养基(目录号211825,BD,美国新泽西州;2mL)添加到14mL圆底管中,并接种一个菌落,并在37℃的培养箱中培养,同时搅动至少12小时。随后,在感染动物前3小时,将在37℃下培养12小时的细菌培养基(400μL)添加到TSB(20mL)中,并在37℃的培养箱中在搅动下培养以生长至对数中期。在培养完成后,储存细菌培养基以防止细胞增殖并允许下一步进行。首先,将所得物在4℃下以3,000rpm的速率离心10分钟,并除去上清液。将所得物混悬于PBS中,并在4℃下以15,000rpm的速率离心1分钟。离心后,除去上清液,重悬于PBS(1mL)中,并使用分光光度计(目录号206-25400-58,Shimadzu,Japan)在600nm处测量吸光度。根据每种动物模型和感染方法,考虑必需的细胞数量来稀释混悬液,并用于实验中。
<5-3>热灭杀细菌的制备
使用表1所示的热灭杀金黄色葡萄球菌菌株测量IL-17A量。
(1)Novick RP,Ross HF,Projan SJ,Kornblum J,Kreiswirth B,Moghazeh S.(1993)Synthesis of Staphylococcal Virulence Factors Is Controlled by a Regulatory Rna Molecule.EMBO J.12(10):3967-75.
(2)From Cellular and Molecular Microbiology Division,Interfaculty Institute of Microbiology and Infection Medicine,University of Tübingen,Germany
(3)Kurokawa K,Kim MS,Ichikawa R,Ryu KH,Dohmae N,Nakayama H,Lee BL.(2012)Environment-mediated accumulation of diacyl lipoproteins over their triacyl counterparts in Staphylococcus aureus.J Bacteriol.194(13):3299-306.
(4)Park KH,Kurokawa K,Zheng L,Jung DJ,Tateishi K,Jin JO,Ha NC,Kang HJ,Matsushita M,Kwak JY,Takahashi K,Lee BL.(2010)Human serum mannose-binding lectin senses wall teichoic acid Glycopolymer of Staphylococcus aureus,which is restricted in infancy.J Biol Chem 285(35):27167-75.
(5)Nakayama M,Kurokawa K,Nakamura K,Lee BL,Sekimizu K,Kubagawa H,Hiramatsu K,Yagita H,Okumura K,Takai T,Underhill DM,Aderem A,Ogasawara K.(2012)Inhibitory receptor paired Ig-like receptor B is exploited by Staphylococcus aureus for virulence.J Immunol.189(12):5903-11.
(6)Kaito C,Sekimizu K.(2007)Colony spreading in Staphylococcus aureus.J Bacteriol.189(6):2553-7.
(7)Takahashi K,Kurokawa K,Moyo P,Jung DJ,An JH,Chigweshe L,Paul E,Lee BL.(2013)PLoS One.8(8):e69739.
使用上表1中所述的菌株向LB10培养基(2mL)中添加抗生素。关于基因型,Erm代表红霉素(目录号E6376,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA),Km代表卡那霉素(目录号17924,OH,USA),它们分别以10μg/mL和50μg/mL的浓度使用。PhleO表示腐草霉素(目录号P9564,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA),并且以10μg/mL的浓度用于在菌株制备期间对每种突变型的分类和确认,但它不用于培养细菌。接种每个菌株的菌落并培养12小时,向其中添加1mL通过在500mL锥形瓶中制备LB10(100mL)进行传代培养的每种菌株的细菌培养基,并根据生长温度在以180rpm的速度搅动下培养。
培养细菌直至OD600nm达到1.2,并将所得细菌培养物在4℃下以10,000rpm的速率离心10分钟。将所得的细菌沉淀混悬在生理盐水(0.9%NaCl;30mL)中,并在4℃下以10,000rpm离心10分钟,除去上清液。用生理盐水洗涤两次后,将沉淀重悬于盐水(10mL)中。将混悬液在50mL管中稀释以将OD600nm调节至0.3,并添加到60℃恒温水浴中,并热处理30分钟。重复在室温下充分冷却经热处理的细菌、在4℃下以10,000rpm的速率离心10分钟、除去上清液并将沉淀物混悬在注射用水(30mL)中的过程,并用注射用水洗涤两次。将沉淀混悬在注射用水(2mL)中,并测量冻干后的重量。然后,将所得物以200μg/mL的浓度腹膜内注射到小鼠中。
<5-4>小鼠模型中WTA-PGN诱导的细胞免疫
(i)由WTA、PGN和WTA-PGN诱导的腹膜炎、细胞免疫和免疫应答
将热灭杀的细菌或50μg,100μg和200μg量的WTA衍生物混悬在100μL PBS(目录号17-516Q,LONZA,MD,USA)中,并经腹膜内注射到小鼠中,从而诱导腹膜炎或免疫接种小鼠,并在每个实验必需的0、3、6、9、12、24、48和72小时的采样时间点处死小鼠,并在实验中使用。对用于重复诱导腹膜炎和记忆性应答的实验模型,在第0天、第7天和第14天用分别在100μL PBS中的100μg WTA、PGN和WTA-PGN腹膜内注射,使其经历21天的恢复期,并在第35天以MRSA(金黄色葡萄球菌USA300菌株,1×108CFU/100μL PBS)腹膜内注射感染。对照组的小鼠腹膜内注射100μL的PBS且将未经处理的小鼠作为对照。细菌攻击后,在0、3、6、9、12、24、48和72小时的时间点处死小鼠,并评价全身感染水平和免疫应答。同时,对在MRSA(金黄色葡萄球菌USA300菌株)和MSSA(金黄色葡萄球菌NRS184菌株)中存活的组以100μL PBS中的5×108CFU腹膜内注射。
(ii)分离腹膜液渗出物和腹膜渗出液细胞(peritoneal exudate cell,PEC)
对于小鼠腹膜液渗出物,用2mL PBS(目录号17-516Q,LONZA,USA)洗涤腹膜,以2,000rpm离心10分钟。将上清液保存在-80℃下,并用于通过ELISA分析细胞因子,并将沉淀重悬于完全RPMI 1640培养基(cRPMI;RPMI 1640:10%FBS:100mM L-谷氨酰胺:和100mg/mL青霉素/链霉素:)中。为了除去红细胞,使用红细胞裂解缓冲液(目录号420301,Bio legend,San Diego,CA,USA)裂解红细胞,并将细胞再次重悬于cRPMI中。
(iii)通过ELISA的细胞因子分析
对于IL-17A、IL-23、IL-1β、IL-10和IFNγ,使用R&D的ELISA试剂盒(R&D Systems Inc.,Minneapolis,MN,USA)和eBioscience的ELISA Ready-SET-Go!试剂盒(eBioscience,San Diego,CA,USA)对其在腹膜液渗出物的上清液中进行测量。关于每种细胞因子的ELISA试剂盒信息如下所示。最后,将使用酶标仪(目录号51119000,Thermo Fisher Scientific Inc.,Waltham,MA,USA)在450nm处测量的吸光度值相对于在550nm处测量的吸光度值进行修正。
(iv)流式细胞术(FACS)
对于表面染色,用PBS洗涤细胞并使用流式细胞术抗体染色。此外,对于细胞内染色,在收集细胞之前,在具有作为蛋白转运抑制剂的Golgistop(目录号554724,BD Bioscience,San Jose,CA,USA)的cRPMI1640培养基的存在下再刺激细胞。将收集的细胞用PBS洗涤,在室温下用100μL细胞内(intracellular,IC)固定缓冲液(目录号00-8222-49,eBioscience,San Diego,CA,USA)固定30分钟,然后用透化缓冲液(目录号00-8333-56,ebioscience,San Diego,CA,USA)洗涤。然后,将细胞用100μL透化缓冲液重悬,并使用细胞内染色Ab在室温下孵育20分钟。然后,在每个步骤用透化缓冲液和PBS洗涤细胞,并用PBS重悬。通过流式细胞术(BD FACS Canto II,BD Biosciences,San Jose,CA,USA)检测细胞,并使用FlowJo软件vX 0.7(FlowJo LLC.,Ashland,OR,USA)进行分析。每个表面分子和细胞内分子的具体信息显示在下表2中。
(v)免疫接种WTA衍生物的巨噬细胞、树突状细胞和纯化的γδ T细胞的细胞分选和体外共培养
如上所述分离天然小鼠和小鼠的PEC,其中对WTA衍生物进行免疫接种;并将PEC转移到96孔平底板中(2至3×105个细胞/孔),并在37℃,5%CO2条件下(目录号MCO-17A,SANYO,Japan)的cRPMI培养基中培养1.5小时,以使巨噬细胞和树突状细胞附着于其上。然后,通过抽吸除去培养基,并用不含抗生素的RPMI替换。
通过使用鼠Pan T细胞分选试剂盒II(目录号130-095-130,Miltenyi Biotec,Bergisch Gladbach,Germany),对巨噬细胞和树突状细胞负选择CD3+T细胞来进行FACS分选;并对γδ T细胞使用γδ TCR特异性Ab。
将染色的细胞在压力下通过具有细胞过滤器卡口盖()的圆底管(目录号352235,Tewksbury,MA,USA)放置,并使用流式细胞分选仪(AstriosTM细胞分选仪,Beckman Coulter,Inc.,South Kraemer Boulevard Brea,CA,USA)分选。所分选细胞的纯度为95%以上。
(vi)RNA分离、cDNA合成和定量实时PCR(qRT-PCR)
使用TRI(目录号TR 118,Molecular Research Center,Inc.,Cincinnati,OH,USA)分离总RNA。根据制造商的方案进行RNA分离,并且对于cDNA合成,使用RT-PCR装置(C1000TouchTM Thermal Cycler,Bio-Rad,Hercules,CA,USA)将mRNA逆转录为总体积为20μL的cDNA,包括oligo(dT)引物(目录号C1101,Promega Corporation,Madison,WI,USA)和Improm-II系统(目录号A3800,Promega Corporation,Madison,WI,USA)。使用qRT-PCR装置(目录号9001870,Rotor-Gene Q,QIAGEN Inc.,Valencia,CA,USA)与RT-PCR一起扩增转录的cDNA。对每种条件,用次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(hypoxanthine-guanine phosphoribosyltransferase,HPRT)将数据归一化。每个基因的引物信息显示在下表3中。
[表2]FACS抗体信息
[表3]引物信息
<5-5>在NZW兔和豚鼠模型中由WTA-PGN诱导的细胞免疫
(i)在NZW兔的皮肤中测量通过WTA-PGN免疫对MRSA感染的保护作用
对于实验动物,从Orient Bio Inc.(Gyeonggi-do,Korea)购买体重为2±0.1kg的NZW雌性兔(Yac;NZW(KBL)),并且在实验之前允许它们适应动物实验实验室环境(兔笼,目录号DJ117,Daejong Instrument Industry Co.,Ltd.,Korea;20℃至25℃,湿度55%)一周,同时向它们饲喂市售固体饲料(目录号38302-NM,Cargill Agri Purina,Inc.,rea基因缺陷)。将实验动物置于育种笼中,每笼一只,自由取食饮食和饮用水。每天测量一次实验动物的体重和饮食摄入量,以12小时间隔打开和关闭照明。
在WTA-PGN免疫接种和用MRSA USA300感染到NZW兔的皮肤中之前,使用电动剃须刀(目录号ER806,Panasonic Corporation,Japan)清除尺寸为15cm(宽)×10cm(长)的NZW兔背部的毛发,并用无菌酒精棉和聚维酮碘溶液(目录号P698900,TRC,CANADA)消毒剃毛区域并用于实验。
对于动物的麻醉,考虑动物的体重,分别以30mg/0.6mL/2kg和9.328mg/0.4mL/2kg的浓度混合50(Virbac Korea Co.,Ltd.,Korea)和甲苯噻嗪盐酸盐(目录号1251,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA),并肌内注射。
将剃毛区域分成两半(7.5cm(长)×10cm(宽))并分隔。作为对照的左侧通过皮内注射用PBS(100μL)免疫接种,右侧用WTA-PGN(20μg/100μL)免疫接种。3小时后,通过皮内注射USA300(1×108CFU)感染一只兔子,6小时后通过皮内注射用USA300(1×108CFU)感染另一只兔子,并且通过宽度(w)和长度(l)测量皮肤脓肿损伤的尺寸,并且定量7天的皮肤坏死面积(cm2)和脓肿体积(cm3)。通过用于球形椭球体的等式[v=(π/6)xlxw2]计算脓肿体积(cm3)。
(ii)在豚鼠皮肤中测量通过WTA-PGN免疫接种抵抗MRSA感染的保护作用
对于实验动物,从Orient Bio Inc.(Gyeonggi-do,Korea)购买体重为2±0.1kg的雌性豚鼠(Cr10ri;HA);并在实验前使它们适应动物实验实验室环境(用于恒定温度恒定湿度的动物笼,目录号AAAC2051,JEIOTECH Co.,Ltd.,Korea;20℃至25℃,湿度55%)一周,同时向其饲喂市售固体饲料(目录号5026,Orient Bio Inc.,Korea)。将实验动物置于育种笼中,每笼一只,自由取食饮食和饮用水。每天测量一次实验动物的体重和饮食摄入量,以12小时间隔打开和关闭照明。
在WTA-PGN免疫接种和感染MRSA USA300进入豚鼠的皮肤中之前,使用电动剃须刀(目录号ER806,Panasonic Corporation,Japan)将豚鼠背部的毛发被除去(尺寸为15cm(宽)×10cm(长),并用无菌酒精棉和聚维酮碘溶液(目录号P698900,TRC,CANADA)消毒剃毛区域并用于实验。
对于动物的麻醉,考虑动物的体重,分别以3mg/0.06mL/100g和0.9328mg/0.04mL/100g的浓度混合50(Virbac Korea Co.,Ltd.,韩国)和盐酸赛拉嗪(目录号1251,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA),并肌内注射。
将剃毛区域分成两半(3cm(长)×6cm(宽))并分隔。作为对照的左侧通过皮内注射用PBS(100μL)免疫接种,右侧用WTA-PGN(20μg/100μL)免疫接种。6小时后,通过皮内注射用USA300(5×108CFU)感染皮肤脓肿病变的尺寸并通过宽度(w)和长度(l)测量,并且定量7天的皮肤坏死面积(cm2)和脓肿体积(cm3)。通过用于球形椭球体的等式[v=(π/6)xlxw2]计算脓肿体积(cm3)。
(iii)在豚鼠腹膜中测量通过WTA-PGN免疫接种抵抗MRSA感染的保护作用
实验动物的饲养以与II.5.2相同的方式进行。使用豚鼠,通过腹膜内注射PBS(100μL)以免疫接种对照组(n=2),通过腹膜内注射WTA-PGN(200μg/100μL)以免疫接种WTA-PGN组。3小时后,通过腹膜内注射用USA300(1.5×109CFU)感染豚鼠,并监测体重、饮食摄入量、运动等7天。然后,解剖豚鼠,观察脓肿的存在和大小、器官的状况等。
<5-6>由WTA-PGN诱导的体液免疫
(i)通过WTA、PGN和WTA-PGN衍生物向皮肤中免疫接种和MRSA(USA300)感染
在第0天、第14天、第28天、第42天和第56天通过皮内注射PBS(目录号17-516Q,Lonza Walkersville,Inc.,MD,USA)和20μg的WTA和PGN衍生物分别以50μL的量免疫接种实验动物5次。免疫前和第7天、第21天、第35天、第49天和第63天,即各自免疫接种后7天,通过切尾收集20μL血液样品。在第5次免疫接种后14天的第70天,通过静脉内注射以USA300(1×107CFU/100μL PBS)感染动物,并在其后7天的第77天处死动物。在实验中使用的时间表被图示并显示在图31中。小鼠在处死前12小时禁食,然后使用麻醉剂(1μL/g BW)麻醉,其通过在0.9%NaCl溶液(目录号S 3014,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)中添加100mg的2,2,2-三溴乙醇(目录号T48402,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)和200μL的叔戊醇(目录号152463,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)制备。然后,使用经肝素处理的无菌注射器从心脏收集血液样品,并在10℃以8,000rpm的速率离心10分钟,并将由此获得的血浆用作样品。将来自肝、脾、肾、心、肺等的组织切除并测量其重量。将肾组织用于CFU测量,将剩余的组织浸入液氮中并储存在-80℃下以备以后用作样品。
(ii)通过ELISA对用WTA衍生物免疫接种的血清中的抗原特异性抗体的定量
用5nmol WTA-PGN(50μL)处理96孔微量培养板的每个孔,并使用以STD按1∶500的比例稀释山羊抗小鼠IgG-FC(目录号G-202-C,R&D systems Inc.,Minneapolis,MN,USA)在4℃下包被过夜。通过向其中添加TBS缓冲液(10mM Tris-HCl(目录号T3253,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA),含有200μL封闭缓冲液(1%BSA(目录号A2153,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA))和140mM NaCl(目录号SOD001.1,Bioshop,Canada;pH 7.4)),将每个细胞在室温封闭2小时;每个孔在室温下用含有200μL洗涤缓冲液(0.05%Tween20;目录号P9416,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)的TBS缓冲液洗涤5次。连续稀释WTA、WTA-PGN并添加经PBS免疫接种的血浆(50μL),在室温下培养2小时,并将小鼠参照血清(目录号RS10-101,Bethyl Laboratories,Inc.,Montgomery,TX,USA)用作STD。每个细胞在室温下用洗涤缓冲液(200μL)洗涤5次,用50μL以1∶2500稀释并与辣根过氧化物酶连接的山羊抗小鼠IgG(目录号W4021,Promega Corporation,Madison,WI,USA)处理,并在室温下温育1小时。将所得到的孔用洗涤缓冲液(200μL)再洗涤5次,添加100μL的3,3′,5,5′-四甲基联苯胺(目录号T0440,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)作为底物,并在室温下孵育10分钟,用作为终止缓冲液的50μL 2N H2SO4(目录号258105,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)处理,使用酶标仪(目录号51119000,Thermo Fisher Scientific Inc.,Waltham,MA,USA)将在450nm处测量的吸光度值相对于在550nm处测量的吸光度值进行修正。
(iii)肾组织中细菌负载的定量
将观察到脓肿形成的肾组织用含有10mL 10mM乙二胺四乙酸(EDTA;目录号EDT001.500,Bioshop,Canada)和0.9%NaCl(目录号14002,JW Pharmaceutical,Korea)的溶液匀浆。连续稀释匀浆物,将50μL经稀释的匀浆物分散在绵羊血琼脂平板(目录号AM601-01,AsanPharm Co.,Ltd.,rea基因缺陷)上,并在37℃的培养箱(目录号SB-9,EYELA,Japan)中培养24小时,并对菌落数进行计数。
(iv)肾组织中的病理学观察
从实验中使用的小鼠肾组织收集肾皮质和肾髓质的一部分。为了证实免疫细胞浸润和脓肿(包括皮层和多形核白细胞、巨噬细胞和淋巴细胞中的肾小球囊坏死),将组织切片进行苏木精-伊红(H&E)染色。
也就是说,将收集的组织在10%福尔马林(目录号HT501128,Sigma-Aldrich Co.LLC.,Saint Louis,MO,USA)中固定,然后制备石蜡块。将石蜡块制备成3μm切片并置于载玻片之上,在60℃至70℃的烘箱中干燥1小时,并进行H&E染色。将完成的载玻片放置在光学显微镜下,并在200X放大视野下观察组织病理学变化。
实施例6:γδ T细胞介导的体内IL-17A分泌和通过纯化的WTA-PGN衍生物抵抗MRSA感染的保护作用
<6-1>通过WTA-PGN衍生物诱导细胞免疫
(6-1-1)向小鼠腹腔内注射纯化的WTA-PGN、WTA和PGN时,小鼠在12小时内分泌IL-17A和IL-1β。
对于纯化的WTA-PGN衍生物的生理活性的详细检查,当以多种浓度(在PBS中0、50、100和200μg/100μL)将分离/纯化的WTA-PGN衍生物腹膜内注射到小鼠中时,观察根据时间变化在腹膜中产生的IL-17A和IL-β的量,其结果分别示于图11A和11B。通过ELISA观察关于细胞因子(例如IL-17A和IL-1β)表达的时间性流行病学。
IL-17A表达从WTA-PGN注射后3小时的时间点开始提高,在6小时内最大诱导,然后迅速降低,并且IL-17A在24小时内不再表达。当注射等量的WTA和PGN的混合物时,在所有时间点不产生IL-17A,因此证实其中WTA和PGN共价键合的WTA-PGN结构是诱导IL-17A所必需的。此外,证实IL-17A表达以浓度依赖性方式提高(图11A)。
在注射WTA-PGN衍生物后3至6小时也显示IL-1β的表达量最高,在24小时内降低到对照水平。同时,WTA和PGN的混合物在注射后3小时显示IL-1β的最大表达水平,但是在注射后6小时IL-1β表达快速降低。像IL-17A一样,IL-1β表达的量也显示以浓度依赖性方式提高(图11B)。
由于公知在宿主特定区域中的金黄色葡萄球菌感染可引起毒素分泌或生物膜形成,从而抑制中性粒细胞介导的吞噬作用,这表明能够收集中性粒细胞的细胞因子在感染早期阶段分泌,以在感染牢固建立之前通过吞噬作用除去金黄色葡萄球菌。然而,在感染的早期阶段可选择性诱导IL-17A分泌的免疫调节剂尚未确定。
由于迄今的基础研究结果,Th17细胞已知为可在体内产生IL-17A的T细胞。然而,已经报道了Th17细胞持续分泌IL-17A可以导致中性粒细胞在特定区域过度积累并破坏宿主的组织或器官,从而诱导自身免疫疾病,例如狼疮、类风湿性关节炎等。因此,建议可诱导由Th17细胞介导的IL-17A表达的材料不可用作有效的疫苗或免疫调节剂。
(6-1-2)通过WTA-PGN衍生物在早期诱导IL-17A和IL-1β过程由抗炎细胞因子IL-10控制。
为了阐明注射后12小时,注射了WTA-PGN的小鼠中IL-17A和IL-1β为什么不分泌,根据作为抗炎细胞因子的IL-10可以控制这些炎症细胞因子的假设,本发明人通过在将分离/纯化的WTA-PGN衍生物(200μg/100μL)注射于小鼠之后根据时间(0、3、6、9、24、48、72和96小时)收集腹膜液渗出物来分析IL-17A、IL-1β和IL-10的量(图12)。
在注射WTA-PGN衍生物3小时后IL-17A的产生开始提高,在6小时内显示最大水平,但是从注射后9小时开始降低,并且在12小时内没有产生。IL-1β显示与IL-17A相似的表达模式,但是IL-1β表达在显示最大水平后,注射后6小时开始降低,并且在注射后12小时保持相对高水平,但在24小时和之后没有产生。然而,有趣的是,注射WTA-PGN衍生物后,IL-10产生从注射后3小时逐渐提高,在12小时内达到最大水平,从24小时开始降低,但维持在高水平直到48小时,之后开始迅速降低,72小时后几乎没有IL-10产生。
这些结果导致如下预期:将从金黄色葡萄球菌纯化的WTA-PGN衍生物腹膜内注射到小鼠中可以使小鼠在3小时至6小时的短时间内分泌炎性细胞因子(例如IL-17A和IL-1β)以收集中性粒细胞,从而能够通过吞噬作用去除感染区域周围的金黄色葡萄球菌。此外,经由WTA-PGN的IL-17A分泌显示在注射后12小时内以及之后受到控制,因此证实WTA-PGN衍生物是新的免疫调节剂,其不通过过量IL-17A分泌引起的自身免疫应答诱导宿主中的组织或器官的损失。
(6-1-3)γδT来源的IL-17A通过WTA-PGN衍生物产生
使用流式细胞术进行的实验的结果示于图13中,其证实了当注射WTA-PGN时产生的IL-17A是来自于γδT细胞的IL-I7A。在WTA-PGN注射后,根据时间收集腹膜中的细胞,并首先收集到CD3+T细胞。然后,收集具有γδT细胞受体(γδTCR)的T细胞,并检查这些T细胞在所有T细胞中的百分比。结果,在WTA-PGN注射后6小时,与PBS组相比,该百分比提高至12.2%。当使用单克隆抗体定量γδT细胞内产生的IL-17A时,证实在注射后3小时,腹膜中累积的γδT细胞的56%是产生IL-17A的细胞;在注射后6小时,腹膜中积累的γδT细胞的78%是产生IL-17A的细胞。
这些结果证实WTA-PGN是一种新的免疫调节剂,其可以诱导由γδT细胞选择性介导的IL-17A的表达。
(6-1-4)WTA-PGN衍生物无法诱导来自于CD4+和CD8+T细胞的IL-17A产生。
为了检查通过WTA-PGN衍生物注射产生的来自CD4+和CD8+T细胞的IL-17A的存在,通过流式细胞术分选CD4+和CD8+T细胞,并对这些细胞分泌的1L-17A量进行定量。结果示于图14。
在WTA-PGN注射后3小时和6小时,未观察到来自于CD4+和CD8+T细胞的IL-17A的产生。这些结果证实,WTA-PGN衍生物是新的免疫调节剂,其通过仅产生来自于γδT细胞的IL-17A而不参与来自于CD4+和CD8+T细胞的适应性免疫来控制中性粒细胞的细胞免疫应答。
(6-1-5)WTA-PGN注射无法在带有γδ TCR缺陷的小鼠中诱导IL-17A和IL-1β产生。
由于WTA衍生物产生来自于γδT细胞的IL-17A,因此使用Vγ2/4-/-小鼠(该小鼠在Vγ2/4基因(γδTCR的主要亚型)中有缺陷)和野生型小鼠检查WTA-PGN是否可诱导来自γδT细胞的IL-17A和IL-1β的表达。
结果,如图15A和15B所示,如所预期的在注射WTA-PGN的野生型小鼠组中表达IL-17A和IL-1β,而在Vγ2/4-/-小鼠组中不产生这些细胞因子。当注射WTA和PGN的混合物时,在野生型小鼠组和Vγ2/4-/-小鼠组中均未观察到IL-17A和IL-1β的表达。根据这些结果,证实了WTA-PGN可通过活化作为主要亚型的Vγ2/4诱导IL-17A的产生。
(6-1-6)通过WTA-PGN的预处理的记忆性(记忆)γδT细胞的产生和相关细胞因子表达的特征
i)用WTA-PGN衍生物预处理3次后用MRSA细菌再感染后的细胞因子表达模式的检查结果
由于关于金黄色葡萄球菌的再感染的记忆性γδT细胞的产生是用于新的金黄色葡萄球菌感染的新型疫苗候选物质或免疫调节剂的有效临床应用的基本要求,本发明人检查了在以一周间隔三次注射WTA-PGN衍生物21天后用USA300菌株(MRSA菌株)在腹膜中再感染的小鼠是否可产生记忆性γδT细胞(图16)。
首先,在用WTA-PGN、WTA和PGN衍生物预处理3次的小鼠中检查炎性细胞因子和抗炎症细胞因子的变化。结果,发现在用USA300菌株感染后6小时IL-17A的表达水平最高,并且在24小时中,表达量降低至与对照组相似的水平(图16A)。IL-17A在用WTA-PGN,WTA和PGN衍生物预处理3次的小鼠中表达,但表达水平相比于WTA-PGN大约为一半,并且特别地,与单次处理相比,3次预处理导致IL-17A表达水平提高约10倍。
在USA300感染后6小时IL-1β产生量达到最大表达水平,并且感染后24小时的表达水平显著降低。以WTA和PGN预处理的组在感染后6小时显示出与WTA-PGN组相似的IL-1β表达水平。这些结果证实,在用WTA和PGN预处理3次的小鼠中用USA300再感染可表现出与WTA-PGN组相似的表达量(图16B)。
有趣的是,IL-23产生仅在WTA-PGN组中用USA300菌株再感染后6小时表达,并且IL-23的产生在24小时内不表达。这些结果表明IL-23的产生与由记忆性γδT细胞介导的IL-17A的产生密切相关(图16C)。
用WTA和PGN预处理的小鼠中,在用USA300菌株感染后6小时IFNγ产生量达到最大表达水平,并且感染后24小时的表达水平显著降低。与IL-17A的表达不同,在WTA-PGN预处理的小鼠中IFNγ的表达显示在WTA-PGN组中最低。这些结果表明IFNγ的产生与由记忆性γδT细胞介导的IL-17A产生无关(图16D)。
同时,作为抗炎细胞因子的IL-10的表达水平在用USA300菌株感染后3小时显著提高,在感染后12小时稍微降低,在24小时内再次显示最大水平,感染后48和72小时略微降低,但仍保持在高水平。如先前所观察的,考虑到作为炎性细胞因子的IL-17A、IL-1β和IL-23的表达在感染后24小时达到最大水平,证实了IL-10可有效地抑制IL-17A表达(图16E)。
ii)用WTA-PGN预处理3次的小鼠产生具有CD44高/CD27低标记的记忆性γδT细胞。
为了检查用WTA-PGN预处理3次的小鼠腹膜中记忆性γδT细胞的产生,在USA300感染后3小时收集用WTA-PGN预处理的小鼠的γδT细胞,并检查作为记忆性γδT细胞的标记物的CD44高/CD27低γδT细胞的表达。结果,证实了其表达水平高于没有预处理的组,并且记忆性γδT细胞显示比对照组更高水平的IL-17A表达,而在CD27+γδ T细胞中未观察到IL-17A的表达(图17A和17B)。
iii)CD3+γδ T细胞中IL-17A的产生
通过用USA300菌株感染,在用WTA-PGN预处理3次从而产生记忆性γδT细胞的小鼠中通过FACS和ELISA分别观察CD3+γδ T细胞中细胞内和细胞外IL-17A的表达。结果,在感染后3小时至9小时期间,用WTA-PGN预处理的小鼠显示高表达水平的IL-17A(图18A和18B)。这些结果证实WTA-PGN可有效诱导记忆性γδT细胞,并且诱导的记忆性γδT细胞可作为用于产生IL-17A的主要细胞。
iv)CD4+和CD8+T细胞中IL-17A的产生
为了再次确认先前的结果,即在用WTA-PGN预处理后产生IL-17A的主要细胞是诱导免疫应答的γδT细胞,检测了来自于参与适应性免疫应答的CD4+和CD8+T细胞的IL-17A的表达(图19)。来自于CD3+γδ T细胞的IL-17A产生为90%或更高,但当从用WTA-PGN预处理的小鼠分离的CD4+和CD8+T细胞检查IL-17A的表达时,未观察到表达。根据这些结果,再次证实当在用WTA-PGN预处理3次后,小鼠感染MRSA时,仅γδ T细胞诱导细胞免疫,而非适应性免疫应答相关细胞例如CD4+和CD8+T细胞。
v)通过WTA-PGN预处理分化的γδTCR亚群的验证
检查了当对以WTA-PGN衍生物预处理3次,由此产生具有记忆性γδT细胞的小鼠用USA300菌株感染时,γδ TCR的哪种亚型提高。结果,证实Vγ4亚型表达最高(图20)。因为目前在市售Vγ4亚型中不可获得抗Vγ4-Ab,所以通过作为Vγ4群体的设门确认了Vγ1.1和Vγ2的双阴性群体区。根据最近的研究结果,在USA300菌株感染中,最初观察到Vγ1.1+和vγ2+的迅速流入,并且随后是γδ TCR亚群向Vγ1.1+和Vγ4+γδ T细胞的转变。此外,关于Vγ4+细胞,据报道当连续诱导金黄色葡萄球菌感染和记忆性应答时,该群体甚至进一步提高,并直接参与IL-17A的产生(J Immunol 2014;192:3697-3708)。
vi)树突状细胞中的IL-23表达
为了检查哪种细胞表达IL-23(其先前显示通过用WTA-PGN再处理表达),本发明人进行了关注树突状细胞可能性的研究(图21)。用WTA-PGN预处理3次,然后用USA300菌株感染后,证实了树突状细胞内的IL-23表达。结果,证实与未经预处理的组相比,用WTA-PGN预处理的组显示出IL-23表达的提高,然而,在感染后24小时,未观察到表达。根据这些结果,表明在MRSA感染的早期阶段在树突状细胞中产生IL-23,其触发γδ T细胞以诱导IL-17A表达。
<6-2>通过WTA-PGN免疫接种诱导的记忆应答在体内抵抗MRSA(金黄色葡萄球菌USA300菌株)和MSSA(金黄色葡萄球菌NRS184菌株)感染的保护作用
将小鼠用WTA-PGN腹膜内免疫接种3次,在第35天用USA300菌株(1×108个细胞)感染,在感染后72小时观察腹膜中产生的器官的形状和脓肿的形成。结果示于图22。
在对照组中,在腹膜中观察到脓肿,但在WTA-PGN组中完全未观察到脓肿,从而表明由γδ T细胞介导的IL-17A产生诱导中性粒细胞的积累并提高吞噬作用,从而有效地保护宿主免受USA300感染。同时,尽管在用WTA治疗的组中未观察到脓肿,但在肝组织中存在异常发现。用PGN处理的组似乎处于比对照组更好的情况下,但观察到脓肿。
此外,为了检查其中通过用WTA-PGN免疫接种诱导记忆应答的小鼠的存活率,用USA300菌株感染后,通过腹膜内注射用WTA-PGN免疫小鼠3次,在第35天用USA300菌株(5×108个细胞)感染,并监测9天。结果示于图23。用WTA-PGN免疫接种的组中的所有小鼠存活,而PBS组(即对照组)中的所有小鼠在第8天死亡。根据这些结果,表明由于在感染早期的细胞免疫和记忆应答,用WTA-PGN免疫接种的小鼠可以有效地进行抵抗高浓度的MRSA感染的体内防御。
同时,为了检查示出抵抗MRSA感染的保护作用的WTA-PGN是否也可以示出抵抗MSSA感染的保护作用,通过腹膜内注射用WTA-PGN免疫接种小鼠3次,在第35天用金黄色葡萄球菌NRS184菌株(5×108细胞)感染,在第7天观察腹膜中脓肿的存在(图24A和24B)。如图24所示,在PBS组(对照)的腹膜中观察到脓肿的存在,但在用WTA-PGN预处理的组中完全未观察到脓肿,从而证实WTA-PGN可以对MSSA菌株感染以及对MRSA菌株感染表现出强的保护作用。
<6-3>在NZW兔和豚鼠中,WTA-PGN免疫接种在宿主抵抗MRSA感染中的保护作用
由于在小鼠实验模型中证实了WTA-PGN免疫接种对记忆性γδ T细胞的产生的作用和抵抗MRSA感染的保护作用,因此代替小鼠模型,在动物模型(例如NZW兔和豚鼠)中检查WTA-PGN是否能够在WTA-PGN免疫接种后显示抵抗MRSA感染的保护作用。
首先,通过皮下注射用20μg WTA-PGN免疫接种NZW兔的皮肤,并且在免疫接种后3小时通过皮下注射用MRSA(1×108CFU的USA300)感染,并观察保护作用。结果示于图25A至25C中。
结果,与用PBS(100μL)免疫接种的对照组相比,该免疫接种的兔的皮肤坏死面积和脓肿体积的尺寸显著小并迅速恢复,因此在第6天几乎没有观察到脓肿组织。根据这些结果,证实即使在NZW兔和在小鼠模型中WTA-PGN也诱导细胞免疫,并且还表现出抵抗MRSA感染的保护作用。
另外,通过皮下注射用WTA-PGN(20μgWTA-PGN/100μL PBS)免疫接种NZW兔和豚鼠模型,并且在免疫接种后6小时通过皮下注射用MRSA(5×108CFU的USA300)感染,并观察到保护作用的存在。
结果,观察到在NZW兔和豚鼠两者中,用WTA-PGN(20μg WTA-PGN/100μL PBS)免疫接种的动物中,脓肿的尺寸表现为显著小并且也迅速恢复(图26A和26B)。因此,证实了WTA-PGN在NZW兔和豚鼠中具有抵抗MRSA感染的保护作用,该动物假定为具有最接近人的免疫系统,因此证实可以通过用WTA-PGN预处理来保护宿主免受MRSA感染。
为了观察其在宿主中抵抗MRSA感染的保护作用,将WTA-PGN注射到豚鼠的腹膜后,通过腹膜内注射分别用PBS和200μg WTA-PGN免疫接种豚鼠,并在3小时后用1.5×109CFU的SA300感染。免疫接种后7天,将动物解剖并观察组织,并且结果是,与用PBS免疫接种的对照组相比,用WTA-PGN免疫接种的动物中脓肿的尺寸显著降低,并且几乎没有由MRSA引起的溶血(图27)。
根据上述结果,证实通过用WTA-PGN预处理小鼠腹膜而显示出抵抗MRSA感染的保护作用的WTA-PGN在使用豚鼠腹膜的模型系统中也具有抵抗MRSA感染的保护作用。
<6-4>在野生型小鼠、具有TLR-9基因缺陷的小鼠和具有胱天蛋白酶-1基因缺陷的小鼠中通过WTA-PGN免疫接种产生IL-17A和IL-1β
为了研究WTA-PGN如何产生来自于γδ T细胞的IL-17A的信号转导机制,对toll样受体(toll-like receptor,TLR)途径和炎症小体途径进行了研究,其已知分别参与树突状细胞中IL-23和IL-1β表达的诱导。
将从ΔoatAΔlgt分离的WTA-PGN和从野生型细菌分离的WTA-PGN注入野生型小鼠、带有TLR-9基因缺陷的小鼠和带有胱天蛋白酶-1基因缺陷的小鼠,并且在免疫接种后6小时,在腹膜液渗出物中测量IL-17A产生。结果,证实IL-17A和IL-1β仅在注射了从ΔoatAΔlgt分离的WTA-PGN的小鼠组中表达,并且在带有TLR-9基因缺陷的小鼠和带有胱天蛋白酶-1基因缺陷的小鼠中不产生这些细胞因子(图28A和28B)。
这些结果表明,当从ΔoatAΔlgt分离的WTA-PGN产生来自于γδ T细胞的IL-17A时,将涉及TLR-9途径和炎症小体途径。
<6-5>在巨噬细胞、树突状细胞和γδ T细胞中WTA-PGN预处理后诱导的细胞因子和趋化因子的表达特征的比较
为了了解γδ T细胞依赖性IL-17A分泌所必需的高水平信号转导系统以及WTA-PGN的生物学功能和机制,从腹膜渗出液细胞(PEC)分离巨噬细胞、树突状细胞和γδ T细胞,并检查从这些细胞诱导的细胞因子(图29)。
结果,证实用WTA-PGN免疫接种,分别地,IL-17A在γδ T细胞中表达,IL-1β在树突状细胞和γδ T细胞中表达,IL-12p40(IL-23)在树突状细胞中表达,且IFNγ在γδ T细胞中表达。
最近,越来越多的报道证实树突状细胞中的IL-23和IL-1β表达在非经典T细胞(即γδ T细胞)中IL-17A的产生中具有重要作用。因此,确定需要对于在WTA-PGN免疫接种下细胞因子如何识别配体并且彼此相互作用的更具体的研究。
另外,使用野生型小鼠和NLRP3基因缺陷小鼠进行了WTA-PGN免疫接种,并分离巨噬细胞、树突状细胞和γδT细胞,通过qRT-PCR检测NLRP3、细胞因子和TLR1至TLR9基因的表达状态。结果,证实NLRP3主要在树突状细胞和γδ T细胞中产生,在未处理的对照组中高度表达,在野生型小鼠和NLRP3基因缺陷的小鼠中略微降低,然而,与NLRP3基因缺陷的小鼠相比,野生型小鼠的表达水平更高(图30)。
一般而言,已知NLRP3在树突状细胞内的炎症小体中表达,从而影响IL-1β的产生。考虑到在先前实验中树突状细胞和γδ T细胞中IL-1β表达显示高的结果,并且树突状细胞和γδ T细胞中NLRP3基因表达的水平几乎相同,表明涉及NLRP3的炎症小体也可存在于γδ T细胞中,并且这些假定为先前从未报道过的新发现(图30A)。
虽然IL-17A在对照组中完全不表达,但是在WTA-PGN免疫接种后IL-17A表达的水平仅在从野生型小鼠和具有NLRP3基因缺陷的小鼠获得的γδ T细胞中提高,并且与具有NLRP3基因缺陷的小鼠组相比,野生型小鼠中IL-17A表达水平更高。这些结果表明,在NLRP3基因缺陷的小鼠的情况下,IL-1β的产生在树突状细胞的炎症小体内被抑制,因此不能刺激γδ T细胞,从而降低IL-17A表达水平(图30B)。
IL-23是由IL-12p40和IL-23p19组成的异源二聚体形式。在检查这些基因的表达时,IL-12p40在以WTA-PGN免疫接种的野生型小鼠中高度表达,并且IL-23p19在NLRP3基因缺陷的小鼠的巨噬细胞和树突状细胞中高度表达,然而,与IL-12p40表达相比,IL-23p19表达水平可忽略(图30C和30D)。
虽然IL-1β在对照组中完全不表达,但是通过WTA-PGN免疫接种,在野生型小鼠组中IL-1β表达水平以树突状细胞>γδT细胞>巨噬细胞的顺序显示为高水平;并且在NLRP3基因缺陷的小鼠中,按γδT细胞>树突状细胞>巨噬细胞的顺序显示为高水平(图30E)。在用WTA-PGN免疫接种的野生型小鼠组中,IFNγ表达被显著抑制,但在对照组的γδT细胞和NLRP3基因缺陷的小鼠中高度表达(图30F)。
根据上述结果,表明了γδT细胞中的IL-17A表达和树突状细胞中的IL-23表达之间存在密切的关系,而γδ T细胞中的IFNγ表达和IL-17A表达未彼此矛盾的关系。
另外,为了理解γδ T细胞依赖性IL-17A分泌所必需的高级信号转导系统,确认了TLR1至TLR9基因的表达。未确认到TLR3,TLR4,TLR5和TLR6基因,甚至在TLR1,TLR2,TLR7和TLR9基因的情况下,在对照组、以WTA-PGN免疫接种的野生型小鼠组和具有NLRP3基因缺陷的小鼠组之间也没有观察到显著性差异(图30G至30J)。特别地,在从ΔoatAΔlgt突变体分离的WTA-PGN的情况下,预期其被内体中存在的TLR9识别,从而分泌IL-23。然而,如上图所示,当以WTA-PGN免疫野生型时,几乎未显示TLR9基因,因此认为存在另一个更高级别的信号转导系统。
实施例7:WTA-PGN衍生物的体液免疫
<7-1>通过WTA和WTA-PGN的皮下免疫接种在小鼠模型中产生抗WTA-IgG。
用WTA和WTA-PGN免疫接种后,为了确认各抗原特异性抗体的产生,用WTA和WTA-PGN包被96孔板,并使用经免疫接种小鼠血清滴定抗WTA-IgG和抗WTA-PGN-IgG的产生量(图32)。
结果,在WTA的情况下,当其免疫接种5次时,血液中抗WTA-IgG的量提高约3倍。相对而言,在WTA-PGN的情况下,当其被免疫接种3次时,抗WTA-PGN-IgG的量显著提高约5倍(图32)。
这些结果使得预期使用WTA-PGN衍生物的免疫接种将产生抗原特异性抗体并活化经典补体途径并诱导调理吞噬作用,从而提供保护作用。因此,用MRTA菌株通过尾静脉感染用WTA和WTA-PGN免疫接种5次的小鼠,并检测宿主中的保护作用。
<7-2>通过皮下注射WTA-PGN衍生物免疫接种后MRSA感染引起的体重变化
在用WTA-PGN衍生物免疫接种5次后,在第70天用USA300菌株(1×107CFU)感染动物,并且监测体重一周的结果显示在图33中。
在感染后注射PBS的组在第2天显示出超过15%的体重降低,并且持续保持低体重。相比之下,与PBS组相比,WTA和PGN组的体重降低率较低,并且WTA-PGN组最初显示5%的体重减轻,但在第6天恢复其初始体重。
上述结果表明,对于MRSA感染,调理吞噬作用由抗原特异性抗体的产生诱导,并且小鼠保护作用表现为在感染早期期间除去细菌。
<7-3>通过WTA-PGN免疫接种产生的宿主中的MRSA保护作用
在用从金黄色葡萄球菌的细胞壁分离的WTA、PGN和WTA-PGN衍生物免疫接种小鼠后,在第70天通过静脉内注射USA300菌株感染小鼠。在第77天,分离肾并且检查存在于小鼠的肾中USA300的CFU和脓肿形成的存在。结果示于图34A和34B。
作为观察小鼠肾中脓肿形成的存在的结果,证实了与PBS对照组相比,WTA-PGN组显示出对脓肿形成的显著抑制,如图34A所示。当研磨肾并计算存在于肾中的MRSA菌株的CUF时(图34B),如所预期,推测WTA-PGN组是作为在小鼠中具有抵抗MRSA感染的保护作用的抗原的材料。
同时,对小鼠肾的组织病理学现象的观察结果示于图35。在肾皮质中证实了肾小球囊的坏死,而在肾髓质中证实了脓肿和含有多形核白细胞、巨噬细胞和淋巴细胞的免疫细胞渗出物。在皮质的情况下,用WTA-PGN免疫接种的小鼠组中的肾小球囊保持与对照组的小鼠相似的形状,而在用PBS和PGN免疫接种的小鼠组中观察到肾小球囊的坏死。在髓质的情况下,在用WTA-PGN免疫接种的小鼠组中观察到少量免疫细胞渗出物,显示与对照组的小鼠几乎相似的特征,但根本没有发现脓肿,其显示接近正常组织的模式。同时,在PBS组和PGN组中观察到大的脓肿,并且肾损伤程度在皮质和髓质两者中以WTA-PGN>WTA>PGN>PBS的组的顺序降低。
- 还没有人留言评论。精彩留言会获得点赞!