移植医药设备到神经组织中的方法与流程
本发明涉及移植医药装置或其他物体例如活细胞到人或动物的软组织(尤其是神经组织)中的方法。此外,本发明涉及对应器件、提供该器件的方法、和所述提供中所用的设备。本发明涉及的医药装置或其他物体通过插入直接移植入所述组织时物理稳定性不足。具体地,本发明的医药装置是微电极或微探针例如电学或光学传感器。
背景技术:
移植入软组织的装置包括微电极。微电极在医药和相关领域具有广泛应用。原则上,单神经细胞或细胞组发射的电信号可被记录。单神经细胞或细胞组还可用该装置进行电刺激,并监控其对该刺激的响应。这使得用户可以选择其刺激产生治疗效果的细胞核。预期选择性刺激可产生比非选择性刺激更强的结果。脑或脊髓的刺激在脑细胞核降解或受损的情况下特别有价值。通过移植装置监控脑活性可用于控制药物局部递送或全身递送或控制脑细胞核的电刺激。在本发明中,微电极是含椭圆形电极体的挠性电极,所述导体的直径为亚毫米范围,具体为1μm-100μm,这对精确插入神经组织来说不够硬,容易在插入期间偏离插入所需路径。本发明中通过用硬基质包封代替或其从远端或顶端向近端方向延伸的至少部分来解决该问题,所述基质以基本低于插入速度的速率溶于水性神经或体液或被其降解。用于移植入软组织的物理上稳定性不足的装置还包括各种传感器例如葡萄糖传感器(其可用作控制胰岛素给药),和含光纤的辐射传感器。
由溶解或降解引起的基质片段较高的局部浓度成为问题。其暂时改变了靶神经细胞或神经细胞组的自然环境,并因此影响其行为,直到基质溶质从插入位置转运出去。通过对流或扩散从插入位置移除基质溶质耗费时间。移除所有或几乎所有该溶质之前,电极无法使用或仅可在该溶质影响下用于监控神经细胞或神经细胞组。含生物可溶性或生物可降解基质包封的微小椭圆形金属电极体的单电极和电极组公开于例如WO 2009/075625 A1。
另一问题是为了足够刚性以插入组织,基质需要在径向上基本大于电极体。该要求可能导致径向上电极体/基质的组合,引起插入该组合的组织的显著损伤。
另一问题是,由于对象之间的组织的功能管理和解剖学(尤其是脑组织)不同,微电极在组织中的最佳位置可能需要对应位置的反复插入和评估。本领域中基质覆盖的微电极无法良好适应反复插入,这是因为每次插入其都会损失一些基质材料,最糟的是在获得组织所需位置前其会损失大量基质材料从而刚性受损。这可能伴随着损失基质中掺入的药学或生物材料,这些材料可能对感兴趣的组织造成负面影响。
基质覆盖的微电极的其他问题或限制在于其插入软组织的速率受限:为了避免过度的组织损伤,微电极必须非常慢地插入。其插入越慢,基质材料以及(若存在)掺入到基质中的药学或其他试剂在插入路径中损失并且无法到达释放所需位置的风险越高。该问题在使用含冷冻生物材料的探针时尤其明显。
本领域基质覆盖的微电极的插入的另一问题时微电极引起的伤口出血。这会导致局部凝结血液粘着在基质表面,显著延缓其溶解或降解,并因此延缓微电极预定用途的使用。
另一重要问题是移植引起的神经组织刺激例如微电极导致神经元损失和星形细胞增殖(Lind G等,J Scientific Reports 3(2013);文章编号2942DOI:doi:10.1038/srep02942)。
G Lind等,J Neural Eng 7(2010)046005(doi:10.1088/1741-2560/7/4/046005)公开了明胶包埋的电极植入脑组织。植入脑中的明胶包被的金属微电极或微电极束显示出长时间的功能改善,伴随着急性组织响应减少。
发明目的
本发明的主要目的是提供前述类型的方法,解决与已知微电极和其他物体插入神经组织相关的一个或数个问题。神经组织包括脑和脊髓组织以及外周神经、背根神经节和视网膜组织。
本发明的其他目的是阻止或减少或停止沿着神经组织中用于医药装置或其他物体的插入路径的出血;保护相邻神经细胞免受该移植的负面影响;保存移植微电极和其他物体的纠正位置的能力;
本发明的其他目的是提供用于所述方法的设备;
本发明的另一个目的是提供生产该设备的方法。
本发明的其他目的将通过以下
技术实现要素:
、以附图形式说明的优选实施方式和所附权利要求书的描述而显见。
发明内容
本发明基于以下发现:神经细胞中填充有生物相容性水性凝胶(例如水性明胶凝胶)的通道可使医药装置或其他物体插入所述神经组织的植入,所述医药装置或其他物体对于直接插入神经组织来说物理稳定性不足。神经组织包括脑和脊髓组织。
本发明的通道优选旋转对称,更优选为圆柱形并具有相应纵向延伸的中央轴。本发明的通道优选是直的或基本直的,即为线形或基本线形。基本线形/直表示当其一端置于中央轴上时,穿过其另一端的直线与中央轴形成的夹角不大于10°,优选不大于5°。本发明的通道的长度基本大于其宽度,具体为5倍或10倍或20倍或更大倍数。所述通道的侧面和底面(前)由活神经组织形成。基于此原因或其他原因,通道的几何形状可随时间变化。具体地,通道的直径可随时间收缩。
生物相容性凝胶防止通道内径向的收缩并因此稳定通道的几何形状,至少持续凝胶基本未变化(即被酶降解或其他方式弱化)的时间。交联凝胶的使用可延长基本稳定的几何形状的时间,这可通过交联程度来调节。
可在生物相容性凝胶中插入(尤其是缓慢插入)微小结构,例如薄的纤丝或电极或光纤,而基本不影响其几何形状。慢速插入为最快至5mm/秒的速率,具体为1或2mm/秒。这与软组织(尤其是神经组织)对该插入的抵抗形成鲜明对比。通常,本发明的水性凝胶的抵抗比神经组织(特别是脑膜和其他纤维膜层)的抵抗低10倍或更多,尤其低25倍或更多。对穿透的抵抗的测量是给定尺寸的椭圆形针在以轴向远端方向施加于所述针上的恒定力影响下穿透限定深度所需的时间。
生物相容性凝胶是半透明的,其在使用通道上设置的光纤发射的可见光和近红外辐照中尤其有优势。
本发明还基于以下发现:本领域的基质稳定化的微电极或探针的插入可通过本发明方法改良。提供上述类型的通道可减少(甚至大量减少)在插入软组织期间维持其稳定所需的可被体液溶解或降解的基质材料的量。
本发明的水性凝胶通过接触凝胶形成剂和水性介质(具体是水性体液)而原位形成。对于形成本发明的通道,凝胶形成剂优选以干燥状态使用,例如以含少于20重量%的水、尤其含少于10重量%或5重量%的水的状态。
本发明的优选方面基于另一发现:通道中形成水性生物相容性凝胶(尤其是水性明胶凝胶)可具有神经保护效果,包括降低小胶质细胞对植入神经组织的医药装置的响应。
根据本发明,来自各种动物来源的明胶可用作凝胶形成剂,例如牛、猪皮、家禽皮和鲔鱼(tuna)明胶。优选哺乳动物来源的明胶,这是因为其在体温下优异的胶凝能力。为了形成长期稳定的通道,优选使用化学交联明胶,因其在体内降解速率较慢。有效明胶交联剂的示例为二(乙烯基磺酰基)甲烷和1-乙基-3-(3-二甲基氨基-丙基)碳二亚胺。其他有用的交联方法为UV辐照。可通过交联程度来控制体内降解速率,其继而可由所用交联剂的量所控制或由与交联给定量明胶所用的UV辐照的暴露所控制。
本发明其他水性生物相容性凝胶包括糖凝胶。本文有用的糖凝胶包括阿拉伯半乳聚糖凝胶、阿拉伯木聚糖凝胶、半乳聚糖凝胶、半乳甘露聚糖凝胶、地衣多糖多糖凝胶、木聚糖凝胶以及纤维素衍生物例如羟甲基丙基纤维素,且糖凝胶通过水性介质(尤其是水性体液)与选自下组的凝胶形成剂接触来形成:阿拉伯半乳聚糖、阿拉伯木聚糖、半乳聚糖、半乳甘露聚糖、地衣多糖、木聚糖、羟甲基丙基纤维素,以及与水性介质接触时形成凝胶的其他纤维素衍生物。
本发明其他水性生物相容性凝胶包括蛋白质凝胶。本发明所用的动物来源的除了明胶之外的蛋白质凝胶包括乳清蛋白凝胶、大豆蛋白凝胶、酪蛋白凝胶,其通过水性介质(尤其是水性体液)与选自乳清蛋白、大豆蛋白、酪蛋白的凝胶形成剂接触来形成。
本文所用的其他水性凝胶可通过水性介质(尤其是水性体液)与选自下组的凝胶形成剂接触来形成:阿拉伯半乳聚糖;阿拉伯木聚糖;半乳聚糖;半乳甘露聚糖;地衣多糖;木聚糖;纤维素衍生物例如羟甲基丙基纤维素;乳清蛋白;大豆蛋白;酪蛋白;透明质酸;壳聚糖;阿拉伯胶;羧基乙烯基聚合物;聚丙烯酸钠;羧甲基纤维素;羧甲基纤维素钠;支链淀粉;聚乙烯基吡咯烷酮;刺梧桐树胶;果胶;黄原胶;黄蓍胶;藻酸;聚甲醛;聚酰亚胺;聚醚;几丁质;聚乙醇酸;聚乳酸;聚乙醇酸和聚乳酸的共聚物;聚乳酸和聚环氧乙烷的共聚物;聚酰胺;聚酐;聚己内酯;马来酸酐共聚物;聚羟基丁酸酯共聚物;聚(1,3-二(对-碳苯氧)丙烷酸酐);通过与癸二酸或聚对苯二甲酸共聚合化形成的聚合物;聚(乙交酯-共-碳酸三亚甲基酯共聚物;聚乙二醇;聚二噁烷酮;聚丙烯富马酸盐;聚(谷氨酸乙酯-共-谷氨酸);聚(谷氨酸叔丁氧基羰基甲基酯);聚己内酯;聚(己内酯-共-丙烯酸丁酯);聚羟基丁酸酯和其共聚物;聚(磷腈);聚(D,L-丙交酯-共-己内酯);聚(乙交酯-共-己内酯);聚(磷酸酯);聚(氨基酸);聚(羟基丁酸酯);聚缩酚酸肽;马来酸酐共聚物;聚磷腈;聚亚氨基碳酸酯;聚[(7.5%二甲基-三亚甲基碳酸酯)-共-(2.5%三亚甲基碳酸酯)];
聚环氧乙烷;羟丙基甲基纤维素,聚(亚乙基-共-乙酸乙烯酯);异丁烯和至少一种其他重复单元(例如丙烯酸丁酯:甲基丙烯酸丁酯)的基于异丁烯的共聚物;取代的苯乙烯例如氨基苯乙烯,羟基苯乙烯,羧基苯乙烯,磺酸苯乙烯;聚乙烯基醇的均聚物;聚乙烯基醇和至少一种其他重复单元(例如乙烯基环己基醚)的共聚物;甲基丙烯酸羟甲酯;羟基-或氨基-封端的聚乙二醇;基于丙烯酸酯的共聚物如甲基丙烯酸、甲基丙烯酰胺,甲基丙烯酸羟甲酯;乙烯乙烯醇共聚物;烷基或芳基硅氧烷和至少一种重复单元的硅酮基共聚物;聚氨酯;硫酸乙酰肝素;RGD肽;聚环氧乙烷;硫酸软骨素;YIGSR肽;硫酸角质素;VEGF仿生肽;串珠素(硫酸乙酰肝素蛋白多糖2);含Ile-Lys-Val-Ala-Val(IKVAV)的层连蛋白α-1链肽;修饰的肝素;血纤蛋白片段。
本发明还公开了在神经组织中形成线形通道用于移植医药装置或其他物体的设备,所述医药装置或其他物体对直接插入神经组织来说物理稳定性不足。形成通道的设备包括具有前端和后端的椭圆形刚性针和含本发明干燥凝胶形成剂的层或由干燥凝胶形成剂组成的层或由所述刚性针和所述层组成,所述凝胶形成剂位于从前端以远端方向延伸的针的部分上并包封所述部分。本发明中,凝胶形成剂指通过接触水性流体例如水性体液形成凝胶的干燥试剂。所述凝胶形成剂的层的水含量少于20重量%、优选少于10重量%、最优选少于5重量%或2重量%。特别优选的凝胶形成剂是明胶。
所述针优选为旋转对称,尤其是圆柱形,并包含中央轴。“圆柱”包括具有椭圆或相似椭圆形底面的圆柱体。优选凝胶形成剂的层的长度至少对应于组织中形成的通道深度。优选所述针的长度大于通道长度,例如长10%或30%或更多。所述针由刚性材料制成,尤其是尽可能刚性的材料,从而提供所述装置的径向尺寸越小越好以最小化其对插入组织的损伤。具体合适的材料包括钢、钛、钨、铪和铱。另一具体合适材料是丙烯酸酯或环氧聚合物,优选用纤维(特别是碳纤维)加强。
根据本发明的优选方面,通道形成设备包括针中的流体通路,其以轴向设置的通道形式设置,在其后部可连通,并且不覆盖凝胶形成剂。通路或通道从针的后端向前端延伸并在其正面或正面附近形成开口。
根据本发明的优选实施方式,轴向设置的通道包含一种或多种径向延伸通道,其在所述针的圆柱面开口但并不延伸通过其上设置的凝胶形成剂层。根据优选的改良,径向通道的侧开口可通过体液可溶解的材料进行栓塞。根据另一优选改良,轴向延伸通道的远端可以相同方式栓塞或永久性栓塞。提供轴向和/或径向延伸通道,允许注射水性流体以影响所述针周围形成的凝胶的结构。提供该通道还允许注射含药学活性剂的水性流体,或继续注射含不同药学活性剂的流体。其还允许注射低粘度水性凝胶,该凝胶可包括药学活性剂或其他试剂,例如营养物如葡萄糖。
或者或此外,药学活性剂可纳入含凝胶形成剂或由其组成的层中。优选的药学活性剂包括凝结剂、抗凝剂、抗生素、渗透压调节剂、抗炎剂、营养物、刺激生长的因子、刺激细胞分化的因子、激素。提供该通道(尤其是轴向通道)还允许注射活细胞。
根据本发明另一优选方面,所述设备包括电极器件和/或光纤器件,或者增加到轴向设置通道里,或者独立存在。所述电极器件和/或光纤器件允许在插入和凝胶形成期间监控电活性并提供视觉控制。
根据本发明的另一优选方面,包含干燥凝胶形成剂或由其组成的层可由移植期间与组织摩擦力减小的材料层覆盖。提供所述摩擦力减小的层(减少摩擦层)避免或减小移植程序引起的损伤。其还可减小移植期间将表层组织的细胞(如脑膜成纤维细胞)带入深层组织的风险。合适的减少摩擦涂层材料包括聚乙烯基醇、几丁质、透明质酸、和US 2008234790 A1公开的试剂,其通过引用纳入本文。
本发明的神经组织通道中的水性生物相容性凝胶可由多于一层,尤其是二层或三层组成。所述层可相对所述通道进行径向和/或轴向取向。成层的凝胶的物理特性可不同,尤其是其溶胀特性和/或其生物可降解特性和/或其药学活性剂含量可不同。
根据本发明的优选实施方式,所述凝胶包括径向设置的外层和内层,所述外层比内层物理上更稳定,例如其通过交联对比未交联的内层。
根据另一优选实施方式,轴向设置的物理稳定的外凝胶层(例如交联层)环绕低粘度凝胶内层或水性液体层。水性凝胶层可通过将针插入神经组织来形成,所述针由一层置于另一层之上的两层或更多层覆盖,所述层呈径向或轴向相邻或二者均有。
本文所述通过填充有本发明凝胶(尤其是明胶)的通道移植入神经组织的药物装置或其他物体不减小或至少基本不减小移植物临近的神经组织中的神经元密度。
根据本发明,通过填充有本发明凝胶(尤其是明胶)的通道移植药物装置或其他物体进入神经组织减少通道壁的出血。
根据本发明,在人或哺乳动物的神经组织中提供椭圆形线性通道的方法,所述通道用于通过插入所述通道将医药装置或其他物体移植入所述组织,所述装置通过直接插入移植入所述组织时物理稳定性不足,所述方法包括:提供通道形成设备,含旋转对称的,尤其是圆柱形的刚性针,所述针的长度超过提供待提供的通常长度并且具有前端和后端,所述针从其前端向其后端延伸的部分用凝胶形成剂包封或含凝胶形成剂,所述延伸的长度至少对应于通道长度,其中凝胶形成剂是能在与水性体液接触时形成水性凝胶的干燥试剂,用凝胶形成剂包封或含凝胶形成剂包括少于20重量%的水,优选少于10重量%的水,尤其少于5重量%或2重量%的水;将所述针以其前端朝前插入神经组织;通过凝胶形成剂与水性流体接触在所述针周围形成水性凝胶;从凝胶中退出所述针;其中所述针足够刚性从而能在没有包含凝胶形成剂或由凝胶形成剂组成的层时插入神经组织。
本发明范围内提供的针的圆柱形壁具有两层或更多层凝胶形成剂,所述不同层的凝胶形成剂的结构和特性不同,例如生物稳定性不同或形成的凝胶强度不同。所述两种或更多层可置于彼此之上和/或以轴向方向彼此相邻。本发明通道中形成的凝胶会反映所述针上凝胶形成剂的层或含凝胶形成剂的层的位置。例如,覆盖所述针的圆柱壁的部分(继而被第二次覆盖)的第一层在所述针插入神经组织而接触体液时会形成中央设置的圆柱凝胶部分,其被管状凝胶部分环绕。
本申请中,“其他物体”包括活细胞和细胞簇,尤其是在冷冻水性悬液中的活细胞和细胞簇。
根据本发明的优选方面,公开了前述类型的方法,包括鉴定神经组织中靶标相对于组织中需要设置的通道的前端的位置,所述方法包括:
i)提供包含具有前端和后端的椭圆形刚性针的通道形成设备,所述针的从前端以轴向延伸的部分由凝胶形成剂覆盖;
ii)提供与所述组织的接触;
iii)定位所述靶标的在组织中的空间位置;
iv)任选定位所述靶标附近的空间位置;
v)就所述设备定位组织的接触面上的插入点的空间位置;
vi)将所述针的前端置于插入点上,同时将所述针的方向对应于连接插入点和靶标或接近靶标的空间位置的直线所限定的插入路径;
vii)沿着所述插入路径将所述针的前端插入所述组织至所述靶标或空间位置限定的深度;
viii)持续足够的时间以允许所述针周围形成凝胶;
ix)任选通过成像技术或通过记录神经活性来获得有关凝胶形成的信息;
x)从所述凝胶退出所述针。
用于移植的优选装置是物理稳定性不足的微电极。任选地,所述微电极可为微电极束或阵列包含的微电极。
用于移植的特别优选的装置是椭圆形微电极。对于给定的直径,插入期间微电极弯曲的风险随着其长度而显著增加。用于移植的优选物体是活细胞或细胞簇,尤其是在冷冻水性悬液中。
本领域合适的微电极材料是已知的并包含金、铂、钨、钛、铜、银、铝和其合金。微电极的其他合适材料包括i)导电聚合物和ii)不导电聚合物,包括形成天然纤维的聚合物、由导电金属或金属合金(例如前述金属或金属合金)覆盖的此类聚合物的核心。
本文中“椭圆形”指微丝形式的微电极,其具有前(远)端和后(近)端,长度为其直径的多倍,例如5倍或10倍或50倍或200倍或500倍或更多。用于本发明的微电极的直径可从纳米范围,例如从100nm或500nm或从1μm或2μm或5μm至20μm或50μm或100μm。尤其适用于本发明的微电极是移植入神经组织的物理稳定性不足的微电极,所述移植通过将其插入从外部可接触并通过外科手术形成的组织表面而进行。“物理稳定性不足”指该微电极以其前端朝前插入神经组织会有其前端弯曲而离开插入所需路径的风险。这会导致电极前端没有按所需设置,例如未置于与神经细胞或神经细胞簇或神经组织的其他光学或径向可区分组件的所需空间关系处。此外,“物理稳定性不足”包括可压缩和/或可回弹的弹性微电极。
用于移植的其他优选装置为直接插入软组织的物理稳定性或刚性不足的光纤,其与所述微电极都有一种或多种物理特性但其导电性不同。除了其端面允许辐照进入和退出,光纤可由导电材料层覆盖,从而具有微电极的功能。
用于移植的另一优选装置是直接插入软组织的物理稳定性或刚性不足的微探针或微传感器。
本发明方法,无论其是否包括鉴定神经组织中靶标相对于需要设置的通道的前端的位置,所述方法可包括导电针,其还可用作临时电极,所述针包括金属、金属合金或导电聚合物或其他导电非金属材料例如碳或由其组成,优选的金属选自:金、银、铜、铂、铱、钛、铬、钨、铝、及其合金,钨、铱和不锈钢中任何均特别优选;蛋白质或碳水化合物或其混合物作为能与体液接触形成凝胶的试剂,优选试剂选自:明胶、透明质酸和其药学上可接受的盐、化学修饰的明胶和透明质酸,例如通过交联和/或部分水解,特别优选天然明胶;以导电形式关联或接近所述针的后端的导电导线;关联所述导线的电压监控装置或电源;与水性体液接触能形成凝胶的试剂所包含的药学活性剂,优选自凝结剂、抗凝剂、抗生素、渗透压调节剂、抗炎剂。根据本发明另一优选方面,所述装置是或包括微电极和/或光纤、微探针或微传感器,例如胰岛素或葡萄糖探针,其能监控/感应组织中生物试剂,例如胰岛素或葡萄糖,的浓度。
或者,本发明方法可包括基本不导电的硬针,尤其是聚合材料的针,所述材料例如聚碳酸酯、聚苯乙烯、聚氯乙烯和聚丙烯酸酯。所述针可由形成水性凝胶后便于退出的材料组成或由其覆盖。聚对二甲苯-C、硅酮橡胶和是该目的特别有用的材料。
根据本发明的优选方面,公开了用于移植活细胞至神经组织的方法,包括:
i)提供在注射器或吸头或其他注射悬液的装置中的活细胞水性悬液;
ii)根据本发明在人或哺乳动物的神经组织中形成通道的方法在所述组织中形成线形移植通道用于移植医药装置到所述组织中,包括或不包括鉴定神经组织中靶标相对于需要设置的通道的前端的位置,
iii)将所述注射器针头插入所述移植通道中的所需深度;
iv)将所述活细胞的水性悬液注射入所述移植通道;
v)退出所述注射器或吸头;
前提是可在退出前和/或期间进行注射。
根据本发明的优选方面,所述注射器针头可用材料覆盖,所述材料接触水性体液时形成凝胶,例如明胶,并且本发明的线形移植通道可通过使用如此覆盖的注射器针头作为针而形成。
根据本发明的另一优选方面,公开了移植活细胞至神经组织的方法,所述方法包括鉴定神经组织中靶标相对于需要设置的通道的前端的位置,包括:
i)提供附于插入棒顶端的活细胞的冷冻水性悬液;
ii)根据本发明在人或哺乳动物的神经组织中形成通道的方法在所述组织中形成线形移植通道用于移植医药装置到所述组织中,包括或不包括鉴定神经组织中靶标相对于需要设置的通道的前端的位置,
iii)将所述棒以顶端朝前插入所述移植通道中的所需深度;
iv)融化所述冷冻悬液;
v)退出所述棒。
根据本发明另一优选方面,公开人或哺乳动物的神经组织中用于移植医药装置的线形(优选圆柱形)通道,所述通道填充有通过接触体液和本发明的干燥凝胶形成剂而形成的凝胶,所述凝胶形成剂尤其选自下组:明胶、透明质酸和其盐、化学修饰的明胶、化学修饰的透明质酸和其盐。化学修饰的明胶和化学修饰的透明质酸部分包括水解降解的明胶和透明质酸和/或交联的明胶和透明质酸。然而所述通道可能但不优选为圆柱形意外的其他形式;可通过使用相应形成的针来提供方形或其他径向截面的通道。圆柱形通道可包括与通道直径相同的两个或更多水性凝胶的圆柱形层或水性凝胶的中央圆柱形层由水性凝胶的外周层环绕。
术语“圆柱通道”包含径向截面为椭圆形式的圆柱通道。
接下来通过参照多种优选实施方式来更详细描述本发明,所述实施方式由非成比例的粗略图说明。径向尺寸显著放大。所有图为轴向或径向截面。
附图说明
图1a-1f显示本发明在人或哺乳动物的神经组织中提供通道用于移植医药装置的方法及所产生的通道,所述方法包括鉴定神经组织中靶标相对于需要设置的通道的前端的位置;图1c-1f显示本发明方法的变体,其中靶标的问题不通过辐照期间鉴定;
图1g,1h显示本发明的移植微电极至神经组织中的方法,所述方法通过本发明方法将微电极插入通道,以及显示如此移植的微电极;
图2显示根据本发明方法移植的微电极,其位置固定于相邻骨组织;
图3显示根据本发明的设备,所述设备用于在神经组织中形成通道用以插入微电极或其他装置;
图4显示图1g-1j的微电极;
图5显示根据本发明的设备,所述设备用于在神经组织中形成通道用以插入微电极或其他装置,所述设备包括光纤;
图6显示根据本发明的设备,所述设备用于在神经组织中形成通道用以插入微电极或其他装置,所述设备包括光纤和电极;
图7和7a显示根据本发明的设备,所述设备用于在神经组织中形成通道用以沿轴向A*-A*(图7;图7a显示放大的该部分)截面插入微电极或其他装置,所述设备除了包括干明胶覆盖的圆柱形针和光纤移机电极器件外还包括所述针中的轴向延伸通路,其用于从所述设备的远端面处的通道开口注射流体材料至通道中;
图8、8a、8b和8c显示根据本发明的设备,所述设备用于在神经组织中形成通道用以沿轴向A**-A**(图8;图8a显示放大的该部分)截面和径向B-B(图 8b,8c,进一步放大)截面插入微电极或其他装置,所述设备除了包括干明胶覆盖的圆柱形针和光纤移机电极器件外还包括所述针中的轴向延伸通路,其用于从所述设备的远端面处的通道开口注射流体材料至通道中,所述设备还包括从所述轴向延伸通路径向延伸的通路,所述设备的变体的径向延伸通路示于栓塞的干燥(dry)图8c中;
图9、9a、9b、9c显示根据本发明的设备,对应于图8、8a、8b和8c,其中明胶层上提供有减少摩擦剂层;
图10显示图9所示设备的变体,在相同的部分,明胶层被第一减少摩擦层(从所述针的远端以近端方向延伸)和含抗凝剂的第二层(从所述减少摩擦层的近端以近端方向延伸)所覆盖;
图11、11a、11b、11c显示本发明的圆柱形针的四种实施方式,所述针覆盖有一种或多种干燥凝胶形成剂的层,所述凝胶形成剂用于在神经组织中在轴向(通道轴)截面产生填充有水性凝胶的相应圆柱形通道;
图12、12a、12b、12c显示本发明神经组织中填充有一层或多层水性凝胶的圆柱形通道的四种实施方式,其分别由图11、11a、11b、11c所示的以轴向(通道轴)截面移植的针所产生。
具体实施方式
实施例1.确定靶标、通道前(底)端、通道后(顶或开口)端的位置,提供插入通道形成设备的指导信息
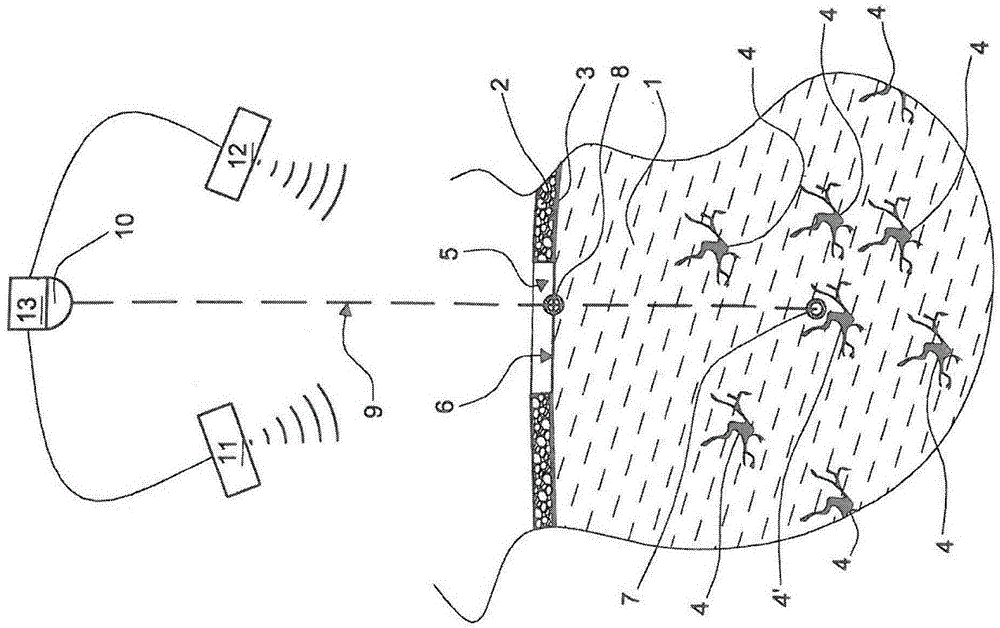
图1是哺乳动物脑1的截面代表图,相邻部分为头骨2和硬膜3。头骨2上提供通孔5,在移除硬膜3的部分后通过该孔可解除脑组织1的表面6。在脑组织1中显示含100或更多细胞4的大量神经细胞或细胞簇。其中之一4’鉴定为使用微电极的可能的神经细胞所需靶标。靶标神经细胞/细胞簇4'的位置通过使用与控制单元13电连接并受其控制的两种图像系统(例如计算机断层扫描术(CT)11和磁共振成像(MRI)12)的组合来确定。基于位置信息,控制单元13的微处理器确定通道形成设备(20,图3)的插入轨迹9,其通过控制单元13所控制的激光束10观察。控制单元13还确定靶标神经细胞4'簇附近路径上的点7,其对应于待形成的通道(23',图2)的远端,限定通道形成设备的插入深度(20,图3)。还确定插入路径9上的点8,激光束在该处命中脑组织4的游离表面6。点8代表通道形成设备(20,图3)插入脑组织1中的点。
实施例2.本发明的通道形成设备及其生产的第一实施方式
本发明的通道形成设备20以轴向A-A截面显示在图3中。通道形成设备20包括刚性材料的硬圆柱形针21和针21的部分上的明胶层22,所述层明胶层从其前(远)端21'向其后(近)端21”延伸。明胶层22可被其他试剂的对应层替代,所述试剂与身体接触能形成凝胶,例如透明质酸或PEG或此类试剂的组合。层22的轴向延伸至少对应于待形成的通道的深度。针21的直径小于待形成通道的直径且应尽可能小。所述针上层22的厚度用过待形成的通道的所需宽度来确定。针21应向其远端渐细,例如通过末端尖锐或圆化尖端形成,尤其是圆锥形圆化尖端。针21的材料并不重要但应提供对明胶或其他试剂的层22的良好粘附,所述试剂接触水性体液后能形成凝胶。另一方面,所述针的材料或覆盖所述针的表面的材料应在干燥凝胶形成剂接触水性体液后容易释放所形成的水性凝胶,即应提供对所形成的水性凝胶的良好粘附。使用聚氟化磺酸材料例如覆盖的针21形成可以接受的损伤。其他有用的材料包括各种类型的硅铜。有用的针21材料包括钢、铝、聚碳酸酯、聚醚、玻璃、陶瓷,以及钛、金、铂和其合金。它们可被(例如)薄层聚氟化的材料或硅酮覆盖,或其表面可硅烷化。
通道形成设备20可通过例如提供明胶的水性溶液和不锈钢的针21来生产。明胶溶液的粘度通过温度和浓度来控制,从而使其明显粘稠但不胶凝。针21浸入明胶溶液中,然后退出,水平设置并旋转。针21上的明胶溶液的干燥可通过加热和/或真空来加速。
重复浸入步骤直到在针21上形成所需厚度的明胶层22。为了避免干燥明胶溶解,针21从明胶溶液中快速退出。
在生产通道形成设备的另一方法中,通过用对应水溶液的喷涂将明胶或接触水能形成凝胶的其他试剂施用于针21。
在生产通道形成设备的另一方法中,使用所需形状的模具生产通道形成设备。在优选实施方式中,两片层丙烯酸类材料(各含相同尺寸的半圆柱体模塑部分,构成圆柱体模具)以相邻位置安装,它们的轴围绕本发明圆柱形针排列,所述针的轴在模具中居中。所述片层通过所述模具外周设置的大量螺杆保持相邻位置。所述模具的径向尺寸稍大于所述针的径向尺寸。在所述模具的一个轴末端处提供通道,通过该通道将凝胶形成剂的浓缩水溶液注射入针和模具壁之间的空间。注射在溶液不胶凝的温度下进行。然后通过松动螺杆来缓慢释放模具的片层,允许接触空气干燥。干燥至水含量约2重量%后,从模具中移出覆盖有干燥胶凝剂的针。继而所述胶凝剂可用材料例如覆盖,阻止干燥的胶凝剂与水性体液接触从而阻止胶凝开始以及结束。
实施例3.形成移植通道
形成本发明移植通道的优选实施方式如图1b至1f所示。
放置本发明的通道形成设备20,其前端21'位于可接触的脑组织4表面6上的插入点8,且其轴A-A与插入轨迹线9并列(图1b)。然后通过对设备20的无凝胶层22的后部分施压而将设备20沿着轨迹线9插入组织4。可手动施压和插入或通过使用合适的微操纵器(未显示)。设备20插入所需深度,即直到其前端达到插入轨迹或路径的前端7(图1c)。插入应尽量快以避免层22中的明胶在插入期间被水性体液溶解。完全插入后,将设备20留在完全插入位置(图1c),直到明胶层22完全被水性体液溶解并且在针21周围形成明胶23的管状层(图1d)。针21和明胶23的管状层的组合构成图1d中轮廓24所示的前通道。由于明胶层22的轴长度超出插入深度并且因此超出其接触水性体液的轴向延伸,明胶层22的近末端部分22’不溶解。在后续步骤中,将针21沿着插入路径9从凝胶23中退出(方向R)。退出针21从前通道的体积中去除了针21的体积,从而形成图1e轮廓24'所示的本发明通道。图1f(放大图)显示退出针21的起始阶段,其中明胶23'的远端部分收缩至通道24'的直径并采用圆柱形,同时明胶23的邻近部分仍为管状。完全退出后,形成填充有明胶23'的移植通道24(图1e)。使用含在水性体液中可溶或可降解基质的物理稳定化的微电极时,形成通道24的明胶含量可减少。
通过使用交联明胶或其他交联凝胶形成剂,可在退出针后于组织中保留填充有水性体液的通道。所述通道被交联凝胶的圆柱形壁环绕。对于插入本发明的物理上不稳定的微电极或其他探针或传感器至软组织中特别有用。
实施例4.含光纤器件的本发明另一设备的第二实施方式
根据本发明的设备的第二实施方式50示于图5。聚丙烯酸酯的针51包封居中(轴A’-A’)的光纤55,所述光纤从所述针的前端51’以近端方向延伸,使所述针靠近其另一端,从而以斜交角从针的圆柱壁突出。或者所述光纤可以居中位置延伸通过整个针并将针置于其近端。针51的侧壁由干燥明胶的层51覆盖,所述层从远端51’延伸至光纤55从圆柱形壁突出的远端位置。针51的前端面未覆盖明胶。这使得辐照可从光纤55的前端出现而不受位于针51前端之前的组织的阻止和/或检查。
实施例5.含光纤和电极器件的本发明另一设备的第三实施方式
根据本发明的设备的第三实施方式60示于图6。其为第二实施方式的改良,其中还包括电极功能。通过针61上的导电金层66提供电极功能,其包封中央设置的光纤65并且与针61的(A”-A”)共有中央轴。除了靠近其远端的短部分,金层66用漆67电绝缘。金层66与控制单元(未显示)通过绝缘导线68电连接,所述导线连接其近端处的金层66。干燥明胶层62覆盖金层66的绝缘和非绝缘部分。
实施例6.微电极
本发明可使用广泛类别的微电极。所述微电极除了应为椭圆形之外其设计并不涉及本发明,且其通常适用于本发明方法所述的移植。图4显示由波形薄金属线31组成的微电极30,所述金属线具有游离前(远)端并将其另一端(后、近)连接偶联元件32;偶联元件优选置于头骨的明显较远处。例如,所述偶联元件32继而连接与线31导电关联的薄绝缘金属导线33,所述线31除了其前端之外还可为电绝缘的,所述前端用作活性电极顶端。微电极30的物理稳定性不足以允许其直接插入脑组织1,这归因于由其灵活性和不均匀的神经组织引起的来自其预期插入路径的挠曲。本发明所用的微电极的直径优选为亚毫米范围,尤其是亚200μm范围。本发明所用的微电极的长度并不重要,并且可最多至100mm或更多。
实施例7.微电极移植
将微电极30移植入脑组织示于图1g和1h。微电极30最初置于通道24'上方(图中轮廓所示),其游离前端邻近通道24'的开口端,与通道24'的中央轴B-B(图1e)近似并列,然后部分插入(方向F)所述通道24'(图1g)和,最终完全插入(图1h)。由于凝胶23'的性质,微电极4插入的径向误差可在插入期间或通过部分退出和重插入来纠正。其他装置例如光纤可通过相同方法植入。
实施例8.植入和位置固定的微电极
对于长期使用,可将移植微电极30或其他设备的位置固定。该固定的原理示于图2。电极体31置于所需位置时,偶联元件3由弹性挠性聚合物的箝位固定器41保持,所述固定器安装在锁40中的通孔处,其在头骨2的开口5处与之胶合。这种排列保护头骨中的伤口免受感染。其他装置可以对应方法固定。
实施例9.与邻近神经细胞的移植相互作用的评估
为了评估组织中环绕移植电极的明胶的效果,比较移植的大鼠脑6周后的组织学反应与移植的SU-8制成的平板(约7μm厚、140μm宽和2.5mm长)测试装置,其包埋有薄层(5-10μm)明胶或未包埋。
手术程序所有动物相关程序根据当地和国际伦理直到进行,得到Lund和伦理委员会的允许,日志编号M258-11。所有移植(n移植=16)在重量200-250g的磁性Sprague-Dawley大鼠(大鼠数量=8,丹麦泰克尼克公司(Taconic,Denmark))中进行。动物用腹膜内注射芬太尼(0.3mg/kg体重)和Domitor vet(盐酸美托咪定,0.3mg/kg)麻醉并置于立体定向框架中用于手术。沿着头骨的中央缝线进行皮肤纵切以暴露前囟点。形成约2mm直径的开口,距前囟点尾部1.0mm和中线横向2.3mm。用镊子和注射器切开硬膜。为了便于操作和移植,测试装置安装在不锈钢引导线(长约3mm,直径50μm)上,使用蔗糖溶液作为粘合剂,然后用微操纵器移植入皮层至2.0mm深度。在大鼠(n=8)大脑皮层中将包封测试装置的明胶移植入一个半球并将未包封测试装置移植入另一半球。用生理清洗皮质表面溶解蔗糖后,将引导回缩并移除,用FujiChem硅橡胶填充头骨的开口,连接植入物至头骨。之后用外科钉闭合伤口。动物接受麻醉的解毒剂(Antisedan,盐酸阿替美唑,0.5mg/kg b.w.)以及Temgesic(丁丙诺啡,50μg/kg b.w.)的皮下注射以减少术后疼痛。
6周后,用过量戊巴比妥腹膜内注射(i.p)麻醉动物,并穿过贲门灌注150-200ml冰冷的0.1M磷酸盐缓冲液(PB),然后灌注0.1M PB中的4%多聚甲醛(PFA)。在4%PFA中对所述脑后固定过夜,然后在30%蔗糖中浸没至少24小时以冷冻保存。然后用低位恒温器(Microm HM560)对其进行30μm水平面连续切片。以无漂浮方式将所述切片保存于抗冻剂中。
用标准无漂浮免疫组化技术(Lind等2013)对星形胶质细胞增殖、神经细胞体和小胶质细胞的募集进行评估。简而言之,脑切片与一抗室温反应过夜。所用一抗为识别胶质细胞原纤维酸性蛋白(GFAP,星形细胞骨架蛋白,1:5000,丹麦大科公司(Dako,Denmark))的兔多克隆抗体和识别CD68/ED1(由活性小胶质细胞/巨噬细胞表达,1:100,美国赛罗泰克公司(Serotec,USA))或NeuN(神经元细胞核上表达,1:100,美国Millipore公司)的鼠单克隆抗体。用PBS重复清洗后,进一步用小鼠IgG的Alexa488-偶联抗体和兔IgG的Alexa594-偶联抗体孵育脑切片(1:500,美国英杰公司(Invitrogen,USA))(室温避光2小时),并用PBS清洗。
安装在尼康Eclipse 80i显微镜上的DS-Ri1数字相机(日本尼康器材公司(Nikon Instruments,Japan))用于组织学荧光成像分析。用NIS-Elements BR软件3.2(NIS-elements,日本尼康器材公司)获取图像并分析。不同评估方法用于不同染色。对于神经元NeuN染色进行手工计数,而对如前所述的胶质标记物GFAP和ED1(Lind等,2013)则使用荧光强度测量。感兴趣的区域(ROI)设在测试装置所处位置的0-50μm(内ROI)和50-200μm(外ROI)处。分析置于测试装置中央部分邻近处的脑切片,其对应于皮层叶片4。为了分析神经细胞存活率,还在设置于皮层的未处理区域中的相同ROI中对匹配的NeuN-阳性细胞进行计数,并作为对照。
使用Wilcoxon匹配对标记评分测试。P值<0.05被认为具有显著性。用GraphPad Prism 5.02软件进行分析(美国GraphPad软件公司)。
显著的星型胶质细胞反应以及显著的小胶质细胞响应限制在移植的测试装置的内ROI中。相比未包封实验组,包封在明胶中的测试装置的小胶质细胞(ED1)密度产生统计上显著(p<0.05)的降低。相反,在包封和未包封测试装置的星状细胞密度之间没有观察到差异。在所有实验组中,将内和外ROI中的神经元密度与未处理组织中的神经密度比较。相比对应对照(未处理的脑),未包封测试装置周围发现神经元密度显著降低(P<0.05)。相反,明胶包封测试装置周围的组织中的神经元密度未减低。任何外ROI中的神经元密度均为观察到与对照相比的差异。结论是明胶包封显著降低小胶质细胞对移植测试装置的响应。此外,相邻明胶包封移植物的神经元密度没有减少的趋势,而未包封移植物的相邻组织中神经元数量显著下降,表明明胶包封具有神经保护性。
实施例10.本发明设备的第四实施方式,包含用于流体远端注射的流体通路器件
根据本发明的设备的第四实施方式70具有近端70”、远端70’和横向圆柱面78示于图7和7a。其为第三实施方式的改良,其中还以针71中的中央(轴A’-A’)轴向延伸通道75的形式包含流体通路器件。主要的圆柱通道75由置于针71的轴向膛中的挠性管73形成,所述管73的内壁由高导电率金属(例如银或金)薄层74覆盖。层74可用作电极但也可忽略。挠性管73优选为透明聚合物材料例如丙烯酸盐,并因此能导光和用作光纤。距离设备70的近端70”短距离处,挠性管73完全远离中央轴A’-A’,从而从针71的横向面78突出。干燥明胶层72覆盖针71的横向面78的部分,从前端70’向远端70”附近延伸,但未覆盖针71的远端正面77并因此未覆盖通道75的远端开口。
通道75可用于注射从其远端出现的流体材料。流体材料可为例如药学活性剂的水溶液,所述药学活性剂例如神经递质(例如多巴胺或乙酰胆碱或组氨酸)。轴向通道75还可用作吸取流体材料,尤其是在从组织退出针71期间。流体材料还可包含营养物例如葡萄糖,并且可经氧化以减少移植后的低血糖和缺血。
实施例11.本发明设备的第五实施方式,包含用于流体横向注射的流体通路器件
根据本发明的设备的第四实施方式80具有近端80”、远端80’和横向圆柱面78示于图8、8a、8b。其为第四实施方式的改良,其还以针81中的中央轴向设置(轴A**-A**)的延伸通道85的形式包含流体通路器件。主要的圆柱通道85由置于针81的轴向膛中的挠性管83形成,所述管83的内壁由高导电率金属(例如银或金)薄层84覆盖。层84可用作电极但也可忽略。挠性管83优选为透明聚合物材料例如丙烯酸盐,并因此能导光和用作光纤。距离设备80的近端80”短距离处,挠性管83完全远离中央轴A**-A**,从而从针81的横向面88突出。水含量为约2重量%的干燥明胶层82覆盖针81,从近端80’向远端80”延伸但未覆盖含挠性管83的远端开口的针81的远端正面87。径向延伸通道86从轴向通道85分支。其可用作在干燥明胶层82转化为水性凝胶后注射从其横向面出现的流体材料。该流体材料可为例如加速干燥明胶层82向水性凝胶转化的试剂,但也可包括或还包括药学活性剂例如神经递质(例如多巴胺或乙酰胆碱或组氨酸)。
横向通道86还可用作吸取流体材料,尤其是在从组织退出针81期间。轴向设置的通道85可在其远端栓塞或开口,栓(未显示)由永久材料或随时间溶解或降解的材料组成,例如交联明胶。缺少金属层84的第五实施方式的变体也包括在本发明中,其为缺少挠性管83或其从远端80’向近端方向延伸部分的变体;在该情况中,挠性管83倍高导电率的金属管替代。径向延伸通道86,例如设置在径向平面(图8b)中的四个通道86,从轴向设置的通道85延伸穿过挠性管83和金属层84壁,但不穿过干燥明胶层82。径向衍生通道86的外周末端部分可由水性流体中可溶的材料制成的栓87(图8c)进行栓塞;这样便于用明胶覆盖针81以形成干燥明胶层82,从而避免堵塞径向延伸通道86。
实施例12.包括减少摩擦层的本发明设备的第五实施方式的第一改良
图9、9a、9b、9c所示的本发明设备的实施方式90对应于图8、8a、8b、8c所示的实施方式80,除了其在相同轴向延伸的干燥明胶层82’上还包含减少摩擦层89。参考编号81’和83’至88’所指特征与图8、8a、8b、8c所示实施方式的特征81和83至88为相同类别。中央轴A+-A+对应于图8的中央轴A**-A**。参考编号90’和90”分别指示针81’的远端和近端。截面B+-B+对应于图8的截面B-B。
实施例13.包括减少摩擦层的本发明设备的第五实施方式的第二改良
图10所示的本发明设备的实施方式91对应于图8、8a、8b所示的实施方式80,除了其在干燥明胶层82’上还包含两个相邻层92、93,所述干燥明胶层与层92、93的总延伸具有相同的轴向延伸。
近端设置的层92包含防止从通道中出血的凝结剂,所述通道由将设备91插入神经组织而形成,而远端设置的层93是减少摩擦层,用以使插入针81”期间的组织损伤最小。参考编号82”、86”至88”所指特征与图8、8a、8b所示实施方式的特征82和86至88为相同类别。中央轴A++-A++对应于图8的中央轴A**-A**。参考编号91’和91”分别指示针81’的远端和近端。
实施例14.本发明设备的实施方式,其中所述针由一层或多层凝胶形成剂覆盖
图11、11a、11b、11c以主要方式显示本发明设备100、100a、100b、100c,其中针101的圆柱面(除了从近端延伸短距离的部分)由一个或多个凝胶形成剂层在不同位置覆盖。图11所示的实施方式100中,针101由一层凝胶形成剂102覆盖。在图11a所示的实施方式100a中,针101由凝胶形成剂的内层102覆盖,其又由凝胶形成剂的外层103覆盖。图11b的实施方式100b中,针101由从其远端向近端延伸约一半的第一层104覆盖,并由邻接所述第一层104的近端并从该处延伸至针101的近端附近的第二层102覆盖。在图11c所示的实施方式100c中,针101由两个内层102、104覆盖,所述内层以与图11b实施方式的层的相同方式设置,所述内层102、104继而被外层103覆盖。
实施例15.填充有一层或多层水性凝胶的本发明神经组织中通道的实施方式
图12、12a、12b、12c以主要方式显示本发明神经组织105中的通道,其填充有一层或多层水性凝胶102*、103*、104*,所述凝胶分别由图11、11a、11b、11c中所示的本发明设备100、100a、100b、100c的针101上的相应干燥凝胶形成剂层102、103、104通过与从神经组织105渗出的水性体液接触所形成。图12的通道均匀填充有水性凝胶102*。图12a的通道填充有中央凝胶圆柱体102*,其由邻接通道的圆柱组织壁的管状凝胶圆柱体103*环绕。从图12b的圆柱通道的底部延伸至约其一半高度的部分填充有第一水性凝胶104*,所述通道的其余上部分填充有第二水性凝胶102*。图12c的通道的中央圆柱部分在图12b的相同位置填充有第一104*和第二102*水性凝胶,并由延伸覆盖了层102*和104*的组合高度的水性凝胶管状层103*环绕。通过采用凝胶形成剂的特性,可设计水性凝胶,例如具有所需粘度或生物降解抗性的水性凝胶。还可在干燥凝胶形成剂中纳入非胶凝剂,例如药学活性剂和营养物,从而产生含非胶凝剂的对应水性凝胶。
- 还没有人留言评论。精彩留言会获得点赞!