进行性骨化性纤维发育不良的治疗的制作方法
相关申请的交叉引用
本专利申请根据35usc119(e)要求2014年9月12日提交的美国临时申请62/049,869和2015年4月1日提交的美国临时申请62/141,775的权益,这两个美国临时申请的公开内容全文以引用方式并入本文。
背景技术:
进行性骨化性纤维发育不良(fop)为一种常染色体显性障碍,其特征为早发、阶段性以及骨骼肌和相关结缔组织的逐渐骨化。fop是由acvr1的细胞内结构域(alk2)的突变驱动,其中大多数将精氨酸206变成组氨酸(r206h)(pignolo,r.j.等人2011,orphanetj.raredis.6:80)。acvr1为骨形态形成性蛋白(bmp)的i型受体。据信r206h突变尤其增加受体对活化的敏感性且使其更不易沉默。尚不知fop的有效医学疗法。
技术实现要素:
本发明提供治疗进行性骨化性纤维发育不良(fop)的方法,该方法包括向患有fop的受试者施用有效方案的活化素受体类型2a(acvr2a)和/或活化素受体类型2b(acvr2b)拮抗剂。在一些方法中,拮抗剂包含acvr2a或acvr2b细胞外结构域。在一些方法中,拮抗剂包含acvr2a或acvr2bfc融合蛋白。在一些方法中,fc融合蛋白的同型为人类igg1。在一些方法中,拮抗剂包含连接于acvr2b细胞外结构域的acvr2a细胞外结构域。在一些方法中,拮抗剂还包含fc结构域。在一些方法中,拮抗剂包含融合于第一fc结构域的acvr2a细胞外结构域以及融合于第二fc结构域的acvr2b细胞外结构域,其中第一fc结构域和第二fc结构域彼此复合。在一些方法中,拮抗剂在各自融合于fc结构域的acvr2a细胞外结构域与acvr2b细胞外结构域之间包含接头。在一些方法中,拮抗剂为包含acvr2a细胞外结构域、acvr2b细胞外结构域以及fc结构域的融合蛋白。在一些方法中,施用有效方案的acvr2a拮抗剂和acvr2b拮抗剂。在一些方法中,acvr2a拮抗剂为acvr2afc融合蛋白且acvr2b拮抗剂为acvr2bfc融合蛋白。在一些方法中,拮抗剂为acvr2a或acvr2b的抗体。在一些方法中,受试者未患有ii型糖尿病、肌肉萎缩、肌萎缩性侧索硬化(als)或骨质疏松症且不处于其风险中。
本发明进一步提供治疗fop的方法,该方法包括向患有fop的受试者施用有效方案的活化素受体类型1(acvr1)拮抗剂。在一些方法中,拮抗剂包含acvr1细胞外结构域。在一些方法中,拮抗剂包含acvr1融合蛋白。在一些方法中,fc融合蛋白的同型为人类igg1。在一些方法中,拮抗剂为acvr1的抗体。
本发明进一步提供治疗进行性骨化性纤维发育不良(fop)的方法,该方法包括向患有fop的受试者施用有效方案的活化素受体类型2a(acvr2a)和/或活化素受体类型2b(acvr2b)拮抗剂与活化素受体类型1(acvr1)拮抗剂的组合。在一些方法中,拮抗剂包含acvr1、acvr2a和/或acvr2b细胞外结构域。在一些方法中,拮抗剂包含acvr1、acvr2a和/或acvr2bfc融合蛋白。在一些方法中,fc融合蛋白的同型为人类igg1。在一些方法中,拮抗剂为acvr1、acvr2a和/或acvr2b的抗体。
本发明进一步提供治疗进行性骨化性纤维发育不良(fop)的方法,该方法包括向患有fop的受试者施用有效方案的针对活化素a的抗体。任选地,抗体与包含命名为h4h10446p、h4h10430p或a1的抗体的重链可变区及轻链可变区的抗体竞争结合。任选地,抗体包含命名为h4h10446p、h4h10430p或a1的抗体的重链可变区及轻链可变区。任选地,抗体为嵌合、镶饰、人源化或人类抗体。任选地,抗体为完整抗体。任选地,抗体为人类κigg1抗体。
附图说明
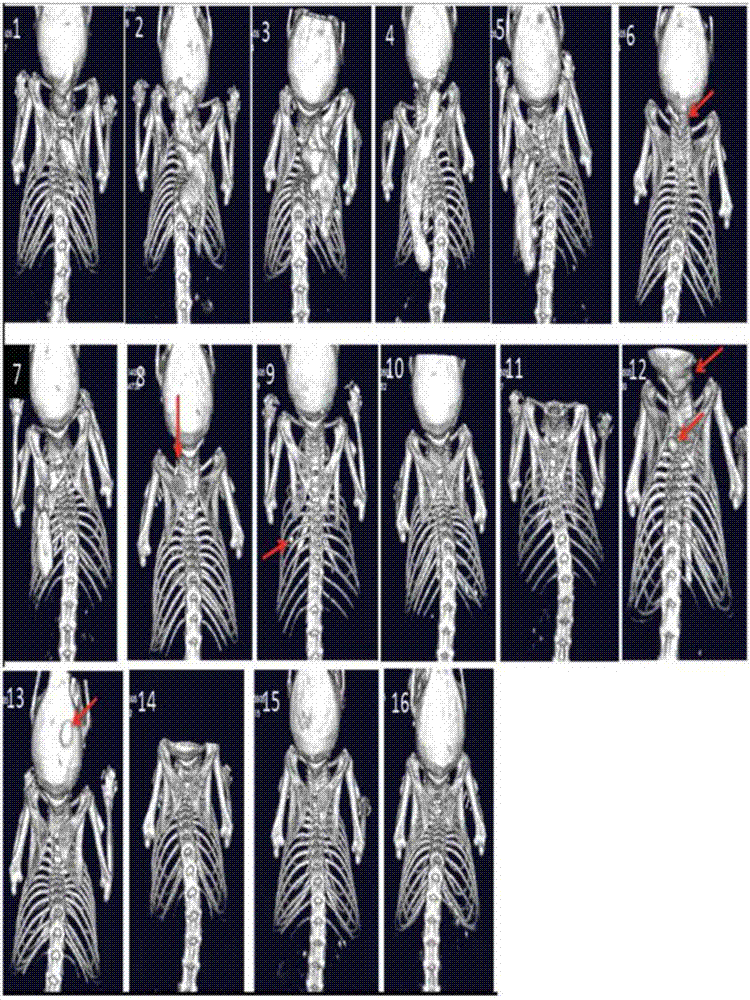
图1示出来自小鼠的microct数据,其示出在进行和不进行acvr2a-fc/acvr2b-fc处理下开始施用他莫昔芬(tamoxifen)后6周时的异位骨形成。十个对照mfc处理的小鼠中的九个(编号1至9)示出在施用他莫昔芬后6周时异位骨形成。大部分共同位置为后肢、颈区及胸骨。十一个acvr2a-fc/acvr2b-fc处理的小鼠中的两个(编号12和14)示出在施用他莫昔芬后6周时异位骨形成。这两个小鼠中的异位骨病变与mfc处理组中所见异位骨病变相比尺寸小,且均位于胸骨。
图2示出来自小鼠的microct数据,其示出在进行或不进行ldn212854处理下开始施用他莫昔芬后4周时的异位骨形成。编号1至8对应于他莫昔芬+媒介物处理的小鼠。大的异位骨结节已在编号为1、2、3、4、5和7的小鼠中形成,且小的异位骨结节已在编号为6和8的小鼠中形成。编号9-16对应于他莫昔芬+ldn212854处理的小鼠。小的异位骨结节已在编号为9、12和13的小鼠中形成。在编号为10、11、14、15或16的小鼠中无法检测到异位骨结节。
图3示出经针对活化素a的抗体、同型匹配的不相关对照抗体及acvr2a-fc处理的倾向于异位骨形成的小鼠的microct数据。针对活化素a的抗体最有效地抑制异位骨结节的形成。
图4示出经针对活化素a的抗体、同型匹配的不相关对照抗体及针对acvr2a/acvr2b的抗体处理的倾向于异位骨形成的小鼠的microct数据。针对活化素a的抗体及针对acvr2a/acvr2b的抗体抑制异位骨结节的形成。
图5示出与同型匹配的不相关对照抗体相比,经改变剂量的针对活化素a的抗体处理的倾向于异位骨形成的小鼠的microct数据。示出介于1mg/kg和25mg/kg之间的剂量有效,其中10mg/kg为测试的最有效剂量。
具体实施方式
定义
拮抗剂典型地以分离形式提供。这意指拮抗剂典型地为至少50%w/w纯,具有由其生产或纯化引起的干扰蛋白质及其它污染物,但不排除拮抗剂与过量药学上可接受的载剂或其它旨在促进其使用的媒介物组合的可能性。有时拮抗剂为至少60%、70%、80%、90%、95%或99%w/w纯,具有来自生产或纯化的干扰蛋白质及污染物。
为了将氨基酸取代分类为保守或非保守的目的,氨基酸如下分组:组i(疏水性侧链):met、ala、val、leu、ile;组ii(中性亲水性侧链):cys、ser、thr;组iii(酸性侧链):asp、glu;组iv(碱性侧链):asn、gln、his、lys、arg;组v(影响链取向的残基):gly、pro;以及组vi(芳族侧链):trp、tyr、phe。保守取代涉及同类氨基酸之间的取代。非保守取代构成这些类别中一者的成员与另一类成员的交换。
百分比序列同一性是在可变区通过kabat编号规定或在恒定区通过eu编号,由抗体序列最大程度比对确定。对于其它蛋白质,序列同一性可通过使用算法诸如wisconsingenetics软件包7.0版(geneticscomputergroup,575sciencedr.,madison,wi)中的bestfit、fasta和tfasta,使用默认空位参数,或通过检查及最佳比对来比对序列进行确定。比对后,如果主题抗体区(例如重链或轻链的整个成熟可变区)正与参考抗体的相同区比较,则主题抗体区与参考抗体区之间的百分比序列同一性为主题抗体区与参考抗体区中相同氨基酸占据的位置的数目除以两个区的比对位置的总数乘以100以转变成百分比,其中空位不计数。
“包含”一个或多个所叙述要素的组合物或方法可包括未具体叙述的其它要素。例如,包含抗体的组合物可含有单独抗体或与其它成分组合的抗体。
人源化抗体为经基因工程改造的抗体,其中来自非人类“供体”抗体的cdr移植至人类“受体”抗体序列(参见例如queen,us5,530,101和5,585,089;winter,us5,225,539;carter,us6,407,213;adair,us5,859,205和6,881,557;foote,us6,881,557)。受体抗体序列可为例如成熟人类抗体序列、此类序列的复合物、人类抗体序列的共有序列或生殖系区序列。因此,人源化抗体为一些或所有cdr完全或基本上来自供体抗体且可变区框架序列和恒定区(如果存在)完全或基本上来自人类抗体序列的抗体。类似地,人源化重链具有至少一个、两个以及通常所有三个完全或基本上来自供体抗体重链的cdr,以及基本上来自人类重链可变区框架和恒定区序列的重链可变区框架序列和重链恒定区(如果存在)。类似地,人源化轻链具有至少一个、两个以及通常所有三个完全或基本上来自供体抗体轻链的cdr,以及基本上来自人类轻链可变区框架和恒定区序列的轻链可变区框架序列和轻链恒定区(如果存在)。除纳米抗体和dab以外,人源化抗体包含人源化重链和人源化轻链。当相应cdr之间至少85%、90%、95%或100%的对应残基(如kabat所定义)相同时人源化抗体中的cdr基本上来自非人类抗体中的对应cdr。当通过kabat定义的对应残基的至少85%、90%、95%或100%相同时,抗体链的可变区框架序列或抗体链的恒定区分别基本上来自人类可变区框架序列或人类恒定区。
虽然人源化抗体常常结合来自小鼠抗体的所有六个cdr(优选地如kabat所定义),但其也可用少于全部cdr(例如来自小鼠抗体的至少3、4或5个cdr)制成(例如pascalis等人,j.immunol.169:3076,2002;vajdos等人,journalofmolecularbiology,320:415-428,2002;iwahashi等人,mol.immunol.36:1079-1091,1999;tamura等人,journalofimmunology,164:1432-1441,2000)。
嵌合抗体为其中非人类抗体(例如小鼠)的轻链和重链的成熟可变区与人类轻链恒定区和重链恒定区组合的抗体。此类抗体基本上或完全保留小鼠抗体的结合特异性,且为约三分之二的人类序列。
镶饰抗体为这样一种类型的人源化抗体,其保留非人类抗体的一些及通常所有cdr和一些非人类可变区框架残基,但用来自人类抗体序列的对应位置的残基置换可影响b细胞表位或t细胞表位的其它可变区框架残基,例如暴露残基(padlan,mol.immunol.28:489,1991)。结果为其中cdr完全或基本上来自非人类抗体且非人类抗体的可变区框架通过取代而更像人类的抗体。
人类抗体可与人类分离,或以其它方式由人类免疫球蛋白基因的表达(例如在转基因小鼠中、在体外或通过噬菌体展现)产生。用于产生人类抗体的方法包括oestberg等人,cysmuoma2:361-367(1983);oestberg,美国专利4,634,664;以及engleman等人,美国专利4,634,666的三源杂交瘤法。单克隆抗体还可通过载有人类免疫系统基因的转基因小鼠产生,诸如来自regeneronpharmaceuticals,inc.的
当据称拮抗剂保留其所来源的亲本抗体的特性时,该保留可为完全或部分的。活性的完全保留意指拮抗剂的活性与其所来源的分子的活性相同(在实验误差范围内)或超过其所来源的分子的活性。活性的部分保留意指活性显著高于阴性对照的背景水平(也即超过实验误差)且优选地为其所来源的分子的对应活性的至少50%。
如果减少或消除一种抗体的结合的抗原中的全部氨基酸突变减少或消除另一抗体的结合,则两个抗体具有相同的表位。如果减少或消除一种抗体的结合的一些氨基酸突变减少或消除另一抗体的结合,则两个抗体具有重迭表位。
抗体之间的竞争通过其中测试抗体抑制参考抗体与共同抗原的特异性结合的测定来确定(参见例如junghans等人,cancerres.50:1495,1990)。如果如竞争性结合测定中所测量,过量测试抗体(例如至少2x、5x、10x、20x或100x)抑制参考抗体的结合至少50%,但优选地75%、90%或99%,则测试抗体与参考抗体竞争。通过竞争测定(竞争抗体)鉴定的抗体包括结合于与参考抗体相同的表位的抗体以及结合于与参考抗体所结合的表位足够接近而出现空间位阻的邻近表位的抗体。
i.概述
提供用于治疗进行性骨化性纤维发育不良(fop)的方法。此类方法涉及向患有fop的受试者施用有效方案的活化素受体类型2a(acvr2a)和/或活化素受体类型2b(acvr2b)拮抗剂和/或活化素受体类型1(acvr1)拮抗剂和/或活化素a拮抗剂。此类拮抗剂包含含有acvr2a、acvr2b和/或acvr1中的一个或多个细胞外结构域(ecd)以及免疫球蛋白重链的fc结构域的融合蛋白。还提供了acvr2a、acvr2b、acvr1或活化素a的抗体拮抗剂。
ii.acvr1、acvr2a、acvr2b以及活化素a
配位体的转化生长因子β(tgfβ)超家族包括例如骨形态生成蛋白(bmp)以及生长和分化因子(gdf)。这些配位体的受体为由i型和ii型跨膜丝氨酸/苏氨酸激酶受体组成的异聚受体复合物。i型受体的示例包括活化素受体类型ia(actria、acvr1或alk2)、bmp受体类型ia以及bmp受体类型ib。ii型受体的示例包括活化素受体类型iia和iib(actriia或acvr2a和actriib或acvr2b)以及bmp受体类型ii。tgfβ超家族的配位体各自针对不同i型和ii型受体具有不同的亲和力。
i型与ii型受体均具有细胞外配位体结合结构域(ecd)以及细胞内丝氨酸/苏氨酸激酶结构域。另外,i型受体在激酶结构域之前具有富含甘氨酸/丝氨酸的区(gs-盒),且在激酶结构域内具有l45环。两种受体一起作用于配位体以活化下游信号传导路径,诸如smad和非smad信号传导路径。活化涉及配位体结合、配位体-受体寡聚和ii型受体激酶使i型受体的gs盒转磷酸化。ii型受体激酶为组成性活性且在i型受体的配位体结合和活化中起作用。
acvr1也命名为活化素受体类型i、acvr1a、acvrlk2或alk2,为配位体的tgfβ超家族的i型受体。acvr1具有丝氨酸/苏氨酸激酶活性且使smad蛋白质磷酸化且活化下游信号传导路径。在包括骨骼肌和软骨的许多身体组织中发现acvr1且其帮助控制骨和肌肉的生长与发育。如在本文中的其它地方描述,acvr1基因的某些突变引起fop。acvr1活性的示例包括结合于配位体的能力、与ii型受体形成复合物的能力或活化下游信号传导路径诸如smad路径的能力。
acvr2也命名为活化素受体类型ii,为配位体的tgfβ超家族的ii型受体。存在至少两种acvr2受体,例如活化素受体类型iia(acvr2a或actriia)和活化素受体类型iib(acvr2b或actriib)。对acvr2的提及包括acvr2a和acvr2b中的任一者或两者。acvr2a和acvr2b可在许多组织中表达,包括骨骼肌、胃、心脏、子宫内膜、睾丸、前列腺、卵巢和神经组织。
在配位体结合时,acvr2受体与i型受体,诸如acvr1形成复合物,且使i型受体的gs盒磷酸化,因此增强i型受体的激酶活性。acvr2a和acvr2b活性的示例包括结合于配位体的能力、与i型受体形成复合物的能力或使i型受体磷酸化的能力。
人类acvr2a的一种例示性形式具有swissprot登陆号p27037。残基1-19为信号肽,残基20-135为细胞外结构域,残基59-116为活化素类型i和ii受体结构域,残基136-161为跨膜结构域且残基162-513为细胞质结构域。指定人类acvr2b的一种例示性形式为swissprot登陆号q13705。残基1-18为信号序列,残基19-137为细胞外结构域,残基27-117为活化素类型i和ii受体结构域,残基138-158为跨膜结构域且残基159-512为细胞质结构域。人类acvr1的一种例示性形式具有swissprot登陆号q04771。残基1-20为信号序列,残基21-123为细胞外结构域,残基33-104为活化素类型i和ii受体结构域,残基124-146为跨膜结构域且残基147-509为细胞质结构域。对acvr1、acvr2a和acvr2b中的任一者的提及包括这些例示性形式、它们已知的同种型和多态性,诸如swissprot数据库中列出的那些、来自其它物种的同源形式以及与例示性形式具有至少90%、95%、96%、97%、98%或99%序列同一性的其它变体。
除以上定义的例示性序列以外的acvr2a、acvr2b和acvr1的形式的残基通过与对应的例示性序列的最大比对来编号,因此比对的残基分配相同的编号。例示性序列的取代可为保守或非保守取代。对acvr1、acvr2a或acvr2b的提及也包括完整细胞外结构域(例如分别为acvr2a、acvr2b和acvr1的残基20-135、19-137或21-123)或其不含或基本上不含跨膜和细胞质部分的部分。细胞外结构域的一部分保留完整细胞外结构域的足够残基以结合至少一种结合于完整细胞外结构域的配位体或反受体且由此拮抗相关受体(例如分别为acvr2a、acvr2b和acvr1的残基59-116、27-117或33-104)。
人类中的活化素a可作为同二聚体蛋白质或异二聚体蛋白质存在。同二聚体蛋白质含有同二聚体βa亚基对。异二聚体蛋白质含有β亚基和βb、βc或βe亚基(即βaβb、βaβc或βaβe)。该亚基各自表达为包括信号肽、前肽和成熟多肽的前体多肽。人类βa亚基前体的一种例示性形式为命名为swissprotp08476的426个氨基酸长的多肽,其中残基1-20为信号肽,残基21-310为前肽,且残基311-426为成熟多肽。βb亚基前体多肽的一种例示性形式命名为swissprotp09529,其中残基1-28为信号肽,残基29-292为前肽,且残基293-407为成熟多肽。βc亚基的一种例示性形式命名为swissprotp55103,其中残基1-18为信号肽,残基19-236为前肽,且残基237-352为成熟多肽。βe亚基前体的一种例示性形式命名为swissprotp58166,其中残基1-19为信号肽,残基20-236为前肽,且残基237-350为成熟多肽。已知这些序列的若干变体描述于swissprot数据库。对活化素a的提及包括βa同二聚体、βaβb、βaβc和βaβe异二聚体形式中的任一者,以及其亚基,以及其中亚基连接到由所提供的例示性swissprot序列定义的前肽和/或信号肽的它们的前体,或这些序列的其它天然存在的人类形式。活化素a经由结合于acvr2a或acvr2b进行信号传导,但不知其为acvr1的配位体。
iii.acvr1、acvr2a、acvr2b的拮抗剂
提供i型受体acvr1和ii型受体acvr2蛋白质(例如acvr2a和/或acvr2b)的拮抗剂用于治疗fop。除了其它机制外,此类拮抗剂尤其可通过结合于受体而直接拮抗受体(关于acvr1、acvr2a或acvr2b的抗体),或通过结合于配位体或反受体且抑制配位体或反受体结合于acvr1、acvr2a或acvr2b(关于acvr1、acvr2a或acvr2b的融合蛋白)而间接拮抗受体。acvr2a和acvr2b的拮抗剂还可结合于活化素a。
相对于未接收拮抗剂的对照细胞或动物模型,本文中提供的acvr1、acvr2a或acvr2b拮抗剂可抑制或降低acvr1、acvr2a和/或acvr2b的活性至少1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%或更多。
acvr1、acvr2a或acvr2b的任何拮抗剂可用于治疗fop的方法中。拮抗剂可包含例如acvr1、acvr2a或acvr2b多肽,诸如细胞外结构域、拮抗抗体或小分子抑制剂。
a.acvr1、acvr2a和acvr2b多肽的细胞外结构域
拮抗剂包含分别有效抑制acvr1、acvr2a和acvr2b中的至少一种活性的acvr1、acvr2a和acvr2b蛋白质及其片段。此类拮抗剂典型地包含acvr1、acvr2a或acvr2b的细胞外结构域或其一部分。优选地,此类细胞外结构域完全或基本上不含跨膜和细胞质区(即,来自这些区的任何其余残基对细胞外结构域的功能均无显著作用)。换言之,此类拮抗剂的acvr2a、acvr2b或acvr1组分由或基本上由如上定义的acvr2a、acvr2b或acvr1的整个细胞外结构域或其一部分组成。此类拮抗剂可能包含或可能不包含如下文进一步描述的不同于acvr2a、acvr2b或acvr1的其它组分。不含或基本上不含跨膜和细胞质结构域的此类细胞外结构域为可溶的。此类细胞外结构域可通过结合于可溶配位体或反受体,有效地与配位体或反受体竞争结合于acvr1、acvr2a或acvr2b细胞表面受体,由此调节(降低)配位体或反受体在体内的可得性来充当拮抗剂。
可溶性细胞外结构域最初可与信号序列一起表达,信号序列在表达过程中裂解。信号序列可为acvr1、acvr2a或acvr2b的天然信号序列,诸如美国专利7,709,605(其以引用的方式全文并入本文中)中描述的那些信号序列,或可为来自诸如蜜蜂蜂毒素(hbm)或组织血纤维蛋白溶酶原活化剂(tpa)的不同蛋白质的信号序列。另选地,可溶性细胞外acvr1、acvr2a或acvr2b多肽可在无信号序列的情况下合成或表达。
acvr1、acvr2a和acvr2b的ecd或配位体结合结构域在包括小鼠和人类的物种中高度保守。ecd含有富含半胱氨酸区和c端尾区。acvr1、acvr2a和acvr2b的ecd结合于不同群体的tgfβ家族配位体,包括例如活化素a、肌肉生长抑制素(gdf-8)、gdf-11和bmp。参见例如souza等人(2008)molecularendocrinology22(12):2689-2702。
acvr2a和acvr2b多肽及可溶性acvr2a和acvr2b多肽的示例包括美国专利7,842,633、美国专利7,960,343和美国专利7,709,605中公开的那些多肽,各专利以引用的方式全文并入本文中。
acvr1、acvr2a或acvr2b多肽的ecd可突变,使得变体多肽具有改变的配位体结合特性(例如结合特异性或亲和力)。一些变体acvr1、acvr2a或acvr2b多肽具有改变的对特定配位体的结合亲和力(例如升高或降低)。变体与天然存在的acvr1、acvr2a或acvr2b序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%序列同一性,且保留生物活性,由此具有如在本文中的其它地方描述的acvr1、acvr2a或acvr2b活性。acvr2a和acvr2b的活性变体及片段描述于例如美国专利7,842,633、美国专利7,960,343和美国专利7,709,605中,各专利以引用的方式全文并入本文中。
测量acvr1、acvr2a或acvr2b活性的测定公开于例如美国专利7,842,633、美国专利7,960,343和美国专利7,709,605中。例如,可针对结合配位体的能力或阻止配位体结合于acvr1、acvr2a或acvr2b受体蛋白的能力筛选acvr1、acvr2a或acvr2b多肽变体。
b.融合蛋白
上述acvr1、acvr2a和acvr2b多肽可表达为具有acvr1、acvr2a和/或acvr2b多肽的至少一部分以及一个或多个融合结构域的融合蛋白。
融合结构域包括免疫球蛋白重链恒定区(fc)、人类血清白蛋白(hsa)、谷胱甘肽s转移酶(gst)、蛋白质a、蛋白质g或可用于稳定、溶解、分离融合蛋白或使融合蛋白多聚的任何融合结构域。
免疫球蛋白重链的fc结构域为融合蛋白的优选的结构域。与免疫球蛋白的fc部分的融合赋予各类蛋白质期望的药物动力学特性(例如增加蛋白质的稳定性和/或血清半衰期)。因此,本发明提供包含融合于免疫球蛋白的fc结构域的acvr1、acvr2a和/或acvr2b的至少一种ecd的融合蛋白。
用于本发明的方法的fc结构域可来自于任何免疫球蛋白。可使用各种类别的免疫球蛋白中的任一者,包括igg、iga、igm、igd和ige。igg类别内存在不同子类或同型,包括例如igg1、igg2、igg3和igg4。在一个实施方案中,fc融合蛋白包含igg分子的fc结构域。在另一个实施方案中,fc结构域来自于igg1分子。免疫球蛋白分子可具有任何动物类型,包括例如哺乳动物、啮齿动物、人类、小鼠、大鼠、仓鼠或兔。在一个实施方案中,免疫球蛋白fc结构域来自于哺乳动物。在另一个实施方案中,fc结构域来自于人类。在又一个实施方案中,fc结构域来自于啮齿动物,诸如小鼠或大鼠。在一个特定实施方案中,融合蛋白的fc结构域来自于人类igg1。
本文中提供的fc-融合蛋白可通过本领域中已知的任何方法制造。fc-融合蛋白可包括至少ch2和ch3区,且典型地包括铰链区的至少一部分。虽然ch1区可存在,但其典型地在融合蛋白中省去。
融合可在免疫球蛋白恒定结构域的fc部分内的任何位点进行。可对恒定结构域的fc部分的c端,或紧靠重链的ch1区的n端进行融合。可选择特定位点以优化fc-融合蛋白的生物活性、分泌或结合特征。
在一些情况下,编码acvr1、acvr2a和/或acvr2b的ecd的核酸在c端融合于编码免疫球蛋白恒定结构域序列的n端的核酸。在其它情况下,n端融合也为可能的。acvr1、acvr2a和/或acvr2b的ecd也可融合于免疫球蛋白恒定结构域序列的n端和c端。
关于免疫球蛋白融合的产生,也参见美国专利5,428,130、美国专利5,843,725、美国专利6,018,026和wo2005/070966,各自以引用的方式全文并入本文中。
融合蛋白可例如通过编码融合蛋白的核酸的重组表达产生。例如,融合蛋白可通过将编码acvr1、acvr2a和/或acvr2b的ecd的核酸融合于编码fc结构域的核酸来制备。acvr1、acvr2a和/或acvr2becd核酸可融合于编码fc结构域的核酸的n端,或可融合于编码fc结构域的基因的c端。另选地,ecd可在fc结构域中的任何位置融合。
ecd融合蛋白还可包含接头。在fc融合蛋白的情况下,接头可位于acvr1、acvr2a或acvr2becd与fc结构域之间,任选地置换铰链区的部分或全部。接头可为1、2、3、4、5、6、7、8、9、10、15、20、30、50或更多个相对不含二级结构的氨基酸。接头可富含甘氨酸和脯氨酸残基,且可例如含有苏氨酸/丝氨酸和甘氨酸的重复序列(例如tg4或sg4重复序列)。
两个或更多个ecd-fc融合蛋白可通过接头连接在一起。在此类情况下,接头可位于ecd之间或接头可位于fc结构域之间以将融合蛋白连接在一起。例如,1、2、3、4或更多个acvr1、acvr2a和/或acvr2bfc融合蛋白可连接在一起。
已描述acvr2a和/或acvr2becd融合蛋白的示例,诸如美国专利7,842,633、美国专利7,960,343和美国专利7,709,605中公开的那些融合蛋白,各自以引用的方式全文并入本文中。
acvr2a拮抗剂的一个示例已知为sotatercept(也命名为ace-011)。sotatercept含有融合于人类igg1fc结构域的acvr2a的ecd且详细描述于carrancio等人,(2014)britishjhaematology.165(6):870-872,其以引用的方式全文并入本文中。
acvr2b拮抗剂的一个示例已知为ace-031。ace-031含有融合于人类igg1fc结构域的acvr2b的ecd且详细描述于sako等人,(2010)j.biol.chem.285(27):21037-21048,其以引用的方式全文并入本文中。
已知acvr1ecd融合蛋白的示例,诸如berasi等人,(2011)growthfactors,29(4):128-139中公开的那些融合蛋白,其以引用的方式全文并入本文中。
c.杂交ecd融合蛋白
还提供了杂交或多特异性ecd融合蛋白拮抗剂。杂交ecd融合蛋白可包含两个或更多个acvr1、acvr2a和/或acvr2becd的组合。例如,融合蛋白可包含acvr1、acvr2a和/或acvr2becd的1、2、3、4或更多个分子。在一个实施方案中,拮抗剂包含连接于acvr2becd的acvr2aecd。在另一个实施方案中,拮抗剂还包含fc结构域。
在一个实施方案中,融合蛋白可包含acvr2aecd的一个或多个分子以及acvr2becd的一个或多个分子。在另一个实施方案中,融合蛋白可包含acvr1ecd的一个或多个分子以及acvr2aecd的一个或多个分子。在另一个实施方案中,融合蛋白可包含acvr1ecd的一个或多个分子以及acvr2becd的一个或多个分子。
在一个实施方案中,融合蛋白包含复合在一起的一个或多个acvr2aecd-fc融合蛋白以及一个或多个acvr2becd-fc融合蛋白。在另一个实施方案中,融合蛋白包含复合在一起的一个或多个acvr1ecd-fc融合蛋白以及一个或多个acvr2aecd-fc融合蛋白。在另一个实施方案中,融合蛋白包含复合在一起的一个或多个acvr1ecd-fc融合蛋白以及一个或多个acvr2becd-fc融合蛋白。在此类情况下,融合蛋白可经由其fc结构域,例如通过至少一个二硫键或通过接头序列连接在一起。另选地,融合蛋白的ecd部分可通过接头序列接合在一起。
在一个实施方案中,拮抗剂包含融合于第一fc结构域的acvr2aecd以及融合于第二fc结构域的acvr2becd。在此类情况下,fc结构域可彼此复合。在另一个实施方案中,拮抗剂在各自融合于fc结构域的acvr2aecd与acvr2becd之间包含接头。
可构建融合蛋白以产生串联格式的acvr1、acvr2a和/或acvr2b拮抗剂。在一个实施方案中,融合蛋白包含两个或更多个来自acvr1、acvr2a和/或acvr2b的串联ecd,接着为fc结构域。在一些情况下,串联排列的ecd通过接头序列分离。此类串联融合蛋白可包含1、2、3、4或更多个acvr1、acvr2a和/或acvr2becd。
d.抗体拮抗剂
acvr1、acvr2a或acvr2b拮抗剂包括针对(换言之,特异性结合于)这些受体中的任一者的抗体,优选地在细胞外结构域内具有表位的抗体。抗体或融合蛋白特异性结合于其靶标抗原意指至少106m-1、107m-1、108m-1、109m-1或1010m-1的亲和力。特异性结合量值可检测地更高,且可与对至少一个无关靶标所发生的非特异性结合区别开。本领域中已知用于制备抗体的方法。参见例如kohler&milstein(1975)nature256:495-497;以及harlow&lane(1988)antibodies:alaboratorymanual(coldspringharborlab.,coldspringharbor,ny)。
可使用抑制或降低acvr1、acvr2a和/或acvr2b的活性的任何抗体(例如拮抗抗体)。此类acvr2a和acvr2b抗体包括例如美国专利8,486,403、美国专利8,128,933、wo2009/137075以及lach-trifilieff等人,(2014)mol.cellbiol.34(4):606-618中公开的那些抗体,各自以引用的方式全文并入本文中。包括这些抗体中的任一者的人源化、嵌合和镶饰形式,以及与其竞争结合的抗体。
在一个实施方案中,抗体为抗acvr2a抗体。在另一个实施方案中,抗体为抗acvr2b抗体。在其它实施方案中,抗体可为针对acvr2a与acvr2b两者的双特异性抗体。在另一个实施方案中,抗体为抗acvr1抗体。在其它实施方案中,抗体可为针对acvr1与acvr2a两者的双特异性抗体或针对acvr1与acvr2b两者的双特异性抗体。
术语“抗体”涵盖具有两对重链和轻链的完整抗体、可结合抗原的抗体片段(例如fab、f(ab')2、fv、单链抗体、双功能抗体、抗体嵌合体、杂交抗体、双特异性抗体、人源化抗体等)以及包含上述的重组肽。
“抗体片段”包含完整抗体一部分,优选地为完整抗体的抗原结合或可变区。抗体片段的示例包括fab、f(ab')2和fv片段;双功能抗体;线性抗体(zapata等人(1995)proteineng.10:1057-1062);单链抗体分子;以及由抗体片段形成的多特异性抗体。
抗体可为单克隆抗体或多克隆抗体。“单克隆抗体”为从基本上均质的抗体的群体中获得的抗体,即构成该群体的单个抗体除可少量存在的可能天然存在的突变外均相同。单克隆抗体常常具有高度特异性,针对单一抗原位点。此外,与典型地包括针对不同决定子(表位)的不同抗体的常规(多克隆)抗体制剂相比,各单克隆抗体典型地针对抗原上的单一决定子。修饰词“单克隆”指示如从基本上均质的抗体的群体(诸如通过b细胞克隆群体产生的抗体)获得的抗体的特征,且不需要通过任何特定方法产生抗体。
根据本文中提供的方法使用的单克隆抗体可通过kohler等人(1975)nature256:495首先描述的杂交瘤方法或其修改形式来制备。典型地,动物诸如小鼠用含有抗原(例如acvr1、acvr2a和/或acvr2b多肽,或活化素a,具体地细胞外结构域(受体中)或其一部分)的溶液免疫接种。
免疫接种可通过将含有抗原的溶液在盐水中,优选地在佐剂诸如弗氏完全佐剂(freund’scompleteadjuvant)中混合或乳化且非经肠道注射混合物或乳液来进行。动物免疫接种后,移除脾(以及任选地,若干大淋巴结)且解离成单个细胞。脾细胞可通过将细胞悬浮液施加至涂覆有感兴趣的抗原的盘或孔来筛选。表达对抗原具有特异性的膜结合免疫球蛋白的b细胞结合于盘且未洗去。接着诱发所得b细胞或全部解离的脾细胞与骨髓瘤细胞融合以形成杂交瘤,且在选择培养基中培养。所得细胞通过连续稀释来涂板,且分析特异性结合感兴趣的抗原(且不结合于无关抗原)的抗体的产生。接着将所选的分泌单克隆抗体(mab)的杂交瘤体外(例如组织培养瓶或中空纤维反应器中)或者体内(如小鼠中腹水)培养。
另选地,单克隆抗体可通过重组dna方法制备(参见例如美国专利4,816,567)。单克隆抗体还可从噬菌体抗体文库使用例如clackson等人(1991)nature352:624-628;marks等人(1991)j.mol.biol.222:581-597;以及美国专利5,514,548中描述的技术来分离。
“抗体”包括如上定义的针对acvr1、acvr2a、acvr2b和活化素a中的任一者的嵌合、镶饰、人源化以及人类单克隆抗体。
取决于它们的重链的恒定结构域的氨基酸序列,免疫球蛋白可分配至不同类别。存在五个免疫球蛋白主要类别:iga、igd、ige、igg和igm,且这些中的若干者可进一步分成子类(同型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于免疫球蛋白的不同类别的重链恒定结构域分别命名为α、δ、ε、γ和μ。熟知不同类别免疫球蛋白的亚基结构和三维构造。
本发明的单克隆抗体或fc融合蛋白可为各种抗体类别中的任一者。在一个实施方案中,单克隆抗体为igg类别抗体。在其它实施方案中,单克隆抗体可具有igm、ige、igd或iga类别。在特定实施方案中,抗体为igg的同型,诸如igg1、igg2、igg3或igg4,具体地人类igg1、igg2、igg3或igg4。
在轻链和/或重链的氨基端或羧基端处的一个或若干个氨基酸,诸如重链的c端赖氨酸可在一定比例或所有分子中缺失或衍生。可在恒定区中进行取代以减少或增加效应子功能,诸如补体介导的细胞毒性或adcc(参见例如winter等人,美国专利5,624,821;tso等人,美国专利5,834,597;以及lazar等人,proc.natl.acad.sci.usa103:4005,2006)或延长人类中的半衰期(参见例如hinton等人,j.biol.chem.279:6213,2004)。例示性取代包括位置250处的gln和/或位置428处的leu(eu编号)以增加抗体的半衰期。在位置234、235、236和/或237中的任一者处的取代降低对fcγ受体,具体地fcγri受体的亲和力(参见例如us6,624,821)。任选地,人类igg2中的位置234、236和/或237被丙氨酸取代且位置235被谷氨酰胺取代(参见例如us5,624,821)。效应子功能还可通过在位置232-236处eflg被pva取代来降低(参见wo14/121087)。任选地,位置428处的s可被p置换,具体地在人类igg4中,以减少内源性免疫球蛋白和外源性免疫球蛋白之间的交换。其它变异可添加或移除翻译后修饰的位点,诸如n-x-s/t基序的n连接的糖基化。变异也可包括引入杵型结构(即一个或多个氨基酸被较大氨基酸置换)或臼型结构(即一个或多个氨基酸被较小氨基酸置换)以促进不同重链之间异二聚体的形成以产生双特异性抗体。形成杵和臼对的例示性取代分别为t336y和y407t(ridgeway等人,proteinengineering第9卷第7期第617-621页,1996)。变异也可包括eu编号系统中降低蛋白质a互相作用(例如h435r和y436f)的突变。其中一个重链具有此类变异且另一个不具有此类变异的双特异性抗体可与其亲本抗体通过蛋白质a亲和色谱法分离。
抗体也可包括特异性结合于活化素a的抗体。此类抗体可特异性结合于活化素a的βaβa、βaβb、βaβc和βaβe形式中的任一者或全部。一些抗体仅仅特异性结合于这些形式(即βaβa、βaβb、βaβc或βaβe)中的一者。对βaβb、βaβc和βaβe形式的特异性可分别通过βb、βc或βe亚基内的表位,或针对异二聚体的两个组分影响的表位赋予。对βaβ的特异性可通过受同型二聚体内两个分子影响(例如在亚基界面)的表位赋予。一些抗体特异性结合于活化素a的所有这些形式,在此情况下表位典型地在βa亚基上。抗体典型地在前体蛋白质的成熟多肽组分内具有表位。一些抗体特异性结合于活化素a的任一种或全部形式而不结合于以α(swissprotp05111)βa或αβb异二聚体形式存在的人类抑制素。一些抗体特异性结合于活化素a的任一种或全部形式且结合于人类抑制素的任一种或两种形式。虽然据信此类抗体经由其反受体acvr2a和/或acvr2b和/或bmpr2中的一个或多个抑制活化素a的信号转导,但在治疗fop的方法中使用此类抗体无需对于机制的理解。
已报导针对活化素a的大量抗体。例如,us2015/00373339公开了命名为h4h10423p、h4h10424p、h4h10426p、h4h10429p、h4h10430p、h4h10432p2、h4h10433p2、h4h10436p2、h4h10437p2、h4h10438p2、h4h10440p2、h4h10442p2、h4h10445p2、h4h10446p2、h4h10447p2、h4h10447p2、h4h10448p2、h4h10452p2的人类抗体。us8,309,082公开了人类抗体a1-a14。针对活化素a的小鼠抗体可购自若干商业供应商,诸如mab3381得自r&dsystems或9h16得自novusbiologicals或mm0074-7l18(ab89307)得自abcam。
优选的抗体对活化素a具有至少108m-1、109m-1、1010m-1、1011m-1、1012m-1或1013m-1的亲和力(如us2015/00373339的实施例3中在25℃下测量)。一些抗体具有在109-1012m-1范围内的亲和力。优选的抗体以小于4nm且优选地小于400pm或40pm的ic50抑制活化素a的信号转导。一些抗体以在4nm至10pm或3.5nm至35pm范围内的ic50抑制信号转导。
信号转导抑制可如us20150037339的实施例6中测量,其如下所概述。将人类a204横纹肌肉瘤细胞系用smad2/3-荧光素酶报告质粒转染以产生a204/cagax12-luc细胞系。将a204/cagax12-luc细胞保持于补充有10%胎牛血清、青霉素/链霉素/谷氨酰胺和250μg/ml的g418的mccoy's5a中。针对生物测定,将a204/cagax12-luc细胞于低血清培养基、0.5%fbs和optimem中以10,000个细胞/孔接种至96孔测定盘上,且在37℃和5%co2下温育过夜。将活化素a以1:3从100nm连续稀释至0.002nm且与不含活化素的对照一起添加至细胞。抗体以1:3连续稀释,从100nm至0.002nm、1000nm至0.02nm、或300nm至0.005nm,包括含有适当同型对照抗体或不含抗体的对照样品,且在100pm活化素a的恒定浓度下添加至细胞。
如受体自细胞表达或细胞外结构域与fc结构域融合成融合蛋白且固定融合蛋白以支撑(例如biacore传感器芯片)时所测量,一些抗体抑制活化素a结合于acvr2a和/或acvr2b和/或bmpr2至少1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%。在此类测量中,抗体和活化素a应以等摩尔量存在且受体或细胞外结构域过量存在。
一些抗体结合于全长活化素a的残基321-343或391-421内的表位,该表位对应于成熟蛋白质的c11-s33和c81-e111。
用于本发明实施例的一种例示性抗体在us2015037339中命名为h4h10446p。其重链可变区和重链cdr1、cdr2和cdr3分别具有us2015/00373339的seqidno:162、164、166和168的氨基酸序列(分别为本发明的seqidno:1-4)。其轻链可变区和轻链cdrcdrl1、cdrl2和cdrl3分别具有us2015/0037339的seqidno:146、148、150和152的氨基酸序列(分别为本发明的seqidno:5-8)。h4h10446p抑制活化素a介导的经由acvr2a和/或acvriib的信号传导,但不强烈抑制(即使有)活化素a与acriia或acvr2b的结合。包括与h4h10446p竞争结合于人类活化素a或结合于人类活化素a上与h4h10446p相同的表位的其它抗体且也包括共享其对信号传导的抑制。
用于本发明的方法的另一例示性抗体在us2015037339中命名为h4h10430p。其重链可变区和重链cdrcdrh1、cdrh2和cdrh3分别具有us2015/00373339的seqidno:66、68、70和72的氨基酸序列(分别为本发明的seqidno:9-12)。其轻链可变区和轻链cdrcdrl1、cdrl2和cdrl3分别具有us2015/0037339的seqidno:74、76、78和80的氨基酸序列(分别为本发明的seqidno:13-16)。此抗体抑制活化素a结合于acrv2a和/或acvr2b且抑制经由这些受体中的一者或两者的信号转导。也包括与h4h10430p竞争结合于活化素a或结合于活化素a上与h4h10430p相同的表位且共享其抑制活化素a结合于acvr2a和acvr2b且抑制经由acvr2a和acvr2b的信号转导的特性的其它抗体。
用于本发明的方法的另一例示性抗体为us8,309,082中命名为a1的抗体,其特征在于具有us8,309,082中序列seqidno:9和10的轻链可变区和重链可变区(分别为本发明的seqidno:17和18)。其轻链cdrcdrl1、cdrl2和cdrl3分别具有us8,309,082中序列seqidno:11、12和13(分别为本发明seqidno:19-21),且其重链cdrcdrh1、cdrh2和cdrh3分别具有us8,309,082中序列seqidno:62、63和64(分别为本发明seqidno:22-24)。也包括与h4h10430p竞争结合于活化素a或结合于活化素a上与h4h10430p相同的表位且共享其抑制活化素a结合于acvr2a和/或acvr2b且抑制经由acvr2a和/或acvr2b的信号转导的特性的其它抗体。
其它抗体可通过编码上述抗体中任一者的重链和轻链的cdna的诱变来获得。本发明也包括在成熟重链可变区和/或轻链可变区的氨基酸序列中与上述抗体中任一者具有至少90%、95%或99%同一性且保持其功能特性,和/或与相应抗体的不同在于少量功能上不重要的氨基酸取代(例如保守取代)、缺失或插入的单克隆抗体。也包括含有与任何例示的抗体的对应cdr具有90%、95%、99%或100%同一性的至少1、2、3、4、5和优选地全部六个cdr的单克隆抗体。cdr优选如kabat所定义,但可通过任何常见的另选的定义,诸如chothia、复合kabat-chothia、接触定义或abm定义(参见worldwidewebbioinf.org.uk/abs)来定义。
e.小分子拮抗剂
acvr1、acvr2a和acvr2b的拮抗剂也可为小分子拮抗剂。此类小分子拮抗剂可抑制acvr1、acvr2a、acvr2b或活化素a的活性。acvr1的小分子拮抗剂包括例如ldn-212854,其描述于以引用的方式全文并入本文中的mohedas等人,(2013)acschem.biol.8:1291-1302中。
iv.筛选测定
本文中提供的各种acvr1、acvr2a和/或acvr2b拮抗剂及其变体或片段的活性可在多种测定中筛选。例如,可针对其结合于配位体或结合于acvr1、acvr2a或acvr2b受体的能力、针对其抑制配位体结合于acvr1和/或acvr2多肽的能力、和/或针对其抑制acvr1或acvr2受体的活性的能力来筛选acvr1、acvr2a和/或acvr2b拮抗剂及其变体。
acvr1或acvr2拮抗剂或其变体或片段的活性可在体外或基于细胞的测定中测试。熟知体外结合测定及测量受体活性抑制的测定。测量acvr1、acvr2a或acvr2b拮抗剂的活性的各种测定详细描述于例如以引用的方式全文并入本文中的美国专利7,842,663中。
拮抗剂调节acvr1或acvr2多肽与其结合蛋白之间的复合物形成的能力可通过多种技术检测。例如,可使用例如可检测标记的蛋白质,诸如放射性标记(例如32p、35s、14c或3h)、荧光标记(例如fitc)或酶标记的acvr1或acvr2多肽或其结合蛋白,通过免疫分析或通过色谱检测来定量复合物形成的调节。
可监测acvr1或acvr2拮抗剂抑制acvr1或acvr2受体介导的信号传导的能力。例如,可使用smad反应性报告基因监测诸如smad活化的对下游信号传导的作用。
也可在体内测定中针对活性筛选acvr1和/或acvr2拮抗剂及其变体或片段。例如,可在fop小鼠模型中针对治疗fop的能力(例如减少异位骨形成的能力)筛选acvr1或acvr2拮抗剂或其变体。已研发转基因敲入小鼠,其携带编码acvr1[r206h]的条件性等位基因。这些acvr1[r206h]coin/+小鼠描述于以引用的方式全文并入本文中的us14/207,320和pct/us2014/026582中。此等位基因仅仅在通过cre重组酶活化后表达r206h变体。此允许在特定组织和特定时间通过使用不同类型的cre驱动系对acvr1[r206h]表达的cre依赖性活化。以此方式,所得小鼠也绕过围产期死亡率,此已在acvr1[r206h]的未经调控的敲入等位基因下观察到。幼年或成年小鼠中acvr1[r206h]表达的活化引起异位骨形成。例如,acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠(其中creert2为已引入gt(rosa26)sor基因座中的他莫昔芬可调控的重组酶(参见feil等人(1997)biochembiophysrescommun.237(3):752-7),且由此其组成性且整体地表达)在暴露于他莫昔芬后出现fop。简而言之,在缺乏他莫昔芬的情况下,creert2为非活性。他莫昔芬活化cre的表达,接着其作用于acvr1[r206h]coin/+以使其转变成acvr1[r206h]/+,由此转变小鼠的基因型以反映acvr1[r206h]fop患者的基因型。acvr1[r206h]等位基因表达acvr1[r206h],且足以驱动acvr1[r206h]/+;gt(rosa26)sorcreert2/+小鼠中fop的出现。此绕过在常见acvr1[r206h]敲入小鼠acvr1tm1emsh下经历的胚胎致死(http://www.informatics.jax.org/allele/key/828153)。他莫昔芬治疗后,acvr1、acvr2a和/或acvr2b拮抗剂或对照可施用于acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠且监测动物的异位骨形成。参见chakkalakalsa等人(20120anacvr1r206hknock-inmousehasfibrodysplasiaossificansprogressiva.jboneminerres.27(8):1746-56)。此测定详细描述于以下实施例中。
v.进行性骨化性纤维发育不良(fop)
fop为一种罕见的可遗传障碍,其中异位骨化在诸如结缔组织的骨骼外位点形成组织学和生物医学上“正常”的骨。此障碍虽然为阶段性的,但为累积的,且导致严重程度渐增的永久残疾。
fop的全世界发病率为约1/2,000,000。fop无人种、种族、性别或地区偏好。其不仅仅为一种极端致残疾病,而且也为一种相当大地缩短寿命的病症。
fop的特征包括例如拇趾的先天畸形;特征在于头、颈和/或背部上痛苦软组织肿胀与炎症的发作及异位骨经由软骨内骨化的逐渐形成。
在临床上可基于拇趾畸形的存在怀疑fop。诊断测试诸如x射线或骨扫描可证明拇趾异常且证实异位骨化的存在。fop诊断也可通过遗传测试,例如通过检测acvr1基因中617g至a(r206h)突变来证实。
fop常常误诊为若干其它障碍,包括异位骨化的其它病症。fop应与包括例如以下的障碍区别诊断:孤立性先天畸形、淋巴水肿、软组织肉瘤、硬纤维瘤肿瘤、侵袭性幼年纤维瘤病、幼年拇囊炎、孤立性短指畸形、进行性骨发育异常及异位骨化。拇趾先天畸形的存在及痛苦的软组织发作可用于区分fop与其它障碍。
患有fop的患者具有拇趾的先天畸形,但在出生时在别的方面看起来正常。与fop相关联的发作始于生命头十年期间。发作可通过例如软组织损伤、跌倒、疲劳、病毒感染或肌肉内注射触发。发作的结果为诸如韧带、骨骼肌或腱的软组织转化成异位骨。
fop先前无治疗性治疗。fop通过预防性措施管理,诸如提高安全性以及使损伤减至最少的策略,避免肌肉内注射且在接收牙科护理时小心。在发作头24小时内开始的高剂量皮质类固醇治疗可帮助减少与发作相关的炎症和浮肿。不建议移除异位骨的外科策略,因为其起反作用且引起新的外伤诱发的异位骨化。
fop由似乎使gs结构域与抑制分子fkbp12的相互作用不稳定的acvr1突变(也称为alk2)引起(groppe,j.等人,2011,cellstissuesorgans,194:291-295)。fkbp12为acvr1的负调节剂且用以使受体呈非活性构形而稳定化(huse,m.等人,1999,cell,96:425-436)。参见kaplan,f.s.等人,2012,diseasemodels&mechanisms,5:756-762。
与fop相关的acvr1突变的一个示例为细胞内结构域中精氨酸206至组氨酸(r206h)的突变。
处于发展fop风险中的受试者包括具有acvr1r206h突变或其它与fop相关的突变的任何受试者、生来拇趾畸形的受试者或具有fop家族史但尚未出现足够由本领域所公认的准则诊断为fop的fop症状的受试者。
vi.治疗方法
本文中提供治疗fop的方法,该方法包括向患有fop的受试者施用有效方案的acvr1、acvr2a和/或acvr2b拮抗剂。在一个实施方案中,施用有效方案的acvr2a拮抗剂和acvr2b拮抗剂。在另一个实施方案中,acvr2a拮抗剂为fc融合蛋白且acvr2b拮抗剂为fc融合蛋白。在另一个实施方案中,fop通过施用有效方案的针对活化素a的抗体来治疗。
“治疗”具用fop的受试者意指向患有fop的受试者施用有效方案的acvr1、acvr2a和/或acvr2b拮抗剂,或针对活化素a的抗体,其中目的为治愈、医治、减轻、缓和、改变、补救、改善、改良或影响fop的一个或多个症状的病症。
“受试者”为其中期望治疗fop的任何动物(即哺乳动物),诸如人类、灵长类动物、啮齿动物(诸如小鼠和大鼠)、农业动物和驯养动物,诸如狗、猫、牛、马、猪、绵羊等。在任何本发明的方法中,受试者可为哺乳动物且优选地为人类。
有效方案的活化素a、acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体意指在fop的至少一个病征或症状中产生阳性反应的拮抗剂的剂量、频率及施用途径的组合。阳性反应可包括fop的至少一个病征或症状的减少、消除、改善、恶化抑制或延迟。可进行阳性反应的fop的病征或症状包括例如异位或异位骨形成、fop发作或与发作相关的疼痛及肿胀。可在单个患者中,通过比较治疗前后的病征及症状来评估方案。如果在治疗后至少一个病征或症状得到阳性反应,则方案视为有效。另选地或除此之外,方案可通过将用本发明的一种或多种拮抗剂治疗的受试者群体的病征及症状与未接收治疗的对照受试者群体比较来评估。用于此比较的受试者可为动物模型,或临床试验中的人类受试者(例如i期、ii期、iia期、iib期或iii期)。如果至少一个病征或症状中群体之间存在统计上显著的阳性反应,则方案视为有效。
在用于治疗fop的一些方法中,受试者未患有可用针对acvr1、acvr2a和/或acvr2b的拮抗剂或针对活化素a的抗体治疗的其它病症且不处于该其它病症的风险之中。例如,受试者可无ii型糖尿病、肌肉萎缩、肌萎缩性侧索硬化(als)及骨质疏松症中的任一者或全部。
a.施用方法
acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体通常以蛋白质或小分子直接施用,但在蛋白质情况下,也可以编码此类蛋白质的核酸施用。此类拮抗剂可通过各种方法施用,诸如细胞转染、基因疗法、与递送媒介物或药学上可接受的载体一起直接施用、通过提供包含编码本文中提供的acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体的核酸的重组细胞间接递送。
各种递送系统可用于施用本文中提供的acvr1、acvr2a和/或acvr2b拮抗剂,或针对活化素a的抗体,例如包封在脂质体、微粒、微胶囊、能够表达化合物的重组细胞、受体介导的内吞(参见例如wu和wu,1987,j.biol.chem.262:4429-4432)、构建核酸作为逆转录病毒或其它媒介物的一部分等等。
施用方法可为肠道方法或非肠道方法且包括皮内、肌肉内、腹膜内、静脉内、皮下、肺、鼻内、眼内、硬膜外和经口途径。化合物可通过任何便利途径,例如通过输注或推注注射,通过经上皮或黏膜与皮肤内层(例如口腔黏膜、直肠和肠黏膜等等)吸收来施用,且可与其它生物活性剂一起施用。施用可为全身性或局部。另外,可期望将本发明的药物组合物通过任何适合途径,包括心室内和鞘内注射引入中枢神经系统;心室内注射可通过例如附接至贮存器,诸如omcana贮存器的心室内导管来推动。也可采用经肺施用,例如通过使用吸入器或喷雾器,以及用雾化剂配制。
本发明的药物组合物可局部施用于需要治疗的区域;此可例如通过在手术期间局部输注、例如通过注射、借助于导管或借助于植入物(所述植入物具有多孔、无孔或凝胶状材料,包括膜,诸如硅橡胶膜、纤维或商业皮肤替代品)局部施用来实现。
在另一个实施方案中,活性剂可在囊泡、具体地脂质体中递送(参见langer(1990)science249:1527-1533)。在另一个实施方案中,活性剂可在控制释放系统中递送。在一个实施方案中,可使用泵(参见langer(1990)上文)。在另一个实施方案中,可使用聚合物材料(参见howard等人(1989)j.neurosurg.71:105)。在另一个实施方案中,在本发明的活性剂为编码蛋白质的核酸的情况下,核酸可通过以下方式在体内施用以促进其编码蛋白质的表达:将核酸构建为适当核酸表达载体的一部分且例如通过使用逆转录病毒载体施用其使得其变成细胞内(参见例如美国专利4,980,286),或通过直接注射,或通过使用微粒轰击,或用脂质或细胞表面受体或转染试剂涂覆,或通过将其与已知进入细胞核的同源盒样肽连接施用(参见例如joliot等人,1991,proc.natl.acad.sci.usa88:1864-1868)等等。另选地,核酸可引入细胞内且并入宿主细胞dna内以通过同源重组来表达。
b.组合疗法
本文所提供的acvr1、acvr2a和acvr2b拮抗剂或针对活化素a的抗体可彼此组合或与其它治疗组合施用。在一个实施方案中,治疗fop的方法包括共同施用acvr2a拮抗剂和acvr2b拮抗剂。在另一个实施方案中,治疗fop的方法包括共同施用acvr1、acvr2a和acvr2b拮抗剂。在其它实施方案中,acvr1拮抗剂可与acvr2a和/或acvr2b拮抗剂共同施用。acvr1、acvr2a和acvr2b拮抗剂可以单独的药物组合物施用或可以包含这些试剂的组合的单一药物组合物施用。单独或组合的acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体可结合一种或多种另外的治疗化合物一起施用。组合疗法可涵盖同时或交替施用。另外,组合可涵盖急性或慢性施用。
c.药物组合物
本发明也提供包含本文所提供的活化素a、acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体以及药学上可接受的载体的药物组合物。术语“药学上可接受”意指经联邦政府或州政府的管理机构批准或在美国药典或其它一般公认的药典中列出用于动物且更具体地用于人类中。术语“载剂”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或媒介物。此类药学载体可为无菌液体,诸如水和油,包括石油、动物、植物或合成来源的油类,诸如花生油、大豆油、矿物油、芝麻油等。合适的药学赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、乙二醇、水、乙醇等。必要时组合物也可含有少量湿润剂或乳化剂或ph值缓冲剂。
这些组合物可采取溶液、悬浮液、乳液、片剂、丸剂、胶囊、散剂、持久释放制剂等的形式。组合物可用传统粘结剂和载剂诸如三甘油酯配制为栓剂。口服制剂可包含标准载体,诸如药品等级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等等。合适的医学载体的示例描述于e.w.martin的“remington'spharmaceuticalsciences”中。
在一个实施方案中,组合物根据常规规程配制为适于静脉内施用于人类的药物组合物。必要时,组合物也可包含增溶剂及局部麻醉剂,诸如利多卡因(lidocaine)以缓解注射部位的疼痛。当组合物通过输注施用时,其可与含有无菌药品等级的水或盐水的输液瓶一起分配。当组合物通过注射施用时,可提供灭菌注射水或盐水的安瓿以使得成分可在施用之前混合。
本文所提供的活化素a、acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体可以中性或盐形式配制。药学上可接受的盐包括与游离氨基基团形成的那些盐,诸如衍生自盐酸、磷酸、乙酸、草酸、酒石酸等的那些盐,以及与游离羧基基团形成的那些盐,诸如衍生自钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙基胺基乙醇、组氨酸、普鲁卡因等的那些盐。
活化素a、acvr1、acvr2a和/或acvr2b拮抗剂或针对活化素a的抗体通过指定途径施用有效治疗fop的量及频率(例如有效方案)可通过标准临床技术,基于本发明的描述来确定。另外,体外测定可用以帮助鉴定最佳剂量范围。用于制剂中的准确剂量也根据施用途径及病症严重程度而定,且应根据执业医生的判断及各受试者的情形决定。然而,适用于非肠道施用、优选地静脉内或皮下施用的剂量范围一般为每千克体重约20-50000微克活性化合物。对于活化素a的抗体,合适的剂量范围包括1-25mg/kg、2-20mg/kg、5-15mg/kg、8-12mg/kg和10mg/kg。
适合于鼻内施用的剂量范围一般为每千克体重约0.01pg至每千克体重1mg。有效剂量可自来源于体外或动物模型测试系统的剂量响应曲线外推。
施用频率也根据病症的严重程度和试剂的半衰期以及其它因素而改变,但典型地在每日与每季之间,包括例如每周两次、每周一次、每两周一次、每月一次、每两月一次。也可以响应于患者的病症或药剂血清含量降至低于阈值以及其它因素的不规则间隔施用试剂。
上文或下文引用的全部专利申请、网址、其它公开、登陆号等均以全文引用的方式并入本文中以用于所有目的,其引用程度如同各个单独的项目特定且个别地指示以引用的方式并入一般。如果不同型式的序列在不同时期与登陆号相关,则意指在本申请的有效申请日期与登陆号相关的型式。有效申请日期意指早于提及登陆号的优先申请案的实际申请日期或申请日期(适用时)。同样,如果不同型式的公开、网址等在不同时期公开,则除非另外指明,否则意指在本申请的有效申请日期的最近公布的型式。除非另外特别指示,否则本发明的任何特征、步骤、要素、实施方案或方面均可与任何其它特征、步骤、要素、实施方案或方面组合使用。
实施例
实施例1:在fop小鼠模型中使用acvr2a-fc/acvr2b-fc抑制异位骨形成。
通过acvr2a-fc/acvr2b-fc治疗保护acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+在他莫昔芬治疗后免于异位骨形成。
fop的小鼠模型(称为acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+)以每只小鼠1mg剂量腹膜内给与他莫昔芬八天。每周将11只小鼠用10mg/kgacvr2a-fc和10mg/kgacvr2b-fc处理两次,且每周将10只小鼠用10mg/kg对照mfc处理两次,持续6周。使用体内μct在基线、开始施用他莫昔芬后2周、4周和6周监测小鼠。6周后,mfc组中10只小鼠中的9只已在至少一个位置中出现异位骨,相比之下,acvr2a-fc和acvr2b-fc组中11只小鼠中仅仅2只示出出现异位骨且此骨尺寸小。这些结果示出于图1中。
实施例2:在fop小鼠模型中使用acvr1激酶小分子抑制剂抑制异位骨形成。
通过acvr1激酶抑制剂ldn-212854治疗保护acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+在他莫昔芬治疗后免于异位骨形成。
16只acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠以每只小鼠1mg剂量腹膜内给与他莫昔芬八天。每日将八只小鼠用3mg/kgacvr1激酶抑制剂ldn-212854(mohedas等人(2013)acschem.biol.8:1291-1302)处理两次,持续4周。每日将八只小鼠用媒介物对照处理两次,持续4周。使用体内μct在基线、开始施用他莫昔芬后2周和4周监测小鼠。4周后,媒介物对照组中8只小鼠中的8只示出异位骨形成,这些小鼠中的6只中异位骨病变的尺寸巨大。相比之下,在经ldn-212854处理的组中,8只小鼠中的3只示出异位骨形成,在该3只小鼠中形成的异位骨病变的尺寸比媒介物对照组小。这些结果示出于图2中。
实施例3:在fop小鼠模型中使用针对活化素a的抗体抑制异位骨形成。
将23只acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠以每只小鼠1mg剂量腹膜内用他莫昔芬处理八天。每周将七只小鼠用25mg/kg同型对照抗体处理两次,每周将八只小鼠用25mg/kg活化素a抗体(h4h10446p)处理两次,且每周将八只小鼠用10mg/kgacvr2a-fc处理两次,持续3周。用这些试剂治疗与开始他莫昔芬治疗同时开始。使用体内微电脑断层摄影术(μct)在基线、开始施用他莫昔芬后2周和3周监测小鼠。图3示出3周后,同型对照抗体组中的全部小鼠均在至少一个位置处出现异位骨,相比之下,此时活化素a抗体组中无小鼠示出出现异位骨。acvr2a-fc组中两只小鼠在第3周出现异位骨。
实施例4:
通过活化素a与acvr2a和acvr2b阻断抗体保护acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+在他莫昔芬治疗后免于异位骨形成。
将26只acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠以每千克40mg剂量腹膜内给与他莫昔芬八天。八只小鼠用10mg/kg同型对照抗体(regn1945)处理,九只小鼠用10mg/kg活化素a抗体(h4h10446p)(regn2477)处理,且九只小鼠用10mg/kgacvr2a/acvr2b抗体处理,每周两次,持续6周。使用体内μct在基线、开始施用他莫昔芬后2周、3周和4周监测小鼠。图4示出4周后,同型对照抗体组中8只小鼠中的7只在至少一个位置处已出现异位骨,相比之下,活化素a抗体处理组中仅仅一只小鼠和acvr2a/acvr2b抗体处理组中三只小鼠在第4周出现异位骨。在抗体处理组中形成的异位骨的尺寸小于同型对照处理组中形成的异位骨的尺寸。
实施例5:
通过活化素a阻断抗体保护acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+在他莫昔芬治疗后免于异位骨形成。
将35只acvr1[r206h]coin/+;gt(rosa26)sorcreert2/+小鼠以每千克40mg剂量腹膜内给与他莫昔芬八天。八只小鼠用25mg/kg同型对照抗体(regn1945)处理,九只小鼠用25mg/kg活化素a抗体(h4h10446p)(regn2477)处理,九只小鼠用10mg/kg活化素a抗体(regn2477)处理,且九只小鼠用1mg/kg活化素a抗体(regn2477)处理,一周一次,持续6周。使用体内μct在基线、开始施用他莫昔芬后2周、3周、4周和6.5周监测小鼠。各小鼠中异位骨的体积由μct影像计算。图5示出4周后,同型对照抗体组中的全部小鼠均在至少一个位置处出现异位骨,而各活化素a抗体处理组中仅仅为2只小鼠。在第6.5周,同型处理组中异位骨的平均总体积为65.4mm3,相比之下,25mg/kg活化素抗体处理组中为1.87mm3,10mg/kg活化素抗体处理组中为0.3mm3,且1mg/kg活化素抗体处理组中为7.3mm3。
- 还没有人留言评论。精彩留言会获得点赞!