粉末制剂的制作方法
相关专利和专利申请的交叉参考该申请为专利合作条约申请且要求2014年10月31日提交的美国临时申请no.62/073,821和2014年7月7日提交的美国临时申请no.62/189,252的优先权,它们都以其整体在此引入作为参考。本发明大体涉及降低化学降解物形成的方法,例如由在固体状态的具有二硫键-封闭的环的多肽如催产素中形成二聚体所导致的那些降解物。还涉及具有改善的物理或化学稳定性的药物组合物、所述组合物的吸入器和剂型、以及制备方法和使用所述组合物治疗疾病和/或病症的方法。
背景技术:
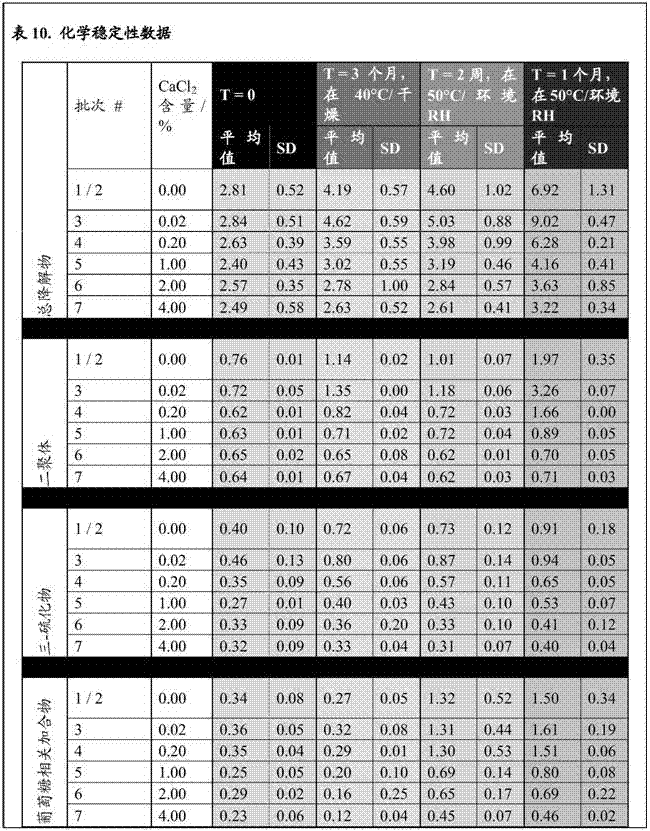
:催产素为九氨基酸多肽。其系统名称为半胱氨酸-酪氨酸-异亮氨酸-谷氨酰胺-天冬酰胺-半胱氨酸-脯氨酸-亮氨酸-甘氨酸-酰胺(cys–tyr–ile–gln–asn–cys–pro–leu–gly–nh2),且其化学名(iupac)为1-({(4r,7s,10s,13s,16s,19r)-19-氨基-7-(2-氨基-2-氧代乙基)-10-(3-氨基-3-氧代丙基)-16-(4-羟基苯甲酰基)-13-[(1s)-1-甲基丙基]-6,9,12,15,18-五氧代-1,2-二硫杂-5,8,11,14,17-五氮杂环二十碳烷-4-基}羰基)-l-脯氨酰-l-亮氨酰甘氨酰胺。催产素具有的分子量为1007道尔顿。一国际单位(iu)催产素相当于约2微克(μg或mcg)纯肽。催产素在哺乳动物生理学中起着许多非常重要的作用,包括在分娩前和分娩期间诱导子宫收缩,以及在分娩后协助血液凝固。因此,催产素的医学适应症包括分娩诱导、收缩规律的改善以及产后出血的预防。虽然催产素在发达国家以品牌名称和通用形式可容易获得,但它们主要是静脉内(iv)和肌内(im)可注射剂型,和很少见的鼻内形式。可注射形式的催产素的全球可用性受到催产素热不稳定并且需要冷藏以避免化学降解这一事实的阻碍。这种热敏感性使得该产品在世界上缺乏持续供电的地区的可行性非常有限。此外,作为注射剂,该剂型需要无菌针头和训练有素的医护人员适当地给药该产品,这在资源贫乏的环境中可能难以得到保证。目前治疗的这些局限性有非常严重的影响。在发展中国家在分娩期间死于可由催产素治疗的并发症的产妇数达到每年数十万例。在发展中国家获得催产素有可能在十年内预防数千万的产后出血病例、和数百万的死亡。现有的水性形式所面临的挑战已经使得许多小组试图将催产素配制为热稳定的干粉。各种吸入性催产素制剂在专利和科学文献中公开。为了解决这一需求,wo130016754描述了可吸入肽(例如催产素)的热稳定制剂,其中催产素作为可呼吸的干粉复合物,通过喷雾干燥溶液制备,其具有赋形剂如碳水化合物(例如海藻糖)和氨基酸(例如l-亮氨酸)。据报道,与可注射形式相比,这种可吸入的干粉形式的催产素被认为是热稳定的,并且更适合在资源贫乏的炎热的气候中用于治疗。此外,这种可吸入形式可以从简单的单位剂量吸入器递送,因此能够在没有无菌针头或经过专门培训的医务人员的帮助下进行给药,从而允许进行自我给药或通过分娩助理给药。这种干粉制剂的研究虽然非常有前途,但可以通过例如改善这些制剂的化学稳定性来改善,例如通过例如减少与肽相关的杂质和其它在储存时由于物理化学不稳定性形成的降解物。催产素物质中已知和潜在的杂质是甲酰亚胺基催产素、乙酰基催产素以及催产素的α-二聚体和β-二聚体。(参见例如,世界卫生组织,oxytocin:adoptedtextfortheinternationalpharmacopoeia(june2010))。如国际药典所述,“胺甲酰基催产素(carbimidooxytocin)”具有化学名,n-(l-半胱氨酰-l-酪氨酰-l-异亮氨酰-l-谷氨酰胺酰-l-天冬酰胺酰-l-半胱氨酰-l-脯氨酰-l-亮氨酰甘氨酰基)脲环-(1→6)-二硫化物,和以下结构:“乙酰基催产素”具有化学名乙酰基-l-半胱氨酰-l-酪氨酰-l-异亮氨酰-l-谷氨酰胺酰-l-天冬酰胺酰-l-半胱氨酰-l-脯氨酰-l-亮氨酰甘氨酰胺环-(1→6)-二硫化物,和以下结构:“α-催产素二聚体”具有化学名l-半胱氨酰-l-酪氨酰-l-异亮氨酰-l-谷氨酰胺酰-l-天冬酰胺酰-l-半胱氨酰-l-脯氨酰-l-亮氨酰甘氨酰胺二聚体(1→1':6→6')-双二硫化物,和以下结构:和“β-催产素二聚体”具有以下化学名l-半胱氨酰-l-酪氨酰-l-异亮氨酰-l-谷氨酰胺酰-l-天冬酰胺酰-l-半胱氨酰-l-脯氨酰-l-亮氨酰甘氨酰胺二聚体(1→6':1'→6)-双二硫化物,和以下结构:根据欧洲药典,为了符合欧洲药典标准,任何杂质的限制为1.5%,总限量最多为5%杂质(见欧洲药典7.0,催产素,01/2008:0780修正6.0)。如美国药典对催产素所述,测定中得到的测定制剂的色谱图中杂质的反应总和不超过催产素峰面积的5%(参见usp35officialmonograph,oxytocin,p.4192-1493(2012年8月))。以下发明代表了这种粉末制剂的进一步改进。技术实现要素:在开发热稳定的干粉催产素产品时,申请人认识到降解物的形成,如α-催产素二聚体和β-催产素二聚体杂质是由以下引起的:一个催产素分子的二硫键断裂、与在相邻的类似“打开”的催产素分子上存在的游离巯基重新形成二硫键。申请人认为,不受任何特定理论的束缚,在催产素的环结构中存在的氨基酸的阴离子部分附近提供带正电荷(+2)的物质将保持单个催产素分子的环中的二硫键的各个巯基部分足够接近,以致在二硫键断裂的情况下,巯基基团将保持彼此接近达足够的时间,以在所述单个催产素分子中而不是与相邻的另一个催产素分子的游离巯基重新形成二硫键,从而减少α-催产素二聚体和β-催产素二聚体杂质的形成。基于这一原理,申请人设计了一种减少固态、治疗活性的具有二硫键-封闭的环的多肽(如催产素、加压素等)中的二聚体杂质形成的方法,其通过包括摩尔相等量或更大量的二价阳离子物质。因此,在第一方面,本发明提供了一种用于增加固态形式(例如干粉)的具有二硫键-封闭的环的多肽如催产素的物理化学稳定性的方法,其包括:在固相复合颗粒中,提供相对每摩尔量的具有二硫键-封闭的环的多肽,摩尔相等量或更大量的二价阳离子,其中所述颗粒包含所述具有环的多肽、所述摩尔相等量或更大量的二价阳离子物质、一种或多种碳水化合物和一种或多种疏水性氨基酸。在本文中,“具有二硫键-封闭的环的多肽”是指具有由二硫键封闭的环结构的治疗活性多肽。当所述二硫键断裂时,这种二硫键封闭的环可以打开,且所述打开的环形成链。二硫键可能会重新形成,从而导致链再次采取其原始结构。环本身可以由任意数目的氨基酸组成,这些氨基酸足够长以形成这种可以被二硫键封闭的环,但不会如此长以使得二价阳离子物质不再与环的氨基酸组分的阴离子区相互作用,从而将构成二硫键的巯基亚组分保持在邻近的位置,从而使得如果二硫键被破坏则可以重新形成二硫键。在一个方面,本方法涉及具有环的多肽,其为九肽,其中9个氨基酸中的6个形成二硫键-封闭的环,如加压素或催产素。在优选的方面,具有环的多肽是催产素。在本申请中使用乙酸催产素形式的催产素。可以测量二聚体杂质含量,例如通过测量包含二价阳离子物质的给定的具有二硫键-封闭的环的多肽干粉制剂中α-催产素二聚体和/或β-催产素二聚体的量,并将其与类似的缺乏这种二价阳离子的干粉制剂比较。这种测试例如可以以任何合适的方式进行,例如通过使用反相高效液相色谱法进行。对于催产素,这种方法可以在例如欧洲药典7.0,催产素,01/2008:0780修正的6.0中发现;或在美国药典,关于催产素,35官方专著,催产素,4192-1493页(2012年8月)中找到。在本发明的一些含催产素的制剂中,在剂型制备60天或更久以后,根据峰面积响应,α-催产素二聚体的百分比是总肽含量的1.75%a/a(面积/面积)或更少,其通过hplc测定(在下面讨论的条件下);在其他实施方案中,在剂型制备60天或更久以后,为总肽含量的1.5%a/a或更少w/w;或在剂型制备60天或更久以后,为总肽含量的1.25%a/a或更少w/w;或在剂型制备60天或更久以后,为总肽含量的1.0%a/a或更少w/w;或在剂型制备60天或更久以后,为总肽含量的0.75%a/a或更少a/a,如在剂型制备60天或更久以后,为总肽含量的0.6%a/a或更少w/w。在本发明含催产素的制剂的其它实施方案中,在剂型制备60天或更久以后,根据峰面积响应,β-催产素二聚体的百分比为总肽含量的1.75%a/a或更少,如通过hplc测定;在其它实施方案中,在剂型制备60天或更久以后,为总肽含量的1.5%a/a或更少;或在剂型制备60天或更久以后,为总肽含量的1.25%a/a或更少;或在剂型制备60天或更久以后,为总肽含量的1.0%a/a或更少;或在剂型制备60天或更久以后,为总肽含量的0.75%a/a或更少,如在剂型制备60天或更久以后,为总肽含量的0.6%a/a或更少。因此,在本发明另一方面,本发明提供包含大量干粉复合颗粒的药物组合物,各复合颗粒包括:(i)一定量生理活性的具有二硫键-封闭的环的多肽;(ii)相对于多肽的量摩尔相等量或更大量的二价阳离子物质;(iii)一种或多种碳水化合物;和(iv)一种或多种氨基酸。在本发明的该另外一个方面,所述复合颗粒具有的平均空气动力学粒度小于10μm(mmad),如约5μm至0.5μm,如约3μm至约0.5μm。对于全身治疗有效的具有二硫键-封闭的环的多肽,这些颗粒被适当制定尺寸以适合递送至肺的肺泡区域。在本发明该方面的一些实施方案中,所述具有二硫键-封闭的环的多肽包括催产素(例如乙酸催产素)。复合颗粒中催产素的量为所述大量复合颗粒的质量的20%或更少,例如,15%或更少,或约10%或更少。在不同实施方案中,包含催产素的复合颗粒的百分比w/w独立地为所述复合颗粒的20%或更少、19%或更少、18%或更少、17%或更少、16%或更少、15%或更少、14%或更少、13%或更少、12%或更少、11%或更少、10%或更少、9%或更少、8%或更少、7%或更少、6%或更少、5.0%或更少、4.0%或更少、3.0%或更少、2.0%或更少、或1%或更少。在这种复合颗粒的给定吸入剂量的药物组合物中提供的催产素的量足以提供与通过可用的静脉内或肌内给药可实现的大致相等的血液水平。因此,催产素被配制为在给定的治疗中递送相当于10iu(~20mcg)催产素肌内注射产品的全身暴露。根据以下因素,本发明的药物组合物的一些实施方案可以含有约10mcg至800mcg催产素,所述因素包括但不限于,肌内注射的全身生物利用度、吸入的药物组合物的沉积性能和吸入的剂量的生物利用度。其它合适的范围可选自约25至600mcg的吸入剂量。其它可供选择的范围包括50至400mcg催产素。例如,如果假定(临床数据未定)肌内注射的催产素例如为50%或更少的全身生物利用度,并且体外级联碰撞数据表明,吸入产品的标称剂量的约20%沉积在肺的可发生全身吸收的区域,则预测与之相当的吸入剂量为50至400mcg,其中沉积的肺剂量的全身生物利用度在假定的肌内生物利用度的25%至200%的范围内。在这种情况下,200mcg剂量反映了为肌内生物利用度的50%的肺的生物利用度。在本发明该进一步的方面,所述二价阳离子物质包括提供二价阳离子,如be2+、ca2+、mg2+、sr2+、ba2+、ra2+、fe2+、zn2+和/或cu2+的物质。该二价阳离子物质可以任何合适的形式存在,如合适的盐等,其为可溶的,允许二价阳离子的解离,且其为药学上可接受的。在一个或多个实施方案中,所述二价阳离子物质包括、基本上由以下组成、或由以下组成:提供ca2+的物质。在不同实施方案中,该二价阳离子物质为盐形式。这些盐的实例包括钙盐,如乳酸钙、硫酸钙、柠檬酸钙、氯化钙、乙酸钙或其任意组合。在各种实施方案中,该二价阳离子物质以化学稳定化的量存在,认为二价阳离子物质与多肽的摩尔比如独立地为大于或等于(≥)1:1,≥2:1、≥3:1、≥4:1、≥5:1、≥6:1、≥7:1、≥8:1、≥9:1、≥10:1、≥15:1、≥20:1、≥25:1、≥50:1。二价阳离子物质的量不应太以致于不利地影响复合颗粒的物理稳定性或雾化性能。在具体实施方案中,该二价阳离子物质存在的量为相对催产素的量少于5摩尔当量,如4.75摩尔当量或更少、4.5摩尔当量或更少、4.25摩尔当量或更少、4.0摩尔当量或更少、3.75摩尔当量或更少、3.5摩尔当量或更少、3.25摩尔当量或更少、3.0摩尔当量或更少。二价阳离子物质以任何合适的量存在。在一些实施方案中,该二价阳离子物质(盐)占复合颗粒的5.0%w/w或更少。因此,在这些实施方案中,该二价阳离子物质独立地占复合颗粒的5.0%w/w或更少、4.5%w/w或更少、4%w/w或更少、3.5%w/w或更少、3%w/w或更少、2.5%w/w或更少、2.0%w/w或更少、1.5%w/w或更少、或1%或更少、0.75%w/w或更少、0.5%w/w或更少、0.25%w/w或更少、0.1%w/w或更少、0.01%w/w或更少,该量取决于存在的具有二硫键-封闭的环的多肽的量。复合颗粒的碳水化合物组分,可包括,单独或以任何组合的二糖(例如,海藻糖、蔗糖等);环糊精(例如,2-羟丙基-β-环糊精等);多糖(例如,菊糖、棉子糖、麦芽糊精、葡聚糖等),和/或糖醇(例如,甘露醇和山梨醇等)。优选非还原糖和糖醇,因为还原糖可增加多肽组分中的杂质形成,如加合物的形成。在一个或多个优选实施方案中,所述碳水化合物包括、由以下组成、或基本上由以下组成:海藻糖。在喷雾干燥的蛋白质制剂中,碳水化合物通常作为水替代物和玻璃状稳定剂。复合颗粒应占颗粒足够的百分比,以防止在喷雾干燥和储存时多肽的聚集,如占复合颗粒的10%至90%w/w,例如,占复合颗粒的25%-80%w/w。因此,在一些实施方案中,所述复合颗粒的碳水化合物组分独立地占复合颗粒的90%w/w或更少、85%w/w或更少、80%w/w或更少、75%w/w或更少、70%w/w或更少、65%w/w或更少、60%w/w或更少、55%w/w或更少、50%w/w或更少、45%w/w或更少、40%w/w或更少、35%w/w或更少、30%w/w或更少、25%w/w或更少、20%w/w或更少、15%w/w或更少、或10%w/w或更少。复合颗粒的氨基酸组分作为疏水壳形成物,可包括,单独或以任何组合的氨基酸如甘氨酸、丙氨酸、天冬氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、脯氨酸、苯丙氨酸、色氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酸、赖氨酸、精氨酸、组氨酸、正亮氨酸,和它们的修饰形式。本文中使用的氨基酸,包括以下氨基酸的二肽和三肽:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、脯氨酸、苯丙氨酸、色氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酸、赖氨酸、精氨酸、组氨酸、正亮氨酸(包括,但不限于三亮氨酸)。在一些实施方案中,对于包含二亮氨酰基的三聚体,该三聚体的第三个氨基酸组分可为以下之一:亮氨酸(leu)、缬氨酸(val)、异亮氨酸(isoleu)、色氨酸(try)、丙氨酸(ala)、蛋氨酸(met)、苯丙氨酸(phe)、酪氨酸(tyr)、组氨酸(his)和脯氨酸(pro)。"亮氨酸",无论是作为单一氨基酸或作为肽的氨基酸组分存在,是指氨基酸亮氨酸,其可为外消旋混合物或为其d-或l-形式。在本发明的一个或多个实施方案中,复合颗粒的一种或多种氨基酸,包括、基本上由以下组成、或由以下组成:l-亮氨酸。在本发明一个方面,该氨基酸即疏水性壳形成组分可占复合颗粒质量的40.0%或更少。因此,疏水性壳形成物质可独立地为复合颗粒的40%w/w或更少、35%w/w或更少、30%w/w或更少、25%w/w或更少、20%w/w或更少、15%w/w或更少、或10%w/w或更少。在其它实施方案中,疏水性壳形成组分占复合颗粒的约40%至10%,例如,复合颗粒的约25.0%至15.0%。在一些实施方案中,该疏水性壳形成组分占复合颗粒的约22%至约18%,例如,占复合颗粒的约20.0%。复合颗粒可以构成通过干粉吸入器递送的制剂或如下所述配制在加压的液体推进剂制剂中且通过mdi递送的制剂的唯一内含物。或者,本文所述的复合颗粒可以形成为药物制剂,其进一步包含不可呼吸尺寸的药学上可接受的赋形剂的干粉载体/稀释剂颗粒。在本发明的一些实施方案中,复合颗粒可以与合适的载体/稀释剂物质部分混合,该载体/稀释剂物质部分可以是无定形粉末、结晶粉末或无定形和结晶粉末的组合的形式。合适的载体/稀释剂物质包括:(a)碳水化合物,包括非还原糖,如二糖(例如,海藻糖、蔗糖等);环糊精(例如,2-羟丙基-β-环糊精等);和/或多糖(例如,菊糖、棉子糖、麦芽糊精、葡聚糖等);环糊精(例如,2-羟丙基-β-环糊精);(b)氨基酸(例如,甘氨酸、精氨酸、天冬氨酸、谷氨酸、半胱氨酸、赖氨酸等);(c)从有机酸和碱制备的有机盐(例如,柠檬酸钠、抗坏血酸钠、葡糖酸镁、葡糖酸钠、胺丁三醇盐酸盐等);(d)肽和蛋白质(例如,阿司帕坦、人血清白蛋白、明胶,等);和/或(e)糖醇(例如,甘露醇、木糖醇等),单独或以任何组合形式。乳糖作为本制剂中的载体/稀释剂是不利的,因为它与催产素反应,通过在催产素的末端氨基上进行的美拉德反应,导致快速的杂质形成。在一些实施方案中,载体/稀释剂颗粒包含一种或多种糖醇、基本上由一种或多种糖醇组成或由一种或多种糖醇组成。在特别优选的实施方案中,载体/稀释剂颗粒包含甘露醇、基本上由甘露醇组成或由甘露醇组成。载体/稀释剂颗粒可通过以下制备,例如,从较大颗粒研磨而形成,或可生成为合适定尺寸的颗粒,例如通过喷雾干燥。载体/稀释剂颗粒通常为不可呼吸尺寸。在本发明的该方面,合适的载体/稀释剂颗粒组合物(不含添加剂物质)具有的mmad大于(>)10微米尺寸。例如,载体/稀释剂部分具有的mmad为大于10μm至约500μm,如>10μm至50μm、50μm-100μm、100μm-150μm。在一些其它实施方案中,载体部分的mmad为大于35μm至100μm。在本发明该方面的一个或多个实施方案中,该药物制剂进一步包含添加剂物质,其中所述添加剂物质包括一种或多种硬脂酸盐,如硬脂酸钙、硬脂酸镁,和/或一种或多种氨基酸,以任何组合。在一种或多种具体实施方案中,该添加剂物质包括、基本上由以下组成、或由以下组成:硬脂酸镁。在药物制剂中加入添加剂物质的实施方案中,添加剂通常为载体/稀释剂部分的质量的10%或更少。在这样的实施方案中,添加剂物质可以与载体/稀释剂组合,并且一起形成载体/稀释剂-添加剂共混物。例如,本发明该方面的共混物独立地包括,例如,约99.75:0.25%w/w、约99.50:0.50%w/w、约99.25:0.75%w/w、约99.0:1.0%w/w、约98.75:1.25%w/w、约98.50:1.50%w/w、约98.25:1.75%w/w、约98.0:2.0%w/w、约97.75:2.25%w/w、约97.50:2.50%w/w、约97.25:2.75%w/w、约97.0:3.0%w/w、约96.75:3.25%w/w、约96.50:3.50%w/w、约96.25:3.75%w/w、约96.0:4.0%w/w、约95.75:4.25%w/w、约95.50:4.5%w/w、约95.25:4.75%w/w、约95.0:5.0%w/w、约94.75:5.25%w/w、约94.50:5.5%w/w、约94.25:5.75%w/w、约94.0:6.0%w/w、约93.75:6.25%w/w、约93.50:6.5%w/w、约93.25:6.75%w/w、93.0:7.0%w/w、约92.75:7.25%w/w、约92.50:7.5%w/w、约92.25:7.75%w/w、92.0:8.0%w/w、约91.75:8.25%w/w、约91.50:8.5%w/w、约91.25:8.75%w/w、91.0:9.0%w/w、约90.75:9.25%w/w、约90.50:9.5%w/w、约90.25:9.75%w/w、或90.0:10.0%w/w的载体/稀释剂质量:添加剂物质质量。添加剂物质的颗粒可为可呼吸或不可呼吸的尺寸范围。在一些实施方案中,在与组合物的一种或多种其它组分颗粒(即,与载体/稀释剂颗粒部分,或组合的载体/稀释剂和复合颗粒,或与复合颗粒部分)混合之前,添加剂部分的颗粒具有的mmd为100μm或更少,例如,独立地,95μm或更少、90μm或更少、85μm或更少、80μm或更少、75μm或更少、70μm或更少、60μm或更少、50μm或更少、40μm或更少、30μm或更少、20μm或更少、或10μm或更少。在其它实施方案中,所述添加剂物质部分包括平均粒度(例如平均质量直径)独立地为10μm或更少、例如、9μm或更少、8μm或更少、7μm或更少、6μm或更少、5μm或更少、4μm或更少、3μm或更少、2μm或更少、或1微米或更少的添加剂物质颗粒。在药物制剂包含复合颗粒、载体/稀释剂载体颗粒和添加剂物质的实施方案中,这些组分可以以任何合适的方式混合,其是本领域普通技术人员将会认识到的。例如,添加剂物质可以与载体/稀释剂颗粒混合以形成载体/稀释剂-添加剂预混物。然后预混物可与含有治疗活性多肽(例如催产素)的复合颗粒混合。或者,可以将添加剂物质与复合颗粒混合,然后可将混合的复合颗粒-添加剂物质与载体稀释剂颗粒混合。或者,复合颗粒、载体/稀释剂颗粒和添加剂物质可以同时混合。物质的混合可以通过任何合适的方式进行,包括高剪切研磨、机械融合、超离心研磨、喷射研磨、高压匀化、球磨、搅拌珠磨、空气喷射研磨、针磨(pinmilling)、锤磨或刀铣削、共振声混合或其他合适的方法/机制。载体/稀释剂物质可以与添加剂物质组合,例如可以共同喷雾干燥所述两种物质的一种或多种溶液或悬浮液原料以产生含有添加剂物质的载体/稀释剂颗粒。混合强度,即干粉总质量中复合颗粒的百分比与载体/稀释剂部分(可以含有或不含有添加剂)的百分比可用于控制在单一吸入中递送的催产素的剂量。混合强度将通过考虑以下因素来确定:如复合颗粒中催产素的百分比、实现给定剂量所需的复合颗粒的量以及给定剂量容器(例如泡罩或胶囊)的填充重量。因此,在将复合颗粒与载体/稀释剂(具有或不具有添加剂物质)颗粒混合或共混的实施方案中,含活性成分的部分(复合物)与含惰性物质的部分(载体/稀释剂(具有或不具有添加剂物质))的比例可为.001:99.999至99.999。在本文所述的实施方案中,干粉药物组合物中的复合颗粒的百分比可以独立地占药物组合物的例如大于(>)0.001%、>0.01%、>0.1%、>1.0%、>2.0%、>3%、>4%、>5.0%、>6%、>7%、>8%、>9%、>10%、>11%、>12%、>13%、>14%、>15%、>16%、>17%、>18%、>19%、>20%、>21%、>22%、>23%、>24%、>25%、>26%、>27%、>28%、>29%、>30%、>31%、>32%、>33%、>34%、>35%、>36%、>37%、>38%、>39%、>40%、>41%、>42%、>43%、>44%、>45%、>46%、>47%、>48%、>49%、>50%、>51%、>52%、>53%、>54%、>55%、>56%、>57%、>58%、>59%、>60%、>61%、>62%、>63%、>64%、>65%、>66%、>67%、>68%、>69%、>70%、>71%、>72%、>73%、>74%、>75%、>76%、>77%、>78%、>79%、>80%、>81%、>82%、>83%、>84%、>85%、>86%、>87%、>88%、>89%、>90%、>91%、>92%、>93%、>94%、>95%、>96%、>97%、>98%、或>99%。因此,在本发明一些实施方案中,本发明提供药物制剂,包括:(a)多个复合颗粒,所述复合颗粒的每一个包括、由以下组成、或基本上由以下组成:(i)药理学有效量的催产素,(ii)相对催产素的量,摩尔相等量或更大量的包括ca2+的二价阳离子物质,(iii)碳水化合物,所述碳水化合物包括海藻糖,和(iv)氨基酸,l-亮氨酸,其中所述复合颗粒具有的mmad为约5μm至约0.5μm,(b)不可呼吸尺寸的载体/稀释剂颗粒,所述载体/稀释剂颗粒包括甘露醇;和(c)混合量的硬脂酸镁。在本发明另一方面,本发明提供制备用于药物制剂的复合颗粒的方法,包括:(a)在药学上可接受的液体中溶解和/或悬浮以下物质以形成原料:(i)一定量的可逆的具有环的多肽(例如,加压素或催产素),(ii)相对可逆的具有环的多肽的量,摩尔相等量或更大量的二价阳离子物质,(iii)氨基酸,和(iv)碳水化合物;和(2)从该原料去除液体以制备颗粒。其中所述颗粒具有的质量中值空气动力学直径为约0.5μm至约7μm。在另一个实施方案中,通过喷雾干燥、冷冻干燥等来实现除去液体的步骤。本发明的另一方面是提供一种通过经由肺全身递送催产素从而治疗可由催产素治疗的病症(例如,产后出血)的方法,包括以下步骤:(a)提供含有至少一剂量的药物制剂的吸入器,其包含:大量干粉形式的复合颗粒,所述复合颗粒包括:催产素、相对所述催产素至少一摩尔当量的二价阳离子、氨基酸和碳水化合物。(b)通过激活所述吸入器分散所述复合颗粒,(c)通过吸入将所述复合颗粒递送到个体肺的肺泡区域以实现全身吸收。特别希望这种方法和组合物足够方便以允许自我给药,即使离开医院或医务人员,并且能够以相对较少的吸入次数递送期望的总剂量,所述吸入次数优选少于10次,更优选少于4次,甚至更优选2次,最优选1次吸入。通过参考说明书的其余部分和附图,对本发明的性质和优点的进一步理解将变得显而易见。附图简述图1是催产素从其半胱氨酸-半胱氨酸连接的(二硫键)环取向转变为线性形式以形成催产素的α-二聚体和β-二聚体的可逆过程的示意图。图2是根据本发明方法的催产素的示意图,其显示相互作用的导致形成环结构的半胱氨酸-半胱氨酸二硫键,和推测的二价阳离子的位置在固态时稳定二硫键的功能。图3是在强制降解研究中,绘制催产素降解物随时间的%α二聚体(对应每一测试天数的第二和第四条棒图)和β二聚体(对应每一测试天数的第三和第六条棒图),与本发明的药物制剂(具有cacl2(对应每一所示天数的第4-6条棒图))和对照(没有cacl2(对应每一所示天数的第1-3条棒图)相比较。图4是绘制本发明的两种药物制剂的fpm(通过ngi)的图示(n=3+/-测量的单个值的最大值/最小值),一种药物制剂已经与载体/稀释剂颗粒共混,一种并未共混。图5是比较散装(冷冻干燥)催产素、不含二价阳离子物质的喷雾干燥复合混合物和具有2%氯化钙的相似混合物的总杂质和含湿量的图示。图6是含有0%、1%、2%和4%二价阳离子的颗粒组合物的复合颗粒的玻璃化转变温度的图示。图7是含有0%、1%、2%和4%二价阳离子物质的颗粒组合物的复合颗粒的含湿量的图示。图8是含有0%、1%、2%和4%二价阳离子物质的颗粒组合物的复合颗粒的粒度分布的图示。图9进一步描述催产素分子,其中用点划线圈出葡萄糖加合物的主要反应点(nh2),用虚线圆圈表示二聚体和三-硫化物反应点(s-s)。图10描绘催产素–葡萄糖加合物。图11描绘催产素的α-二聚体。图12描绘催产素的β-二聚体。图13描绘催产素的三-硫化物降解物。图14为总降解物含量百分比的图示。图15显示二聚体含量。图16显示葡萄糖加合物含量。图17表示三-硫化物降解物含量。本发明的具体实施方案的详述在本申请中使用以下术语,并且意图具有所示的含义。在用于颗粒生产的原料的情况下使用的“水性”将被理解为至少部分地由水构成的液体,但可以包括其它与水可混溶的液体,例如作为共溶剂的液体,如醇(如乙醇、异丙醇)。无论如何,本领域技术人员将认识到,根据本发明的方法,水性液体必须适合于喷雾干燥。“干粉”是指根据具体配方,通常含有小于约10%的水分,优选小于约6%的水分,最优选含有少于约3%的水分的粉末组合物。“粉末”是指所述物质包括自由流动的颗粒,其尺寸被选择为允许渗入肺的肺泡,优选直径小于10μm,优选小于7μm,最优选小于5μm,以及优选直径在5μm至0.5μm的范围内。本文所用的“细颗粒质量”或“fpm”是指在ngi级联碰撞的阶段3、4和5中沉积的颗粒的质量,其大致等于空气动力学尺寸为约5μm至约1微米的颗粒,流速为每分钟60升。根据ngi的产品说明书,第3阶段收集空气动力学尺寸为4.4μm至2.8μm的颗粒,第4阶段收集2.8μm至1.7μm的颗粒,第5阶段收集1.7μm至0.92μm的颗粒。“质量中值直径”或“mmd”是颗粒平均几何尺寸的量度,因为本发明的药物组合物的复合颗粒可以是多分散的(即由一定范围的粒度组成),或者可能会破裂或附聚。通过激光衍射可以确定本文报道的mmd值,但可以使用任何数量的常用技术来测量平均粒度(例如电子显微镜、光散射、激光衍射)。可以在与载体/稀释剂颗粒共混之前确定例如本文所述的复合颗粒的mmd值。“质量中值空气动力学直径”或“mmad”是分散颗粒的空气动力学尺寸的量度。空气动力学直径用于描述雾化粉末的沉降行为,并且是在空气中具有与颗粒相同沉降速度的单位密度球的直径。空气动力学直径包括颗粒形状、颗粒的密度和物理尺寸。如本文所用,除非另有说明,mmad是指通过级联碰撞(优选地通过ngi)确定的雾化粉末的空气动力学粒度分布的中点或中值。“下一代撞击器(ngi)”是指一种级联撞击器,用于根据其沉积行为将气雾颗粒分类成尺寸级分,其包含七个撞击阶段和最终的微孔收集器,并且其可从例如mspcorporation(shoreline,mn,usa)商购。撞击器描述于例如美国专利6453758、65343301和6595368;英国专利gb2351155、gb2371001和gb2371247中,且其在吸入器中的应用详述于uspharmacopeia29:601,“aerosols,nasalsprays,metered-doseinhalers,anddrypowderinhalers”。“不可呼吸尺寸”是指具有大于10μm,例如大于约20μm,例如大于35μm,在一些实施方案中大于50μm的空气动力学尺寸的颗粒。通常,在本申请中用作载体/稀释剂物质的这种不可呼吸的颗粒具有的mmad为15-500μm尺寸。“药学上可接受的载体/稀释剂”是指可任选地包括在本发明的组合物中,并且被摄入肺中,对受试者,特别是受试者的肺没有显著的不利的毒理作用的赋形剂颗粒。药学上可接受的载体/稀释剂可以包括一种或多种改善药物制剂的化学或物理稳定性的添加剂赋形剂物质。载体/稀释剂颗粒(具有或不具有添加剂)在本文中可以称为“载体部分”或“载体/稀释剂部分”。“药理学有效量”或“生物活性剂的生理有效量”是在本文所述的可雾化组合物中存在的活性剂的量,当这种组合物被肺部施用时其需要在待治疗受试者的血液中提供所需水平的活性剂,以得到预期的生理反应。精确的量将取决于许多因素,例如活性剂、组合物的活性、所用的递送装置、组合物的物理特性、预期的患者使用(即,每天施用的剂量数)、患者考虑因素等等,并且可以由本领域技术人员基于本文提供的信息容易地确定。所有这里提及的盐包括无水形式和所有水合形式的盐。缩写:“%w/w”以重量计的含量百分比“a/a”面积/面积“cacl2”氯化钙“ca2+”二价钙阳离子“cs”化学稳定性“dsc”差示扫描量热法“fpf”细颗粒部分“hplc”高压液相色谱法“im”肌内“iu”国际单位“iv”静脉内(iv)“kf”karlfischer“mg2+”二价镁阳离子“ngi”下一代撞击器“t:l:o”以%w/w计的海藻糖:亮氨酸:催产素“t:l:c:o”以%w/w计的海藻糖:亮氨酸:cacl2:催产素“uv”紫外线吸收“μm”微米“wc”水含量多种本发明的实施方案的描述本发明涉及减少一些化学降解物的形成的方法,例如与可吸入粉末形式的具有二硫键-封闭的环的多肽(如催产素)相关的二聚体降解产物、以及用于制备具有改善的化学稳定性的药物组合物的方法、组合物本身、以及它们在治疗中的用途。这种组合物还应该是物理化学稳定的,优选由粉末制剂组成,其能够耐受热和/或湿气保持适当的时间。催产素的主要降解途径被充分证明,其为在催产素分子中形成胱氨酸官能团的两个半胱氨酸氨基酸的二硫键的热刺激断裂。如图1所示,分子活性形式的催产素(最上面的化合物)在两个半胱氨酸之间形成环结构,这两个半胱氨酸是序列中的第一和第六个氨基酸。然而,环是可断裂的,并且一旦断裂(如中间化合物所示),该键可以重新形成为分子的活性形式(如顶部和中间化合物之间的可逆箭头所示),或作为当前市售产品中的两种主要降解物之一,即α-二聚体或β-二聚体(如图1的底部所示),当这种键是与另一相邻催产素分子的胱氨酸重新形成而不是在同一分子内重新形成时,可形成两种二聚体中的任一种。据信,活性形式的环结构可以包含足够的极性基团,其适当排列形成中心带正电荷的原子周围的复合物,并且这种带正电荷的原子可能限制一旦二硫键断裂催产素环结构能够打开的程度。这种排列如图2所示,其描绘了位于环结构内的二价阳离子(例如ca2+,mg2+)。如果这种环结构保持足够长的时间,以使键在没有环结构打开的情况下重新组成,则分子的原始活性形式将被恢复。在溶液相中,由于所有组分都是可移动的,因此这个优点可能很小;除了非常牢固的复合物之外的任何东西都是短暂的,并且还有时间打开环。然而,在金属离子不能逸出复合物的固相基质中,它将提供持久的环保持和稳定的作用。如本文所述,本发明一方面提供增加具有二硫键-封闭的环的多肽固态组合物(例如,催产素)的物理化学稳定性的方法(例如,通过减少二聚体降解物的量),包括在固体-相中提供相对催产素的量至少摩尔相等量的二价阳离子。在一些实施方案中,二价阳离子物质与多肽的摩尔比为1:1至50:1。在具体实施方案中,二价阳离子物质与多肽的摩尔比为1:1至少于5:1。在该方法一些实施方案中,二价阳离子物质提供,例如、ca2+、mg2+、fe2+、zn2+和/或cu2+,例如以合适的盐形式。(例如cacl2等)。在该方法中,合适的碳水化合物(例如,海藻糖)和/或疏水氨基酸(例如,l-亮氨酸)可包含在所述固态组合物中,其在本文进一步讨论。因为催产素与加压素结构类似,例如,精氨酸加压素的氨基酸序列为cys-tyr-phe-gln-asn-cys-pro-arg-gly,其中半胱氨酸残基形成二硫键。赖氨酸加压素具有代替精氨酸的赖氨酸。本文的讨论同样适用于含有二硫桥接键的其它化合物。在本发明的另一方面,催产素存在于复合颗粒中,还包含摩尔相等量或更大量的二价阳离子物质、至少一种氨基酸和至少一种碳水化合物赋形剂。认为碳水化合物在复合颗粒中是有益的,不仅用作水替代物和结构组分,而且还有助于增加环结构重新形成的可能性(优先于优选二聚体形成),并增加制剂的玻璃转化温度(tg)。可以测量物理化学稳定性,例如与不含这种二价阳离子的干粉制剂相比,α(α)-催产素二聚体和/或β(β)催产素二聚体形成量的减少。在具体实施方案中,该复合颗粒包含催产素;二价阳离子物质,氯化钙;氨基酸,l-亮氨酸;和碳水化合物,甘露醇。如本文所述,本发明的另一方面提供包含大量复合颗粒的药物制剂,每个所述复合颗粒包含:催产素,相对所述催产素摩尔相等量或更大量的一种或多种二价阳离子物质,氨基酸,和碳水化合物,其中所述颗粒具有的空气动力学粒度为约5μm至0.5μm,且适合递送至肺的肺泡区域。在本发明的各个方面的一个或多个实施方案中,所选择的赋形剂形成无定形玻璃基质,催产素被分散其中,其基本上是非结晶的,或者没有实质的结晶区域或规则的重复结构分子顺序。在一些实施方案中,复合颗粒的氨基酸内含物包括l-亮氨酸,并且l-亮氨酸占所述制剂的干组分的5-40%重量。更优选地,l-亮氨酸将占复合颗粒的10至40%重量。如将理解的,雾化颗粒沉积在肺中,取决于空气动力学因素,以及其它因素如密度、空气流动速度和方向性等。在空气动力学上,本发明的复合颗粒被设计成尺寸小于7μm,优选小于5μm,但大于约0.5μm。因此,它们被设计成沉积在患者肺的肺泡区域中。因此,可以产生复合颗粒,其空气动力学尺寸独立地小于7μm,更优选小于约6μm,例如独立地为约5μm或更小,约4μm或更小,约3μm或更小,约2μm或更小或约1μm至约0.5μm。本发明的药物组合物预期用于递送至肺,并且将具有小于约7μm(例如约6μm至约0.5μm)的质量中值空气动力学直径(mmad)。因此,这种复合颗粒的组合物可以具有以下mmad:独立地小于约7μm,更优选小于约6μm,例如独立地为约5μm或更小,约4μm或更小,约3μm或更小,约2μm或更小或约1μm至约0.5μm。根据本发明的优选组合物将基本上不含渗透增强剂。“渗透增强剂”是促进催产素(或其他药物)通过粘膜或上皮渗透的表面活性化合物,并被提出用于鼻内、直肠内和阴道内药物制剂中。示例性的渗透增强剂包括胆汁盐,例如牛磺胆酸盐、甘胆酸盐和脱氧胆酸盐;夫西地酸盐(fusidates),例如牛磺脱氢夫西地酸盐;和生物相容的洗涤剂,例如吐温,月桂醇聚醚-9等。然而,在肺制剂中使用渗透促进剂通常是不期望的,因为肺中的上皮血液屏障可受到这种表面活性化合物的不利影响。在催产素的情况下,认为希望避免被设计为将催产素加速递送至血液的物质,因为催产素相关的大多数副作用与cmax相关。催产素通常是无定形物质。干粉催产素优选通过在导致具有在上述范围内的粒度的基本无定形粉末的条件下喷雾干燥制备。用于形成包含所需尺寸范围的颗粒的催产素粉末的优选方法是喷雾干燥,其中将纯的散装乙酸催产素溶解在含有溶解的其它赋形剂的溶液中,使总溶解固体含量为5%w/w。如果需要,可以调节溶液的ph。然后可将溶液在诸如buchi、niro等的商业供应商的常规喷雾干燥设备中进行喷雾干燥,得到基本无定形的颗粒产物。本发明的催产素粉末可以任选地与适用于呼吸给药和肺部给药的药物载体或赋形剂组合。当期望减少递送给患者的粉末中的催产素浓度时,这样的载体可以简单地用作填充剂,但也可用于增强催产素组合物的稳定性并改善粉末在粉末分散装置中的分散性,以提供催产素的更有效和可再现的递送,并改善催产素的处理特性,例如流动性和一致性,以促进制造和粉末填充。合适的载体/稀释剂物质可以是无定形粉末、结晶粉末或无定形粉末和结晶粉末的组合的形式。合适的物质包括碳水化合物、非还原糖,如二糖,如海藻糖、蔗糖等;环糊精,如2-羟丙基-β-环糊精;和多糖,如棉子糖,麦芽糊精,葡聚糖等;(b)氨基酸,如甘氨酸、精氨酸、天冬氨酸、谷氨酸、半胱氨酸、赖氨酸等;(c)从有机酸和碱制备的有机盐,如柠檬酸钠、抗坏血酸钠、葡糖酸镁、葡糖酸钠、胺丁三醇盐酸盐等;(d)肽和蛋白质,如阿司帕坦、人血清白蛋白、明胶,等;(e)糖醇,如甘露醇、木糖醇等。在一个或多个实施方案中,所述载体/稀释剂颗粒包括糖醇,(例如,甘露醇)。乳糖作为本制剂中的载体/稀释剂是不利的,因为它与催产素反应,导致快速的杂质形成。载体可以单独制备成干粉形式并通过共混与干粉催产素组合。单独制备的粉末载体通常是结晶的(以避免吸水),但在一些情况下可能是无定形的或结晶物和无定形物的混合物。可以选择载体颗粒的尺寸以改善所述大量复合颗粒的流动性;通常这种载体颗粒在25μm至200μm的范围内。在该尺寸范围内的载体颗粒通常不会渗入肺的肺泡区域,并且在吸入之前通常会与递送装置中的催产素分离。因此,渗入肺的肺泡区域的颗粒将基本上由以下组成:选择的活性药物成分(例如催产素)、化学稳定化量的二价阳离子(其以相对催产素摩尔相等量或更大量存在)、以及氨基酸和碳水化合物。优选的载体/稀释剂物质是尺寸在上述范围内的结晶甘露醇。在另外的实施方案中,将载体/稀释剂颗粒与添加剂物质(例如硬脂酸镁)混合。在一些实施方案中,包含载体/稀释剂部分的颗粒具有不可呼吸的尺寸。这样的载体/稀释剂部分可以在受控的尺寸范围内形成,以便赋予药物制剂所需的特性或属性。例如,稀释剂/载体部分可以包括空气动力学尺寸在下限和上限之间的颗粒。合适的范围可以独立地选择,例如,在以下范围内:大于(>)10μm至500μm、>10μm至400μm、>10μm至300μm、>10μm至200μm、>10μm至100μm、>10μm至50μm、20μm至500μm、20μm至400μm、20μm至300μm、20μm至200μm、20μm至100μm、20μm至50μm、30μm至500μm、30μm至400μm、30μm至300μm、30μm至100μm、30μm至50μm、35μm至500μm;35μm至400μm、35μm至300μm、35μm至200μm、35μm至100μm、35μm至50μm、40μm至500μm;40μm至400μm、40μm至300μm、40μm至200μm、40μm至100μm;40μm至50μm、45μm至500μm;45μm至400μm、45μm至300μm、45μm至200μm、45μm至100μm;45μm至50μm、50μm至500μm、50μm至400μm、50μm至300μm、50μm至200μm、50μm至100μm;60μm至500μm、60μm至400μm、60μm至300μm、60μm至200μm、60μm至100μm;75μm至500μm、75μm至400μm、75μm至300μm、75μm至200μm、75μm至100μm;100μm至500μm、100μm至400μm、100μm至300μm、100μm至200μm、150μm至500μm、150μm至400μm、150μm至300μm、150μm至200μm、200μm至500μm、200μm至400μm、and200μm至300μm、250μm至500μm、250μm至400μm、and250μm至300μm、300μm至500μm、300μm至400μm、350μm至500μm、350μm至400μm、和400μm至500μm,和在前述各个范围子集之间的适当范围。如上所述,本发明的含催产素的药物制剂优选地被布置成使得每个吸入剂量等于静脉内或肌肉内可实现的血液水平。因此,催产素配制成以单次吸入剂量递送,全身暴露量相当于10iu(~20mcg)催产素肌内注射产品。在本申请的多个方面,给定剂量中递送或包含的活性的含封闭环的多肽的量取决于多种因素,如肽的全身生物利用度、递送到肺内的所需区域的吸入复合颗粒的标称剂量的百分比、以及给定剂量容器(例如,胶囊、泡罩、定量容器等)的填充重量,所有这些可以由普通技术人员确定。在替代实施方案中,施用可以是每天一次,或每天几次,例如2、3、4或8次,每次给予例如1或更多剂量,以实现期望的血液水平。根据规格,递送剂量的给药时间优选小于2分钟,通常小于30秒,优选小于20秒。药物制剂可以通过干粉吸入器以干粉形式存在,或者配制成在合适的加压液体推进剂中的悬浮液并通过定量吸入器递送。递送装置:干粉吸入器包含本文所述的大量复合颗粒的药物组合物可以定量为单个剂量,并以多种方式递送,本发明的另外方面涉及递送定量的本发明组合物的剂型和吸入器。在这些方面,本发明的组合物是可从干粉吸入器递送的干粉组合物的形式,或作为从加压的定量吸入器递送的加压液体推进剂悬浮液制剂。因此,在一个或多个实施方案中,本发明涉及适于通过作为干粉吸入给药于患者的剂型。在本发明的一个方面,我们提供了一种含有一种或多种预计量剂量的本发明组合物的干粉吸入器。“干粉吸入器”或“dpi”是指一种装置,其含有一种或多种剂量的干粉形式的本发明药物组合物、将一剂量干粉暴露于空气流中的机械装置、以及管口形式的出口,使用者可以通过该出口吸入,以将暴露剂量的药物组合物夹带在气流中并进入肺的目标区域。本发明的药物组合物可以包含在含有预定量的药物组合物的剂量容器内。在一个或多个实施方案中,剂量容器可以是胶囊或药筒。例如,胶囊可以包括羟丙基甲基纤维素、明胶或塑料等。在一些实施方案中,胶囊将具有粉末容量,例如每个胶囊约50mg或更少;例如40mg或更少;35mg或更少;30mg或更少;25mg或更少,或每个胶囊20mg或更少,或其他合适的量。胶囊被填充的程度符合与剂量容器(例如胶囊、泡罩或定量容器)的总内部体积相关的公式,可为性能相关的,这是本领域技术人员可以确定的。在单位剂量吸入器中,胶囊/药筒(每个胶囊/药筒一个剂量)通常被装载到吸入装置中,通常由患者按需装载。该装置具有破裂、刺穿或以其他打开胶囊的方式,使得当剂量在装置管口处吸入时能够被夹带到患者的肺中。作为这样的设备的市售例子,可以提及glaxosmithkline的rotahalertm(例如在us4353365中描述),boehringeringelheim的handihalertm或novartis的breezhalertm。含有本文所述的药物组合物的多剂量干粉形式可以采用多种不同的形式。例如,多剂量可以包括一系列密封的泡罩,其中组合物密封地包含在泡罩袋中,并且被布置为盘形或细长条。使用这种多剂量形式的代表性吸入装置包括以下装置:由glaxosmithkline销售的诸如diskhalertm、diskustm和elliptatm吸入器。例如在us4,627,432和us4,811,731中描述了diskhalertm。例如,在us5,873,360(gb2242134a)中描述了diskustm吸入装置。例如,在us8,511,304、us8,161,968和8,746,242中描述了ellipta吸入器。再次,剂量容器(泡罩等)可以是可破裂的、可剥离的或以其他方式可开启的,一次一个,并且一剂干粉组合物通过在吸入装置的管口吸气而给药,如本领域已知。或者,本发明的组合物可以经由基于干粉储存器的装置内计量的干粉吸入器施用,其中本发明的药物组合物以散装的形式提供在吸入器的储存器中。吸入器包括计量机构,用于从储存器计量出单个剂量的组合物,所述储存器暴露于吸入通道,其中计量的剂量能够被在装置的管嘴处吸气的患者吸入。这种类型的市售设备是astrazeneca的turbuhalertm、schering的twisthalertm和innovata的clickhalertm。除了从被动设备递送之外,本发明的组合物可以从主动设备(activedevice)递送,其用来递送和解聚组合物的剂量的能量并非来自患者的吸气作用导出的能量。药物组合物可以基本上由本文所述的干粉形式的复合颗粒组成。或者,药物组合物可以包含可与载体/稀释剂颗粒例如甘露醇混合的复合颗粒,有或没有其它赋形剂物质(即,添加剂)如润滑剂,还包含氨基酸或其它被指明在这样的载体/稀释剂制剂中具有有益性质的赋形剂,它们组合形成微细粉末。在本发明一个或多个实施方案中,本发明的干粉组合物具有的含湿量为低于约10%重量的水,如含湿量为约9%重量或更低;如约9%重量、8%重量、7%重量、6%重量、5%重量、4%重量、3%重量、2%重量、或1%重量或更低的水。在一个或多个优选实施方案中,该干粉药物组合物具有的含湿量为低于约3%重量的水,如1%重量或更低。含湿量可以通过任何合适的技术来确定,例如体积滴定和/或库仑滴定(例如karlfisher滴定)。在各种实施方案中,dpi剂型(例如胶囊或泡罩)、或含有药物制剂的dpi整体,也可以与其它构造物结合使用,例如但不限于用于储存和容纳dpi或剂型的外包装,其具有或不具有干燥剂物质或含湿量控制物质,该干燥剂物质或含湿量控制物质可以作为小袋包含在其中,或与所选择的物质成一体(即,所选择的物质具有干燥剂特性)。递送装置:定量吸入器在本发明的另一方面,本文所述的药物组合物可以配制在合适的液体加压液体推进剂中,用于计量剂量(mdi)。“定量吸入器”或“mdi”是指包括罐、覆盖罐的固定盖和位于盖中的制剂计量阀的单元。mdi系统包括合适的引导装置。合适的引导装置包括例如阀致动器和圆柱形或锥形通道,通过它们,药物可以经由计量阀(例如管口致动器)被从填充的罐输送到患者的鼻子或口中。本文详述的药物组合物可以制备成于用于mdi的液化推进剂中的悬浮颗粒。因此,本发明的另外方面提供了含有本文所述的药物制剂的定量吸入器以及其中使用的液体推进剂药物制剂本身。这样的吸入器可以是通常包括用阀(例如计量阀)封闭的罐(例如铝罐)的定量吸入器(mdi)的形式,并且该罐安装到致动器上,具有管口,并且填充有含有本文所述的药物组合物的液体加压液体推进剂制剂。合适装置的实例包括定量吸入器,如(gsk)如(chiesi)、skyefinetm和skyedrytm(skyepharma)。当配制用于定量吸入器时,根据本发明的药物组合物被配制为于加压液体推进剂中的悬浮液。在本发明的一个或多个实施方案中,尽管在mdi中使用的推进剂可以是cfc-11和/或cfc-12,但优选推进剂是臭氧友好的、非cfc推进剂,例如1,1,1,2-四氟乙烷(hfc134a)、1,1,1,2,3,3,3-七氟正丙烷(hfc-227)、hcfc-22(二氟氯甲烷)、hfa-152(二氟乙烷和异丁烯),单独或以任何组合的形式。这样的制剂可以仅由推进剂和本文所述的复合颗粒组成,或者还可以包括一种或多种表面活性剂物质,例如聚乙二醇、二甘醇单乙醚、聚氧乙烯脱水山梨醇单月桂酸酯、聚氧乙烯脱水山梨醇单油酸酯、丙氧基化聚乙二醇和聚氧乙烯月桂基醚、油酸、卵磷脂或低聚乳酸衍生物,例如如wo94/21229和wo98/34596中所述,用于将组合物悬浮在其中,并且还可以包括增溶剂(共溶剂可以包括例如乙醇)、制剂的润湿和乳化组分和/或用于润滑mdi的阀组分,以提高溶解度,或改善味道。在本发明的一个或多个实施方案中,罐的金属内表面涂覆有氟聚合物,更优选与非氟聚合物共混。在本发明的另一个实施方案中,罐的金属内表面涂覆有聚四氟乙烯(ptfe)和聚醚砜(pes)的聚合物共混物。在本发明的另一个实施方案中,罐的整个金属内表面涂覆有聚四氟乙烯(ptfe)和聚醚砜(pes)的聚合物共混物。计量阀被设计成每次致动递送计量的制剂,并且包括垫圈以防止推进剂通过阀的泄漏。垫圈可以包括任何合适的弹性体物质,例如低密度聚乙烯,氯丁基,溴丁基,epdm,黑色和白色丁二烯-丙烯腈橡胶,丁基橡胶和氯丁橡胶。合适的阀可以从气雾剂工业中众所周知的制造商商购获得,例如来自valois,法国(例如df10、df30、df60)、bespakplc、uk(例如bk300、bk357)和3m-neotechnicltd,uk(例如spraymisertm)。在各种实施方案中,mdi还可以与其它构造物结合使用,例如但不限于用于储存和容纳mdi的包装,包括美国专利号6,119,853;6,179,118;6,315,112;6,352,152;6,390,291;和6,679,374中所述的那些,以及剂量计数器单元,例如但不限于美国专利6,360,739和6,431,168中所述的那些。用于药物气雾剂制造领域的技术人员所熟知的常规批量制造方法和机器可用于制备用于商业生产填充罐的大规模批料。因此,例如,在用于制备悬浮气雾剂制剂的一种批量制造方法中,将计量阀压接到铝罐上以形成空罐。将颗粒药物加入到加料容器中,并将液化推进剂与任选的赋形剂一起通过加料容器加压填充到制造容器中。药物悬浮液在再循环之前混合到填充机中,然后将药物悬浮液的一等分试样通过计量阀填充到罐中。在制备溶液气雾剂制剂的一个示例性批量制造方法中,将计量阀压接到铝罐上以形成空罐。液化的推进剂与任选的赋形剂和溶解的药物一起通过加料容器加压填充到制造容器中。在替代方法中,将液化制剂的一等分试样在足够冷的条件下加入到敞口的罐中,以确保制剂不蒸发,然后将计量阀压接到罐上。通常,在制备用于药物用途的批次中,每个填充的罐被检查称重,用批号编码,并且在出厂试验之前被包装成货盘用于储存。本发明的制剂可以通过例如在超声处理或高剪切混合器的帮助下,在合适的容器中将药物制剂的复合颗粒分散在选定的推进剂中来制备,在有或没有其它组分的情况下。该方法期望在受控的湿度条件下进行。根据本发明的气雾剂制剂的化学和物理稳定性和药物可接受性可以通过本领域技术人员熟知的技术来确定。因此,例如,组分的化学稳定性可以通过hplc测试来确定,例如,在产品的长期储存之后确定。物理稳定性数据可以从其它常规分析技术获得,例如通过泄漏测试,通过阀递送测定(每次致动的平均喷射重量),通过剂量再现性测试(每次致动的活性成分)和喷雾分布分析来获得。根据本发明的悬浮气雾剂制剂的稳定性可以通过常规技术测量,例如通过使用背向光散射仪测量絮凝尺寸分布,或通过用ngi测量粒度分布或其他级联碰撞分析方法来测量。mdi罐通常包括能够承受所使用的推进剂的蒸气压的容器,例如塑料或塑料涂覆的玻璃瓶或优选金属罐,例如铝或其合金,其可任选地被阳极化处理、漆涂覆和/或塑料涂覆(例如通过参考wo96/32099并入本文,其中部分或全部内表面涂覆有一种或多种碳氟聚合物,任选地与一种或多种非碳氟聚合物组合),该容器用计量阀封闭。所述盖可以通过超声波焊接、螺丝配合或压接固定在罐上。本文教导的mdi可以通过本领域的方法制备(例如参见byron,上文和wo96/32099)。优选地,罐装配有盖组件,其中药物计量阀位于盖中,并且所述盖被原位压接。因此,作为本发明的另一方面提供一种药物气雾剂制剂,其包含一定量的如前所述的复合颗粒,以及作为推进剂的碳氟化合物或含氢氯氟烃,任选与表面活性剂和/或共溶剂组合。根据本发明的另一方面,其提供了一种药物气雾剂制剂,其中推进剂选自1,1,1,2-四氟乙烷,1,1,1,2,3,3,3-七氟正丙烷及其混合物。本发明的制剂可以通过加入合适的缓冲剂来缓冲。在另一个实施方案中,本发明涉及适于经由定量吸入器通过吸入给予患者的剂型。在悬浮气雾剂制剂的情况下,催产素复合颗粒的粒度应当例如允许在给予气雾剂制剂时将基本上所有的药物吸入肺中,因此理想的小于10μm,特别是在从7μm,例如0.5至5μm,例如约1至约3μm的范围。通过说明而非限制的方式提供以下实施例。实验i物质和方法物质表1中列出使用的物质表1:物质可以通过首先产生喷雾干燥用原料溶液来制备喷雾干燥的颗粒,其中:(1)称量配方量的赋形剂;(2)将一部分纯净水加入到赋形剂中,并搅拌溶解;(3)催乳素按照配方称重,并加到赋形剂溶液的表面并使其溶解;(4)加入余量的纯净水达到规定的总重量;和(5)通过滴加乙酸来调节溶液的ph至目标ph4。所述制剂详述于表2。表2:喷雾干燥制剂样品1(对照)样品2催产素(%w/w)55催产素所需量(g)0.27900.2790海藻糖(%w/w)74.9373.42海藻糖所需量(g)4.14044.0299亮氨酸(%w/w)2020亮氨酸所需量(g)1.0001.000cacl2(%w/w)n/a1.51cacl2所需量(g)n/a0.100喷雾干燥使用sdmicro(geaniro)制备喷雾干燥的制剂。使用表3中的喷雾干燥参数。表3:喷雾干燥参数参数设置干燥气体流速(kg/hr)30雾化气体流速(kg/hr)5入口温度(℃)150出口温度(℃)70溶液进料速率(g/min)控制以靶向出口温度(约12.5g/min)二次干燥制备用于二次干燥的批次,其通过取下盖子并用不掉毛的清洁布代替,该清洁布用扎带扎在瓶子的颈部周围以原位固定。二次干燥在gallenkamp真空烘箱中完成(环境温度下)。使用e2m5edwards真空泵(assetpmp163070)和buchi真空控制器(biomax65766)以设置低于5mbar的真空。在所记录的时间中将该批次在真空下保持。载体/稀释剂-添加剂预混物的制备:将99.0g甘露糖醇(mmad为60μm,其中10%的颗粒小于10%μm)与1.0g硬脂酸镁(mgst)混合,以产生99%载体/稀释剂:1%添加剂物质的混合物。将其置于配有刀片的qmm掺合机中并暴露于高剪切共混(例如在600rpm下10分钟)以获得组分的良好混合。干粉混合制剂将8g载体/稀释剂-添加剂预混物与2g复合颗粒混合以形成80/20w/w%共混物,如下:使用以下方法进行turbula混合:(1)将所需量的喷雾干燥复合颗粒制剂称取到20ml容器中;(2)称量所需量的预混合物(1%mgst在甘露醇中,之前在qmm(高剪切混合机)上制造;(3)将预混合物加入容器中;(4)手动翻滚30秒;(5)固定容器;(6)使用纸巾将容器放入turbula混合器罐中,所述纸巾用于铺垫罐子;(7)以42rpm混合30分钟。分析测试1.通过hplc测量化学稳定性:催产素药物相关的杂质含量将一定量样品1(对照物质)和样品2(含有1.5%cacl2)(二者均含有混合的载体/稀释剂与添加剂物质)置于敞口的玻璃小瓶中,然后将小瓶在加速条件(40℃/20%相对湿度(rh))放置。使用反相高效液相色谱定期检查部分样品物质,以确定α-催产素二聚体和β-催产素二聚体含量。药物相关杂质含量的测定方法采用反相梯度hplc法,使用表4所示的条件进行。表4.色谱条件该hplc研究的结果示于图3。可以看出,在对照样品(样品1)中,α-催产素二聚体和β-催产素二聚体二者的形成明显大于样品2。通常,在对照样品中,到第7天由hpla确定的α-催产素二聚体和β-催产素二聚体二者的量相对于总肽含量超过了总肽含量的0.5%。在第0天和第21天之间,对照样品中这些杂质的百分比翻了一倍,并且从第0天到第87天大约为四倍。相比之下,含有二价二聚体物质的样品2在87天稳定性研究中,维持低水平(~0.5%或更低)的α-催产素二聚体和β-催产素二聚体。2.ngi测定的细颗粒质量通过与上述类似的方法制备喷雾干燥的复合颗粒,但不含cacl2。使所述颗粒的一部分与载体/稀释剂颗粒+添加剂物质(甘露醇+硬脂酸镁)共混,并且一部分喷雾干燥的物质未共混(即缺乏载体/稀释剂+添加剂的样品)。然后使用以60l/min运行的ngi对所述每部分物质样品进行fpm分析。这种测试的结果如图4所示。这些结果表明,当在30、90和180天比较,fpm(即以60升/分钟运行的ngi的阶段3、4和5)在6个月的时间内保持相对稳定。3.使用karlfisher滴定测定的含湿量图5显示了散装催产素、不含二价阳离子物质的喷雾干燥复合共混物、以及具有2%氯化钙的类似复合物的总杂质和含水量。这些结果表明,尽管在初始、25℃/60%rh和45℃/70%rh条件下两种共混物中的含湿量几乎相同,但与同样在25℃/60%rh和45℃/70%rh的对照共混物相比,在含1.5%氯化钙的复合物中杂质降低。实验ii研究了复合颗粒中二价阳离子物质(例如cacl2)的存在对催产素组分随时间的整体稳定性的影响。制备含各种量(0至4%w/w)的二价阳离子物质(cacl2)催产素,然后分析复合颗粒样品的催产素化学降解。在这些实施例中,添加一定量的提供二价阳离子的成分(cacl2)伴随着喷雾干燥物质中碳水化合物组分(海藻糖)的量的相应减少。材料和设备:表5步骤1:制备制剂使用procept4m8-trix喷雾干燥器(proceptnv,zelzate,belgium)制造,各自具有相同的喷雾干燥条件。改变加入到原料溶液中的cacl2的量。使用来自以前实验研究设计的数据,试验使用如表6所示的最干燥制剂的可变参数。这些制剂的其他恒定参数包括:原料固体含量=5%,ph=4.0,旋风空气速率=0.15m3.min-1,喷嘴直径=0.4mm。表6.制备后,将收集容器直接移动到低湿度环境(<20%rh)并密封。将样品在5℃下保存在密封瓶中,然后分析或转移到进行稳定性测试的小瓶中。步骤2:分析制备后,通过karlfischer(kf)立即分析每种制剂的含湿量。通过差示扫描量热法(dsc)测定玻璃化转变温度(tg)。测定粒度分布(mastersizer)和降解物含量(通过高压液相色谱(hplc),如上文在实验i的讨论中所述的那样)(如下表9所述)。将所有制剂分配到小瓶中,所述小瓶保持在加速和标准温度条件下2周、1个月、3个月和6个月,如下所详述。稳定性方案所使用的稳定性方案如下所示,且基于在50℃和25℃和40℃温度下的加速稳定性测量结果,反映了ich指南值:将样品储存在2-8℃的冰箱中,且在密封(封闭)条件下,在25℃和40℃的控制烘箱中;将样品在环境湿度(约10%rh)的非密封(敞口)容器中的50℃烘箱中储存;在下表7中的时间表规定的时间点分析样品中的催产素和相关物质含量。表7.稳定性方案1待分析。结果物理分析(紧接制备后)在制备后立即对所有制剂的玻璃化转变温度、含湿量和粒度分布进行分析,以确保样品间变化最小。图6(tg)、图7(含湿量)和图8(粒度分布)中的图显示了参数结果,表明在所有cacl2浓度无显著变化,如下表8所示:表8.物理分析数据化学稳定性使用uv-hplc测定法分析制剂的降解,在下列表9所示的条件下操作。表9色谱条件在紧接制备后,在50℃/环境湿度下储存两周后、在50℃/环境湿度下储存1个月后和在40℃在热封的干燥袋中在密封的小瓶中储存3个月后,进行hplc分析,如表7所示。对总降解物含量的贡献最显著的降解物是(α和β)二聚体、三-硫化物和葡萄糖相关的加合物,其描述在图9-13中。在这些图中,图9描绘了催产素分子,其中葡萄糖加合物的主要反应点(nh2)用点划线圈出(葡萄糖被认为是实验中使用的海藻糖中的杂质),二聚体和三-硫化物反应点(s-s)以虚线圈出。图10是催产素-葡萄糖加合物的描述。图11描绘了α-二聚体。图12是β-二聚体的描述。图13描绘了催产素三-硫化物降解物。稳定性测定的结果总结在图14-17中,其代表下表10中列出的数据。图14显示了总降解物含量百分比。图15显示二聚体含量。图16显示葡萄糖加合物含量。最后,图17表示三-硫化物降解物含量。总降解物含量和最显著降解物的总体趋势(参见表10和图14-17)是在所有稳定条件下和所有时间点当在制剂中包含cacl2时,它们的形成减少。这通过以下显示:在含有%w/w或0.02%w/wcacl2的制剂中发生了最高百分比降解,和在含有2%w/w和4%w/wcacl2的制剂发生最低降解物形成。在50℃和环境湿度下存储1个月的样品中观察到总降解物含量和二聚体含量的最显著差异。然而,三-硫化物和葡萄糖加合物含量在50℃下2周至在50℃下1个月的储存期间未显示显著增加。1%w/w或更大的cacl2含量似乎显著降低了所有这些降解物的形成。这些结果表明,在研究的制剂中包含二价阳离子物质(例如cacl2)导致催产素二聚体形成的减少。在加速稳定性研究中,在50℃和环境湿度下保存1个月,1%w/wcacl2含量或更高含量能够将二聚体形成降低到不超过零,这可能有助于为最小cacl2含量设定制剂规格。除了二聚体形成的减少之外,包含cacl2也可以减少三-硫化物降解物和葡萄糖相关的加合物降解物的形成。虽然不希望受到任何特定科学理论的约束,但这些结果表明ca2+离子的存在会干扰这两种降解物的形成。三-硫化物降解物减少可以通过与二聚体形成的减少相同的机理来解释。如果ca2+离子稳定催产素环,则形成三-硫化物所需的二硫键的断裂将被破坏。此外,三-硫化物可以由二聚体的不完全分裂形成,因此如果形成较少的二聚体,则预期形成较少的三-硫化物降解物。最后,葡萄糖加合物形成的减少可以通过以下事实来解释:ca2+离子在催产素环附近的存在可能在构象上削弱催产素的n-末端半胱氨酸残基上的胺与葡萄糖反应形成该降解物。虽然已经通过说明和实施例的方式对前述发明进行了详细描述,但是为了清楚理解的目的,显而易见的是,可以在所附权利要求的范围内实施一些改变和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1