协同澳瑞他汀组合的制作方法
发明领域
本发明涉及澳瑞他汀或基于澳瑞他汀(auristatin)的抗体-药物-缀合物(adc)与第二种活性剂(诸如pi3k/mtor抑制剂、mek抑制剂、紫杉烷或其它抗癌剂)的组合。本发明还涉及通过将这些组合施用给患者来治疗异常细胞生长(例如癌症)的方法。
发明概述
在本发明的一个实施方案中,提供了一种治疗异常细胞生长(诸如癌症)的方法,所述方法包括给有此需要的患者施用有效量的澳瑞他汀或基于澳瑞他汀的adc与选自pi3k/mtor抑制剂、mek抑制剂、紫杉烷和其它抗癌剂的第二种药剂的组合。
癌症药物靶标mtor以两类复合物形式存在:含有raptor亚基的mtorc1和含有rictor的mtorc2。如本领域已知的,“rictor”表示具有人基因座sp13.1的细胞生长调节蛋白。这些复合物被不同地调节且具有不同的底物范围。mtorc2通常对雷帕霉素和选择性抑制剂不敏感。认为mtorc2通过磷酸化一些agc激酶(诸如akt)的c-端疏水基序来调节生长因子信号传递。在许多细胞背景下,mtorc2是akt的s473位点的磷酸化所必需的。因而,mtorc1活性部分地受akt控制,而akt本身部分地受mtorc2控制。磷脂酰肌醇3-激酶(pi3k)的生长因子刺激会造成通过在两个关键位点s473和t308处的磷酸化实现的akt活化。已经报道,akt的完全活化需要s473和t308active的磷酸化。akt会以许多方式促进细胞存活和增殖,所述方式包括抑制细胞凋亡、促进葡萄糖摄取和改变细胞代谢。在akt上的2个磷酸化位点中,认为由pdki介导的在t308处的激活环磷酸化是激酶活性所必不可少的,而在s473处的疏水基序磷酸化会增强akt激酶活性。在s473处的akt磷酸化可以用作pi3k/aktmtor途径的组成性活化的标志物。
本发明的另一个实施方案涉及一种用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和pi3k-mtor抑制剂,其中所述pi3k-mtor抑制剂选自pf-384和pf-502。
在一个优选实施方案中,所述pi3k-mtor抑制剂是pf-384。
在另一个实施方案中提供了一种用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和pi3k-mtor抑制剂,其中所述pi3k-mtor抑制剂选自pf-384和pf-502,且其中所述澳瑞他汀是下式的化合物:
或其药学上可接受的盐或溶剂合物,或所述化合物或盐或溶剂合物的抗体-药物缀合物,其中,在每次出现时独立地,
w是
r1是氢、c1-c8烷基或c1-c8卤代烷基;
r2是氢、c1-c8烷基或c1-c8卤代烷基;
r3a和r3b是以下任一种:
(i)r3a是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基、卤素或芳烷基;且
r3b是c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基、芳烷基或卤素;或
(ii)r3a和r3b一起是c2-c8亚烷基或c1-c8亚杂烷基;
r4a和r4b是以下任一种:
(i)r4a是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基或芳烷基;且
r4b是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基或芳烷基;或
(ii)r4a和r4b一起是c2-c8亚烷基或c1-c8亚杂烷基;
r5是
或r5是
r6是氢、-c1-c8烷基、-c2-c8烯基、-c2-c8炔基或-c1-c8卤代烷基;
r12是氢、c1-c4烷基、c1-c10杂环基或c6-c14芳基;
r13是c1-c10杂环基;且
x是o。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂选自pf-384和pf-502,且所述澳瑞他汀选自抗体药物缀合物5t4-adc、pf-101和mmaf。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂选自pf-384和pf-502,且所述澳瑞他汀是抗体药物缀合物5t4-adc。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂选自pf-384和pf-502,且所述澳瑞他汀是澳瑞他汀-101。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂选自pf-384和pf-502,且所述澳瑞他汀是mmaf。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗肺癌。
在这样的方法的另一个实施方案中,所述pi3k-mtor抑制剂和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗乳腺癌。
在这样的方法的另一个实施方案中,同时施用或相继施用所述澳瑞他汀或基于澳瑞他汀的adc和所述pi3k-mtor抑制剂。
在这样的方法的另一个实施方案中,以任一种次序依次施用所述澳瑞他汀或基于澳瑞他汀的adc和所述pi3k-mtor抑制剂。
在另一个实施方案中,本发明涉及一种药物组合物,其包含:一定量的澳瑞他汀或其药学上可接受的盐;一定量的pf-384或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
本发明的另一个实施方案涉及一种用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和mek抑制剂。
在一个优选实施方案中,所述mek抑制剂是pd-901。
在这样的方法的另一个实施方案中,所述mek抑制剂是pd-901,且所述澳瑞他汀选自抗体药物缀合物5t4-adc、pf-101和mmaf。
在这样的方法的另一个实施方案中,所述mek抑制剂是pd-901,且所述澳瑞他汀是抗体药物缀合物5t4-adc。
在这样的方法的另一个实施方案中,所述mek抑制剂是pd-901,且所述澳瑞他汀是澳瑞他汀-101。
在这样的方法的另一个实施方案中,所述mek抑制剂是pd-901,且所述澳瑞他汀是mmaf。
在这样的方法的另一个实施方案中,所述mek抑制剂和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗肺癌。
在这样的方法的另一个实施方案中,所述mek抑制剂和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗乳腺癌。
本发明的另一个实施方案涉及一种药物组合物,其包含:一定量的澳瑞他汀或基于澳瑞他汀的adc或其药学上可接受的盐,和一定量的pd-901或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
本发明的另一个实施方案涉及一种用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和紫杉烷。
在这样的方法的另一个实施方案中,所述紫杉烷是紫杉醇或多西他赛,且所述澳瑞他汀选自抗体药物缀合物5t4-adc、pf-101和mmaf。
在这样的方法的另一个实施方案中,所述紫杉烷是紫杉醇或多西他赛,且所述澳瑞他汀是抗体药物缀合物5t4-adc。
在这样的方法的另一个实施方案中,所述紫杉烷是紫杉醇或多西他赛,且所述澳瑞他汀是澳瑞他汀-101。
在这样的方法的另一个实施方案中,所述紫杉烷是紫杉醇或多西他赛,且所述澳瑞他汀是mmaf。
在这样的方法的另一个实施方案中,所述紫杉烷和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗肺癌。
在这样的方法的另一个实施方案中,所述紫杉烷和所述澳瑞他汀或基于澳瑞他汀的adc用于治疗乳腺癌。
本发明的另一个实施方案涉及一种药物组合物,其包含:一定量的澳瑞他汀或基于澳瑞他汀的adc或其药学上可接受的盐,和一定量的选自紫杉醇和多西他赛或其药学上可接受的盐的紫杉烷;和药学上可接受的载体或稀释剂。
还提供了这样的实施方案,其中同时施用或相继施用所述澳瑞他汀和所述紫杉烷。
还提供了这样的实施方案,其中以任一种次序依次施用所述澳瑞他汀和所述紫杉烷。
另一个实施方案包括一种药物组合物,其包含:一定量的澳瑞他汀或其药学上可接受的盐;一定量的紫杉烷或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
提供了一个实施方案,其中,在本文描述的并行施用方法(包括澳瑞他汀与pi3k/mtor抑制剂一起、澳瑞他汀与mek抑制剂一起、和澳瑞他汀与紫杉烷一起施用)中的任一种中,通过并行施用实现的抗癌效果大于通过非并行地施用所述第一种和第二种药物组合物实现的抗癌效果。
提供了用于治疗哺乳动物中的癌症的剂型实施方案,其包含:(a)澳瑞他汀或其药学上可接受的盐;(b)pi3k-mtor抑制剂或其药学上可接受的盐,其中所述pi3k-mtor抑制剂选自pf-384和pf-502;和(c)药学上可接受的载体或稀释剂。
提供了用于治疗哺乳动物中的癌症的剂型实施方案,其包含:(a)澳瑞他汀或其药学上可接受的盐;(b)mek抑制剂或其药学上可接受的盐,其中所述mek抑制剂是pd-901;和(c)药学上可接受的载体或稀释剂。
提供了用于治疗哺乳动物中的癌症的剂型实施方案,其包含:(a)澳瑞他汀或其药学上可接受的盐,其中所述澳瑞他汀是澳瑞他汀-101;(b)紫杉烷或其药学上可接受的盐,其中所述紫杉烷是紫杉醇或多西他赛;和(c)和药学上可接受的载体或稀释剂。
提供了试剂盒实施方案,其包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂;(b)在第一单位剂型中的pi3k-mtor抑制剂或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述pi3k-mtor抑制剂选自pf-384和pf-502;和(c)用于容纳所述第一剂型和第二剂型的装置。
提供了试剂盒实施方案,其包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂;(b)在第一单位剂型中的mek抑制剂或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述mek抑制剂是pd-901;和(c)用于容纳所述第一剂型和第二剂型的装置。
提供了试剂盒实施方案,其包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述澳瑞他汀是澳瑞他汀-101;(b)在第一单位剂型中的紫杉烷或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述紫杉烷是紫杉醇或多西他赛;和(c)用于容纳所述第一剂型和第二剂型的装置。
附图简述
图1:在一组癌细胞系中的联合指数(ci)值的总结.a.点图显示了分析含有pf-384(一种双重pi3k/mtor抑制剂)或含有mtor-特异性的抑制剂的药物组合以后得到的ci指数值的范围。b.点图显示了分析含有ptx的药物组合以后得到的ci指数值的范围。使用如在材料和方法中所述的choutalalay方法确定a.和b.的ci指数,并且对于每个组合以ed50水平呈现。结果是至少三个独立实验的平均值。已经如下解释ci:非常强的协同作用(<0.1)、强协同作用(0.1-0.3)、协同作用(0.3-0.7)、中等协同作用(0.7-0.85)、轻微协同作用(0.85-0.9)、接近累加(0.9-1.1)、轻微拮抗作用(1.1-1.2)和中等拮抗作用(1.2-1.45)。虚线是在1.1和0.7的ci值处。ptx,紫杉醇;vino,长春瑞滨;aur101,澳瑞他汀-101;mtori,wye-132。
图2:用xceligence系统动态监测mda-468细胞中的细胞生长.a.5t4-adc、pf-384或组合在mda-468细胞中的浓度-和时间-依赖性的细胞毒性效应。在a.中,显示了三个不同实验的一个代表。b.呈现了8-天时间点的阻抗指数值,并显示了5t4-adc+pf-384组合的细胞生长抑制的统计上显著的增强。c.mmaf-ome、pf-384或组合在mda-468细胞中的浓度-和时间-依赖性的细胞毒性效应。在c.中,显示了三个不同实验的一个代表。d.呈现了8-天时间点的阻抗指数值,并显示了mmaf-ome+pf-384组合的细胞生长抑制的统计上显著的增强。
图3:5t4-adc或mmaf-ome与pf-384或ptx的组合导致3d培养物中细胞生长的更强抑制。如在材料和方法中所述,测量在基质胶中作为3d球状体生长的mda-468(a-f)或h-1975(g-j)细胞和球状体生存力。值是平均值±sem。a,用递增剂量的5t4-adc、固定剂量的pf-384(10nm)或两种药物的组合处理7天的mda-468细胞。描绘了相对于各个未经处理的对照的生长百分比。虚线指示固定剂量的pf-384的%生存力。b,在来自a的指示的药物浓度处选择的数据点的直方图。星号代表相对于5t4-adc+pf-384的显著差异(**p<0.01,student氏t检验)。c,用递增剂量的pf-384、固定剂量的mmaf-ome(0.8nm)或两种药物的组合处理7天的mda-468细胞。描绘了相对于各个未经处理的对照的生长百分比。虚线指示固定剂量的mmaf-ome的%生存力。d,在来自(c)的指示的药物浓度处选择的数据点的直方图。星号代表相对于mmaf-ome+pf-384的显著差异(**p<0.01,***p<0.001;student氏t检验)。e,用递增剂量的5t4-adc、固定剂量的ptx(1nm)或两种药物的组合处理7天的mda-468细胞。描绘了相对于各个未经处理的对照的生长百分比。虚线指示固定剂量的ptx的%生存力。f,在来自(e)的指示的药物浓度处选择的数据点的直方图。值是平均值±sem。星号代表相对于5t4-adc+ptx的显著差异(**p<0.01,***p<0.001;student氏t检验)。g,用递增浓度的pf-384、固定剂量的5t4-adc(5或10
图4:5t4-adc或mmaf-ome与pf-384或ptx的组合对天冬氨酸特异性半胱氨酸蛋白酶3/7活性的诱导。a,d在用5t4-adc(10μg/ml)+pf-384(1
图5:5t4adc、mmaf-ome、pf-384的单一药剂处理和它们的组合对细胞周期状况的影响.用媒介物(cntrl)、5t4-adc(1μg/ml)、pf-384(100nm)作为单一药剂或5t4-adc(1μg/ml)+pf-384(100nm)组合处理24(a)和36(b)小时的mda-468的细胞周期阶段分布。c,单一药剂处理5t4-adc、pf-384和它们的组合对有丝分裂指数的影响。对于在a、b中所示的实验,通过流式细胞计量术将有丝分裂指数确定为群体中磷酸-组蛋白h3-阳性的细胞的百分比。用flowcellectbivariatecellcycle试剂盒通过流式细胞计量术执行细胞周期分析和有丝分裂指数。将细胞周期的g1、s、g2期标绘为带有标准误差的总细胞群体的平均百分比。结果是一式三份地运行的两个独立实验的代表,误差棒表示标准误差。
图6:5t4-adc+pf-384组合治疗导致在体内乳腺癌和肺癌模型中增强的治疗效果。a,用媒介物、5t4-adc(静脉内2mg/kg,q4dx4)、pf-384(静脉内7.5mg/kg,q4dx4)或组合治疗的携带皮下mda-468肿瘤的小鼠。将达到端点的时间(tte)定义为动物实现肿瘤消退的所逝去的时间。kaplan-meier图显示了具有肿瘤的动物的百分比随时间的变化。tte分析证实了与5t4-adc的单一药剂活性相比,对于5t4-adc和pf-384的组合而言显著增加的肿瘤消退速率(p<0.0001,时序mantel-cox检验)。pf-384在该实验中没有引起消退。b,在第53天对(a)所示的数据的单个肿瘤体积分析。5t4-adc+pf-384导致与单独的5t4-adc(p<0.05)或pf-384(p<0.0001)治疗相比平均肿瘤体积的统计上显著的抑制。图显示了在第53天(在任何实验组中从研究取出≥15%的小鼠时的时间)的单个肿瘤体积,条指示每组的平均肿瘤体积。cr,通过完全肿瘤消退定义的完全缓解。c,用5t4-adc(静脉内3mg/kg,q4dx4)、pf-384(静脉内7.5mg/kg,q4dx4)或组合治疗携带皮下h-1975肿瘤的小鼠。将端点定义为肿瘤体积已经增至三倍的时间。kaplan-meier图显示了随时间变化的具有小于3倍的肿瘤体积增加的动物的百分比。数据的tte分析证实了与单独的5t4-adc(p=0.0356,时序检验)或pf-384(p<0.0001时序检验)的单一药剂活性相比,对于5t4-adc+pf-384组合而言肿瘤增至三倍的速率的显著延迟。d,在第21天在(c)中显示的数据的单个肿瘤体积分析。5t4-adc导致与单独的5t4-adc(p<0.01)或pf-384(p<0.0001)治疗相比平均肿瘤体积的统计上显著的抑制。
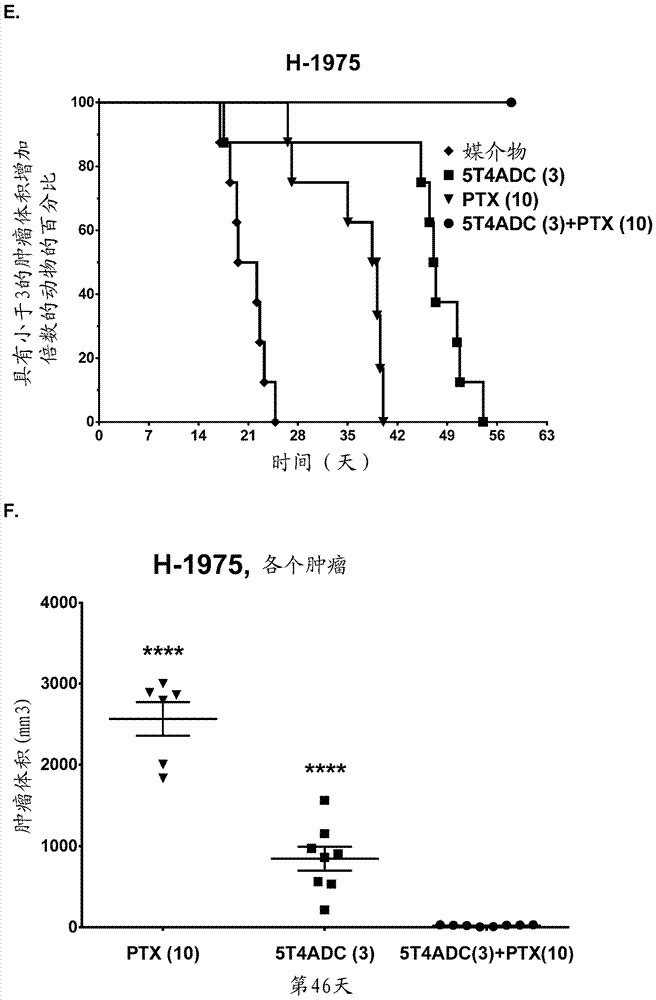
图7:5t4-adc和ptx组合治疗导致在体内乳腺癌和肺癌模型中增强的治疗效果。a,用5t4-adc(静脉内2mg/kg,q4dx4)、ptx(口服10mg/kg,q4dx4)或组合治疗携带皮下mda-468肿瘤的小鼠。数据的tte分析证实了与5t4-adc(p=0.0071,时序检验)或ptx(p=0.01,时序检验)的单一药剂活性相比,用5t4-adc和ptx的组合实现的显著更快的完全肿瘤消退速率。b,在第53天对(a)所示的数据的单个肿瘤体积分析。5t4-adc+ptx(10mg/kg)导致与单独的5t4-adc(p<0.05)或ptx(p<0.001)治疗相比平均肿瘤体积的显著增强的抑制。条指示每组的平均肿瘤体积。cr,通过完全肿瘤消退定义的完全缓解。c,类似于(a),但是以22.5mg/kg(口服q4dx4)的剂量使用ptx。数据的tte分析显示了与5t4-adc(p=0.00821,时序检验)或ptx(所述药剂在该剂量没有产生任何肿瘤消退)的单一药剂活性相比,用5t4-adc+ptx的组合实现的显著更快的完全肿瘤消退速率。d,在第53天对(c)中所示的数据的单个肿瘤体积分析。5t4-adc+ptx(22.5mg/kg)导致与单独的5t4-adc(p<0.05)或ptx(p=0.07)治疗相比平均肿瘤体积的增强的抑制。条指示每组的平均肿瘤体积。cr,通过完全肿瘤消退定义的完全缓解。e,用5t4-adc(静脉内3mg/kg,q4dx4)、ptx(口服10mg/kg,q4dx4)或组合治疗携带皮下h-1975肿瘤的小鼠。与ptx组合的5t4-adc比用单一药剂治疗更有效。与图3c类似地执行的数据的tte分析证实了与单独的5t4-adc(p<0.0001,时序检验)或ptx(p=0.0001,时序检验)的单一药剂活性相比,对于5t4-adc+ptx组合而言肿瘤增至三倍的速率的显著延迟。f,在第46天对(e)中所示的数据的单个肿瘤体积分析。5t4-adc+ptx(22.5mg/kg)导致与单独的5t4-adc(p<0.0001)或ptx(p<0.0001)治疗相比平均肿瘤体积的增强的抑制。条指示每组的平均肿瘤体积。g,用5t4-adc(静脉内3mg/kg,q4dx4)、ptx(口服22.5mg/kg,q4dx4)或组合治疗携带皮下37622a1肺癌pdx肿瘤的小鼠。误差棒表示平均值的标准误差。在第56天终止研究,此时一个组(媒介物)已经丧失超过15%的动物。在媒介物组终止时进行统计分析(***p<0.001,****p<0.0001,双因素方差分析)。
图8:5t4-adc+吉西他滨组合治疗导致在体内肺癌模型中增强的治疗效果。
用5t4-adc(静脉内4mg/kg,q4dx4)、吉西他滨(静脉内30mg/kg,q7dx3)或组合治疗携带皮下h-1975人肺肿瘤异种移植物的小鼠。图显示了在治疗开始以后在指定的时间确定的具有肿瘤体积的肿瘤生长曲线。点,来自10只小鼠/组的值的平均值;条,se。
发明详述
在本发明中,以下术语如下所示进行描述,除非另外指出。
澳瑞他汀:本文中使用的术语“澳瑞他汀(“auristatin”或“auristatins”)”表示一类基于多肽的化合物,包括从天然产物dolabellaauricularia衍生出的药物和结构上相关的化合物诸如澳瑞他汀-101、mmae和mmaf。如本文中使用的,为了描述本发明的一种或多种组合的组分,“澳瑞他汀”也表示掺入或包含澳瑞他汀的生物缀合的分子,例如抗体-药物缀合物(adc),其中所述生物基团诸如抗体(ab)连接至多肽基团。代表性的基于澳瑞他汀多肽的分子包括澳瑞他汀-101、mmae和mmaf。代表性的澳瑞他汀adc包括5t4-adc。
“澳瑞他汀-101”表示下式的澳瑞他汀多肽化合物:2-甲基丙氨酰基-n-[(3r,4s,5s)-3-甲氧基-1-{(2s)-2-[(1r,2r)-1-甲氧基-2-甲基-3-氧代-3-{[(1s)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基}丙基]吡咯烷-1-基}-5-甲基-1-氧代庚烷-4-基]-n-甲基-l-缬氨酰胺:
或其药学上可接受的盐或溶剂合物,或其衍生物。
“mmae”表示被称作单甲基澳瑞他汀e且具有下式的澳瑞他汀多肽化合物:
或其药学上可接受的盐或溶剂合物,或其衍生物。
“mmaf”表示被称作单甲基澳瑞他汀f、或(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-((s)-3-甲基-2-(甲基氨基)丁酰氨基)丁酰氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙烷酰氨基)-3-苯基丙酸且具有下式的澳瑞他汀多肽化合物:
或其药学上可接受的盐或溶剂合物,或其衍生物。
“5t4-adc”表示包含澳瑞他汀多肽mmaf的分子,所述澳瑞他汀多肽mmaf通过“mc”连接基缀合至对5t4抗原特异性的抗体。
“抗-5t4抗体-药物缀合物”表示通过不可切割的马来酰亚氨基己酰基(mc)连接基与有效的微管蛋白抑制剂单甲基澳瑞他汀f(mmaf)连接的抗-5t4a1抗体。在一个称为a1mcmmaf的抗-5t4adc中的靶向试剂是特异性地识别人5t4的人化的igg1单克隆抗体a1(saprap,damelinm,dijosephj,marquettek,geleskg,golasj,等人.long-termtumorregressioninducedbyanantibody-drugconjugatethattargets5t4,anoncofetalantigenexpressedontumor-initiatingcells.molecularcancertherapeutics.2013;12:38-47)。mcmmaf的马来酰亚胺缀合至抗体上的半胱氨酸巯基。得到的adc含有4mol/mol的平均药物:抗体比率。有人提出,在内化进靶细胞中后,adc在溶酶体中分解代谢,导致cysmcmmaf的释放,所述cysmcmmaf抑制微管蛋白聚合从而导致细胞凋亡和细胞死亡。
本文中使用的“pi3k/mtor抑制剂”表示能够双重抑制pi3k和mtor靶标的化合物。这样的双特异性抑制剂会结合mtor和pi3k的atp结合位点。这样的抑制剂的例子包括渥曼青霉素、ly294002、pi-103(caymanchemical)、sf1126(semafore)、bgt226(novartis)、xl765(exelixis)和nvp-bez235(novartis)(liu等人.,naturereview,8,627-644,2009)。在某些方面,双特异性抑制剂将是咪唑并喹唑啉(例如,咪唑并[4,5-c]喹啉衍生物)。关于化合物是否结合和/或抑制pi3k和/或mtor的示例性测定是本领域众所周知的。
术语”对象”和“患者”在本文中可互换地使用。“对象”或“患者”的例子包括、但不限于人、大鼠、小鼠、豚鼠、猴、猪、山羊、牛、马、狗、猫、鸟和家禽。在一个示例性实施方案中,所述对象或患者是人。
还在临床开发中且对于本发明特别重要的pi3k/mtor抑制剂是2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基吡啶-3-基)-4-甲基吡啶并[2,3-d]嘧啶-7(8h)-酮:
或其药学上可接受的盐或溶剂合物,或其衍生物,和1-(4-{[4-(二甲基氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲:
或其药学上可接受的盐或溶剂合物,或其衍生物。
该第二种基于三嗪的化合物也被称作pf-05212384、pf-‘384、pf-384或pki-587。
在本文中使用的另外术语包括:2d(二维细胞培养);3d(三维细胞培养);5t4(癌胚胎抗原或tpbg);5t4-adc(5t4mab或mab与mcmmaf毒素的缀合物);cr(完全应答);ci(联合指数);ed50(50%有效剂量);ic50(半数最大抑制浓度);igg(免疫球蛋白g);ihc(免疫组织化学);mc(不可切割的马来酰亚氨基己酰基连接基);mcmmaf(与不可切割的马来酰亚氨基己酰基连接基连接的单甲基澳瑞他汀f);mmaf-ome(单甲基澳瑞他汀f的可渗透形式);mtor(雷帕霉素的哺乳动物靶标);pd-901(mek抑制剂pd0325901);pf-384(双重pi3k/mtor抑制剂pf-05212384或pki-587);pi3k(磷酸肌醇3-激酶);ptx(紫杉醇);rnaseq(rna测序);soc(护理治疗标准);tcga(thecancergenomeatlas,癌症基因组图谱);和wye-132(通用mtor抑制剂wye-125132)。
用在本发明中的另一类活性部位抑制剂是选择性的mtor抑制剂。这类mtor抑制剂相对于一种或多种i型磷脂酰肌醇3-激酶选择性地抑制mtorc1和mtorc2活性。所述i型磷脂酰肌醇3-激酶可以选自,例如,pi3激酶u、pi3激酶p、pi3激酶7或pi3激酶6。这些活性部位抑制剂会结合mtor的活性部位,但是不会结合pi3k的活性部位。这样的抑制剂的例子包括torin1(guertin和sabatini)、pp242(2-(4-氨基-1-异丙基-1h-吡唑并[3,4-d]嘧啶-3-基)-1h-吲哚-5-醇)、pp30、ku-0063794、way-600(wyeth)、way-687(wyeth)、way-354(wyeth)和azd8055(sparks和guertin,oncogene,29,2733-2744,2010,liu等人,naturereview,8,627-644,2009)。在某些方面,所述mtor抑制剂将是吡唑并嘧啶。用于确定mtor抑制剂的选择性的方法是本领域已知的。用在本发明中的另一类mtor抑制剂在本文中被称作“雷帕霉素类似物”。本文中使用的术语“雷帕霉素类似物”表示这样的化合物:其特异性地结合mtorfrb结构域(fkbp雷帕霉素结合结构域),在结构上与雷帕霉素相关,且保留mtor抑制性能。
本文中使用的术语“pi3k抑制剂”表示结合pi3k并抑制pi3k的至少一种活性的化合物或配体。所述pi3k蛋白可以分成三类:1类pi3k、2类pi3k和3类pi3k。pi3k抑制剂的例子包括bkm120(1类pi3k抑制剂,novartis)、xl147(1类pi3k抑制剂,exelixis)、gdc0941(1类pi3k抑制剂,genentech)、gsk1059615(pan-pi3k抑制剂,glaxosmithkline)、px-866(1类pi3k抑制剂;p110u、p110p和p1107异形体,oncothyreon)和cal-101(1类pi3k抑制剂;p1106异形体,calistoga)。
除了本文中已经提及的那些以外,与本发明关联使用的pi3k或pi3k/mtor抑制剂包括gdc0941(pi3ki)和gdc-0980(pi3k/mtori)(genetech/roche);bez235(pi3k/mtori)、bgt226(pi3k/mtori)、bkm120(pi3ki)和依维莫司(mtorc1i雷帕霉素类似物)(novartis);xl-767(pi3k/mtori)、xl-147(pi3ki)和xl-388(exelixis/sanofi-aventis);azd8055(mtori)(astrazeneca);gsk214179(akti)和gsk2126458(pi3k/mtori)(gsk);osi-027(mtori)和oxa-01(mtori)(osi);cal-101(pi3kδ)和cal120(pi3kγ/δi)(calistoga);sf1126(pi3ki)(semafore);ink-128(mtori)、pi3kγ/δ和pi3kα/βi(intellikine);sb2312(pi3k/mtori)(s*bio);ar-mtor-1(mtori)和ar-mtor-26(mtori)(array);px-866(pi3ki)(oncothyreon);aezs-126(pi3ki)(aeternazentaris);zstk474(日本癌症研究基金会);wx037(wilex);nv-128(mtori)(novagen);ezn-4150(pi3ki)(enzon);和由xcovery、cellzome和其它单位开发的化合物。除了本文中已经提及的那些以外,与本发明关联使用的fgfr抑制剂包括azd-4547(astrazeneca);ly2874455(lilly);bgj-398和度维替尼(novartis);丙氨酸布立尼布(bms);sulfatinib(hutchinsonmedipharm);intedanib(boehringeringelheim);lenvatinib(eisai);和tsu-68(taihopharmaceutical)。
本文中使用的“mek抑制剂”是抑制促分裂原活化蛋白激酶mek1和/或mek2的化学试剂或药物。mek抑制剂可以用于影响mapk/erk途径,该途径经常在某些癌症中是过度活跃的。因此,mek抑制剂具有用于治疗某些癌症的潜力,所述癌症包括braf-突变的黑素瘤和kras/braf突变的结直肠癌。mek抑制剂包括:trametinib(gsk1120212),其被fda批准用于治疗braf突变的黑素瘤,且在与braf抑制剂dabrafenib组合治疗braf突变的黑素瘤的研究中;司美替尼,其在用于非小细胞肺癌(nsclc)的2期临床试验中表现出改善的pfs,且用于眼色素层黑素瘤和分化的甲状腺癌的其它临床试验在进行中;binimetinib或mek162,其已经具有用于胆道癌和黑素瘤的1期试验;pd-325901或pcd-901,其已经与乳腺癌、结肠癌和黑素瘤关联地进行研究;cobimetinib或xl518,在iii期试验中,与vemurafenib(zelboraf(r))联合用于治疗晚期黑素瘤;和ci-1040。与本发明特别相关的是mek抑制剂pd-325901。
紫杉醇是在癌症化学疗法中使用的有丝分裂抑制剂;它和多西他赛代表“紫杉烷”家族的药物。
在该方法的一个实施方案中,所述异常细胞生长是癌症,包括、但不限于,间皮瘤、肝胆(肝和胆管)、原发性或继发性cns肿瘤、原发性或继发性脑肿瘤、肺癌(nsclc和sclc)、鳞状细胞癌、骨癌、胰腺癌、皮肤癌、头或颈的癌症、皮肤或眼内黑素瘤、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、胃肠(胃、结肠直肠和十二指肠)癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统的癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、睾丸癌、慢性或急性白血病、慢性髓性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、肾上腺皮质癌、胆囊癌、多发性骨髓瘤、胆管上皮癌、纤维肉瘤、神经母细胞瘤、视网膜母细胞瘤或前述癌症中的一种或多种的组合。
在本发明的另一个实施方案中,所述癌症选自肺癌(nsclc和sclc)、头或颈的癌症、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、乳腺癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤和脊柱轴肿瘤;或选自肺癌(nsclc和sclc)、卵巢癌、结肠癌、直肠癌、肛门区域的癌症;或选自肺癌(nsclc和sclc)、卵巢癌、结肠癌和直肠癌;或选自膀胱癌、子宫内膜癌、多发性骨髓瘤、胃癌、肺癌(nsclc和sclc)、乳腺癌和鳞状细胞癌;或选自子宫内膜癌、胃癌、肺癌(nsclc和sclc)、乳腺癌和鳞状细胞癌;或选自子宫内膜癌、胃癌和肺癌(nsclc和sclc);或前述癌症中的一种或多种的组合。
在本发明的一个实施方案中,提供了一种用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和pi3k-mtor抑制剂,其中所述pi3k-mtor抑制剂选自pf-384和pf-502。
本发明的另外实施方案包括其中所述pi3k-mtor抑制剂是pf-384的那些。
本发明的另外实施方案包括其中所述澳瑞他汀是下式的化合物或其药学上可接受的盐或溶剂合物、或所述化合物或盐或溶剂合物的抗体-药物缀合物的那些:
其中,在每次出现时独立地,
w是
r1是氢、c1-c8烷基或c1-c8卤代烷基;
r2是氢、c1-c8烷基或c1-c8卤代烷基;
r3a和r3b是以下任一种:
(iii)r3a是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基、卤素或芳烷基;且
r3b是c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基、芳烷基或卤素;或
(iv)r3a和r3b一起是c2-c8亚烷基或c1-c8亚杂烷基;
r4a和r4b是以下任一种:
(iii)r4a是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基或芳烷基;且
r4b是氢、c1-c8烷基、c1-c8卤代烷基、c3-c8碳环基、c1-c10杂环基、芳基、杂芳烷基或芳烷基;或
(iv)r4a和r4b一起是c2-c8亚烷基或c1-c8亚杂烷基;
r5是
或r5是
其任选地被1、2、3、4或5个基团取代,所述基团独立地选自c1-c8烷基、-c1-c8烷基-n(r’)2、-c1-c8烷基-c(o)r’、-c1-c8烷基-c(o)or’、-o-(c1-c8烷基)、-c(o)r'、-oc(o)r'、-c(o)or'、-c(o)n(r')2、-nhc(o)r'、-s(o)2r'、-s(o)r'、-oh、卤素、-n3、-n(r')2、-cn、-nhc(=nh)nh2、-nhconh2、-s(=o)2r'、-sr'和亚芳基-r’,其中每个r'独立地选自氢、c1-c8烷基、c1-c8杂环基、c1-c10亚烷基-c3-c8杂环基和芳基,或两个r’可以与它们所连接的氮一起形成c1-c10杂环基;
r6是氢、-c1-c8烷基、-c2-c8烯基、-c2-c8炔基或-c1-c8卤代烷基;
r12是氢、c1-c4烷基、c1-c10杂环基或c6-c14芳基;
r13是c1-c10杂环基;且
x是o或s;
前提条件是,当r3a是氢时x是s。
本发明的另外实施方案包括其中所述澳瑞他汀选自抗体药物缀合物5t4-adc、pf-101和mmaf的那些。
本发明的另外实施方案包括其中所述澳瑞他汀是抗体药物缀合物5t4-adc的那些。
本发明的另外实施方案包括其中所述澳瑞他汀是澳瑞他汀-101的那些。
本发明的另外实施方案包括其中所述澳瑞他汀是mmaf的那些。
本发明的另外实施方案包括癌症的治疗方法,其中所述癌症是肺癌。
本发明的另外实施方案包括癌症的治疗方法,其中所述癌症是乳腺癌。
本发明的另外实施方案包括其中同时或依次施用所述澳瑞他汀和所述pi3k-mtor抑制剂的那些。依次施用可以以任一种次序发生-首先或第二施用澳瑞他汀。
本发明的实施方案包括药物组合物,其包含:一定量的澳瑞他汀或其药学上可接受的盐;一定量的pf-384或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
本发明的实施方案也包括用于治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和mek抑制剂。
另外的实施方案包括其中所述mek抑制剂是pd-901的那些。
另外的实施方案包括其中所述澳瑞他汀选自抗体药物缀合物5t4-adc、pf-101和mmaf的那些。
在某些实施方案中,所述澳瑞他汀是抗体药物缀合物5t4-adc。
在某些实施方案中,所述澳瑞他汀是澳瑞他汀-101。
在某些实施方案中,所述澳瑞他汀是mmaf。
在澳瑞他汀/mek组合中,实施方案包括其中所述癌症是肺癌的那些和其中所述癌症是乳腺癌的那些。
在本发明的某些实施方案中,同时施用或相继施用所述澳瑞他汀和所述mek抑制剂,且如果相继施用的话,以任一种次序。
在某些实施方案中,本发明提供了一种药物组合物,其包含:一定量的澳瑞他汀或其药学上可接受的盐;一定量的pd-901或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
在某些实施方案中,本发明提供了一种治疗对象中的癌症的方法,所述方法包括给有此需要的对象并行地施用澳瑞他汀和紫杉烷,其中所述澳瑞他汀是澳瑞他汀-101,且其中所述紫杉烷是紫杉醇或多西他赛。这些方法包括治疗肺癌的方法和治疗乳腺癌的方法。
在本发明的某些实施方案中,同时施用或相继施用所述澳瑞他汀-101和所述紫杉烷,且如果相继施用的话,以任一种次序。
本发明还提供了药物组合物,其包含:一定量的澳瑞他汀或其药学上可接受的盐;一定量的紫杉烷或其药学上可接受的盐;和药学上可接受的载体或稀释剂。
在本文所述的某些实施方案中,通过所述并行施用实现的抗癌效果大于通过非并行地施用所述第一种和第二种药物组合物实现的抗癌效果。
在本发明的某些实施方案中,提供了一种用于治疗哺乳动物中的癌症的剂型,所述剂型包含:(a)澳瑞他汀或其药学上可接受的盐;(b)pi3k-mtor抑制剂或其药学上可接受的盐,其中所述pi3k-mtor抑制剂选自pf-384和pf-502;和(c)药学上可接受的载体或稀释剂。
在本发明的某些实施方案中,提供了一种用于治疗哺乳动物中的癌症的剂型,所述剂型包含:(a)澳瑞他汀或其药学上可接受的盐;(b)mek抑制剂或其药学上可接受的盐,其中所述mek抑制剂是pd-901;和(c)药学上可接受的载体或稀释剂。
在本发明的某些实施方案中,提供了一种用于治疗哺乳动物中的癌症的剂型,所述剂型包含:(a)澳瑞他汀或其药学上可接受的盐,其中所述澳瑞他汀是澳瑞他汀-101;(b)紫杉烷或其药学上可接受的盐,其中所述紫杉烷是紫杉醇或多西他赛;和(c)和药学上可接受的载体或稀释剂。
在本发明的某些实施方案中,提供了一种用于在哺乳动物中实现治疗效果的试剂盒,所述试剂盒包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂;(b)在第一单位剂型中的pi3k-mtor抑制剂或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述pi3k-mtor抑制剂选自pf-384和pf-502;和(c)用于容纳所述第一剂型和第二剂型的装置。
在本发明的某些实施方案中,提供了一种用于在哺乳动物中实现治疗效果的试剂盒,所述试剂盒包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂;(b)在第一单位剂型中的mek抑制剂或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述mek抑制剂是pd-901;和(c)用于容纳所述第一剂型和第二剂型的装置。
在本发明的某些实施方案中,提供了一种用于在哺乳动物中实现治疗效果的试剂盒,所述试剂盒包含:(a)在第一单位剂型中的澳瑞他汀或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述澳瑞他汀是澳瑞他汀-101;(b)在第一单位剂型中的紫杉烷或其药学上可接受的盐、和药学上可接受的载体或稀释剂,其中所述紫杉烷是紫杉醇或多西他赛;和(c)用于容纳所述第一剂型和第二剂型的装置。在本发明的一个实施方案中,涉及2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基吡啶-3-基)-4-甲基吡啶并[2,3-d]嘧啶-7(8h)-酮(化合物1a):
其描述在国际专利申请公开号wo2008/002578、美国公开号us2008-0090801a1和美国专利号7,696,213中,它们通过引用并入本文。化合物1a是结构上新颖的、有效的、atp-竞争性的和可逆的i类pi3k和mtor的双重抑制剂。化合物1a表现出对pi3k家族的高度选择性,如利用dundeeuniversity和invitrogen激酶筛选服务在一组81种蛋白激酶和iii类pi3k家族hvps34中的活性缺乏所证实的。对于评价的激酶中的任一种,直到10μm都没有观察到显著的抑制活性(>500选择性)。从体内大鼠pk研究中,化合物1a表现出低的清除率和良好的口服生物利用度(f(%)56±16)。化合物1a在大鼠中表现出中等血浆蛋白结合,具有20.2%的未结合分数(fu)。所以,未结合的1a的清除率较低。已经转化这些性能来证实稳健的体内性能,且化合物1a在移植了具有pi3k途径畸变的人癌细胞系的小鼠异种移植物模型中具有体内活性。
在本发明的另一个实施方案中涉及1-(4-{[4-(二甲基氨基)哌啶-1-基]羰基}苯基)-3-[4-(4,6-二吗啉-4-基-1,3,5-三嗪-2-基)苯基]脲(化合物1b)
其描述在国际专利申请公开号wo2009/044774、美国公开号us2009-0291079a1和美国专利号8,039,469中,它们通过引用并入本文。化合物1b是一种静脉内施用的、非常有效的pan-pi3k/mtor抑制剂。在化学上,化合物1b是结合在pi3k酶的atp结合槽中的2,4-二吗啉代-6-芳基脲基三嗪。关键结合相互作用是吗啉代氧与铰链区val851、脲氧与lys-802氨基之间的h-键以及脲基-nh与asp810羧酸酯之间的双h-键。化合物1b对pi3k和pikk是高选择性的,如它的针对236种激酶的激酶选择性筛选(invitrogen)所证实的。所述化合物在超过50种不同人肿瘤细胞系中具有强抗增殖作用,ic50<100nm。此外,化合物1b在具有升高的pi3k信号传递和受抑制的pi3k/mtor下游效应物(诸如akt)的磷酸化的癌细胞系中诱导细胞凋亡。在特别响应性的细胞系之一mda-mb-361中,30nm的化合物1b在4h诱导细胞凋亡,如被切割的parp的抑制所证实的。将这些体外结果转化成体内结果,其中化合物1b在乳腺(bt474、mda-mb-361)、结肠(hct116)、肺(h1975)和神经胶质瘤(u87mg)异种移植物模型中抑制肿瘤生长。以25mg/kg每周1次施用的化合物1b使大(1000mm3)mda-mb-361肿瘤缩小且抑制再生长。该肿瘤消退与mda-mb-361模型中磷酸化的akt的消退相关。
在本发明的另一个实施方案中涉及1-环戊基-7-(4-二乙基氨基-丁基氨基)-3-(2,6-二氟-3,5-二甲氧基-苯基)-3,4-二氢-1h-嘧啶并[4,5-d]嘧啶-2-酮:
其描述在国际专利申请公开号wo2004/011465、美国公开号us2004-0019210a1和美国专利号7,196,090中,它们通过引用并入本文。化合物2是一种可口服利用的、有效的和高选择性的、fgfr家族酪氨酸激酶(fgfr1、2、3和4)的小分子抑制剂。化合物2选择性地对fgfr遗传改变的细胞系有效,且在体外和体内胃和肺癌细胞系中表现出优先敏感性。化合物2对>60种试验的激酶显示出高激酶选择性。在细胞测定中,所述化合物相对于fgfr2对vegfr2的选择性超过100倍,且已经被证实会在体外和在体内抑制fgfr和其它下游标志物的磷酸化。所述化合物已经被证实会在多种以fgfr基因扩增或突变为特征的异种移植物肿瘤模型中抑制体内肿瘤生长。化合物2具有药物-样药学性能,且预期具有适合每天1次(qd)或每天2次(bid)口服施用的药代动力学特性。
除非另有说明,本文中使用的术语“治疗”是指逆转、减轻、抑制这样的术语所应用的障碍或病症的进展或者阻止所述障碍或病症,或逆转、减轻、抑制、阻止这样的障碍或病症的一种或多种症状。除非另有说明,本文中使用的术语“治疗”将治疗的行为当作上面刚刚定义的“治疗”。
要根据本发明治疗的患者包括任何温血动物,例如,但不限于人、马、狗、豚鼠或小鼠。例如,所述患者是人。医学领域的技术人员容易地能够鉴别各个罹患癌症且需要治疗的患者。
本文中使用的术语“同时施用”或“并行施用”表示多种治疗性化合物的施用,使得所述各种治疗性化合物同时(包括在重叠的时间段内)存在于对象内。同时施用或并行施用还可以表示一个阶段或疗程,在此期间患者接受多种治疗性化合物,不论各种治疗性化合物是否在相同的或重叠的时间段内存在于个体中。
依次施用表示这样的疗程:在此期间相继施用多种治疗性化合物,从而在第一个规定的时间段给患者提供第一种治疗性化合物,并在第二个规定的时间段给患者提供第二种治疗性化合物,以此类推,具有或没有在其中不施用治疗性化合物期间的时间段。
在该方法的一个实施方案中,所述癌症包括但不限于:间皮瘤、肝胆(肝和胆管)、原发性或继发性cns肿瘤、原发性或继发性脑肿瘤、肺癌(nsclc和sclc)、鳞状细胞癌、骨癌、胰腺癌、皮肤癌、头或颈的癌症、皮肤或眼内黑素瘤、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、胃肠(胃、结肠直肠和十二指肠)癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统的癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、睾丸癌、慢性或急性白血病、慢性髓性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、肾上腺皮质癌、胆囊癌、多发性骨髓瘤、胆管上皮癌、纤维肉瘤、神经母细胞瘤、视网膜母细胞瘤或前述癌症中的一种或多种的组合。
在本发明的一个实施方案中,所述癌症选自肺癌(nsclc和sclc)、头或颈的癌症、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、乳腺癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤、脊柱轴肿瘤或前述癌症中的一种或多种的组合。
本文中使用的术语“协同”表示比两种或更多种单一药剂的累加作用更有效的治疗剂组合。例如5t4-mcmmaf(或mmaf或其它澳瑞他汀)与一种或多种化学治疗剂之间的协同相互作用的确定可以是基于从本文描述的测定得到的结果。使用chou和talalay联合方法和剂量-效应分析(采用calcusyn软件),分析这些测定的结果,以便得到联合指数“ci”(chou和talalay(1984)adv.enzymeregul.22:27-55)。已经在几个测定系统中评价了由本发明提供的组合,且可以利用用于量化抗癌剂之间的协同作用、累加作用和拮抗作用的标准程序来分析数据。优选地利用的程序是chou和talalay在“newavenuesindevelopmentalcancerchemotherapy,”academicpress,1987中描述的程序。小于0.8的联合指数(ci)值指示协同作用,大于1.2的值指示拮抗作用,且在0.8-1.2之间的值指示累加作用。所述联合治疗可以提供“协同作用”并证实“协同”,即,当所述活性成分一起使用时实现的效应大于分别使用所述化合物引起的效应的总和。在以下情况下可以实现协同效应:将活性成分(1)在组合的单位剂量制剂中共配制并同时施用或递送;(2)作为单独制剂交替地递送;或(3)通过一些其它方案。当在交替疗法中递送时,当依次施用或递送(例如,通过在单独注射器中的不同注射剂)化合物时可以实现协同效应。一般而言,在交替疗法中,依次(即,在时间上相继)施用有效剂量的每种活性成分。
在测量体内或治疗协同作用时,协同作用的一种量度被称作“超越最高单一药剂”协同作用。在以下情况下发生超越最高单一药剂协同作用:当固定剂量的组合使得它优于两种它的组分剂量时,则将其称作“超越最高单一药剂”(参见fda的政策,在21cfr300.50,其采用这样的方法来批准组合药物产品;和,borisy等人(2003)proceedingsofthenationalacademyofscience.)。当然,“协同作用”在本文中的应用也包括体内协同作用,如通过另外的和/或替代性的方法所测量的。
本发明的某些方面涉及药学上可接受的盐的施用。除非另有说明,本文中使用的术语“药学上可接受的盐”包括可能存在于本发明的化合物中的酸性或碱性基团的盐。代表性的盐包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、硝酸盐、乙酸盐、草酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐、甲磺酸盐、葡庚糖酸盐、乳糖酸盐和月桂基磺酸盐等。这些可以包括基于碱金属和碱土金属(诸如钠、锂、钾、钙、镁等)的阳离子,以及无毒的铵、季铵和胺阳离子,包括、但不限于铵、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等(参见,例如,s.m.berge,等人,“pharmaceuticalsalts,”j.pharm.sci.,1977;66:1-19,其通过引用并入本文);和handbookofpharmaceuticalsalts,p.heinrichstahl,camilleg.wermuth(编),vhca(苏黎士,瑞士)和wiley-vch(魏因海姆,德国)于2002年联合出版。该术语也包括药学上可接受的酸加成盐,且有关的化合物可能作为水合物或溶剂合物存在,并且水合物和溶剂合物也在本发明的范围内。
化合物(或其药学上可接受的盐)的有效量可以理解为包括在本发明的组合中足以阻止或抑制肿瘤细胞的生长或癌症转移的进展的量。剂量和施用方案的治疗或药理学有效性也可以表征为在经历特定肿瘤的患者中诱导、增强、维持或延长缓解的能力。
可以以临床上常用的药量或剂量施用要用在本发明的方法或组合中的化合物。考虑到因素诸如年龄、重量、一般健康、施用的化合物、施用途径、需要治疗的癌症的性质和进展以及其它药物治疗的存在,本领域技术人员将能够根据已知方法确定在本发明的组合中使用的每种化合物的适当有效量或剂量以施用给患者。
通过能够将化合物递送至作用部位的任何方法,可以实现本发明的组合的化合物的施用。这些方法包括口服途径、十二指肠内途径、胃肠外注射(包括静脉内、皮下、肌肉内、血管内或输注)、局部和直肠施用。
可以在施用之前配制本发明的方法或组合的化合物。所述制剂优选地适合特定施用模式。这些化合物可以用本领域已知的药学上可接受的载体配制,且以本领域已知的多种剂型施用。在制备本发明的药物组合物时,经常将活性成分与药学上可接受的载体混合,或用载体稀释,或包封在载体内。这样的载体包括、但不限于固体稀释剂或填充剂、赋形剂、无菌的水性介质和各种无毒的有机溶剂。剂量单位形式或药物组合物包括片剂、胶囊剂(诸如明胶胶囊剂)、丸剂、粉剂、颗粒、水性和非水性口服溶液和混悬液、锭剂、糖锭、硬糖果、喷雾剂、乳膏剂、油膏剂、栓剂、胶冻剂、凝胶剂、糊剂、洗剂、软膏剂、可注射的溶液、酏剂、糖浆剂和胃肠外溶液,其包装在适合细分成单个剂量的容器中。
胃肠外制剂包括用于其制备的药学上可接受的水性或非水性溶液、分散体、混悬液、乳剂和无菌粉剂。载体的例子包括水、乙醇、多元醇(丙二醇、聚乙二醇)、植物油和可注射的有机酯诸如油酸乙酯。通过使用涂层诸如卵磷脂、表面活性剂或维持适当的粒度,可以维持流动性。示例性的胃肠外施用形式包括本发明的化合物在无菌水溶液(例如,丙二醇或右旋糖水溶液)中的溶液或混悬液。如果需要的话,可以适当地缓冲这样的剂型。
另外,润滑剂诸如硬脂酸镁、月桂基硫酸钠和滑石经常可用于压片目的。也可以在软和硬填充的明胶胶囊中使用类似类型的固体组合物。因此,优选的材料包括乳糖或奶糖和高分子量聚乙二醇。当水性混悬液或酏剂期望用于口服施用时,其中的活性化合物可以与以下物质组合:各种甜味剂或矫味剂、着色剂或染料,和如果需要的话,乳化剂或助悬剂,以及稀释剂诸如水、乙醇、丙二醇、甘油或它们的组合。
制备含有指定量的活性化合物的各种药物组合物的方法是本领域技术人员已知的,或本领域技术人员会明白的。例如,参见remington'spharmaceuticalsciences,mackpublishingcompany,easter,pa.,第15版(1975)。
根据本发明的方法、组合物和试剂盒可以提供与常规抗癌治疗相比提高的抗癌活性抑制水平,所述常规抗癌治疗包含单独的化合物1a或其药学上可接受的盐或化合物1b或其药学上可接受的盐、或单独的化合物2或其药学上可接受的盐。这样,可能以在没有其它抗癌剂存在下不足够(即亚治疗)的剂量利用本发明的抗癌剂,同时以更少的副作用维持相同或足够的抗癌活性水平。
在本发明的方法、组合物和试剂盒中,可以以每天1次约0.1至约20mg的剂量口服地(“po”)施用澳瑞他汀或其药学上可接受的盐。例如,以每天1次约0.1至约20mg、每天1次约0.5至约15mg、每天1次约1至约10mg、或每天1次约2-8mg的剂量。在一个实施方案中,可以以每天1次约2-8mg、或每天1次1、2、3、4、5、6、7、8、9或10mg的剂量口服地(“po”)施用要求保护的治疗性化合物。施用还可以更经常地或更不经常地发生,例如每天2次,每2、3、4、5或6天1次,每2周1次,每月1次,或按照处方。在另一个实施方案中,可以通过静脉内输注施用治疗性化合物。
在本发明的方法、组合物和试剂盒中,可以每周1次历时约15分钟至约3小时通过静脉内输注以约10至约500mg的剂量施用治疗性化合物(包括其药学上可接受的盐),优选地历时约30分钟通过静脉内输注。施用还可以更经常地或更不经常地发生,例如每天1次,每2、3、4、5或6天1次,每2周1次,每月1次,或按照处方。可以在施用其它组合化合物之前、过程中或之后施用在要求保护的方法和组合中的澳瑞他汀化合物。这样的并行施用(共同施用)可以是在单独的剂型中或在相同剂型中。
在某些情况下,低于前述范围的下限的剂量水平可以是超过足够量,而在其它情况下可以采用还更大的剂量,由本领域技术人员确定。
通过多种施用方案可以完成本发明的方法、组合物和试剂盒的实践。在一个方面,可以以1-周、2-周、3-周、4-周、5-周、6-周、7-周或8-周循环施用化合物。可以在必要时进行施用方案的重复以实现期望的癌细胞的减少或缩减。
本发明还涉及一种试剂盒,其包含澳瑞他汀和另一种治疗性化合物(当然包括之一或二者的药学上可接受的盐)和关于施用所述治疗剂的说明书。在一个实施方案中,所述说明书详细说明并确证治疗剂的施用模式,例如,关于本发明的治疗剂的同时或依次施用。在另一个实施方案中,所述试剂盒用于治疗癌症,包括、但不限于,间皮瘤、肝胆(肝和胆管)、原发性或继发性cns肿瘤、原发性或继发性脑肿瘤、肺癌(nsclc和sclc)、鳞状细胞癌、骨癌、胰腺癌、皮肤癌、头或颈的癌症、皮肤或眼内黑素瘤、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、胃肠(胃、结肠直肠和十二指肠)癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统的癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、睾丸癌、慢性或急性白血病、慢性髓性白血病、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、肾上腺皮质癌、胆囊癌、多发性骨髓瘤、胆管上皮癌、纤维肉瘤、神经母细胞瘤、视网膜母细胞瘤或前述癌症中的一种或多种的组合;或更具体地,肺癌(nsclc和sclc)、头或颈的癌症、卵巢癌、结肠癌、直肠癌、肛门区域的癌症、胃癌、乳腺癌、肾或输尿管癌、肾细胞癌、肾盂癌、中枢神经系统(cns)的肿瘤、原发性cns淋巴瘤、非霍奇金淋巴瘤、脊柱轴肿瘤或前述癌症中的一种或多种的组合;或更具体地,肺癌(nsclc和sclc)、卵巢癌、结肠癌、直肠癌、肛门区域的癌症或前述癌症中的一种或多种的组合;或更具体地,肺癌(nsclc和sclc)、卵巢癌、结肠癌、直肠癌或前述癌症中的一种或多种的组合;或膀胱癌、子宫内膜癌、多发性骨髓瘤、胃癌、肺癌(nsclc和sclc)、乳腺癌和鳞状细胞癌或前述癌症中的一种或多种的组合;或子宫内膜癌、胃癌、肺癌(nsclc和sclc)、乳腺癌和鳞状细胞癌或前述癌症中的一种或多种的组合;或子宫内膜癌、胃癌和肺癌(nsclc和sclc)或前述癌症中的一种或多种的组合。
实施例
实施例1:细胞系和试剂
人肿瘤细胞系nci-h1975、calu-6、nci-h358、hcc2429、mda-mb-468、mda-mb-231、caov-3、tov-112d、ov-90、ovcar-3、skov-3、ht-29、nci-n87、raji、ramos购自美国典型培养物保藏中心(atcc)。mdamb361-dyt2细胞mdamb435/5t4是用人5t4稳定地转染的细胞。描述了37622a1nsclc患者-衍生的异种移植物(pdx)和从37622a1建立并表征原代无血清培养物tum622(6)。将每种细胞系在atcc推荐的它的标准培养基中培养。对于体外研究,化疗药物得自siugma-aldrich。厄洛替尼和培美曲塞购自selleckchemicals。根据已知的技术用商购可得的试剂制备pf-05212384(pki-587)、pd-0325901(pd-901)、o-me-mmaf(mmaf)和澳瑞他汀101。以前在us20120251558a中描述了5t4-adc(a1mcmmaf)的制备。
实施例2:2d细胞增殖测定
将细胞铺板在96-孔透明底平板(corning)中并用不同浓度的化合物处理4天。使用celltiterglo发光细胞生存力测定试剂盒(promega)确定,并使用victorx3平板读数器(perkinelmer)测量。将数据归一化至对照组(空载体或dmso)。将ic50值定义为造成50%生长抑制的浓度。使用逻辑非线性回归(模型编号203,具有xlfitv4.2(idbs,guldford,surry,uk))计算ic50值。所有实验点在三个重复孔中建立并一式两份地独立执行。
实施例3:3d细胞增殖球状体测定
透明底96孔平板含有40μl/孔的100%bd基质胶基质(生长因子减少的)(#354230)。将3000/孔终浓度的mda-mb-468或h-1975在2%基质胶中的细胞混悬液覆盖在100%基质胶基底的上面。使细胞生长和形成球状体,并在球状体达到约100um大小(通过光学显微术测量)时开始药物处理。对于单次剂量处理和ic50确定,用化合物或adc处理双份孔的球状体以得到7天的9点、2倍剂量-响应曲线。在处理后第7天使用celltiterglo发光细胞生存力测定试剂盒(promega#g7570)测量增殖。
实施例4:协同作用测定
使用chou-talalay中效分析(28)评价药物组合的效应。在两个独立96-孔平板中以对角矩阵形式用单独的和组合的每种药物处理细胞,并通过使用celltiterglo试剂盒(promega)测量增殖。将结果表达为存活分数(受影响分数,fa),其基于经处理的样品的测量的发光计数与未经处理的对照的发光计数之比。用calcusyn软件(biosoft,ferguson,mo)使用7条代表具有固定药物比率的不同剂量-效应曲线的对角线来测量每种组合的联合指数(ci)。在每个实验中,针对3条具有7-8个数据点的剂量-效应曲线取在ed50水平的ci指数的平均值。参见图1。
实施例5:阻抗测定
使用96e-平板使用xcelligencertcamp系统(aceabiosciencesinc,sandiego,ca)实时监测细胞生长。xcelligence系统通过测量电阻抗来检测细胞数目的变化并产生细胞指数值,其与附着于孔底的细胞数目直接相关(29)。在细胞接种之前得到基线平板细胞指数。将细胞以4,000个细胞/孔接种在50ml体积中并温育过夜。在给药当天(第1天),将化合物以指示的浓度加入,并监测阻抗读数约250小时。可以在实验结束时或相对于时间绘制药物或媒介物处理组的阻抗指数值。
实施例6:天冬氨酸特异性半胱氨酸蛋白酶3/7细胞凋亡测定
在处理前一天将mda-468和h-1975细胞以15,000/孔接种在96-孔平板中。16、24或48小时处理以后,根据生产商的方案使用caspase-glo3/7assay(promegag8092,madison,usa)测量天冬氨酸特异性半胱氨酸蛋白酶3/7活性。在副本平板中,通过celltiter-glo发光细胞生存力测定(promegag7573,madison,usa)确定细胞的生存力。将药物处理过的样品中天冬氨酸特异性半胱氨酸蛋白酶3/7活性的增加首先相对于媒介物处理过的对照进行表达,关于生存力归一化,并表达为相对于媒介物处理过的对照的诱导倍数。
实施例7:细胞周期分析
根据生产商的方案,使用flowcellectbivariate细胞周期试剂盒(millipore,目录号fcch025103),制备用于组合的细胞周期和磷酸-组蛋白h3分析的细胞。使用facscalibur仪器(bdbiosciences)和flowjo软件(treestar,ashlandor)通过流式细胞计量术分析样品。
实施例8:异种移植物效力
雌性无胸腺nu/nu小鼠(18-23g)得自charlesriverlaboratories,wilmington,ma。给小鼠皮下地注射肿瘤细胞,并给具有不同阶段的肿瘤的动物静脉内地施用盐水(媒介物)、5t4-adc、pf-384、紫杉醇或组合5t4-adc+pf-384、5t4-adc+紫杉醇。基于mab蛋白质含量(2或3mgab/kg)以q4dx4(每4天)计划来施用adc,每组8-10只小鼠。以临床上有关的剂量(crd)施用5t4-adc、pf-384和紫杉醇,所述剂量从这些药物在人类中实现的暴露外推得到。根据确立的指南,所有使用小鼠的操作被pfizerinstitutionalanimalcareandusecommittee批准。将达到端点的时间(达到无肿瘤或肿瘤增至三倍的速率的时间)用于药物处理过的组的对比。使用t-检验来对比各个肿瘤体积,如在图例中所指示的那样。
实施例9:体外5t4-adc或澳瑞他汀净荷组合
在肺癌、乳腺癌和卵巢癌细胞系中针对与不同护理标准(soc)药剂或选择的信号传递抑制剂组合的5t4-adc或澳瑞他汀净荷评价体外细胞毒性活性。基于如以前描述的5t4状态(sapra等人,2013),为每种肿瘤适应症选择细胞系。在开始药物组合研究之前,确定每种药剂在常规2d增殖测定中的ic50值。采用chou-talalay方法来计算在不同剂量-效应水平的ci值。来自独立实验的平均ci值呈现在表2-5以及图1a和1b中。将<0.9的ci值视作协同作用的证据;0.9-1.1,累加作用;ci>1.1,拮抗作用。当将5t4-adc与pf-384、pd-901、培美曲塞、厄洛替尼或紫杉烷组合时,存在一致的强协同作用。尽管大多数细胞系对单独的pd-901或厄洛替尼相对不敏感,但是敏感的和不敏感的细胞都已经表现出协同相互作用(表2-5)。当将5t4-adc与铂化合物组合时通常观察到累加作用,而在5t4-adc和阿霉素、表柔比星或吉西他滨之间观察到适度的累加作用或拮抗作用。在组合测定中还包括澳瑞他汀或另外的微管-抑制剂药物。在净荷mmaf-ome或澳瑞他汀-101与上述药剂的细胞可渗透形式之间也观察到协同或累加相互作用模式。当在细胞系的更小子集中与pf-384组合时,紫杉醇或长春瑞滨也表现出协同或累加关系。高选择性的mtor激酶抑制剂wye-132(表5)会增强澳瑞他汀-101在ht-29、n87细胞中的抗增殖作用,该发现支持以下观点:全面降低mtor功能可能至少部分地引起在澳瑞他汀和pf-384之间观察到的宽协同作用。在更宽范围的细胞系和肿瘤类型之中鉴别出基于澳瑞他汀的药剂与pf-384或紫杉醇之间的更稳健协同作用的事实提示这些组合可能提供潜在的临床益处。
为了理解协同相互作用的动力学,使用xcelligence系统对细胞生长进行动态监测,这会实时提供增殖和粘附的电阻抗测量。用单独的各种药物5t4-adc、pf-384或用5t4-adc/pf-384组合以预定的次优剂量的药物处理mda-468细胞以允许在长时间段内更准确的观察增强的效应。在大约11天的进程中,观察到5t4-adc或pf-384在试验的浓度对细胞生长的最小抑制(图2a,b)。但是,由5t4-adc/pf-384组合造成的增殖的抑制远远比单独每种药剂中的任一种的效应更显著。在加入组合混合物以后立即观察到增强,该效应在整个实验时程中持续。当将游离的未缀合的净荷mmaf-ome与pf-384组合时,得到类似的结果(图2c,d)。因而,这些结果证实了我们使用常规增殖测定的先前发现,并提供了对体外协同效应的时间依赖性的另外洞察。
在有细胞外基质存在下产生的多细胞3d球状体与生长中的实体瘤具有更多的相似性:与2d培养物相比,在3d条件下的细胞以更慢的速率增殖且含有休眠细胞。为了提供在3d条件下对药物组合效应的生物学洞察,研究了mda-468球状体对5t4-adc、mmaf-ome、pf-384和紫杉醇处理的应答以确定每种单独药剂的ic50。然后通过与固定剂量的第二种药剂组合的5t4-adc或两种药物的相互组合的系列稀释来评价组合。还在与单一药剂相同的实验中包括组合的药剂以提供单独一种药物对照。对于5t4-adc/pf-384、mmaf-ome/pf-384或5t4-adc/紫杉醇的组合,观察到3d球状体细胞毒性的显著增强(图3a-f)。对于用5t4-adc/pf-384、mmaf-ome/pf-384或5t4-adc/ptx的组合处理过的肺癌h-1975球状体,观察到类似的情况(图3g-j且数据未显示)。
实施例10:pf-384或紫杉醇对细胞凋亡和细胞周期的影响
为了评价由5t4-adc和pf384或紫杉醇组合诱导的协同生长抑制是否是由于细胞凋亡,确定了h-1975或mda-468细胞中的促凋亡信号天冬氨酸特异性半胱氨酸蛋白酶3/7活化。在温育后24小时测得,单独的5t4-adc或pf-384导致两种细胞系中天冬氨酸特异性半胱氨酸蛋白酶3/7的适度的活化(图4)。但是,组合治疗表明天冬氨酸特异性半胱氨酸蛋白酶3/7的显著增强的诱导(图4a,e)。当用mmaf-ome+pf-384处理相同细胞时,得到类似的结果,从而提示,5t4-adc/pf-384组合中细胞凋亡的诱导在机理上与亲本净荷mmaf-ome的作用相关联(图4b,f)。关于切割的parp的免疫印迹分析(未显示)进一步支持了5t4-adc/pf384或mmaf-ome/pf384的组合对细胞凋亡的诱导。此外,与用单独的单一药剂处理过的细胞相比,还在用5t4-adc或mmaf-ome+紫杉醇处理48小时的mda-468细胞中观察到增强的天冬氨酸特异性半胱氨酸蛋白酶3/7活化(图4c,d)。总之,这些发现证实了用组合观察到的抗增殖作用可以至少部分地通过天冬氨酸特异性半胱氨酸蛋白酶3/7介导的增强的细胞凋亡应答来解释。
另外,评估了细胞周期进展的调节是否可以提供5t4-adc和pf-384(预期对细胞周期具有不同作用的试剂)之间的协同作用的解释。在等于或高于细胞增殖的ic50的浓度药物暴露24或36小时以后,对mda-468和h-1975细胞二者执行细胞周期分析(图5a-c且数据未显示)。如预期的,pf-384诱导处于细胞周期的g0/g1期的细胞的积累,处于g2/m期的细胞的比例下降。在药物处理以后24和36小时,该效应是明显的。相反,5t4-adc造成处于细胞周期的g2/m期的细胞的剂量依赖性的积累和在暴露的24-36小时内g0/g1细胞的同时发生的损失。使用5t4-adc和pf-384的组合的处理导致处于g1的细胞的最初积累和在暴露24小时之前接近正常百分比的在g2/m期的细胞(图5a,b)。不同于单独的5t4-adc,对于组合在任何时间点没有观察到g2/m峰的增加,且在36小时之前看到g2/m的减少。这伴随着亚-g1的大幅增加,从而提示,g2/m的较短持续时间可以由在该细胞周期阶段增强的细胞死亡来解释(数据未显示)。此外,与10-或100nm-pf-384组合的未缀合的mmaf-ome对g0/g1和g2/m的效应在总体上类似于单独的mmaf-ome,至少在试验的浓度如此(数据未显示)。与关于组合检测到的总g2/m峰的减少相一致,观察到用5t4-adc/pf-384组合处理24或36小时的细胞的磷酸-组蛋白h3水平相对于单独5t4-adc而言的下降(24小时,5t4-adc+pf-384(4.9%)相对于5t4-adc(7.7%);36小时,5t4-adc+pf-384(6.2%)相对于5t4-adc(10.8%)),发现可能提示药物组合处理过的细胞从有丝分裂停止状态更快地退出(图5c)。
实施例11:使用5t4-adc和pf-384或紫杉醇的体内组合治疗
为了确定在体外使用5t4-adc/pf-384或5t4-adc/紫杉醇实现的细胞增殖的优先减少和细胞凋亡的诱导是否可以转移至体内场合,在两种先前表征的肿瘤异种移植物模型中评价了各种单一药剂和所述组合的效力。mda-468三重阴性的乳腺癌和h-1975肺腺癌模型是具有宽范围的5t4表达水平的5t4+肿瘤异种移植物,如通过流式细胞计量术和ihc染色所证实的(3)。尽管在该研究中使用的药剂在以较高剂量使用时可能导致较高效力,临床上有关剂量的这些药物的施用是确保我们的数据向临床实践的更好转移的焦点。关于mda-468乳腺癌模型(与h-1975异种移植物相比,其经常对5t4-adc更敏感),执行达到无肿瘤(肿瘤消退)的时间的到端点时间(time-to-endpoint,tte)分析。tte图表明,用pf-384(7.5mg/kg)处理过的所有动物仍然含有肿瘤,而5t4-adc(2mg/kg)和5t4-adc/pf-384组在研究进程中实现肿瘤消退(图6a)。相对于单独的5t4-adc(p<0.0001,通过时序检验),在组合组中达到完全肿瘤消退需要短得多的时间,且在5t4-adc/pf-384组中的所有动物在第36天之前变得无肿瘤。此外,在初次给药后第53天在单一处理组和5t4-adc/pf-384组合之间观察到平均肿瘤体积的显著差异(通过t-检验,pf-384相对于5t4-adc/pf-384,p<0.0001;5t4-adc相对于5t4-adc/pf-384,p=0.02)(图6b)。值得注意的是,在第53天,5t4-adc/pf-384组合组具有10/10完全缓解(cr),与此相比,单独的5t4-adc仅为3/8cr,且在pf-384组中无cr(图6b)。将具有小于3倍的肿瘤体积增加的动物的百分比用作h-1975模型的分析的存活端点,所述h-1975模型通常对5t4-adc的敏感性低于mda-468。tte分析指示组合组的肿瘤增至三倍速率相对于单独的5t4-adc(3mg/kg;p=0.0356,时序检验)或pf-384(7.5mg/kg,p<0.0001,时序检验,图6c)的统计上显著的延迟。使用5t4-adc+pf384的处理也导致肿瘤生长的更完全抑制,在治疗开始以后第21天具有统计上显著的肿瘤体积差异(p=0.006)(图6c)。
鉴于在体外在5t4-adc和紫杉烷之间观察到的有利相互作用,研究了该组合在体内的潜在抗肿瘤活性。用5t4-adc(2mg/kg)+紫杉醇(22.5mg/kg)的组合试验了mda-468异种移植物。这些组合的tte分析揭示了组合组达到完全肿瘤消退需要与单独的单一药物相比显著更短的时间(图7a,c)。如在图7b中所示,5t4-adc单一疗法在2mg/kg表现出强抗肿瘤活性,在第53天之前导致8个肿瘤中的3个的肿瘤消退,而单独的紫杉醇在10mg/kg对肿瘤生长不具有显著作用。5t4-adc/ptx组合组表现出胜过单一疗法治疗的治疗益处,如10个肿瘤中的9个的肿瘤消退和平均肿瘤体积的显著差异和(5t4-adc/ptx相对于5t4-adc,t-检验p=0.037;5t4-adc/ptx相对于ptx,p<0.0001)所证实的。与22.5mg/kg紫杉醇组合的5t4-adc在第53天之前表现出9个肿瘤中的9个的深远持久消退,而单独的单一处理表现出更适中的抗肿瘤活性(对于5t4-adc为3/9cr;对于ptx为6/10cr;平均肿瘤体积:5t4-adc/ptx相对于5t4-adc,p=0.037;5t4-adc/ptx相对于ptx,p<0.0001)(图6d)。还用类似的单一药剂(3mg/kg5t4-adc,10mg/kg紫杉醇)或组合治疗处理了h-1975肺癌异种移植物(图7)。使用5t4-adc+紫杉醇的双重处理产生了与单一疗法治疗相比抗肿瘤活性的显著增强,如组合组相对于单独5t4-adc或ptx处理组而言肿瘤增至三倍速率的显著延迟所证实的(图7a)。此外,在初次给药后第46天在5t4-adc/ptx组中的平均肿瘤体积相对于单独单一药物处理组强烈减小(图7f;p<0.0001,t-检验)。
进行研究以包括肺癌aa37622的pdx模型,即最近在我们的组中建立的k-ras突变体模型(3,4)。惊人的是,3mg/kg的5t4-adc和22.5mg/kg的紫杉醇的类似组合导致与单一疗法治疗相比更显著的肿瘤生长抑制(5t4-adc/ptx相对于5t4-adc,p<0.001;5t4-adc/ptx相对于ptx,p<0.0001;双因素方差分析,在第56天;图7g)。
生物学数据
表1.癌细胞系
表2.在肺癌细胞系中的药物组合
表3.在乳腺癌细胞系中的药物组合
表4.在卵巢癌细胞系中的药物组合
表5.在ht-29和n-87细胞系中的药物组合
表1列出了在研究中使用的癌细胞系。基于可公开得到的来源,总结了每个细胞系的细胞系名称、组织起源、选择的突变或分子状态。
表2-5列出了每个确定的组合在ed50水平的平均联合指数(ci)值。已经如下解释ci:非常强的协同作用(<0.1),强协同作用(0.1-0.3),协同作用(0.3-0.7),中等协同作用(0.7-0.85),轻微协同作用(0.85-0.9),接近累加(0.9-1.1),轻微拮抗作用(1.1-1.2)和中等拮抗作用(1.2-1.45)。结果是至少三个独立实验的平均值。
- 还没有人留言评论。精彩留言会获得点赞!