多特异性抗体平台和相关方法与流程
优先权要求
本专利申请要求2015年8月26日提交的美国临时申请系列号62/209,978的优先权,且其内容通过提述以其整体并入本文。
序列表
本申请含有序列数据。
发明领域
本发明涉及多特异性抗体平台、多特异性抗体,包括双特异性抗体,和产生它们的方法。
发明背景
抗体是大的糖蛋白,其由b淋巴细胞衍生的浆细胞响应于抗原而分泌。存在五种主要类型的抗体:igg、igm、iga、ige和igd。igg占人体内血清抗体的约75%,且其是存在于循环中的最常见类型的抗体。在所有五种主要类型的抗体中,基本单元是y形状的单体,其由两条相同的重链(hc)和两条相同的轻链(lc)组成。每条lc具有一个可变结构域(vl)和一个恒定结构域(cl)。每个hc具有一个可变结构域(vh)和三个恒定结构域(ch)。y结构中的‘臂’形成抗原结合片段(fab)。该臂通过柔性铰链区连接至同二聚体fc片段(可结晶片段),其形成y结构的‘底座’。抗体与免疫系统的其它组分通信的能力经由fc区介导。在哺乳动物细胞系中产生同二聚体fc区是本领域中已知的。此类同二聚体fc区可以用于例如将抗体样特性带给融合蛋白。
双特异性抗体(bsab)是人工蛋白,其由两个不同抗体的片段构成,且因此bsab结合两种不同类型的抗原。双特异性抗体属于多特异性抗体。多特异性抗体可以是双特异性的、三特异性的,或四特异性的抗体。此类多特异性抗体的fc片段优选是异二聚体。双特异性,以及其它多特异性抗体通常在广泛的临床和诊断应用中显示出巨大的潜力。存在有欧盟和美国批准用于治疗肿瘤疾病的两种双特异性抗体药物(catumaxomab和blinatumab)。由于其独特的特征,双特异性和多特异性抗体通常已经分期为对于下一代抗体治疗剂非常有吸引力的形式。
在临床研究领域中,已经在几篇出版物中描述了特异性抗体的诊断应用(例如fanger等人,crit.rev.immunol.1992,12:101-124;nolan等人,biochem.biophys.acta.1990,1040:1-11;song-sivilai等人,clinexp.immunol.1990,79:315)。然而,双特异性抗体(bsab)最令人印象深刻的应用在于免疫-肿瘤领域。理论上,bsab的一个臂可以结合肿瘤细胞上的肿瘤抗原,bsab的第二个臂可以结合免疫效应细胞标志物。因此,bsab可以作为桥接剂(bridgingagent)来募集免疫效应细胞(天然杀伤细胞或效应t细胞)并将其带到局部肿瘤部位以杀死肿瘤细胞。这些治疗应用已经描述于许多出版物中(hseih-ma等人,cancerres.1992,52:6832-6839;weiner等人,cancerres.1993,53:94-100;shalaby等人,j.exp.med.1992,175:217;weiner等人,j.immunol.1994,152:2385)。
制备bsab或多特异性抗体的几种不同方法是本领域已知的。在20世纪80年代,通过两种不同杂交瘤的交叉杂合体(cross-hybrid)产生双特异性抗体(millstein和cello,nature1983,305:537-539)。由于两种不同重链和两种不同轻链的随机配对,那些杂合的杂交瘤(也称为四源杂交瘤(quadromas))可以产生多达10种不同种类的抗体组合,其中只有一种是所需的bsab形式。这种情况导致正确的bsab形式的麻烦和低产率纯化。为了克服随机分类问题,优选产生两个不同修饰的fc结构域,使得那两个修饰的fc结构域当它们彼此相遇时能够相对于同二聚体形成有利于异二聚体形成。每个修饰的fc可以与具有独特结合特异性的fab或scfv融合。当具有不同结合特异性的那两种不同修饰的含fc的片段在哺乳动物细胞培养物中共表达时,它们可以以良好的产率形成异二聚体双特异性抗体。
在pct专利申请公开wo2007/147901和美国专利8,592562中公开了另一种方法,其中第一ch3结构域和第二ch3结构域的电荷被重新分布,使得那两个不同修饰的ch3结构域相对于同二聚体形成将有利于异二聚体形成。然而,通常在哺乳动物细胞中共表达两种不同的fc重链可以导致形成一些异二聚体fc片段,但也导致大量形成同二聚体片段。从共转染的细胞培养物或工程化的稳定细胞系上清液纯化异二聚体片段是麻烦和昂贵的。
已经对这个问题进行了一些改进。例如美国专利号5,807,706公开了在ch3结构域上的所谓的“突出-入-穴(knob-into-hole)”突变。通过采用“突出-入-穴”策略,已经公开了几种其它的方法,例如在美国专利申请2014/0348839和2013/0245233中。这种技术导致更高的异二聚体形成,但是一些“穴”同二聚体和“突出”单体仍然存在。美国专利申请号2012/0116057公开了在野生型ch3结构域中,通过优选用丙氨酸取代丝364位丝氨酸来改进异二聚化。这种取代导致异二聚体fc的聚集增加。
在开发治疗组合物中抗体已经变得越来越重要。多特异性抗体衍生物,包括双特异性抗体可以认为是用于癌症治疗的下一代靶向生物制剂。多特异性抗体结合至少两种抗原或表位。多特异性抗体在实验性癌症治疗中的应用包括结合不同细胞表面蛋白以实现更完全阻断增殖或血管发生相关途径的分子。多特异性抗体也可用作载体以将免疫效应细胞递送至肿瘤。因此,多特异性抗体由于其结合多于一种抗原的能力是合乎需要的。然而,制备和纯化多特异性抗体(包括双特异性抗体),仍然是技术挑战,也非常昂贵。因此,需要新的方法来制备高纯度的此类抗体。
各种手段在本领域中是已知的,但是不能解决本文所述的本发明解决的所有问题。本发明的一个实施例在附图中说明并将在下文中更详细地描述。
发明概述
本发明成功地赋予以下期望和有用的益处和目的,等等。本文描述的发明提供了新的多特异性抗体(包括双特异性抗体)、新的抗体和抗体衍生物的平台,提供所述抗体的新方法和提供高度纯化的新的多特异性抗体的新方法。
本发明提供了新的双或多特异性抗体平台以提高两种不同修饰的哺乳动物iggfc区以及iga,igd,ige和igmfc区的异二聚化。本发明还提供了铰链区域中的任选修饰。本发明进一步提供了简化的一步纯化以实现异二聚体的高纯度。
本发明的一个目的是提供修饰抗体ch3结构域以工程化包含ch3的第一多肽和包含ch3的第二多肽之间的界面用于异二聚化的策略。特别地,通过氨基酸取代将至少两个,优选二至六个,且最优选三至四个带正电荷的氨基酸(例如但不限于精氨酸,赖氨酸或组氨酸)引入第一多肽的界面以增加正电荷。同时,通过氨基酸取代将至少两个,优选二至六个,且最优选三至四个带负电荷的氨基酸(例如但不限于天冬氨酸或谷氨酸)引入第二多肽的互补界面以增加多肽链的负电荷。在两个互补的ch3结构域的界面处的那些不同的修饰推测提供那两条链之间强得多静电吸引力,以促进异二聚体形成而不是同二聚体形成。此外,可以将半胱氨酸分子与带电荷的氨基酸一起引入到两个互补的ch3结构域的两个界面的适当位置,以允许链间二硫键的形成,并进一步加强异二聚体形成。
本发明的另一个目的是提供生成此类氨基酸取代的方法,使得第一多肽链上引入的带正电荷的氨基酸将位于与第二多肽链的互补界面的最接近位置处的相对的带负电荷的氨基酸相互作用的最适合的取向位置。当那些氨基酸取代适当地定位时,异二聚体形成是静电有利的:例如相反的电荷位于两个配对ch3结构域的界面的最接近位置中。
本发明的另一个目的是提供制备异二聚体抗体的方法,所述异二聚体抗体可以是双特异性或多特异性结合蛋白。异二聚体抗体可以包含包含修饰的ch3的第一多肽和包含修饰的ch3的第二多肽,其在界面处相遇并聚在一起以增强异二聚体形成。在某些方面,所述分子可以是双特异性、三特异性或四特异性抗体。含有ch3的第一多肽的n末端可以与重链fab区(vh和ch1),scfv,原抗体(probody),单抗体(monobody),双抗体,纳米抗体(nanobody),配体或受体,或任何种类的结合结构域融合。含有ch3的第一多肽的c末端可以与不同的重链fab区(vh和ch1),scfv,原抗体,单抗体,双抗体,纳米抗体,配体或受体,或任何种类的结合结构域融合。可以在融合的结合单元和第一多肽链之间使用肽接头。同时,含有ch3结构域的第二多肽的n末端可以与另一种不同的重链fab区(vh和ch1),scfv,原抗体,单抗体,双抗体,纳米抗体,配体或受体,或任何种类的结合结构域融合。所述含有ch3的第二多肽的c末端可以与另一种不同的重链fab区(vh和ch1),scfv,原抗体,单抗体,双抗体,纳米抗体,配体或受体融合,或任何形式的迷你结合结构域融合。可以在融合的结合单元和所述第二链之间引入肽接头。
本发明的另一个目的是提供方法,以使用瞬时转染的细胞培养系统,稳定工程化的细胞系系统或体外无细胞蛋白质合成系统产生此类异二聚体蛋白。那些系统包括编码第一链和第二链的核酸。那两条链可以在相同的载体上或两个单独的载体上编码。可以使用的细胞培养系统包括但不限于哺乳动物细胞(例如cho,hek293或骨髓瘤ns0细胞),昆虫细胞,酵母细胞或细菌细胞系统。在某些实施方案中,编码包含ch3的第一多肽和包含ch3的第二多肽的核酸之间的比率可以在1:2至除了2:1之外的比率变化。在优选的实施方案中,使用1:1比率。
本发明的另一个目的是纯化所述异二聚体蛋白的方法。标准的单克隆抗体纯化技术可用于纯化异二聚体抗体。那些技术包括但不限于蛋白a亲和层析,尺寸排阻和离子交换层析,以及铵沉淀。
在优选的实施方案中,带负电荷的氨基酸取代的第二多肽相应地损失了其几乎所有的蛋白a结合性质。这种独特的特征提供了用于纯化所述异二聚体蛋白质的技术优点。因为异二聚体抗体中仅第一多肽与蛋白a结合,而第二多肽不结合,因此相比于具有两条结合蛋白a的链的正常fc同二聚体相比,异二聚体具有对蛋白a柱的低的结合亲和力,并可以在较高的ph下洗脱。从本发明生成的分子可以在ph4下洗脱,而同二聚体仍然保留在蛋白a柱上。
在某些实施方案中,含有ch3的多肽可以是来自但不限于人,小鼠,牛,马,鸡,大鼠,非人灵长类动物,骆驼,美洲驼羊(llama),羊驼(alpaca),大羊驼(guanaco),骆马(vicunas)或鲨鱼的免疫球蛋白分子。而在其他方面,免疫球蛋白可以是igg,iga,igm,ige和igd或其亚类(例如igg1,igg2,igg3或igg4等)。含有ch3结构域的多肽可以含有另外的改变,如非天然氨基酸,fc效应子功能突变和糖基化位点突变。
本发明的另一方面是所述异二聚体抗体可以用作药物或治疗组合物。异二聚体蛋白可以配制成含有其它药学上可接受的缓冲剂,成分或赋形剂的组合物。可以将此类药物组合物施用于患者以治疗疾病或预防疾病。
本发明的再一个目的是提供包含一对抗体片段的分子,每个抗体片段含有修饰的ch3结构域以促进异二聚体形成。在一个方面,当在可比较的表达系统中表达时,该分子具有与野生型抗体fc基本上相同的产率。在另一方面,来自所述分子的第一片段的修饰的ch3结构域优选在边缘界面处含有3或4个氨基酸取代,其中至少2个,优选2至6个,且最优选3至4个已经改变为选自精氨酸,组氨酸或赖氨酸的带正电荷的氨基酸。一个氨基酸可以改变为带正电荷的氨基酸,半胱氨酸或其它不带电荷的氨基酸。另一方面,来自该分子的第二片段的修饰的ch3结构域优选在边缘界面处含有3或4个氨基酸取代,其中至少2个,优选2至6个,且最优选3至4个已经改变为选自天冬氨酸或谷氨酸的带负电荷的氨基酸。一个氨基酸可以改变为带负电的氨基酸,半胱氨酸或其它不带电氨基酸。
本发明的一个目的是提供包含第一免疫球蛋白重链和第二免疫球蛋白重链的多特异性异二聚体抗体分子,其中第一重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,第二重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,其中第一重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带正电荷的氨基酸,且第二重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带负电荷的氨基酸,且其中每个突变定位于y391至s400的边缘界面,q347至e357的边缘界面,或d401至l410的中间界面。
本发明的一个目的是提供包含第一免疫球蛋白重链和第二免疫球蛋白重链的多特异性异二聚体抗体分子,其中第一重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,第二重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,其中第一重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带正电荷的氨基酸,且第二重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带负电荷的氨基酸,其中第一重链的ch3结构域中的取代选自下组:y391k,y391r,y391h,k392r,k392h,t393k,t393r,t393h,t394k,t394r,t394h,p395k,p395r,p395h,p396k,p396r,p396h,v397k,v397r,v397h,v397c,l398k,l398r,l398h,d399k,d399r,d399h,s400k,s400r,s400h,q347k,q347r,q347h,v348k,v348r,v348h,y349k,y349r,y349h,t350k,t350r,t350h,f405r,f405k,f405h,y407r,y407k和y407h。
本发明的一个目的是提供包含第一免疫球蛋白重链和第二免疫球蛋白重链的多特异性异二聚体抗体分子,其中第一重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,第二重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,其中第一重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带正电荷的氨基酸,且第二重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变是突变为2个,优选2至6个,且最优选3至4个带负电荷的氨基酸,其中第二重链的ch3结构域中的取代选自下组:y391d,y391e,k392d,k392e,t393d,t393e,t394d,t394e,p395d,p395e,p396d,p396e,v397d,v397e,v397c,l398d,l398e,d399e,s400d,s400e,s354d,s354e,r355e,r355d,f405e,f405d,y407e,y407d,k409d和k409e。
本发明的一个目的是提供包含第一免疫球蛋白重链和第二免疫球蛋白重链的多特异性异二聚体抗体分子,其中第一重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,第二重链的ch3结构域包含至少2个,优选2至6个,且最优选3至4个氨基酸突变,其中第一重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变向第一重链的ch3结构引入至少2个,优选2至6个,且最优选3至4个带正电荷的氨基酸,且第二重链ch3结构域中的至少2个,优选2至6个,最优选3至4个突变向第二重链的ch3结构引入至少2个,优选2至6个,且最优选3至4个带负电荷的氨基酸,且其中第一重链的ch3结构域包含根据seqidno:5(oa)的氨基酸序列,且第二重链的ch3结构域包含根据seqidno:7(ob)或根据seqidno:11的氨基酸序列(od),或者第一重链的ch3结构域包含seqidno:9(oc)的氨基酸序列且第二重链的ch3结构域包含根据seqidno:7(ob)的氨基酸序列)。
本发明的另一个目的是提供包含编码前述权利要求中任一项的分子的第一重链和第二重链的核苷酸序列的核酸载体,其中所述编码序列可以在相同的载体上或单独的载体上,并且其中编码第一链和第二链的核酸的比率可以变化。
本发明的另一个目的是提供分离的多肽链,其包含多特异性抗体的ch3结构域,所述多肽链包含根据选自下组的seqid的氨基酸序列:seqidno:1、3、5、7、9、11、13、15、16、17、19、21、23、25、27、29、31、33和35。
本发明的再一个目的是提供制备多特异性抗体的方法,其中该方法包括以下步骤:a)提供包含第一ch3结构域,第一ch2结构域和第一抗原结合结构域的第一多肽;b)提供包含第二ch3结构域,第二ch2结构域和第二抗原结合结构域的第二多肽;c)在第一多肽的ch3结构域中取代至少2个,优选2至6个,且最优选3至4个氨基酸,其中所述取代增加链的正电荷;d)在第二多肽的ch3结构域中取代至少2个,优选2至6个,且最优选3至4个氨基酸,其中所述取代增加链的负电荷;e)在适合的细胞系中共表达步骤a)和b)的多肽链;f)从细胞系表达的二聚体中分离含有第一和第二多肽的异二聚体;和任选地g)通过将其它单元融合至多肽来修饰分离的异二聚体。
附图简述
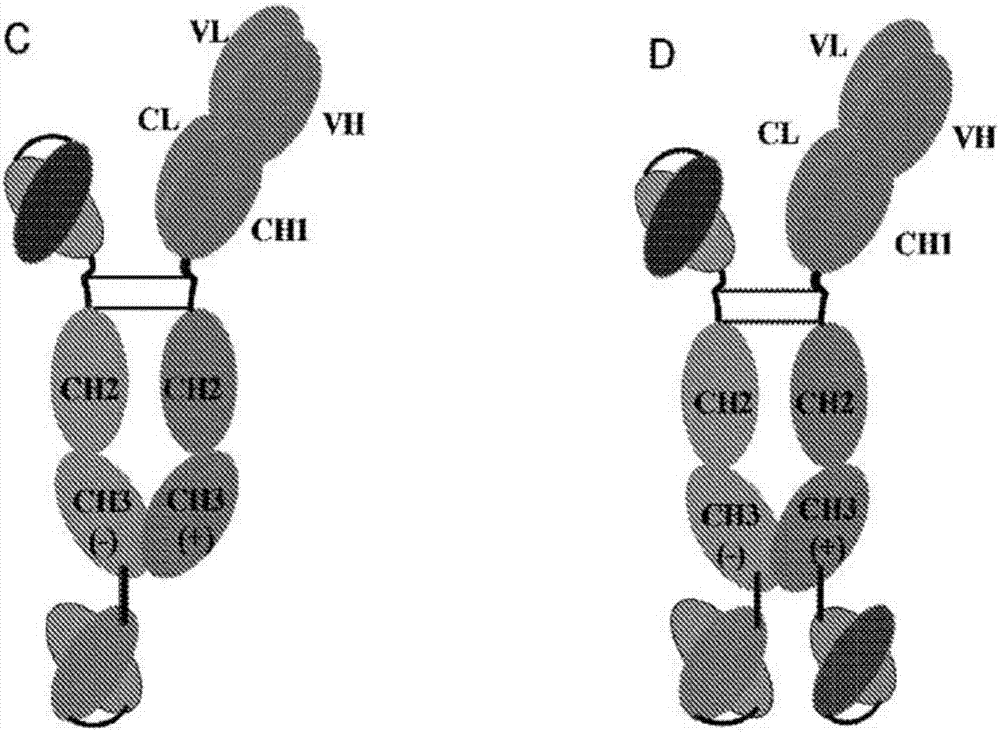
图1显示了本发明的双特异性或多特异性抗体结构的实例的示意图。本发明提供了可以是双特异性,三特异性或四特异性抗体的分子。图a和b(图1a)是两个常见的“y”形状双特异性抗体结构。图c和d(图1b)示出了衍生自图a的三特异性和四特异性抗体形式。图e和f(图1c)是衍生自图b的三特异性和四特异性抗体形式。
图2是用于评价两种含有修饰的ch3的多肽片段之间异二聚体形成的实验程序的示意图。长链通常含有ch1-铰链-ch2-ch3,其具有带正电荷的氨基酸取代,而短链通常仅含有铰链-ch2-ch3,其具有带负电荷的氨基酸取代。编码长链和短链的dna以1:1比率混合并转染至hek293细胞中。三天后,收获细胞培养上清液,并进行磁性蛋白a珠下拉。通过sds电泳分析与磁珠结合的蛋白。
图3显示了装载各种样品的sds-page凝胶:m:标记物;泳道1:wt长链;泳道2:wt短链;泳道3:wt长链和短链的共转染。除中间的异二聚体带外,还有大量长链同二聚体(上)和短同二聚体(底部);泳道4:突变体oe链;泳道5:突变体of链;泳道6:oe和of链的共转染;泳道7:突变体oa链;泳道8:突变体ob链。注意ob对蛋白a的结合活性丧失;泳道9:oa和ob链的共转染。注意,异二聚体带的强度与泳道4中的wt异二聚体带的强度相当,而长链和短链同二聚体条都不可见。
图4显示装载有各种样品的sds-page凝胶:泳道1:突变oa链;泳道2:突变ob链;泳道3:oa和ob链的共转染:泳道4:突变oc链;泳道5:突变od链;泳道6:oc和od链的共转染。注意,第6泳道中有两条异二聚体带。
图5显示了装载各种样品的sds-page凝胶。泳道m:标记物;泳道1:突变oa链;泳道2:突变ob链;泳道3:突变oc链;泳道4:突变od链;泳道5:oa和od链的共转染;泳道6:空;泳道7:oc和ob链的共转染。
图6显示了装载各种样品的sds-page凝胶。泳道1至3:oa和ob链的三次独立共转染;泳道4:空;泳道5:野生型长链和短链的共转染作为对照。
图7显示了装载各种样品的sds-page凝胶。泳道m:标记物;泳道1:og和oh链的共转染;泳道2:空;泳道3:oi和oj链的共转染;泳道4:空;泳道5:om和on链的共转染。
图8是本发明抗体的单步骤蛋白a柱纯化的示意图。短链包含失去蛋白a结合活性的突变,并且其同二聚体(如果存在的话)将在洗涤步骤期间流过柱。另一方面,长链包含保留蛋白a结合的突变,并且其同二聚体(如果存在的话)将在ph高于3洗脱时保留在柱上。只有长链和短链异二聚体可以在4.0和5.0之间的ph下洗脱出来。
图9显示了使用蛋白a柱的oa和ob异二聚体纯化结果。将oa和ob共转染样品加载到蛋白a柱中。洗涤后,首先在ph4.0下洗脱异二聚体产物,然后在ph2.8下洗脱。泳道2至6为ph4.0洗脱级分,而泳道7至10为ph2.8洗脱级分。如泳道4和5所示,oa和ob异二聚体可以在ph4.0下洗脱。
图10显示了两种纯化的双特异性抗体产物的sds-page分析。泳道1是分子标记物;泳道2至6是第一双特异性抗体产物her2xcd3.1(抗her2和抗cd3.1的异二聚体)的洗脱级分。泳道7至10是第二双特异性抗体产物her2xcd3.2(抗her2和抗cd3.2的异二聚体)的洗脱级分。
图11显示了双重特异性elisa结合结果。tbs和pbs是缓冲液对照。抗her2是与oa片段融合的源自赫赛汀(herceptin)的scfv。抗cd3.1和抗cd3.2是与oa片段融合的衍生自两种不同cd3抗体的两种scfv。her2xcd3.1是抗her2-ob和抗cd3.1-oa异二聚体。her2xcd3.2是抗her2-ob和抗cd3.2-oa异二聚体。结果表明,只有两个异二聚体显示双重特异性结合活性。其他单一结合剂没有显示任何双重特异性结合活性。
发明详述
定义
如本文所用的,“氨基酸”是指20种天然存在的氨基酸之一或可能存在于特定的限定位置的任何非天然类似物。
如本文所用的,“氨基酸突变”是指多肽序列中的氨基酸取代,插入和/或缺失。本文中优选的氨基酸修饰是取代。
如本文所用的,“氨基酸取代”或“取代”是指将亲本多肽序列中特定位置的氨基酸替代为另一种氨基酸。例如,取代p395d是指变体多肽,其中多肽的位置395处的氨基酸脯氨酸已被氨基酸天冬氨酸替代。
如本文所用的,“抗体”是指包括全长抗体以及抗体片段。抗体可以指来自任何生物体的天然抗体,工程化抗体,或通过用于实验、治疗或其它目的的重组技术生成的抗体。术语“抗体”包括单克隆抗体和多克隆抗体。抗体可以是拮抗性的,激动性的,中和性的,抑制性的或刺激性的。
如本文所用的,“抗体片段”是指通过全抗体修饰产生的或通过使用重组dna技术从头合成的蛋白,例如fab,fv,scfv或抗体的其它抗原结合子序列。
如本文所用的,“双特异性抗体”或“bsab”是指由两种不同抗体的片段组成并因此结合两种不同类型的抗原的人工蛋白。
如本文所用的,“多特异性抗体”是指双特异性,三特异性或四特异性抗体。多特异性抗体由两种或更多种不同抗体的片段组成,因此与两种,三种或四种不同的蛋白结合。
如本文所用的,“迷你抗体(minibody)”是指由抗体片段vl-vh-ch3组成的人工抗体片段。
如本文所用的,“纳米抗体(nanobody)”是指由单一单体可变抗体区组成的骆驼科抗体片段。
如本文所用的,“原抗体(probody)”是抗原结合侧被掩蔽直到活化的人工抗体分子。
如本文所用的,“双抗体”是指具有二聚化单链可变片段的人工抗体片段。
如本文所用的,“fab”或“fab区”是指包含vl,vh,cl和ch1免疫球蛋白结构域或区域的多肽。
如本文所用的,“fc”或“fc区”或“fc片段”是指包含iga,igd和igg的最后两个恒定区免疫球蛋白结构域(ch2和ch3),和ige和igm的最后三个恒定区免疫球蛋白结构域,以及这些结构域的n-末端的柔性铰链的一部分的多肽。虽然fc区的边界可以变化,但人igg重链fc区通常定义为包含从a231开始到其羧基末端的残基,其中该编号是根据eu编号方案。
如本文所用的,“铰链”或“铰链区”是指包含抗体的第一和第二恒定结构域(ch1和ch2)之间的氨基酸的柔性多肽。为了本发明的目的,在结构上定义铰链,并且如在本文中对于igg使用的,“铰链区”包括残基216-230,其中该编号是根据eu编号方案。
如本文所用的,“igg”是指属于基本上由公认的免疫球蛋白γ基因编码的抗体类别的蛋白。在人类中,该类别包括igg1,igg2,igg3和igg4。
如本文所用的,“位置”是指蛋白序列中的定位。位置可以按顺序编号,也可以按照已建立的格式进行编号,例如kabat或eu编号方案。例如,位置297是人抗体igg1中的位置。
如本文所用的,“蛋白”是指至少两个共价连接的氨基酸,其包括蛋白,多肽,寡肽和肽。
如本文所用的,“野生型或wt”是指在自然界中发现的氨基酸序列或核苷酸序列,包括等位变异。wt蛋白具有未被有意修饰的氨基酸序列或核苷酸序列。
本公开提供了新的多特异性抗体平台,以增强两种不同修饰的哺乳动物,优选人iggfc区(即igg1、2、3、4或iga,igd,ige,igm)的异二聚化,所述修饰还可以包括其他哺乳动物抗体,例如小鼠mlgg1、migg2a、migg2b和migg3。
实际上,本发明的抗体可以靶向任何抗原。本发明的抗体变体可用于广泛的抗体产物。在一个实施方案中,本发明的抗体变体是治疗性,诊断性或研究性试剂,优选治疗剂。抗体变体可以用于单克隆或多克隆的抗体组合物中。一方面,本发明的抗体变体用于杀死携带靶抗原的靶细胞,例如癌细胞。另一方面,本发明的抗体变体用于阻断,拮抗或激动靶抗原,例如拮抗细胞因子或细胞因子受体。一方面,本发明的抗体变体用于阻断,拮抗或激动靶抗原并杀死携带靶抗原的靶细胞。本发明的抗体变体可用于各种治疗目的。各种其它治疗剂可用于与本发明的抗体变体一起施用。一方面,抗体可以与抗血管生成剂一起施用。
考虑药物组合物,其中配制本发明的抗体变体和一种或多种治疗活性剂。通过将具有所需纯度的所述抗体与任选的药学上可接受的载体、赋形剂或稳定剂混合(remington'spharmaceuticalsciences第16版,osol,a.ed.,1980),以冻干制剂或水性制剂的形式制备本发明的抗体变体的制剂用于储存。用于体内施用的制剂优选是无菌的。这通过无菌过滤膜或其它方法过滤容易地实现。本文公开的抗体和其它治疗活性剂也可以配制成免疫脂质体,和/或包埋在微胶囊中。
制剂中治疗活性抗体变体的浓度可以在约0.1至100wt%变化。一方面,抗体的浓度在0.003至1.0摩尔的范围内。为了治疗患者,可以施用本发明的抗体变体的治疗有效剂量。本文中“治疗有效剂量”是指产生其施用效果的剂量。确切的剂量将取决于治疗的目的,并且本领域技术人员将使用已知技术来确定。剂量范围可以为0.01至100mg/kg体重或更大,例如0.1、1、10或50mg/kg体重,其中优选1-10mg/kg。如本领域已知的,针对抗体降解,全身相对于局部递送,和新蛋白酶合成速率,以及年龄,体重,一般健康状况,性别,饮食,施用时间,药物相互作用和状况的严重性的调整可能是必需的,并且本领域技术人员将通过常规实验来确定。
包含本发明的抗体变体的药物组合物的施用(优选以无菌水性溶液的形式),可以以多种方式进行,包括但不限于口服,皮下,静脉内,鼻内,口腔内(intraotically)、经皮、局部(例如凝胶、药膏、乳液、乳膏等)、腹膜内,肌肉内,肺内,肠胃外,直肠或眼内。
野生型抗体fc由两个相同的铰链-ch2-ch3多肽片段组成。两个ch3结构域之间的结合相互作用导致两个多肽片段的二聚化。本发明的基本思想是增加第一ch3结构域上的正电荷分布和第二ch3结构域上的负电荷分布,从而增强ch3结构域异二聚化并提高抗体产出的纯度。为了实现这些目标,研究了几种抗体fc结晶结构中两个ch3结构域之间的结合界面。使用蛋白3d结构分析软件cn3d4.3.1分析免疫球蛋白重链二聚体结构。仔细检查了pdb数据库中的以下iggx射线晶体学结构:1l6x,1hzh,1oqx,1h3x和4hag。特别的兴趣集中在铰链区,从n390至s400和q347-e357的ch3结构域边缘界面,以及d401至l410的ch3中间界面,由于它们位于两条相同的重链之间的最接近位置。两条相同重链之间可能的相互作用的氨基酸对鉴定如下:
铰链区:
h224-h224
t225-t225
c226-c226
p227-p227
p228-p228
c229-c229
ch3边缘界面:
y391-s400
k392-d399
t393-l398
t394-v397
p395-p396
p396-p395
v397-t394
l398-t393
d399-k392
s400-y391
s354-t350
r355-y349
e356-v348
e357-q347
ch3中间界面
f405-k409
y407-y407
k409-f405
为了提供更强的离子相互作用力并增强两个不同修饰重链之间的异二聚体形成,采用氨基酸突变扫描方法步行在两个ch3结构域之间的上述界面以鉴定最佳突变组合。测试了不同数量的氨基酸突变对。除了ch3突变之外,还通过突变扫描来评估可能的铰链区突变。
简言之,将连续或分开的至少2个,优选2至6个,且最优选3至4个带正电荷的氨基酸(精氨酸,组氨酸或赖氨酸等)引入第一重链上可能的相互作用氨基酸位置。同时,将连续或分开的至少2个,优选2至6个,且最优选3至4个带负电荷的氨基酸(天冬氨酸或谷氨酸等)引入上述区域中第二重链上的可能的相互作用氨基酸位置。用于诱变的dna构建体购自invivogen(sandiego,ca)。pfuse-chig-hg1用于表达由人延伸因子1启动子驱动的ch1铰链-ch2-ch3片段,通过常规分子克隆将il-2分泌信号序列添加到chi的n末端前,使得表达产物从宿主细胞分泌。pfuse-higg1-fc2用于表达由相同启动子驱动的铰链-ch2-ch3片段。
通过使用购自agilenttechnologies的quikchange诱变试剂盒进行氨基酸诱变。所有dna诱变寡核苷酸引物均从lifetechnologies订购。产生一系列氨基酸取代组,如下所述:
铰链区:
1.链a中的铰链区域(h1):
h224e,t225p,p227g,p228e
链a具有根据seqidno:1的氨基酸序列,并由根据seqidno:2的核酸序列编码。
2.链b中的铰链区域(h2):
t225r,p227k,p228s
链b具有根据seqidno:3的氨基酸序列,并由根据seqidno:4的核酸序列编码。
ch3边缘界面:
3.链a中的边缘界面(oa):
p395k,p396k,v397k
链oa具有根据seqidno:5的氨基酸序列,并由根据seqidno:6的核酸序列编码。
4.链b中的边缘界面(ob):
t394d,p395d,p396d
链ob具有根据seqidno:7的氨基酸序列,并由根据seqidno:8的核酸序列编码。
5.链a中的边缘界面(oc):
p395k,p396k,v397c
链oc具有根据seqidno:9的氨基酸序列,并由根据seqidno:10的核酸序列编码。
6.链b中的边缘界面(od):
t394c,p395d,p396d
链od具有根据seqidno:11的氨基酸序列,并由根据seqidno:12的核酸序列编码。
7.链a中的边缘界面(og):
p395r,p396r,v397r
链og具有根据seqidno:13的氨基酸序列,并由根据seqidno:14的核酸序列编码。
8.链b中的边缘界面(oh):
t394e,p395e,p396e
链oh具有根据seqidno:15的氨基酸序列,并由根据seqidno:16的核酸序列编码。
9.链a中的边缘界面(oi):
t393k,t394k,p395k
链oi具有根据seqidno:17的氨基酸序列,并由根据seqidno:18的核酸序列编码。
10.链b中的边缘界面(oj):
p396d,v397d,l398d
链oj具有根据seqidno:19的氨基酸序列,并由根据seqidno:20的核酸序列编码。
11.链a中的边缘界面(om):
t394k,p395k,p396k
链om具有根据seqidno:21的氨基酸序列,并由根据seqidno:22的核酸序列编码。
12.链b中的边缘界面(on):
p395d,p396d,v397d
链on具有根据seqidno:23的氨基酸序列,并由根据seqidno:24的核酸序列编码。
13.链a中的边缘界面(op):
p396k,v397k,l398k
链op具有根据seqidno:25的氨基酸序列,并由根据seqidno:26的核酸序列编码。
14.链b中的边缘界面(oq):
t393d,t394d,p395d
链oq具有根据seqidno:27的氨基酸序列,并由根据seqidno:28的核酸序列编码。
15.链a中的边缘界面(os):
s354d,r355d
链os具有根据seqidno:33的氨基酸序列,并由根据seqidno:34的核酸序列编码。
16.链b中的边缘界面(ot)
v348k,y349k,t350k
链ot具有根据seqidno:35的氨基酸序列,并由根据seqidno:36的核酸序列编码。
ch3中间界面:
17.链a中的中间界面(oe):
f405e,y407e,k409e
链oe具有根据seqidno:29的氨基酸序列,并由根据seqidno:30的核酸序列编码。
18.链b中的中间界面(of):
f405k,y407k
链of具有根据seqidno:31的氨基酸序列,并由根据seqidno:32的核酸序列编码。
其他可能的突变可以从以下列表中选择:
19.链a中的边缘界面(ou):
y391k,k392,t393k
20.链b中的边缘界面(ov):
l398d,d399,s400d
21.链a中的边缘界面(ok):
k392,t393k,t394k
22.链b中的边缘界面(ol):
d399,l398d,v397d
23.链a中的边缘界面(ow):
v397k,l398k,d399k
24.链b中的边缘界面(ox):
k392d,t393d,t394d
25.链a中的边缘界面(oy):
l398k,d399k,s400k
26.链b中的边缘界面(oz):
y391d,k392d,t393d
27.链a中的边缘界面(os):
s354d,r355d
28.链b中的边缘界面(ot)
v348k,y349k,t350k
29.链a中的边缘界面(rs):
s354d,r355e
30.链b中的边缘界面(rt)
q347r,y349r,t350r
在本发明的其他方面,突变h1可以与突变oa和oc组合。突变h2可以与突变ob和od组合。在另一个实施方案中,突变oe可以与oa,ob,oc和od组合;突变of可以与oa,ob,oc和od的突变组合。也可以制备上述链的其它组合。
可以使用多种抗体作为源抗体用于构建本异二聚体分子,包括单克隆抗体,嵌合抗体,人或人源化抗体,双抗体,单链fv(scfv),仅重链抗体(例如纳米抗体),纤连蛋白结合结构域,多特异性抗体和抗体缀合物。源抗体可以来自任何同种型(例如igg,ige,igd,iga,igm和igy等)和任何亚类(例如igg1,igg2,igg3,igg4,iga1,iga2,migg2a和migg2b等)。源抗体可以识别本领域已知的各种蛋白质或非蛋白质靶标。
图2显示了评估两种修饰的重链之间异二聚体形成的实验程序的示意图。在图2中,例如,第一链是包括chi,铰链区,ch2和ch3的长链。第二链是仅包括铰链区,ch2和ch3的短链。通过氨基酸取代将第一链的ch3结构域突变,从而增加ch3结构域的正电荷。优选地,第一链包括2至6个氨基酸突变。然而,3或4个氨基酸突变提供最优选的结果。突变位点优选在从y391到s400的边缘界面(例如y391,k392,t393,t394,p395,p396,v397,l398,d399和s400),q347到e357的边缘界面(q347,v348,y349,t350,s354,r355,e356,e357)和d401到l410的中间界面(f405,y407和k409)选择。最优选的取代选自t393k,t394k,p395k,p396k,v397k,v397c,l398k,v348k,y349k和t350k。然而,也可以使用其他取代,只要通过取代组合增加ch3结构域的正电荷。在本发明中,使用eu抗体氨基酸编号系统。
如图2所示的第二链是例如仅包括铰链区,ch2和ch3的短链。第二链的ch3通过第二链中的氨基酸取代而突变,以增加ch3结构域的负电荷。优选地,第二链包括2至6个此类氨基酸突变。然而,3或4个氨基酸突变提供了最优选的结果。突变位点优选在y391至s400的边缘界面(y391,k392,t393,t394,p395,p396,v397,l398,d399和s400),q347到e357的边缘界面(q347,v348,y349,t350,s354,r355,e356,e357)以及d401至l410的中间界面(f405,y407,k409)选择。最优选的取代选自t393d,t394d,p395d,p396d,v397d,v397c,l398d,s354d和r355d。然而,也可以使用其它取代,只要通过取代组合增加ch3结构域的负电荷即可。
将突变链的互补对共转染到人胚胎肾hek293细胞中。也可以使用其他哺乳动物细胞系,例如中国仓鼠卵巢(cho)细胞和小鼠ns0细胞。作为共转染的结果,突变的长链和短链将以三种可能的方式二聚化,如图2的右侧所示。二聚体的一部分将是长链同二聚体,它们的另一部分将是长/短链异二聚体,它们的第三部分将是短链同二聚体。优选的异二聚体抗体是长/短链异二聚体。在图1中,示意性地显示了一种此类双特异性抗体结构。如图1所示的短重链包括具有增加的负电荷的突变ch3,非突变的ch2和附接到针对抗原a的单链可变片段scfv的铰链区。长重链包含突变为包括增加的正电荷的ch3结构域,非突变的ch2,附接针对抗原b的抗原结合片段fab的铰链区。图1中的图c和图d示出了衍生自图a的三特异性和四特异性抗体形式。图e和f是来自衍生自图b的三特异性和四特异性抗体形式。
长重链中增加的正电荷和短重链中增加的负电荷增加了短/长链异二聚体的产率(参见图2),这是由于两条链的ch3结构域中的负电荷和正电荷之间的更强的静电吸引力。因此,优选的异二聚体的产率更高。
在短重链ch3结构域中增加的负电荷也导致根据本发明的抗体的另一特定特征;即只有带正电的长链fc能够结合蛋白a(一种抗体纯化试剂);带负电的短链fc不与蛋白a结合。此特征现在可用于进一步纯化由共转染的hek293细胞培养物产生的异二聚体抗体。
如图2所示,所接受的抗体具有三种不同的类型;长链同二聚体,长/短链异二聚体和短链同二聚体。图8显示基于上述短/长链异二聚体的特定特征的纯化步骤的示意图。当从共转染的细胞培养物接收的抗体的产出通过蛋白a亲和柱时,短链同二聚体由于它们不再与蛋白a结合而流过柱。具有两条长链的同二聚体将强烈结合到柱中的蛋白a,而异二聚体将以较低的亲和力结合蛋白a,这是由于只有长链fc提供与蛋白a的结合的事实。通过用ph为4或更高的洗脱溶液洗脱柱,异二聚体将被洗脱出来,但是长链同二聚体由于其与柱的结合更强而不会被洗脱出来。因此,异二聚体是在该ph下洗脱的唯一物质。
因此,本发明提供了至少两个益处:首先,由于ch3结构域中负电荷和正电荷之间的吸引力较强,共转染中长链/短链异二聚体形成的产率增加;优选90-95%的二聚体是异二聚体。其次,优选的短链/长链异二聚体可以通过使用较高的ph洗脱溶液在单步骤蛋白a亲和柱中纯化。
在以上描述中,重链被描述为短链和长链,因为图1所示的示例性双特异性抗体具有短重链和长重链。然而,没有必要具有短重链和长重链。两条链可以附接到scfv抗原结合片段,或者两条链都可以具有fab抗原结合片段。在以上描述中,如图1所示的抗体是具有对两种不同蛋白的两个结合位点的双特异性抗体,但该抗体也可以是三或四特异性且具有三个或四个不同抗原的结合位点。具有不同特异性的那些结合结构域可以融合到两个二聚重链的n末端或c末端,如图1c-f所示。
根据本发明的另一方面,在重链的铰链区域中产生另外的突变。最优选地,铰链区中的突变位于位置h224,t225,p229或p228中的一个或多个氨基酸。第一重链中的至少一个铰链区突变优选选自h334e,t225p,p229g和p228g,且第二重链铰链区中的至少一个突变选自t225r,p227s和p228k。
应当理解,本文描述的抗体平台可以应用于具有fc区的任何类型的双特异性或多特异性抗体。此外,应当理解,可以根据需要选择抗原结合片段。本发明的抗体可以是抗癌症抗原抗体,它们可以对于癌症发展或侵袭性相关的非癌症蛋白是特异性的,或者它们可以对于例如病毒相关蛋白是特异性的。实际上,本发明的抗体可以靶向任何抗原,包括但不限于属于以下蛋白列表的蛋白,亚基,结构域,基序和表位:cd2;cd3,cd3e,cd4,cd11,cd11a,cd14,cd16,cd18,cd19,cd20,cd22,cd23,cd25,cd28,cd29,cd30,cd32,cd33(p67蛋白),cd38,cd40,cd40l,cd52,cd54,cd56,cd80,cd147,gd3,il-1,il-1r,il-2,il-2r,il-4,il-5,il-6,il-6r,il-8,il-12,il-15,il-18,il-23,干扰素α,干扰素β,干扰素γ;tnf-α,tnfβ,tnfα,tnfαβ,tnf-r1,tnf-rii,fasl,cd27l,cd30l,4-1bbl,trail,rankl,tweak,april,baff,light,veg1,ox40l,trail受体-1,腺苷受体,淋巴毒素β受体,taci,baff-r,epo;lfa-3,icam-1,icam-3,epcam,整联蛋白β1,整联蛋白β2,整联蛋白α4/β7,整联蛋白α2,整联蛋白α3,整联蛋白α4,整联蛋白α5,整联蛋白α6,整联蛋白αv,αvβ3整联蛋白,fgfr-3,角质形成细胞生长因子,vla-1,vla-4,l-选择素,抗id,e-选择素,hla,hla-dr,ctla-4,t细胞受体,b7-1,b7-2,vnr整联蛋白,tgfβ1,tgfβ2,嗜酸性粒细胞趋化因子1(eotaxin1),blys(b淋巴细胞刺激因子),补体c5,ige,因子vii,cd64,cbl,nca90,egfr(erbb-1),her2/neu(erbb-2),her3(erbb-3),her4(erbb4),组织因子,vegf,vegfr,内皮素受体,vla-4,半抗原np-cap或nip-cap,t细胞受体α/β,e-选择素,地高辛,胎盘碱性磷酸酶(plap)和睾丸plap样碱性磷酸酶,转铁蛋白受体,癌胚抗原(cea),ceacam5,hmfgpem,粘蛋白muc1,muc18,肝素酶i,人心脏肌球蛋白,肿瘤相关糖蛋白-72(tag-72),肿瘤相关抗原ca125,前列腺特异性膜抗原(psma),高分子量黑色素瘤相关抗原(hmw-maa),癌(carcinoma)相关抗原,gcoproteiniib/iiia(gpiib/iiia),表达lewisy相关碳水化合物的肿瘤相关抗原,人巨细胞病毒(hcmv)gh包膜糖蛋白,hivgp120,hcmv,呼吸合胞病毒rsvf,rsvffgp,vnr整联蛋白,il-8,细胞角蛋白肿瘤相关抗原,hepbgp120,cmv,gpiibiiia,hiviiibgp120v3环,呼吸道合胞病毒(rsv)fgp,单纯疱疹病毒(hsv)gd糖蛋白,hsvgb糖蛋白,hcmvgb包膜糖蛋白和产气荚膜梭菌(clostridiumperfringens)毒素。
可以选择的抗体包括但不限于针对以下抗原的抗体:psma,cd133,cd138,cd20,cd19,ox40,gitr,pd-1,pd-l1或pd-l2,ctla-4,kir,lag-3,cd3,tcrα,tcrβ,tcrγ,tcrδ,cd40,cd40l,vegf,egf,vegfr,egfr,her1,her2,her3,epcam,间皮素,glypicans,cd28,erbl,erb2,b7-h3,icos,bmp1,bmp2,bmp3b,bmp4,csf1,gm-csf,fgf1,fgf2,fgf3,fgf4,pdgfr,tigit,cs1,tweak,ccl1,ccl2,ccl3,ccl13,cxcl1,cxcl2,cxcl3,ip-10,岩藻糖基-gm1,igf1,igf2,igf1r,igf2r,cd64,cd32a,cd32b,cd16,整联蛋白,rank配体,cea,dll-4,gm-csfr,adams,肌生成抑制素,pcsk9,cxcr4,il-1α,il-1β,il-12,il-18,tnfα,il-23,il-13,mif,il-17,il-17r,il-15,il-9,il-5,il-5r,il-6,il-25,peg2等
或者,本发明的抗体可以对于病毒相关靶标是特异性的,例如hiv蛋白,hpv蛋白,cmv蛋白,流感病毒蛋白或朊病毒蛋白。
在某些方面,本发明的分子可用于诊断和治疗应用。更具体地,本发明的分子可以用于生成可以结合两种或多于两种靶抗原的双特异性或多特异性抗体,所述靶抗原选自但不限于以下靶标:il-1α,il-1β,il-12,il-18,tnfα,il-23,il-13,mif,il-17,il-17r,il-15;vegf,vegfr,egfr;il-9,il-5,il-5r,il-6,il-25,il-13,adams,peg2,her1,her2和her3。本领域技术人员将能够识别其它可能的靶标。
现在通过非限制性实施例描述本发明。
实施例1:鉴定负责免疫球蛋白fc区域中的离子相互作用的氨基酸残基
使用蛋白3d结构分析软件cn3d4.3.1分析免疫球蛋白重链二聚体结构。仔细检查了pdb数据库中的以下iggx射线晶体学结构:1l6x,1hzh,10qx,1h3x和4hag。由于两条相同重链之间的紧密接近性,特别关注的是铰链区,从n390到s400的ch3结构域边缘界面和d401到l410的ch3中间界面。两条相同重链之间可能的相互作用氨基酸残基对如下:
铰链区:
h224-h224
t225-t225
c226-c226
p227-p227
p228-p228
c229-c229
ch3边缘界面:
y391-s400
k392-d399
t393-l398
t394-v397
p395-p396
p396-p395
v397-t394
l398-t393
d399-k392
s400-y391
s354-t350
r355-t349
e356-v348
e357-q347
ch3中间界面:
f405-k409
y407-y407
k409-f405
eu抗体氨基酸编号系统在本发明中用于氨基酸编号。
实施例2:修饰重链中的氨基酸以促进异二聚体形成
为了提供适合的离子相互作用力并增强两个不同修饰的重链之间的异二聚体形成,向第一重链上可能的相互作用氨基酸位置(连续的或分开的)引入至少2个,优选2至6个,且最优选3至4个带正电荷的氨基酸(精氨酸或赖氨酸等)。同时,向在如上所述的区域中在第二重链上可能的相互作用氨基酸位置引入(连续的或分开的)至少2个,优选2至6个,且最优选3至4个带负电荷的氨基酸(天冬氨酸或谷氨酸等)。用于诱变的载体构建体购自invivogen(sandiego,ca):pfuse-chig-hg1用于表达由人延伸因子1启动子驱动的ch1-铰链-ch2-ch3片段,通过常规分子克隆在chi的n末端前加入il-2分泌信号序列,使表达产物从宿主细胞分泌。pfuse-higg1-fc2用于表达由相同启动子驱动的铰链-ch2-ch3片段。
通过使用从agilenttechnologies购买的quickchange诱变试剂盒进行氨基酸诱变。所有dna诱变寡核苷酸引物均从lifetechnologies订购。利用氨基酸突变扫描方法步行重链铰链区,ch3边缘界面和中间界面,以鉴定产生高纯度异二聚体的最佳突变体组合。一系列氨基酸取代组列举如下:
铰链区:
1.链a中的铰链区(h1,负电荷):
h224e,t225p,p227g,p228e
2.链b中的铰链区(h2,正电荷):
t225r,p227k,p228s
ch3边缘界面:
3.链a中的边缘界面(oa,正电荷):
p395k,p396k,v397k
4.链b中的边缘界面(ob,负电荷):
t394d,p395d,p396d
5.链a中的边缘界面(oc,正电荷和二硫键形成):
p395k,p396k,v397c
6.链b中的边缘界面(od,负电荷和二硫键形成):
t394c,p395d,p396d
7.链a中的边缘界面(og,正电荷):
p395r,p396r,v397r
8.链b中的边缘界面(oh,负电荷):
t394e,p395e,p396e
9.链a中的边缘界面(oi,正电荷):
t393k,t394k,p395k
10.链b中的边缘界面(oj,负电荷):
p396d,v397d,l398d
11.链a中的边缘界面(om,正电荷):
t394k,p395k,p396k
12.链b中的边缘界面(on,负电荷):
p395d,p396d,v397d
13.链a中的边缘界面(op,正电荷):
p396k,v397k,l398k
14.链b中的边缘界面(oq,负电荷):
t393d,t394d,p395d
15.链a中的边缘界面(os,负电荷):
s354d,r355d
16.链b中的边缘界面(ot,正电荷)
v348k,y349k,t350k
ch3中间界面:
17.链a中的中间界面(oe,负电荷):
f405e,y407e,k409e
18.链b中的中间界面(of,正电荷):
f405k,y407k
突变hi也可以与突变oa或oc组合。突变h2可以与突变ob或od组合。那些组合突变不仅产生足够量的结合蛋白a的蛋白,而且还有利于异二聚体形成。然而,在最终产物中呈现显著量的单链单体,其可能再需要至少一个纯化步骤以除去。
突变oe可以与oa,ob,oc和od组合;突变of可以与oa,ob,oc和od的突变组合。然而,那些组合突变不能产生足够量的结合蛋白a的蛋白。
实施例3:hek293细胞的共转染和蛋白产物分析
用于评估异二聚体形成效果的实验程序如图2中所示。引入带正电荷的氨基酸的突变的多肽链a(通常为图中的长链)和引入带负电荷的氨基酸的突变的多肽链b(通常为图中的短链)使用lifetechnologies的293fectin转染试剂单独或彼此一起转染入hek293细胞。各种带正电荷和负电荷多肽链组合在hek293细胞中共表达。在本发明中,带正电荷的多肽链和带负电荷的多肽链之间的优选比率为1:1,但也可使用其它比率。转染后3天,通过离心收获细胞培养物上清液,并将其进行蛋白a磁珠(pierce)下拉。磁珠上结合的蛋白产物基于其在sds-page凝胶电泳上的迁移率来表征。收集的具有结合的蛋白的蛋白a磁珠在30μlpbs缓冲液中重悬,与30μlsds加载缓冲液混合并煮沸5分钟。将一半体积的煮沸样品加载到10%sds-page上以分离长链同二聚体,长链和短链异二聚体和短链同二聚体。一些代表性的异二聚体形成结果如图3、4、5、6和7所示。
图3显示了加载以下样品的sds-page凝胶:m:标记物;泳道1:wt长链;泳道2:wt短链;泳道3:wt长链和wt短链的共转染。注意除了中间的异二聚体带外,还有大量的长链同二聚体(上)和短链同二聚体(底部);泳道4:oe突变链;泳道5:of突变链;泳道6:oe和of链的共转染;泳道7:oa突变链;泳道8:ob突变链;泳道9:oa和ob链的共转染。在图的左手侧,示出了对应于每个蛋白带的结构。泳道3、6和9中明确存在长链/短链异二聚体。泳道3还显示出显著量的长链同二聚体和短链同二聚体。类似地,泳道6除了异二聚体带之外还显示出两种同二聚体,但是以比泳道3更少的量。泳道9基本上没有(cleanfrom)两种同二聚体,并且主要显示出异二聚体。基于该结果,似乎oa链和ob链的共表达产生了高产率的短/长链异二聚体抗体。oa链中的突变如下:p395k,p396k和v397k。ob链中的突变为t394d,p395d和p396d。第二好的组合似乎是oe和of的共表达。oe中的突变如下:f405e,y407e和k409e。of中的突变如下:f405k,y407k。
本实施例的一个重要方面是突变oe/of和突变oa/ob异二聚体的产物产率与野生型异二聚体的产物产率相当。这表明那些突变不会损害在常见的哺乳动物细胞表达系统中的蛋白表达水平,其对于大规模制造多特异性抗体至关重要。
本实施例的另一个重要方面是突变ob已经失去了几乎所有与蛋白a的结合活性,如泳道8所示。然而,其仍然能够与突变a形成异二聚体。在异二聚体重链中不常见的是,突变的fc链之一可以失去其与蛋白a的结合活性,但只要第二链仍然能结合蛋白a,可以形成蛋白a结合的异二聚体(jhdavisetal,proteinengineering,design&selection,2010,23:4,195-202)。如图8中所讨论的,这种特定特征成为异二聚体抗体纯化中的技术优势。
图4显示了装载以下样品的sds-page凝胶:泳道1:oa链;泳道2:ob链;泳道3:oa链和ob链的共转染;泳道4:oc链,泳道5:od链;泳道6:oc链和od链的共转染。在图的左手侧,示出了对应于每个蛋白带的结构。来自泳道1至3的数据显示与图3中的泳道7至9相似的结果,表明那些结果是可重现的。oc链中的突变如下:p395k,p396k和v397c。od链中的突变为t394c,p395d和p396d。替代使得长链中的三个带正电荷的氨基酸与短链中的三个带负电荷的氨基酸配对,向两条链中引入两个半胱氨酸,以允许在v397c和t394c之间的链间二硫键形成,其推测将增强异二聚体形成。然而,oc链和od链在hek293细胞中的共表达产生两个异二聚体带,如泳道6所示。这表明二硫键形成不完全,其增加了产物的异质性。根据一些出版物,较低中间带中的具有另外的二硫键的异二聚体通常比上方的中间带中的正常异二聚体迁移更快(a.m.merchantelal.,naturebiotechnology,1998:16)。另外,长链同二聚体清楚地存在于该组合中。
图5显示了加载有以下蛋白的sds-page凝胶:泳道m:标记物;泳道1:oa链;泳道2:ob链;泳道3:oc链;泳道4:od链;泳道5:oa链和od链的共转染;泳道6:空;泳道7:oc链和ob链的共转染。在图的左手侧,示出了对应于每个蛋白带的结构。泳道5和7显示了主要的短/长链异二聚体抗体。这两条泳道也显示了微量(trace)的同二聚体。基于该结果,似乎oa链和od链的共转染以及oc链和ob链的共转染产生相对较高产率的异二聚体链。oa链中的突变如下:p395k,p395k和v397k。od链中的突变为t394c,p395d和p396d。oc链中的突变为p395k,p396k,c397c且ob链中的突变为:t394d,p395d和p396d。
图6显示了加载以下样品的sds-page凝胶:泳道1至3:oa链和ob链的三次独立共转染;泳道4:空;泳道5:wt长链和短链的共转染作为对照。泳道1至3显示基本上纯的长/短链异二聚体抗体,表明oa和ob异二聚体的高纯度产生是一致的。
图7是以下样品的sds-page凝胶分析:泳道1:og链和oh链的共转染;泳道2:空;泳道3:oi链和oj链的共转染;泳道4:空;泳道5:om链和on链的共转染。每条链中的氨基酸突变在实施例2中公开。除了中间的异二聚体带之外,所有三种组合都具有至少一个同二聚体带。泳道1和3具有长链同二聚体带(顶部),而泳道5具有短链同二聚体带(底部)。这表明需要调整长链和短链之间的比率(需要不同于1:1的比例,如1:2或2:1),以使异二聚体带的产率最大化。泳道1中需要更多的oh,泳道3中需要更多的oj,而泳道5中需要更多的om。
实施例4:单步骤纯化提供高度纯化的抗体
图8说明了抗体的单步骤纯化的原理。含有fc的异二聚体双特异性或多特异性抗体的纯化可以通过使用本领域已知的方法来完成。为了在蛋白纯化过程之后实现高纯度的双特异性或多特异性抗体产物,几种已知技术已有意将氨基酸突变(例如,h435r或y436f)引入fc异二聚体中的两条链之一以减少或消除其与蛋白a的结合活性。那些方法描述于us2014/0348839(medlmmune),wo2010/151792,us20140248664(regeneron),pegs2015gbr1302海报(glenmark)中。异二聚体fc中的此类修饰使得fc异二聚体中仅剩下一条链结合蛋白a。作为结果,与野生型同二聚体相比,此类异二聚体具有与蛋白a的较弱的结合,因此可以在较高的ph(ph4.0和5.0之间)洗脱,而正常的fc同二聚体仅能在ph2.8至ph3.0洗脱。
在本发明中,将突变体oa和ob共转染到hek293细胞中可以产生高产率的异二聚体(高于95%),如图3,4和6所示。相应的,突变体oa保留了其蛋白a结合活性(如在图3泳道7;图4泳道1和图5泳道1中所示),而突变体ob几乎失去其全部蛋白a结合(如图3泳道8;图4泳道2和图5泳道2所示)。因此,上述纯化方法可以容易地应用于oa/ob异二聚体纯化。oa/ob异二聚体纯化策略如图8所示。
在一个实施方案中,收获oa和ob共转染的细胞培养上清液并将其应用于蛋白a柱。因为ob失去了蛋白a的结合活性,其同二聚体(如果有的话)将通过柱子或通过洗涤步骤被洗涤掉。仅oa/ob异二聚体在ph4.2(20mm柠檬酸钠,1mnacl,ph4.2)从柱上洗脱。在该ph下,oa同二聚体将保留在柱上。使用该单一纯化步骤,oa/ob异二聚体可纯化至高纯度。
oa和ob异二聚体纯化特性如图9所示。将oa和ob共转染样品加载到蛋白a柱中。洗涤后,异二聚体产物在ph4.0下洗脱,然后在ph2.8下洗脱。泳道2至6为ph4.0洗脱级分,泳道7至10为ph2.8洗脱级分。如泳道4和5所示,oa和ob异二聚体可以在ph4.0下洗脱。
为了证明oa和ob异二聚体促进双特异性抗体形成,使用标准分子克隆方法将衍生自赫赛汀vl和vh的抗her2scfv与ob片段以符合读码框的方式融合,以生成抗her2-ob。另外,使用标准分子克隆方法将衍生自两种不同的抗cd3鼠抗体vl和vh的两种抗cd3scfv与oafc片段(无chi区)以符合读码框的方式融合,以生成抗cd3.1-oa和抗cd3.2-oa。通过使用来自lifetechnologies的293fectin将抗-he2-ob与抗cd3.1-oa或抗cd3.2-oa共转染到hek293细胞中生成两种双特异性抗体。纯化的双特异性抗体产物如图10所示。泳道1是分子标记物;泳道2至6是第一双特异性抗体产物her2xcd3.1(抗her2和抗cd3.1的异二聚体)的洗脱级分。泳道7至10是第二双特异性抗体产物her2xcd3.2(抗her2和抗cd3.2的异二聚体)的洗脱级分。
为了确认那些双特异性抗体的双重特异性结合活性,进行了双重特异性结合elisa测定。用2μg/ml的人cd3包被elisa板,并用1%bsa封闭剂封闭。将双特异性抗体样品和对照样品加入板中并在室温下孵育1小时。洗涤后,将her2抗原(2ng/ml)加入板中并孵育2小时。之后,使用thermoscientific的humanerbb2(her2)elisa试剂盒进行标准抗her2elisa。elisa结果如图11所示。tbs和pbs是缓冲液对照。抗her2是与oa片段融合的衍生自赫赛汀的scfv。抗cd3.1和抗cd3.2是与oa片段融合的衍生自两种不同的cd3抗体的两种scfv。her2xcd3.1是抗her2-ob和抗cd3.1-oa异二聚体。her2xcd3.2是抗her2-ob和抗cd3.2-oa异二聚体。结果表明只有两种双特异性抗体显示双重特异性结合活性。其他单一特异性试剂未能显示任何双重特异性结合活性。
虽然已经以某种程度的特殊性描述了本发明,但是应当理解,本公开仅通过说明的方式进行,并且可以在不偏离本发明的精神和范围的情况下进行部分的构造和布置的细节的许多变化。
随附的序列表
seqidno1
类型:蛋白(h1)
生物体:人工序列
serasplysthrgluprocysglyglucysproalapro
seqidno2
类型:dna
生物体:人工序列
5'-tctgacaaaactgaaccctgcggagaatgcccagcacct-3'
seqidno3
类型:蛋白(h2)
生物体:人工序列
asplysthrhisargcyslyssercysproalapro
seqidno4
类型:dna
生物体:人工序列
5'-gacaaaactcaccgatgcaaatcctgcccagcacct-3'
seqidno5
类型:蛋白(oa)
生物体:人工序列
tyrlysthrthrlyslyslysleuaspserasp
seqidno6
类型:dna
生物体:人工序列
5'-tacaagaccacgaagaagaagctggactccgac-3'
seqidno7
类型:蛋白(ob)
生物体:人工序列
tyrlysthraspaspaspvalleuaspserasp
seqidno8
类型:dna
生物体:人工序列
5'-tacaagaccgatgacgatgtgctggactccgac-3'
seqidno9
类型:蛋白(oc)
生物体:人工序列
tyrlysthrthrlyslyscysleuaspserasp
seqidno10
类型:dna
生物体:人工序列
5'-tacaagaccacgaagaagtgcctggactccgac-3'
seqidno11
类型:蛋白(od)
生物体:人工序列
tyrlysthrcysaspaspvalleuaspserasp
seqidno12
类型:dna
生物体:人工序列
5'-tacaagacctgcgacgatgtgctggactccgac-3'
seqidno13
类型:蛋白(og)
生物体:人工序列
tyrlysthrthrargargargleuaspserasp
seqidno14
类型:dna
生物体:人工序列
5'-tacaagaccacgagacgaaggctggactccgac-3'
seqidno15
类型:蛋白(oh)
生物体:人工序列
asntyrlysthrgluglugluvalleuaspser
seqidno16
类型:dna
生物体:人工序列
5'-aactacaagaccgaagaggaagtgctggactcc-3'
seqidno17
类型:蛋白(oi)
生物体:人工序列
asnasntyrlyslyslyslysprovalleuasp
seqidno18
类型:dna
生物体:人工序列
5'-aacaactacaagaagaagaagcccgtgctggac-3'
seqidno19
类型:蛋白(oj)
生物体:人工序列
lysthrthrproaspaspaspaspseraspgly
seqidno20
类型:dna
生物体:人工序列
5'-aagaccacgcctgacgatgacgactccgacggc-3'
seqidno21
类型:蛋白(om)
生物体:人工序列
asntyrlysthrlyslyslysvalleuasps
seqidno22
类型:dna
生物体:人工序列
5'-acctacaagaccaagaaaaaggtgctggactcc-3'
seqidno23
类型:蛋白(on)
生物体:人工序列
tyrlysthrthraspaspaspleuaspserasp
seqidno24
类型:dna
生物体:人工序列
5'-tacaagaccacggatgacgacctggactccgac-3'
seqidno25
类型:蛋白(op)
生物体:人工序列
lysthrthrprolyslyslysaspseraspgly
seqidno26
类型:dna
生物体:人工序列
5'-aagaccacgcctaagaaaaaggactccgacggc-3'
seqidno27
类型:蛋白(oq)
生物体:人工序列
asnasntyrlysaspaspaspprovalleuasp
seqidno28
类型:dna
生物体:人工序列
5'-aacaactacaaggacgacgaccccgtgctggac-3'
seqidno29(epc)
类型:蛋白
生物体:人工序列
aspglyserphegluleuglusergluleuthrvalasp
seqidno30
类型:dna
生物体:人工序列
5'-gacggctccttcgaactcgaaagcgaactcaccgtggac-3'
seqidno31(fpc)
类型:蛋白
生物体:人工序列
aspglyserphelysleulysserlysleuthr
seqidno32
类型:dna
生物体:人工序列
5'-gacggctccttcaaactcaagagcaagctcacc-3'
seqidno33(os)
类型:蛋白
生物体:人工序列
thrleuproproaspaspgluglumetthr
seqidno34(os)
类型:dna
生物体:人工序列
5'-accctgcccccagacgatgaggagatgacc-3'
seqidno35(ot)
类型:蛋白
生物体:人工序列
arggluproginlyslyslysleuproproser
seqidno36(ot)
类型:dna
生物体:人工序列
5'-cgagaaccacagaagaagaagctgcccccatcc-3'
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺