具有抗炎特性的肽的制作方法
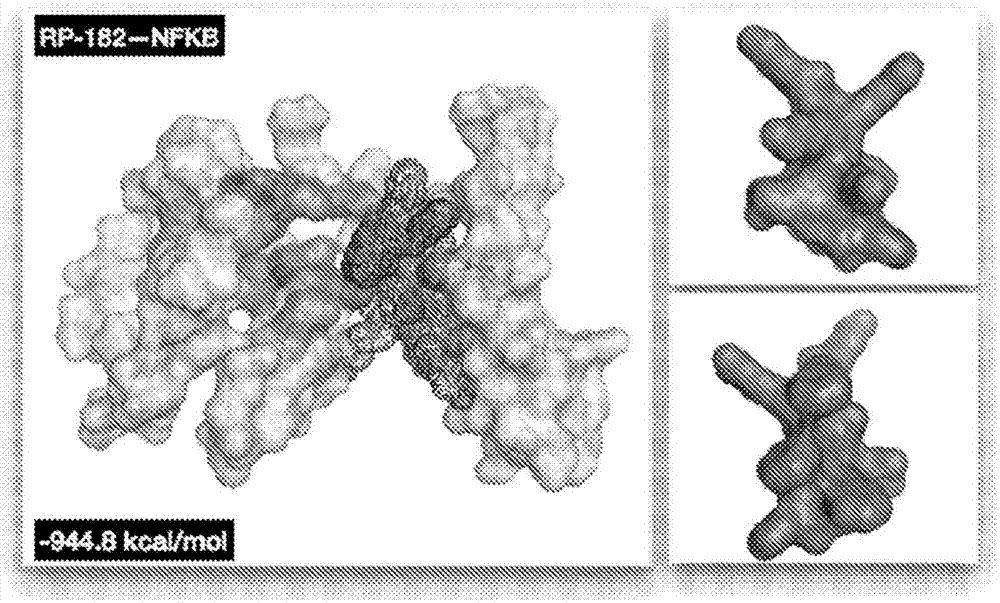
相关申请的交叉引用根据35u.s.c.§119(e),本申请要求2014年10月14日提交的美国临时专利申请序列号62/063,909的优先权益,所述申请的公开内容特此以引用的方式整体并入本文。本发明的方面涉及具有抗炎活性的肽、含有一种或多种所述肽的组合物以及所述肽治疗与动物特别是人和其他哺乳动物中的过度炎症相关的病状的用途。
背景技术:
:在正常条件下,炎症为帮助动物从损伤中恢复的过程。急性炎症为组织对有害刺激物的初始响应。它涉及一种复杂的高度调节的过程,所述过程当受损组织中存在的细胞(包括巨噬细胞、树突细胞、组织细胞、枯否细胞以及肥大细胞)感测与损伤相关的分子并且变得激活时开始。在激活时,这些细胞释放炎症介质,诸如血管扩张剂。血管扩张剂诱导在损伤附近的血流和血管渗透性增加。这进而诱导血浆和白细胞(包括嗜中性粒细胞和巨噬细胞)从血液到受损组织的移动增加。因此炎症介质通常快速降解,所以急性炎症需要不断刺激来持续。因此,一旦有害刺激被去除,急性炎症就结束。各种刺激试剂(包括但不限于细菌、病毒、物理损伤、化学损伤、癌症、化学疗法以及辐射疗法)根据特定试剂和暴露于所述试剂的动物的遗传组成可以引起延长的且过量的炎症。据信此炎症(称为慢性炎症)为许多普遍且导致虚弱的疾病的贡献因素,所述疾病包括心脏病、癌、呼吸道疾病、中风、神经病诸如阿尔兹海默病、糖尿病以及肾病。慢性炎症的结果为正常组织破坏以及其被富含胶原的结缔组织替换。富含胶原的结缔组织也称为瘢痕组织,其展现出与正常组织相比减少的组织功能。持续且延长的瘢痕组织形成进而导致纤维化。纤维化为影响肺部、皮肤、肝脏、心脏和骨髓的疾病的常见症状,并且为诸如特发性肺纤维化、硬皮病、瘢痕瘤、肝硬化、心肌纤维化、糖尿病肾病、脊髓发育不良综合征以及其他病症等疾病的关键性因素。慢性炎症和纤维化的研究已指示不管活化剂和受影响组织如何,信号蛋白的常见网络倾向于一起起作用,以建立促炎状态。信号蛋白的此网络包括许多不同的细胞因子、细胞因子受体、转录因子和微rna,包括tgfβ、tgfβrii和mirna19b。尽管关于涉及过量炎症的病状(诸如慢性炎症和纤维化)的知识逐渐增长,但是此类病状的治疗仍然不清楚。许多药物和其他物质已显示具有体内或体外的抗炎活性,但是对于由炎症引起或加重的许多并发症而言,仍不存在疗法。另外,许多抗炎疗法与有害的副作用相关。因此,仍急需鉴别减少炎症而无有害副作用的治疗剂。技术实现要素:本发明部分基于具有强烈的体外和体内抗炎活性的新型肽的发现。本发明还部分基于以下发现:本发明的肽特异性结合一种或多种信号蛋白上的关键性功能区域,所述信号蛋白特别是促炎性细胞因子、巨噬细胞抑制蛋白和组蛋白调节蛋白。本发明还部分基于以下发现:本发明的肽在循环中足够稳定,以允许静脉内施用。因此,在一方面,本发明提供一种包含抗炎性多肽的组合物。在某些实施方案中,抗炎性多肽的长度为3至24个氨基酸残基并且包含由交替的疏水性模块和亲水性模块组成的条带性亲疏(striapathic)区域。在某些实施方案中,每个亲水性模块由一个或多个(例如,1-5、1-4、1-3)亲水性氨基酸残基的序列组成。在某些实施方案中,每个疏水性模块由一个或多个(例如,1-5、1-4、1-3)疏水性氨基酸残基的序列组成。在某些实施方案中,抗炎性多肽的条带性亲疏区域包含m个亲水性模块和n个疏水性模块,其中m和n为正整数。例如,在某些实施方案中,条带性亲疏区域包含两个亲水性模块和两个疏水性模块(2:2)、两个亲水性模块和三个疏水性模块(2:3)、三个亲水性模块和两个疏水性模块(3:2)、三个亲水性模块和三个疏水性模块(3:3)、三个亲水性模块和四个疏水性模块(3:4)或者四个亲水性模块和三个疏水性模块(4:3)。在某些实施方案中,抗炎性多肽的条带性亲疏区域的长度为至少5、6、7、8、9或10个氨基酸残基。在优选的实施方案中,条带性亲疏区域的长度为7与12个之间的氨基酸残基。在某些实施方案中,条带性亲疏区域构成多肽长度的至少25%。例如,在某些实施方案中,条带性亲疏区域构成多肽长度的至少30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%或100%。在某些实施方案中,抗炎性多肽的条带性亲疏区域采用螺旋二级结构。螺旋二级结构的实例包括310-螺旋、α-螺旋、π-螺旋以及多脯氨酸螺旋。在其他实施方案中,抗炎性多肽的条带性亲疏区域采用β-链二级结构。在优选的实施方案中,抗炎性多肽的条带性亲疏区域具有两亲性构象。在某些实施方案中,抗炎性多肽包含具有与本文所公开的结构式中任一种(例如,式i-liii中任一种)相符的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成。在某些实施方案中,抗炎性多肽为表3-9中列出的多肽之一。在其他实施方案中,抗炎性多肽与表3-9中公开的多肽中的任一种具有至少70%、80%或90%同源性。在某些实施方案中,抗炎性多肽结合至少一种信号蛋白。在优选的实施方案中,抗炎性多肽以足够的亲和力体外和/或体内结合至少一种信号蛋白,以调节信号蛋白的活性。抗炎性多肽所结合的信号蛋白的实例包括用作促炎性细胞因子的蛋白质、抑制巨噬细胞活性的蛋白质或者调节组蛋白功能的蛋白质。在某些实施方案中,抗炎性多肽结合选自由以下组成的组的蛋白质靶标:nfkbii类蛋白(例如,rela、relb、crel、nf-kb1和nf-kb2)、tgfβ、notch受体(例如,notch1)、wnt受体(例如,wnt8r)、trail、egfr、白介素受体(例如,il6r、il10r)、周期素依赖性激酶(例如,cdk6)、cd47、sirp-α、转谷氨酰胺酶(例如,tgm2)、legumain、cd209、fas、程序性细胞死亡蛋白1(pd-1/cd279)、促分裂原活化蛋白激酶激酶7(mkk7)、核糖核苷酸还原酶(rnr)以及组蛋白甲基转移酶。在优选的实施方案中,抗炎性多肽结合两个、三个、四个或更多个此类信号蛋白。例如,在某些实施方案中,抗炎性多肽结合nf-kbii类蛋白(例如,relb)和用作促炎性细胞因子、巨噬细胞活性抑制剂或组蛋白功能调节剂的至少一种其他信号蛋白。在优选的实施方案中,抗炎性多肽以与每个靶标足够的结合亲和力结合nf-kbii类蛋白和至少一种其他蛋白靶标,以调节两种靶标的体内活性。在优选的实施方案中,抗炎性多肽结合nfkbii类蛋白(例如,relb)的二聚位点。在某些实施方案中,抗炎性多肽结合血液中的载体蛋白(例如,血清白蛋白)。在某些实施方案中,抗炎性多肽被修饰为包含例如接头、碳水化合物、脂质或聚合物(例如,peg)。在某些实施方案中,第一抗炎性多肽连接至第二抗炎性多肽,以便形成多聚物,诸如二聚物。在某些实施例中,二聚物为同源二聚物。在其他实施例中,二聚物为异源二聚物。在某些实施方案中,接头为肽接头。在优选的实施方案中,肽接头与第一抗炎性多肽的c-末端形成肽键并且与第二抗炎性多肽的n-末端形成肽键。在某些实施方案中,接头为可生物降解接头。在某些实施方案中,接头为二硫键。在某些实施方案中,二硫键通过一对半胱氨酸残基(例如,来自所连接的每个多肽的一个半胱氨酸残基)形成。在某些实施方案中,抗炎性多肽连接至除另一个抗炎性多肽之外的分子。例如,抗炎性多肽可以连接至标签或化学治疗剂。在某些实施方案中,接头为可生物降解接头。在某些实施方案中,接头为二硫键(例如,涉及位于抗炎性多肽的c-末端或n-末端出的半胱氨酸残基的巯基)。在另一方面,本发明提供包含抗炎性多肽和药学上可接受的载体的药物组合物。在某些实施方案中,药物组合物包含单一类型的抗炎性多肽。在其他实施方案中,药物组合物包含两种或更多种抗炎性多肽的组合。在优选的实施方案中,药物组合物基本上不含血液中可见的血蛋白和/或代谢物。在其他实施方案中,药物组合物包含血清白蛋白(例如,人血清白蛋白)。在优选的实施方案中,药物组合物中存在的任何血清白蛋白重组产生和/或基本上不含血液中可见的其他血蛋白和/或代谢物。在某些实施方案中,药物组合物包含1mg至1000mg(例如,10至400mg、20至300mg或约25至250mg)的抗炎性多肽。在另一方面,本发明提供了通过向受试者施用包含抗炎性多肽的组合物(例如,药物组合物)来治疗受试者的方法。在某些实施方案中,受试者为动物,诸如哺乳动物(例如,人)。在某些实施方案中,受试者具有提高的水平的炎性细胞因子,正在罹患慢性炎症病状,或者可能发展慢性炎症病状。在某些实施方案中,慢性炎症病状可以是易激性肠病、溃疡性结肠炎、结肠炎、克罗恩病、纤维化、特发性肺纤维化、哮喘、角膜炎、关节炎、骨关节炎、类风湿性关节炎、自身免疫病、猫或人免疫缺陷病毒(fiv或hiv)感染或癌症。在某些实施方案中,癌症为结肠癌、乳腺癌、白血病、淋巴瘤、卵巢癌、前列腺癌、肝癌、肺癌、睾丸癌、宫颈癌、膀胱癌、子宫内膜癌、肾癌、黑素瘤或者甲状腺癌或脑癌。在某些实施方案中,组合物与化学治疗剂、免疫治疗剂和/或放射性疗法组合施用。本发明的组合物和方法的这些和其他特征和优点将在以下描述中和所附权利要求书中列出或者在所述描述和权利要求书中将变得更清楚。例如,适合的抗炎性多肽可通过使用本文所述的结构算法来鉴别。另外,所述组合物和方法的特征和优点可通过实践所述方法来获知或者将从描述中显而易见的。附图说明图1描绘了nf-kbii类蛋白人relb的结构模型。图2描绘了rp-182所结合的人relb的结构模型。图3描绘了rp-166所结合的人relb的结构模型。图4描绘了rp-113所结合的人relb的结构模型。图5描绘了rp-387所结合的人relb的结构模型。图6描绘了rp-289所结合的人relb的结构模型。图7描绘了nf-contr2所结合的人relb的结构模型。图8描绘了nf-contr3所结合的人relb的结构模型。图9描绘了多肽rp-182、rp-166、rp-113和rp-289的结构模型,其中每个模型显示极性面部弧度和非极性面部弧度与多肽所形成的螺旋相关。图10描绘了多肽rp-387、nf-contr2和nf-contr3的结构模型,其中每个模型显示极性和非极性氨基酸残基。还示出与rp-387形成的螺旋相关的面部弧度。图11描绘了relb二聚结构域的结合袋的结构模型。图12描绘了rp-183所结合的relb二聚结构域的结合袋的结构模型。图13描绘了rp-182所结合的组蛋白甲基转移酶的结构模型。图14描绘了cd47二聚物(左图)和rp-183所结合的cd47二聚物的结构模型。图15描绘了sirp-α二聚物(左图)和rp-183所结合的sirp-α二聚物的结构模型。图16描绘了cd206(左侧)和rp-182所结合的cd206(右侧)的结构模型。图17描绘了tgm2(左侧)和rp-182所结合的tgm2(右侧)的结构模型。图18描绘了rp-183所结合的人血清白蛋白的结构模型。图19示出了pd-1-染色的肿瘤细胞,所述肿瘤细胞来自仅用媒介物处理(左图)或用rp-182处理(右图)的p53/kras小鼠。pd-1表达在rp-182处理的小鼠中有所减少。图20示出pd-l1-染色的(左图)和pd-l2-染色(右图)肿瘤细胞,其来自仅用媒介物处理(在每个集合中的顶图)或用rp-182(在每个集合中的底图)处理的p53/kras小鼠。pd-l1和pd-l2表达在rp-182处理的小鼠中有所减少。图21示出了四个小鼠组中随着时间的mda-mb-231肿瘤体积。组1:媒介物;组2:吉西他滨处理的;组3:rp-182处理的;组4:rp-182+吉西他滨处理的。图22示出了四个小鼠组中随着时间的c42b肿瘤体积。组1:媒介物;组2:多西他赛处理的;组3:rp-182处理的;组4:rp-182+多西他赛处理的。具体实施方式以下描述提供了具体细节,以便提供本发明的充分理解。也就是说,为了避免模糊所述抗炎性多肽和治疗受试者的相关方法的方面,未详细示出或描述已熟知的结构、材料、过程、技术和操作。另外,技术人员将理解的是,所述抗炎性多肽和治疗受试者的相关方法可以实施和使用而无需采用这些具体细节。实际上,所述抗炎性多肽和方法可以通过改变所说明的多肽、组合物和方法来实施,并且可以与工业中常规使用的其他治疗、装置和技术结合使用。如以上所讨论的,本文所公开的发明涉及免疫调节多肽,特别是具有免疫抑制特性的肽,以及向受试者(特别是罹患与持续性炎症相关的医学病状或处于发展此医学病状的危险下的受试者)施用此类免疫调节多肽的方法。本发明提供了满足以下所述结构算法的要求的抗炎性多肽,有时称为“rp肽”。本发明还提供与本文所公开的示例性rp肽中任一种共享最小的同源程度的抗炎性多肽。因此,本发明的肽或多肽为满足以下所述的结构算法或者与本文所公开的示例性rp肽中任一种(例如,在表3-9中)共享最小的同源程度的抗炎性多肽。术语“肽”和“多肽”在本文中同义使用,是指由氨基酸残基构成的聚合物。如本文所用的术语“氨基酸残基”是指任何天然存在的氨基酸(l或d形式)、非天然存在的氨基酸或氨基酸模拟物(诸如类肽单体)。多肽的“长度”为端对端连接的构成多肽的氨基酸残基的数目,排除任何非肽接头和/或多肽可含有的修饰。如本文所用的术语“条带性亲疏区域”是指疏水性模块和亲水性模块的交替序列。“疏水性模块”由肽序列构成,所述肽序列由一个至五个疏水性氨基酸残基组成。同样,亲水性模块由肽序列构成,所述肽序列由一个至五个亲水性氨基酸残基组成。疏水性氨基酸残基的特征在于主要具有非极性化学特性的官能团(“侧链”)。此类疏水性氨基酸残基可以是天然存在的(l或d形式)或非天然存在的。可选地,疏水性氨基酸残基可以是特征在于主要具有非极性化学特性的官能团(“侧链”)的氨基酸模拟物。相反,亲水性氨基酸残基的特征在于主要具有极性(带电荷或不带电荷)化学特性的官能团(“侧链”)。此类亲水性氨基酸残基可以是天然存在的(l或d形式)或非天然存在的。可选地,亲水性氨基酸残基可以是特征在于主要具有极性(带电荷或不带电荷)化学特性的官能团(“侧链”)的氨基酸模拟物。以下表1示出了亲水性氨基酸残基和疏水性氨基酸残基的实例。本领域已知适合的非天然存在的氨基酸残基和氨基酸模拟物。参见,例如,liang等,(2013),“anindexforcharacterizationofnaturalandnon-naturalaminoacidsforpeptidomimetics,”plosone8(7):e67844。尽管大部分氨基酸残基可以被视为疏水性或亲水性的,但是根据其背景,少数氨基酸残基可以表现为疏水性或亲水性的。例如,由于其相对弱的非极性特征,甘氨酸、脯氨酸和/或半胱氨酸有时可以充当亲水性氨基酸残基。相反,由于其大的稍微疏水性的侧链,组氨酸和精氨酸有时可以充当疏水性氨基酸残基。表1:疏水性氨基酸残基和亲水性氨基酸残基亲水性残基(x)疏水性残基(y)精氨酸色氨酸组氨酸苯丙氨酸赖氨酸酪氨酸天冬氨酸异亮氨酸谷氨酸亮氨酸天冬酰胺缬氨酸谷氨酰胺蛋氨酸吡咯赖氨酸半胱氨酸苏氨酸丝氨酸丙氨酸脯氨酸甘氨酸硒代半胱氨酸n-甲酰蛋氨酸正亮氨酸正缬氨酸如本文所用的术语“抗炎特性”是指可以多肽可以在计算机中、在体外和/或体内评价的任何特性,所述特性减少或抑制或者预期减少或抑制由蛋白质靶标介导的促炎信号和/或减少或抑制受试者中的炎症。结构算法在其最基本形式中,结构算法需要抗炎性肽具有以下特征:3至24个氨基酸残基的长度;构成多肽长度的至少25%的条带性亲疏区域;以及至少一种抗炎特性。抗炎性肽和/或其条带性亲疏区域可以具有大于3个氨基酸残基和/或小于24个氨基酸残基的长度。因此,多肽的必需长度可以是例如3至20、3至18、3至16、3至14、3至12、4至20、4至18、4至16、4至14、4至12、5至20、5至18、5至16、5至14、5至12、6至20、6至18、6至16、6至14、6至12、7至20、7至18、7至16、7至14,或者在某些实施方案中为7至12个氨基酸残基。对于长于12个氨基酸残基的抗炎性多肽,有利的是设计二级结构中的扭结(例如,诸如通过脯氨酸残基产生的),以使得多肽具有长度为12个或更少氨基酸残基的条带性亲疏区域。抗炎性肽的条带性亲疏区域可以构成多肽长度的至少30%、35%、40%、45%、50%、60%、65%、70%、75%、80%、85%、90%、95%或100%。抗炎性多肽可以具有包含至少两个疏水性模块和一个或多个(例如,两个或三个)亲水性模块的条带性亲疏区域。可选地,抗炎性多肽可以具有包含至少三个疏水性模块和两个或更多个(例如,三个或四个)亲水性模块的条带性亲疏区域;包含至少两个疏水性模块和一个或多个(例如,两个或三个)亲水性模块的条带性亲疏区域;或者包含至少三个亲水性模块和两个或更多个(例如,三个或四个)疏水性模块的条带性亲疏区域。如以上所讨论的,条带性亲疏区域由交替的亲水性(xm)模块和疏水性(yn)模块组成。在此上下文中,下标m和n为确定不同模块的正整数。每个xm模块由根据式xma-xmb-xmc-xmd-xme的序列组成。xma选自由天然存在的亲水性氨基酸、非天然存在的亲水性氨基酸和亲水性氨基酸模拟物组成的组;并且xmb、xmc、xmd和xme各自单独地不存在或者选自由天然存在的亲水性氨基酸、非天然存在的亲水性氨基酸和亲水性氨基酸模拟物组成的组。每个yn模块由根据式yna-ynb-ync-ynd-yne的序列组成。yna选自由天然存在的疏水性氨基酸、非天然存在的疏水性氨基酸和疏水性氨基酸模拟物组成的组;ynb、ync、ynd和yne各自单独地不存在或者选自由天然存在的疏水性氨基酸、非天然存在的疏水性氨基酸和疏水性氨基酸模拟物组成的组。在某些抗炎性多肽中,每个xm模块由根据式xma-xmb-xmc-xmd或xma-xmb-xmc的序列组成。类似地,在某些抗炎性多肽中,每个yn模块由根据式yna-ynb-ync-ynd或yna-ynb-ync的序列组成。抗炎性肽可以包含与选自由以下组成的组的式相对应的条带性亲疏区域:y1a-y1b-y1c-x1a-y2a-y2b-y2c(式i);y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a(式ii);x2a-y3a-x3a-y1b-y1b-y1c-x1a-y2a-y2b-y2c(式iii);x1a-x1b-x1c-y2a-x2a-x2b-x2c(式iv);y1a-x1a-x1b-x1c-y2a-x2a-x2b-x2c-y3a-x3a(式v);x1a-x1b-y2a-y2b-x2a-x2b(式vi);y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a(式vii);y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a-y3b-x3a(式viii);y1a-y1b-x1a-x1b-y2a-y2b-x2a-x2b-y3a-y3b(式ix);y1a-y1b-x1a-x1b-y2a-y2b-x2a-x2b-y3a-x3a(式x);x1a-y1a-x2a-x2b-y2a-y2b-x3a-x3b-y3a-y3b(式xi);x1a-y1a-y1b-x2a-x2b-y2a-y2b-x3a-x3b-y3a(式xii);y1a-x1a-x1b-y2a-y2b-x2a-x2b-x2c-y3a-y3b(式xiii);x1a-x1b-x1c-y1a-y1b-x2a-x2b-y2a-y2b-y2c(式xiv);y1a-y1b-y1c-x1a-x1b-y2a-y2b-x2a-x2b-x2c(式xv);y1a-y1b-x1a-x1b-x1c-y2a-y2b-x2a-x2b-y3a(式xvi);y1a-y1b-x1a-x1b-y2a-y2b(式xvii);x1a-y1a-y1b-x2a-x2b-y2a-y2b-x3a(式xviii);y1a-y1b-x1a-x1b-y2a-y2b-x2a-y3a-y3b-x3a(式xix);x1a-y1a-y1b-x2a-y2a-y2b-x3a-x3b-y3a-y3b(式xx);y1a-y1b-x1a-x1b-y2a-x2a-x2b-y3a-y3b(式xxi);x1a-y1a-y1b-x2a-x2b-x2c-y2a-x3a-y3a-y3b(式xxii);y1a-y1b-x1a-y2a-x2a-x2b-x2c-y3a-y3b-x3a(式xxiii);x1a-x1b-y1b-x2a-y2a-x3a-x3b(式xxiv);y1a-y1b-y1c-x1a-x1b-y2a-x2a-y3a-x3a-x3b(式xxv);x1a-x1b-y1a-x2a-y2a-x3a-x3b-y3a-y3b-y3c(式xxvi);x1a-x1b-x1c-y1a-y1b-y1c(式xxvii);x1a-x1b-x1c-x1d-y1a-y1b-y1c-y1d(式xxviii);y1a-x1a-x1b-x1c-x1d-y2a-y2b-y2c-y2d-x2a(式xxix);x1a-x1b-x1c-x1d-x1e-y1a-y1b-y1c-y1d-y1e(式xxx);y1a-y1b-x1a-x1b-x1c-y2a-y2b-y2c-x2a-x2b(式xxxi);x1a-y1a-x2a-y2a-x3a-x3b-x3c-y3a-y3b-y3c(式xxxii);y1a-y1b-y1c-x1a-x1b-x1c(式xxxiii);y1a-y1b-y1c-y1d-x1a-x1b-x1c-x1d(式xxxiv);x1a-y1a-y1b-y1c-y1d-x2a-x2b-x2c-x2d-y2a(式xxxv);y1a-y1b-y1c-y1d-y1e-x1a-x1b-x1c-x1d-x1e(式xxxvi);x1a-x1b-y1a-y1b-y1c-x2a-x2b-x2c-y2a-y2b(式xxxvii);y1a-y1b-y1c-x1a-x1a-x1c-y2a-x2a-y3a-x3a(式xxxviii);y1a-x1a-x1b-x1c-x1d-x1e-y2a(式xxxix);y1a-x1a-x1b-x1c-x1d-x1e-y2a-y2b-y2c-y2d(式xl);y1a-y1b-x1a-x1b-x1c-x1d-x1e-y2a-y2b-y2c(式xli);y1a-y1b-y1c-x1a-x1b-x1c-x1d-x1e-y2a-y2b(式xlii);y1a-y1b-y1c-y1e-x1a-x1b-x1c-x1d-x1e-y2a(式xliii);x1a-y1a-y1b-y1c-y1d-y1e-x2a(式xliv);x1a-y1a-y1b-y1c-y1d-y1c-x2a-x2b-x2c-x2d(式xlv);x1a-x1b-y1a-y1b-y1c-y1d-y1e-x2a-x2b-x2c(式xlvi);x1a-x1b-x1c-y1a-y1b-y1c-y1d-y1e-x2ax2b(式xlvii);x1a-x1b-x1c-x1d-y1a-y1b-y1c-y1d-y1e-x2a(式xlviii);y1a-x1a-y2a-x2a-y3a-x3a(式xlix);y1a-y1b-x1a-y2a-y2b-x2a-y3a-y3b-x3a-y4a(式l);x1a-x1b-y1a-y1b-x2a-y2a-y2b-y2c-y2d(式li);y1a-y1b-y1c-y1d-x1a-y2a-y2b-x2a-x2b(式lii);y1a-y1b-x1b-y2a-y2b-y2c-x2b-y3a-x3a-y4a(式liii);以及y1a-x1a-y2a-x2a-y3a-y3b-y3c-x3a-y4a-y4b(式liv)。典型地,抗炎性多肽的条带性亲疏区域(或其部分)将具有两亲性构象(例如,在生理条件下)。为了考虑到两亲性,条带性亲疏区域(或其部分)不需要总是处于两亲性构象中。相反,两亲性构象存在至少50%、60%、70%、80%或更长时间或者当抗炎性多肽结合靶标分子诸如nf-kbii类蛋白(例如,relb)时是足够的。通常,两亲性构象将与特定二级结构诸如螺旋结构相关联。因此,抗炎性多肽的条带性亲疏区域(或其部分)可具有两亲性310-螺旋构象、两亲性α-螺旋构象、两亲性π-螺旋构象或两亲性聚脯氨酸螺旋构象。可选地,抗炎性多肽的条带性亲疏区域(或其部分)可以具有两亲性β-链构象。对于包含含有或具有两亲性螺旋构象(例如,310-螺旋构象、α-螺旋构象、π-螺旋构象或聚脯氨酸螺旋构象)的条带性亲疏区域的抗炎性肽,疏水性表面(“侧”)可以具有至少100°的面部弧度。在某些实施方案中,疏水性表面或侧的面部弧度为至少125°、150°、175°、200°、225°、250°、275°或300°。在某些实施方案中,抗炎性多肽具有含有相对大的疏水性容积的条带性亲疏区域。因此,条带性亲疏区域可以最佳地包含疏水性氨基酸残基,所述残基具有至少600立方埃的总侧链容积。在某些实施方案中,条带性亲疏区域的疏水性氨基酸残基具有至少650、700、750、800、850、900、950、1000或更大立方埃的疏水性侧链容积。可选地或另外地,条带性亲疏区域的特征可以在于疏水性氨基酸残基的侧链容积的总和与亲水性氨基酸残基的侧链容积的总和的比率,其中所述比率为至少0.75或更高。例如,比率可以是至少0.8、0.85、0.9、0.95、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5或更大。由于具有相对大的疏水性侧链容积的条带性亲疏区域的理想性,通常优选在条带性亲疏区域的序列内包含一个或多个(例如,2、3、4、5或更多个)大疏水性氨基酸残基。相反地,通常优选在条带性亲疏区域的序列内具有两个或更少(例如,1或0个)小疏水性氨基酸残基。大疏水性氨基酸残基的实例包括色氨酸、苯丙氨酸和酪氨酸。另外,在某些情况下,组氨酸或精氨酸可以被视为大疏水性氨基酸残基。小疏水性残基的实例包括甘氨酸、丙氨酸、丝氨酸、半胱氨酸、缬氨酸、苏氨酸以及脯氨酸。因此,抗炎性多肽可以具有包含选自由以下组成的组的一个或多个(例如,2、3、4、5或更多个)疏水性残基的条带性亲疏区域:色氨酸、苯丙氨酸和酪氨酸。可选地,抗炎性多肽可以具有包含选自(i)由色氨酸、苯丙氨酸、酪氨酸和组氨酸组成的组或(ii)由色氨酸、苯丙氨酸、酪氨酸和精氨酸组成的组的一个或多个(例如,2、3、4、5或更多个)疏水性残基的条带性亲疏区域。在某些实施方案中,抗炎性多肽具有包含选自由以下组成的组的两个或更少个(例如,1或0个)疏水性残基的条带性亲疏区域:甘氨酸、丙氨酸、丝氨酸、半胱氨酸、缬氨酸、苏氨酸以及脯氨酸。可选地,抗炎性多肽具有包含选自由以下组成的组的不超过一个疏水性残基的条带性亲疏区域:甘氨酸、丙氨酸、丝氨酸、半胱氨酸、缬氨酸、苏氨酸以及脯氨酸。在其他替代方案中,抗炎性多肽具有不包含甘氨酸残基、不包含丙氨酸残基、不包含丝氨酸残基、不包含半胱氨酸残基、不包含缬氨酸残基、不包含苏氨酸残基和/或不包含脯氨酸残基的条带性亲疏区域。还优选的是抗炎性多肽具有特征在于中度水平的阳离子度的条带性亲疏区域(即,不含有过量数目具有带正电荷侧链的氨基酸残基的条带性亲疏区域)。具有带正电荷侧链基团(确保生理学条件)的氨基酸残基的实例包括赖氨酸,典型地为精氨酸,并且有时为组氨酸。具有带负电荷侧链(确保生理学条件)的氨基酸残基的实例包括天冬氨酸和谷氨酸。具有不带电荷侧链(确保生理学条件)的亲水性氨基酸残基的实例包括天冬酰胺和谷氨酰胺。因此,抗炎性多肽可以具有包含五个或更少(例如,4、3、2)个赖氨酸残基的条带性亲疏区域。可选地,抗炎性多肽可以具有包含选自由赖氨酸和精氨酸组成的组的五个或更少个(例如,4、3、2个)氨基酸残基的条带性亲疏区域。在其他替代方案中,抗炎性多肽可以具有包含选自由赖氨酸、精氨酸和组氨酸组成的组的五个或更少个(例如,4、3、2个)氨基酸残基的条带性亲疏区域。对于具有包含一个或多个(例如,两个或更多个)带正电荷氨基酸残基的条带性亲疏区域的抗炎性多肽,对于也包含一些带负电荷或极性、不带电荷氨基酸残基的条带性亲疏区域而言可以是有利的。例如,抗炎性多肽可以具有包含带正电荷氨基酸残基和带负电荷氨基酸残基二者的条带性亲疏区域,以使得多肽上的净电荷不超过+2或+1(例如,带正电荷氨基酸残基的数目不超过带负电荷氨基酸残基的数目多于一个或两个)。可选地,抗炎性多肽可以具有包含带正电荷氨基酸残基和极性、不带电荷氨基酸残基的条带性亲疏区域,以使得多肽上的净电荷不超过+2或+1(例如,带正电荷氨基酸残基的数目不超过一个或两个)。在其他替代方案中,抗炎性多肽可以具有包含带正电荷氨基酸残基、带负电荷氨基酸残基和亲水性不带电荷氨基酸残基的条带性亲疏区域,以使得多肽上的净电荷不超过+2。为了避免rp肽与其他分子(无论是另一个rp肽、金属离子等)之间的不希望的相互作用,限制多肽中某种类型的氨基酸残基的数目可以是有利的。例如,因为半胱氨酸残基在某些条件(例如,氧化环境)下形成二硫键,它可以适用于限制本发明的多肽中的半胱氨酸残基数目不超过一个或两个或甚至无。因为组氨酸残基在某些条件(例如,碱性环境)下螯合金属,它可以适用于限制本发明的多肽中的组氨酸残基数目不超过一个或两个或甚至无。另外,因为脯氨酸倾向于将扭结引入到二级结构元件(例如,α-螺旋和β-链)中,它可以适用于排除本发明的多肽的条带性亲疏区域中的脯氨酸残基或者限制其数目不超过一个。i类多肽本发明的抗炎性多肽可以是i类多肽。i类多肽包含含有选自由式i定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:y1a-y1b-y1c-x1a-y2a-y2b-y2c(式i)。式i中的氨基酸残基y1a、y1b、y1c、y2a、y2b和y2c中的每一个可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、his(h)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、pro(p)、thr(t)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式i中氨基酸残基y1a、y1b、y1c、y2a、y2b和y2c中的至少3、4、5或6选自由以下组成的组:phe(f)、trp(w)、tyr(y)、his(h)以及leu(l)。在某些实施方案中,式i中氨基酸残基y1a、y1b、y1c、y2a、y2b和y2c中的至少3、4、5或6选自由以下组成的组:phe(f)、trp(w)和tyr(y)。在某些实施方案中,式i中氨基酸残基y1a、y1b、y1c、y2a、y2b和y2c中的小于两个(并且在某些实施方案中为1个或无)选自由以下组成的组:pro(p)、thr(t)、ser(s)、ala(a)以及gly(g)。式i中的模块y1a-y1b-y1c可以具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)、leu-leu-leu(lll)、cys-cys-cys(ccc)、met-met-met(mmm)、val-val-val(vvv)、ile-ile-ile(iii)。可选地,式i中的模块y1a-y1b-y1c可以具有选自由pro-pro-pro(ppp)、thr-thr-thr(ttt)和ala-ala-ala(aaa)组成的组的序列。在某些实施方案中,式i中的模块y1a-y1b-y1c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)及其组合(例如,phe-phe-trp(ffw)、phe-trp-trp(fww)、trp-phe-trp(wfw)、trp-trp-phe(wwf)、phe-phe-tyr(ffy)、phe-tyr-tyr(fyy)、tyr-phe-tyr(yfy)、tyr-tyr-phe(yyf)、trp-trp-tyr(wwy)、trp-tyr-tyr(wyy)、tyr-trp-tyr(ywy)、tyr-tyr-trp(yyw)、phe-trp-tyr(fwy)、phe-tyr-trp(fyw)、trp-phe-tyr(wfy)、trp-tyr-phe(wyf)、tyr-trp-phe(ywf)或tyr-phe-trp(yfw))。式i中的模块y2a-y2b-y2c可以具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)、leu-leu-leu(lll)、cys-cys-cys(ccc)、met-met-met(mmm)、val-val-val(vvv)以及ile-ile-ile(iii)。可选地,式i中的模块y2a-y2b-y2c可以具有选自由pro-pro-pro(ppp)、thr-thr-thr(ttt)和ala-ala-ala(aaa)组成的组的序列。在某些实施方案中,式i中的模块y2a-y2b-y2c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)及其组合(例如,phe-phe-trp(ffw)、phe-trp-trp(fww)、trp-phe-trp(wfw)、trp-trp-phe(wwf)、phe-phe-tyr(ffy)、phe-tyr-tyr(fyy)、tyr-phe-tyr(yfy)、tyr-tyr-phe(yyf)、trp-trp-tyr(wwy)、trp-tyr-tyr(wyy)、tyr-trp-tyr(ywy)、tyr-tyr-trp(yyw)、phe-trp-tyr(fwy)、phe-tyr-trp(fyw)、trp-phe-tyr(wfy)、trp-tyr-phe(wyf)、tyr-trp-phe(ywf)或tyr-phe-trp(yfw))。因此,i类抗炎性多肽可以包含具有选自由以下组成的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:fff-x1a-fff(seqidno:1)、www-x1a-www(seqidno:2)、yyy-x1a-yyy(seqidno:3)以及其组合。可选地,i类抗炎性多肽可以包含具有选自由以下组成的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:lll-x1a-lll(seqidno:4)、ccc-x1a-ccc(seqidno:5)、mmm-x1a-mmm(seqidno:6)、vvv-x1a-vvv(seqidno:7)以及iii-x1a-iii(seqidno:8)。在此类肽中,x1a可以选自由arg(r)、his(h)和lys(k)组成的组;或者x1a可以选自由glu(e)、gln(q)、asn(n)和asp(d)组成的组。i类抗炎性多肽可以包含具有选自由式ii定义的序列的组或由式iii定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a(式ii);x2a-y3a-x3a-y1a-y1b-y1c-x1a-y2a-y2b-y2c(式iii)。由式ii和式iii定义的y1a-y1b-y1c-x1a-y2a-y2b-y2c序列可以是以上结合式i描述的任何序列。式ii和式iii中的x2a和x3a可以各自单独地选自由以下组成的组:arg(r)、his(h)、lys(k)、glu(e)、gln(q)、asn(n)以及asp(d)。可选地,式ii和式iii中的x2a和x3a可以各自单独地选自由arg(r)、his(h)和lys(k)组成的组。在其他替代方案中,式ii和式iii中的x2a和x3a可以各自单独地选自由arg(r)、his(h)、lys(k)和gln(q)组成的组。在其他替代方案中,式ii和式iii中的x2a和x3a可以各自单独地选自由glu(e)、gln(q)、asn(n)和asp(d)组成的组。在其他替代方案中,式ii和式iii中的x2a可以选自由arg(r)、his(h)和lys(k)组成的组,并且式ii和式iii中的x3a可以选自由glu(e)、gln(q)、asn(n)和asp(d)组成的组。式ii和式iii中的y3a可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)以及ile(i)。在某些实施方案中,式ii和式iii中的y3a选自由以下组成的组:phe(f)、trp(w)、tyr(y)和leu(l)。式ii和式iii中的模块x2a-y3a-x3a可以选自由以下组成的组:efq、efe、efn、efd、nfq、nfe、nfn、nfd、qfq、qfe、qfn、qfd、dfq、dfe、dfn、dfd、ewq、ewe、ewn、ewd、nwq、nwe、nwn、nwd、qwq、qwe、qwn、qwd、dwq、dwe、dwn、dwd、eyq、eye、efn、eyd、nyq、nye、nyn、nyd、qyq、qye、qyn、qyd、dyq、dye、dyn、dyd、elq、ele、eln、eld、nlq、nle、nln、nld、qlq、qle、qln、qld、dlq、dle、dln、dld、rfr、rfq、rfe、rfn、rfd、rwr、rwq、rwe、rwn以及rwd。i类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由表3中所列出的序列组成的组的序列,大致上由所述序列组成或者由所述序列组成,所述序列例如rp394、rp108-rp123、rp125-131、rp133、rp135-rp141、rp143-rp146、rp148-rp150、rp152-rp165、rp179、rp395、rp211、rp230、rp232、rp258、rp267、rp268、rp271、rp273、rp280-281以及rp287(即,分别为seqidno:33-98)。在某些实施方案中,i类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由以下序列组成的组的序列,大致上由所述序列组成或者由所述序列组成,所述序列由以下各项组成:rp113(seqidno:39)、rp118(seqidno:44)和rp394(seqidno:33)。ii类多肽本发明的抗炎性多肽可以是ii类多肽。ii类抗炎性多肽可以包含含有选自由式vii定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a(式vii)。式vii中的氨基酸残基y2a可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、pro(p)、thr(t)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式vii中的氨基酸残基y2a选自由以下组成的组:phe(f)、trp(w)和tyr(y)。可选地,式vii中的氨基酸残基y2a可以选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)。式vii中的氨基酸残基y2b可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、pro(p)、thr(t)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式vii中的氨基酸残基y2b选自由以下组成的组:phe(f)、trp(w)和tyr(y)。可选地,式vii中的氨基酸残基y2b可以选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)。式vii中的氨基酸残基x1b可以选自由以下组成的组:arg(r)、lys(k)和his(h)。可选地,式vii中的氨基酸残基x1b可以选自由以下组成的组:asn(n)、gln(q)、asp(d)和glu(e)。式vii中的氨基酸残基x2a可以选自由以下组成的组:arg(r)、lys(k)和his(h)。可选地,氨基酸残基x2a可以选自由以下组成的组:asn(n)、gln(q)、asp(d)和glu(e)。式vii中的序列x1b-y2a-y2b-x2a可以选自由以下组成的组:lys-phe-phe-lys(kffk;seqidno:386)、lys-trp-trp-lys(kwwk;seqidno:387)、lys-tyr-try-lys(kyyk;seqidno:388)、lys-phe-trp-lys(kfwk;seqidno:389)、lys-trp-phe-lys(kwfk;seqidno:390)、lys-phe-tyr-lys(kfyk;seqidno:391)、lys-tyr-phe-lys(kyfk;seqidno:392)、lys-trp-tyr-lys(kwyk;seqidno:393)以及lys-tyr-trp-lys(kywk;seqidno:394)。可选地,式vii中的序列x1b-y2a-y2b-x2a可以选自由以下组成的组:arg-phe-phe-arg(rffr;seqidno:395)、arg-trp-trp-arg(rwwr;seqidno:396)、arg-tyr-try-arg(ryyr;seqidno:397)、arg-phe-trp-arg(rfwr;seqidno:398)、arg-trp-phe-arg(rwfr;seqidno:399)、arg-phe-tyr-arg(rfyr;seqidno:400)、arg-tyr-phe-arg(ryfr;seqidno:401)、arg-trp-tyr-arg(rwyr;seqidno:402)以及arg-tyr-trp-arg(rywr;seqidno:403)。在其他替代方案中,式vii中的序列x1b-y2a-y2b-x2a可以选自由以下组成的组:his-phe-phe-his(hffh;seqidno:404)、his-trp-trp-his(hwwh;seqidno:405)、his-tyr-try-his(hyyh;seqidno:406)、his-phe-trp-his(hfwh;seqidno:407)、his-trp-phe-his(hwfh;seqidno:408)、his-phe-tyr-his(hfyh;seqidno:409)、his-tyr-phe-his(hyfh;seqidno:410)、his-trp-tyr-his(hwyh;seqidno:411)以及his-tyr-trp-his(hywh;seqidno:412)。式vii中的氨基酸残基x1a可以选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。在其他实施方案中,氨基酸残基x1a选自由arg(r)和gln(q)组成的组。在某些实施方案中,式vii中的氨基酸残基x1a为arg(r)。可选地,式vii中的氨基酸残基x1a可以选自由以下组成的组:lys(k)、gln(q)、glu(e)和asn(n)。式vii中的氨基酸残基x2b可以选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。在其他实施方案中,氨基酸残基x2b选自由arg(r)和gln(q)组成的组。在某些实施方案中,式vii中的氨基酸残基x2b为arg(r)。可选地,式vii中的氨基酸残基x2b可以选自由以下组成的组:lys(k)、gln(q)、glu(e)和asn(n)。式vii中的氨基酸残基y1a可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式vii中的氨基酸残基y1a选自由以下组成的组:phe(f)、trp(w)和tyr(y)。可选地,式vii中的氨基酸残基y1a可以选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)。式vii中的氨基酸残基y3a可以选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式vii中的氨基酸残基y3a选自由以下组成的组:phe(f)、trp(w)和tyr(y)。可选地,式vii中的氨基酸残基y3a可以选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)。因此,ii类抗炎性多肽可以包含具有选自由以下组成的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:f-x1a-x1b-ff-x2a-x2b-f(seqidno:9)、f-x1a-x1b-ff-x2a-x2b-w(seqidno:10)、w-x1a-x1b-ff-x2a-x2b-f(seqidno:11)、f-x1a-x1b-fw-x2a-x2b-f(seqidno:12)、f-x1a-x1b-wf-x2a-x2b-f(seqidno:13)、f-x1a-x1b-ww-x2a-x2b-f(seqidno:14)、w-x1a-x1b-ww-x2a-x2b-f(seqidno:15)、f-x1a-x1b-ww-x2a-x2b-w(seqidno:16)、w-x1a-x1b-ww-x2a-x2b-w(seqidno:17)、f-x1a-x1b-ff-x2a-x2b-y(seqidno:18)、y-x1a-x1b-ff-x2a-x2b-f(seqidno:19)、f-x1a-x1b-fy-x2a-x2b-f(seqidno:20)、f-x1a-x1b-yf-x2a-x2b-f(seqidno:21)、f-x1a-x1b-yy-x2a-x2b-f(seqidno:22)、y-x1a-x1b-yy-x2a-x2b-f(seqidno:23)、f-x1a-x1b-yy-x2a-x2b-y(seqidno:24)以及y-x1a-x1b-yy-x2a-x2b-y(seqidno:25)、y-x1a-x1b-yy-x2a-x2b-w(seqidno:26)、w-x1a-x1b-yy-x2a-x2b-y(seqidno:27)、y-x1a-x1b-yw-x2a-x2b-y(seqidno:28)、y-x1a-x1b-wy-x2a-x2b-y(seqidno:29)、y-x1a-x1b-ww-x2a-x2b-y(seqidno:30)、w-x1a-x1b-ww-x2a-x2b-y(seqidno:31)以及y-x1a-x1b-ww-x2a-x2b-w(seqidno:32)。在以上序列中的氨基酸残基x1a、x1b、x2a和x2b可以如以上所讨论地选择。ii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含直接结合至式vii的氨基酸残基y1a的第一个另外的氨基酸残基。所述第一个另外的氨基酸残基可以是疏水性氨基酸残基(例如,选自由phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)组成的组的残基;选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组的残基)。可选地,第一个另外的氨基酸残基可以是亲水性氨基酸残基(例如,选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)组成的组的残基;选自由arg(r)、lys(k)和his(h)组成的组的残基;选自由arg(r)、lys(k)、his(h)和gln(q)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基)。ii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含直接结合至式vii的氨基酸残基y3a的第一个另外的氨基酸残基。第一个另外的氨基酸残基可以是疏水性氨基酸残基(例如,选自由phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)组成的组的残基;选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组的残基)。可选地,第一个另外的氨基酸残基可以是亲水性氨基酸残基(例如,选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基;选自由arg(r)、lys(k)和his(h)组成的组的残基;选自由arg(r)、lys(k)、his(h)和gln(q)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基)。ii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含直接结合至式vii的氨基酸残基y1a的第一个另外的氨基酸残基和直接结合至式vii的氨基酸残基y3a的第二个另外的氨基酸残基。第一个另外的氨基酸残基可以是疏水性氨基酸残基并且第二个另外的氨基酸残基可以是亲水性氨基酸残基。可选地,第一个另外的氨基酸残基可以是亲水性氨基酸残基并且第二个氨基酸残基可以是疏水性氨基酸残基。无论如何,另外的疏水性氨基酸残基可以选自由phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)组成的组;并且在某些实施方案中,选自由phe(f)、trp(w)和tyr(y)组成的组;并且在另外的实施方案中,选自由phe(f)组成的组。另外的亲水性氨基酸残基可以选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)组成的组;并且在某些实施方案中,可以是选自由arg(r)、lys(k)和his(h)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基。ii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由表5中所列出的序列的组的序列,大致上由所述序列组成或者由所述序列组成,所述序列例如rp124、rp132、rp134、rp142、rp147、rp151、rp166-rp172、rp175、rp177、rp182、rp183、rp185、rp186、rp424、rp190、rp194、rp198、rp199-rp202、rp204、rp206、rp207、rp209、rp210、rp212-rp216、rp218、rp219、rp425、rp225、rp227、rp233-rp239、rp398、rp241-rp247、rp250-rp256、rp426、rp427、rp285以及rp387(即,分别为seqidno:106-173)。在某些实施方案中,ii类抗炎性多肽包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp124(seqidno:106)、rp166(seqidno:112)、rp182(seqidno:121)以及rp183(seqidno:122)。xii类多肽本发明的抗炎性多肽可以是xii类多肽。xii类抗炎性多肽可以包含含有选自由式xlix定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:y1a-x1a-y2a-x2a-y3a-x3a(式xlix)。式xlix中的氨基酸残基y1a、y2a和y3a可以各自独立地选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、ile(i)、cys(c)、met(m)、val(v)、pro(p)、thr(t)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,式xlix中的氨基酸残基y1a、y2a和y3a各自独立地选自由phe(f)、trp(w)和tyr(y)组成的组;由phe(f)、trp(w)、tyr(y)和leu(l)组成的组;或者由phe(f)、trp(w)、tyr(y)、leu(l)、ile(i)、cys(c)、met(m)、val(v)和ala(a)组成的组。式xlix的氨基酸残基x1a、x2a和x3a可以各自独立地选自由以下组成的组:arg(r)、lys(k)、his(h)、gln(q)、glu(e)、asn(n)以及asp(d)。在某些实施方案中,氨基酸残基x1a、x2a和x3a各自独立地选自由以下组成的组:arg(r)、lys(k)和his(h)。可选地,氨基酸残基x1a、x2a和x3a各自独立地选自由以下组成的组:arg(r)、lys(k)、his(h)和gln(q)。xii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含第一个另外的氨基酸残基。第一个另外的氨基酸残基可以是直接结合至式xlix的氨基酸残基y1a。因此,第一个另外的氨基酸残基可以例如是选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)组成的组的残基;选自由arg(r)、lys(k)和his(h)组成的组的残基;选自由arg(r)、lys(k)、his(h)和gln(q)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基)。可选地,第一个氨基酸残基可以是直接结合至式xlix的氨基酸残基x3a的疏水性氨基酸残基。因此,第一个另外的氨基酸残基可以是例如选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由phe(f)、trp(w)、tyr(y)、leu(l)、ile(i)、cys(c)、met(m)、val(v)以及ala(a)组成的组的残基)。xii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含第一个和第二个另外的氨基酸残基。第一个另外的氨基酸残基可以是如以上所讨论的亲水性氨基酸残基,其直接结合至式xlix的氨基酸残基y1a。第二个另外的氨基酸残基可以直接结合至第一个另外的氨基酸残基。因此,第二个另外的氨基酸残基可以是疏水性氨基酸残基,例如,选自由phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)组成的组的残基;选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组的残基)。可选地,第二个另外的氨基酸残基可以是直接结合至式xlix的氨基酸残基x3a的疏水性氨基酸残基,如以上所讨论的。xii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含第一个、第二个和第三个另外的氨基酸残基。第一个另外的氨基酸残基可以是直接结合至式xlix的氨基酸残基y1a的亲水性氨基酸残基并且第二个另外的氨基酸残基可以是直接结合至第一个另外的氨基酸残基的疏水性氨基酸残基,如以上所讨论的。第三个另外的氨基酸残基可以直接结合至第二个另外的氨基酸残基的亲水性氨基酸残基。因此,第三个另外的氨基酸残基可以例如是选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)组成的组的残基;选自由arg(r)、lys(k)和his(h)组成的组的残基;选自由arg(r)、lys(k)、his(h)和gln(q)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基)。可选地,第三个氨基酸残基可以是直接结合至式xlix的氨基酸残基x3a的疏水性氨基酸残基。因此,第三个另外的氨基酸残基可以是例如选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由phe(f)、trp(w)、tyr(y)、leu(l)、ile(i)、cys(c)、met(m)、val(v)以及ala(a)组成的组的残基)。xii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含四个、五个、六个或更多个另外的氨基酸残基。另外的氨基酸残基可以一种方式添加,所述方式使疏水性氨基酸残基接着亲水性氨基酸残基接着疏水性氨基酸残基的交替模式继续,如式xlix所示的。以这种方式,xii类抗炎性多肽可以扩展来包含具有10、11、12个或更多个氨基酸残基的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成。xii类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp393、rp391、pr392、rp390以及rp389(即,分别为seqidno:253-257)。xiv类多肽本发明的抗炎性多肽可以是xiv类多肽。xiv类抗炎性多肽可以包含含有选自由以下式li至式liv的任一个定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成:x1a-x1b-y1a-y1b-x2a-y2a-y2b-y2c-y2d(式li)y1a-y1b-y1c-y1d-x1a-y2a-y2b-x2a-x2b(式lii);y1a-y1b-x1a-y2a-y2b-y2c-x2b-y3a-x3a-y4a(式liii);以及y1a-x1a-y2a-x2a-y3a-y3b-y3c-x3a-y4a-y4b(式liv)。xiv类多肽的条带性亲疏区域可以包含至少3个(例如,3至6个)脯氨酸氨基酸残基。例如,式li中的氨基酸残基y1a、y2a和y2b可以是脯氨酸氨基酸残基。可选地,式lii中的氨基酸残基y1c、y1d和y2b可以是脯氨酸氨基酸残基。在其他替代方案中,式liii中的氨基酸残基y1a、y2a、y2b、y2c、y3a以及y4a可以是脯氨酸氨基酸残基。仍在其他替代方案中,式liv中的氨基酸残基y1a、y2b、y3a、y3b、y3c以及y4b可以是脯氨酸氨基酸残基。在式li至式liv中并未指示为脯氨酸残基的疏水性氨基酸残基(例如,y1a、y1b、y1c、y1d、y2a、y2b、y2c、y2d、y3a、y3b、y3c、y4a以及y4b)可以各自单独地选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,此类疏水性氨基酸残基各自单独地选自:由phe(f)、trp(w)和tyr(y)组成的组;由phe(f)、trp(w)、tyr(y)和leu(l)组成的组;或者由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组)。在式li至式liv中的亲水性氨基酸残基(例如,x1a、x1b、x2a、x2b和x3a)可以各自单独地选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。在某些实施方案中,此类亲水性氨基酸残基各自单独地选自由以下组成的组:arg(r)、lys(k)和his(h)。可选地,此类亲水性氨基酸残基各自单独地选自:由arg(r)、lys(k)、his(h)和gln(q)组成的组;或者由asn(n)、gln(q)、asp(d)和glu(e)组成的组。xiv类抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp449、rp450、rp448、rp447、rp452、rp451、rp444、rp441、rp446、rp445、rp442以及rp443(即,分别为seqidno:258-269)。其他类别的多肽本发明的抗炎性多肽可以是ii类至xi类和xiii类中的任一种。此类抗炎性多肽可以包含含有选自由式iv至式xlviii和式l中任一项定义的序列的组的序列的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成。在式iv至式xlviii和式l中的疏水性氨基酸残基(例如,y1a、y1b、y1c、y1d、y1e、y2a、y2b、y2c、y2d、y2e、y3a、y3b、y3c、y4a以及y4b)可以各自单独地选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)。在某些实施方案中,此类疏水性氨基酸残基各自单独地选自:由phe(f)、trp(w)和tyr(y)组成的组;由phe(f)、trp(w)、tyr(y)和leu(l)组成的组;或者由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组)。在式iv至式xlviii和式l中的亲水性氨基酸残基(例如,x1a、x1b、x1c、x1d、x2a、x2b、x2c、x2d、x3a、x3b、x3c、x4a以及x4b)可以各自单独地选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。在某些实施方案中,此类亲水性氨基酸残基各自单独地选自由以下组成的组:arg(r)、lys(k)和his(h)。可选地,此类亲水性氨基酸残基各自单独地选自:由arg(r)、lys(k)、his(h)和gln(q)组成的组;或者由asn(n)、gln(q)、asp(d)和glu(e)组成的组。式iv至式xlviii和式l中任一项的抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域进一步包含直接结合至式的第一个氨基酸残基(例如,y1a或x1a)或结合至式中最后一个氨基酸残基的第一个另外的氨基酸残基。第一个另外的氨基酸残基可以是亲水性氨基酸残基(例如,选自由arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)组成的组的残基;选自由arg(r)、lys(k)和his(h)组成的组的残基;选自由arg(r)、lys(k)、his(h)和gln(q)组成的组的残基;或者选自由asn(n)、gln(q)、asp(d)和glu(e)组成的组的残基)。可选地,第一个另外的氨基酸残基可以是疏水性氨基酸残基(例如,选自由phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)、thr(t)、pro(p)、ser(s)、ala(a)以及gly(g)组成的组的残基;选自由phe(f)、trp(w)和tyr(y)组成的组的残基;选自由phe(f)、trp(w)、tyr(y)和leu(l)组成的组的残基;或者选自由leu(l)、cys(c)、met(m)、val(v)和ile(i)组成的组的残基)。式iv至式xlviii和式l中任一项的抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或由所述区域组成,所述区域进一步包含第一个和第二个另外的氨基酸残基,其中第一个另外的氨基酸残基直接结合至式的第一个氨基酸残基(例如,y1a或x1a)或者式中的最后一个氨基酸残基,并且第二个另外的氨基酸残基直接结合至式中的第一个氨基酸残基、式中的最后一个氨基酸残基或者第一个另外的氨基酸残基。第一个另外的氨基酸残基可以是如以上所讨论的亲水性或疏水性氨基酸残基。第二个另外的氨基酸残基也可以是如以上所讨论的亲水性或疏水性氨基酸残基。式iv至式xlviii和式l中任一项的抗炎性多肽可以包含条带性亲疏区域,大致上由所述区域组成或者由所述区域组成,所述区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp396、rp405、rp174、rp176、rp178、rp180-181、rp184、rp408、rp187、rp416、rp188、rp189、rp388、rp417、rp191-rp193、rp404、rp196、rp397、rp197、rp402、rp203、rp409、rp205、rp208、rp217、rp220-rp224、rp226、rp229、rp231、rp240、rp248、rp249、rp415、rp257、rp259-rp266、rp269、rp272、rp274、rp277-rp279、rp282、rp283、rp286、rp289以及rp414(即,分别为seqidno:174-233)。变体多肽表3-9(下文)中示出的示例性抗炎性多肽序列仅是实例并且不仅仅是本文所提供的抗炎性多肽。实际上,所公开肽的序列的片段和变体处于本发明的范围内。本发明的“片段”包含本文所公开的多肽的至少6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23个连续氨基酸残基(或者多至比主题多肽中的氨基酸残基数目少一个)并且保留主题多肽的至少一种抗炎特性。因此,本发明的片段包括相对于本文所公开的多肽从n-末端和/或c-末端缺失一个、两个、三个、四个或更多个氨基酸的多肽。本发明的“变体”为基本上类似于本文所公开的多肽并且保留主题多肽的至少一种抗炎特性的多肽。变体可以包含本文所公开的主题多肽的n-末端或c-末端处的一个或多个氨基酸残基的缺失(即,截短);在本文所公开的主题多肽的一个或多个内部位点处的一个或多个氨基酸残基的缺失和/或添加;和/或在本文所公开的主题多肽的一个或多个位置处的一个或多个氨基酸残基的取代。对于长度为12个氨基酸或更短的主题多肽,变体多肽可以包含三个或更少(例如,两个、一个或无)在n-末端和/或c-末端的缺失的氨基酸残基,无论其是否位于内部。因此,本发明进一步提供与表3-9中公开的任一种抗炎性多肽至少50%相同(例如,至少60%、70%、80%、90%或更大)并且仍保留至少一种抗炎特性的抗炎性多肽。例如,本发明提供长度为3至24个氨基酸残基并且包含与i类抗炎性多肽(例如,表3中的任一种序列)共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。此类同一性可以例如与以下各项共享:rp-394(seqidno:33)、rp-108(seqidno:34)、rp-113(seqidno:39)、rp-118(seqidno:44)、rp-129(seqidno:54)或rp-179(seqidno:86)。可选地,本发明提供长度为3至24个氨基酸残基并且包含与ii类(子类1)抗炎性多肽(例如,表5中的任一种序列)共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。此类同一性可以例如与以下各项共享:rp-124(seqidno:106)、rp-134(seqidno:108)、rp-166(seqidno:112)、rp-168(seqidno:114)、rp-182(seqidno:121)或rp-183(seqidno:122)。在其他替代方案中,本发明提供长度为3至24个氨基酸残基并且包含与任何ii类至ix类或xiii类抗炎性多肽(例如,表6中的任一种序列)共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。在其他替代方案中,本发明提供长度为3至24个氨基酸残基并且包含与任何viii类至xi类抗炎性多肽(例如,表7中的任一种序列)共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。在其他替代方案中,本发明提供长度为3至24个氨基酸残基并且包含与xii类或xiv类抗炎性多肽(例如,表8中的任一种序列)共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。在其他替代方案中,本发明提供长度为3至24个氨基酸残基并且包含与表9中的任一种组合序列共享至少50%同一性(例如,至少60%、70%、80%、90%或更大同一性)的条带性亲疏区域,大致上由所述区域组成或者由所述区域组成的抗炎性多肽。同源性抗炎性多肽与表3-9中的任一种抗炎性多肽的条带性亲疏区域之间的差异可以包括氨基酸残基的缺失、添加和/或取代,如以上所讨论的。取代的氨基酸残基可以与替换的氨基酸残基不相关(例如,在疏水性/亲水性、大小、电荷、极性等方面不相关),或者取代的氨基酸残基可以构成类似的、保守的或高度保守的氨基酸取代。如本文所用的,“类似的”、“保守的”和“高度保守的”氨基酸取代为如以下表2所示地定义的。确定氨基酸残基取代是否是类似的、保守的或高度保守的是排他地基于氨基酸残基的侧链而不是肽主链,所述侧链可以被修饰来增加肽稳定性,如以下所讨论的。表2:氨基酸取代的分类在某些实施方案中,本发明的变体多肽结合至两个或更多个靶标(例如,促炎性靶标)。在一些实施方案中,变体多肽结合至三个、四个、五个或更多个促炎性靶标。例如,变体多肽可以结合至本文所公开的靶标的任何组合(例如,nf-kbii类蛋白质和人血清白蛋白(hsa)),如以下所讨论的。此类结合可以是基于计算机数据、体外数据或体内数据。对结合至靶标分子的多肽建模可以在计算机上进行多肽是否具有抗炎特性的确定。例如,多肽(例如,具有3至24个氨基酸残基的长度并且包含构成多肽长度的至少25%的条带性亲疏区域的多肽)与推定的靶标分子的结合可以在计算机上使用本领域可用的许多分子建模和对接平台中的任一种来建模,从而评定所述多肽是否为抗炎性多肽。在线clusprotm算法2.0版(波士顿大学开发)尤其适用于对多肽的构象及其与靶标分子(诸如信号蛋白)的结合进行建模,如以下所列出的实施例所描述的。可以使用允许多肽在靶标分子上对接的建模算法诸如clusprotm算法,例如以预测与多肽-靶标相互作用相关联的结合能。此类预测提供对结合能的合理评估,但是它们不必等于通过体外测试多肽和蛋白靶标计算的结合能。为此,本文鉴别的结合能全部使用clusprotm算法来生成。因此,当不存在相反的指示时,对于与肽和特定靶标的结合相关联的结合能的任何数值参考为通过使用clusprotm算法对相互作用进行建模测定的结合能的参考。如以下实施例详细说明的,已示出示例性rp肽与和炎症相关联的各种信号分子(包括nf-kbii类亚基relb、tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr和cdk6)以及其他膜相关性信号分子(包括cd206、cd47和sirp-α)、翻译修饰蛋白转谷氨酰胺酶2(tgm2)和组蛋白修饰酶组蛋白甲基转移酶(hmt)相互作用。在这些蛋白质靶标折叠成其正常的三维构象时,常常生成两亲性裂隙,其对本文所述的免疫调节肽具有高亲和力。对于潜在抗炎性多肽与nf-kbii类亚基之间的相互作用建模,可以使用任何ii类亚基序列(例如,rela、reib、crel、nf-kb1或nf-kb2)。在某些实施方案中,ii类亚基序列折叠成功能性ii类亚基或其功能片段。用于建模的特定ii类亚基可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人nf-kbii类亚基,如果预期受试者为牛,则选择牛nf-kbii类亚基,等等)来选择。用于建模的nf-kbii类亚基可以是人reib序列(ncbi登录号np-006500),所述序列如下:mlrsgpasgpsvptgrampsrrvarppaapelgalgspdlsslslavsrsideleiideyikengfgldggqpgpgeglprlvsrgaaslstvtlgpvappatpppwgcplgrlvspapgpgpqphlvtteqpkqrgmrfryrcegrsagsilgrssteasktlpaielrdcgglrevevtaclvwkdwphrvhphslvgkdctdgicrvrlrphvsprhsfnnlgiqcvrkkeieaaierkiqlgidpynagslknhqevdmnvvricfqasyrdqqgqmrrmdpvlsepvydkkstntselricrinkesgpctggeelyllcdkvqkedisvvfsraswegradfsqadvhrqiaivfktppyedleivepvtvnvflqrltdgvcseplpftylprdhdsygvdkkrkrgmpdvlgelnssdphgieskrrkkkpaildhflpnhgsgpflppsallpdpdffsgtvslpgleppggpdllddgfaydptaptlftmldllppapphasavvcsggagavvgetpgpepltldsyqapgpgdggtaslvgsnmfpnhyreaafgggllspgpeat(seqidno:367)。人relb(上文)中的加下划线序列已鉴别为二聚化结构域。据信突出显示的氨基酸残基(tyr-300、leu-302和his-332)在二聚化相互作用中是尤其重要的。抗炎性多肽可以基于其结合(例如,在计算机上)至ii类亚基的二聚化袋和/或干扰或阻断ii类亚基二聚化能力的能力来鉴别。例如,抗炎性多肽可以结合至人relb(seqidno:367)的选自由以下组成的组的至少一个氨基酸残基:leu-281、ile-283、cys-284、glu-298、tyr-300、leu-301、leu-302、cys-303、ile-311、ser-312、ala-329、asp-330、val-331、his-332、gln-334以及leu-371,或在不同人nf-kbii类蛋白或另一种物种的nf-kbii类蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人relb(seqidno:367)的选自由以下组成的组的至少一个氨基酸残基:glu-298、tyr-300、leu-302、asp-330、gln-334以及leh-371,或在不同人nf-kbii类蛋白或另一种物种的nf-kbii类蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽结合至人relb(seqidno:367),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050、-1075、-1100、-1125、-1150、-1200kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与tgfβ之间的相互作用进行建模,可以使用任何tgfβ蛋白序列。tgfβ序列通常折叠成功能性tgfβ蛋白或其功能片段。用于建模的tgfβ蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人tgfβ,如果预期受试者为牛,则选择牛tgfβ,等等)来选择。用于建模的序列可以是人tgfβ序列(ncbi登录号np_000651.3),所述序列如下:mppsglrllplllpllwllvltpgrpaaglstcktidmelvkrkrieairgqilsklrlasppsqgevppgplpeavlalynstrdrvagesaepepepeadyyakevtrvlmvethneiydkfkqsthsiymffntselreavpepvllsraelrllrlklkveqhvelyqkysnnswrylsnrllapsdspewlsfdvtgvvrqwlsrggeiegfrlsahcscdsrdntlqvdingfttgrrgdlatihgmnrpflllmatpleraqhlqssrhrraldtnycfssteknccvrqlyidfrkdlgwkwihepkgyhanfclgpcpyiwsldtqyskvlalynqhnpgasaapccvpqaleplpivyyvgrkpkveqlsnmivrsckcs(seqidno:368)。抗炎性多肽可以例如基于其结合至tgfβ上的受体结合位点和/或干扰或阻断tgfβ结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人tgfβ(seqidno:368)的选自由以下组成的组的至少一个氨基酸残基:arg-25、gly-29、trp-30、lys-31、trp-32、ile-33、his-34、tyr-91、val-92、val-93、gly-94、arg-95、lys-96以及pro-97,或者在另一种物种的tgfβ蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人tgfβ(seqidno:368)的选自由以下组成的组的至少一个氨基酸残基:leu-20、ile-22、phe-24、asp-27、leu-28、trp-30、trp-32、tyr-39、phe-43、pro-80、leu-83、leu-101以及ser-112,或者另一种物种的tgfβ蛋白中的等效氨基酸残基。在其他替代方案中,抗炎性多肽可以结合至人tgfβ(seqidno:368)的选自由以下组成的组的至少一个氨基酸残基:asp-27、leu-28、trp-30以及trp-32,或者另一种物种的tgfβ蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人tgfβ(seqidno:368),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与notch1之间的相互作用进行建模,可以使用任何notch1蛋白序列。用于建模的notch1序列通常折叠成功能性notch1蛋白或其钙结合片段。用于建模的notch1蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人notch1,如果预期受试者为牛,则选择牛notch1,等等)来选择。用于建模的序列可以是人notch1序列(genbank登录号aag33848.1),所述序列如下:mppllapllclallpalaargprcsqpgetclnggkceaangteacvcggafvgprcqdpnpclstpcknagtchvvdrrgvadyacscalgfsgplcltpldnacltnpcrnggtcdlltlteykcrcppgwsgkscqqadpcasnpcanggqclpfeasyichcppsfhgptcrqdvnecgqkprlcrhggtchnevgsyrcvcrathtgpncerpyvpcspspcqnggtcrptgdvthecaclpgftgqnceeniddcpgnncknggacvdgvntyncpcppewtgqyctedvdecqlmpnacqnggtchnthggyncvcvngwtgedcseniddcasaacfhgatchdrvasfycecphgrtgllchlndacisnpcnegsncdtnpvngkaictcpsgytgpacsqdvdecslganpcehagkcintlgsfecqclqgytgprceidvnecvsnpcqndatcldqigefqcmcmpgyegvhcevntdecasspclhngrcldkinefqcecptgftghlcqydvdecastpckngakcldgpntytcvctegytgthcevdidecdpdpchygsckdgvatftclcrpgytghhcetninecssqpcrlrgtcqdpdnaylcfclkgttgpnceinlddcasspcdsgtcldkidgyecacepgytgsmcnsnidecagnpchnggtcedgingftcrcpegyhdptclsevnecnsnpcvhgacrdslngykcdcdpgwsgtncdinnnecesnpcvnggtckdmtsgivctcregfsgpncqtninecasnpclnkgtciddvagykcncllpytgatcevvlapcapspcrnggecrqsedyesfscvcptagakgqtcevdinecvlspcrhgascqnthgxyrchcqagysgrncetdiddcrpnpchnggsctdgintafcdclpgfrgtfceedinecasdpcrnganctdcvdsytctcpagfsgihcenntpdctesscfnggtcvdginsftclcppgftgsycqhvvnecdsrpcllggtcqdgrglhrctcpqgytgpncqnlvhwcdsspcknggkcwqthtqyrcecpsgwtglycdvpsvscevaaqrqgvdvarlcqhgglcvdagnthhcrcqagytgsycedlvdecspspcqngatctdylggysckcvagyhgvncseeideclshpcqnggtcldlpntykcscprgtqgvhceinvddcnppvdpvsrspkcfnngtcvdqvggysctcppgfvgercegdvneclsnpcdargtqncvqrvndfhcecraghtgrrcesvingckgkpcknggtcavasntargfickcpagfegatcendartcgslrclnggtcisgprsptclclgpftgpecqfpasspclggnpcynqgtceptsespfyrclcpakfngllchildysfgggagrdippplieeacelpecqedagnkvcslqcnnhacgwdggdcslnfndpwknctqslqcwkyfsdghcdsqcnsagclfdgfdcqraegqcnplydqyckdhfsdghcdqgcnsaecewdgldcaehvperlaagtlvvvvlmppeqlrnssfhflrelsrvlhtnvvfkrdahgqqmifpyygreeelrkhpikraaegwaapdallgqvkasllpggseggrrrreldpmdvrgsivyleidnrqcvqassqcfqsatdvaaflgalaslgslnipykieavqsetveppppaqlhfmyvaaaafvllffvgcgvllsrkrrrqhgqlwfpegfkvseaskkkrreplgedsvglkplknasdgalmddnqnewgdedletkkfrfeepvvlpdlddqtdhrqwtqqhldaadlrmsamaptppqgevdadcmdvnvrgpdgftplmiascsgggletgnseeeedapavisdfiyqgaslhnqtdrtgetalhlaarysrsdaakrlleasadaniqdnmgrtplhaavsadaqgvfqilirnratdldarmhdgttplilaarlavegmledlinshadvnavddlgksalhwaaavnnvdaavvllkngankdmqnnreetplflaaregsyetakvlldhfanrditdhmdrlprdiaqermhhdivrlldeynlvrspqlhgaplggtptlspplcspngylgslkpgvqgkkvrkpsskglacgskeakdlkarrkksqdgkgclldssgmlspvdslesphgylsdvasppllpspfqqspsvplnhlpgmpdthlgighlnvaakpemaalggggrlafetgpprlshlpvasgtstvlgsssggalnftvggstslngqcewlsrlqsgmvpnqynplrgsvapgplstqapslqhgmvgplhsslaasalsqmmsyqglpstrlatqphlvqtqqvqpqnlqmqqqnlqpaniqqqqslqppppppqphlgvssaasghlgrsflsgepsqadvqplgpsslavhtilpqespalptslpsslvppvtaaqfltppsqhsysspvdntpshqlqvpehpfltpspespdqwssssphsnvsdwsegvsspptsmqsqiaripeafk(seqidno:369)。抗炎性多肽可以基于其结合至notch1上的钙结合位点和/或干扰或阻断notch1结合至钙能力的能力来鉴别。例如,抗炎性多肽可以结合至人notch1(seqidno:369)的选自由以下组成的组的至少一个氨基酸残基:phe-1520、gln-1523、arg-1524、glu-1526、ala-1553、glu-1556、trp-1557、cys-1562、his-1602、arg-1684、gln-1685、cys-1686、ser-1691、cys-1693、phe-1694以及phe-1703,或另一种物种的notch1蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人notch1(seqidno:369)的选自由以下组成的组的至少一个氨基酸残基:phe-1520、trp-1557、cys-1562以及phe-1703,或者另一种物种的notch1蛋白中的等效氨基酸残基。在某些实施方案中,本发明的多肽结合至人notch1(seqidno:369),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050、-1075kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与wnt8r之间的相互作用进行建模,可以使用任何wnt8r蛋白序列。用于建模的wnt8r序列通常折叠成功能性wnt8r蛋白或其wnt8结合片段。用于建模的wnt8r蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人wnt8r,如果预期受试者为牛,则选择牛wnt8r,等等)来选择。用于建模的序列可以是例如牛wnt8r序列(ncbi登录号xp_005214377.1),所述序列如下:mewgyllevtsllaalallqrssgaaaasakelacqeitvplckgigynytympnqfnhdtqdeaglevhqfwplveiqcspdlkfflcsmytpicledykkplppcrsvcerakagcaplmrqygfawpdrmrcdrlpeqgnpdtlcmdynrtdlttaassvdgdpvagicyvgnqsldnllgfvlaplviylfigtmfllagfvslfrirsvikqqggptkthkleklmirlglftvlytvpaavvvaclfyeqhnrprweathncpclrdlqpdqarrpdyavfmlkyfmclvvgitsgvwvwsgktleswralctrccwaskgagaagagaagggpggggpgagggggpgaggagslysdvstgltwrsgtassvsypkqmplsqv(seqidno:370)。抗炎性多肽可以基于其结合至wnt8r上的wnt配体结合位点和/或干扰或阻断wnt8r结合至wnt配体(例如wnt8)能力的能力来鉴别。例如,抗炎性多肽可以结合至牛wnt8r(seqidno:370)的选自由以下组成的组的至少一个氨基酸残基:tyr-52、gln-56、phe-57、asn-58、met-91、tyr-100、lys-101、pro-103、pro-105、pro-106、arg-137以及asp-145,或者另一种物种的wnt8r蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至牛wnt8r(seqidno:370)的选自由以下组成的组的至少一个氨基酸残基:tyr-52、phe-57、tyr-100以及asp-145,或者另一种物种的wnt8r蛋白中的等效氨基酸残基。在某些实施方案中,本发明的多肽可以结合至牛wnt8r(seqidno:370),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-875、-900、-925、-950、-975kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与trail之间的相互作用进行建模,可以使用任何trail蛋白序列。在某些实施方案中用于建模的trail序列折叠成功能性trail蛋白或其功能片段。用于建模的trail蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人trail,如果预期受试者为牛,则选择牛trail,等等)来选择。用于建模的序列可以是人trail序列(genbank登录号eaw78466.1),所述序列如下:kekqqnisplvrergpqrvaahitgtrgrsntlsspnsknekalgrkinswessrsghsflsnlhlrngelvihekgfyyiysqtyfrfqeeikentkndkqmvqyiykytsypdpillmksarnscwskdaeyglysiyqggifelkendrifvsvtnehlidmdheasffgaflvg(seqidno:371)。抗炎性多肽可以例如基于其结合至trail上的受体结合位点和/或干扰或阻断trail结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人trail(seqidno:371)的选自由以下组成的组的至少一个氨基酸残基:arg-130、arg-158、ser-159、gly-160、his-161、phe-163、tyr-189、arg-189、gln-193、glu-195、glu-236、tyr-237、leu-239、asp-267、asp-269、his-270以及glu-271,或者在另一种物种的trail蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人trail(seqidno:371)的选自由以下组成的组的至少一个氨基酸残基:ala-123、his-161、ser-162、phe-163、tyr-183、tyr-185、tyr-243、his-270、glu-271、phe-274、phe-278、leu-279以及val-280,或者在另一种物种的trail蛋白中的等效氨基酸残基。在其他替代方案中,抗炎性多肽可以结合至人trail(seqidno:371)的选自由以下组成的组的至少一个氨基酸残基:phe-163、tyr-243、glu-271以及phe-278,或者另一种物种的trail蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人trall(seqidno:371),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与il6r之间的相互作用进行建模,可以使用任何il6r蛋白序列。用于建模的il6r序列通常折叠成功能性il6r蛋白或其il6结合片段。用于建模的il6r蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人il6r,如果预期受试者为牛,则选择牛il6r,等等)来选择。用于建模的序列可以是人il6r序列(ncbi登录号np_786943.1),所述序列如下:mltlqtwlvqalfiflttestgelldpcgyispespvvqlhsnftavcvlkekcmdyfhvnanyivwktnhftipkeqytiinrtassvtftdiaslniqltcniltfgqleqnvygitiisglppekpknlscivnegkkmrcewdggrethletnftlksewathkfadckakrdtptsctvdystvyfvnievwveaenalgkvtsdhinfdpvykvkpnpphnlsvinseelssilkltwtnpsiksviilkyniqyrtkdastwsqippedtastrssftvqdlkpfteyvfrircmkedgkgywsdwseeasgityedniasf(seqidno:372)。抗炎性多肽可以例如基于其结合至il6r上的il6结合位点和/或干扰或阻断il6r结合至其配体il6能力的能力来鉴别。例如,抗炎性多肽可以结合至人il6r(seqidno:372)的选自由以下组成的组的至少一个氨基酸残基:glu-163、gly-164、phe-168、gln-190、phe-229、tyr-230、phe-279以及gln-281,或者在另一种物种的il6r蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人il6r(seqidno:372)的选自由以下组成的组的至少一个氨基酸残基:leu-108、glu-140、pro-162、phe-229、tyr-230以及phe-279,或者在另一种物种的il6r蛋白中的等效氨基酸残基。在其他替代方案中,抗炎性多肽可以结合至人il6r(seqidno:372)的选自由以下组成的组的至少一个氨基酸残基:glu-140、phe-229、tyr-230、phe-279,或者在另一种物种的il6r蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人il6r(seqidno:372),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与il10r之间的相互作用进行建模,可以使用任何适当的il10r蛋白序列。用于建模的il10r序列通常折叠成功能性il10r蛋白或其il10结合片段。用于建模的il10r蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人il10r,如果预期受试者为牛,则选择牛il10r,等等)来选择。用于建模的序列可以是人il10r序列(ncbi登录号np_001549.2),所述序列如下:mlpclvvllaallslrlgsdahgtelpsppsvwfeaeffhhilhwtpipnqsestcyevallrygieswnsisncsqtlsydltavtldlyhsngyrarvravdgsrhsnwtvtntrfsvdevtltvgsvnleihngfilgkiqlprpkmapandtyesifshfreyeiairkvpgnftfthkkvkhenfslltsgevgefcvqvkpsvasrsnkgmwskeecisltrqyftvtnviiffafvlllsgalayclalqlyvrrrkklpsvllfkkpspfifisqrpspetqdtihpldeeaflkvspelknldlhgstdsgfgstkpslqteepqfllpdphpqadrtlgnreppvlgdscssgssnstdsgiclqepslspstgptweqqvgsnsrgqddsgidlvqnsegragdtqggsalghhsppepevpgeedpaavafqgylrqtrcaeekatktgcleeespltdglgpkfgrclvdeaglhppalakgylkqdplemtlassgaptgqwnqpteewsllalsscsdlgisdwsfahdlaplgcvaapggllgsfnsdlvtlplisslqsse(seqidno:373)。抗炎性多肽可以例如基于其结合至il10r上的il10结合位点和/或干扰或阻断il10r结合至其配体il10能力的能力来鉴别。例如,抗炎性多肽可以结合至人il10r(seqidno:373)的选自由以下组成的组的至少一个氨基酸残基:tyr-43、ile-45、glu-46、asp-61、asn-73、arg-76、asn-94、arg-96、phe-143、ala-189、ser-190以及ser-191,或者另一种物种的il6r蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人1l10r(seqidno:373)的选自由以下组成的组的至少一个氨基酸残基:leu-41、arg-42、tyr-43、ile-45、glu-46、ser-47、trp-48、arg-76以及arg-78,或者在另一种物种的il10r蛋白中的等效氨基酸残基。在其他替代方案中,抗炎性多肽可以结合至人il10r(seqidno:373)的选自由以下组成的组的至少一个氨基酸残基:tyr-43、ile-45、glu-46、trp-48,或者在另一种物种的il10r蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人il10r(seqidno:373),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-775、-800、-825、-850、-875、-900kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与egfr之间的相互作用进行建模,可以使用任何egfr蛋白序列。用于建模的egfr序列通常折叠成功能性egfr蛋白或其配体结合片段。用于建模的egfr蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人egfr,如果预期受试者为牛,则选择牛egfr,等等)来选择。可选地,用于建模的序列可以是果蝇egfr序列(genbank登录号aar85273.1),所述序列如下:kicigtksrlsvpsnkehhyrnlrdrytnctyvdgnleltwlpnenldlsfldnirevtgyilishvdvkkvvfpklqiirgrtlfslsveeekyalfvtyskmytleipdlrdvlngqvgfhnnynlchmrtiqwseivsngtdayynydftaperecpkchescthgcwgegpkncqkfskltcspqcaggrcygpkprecchlfcaggctgptqkdciacknffdegvckeecppmrkynpttyvletnpegkyaygatcvkecpghllrdngacvrscpqdkmdkggecvpcngpcpktcpgvtvlhagnidsfrnctvidgnirildqtfsgfqdvyanytmgpryipldperlevfstvkeitgylniegthpqfrnlsyfrnletihgrqlmesmfaalaivksslyslemrnlkqissgsvviqhnrdlcyvsnirwpaiqkepeqkvwvnenlradlcekngticsdqcnedgcwgagtdqclncknfnfngtciadcgyisnaykfdnrtckichpecrtcngagadhcqecvhvrdgqhcvsecpknkyndrgvcrechatcdgctgpkdtigigacttcnlaiinndatvkrcllkddkcpdgyfweyvhpqeqgslkplagravcrkchplcelctnygyheq(seqidno:374)。抗炎性多肽可以例如基于其结合至egfr上的配体结合位点和/或干扰或阻断至少一种配体结合至egfr能力的能力来鉴别。例如,抗炎性多肽可以结合至果蝇egfr(seqidno:374)的选自由以下组成的组的至少一个氨基酸残基:leu-10、thr-40、trp-41、asp-48、phe-51、leu-63、his-66、asp-68、leu-88以及tyr-101,或者在另一种物种的egfr蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至果蝇egfr(seqidno:374)的选自由以下组成的组的至少一个氨基酸残基:trp-41、asp-48、phe-51、asp-68以及tyr-101,或者在另一种物种的egfr蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至果蝇egfr(seqidno:374),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与cdk6之间的相互作用进行建模,可以使用任何cdk6蛋白序列。用于建模的cdk6序列通常折叠成功能性cdk6蛋白或其功能片段。用于建模的cdk6蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人cdk6,如果预期受试者为牛,则选择牛cdk6,等等)来选择。用于建模的序列可以是人cdk6序列(ncbi登录号np_001250.1),所述序列如下:mekdglcradqqyecvaeigegaygkvfkardlknggrfvalkrvrvqtgeegmplstirevavlrhletfehpnvvrlfdvctvsrtdretkltlvfehvdqdlttyldkvpepgvptetikdmmfqllrgldflhshrvvhrdlkpqnilvtssgqikladfglariysfqmaltsvvvtlwyrapevllqssyatpvdlwsvgcifaemfrrkplfrgssdvdqlgkildviglpgeedwprdvalprqafhsksaqpiekfvtdidelgkdlllkcltfnpakrisaysalshpyfqdlerckenldshlppsqntselnta(seqidno:375)。抗炎性多肽可以例如基于其结合至cdk6上的活性位点和/或干扰或阻断cdk6的激酶活性或cdk6使一种或多种cdk6底物磷酸化能力的能力来鉴别。例如,抗炎性多肽可以结合至人cdk6(seqidno:375)的选自由以下组成的组的至少一个氨基酸残基:val-142、arg-144、asp-145、ser-171、val-180、val-181、leu-183、arg-186、val-190、gln-193、tyr-196以及val-200,或者在另一种物种的cdk6蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人cdk6(seqidno:375)的选自由以下组成的组的至少一个氨基酸残基:asp-145、val-180以及tyr-196,或者在另一种物种的cdk6蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人cdk6(seqidno:375),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与组蛋白甲基转移酶(hmt)之间的相互作用进行建模,可以使用任何hmt蛋白序列。用于建模的hmt序列通常折叠成功能性hmt蛋白或其功能片段。用于建模的hmt蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人hmt,如果预期受试者为牛,则选择牛hmt,等等)来选择。用于建模的序列可以是例如绿球藻病毒(parameciumbursariachlorellavirus)1hmt序列(ncbi登录号np_048968.1),所述序列如下:mfndrvivkksplggygvfarksfekgelveeclcivrhnddwgtaledylfsrknmsamalgfgaifnhskdpnarheltaglkrmriftikpiaigeeitisygddywlsrprltqn(seqidno:376)。抗炎性多肽可以例如基于其结合至hmt上的活性位点和/或干扰或阻断hmt的甲基转移酶活性或hmt使组蛋白底物甲基化能力的能力来鉴别。例如,抗炎性多肽可以结合至绿草履虫hmt(seqidno:376)的选自由以下组成的组的至少一个氨基酸残基:asn-69、his-70、ser-71、lys-72、asp-73、pro-74以及asn-75,或者在另一种物种的hmt蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至绿草履虫hmt(seqidno:376)的选自由以下组成的组的至少一个氨基酸残基:tyr-16、glu-48、tyr-50、leu-51、phe-52以及asn-69,或者另一种物种的hmt蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至绿草履虫hmt(seqidno:376),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与cd47蛋白之间的相互作用进行建模,可以使用任何cd47蛋白序列。用于建模的cd47序列通常折叠成功能性cd47蛋白或其sirp-α-结合部分。用于建模的cd47蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人cd47,如果预期受试者为牛,则选择牛cd47,等等)来选择。用于建模的序列可以是人cd47序列(ncbi登录号xp_005247966.1),所述序列如下:mwplvaalllgsaccgsaqllfnktksveftfcndtvvipcfvtnmeaqnttevyvkwkfkgrdiytfdgalnkstvptdfssakievsqllkgdaslkmdksdavshtgnytcevteltregetiielkyrvvswfspnenilivifpifaillfwgqfgiktlkyrsggmdektiallvaglvitvivivgailfvpgeyslknatglglivtstgilillhyyvfstaigltsfviailviqviayilavvglslciaacipmhgpllisglsilalaqllglvymkfve(seqidno:377)。抗炎性多肽可以例如基于其结合至hmt上的sirp-α-结合位点和/或干扰或阻断cd47结合至sirp-α能力的能力来鉴别。例如,抗炎性多肽可以结合至cd47(seqidno:377)的选自由以下组成的组的至少一个氨基酸残基:glu-29、ala-30、glu-35、val-36、tyr-37、lys-39、thr-49、asp-51、glu-97、thr-99、leu-101、thr-102、arg-103、glu-104以及glu-106,或者在另一种物种的cd47蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至cd47(seqidno:377)的选自由以下组成的组的至少一个氨基酸残基:glu-29、glu-35、lys-39、glu-97、leu-101、thr-102、arg-103、glu-104以及glu-106,或者在另一种物种的cd47蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人cd47(seqidno:377)的选自由以下组成的组的至少一个氨基酸残基:tyr-16、glu-48、tyr-50、leu-51、phe-52以及asn-6tyr-37、thr-49、phe-50、asp-51、ala-53、glu-97、val-98、glu-100、leu-101、thr-102、glu-104、glu-106、gly-107,或者在另一种物种的cd47蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至cd47(seqidno:377)的选自由以下组成的组的至少一个氨基酸残基:tyr-37、glu-97、glu-100、leu-101、glu-104、glu-106,或者在另一种物种的cd47蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人cd47(seqidno:377),其中亲和力为至少-550kcal/mol,并且在某些实施方案中为至少-600、-650、-675、-700、-725、-750、-775、-800kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与sirp-α之间的相互作用进行建模,可以使用任何sirp-α蛋白序列。用于建模的sirp-α序列通常折叠成功能性sirp-α蛋白或其cd47-结合片段。用于建模的sirp-α蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人sirp-α,如果预期受试者为牛,则选择牛sirp-α,等等)来选择。用于建模的序列可以是人sirp-α序列(genbank登录号aah26692.1),所述序列如下:mepagpapgrlgpllclllaascawsgvageeelqviqpdksvsvaagesailhctvtslipvgpiqwfrgagpareliynqkeghfprvttvsestkrenmdfsisisnitpadagtyycvkfrkgspdtefksgagtelsvrakpsapvvsgpaaratpqhtvsftceshgfsprditlkwfkngnelsdfqtnvdpvgesvsysihstakvvltredvhsqvicevahvtlqgdplrgtanlsetirvpptlevtqqpvraenqvnvtcqvrkfypqrlqltwlengnvsrtetastvtenkdgtynwmswllvnvsahrddvkltcqvehdgqpavskshdlkvsahpkeqgsntaaentgsnerniyivvgvvctllvallmaalylvrirqkkaqgstsstrlhepeknareitqvqsldtndityadlnlpkgkkpapqaaepnnhteyasiqtspqpasedtltyadldmvhlnrtpkqpapkpepsfseyasvqvprk(seqidno:378)。抗炎性多肽可以例如基于其结合至sirp-α上的hmt-结合位点和/或干扰或阻断sirp-α结合至hmt能力的能力来鉴别。例如,抗炎性多肽可以结合至sirp-α(seqidno:378)的选自由以下组成的组的至少一个氨基酸残基:leu-30、gln-37、gln-52、lys-53、ser-66、thr-67、arg-69、met-72、phe-74、lys-96以及asp-100,或者在另一种物种的sirp-α蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人sirp-α(seqidno:378)的选自由以下组成的组的至少一个氨基酸残基:tyr-50、gln-52、pro-58、ser-66、thr-67以及ser-77,或者在另一种物种的sirp-α蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至sirp-α(seqidno:378)的选自由以下组成的组的至少一个氨基酸残基:tyr-50、gln-52、ser-66以及thr-67,或者在另一种物种的sirp-α蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人sirp-α(seqidno:378),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-825、-850、-875、-900、-925、-950、-975、-1000kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与cd206之间的相互作用进行建模,可以使用任何cd206蛋白序列。用于建模的cd206序列通常折叠成功能性cd206蛋白或其甘露糖结合片段。用于建模的cd206蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人cd206,如果预期受试者为牛,则选择牛cd206,等等)来选择。用于建模的序列可以是人cd206序列(ncbi登录号np_002429.1),所述序列如下:mrlplllvfasvipgavllldtrqfliynedhkrcvdavspsavqtaacnqdaesqkfrwvsesqimsvafklclgvpsktdwvaitlyacdsksefqkweckndtllgikgedlffnygnrqeknimlykgsglwsrwkiygttdnlcsrgyeamytllgnangatcafpfkfenkwyadctsagrsdgwlwcgtttdydtdklfgycplkfegseslwnkdpltsvsyqinsksaltwhqarkscqqqnaellsiteiheqtyltgltssltsglwiglnslsfnsgwqwsdrspfrylnwlpgspsaepgkscvslnpgknakwenlecvqklgyickkgnttlnsfvipsesdvpthcpsqwwpyaghcykihrdekkiqrdalttcrkeggdltsihtieeldfiisqlgyepndelwiglndikiqmyfewsdgtpvtftkwlrgepshennrqedcvvmkgkdgywadrgcewplgyickmksrsqgpeivevekgcrkgwkkhhfycymightlstfaeanqtcnnenaylttiedryeqafltsfvglrpekyfwtglsdiqtkgtfqwtieeevrfthwnsdmpgrkpgcvamrtgiagglwdvlkcdekakfvckhwaegvthppkptttpepkcpedwgassrtslcfklyakgkhekktwfesrdfcralggdlasinnkeeqqtiwrlitasgsyhklfwlgltygspsegftwsdgspvsyenwaygepnnyqnveycgelkgdptmswndincehlnnwicqiqkgqtpkpeptpapqdnppvtedgwviykdyqyyfskeketmdnarafckrnfgdlvsiqsesekkflwkyvnrndaqsayfigllisldkkfawmdgskvdyvswatgepnfanedencvtmysnsgfwndincgypnaficqrhnssinattvmptmpsvpsgckegwnfysnkcfkifgfmeeerknwqearkacigfggnlvsiqnekeqafltyhmkdstfsawtglndvnsehtflwtdgrgvhytnwgkgypggrrsslsyedadcvviiggasneagkwmddtcdskrgyicqtrsdpsltnppatiqtdgfvkygkssyslmrqkfqwheaetycklhnsliasildpysnafawlqmetsnervwialnsnltdnqytwtdkwrvrytnwaadepklksacvyldldgywktahcnesfyflckrsdeipateppqlpgrcpesdhtawipfhghcyyiessytrnwgqasleclrmgsslvsiesaaessflsyrveplksktnfwiglfrnvegtwlwinnspvsfvnwntgdpsgerndcvalhassgfwsnihcssykgyickrpkiidakpthellttkadtrkmdpskpssnvagvviivilliltgaglaayffykkrrvhlpqegafentlyfnsqsspgtsdmkdlvgnieqnehsvi(seqidno:379)。抗炎性多肽可以例如基于其结合至cd206上的甘露糖结合位点和/或干扰或阻断sirp-甘露糖结合至cd206能力的能力来鉴别。例如,抗炎性多肽可以结合至cd206(seqidno:379)的选自由以下组成的组的至少一个氨基酸残基:glu-725、tyr-729、glu-733、asn-747以及asp-748,或者在另一种物种的cd206蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人cd206(seqidno:379)的选自由以下组成的组的至少一个氨基酸残基:phe-708、thr-709、trp-710、pro-714。glu-719、asn-720、trp-721、ala-722、glu-725、tyr-729、glu-733、asn-747、asp-748、ser-1691、cys-1693、phe-1694以及phe-1703,或者在另一种物种的cd206蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至cd206(seqidno:379)的选自由以下组成的组的至少一个氨基酸残基:phe-708、trp-710、trp-721、glu-725、tyr-729、glu-733,或者在另一种物种的cd206蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人cd206(seqidno:379),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与tgm2之间的相互作用进行建模,可以使用任何tgm2蛋白序列。用于建模的tgm2序列通常折叠成功能性tgm2蛋白或其酰基转移酶催化片段。用于建模的tgm2蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人tgm2,如果预期受试者为牛,则选择牛tgm2,等等)来选择。用于建模的序列可以是人tgm2序列(genbank登录号aab95430.1),所述序列如下:mmdaskelqvlhidflnqdnavshhtwefqtsspvfrrgqvfhlrlvlnqplqsyhqlklefstgpnpsiakhtlvvldprtpsdhynwqatlqnesgkevtvavtsspnailgkyqlnvktgnhilkseenilyllfnpwckedmvfmpdederkeyilndtgchyvgaarsikckpwnfgqfeknvldccislltesslkptdrrdpvlvcramcammsfekgqgvlignwtgdyeggtapykwtgsapilqqyyntkqavcfgqcwvfagilttvlralgiparsvtgfdsahdternltvdtyvnengekitsmthdsvwnfhvwtdawmkrpdlpkgydgwqavdatpqersqgvfccgpspltairkgdifivydtrfvfsevngdrliwlvkmvngqeelhvismettsigknistkavgqdrrrdityeykypegsseerqvmdhaflllsserehrrpvkenflhmsvqsddvllgnsvnftvilkrktaalqnvnilgsfelqlytgkkmaklcdlnktsqiqgqvsevtltldsktyinslailddepvirgfiiaeiveskeimasevftsfqypefsielpntgrigqllvcncifkntlaipltdvkfsleslgisslqtsdhgtvqpgetiqsqikctpiktgpkkfivklsskqvkeinaqkivlitk(seqidno:380)。抗炎性多肽可以例如基于其结合至tgm2上的活性位点和/或干扰或阻断tgm2的酰基转移酶活性的能力来鉴别。例如,抗炎性多肽可以结合至tgm2的选自由以下组成的组的至少一个氨基酸残基(seqidno:380):cys-277、his-335和asp-358,或者在另一种物种的tgm2蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人tgm2(seqidno:380),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与血清白蛋白之间的相互作用进行建模,可以使用任何血清白蛋白序列。用于建模的血清白蛋白序列通常折叠成功能性血清白蛋白或其功能片段。用于建模的血清白蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人血清白蛋白(hsa),如果预期受试者为牛,则选择牛血清白蛋白(bsa),等等)来选择。用于建模的序列可以是人血清白蛋白(hsa)序列(ncbi登录号np_000468.1),所述序列如下:dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl(seqidno:381)。抗炎性多肽可以例如基于其在生理条件下(例如,在血流中)结合至hsa的能力来鉴别。在某些实施方案中,抗炎性多肽可以结合至hsa(seqidno:381),其中亲和力为至少-650kcal/mol,并且在某些实施方案中为至少-700、-750、-800、-850、-900、-925、-950、-975、-1000、-1025、-1050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。在某些实施方案中,抗炎性多肽结合至两个或更多个靶标(例如,促炎性靶标)。在一些实施方案中,抗炎性多肽结合至三个、四个、五个或更多个促炎性靶标。例如,抗炎性多肽可以结合至本文所公开的靶标的任何组合。此类结合可以是基于计算机数据、体外数据或体内数据。因此,抗炎性多肽可以结合至两个或更多个nf-kbii类亚基(例如,relb和至少一个其他nf-kbii类亚基,诸如rela、crel、nf-kb1或nf-kb2)。可选地(或另外地),抗炎性多肽可以结合至nf-kbii类亚基(例如,relb)和至少一个其他信号分子(例如,选自由以下组成的组的至少一个信号分子:tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr、cdk6、cd206、cd47、sirp-α、hmt以及tgm2)。例如,抗炎性多肽可以结合至nf-kbii类亚基(例如,relb)和选自由以下组成的组的至少一个信号分子:tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr以及cdk6。可选地,抗炎性多肽可以结合至nf-kbii类亚基(例如,relb)和选自由以下组成的组的至少一个信号分子:cd206、cd47、sirp-α以及tgm2。在其他替代方案中,抗炎性多肽可以结合至nf-kbii类亚基(例如,re1b)和hmt。在其他替代方案中,抗炎性多肽可以结合至选自由tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr以及cdk6组成的组的至少一个信号分子和选自由cd206、cd47、sirp-α以及tgm2组成的组的至少一个信号分子。在其他替代方案中,抗炎性多肽可以结合至选自由tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr以及cdk6组成的组的至少一个信号分子,并且还结合至hmt。仍在其他实施方案中,抗炎性多肽可以结合至nf-kbii类亚基(例如,relb)、选自由tgfβ、notch1、wnt8r、trail、il6r、il10r、egfr以及cdk6组成的组的至少一个信号分子、选自由cd206、cd47、sirp-α以及tgm2组成的组的至少一个信号分子以及还有hmt。在某些实施方案中,抗炎性多肽结合至两个或更多个促炎性靶标以及还有血清白蛋白(例如,人血清白蛋白)。对于对潜在抗炎性多肽与legumain之间的相互作用进行建模,可以使用任何legumain蛋白序列。用于建模的legumain序列通常折叠成功能性legumain蛋白或其功能片段。用于建模的legumain蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人legumain,如果预期受试者为牛,则选择牛legumain,等等)来选择。用于建模的序列可以是人legumain序列(genbank登录号aah03061.1)。mvwkvavflsvalgigaipiddpedggkhwvvivagsngwynyrhqadachayqiihrngipdeqivvmmyddiaysednptpgivinrpngtdvyqgvpkdytgedvtpqnflavlrgdaeavkgigsgkvlksgpqdhvfiyftdhgstgilvfpnedlhvkdlnetihymykhkmyrkmvfyieacesgsmmnhlpdninvyattaanpressyacyydekrstylgdwysvnwmedsdvedltketlhkqyhlvkshtntshvmqygnktistmkvmqfqgmkrkasspvplppvthldltpspdvpltimkrklmntndleesrqlteeiqrhldarhlieksvrkivsllaaseaeveqllserapltghscypeallhfrthcfnwhsptyeyalrhlyvlvnlcekpyplhriklsmdhvclghy(seqidno:413)。抗炎性多肽可以例如基于其结合至legumain上的活性位点和/或干扰或阻断legumain结合至其靶标能力的能力来鉴别。例如,抗炎性多肽可以结合至人legumain(seqidno:413)的选自由以下组成的组的至少一个氨基酸残基:asn-44、arg-46、his-159、glu-189、cys-191、ser-217、ser-218以及asp-233,或者另一种物种的legumain蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人legumain(seqidno:413)的选自由以下组成的组的至少一个氨基酸残基:asn-44、glu-189和asp-233,或者在另一种物种的legumain蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人legumain(seqidno:413),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与cd209之间的相互作用进行建模,可以使用任何cd209蛋白序列。用于建模的cd209序列通常折叠成功能性cd209蛋白或其功能片段。用于建模的cd209蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人cd209,如果预期受试者为牛,则选择牛cd209,等等)来选择。用于建模的序列可以是人cd209序列(genbank登录号np_001138366.1)。msdskeprlqqlgllvskvpssisqeqsrqdaiyqnltqlkaavgelseksklqeiyqeltqlkaavgelpeksklqeiyqeltrlkaavgelpeksklqeiyqeltwlkaavgelpekskmqeiyqeltrlkaavgelpekskqqeiyqeltrlkaavgelpekskqqeiyqeltrlkaavgelpekskqqeiyqeltqlkaaverlchpcpwewtffqgncyfmsnsqrnwhdsitackevgaqlvviksaeeqnflqlqssrsnrftwmglsdlnqegtwqwvdgspllpsfkqywnrgepnnvgeedcaefsgngwnddkcnlakfwickksaascsrdeeqflspapatpnpppa(seqidno:414)抗炎性多肽可以例如基于其结合至cd209上的活性位点和/或干扰或阻断cd209结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人cd209(seqidno:414)的选自由以下组成的组的至少一个氨基酸残基:phe-269、glu-280、glu-303、asn-305、asn-306、glu-310、asp-311、ser-316、gly-317、asn-321以及lys-324,或者另一种物种的cd209蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人cd209(seqidno:414)的选自由以下组成的组的至少一个氨基酸残基:phe-269、glu-280、glu-303、glu-310、asp-311、asn-321以及lys-324,或者另一种物种的cd209蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人cd209(seqidno:414),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-1,000、-1,050kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与fas之间的相互作用进行建模,可以使用任何fas蛋白序列。用于建模的fas序列通常折叠成功能性fas蛋白或其功能片段。用于建模的fas蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人fas,如果预期受试者为牛,则选择牛fas,等等)来选择。用于建模的序列可以是人fas序列(ncbi参考序列:np_000034.1)。mlgiwtllplvltsvarlssksvnaqvtdinskglelrktvttvetqnleglhhdgqfchkpcppgerkardctvngdepdcvpcqegkeytdkahfsskcrrcrlcdeghgleveinctrtqntkcrckpnffcnstvcehcdpctkcehgiikectltsntkckeegsrsnlgwlcllllpiplivwvkrkevqktcrkhrkenqgshesptlnpetvainlsdvdlskyittiagvmtlsqvkgfvrkngvneakideikndnvqdtaeqkvqllrnwhqlhgkkeaydtlikdlkkanlctlaekiqtiilkditsdsensnfrneiqslv(seqidno:415)。抗炎性多肽可以例如基于其结合至fas上的活性位点和/或干扰或阻断fas结合至其配体能力的能力来鉴别。例如,抗炎性多肽可以结合至人fas(seqidno:415)的选自由以下组成的组的至少一个氨基酸残基:lys-251、lys-296、lys-299、leu-303、leu-306、ala-307、glu-308、lys-309、gln-311、ile-314、leu-315、asp-317、ile-318以及thr-319,或者另一种物种的fas蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人fas(seqidno:415)的选自由以下组成的组的至少一个氨基酸残基:lys-296、lys-299、leu-306、ala-307、glu-308、ile-314、leu-315、asp-317以及ile-318,或者另一种物种的fas蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人fas(seqidno:415),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。程序性细胞死亡蛋白1也称为pd-1和cd279(分化簇279),它是人中由pdcd1基因编码的蛋白质。pd-1为属于免疫球蛋白超家族的细胞表面受体并且在t细胞和促b细胞上表达。pd-1结合至两个配体pd-l1和pd-l2。pd-1用作免疫检查点,在通过防止t细胞活化来下调免疫系统方面起重要作用,这进而减少自身免疫并促进自身耐受。pd-1的抑制作用通过促进淋巴结中抗原特异性t细胞中的细胞凋亡(程序性细胞死亡)同时减少调节性t细胞(抑制性t细胞)中的细胞凋亡的双机制来实现。对于对潜在抗炎性多肽与pd-1之间的相互作用进行建模,可以使用任何pd-1蛋白序列。用于建模的pd-1序列通常折叠成功能性pd-1蛋白或其功能片段。用于建模的pd-1蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人pd-1,如果预期受试者为牛,则选择牛pd-1,等等)来选择。用于建模的序列可以是人pd-1序列(基因座:xp_006712636.1)。mqipqapwpvvwavlqlgwrpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvvgvvggllgslvllvwvlavicsraarg(seqidno:416)。抗炎性多肽可以例如基于其结合至pd-1上的活性位点和/或干扰或阻断pd-1结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人pd-1(seqidno:416)的选自由以下组成的组的至少一个氨基酸残基:val-64、asn-66、tyr-68、met-70、thr-76、lys-78、thr-120、leu-122、ala-125、ser-127,或者在另一种物种的pd-1蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人pd-1(seqidno:416)的选自由以下组成的组的至少一个氨基酸残基:tyr-68、met-70、lys-78以及leu-122,或者在另一种物种的pd-1蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人pd-1(seqidno:416),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-1,000kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。双特异性促分裂原活化蛋白激酶7也称为map激酶激酶7或mkk7,它是人中由map2k7基因编码的酶。此蛋白是促分裂原活化蛋白激酶激酶家族的成员。mkk7蛋白作为具有三个可能的n-末端(α、β和γ亚型)和两个可能的c末端(1和2亚型)的六种不同亚型存在。mkk7涉及介导对促炎性细胞因子的细胞反应的信号转导以及环境应激。此激酶特异性活化mapk8/jnk1和mapk9/jnk2,并且此激酶本身通过map激酶激酶激酶磷酸化和活化,所述激酶包括map3k1/mekk1、map3k2/mekk2、map3k3/mekk5以及map4k2/gck。对于对潜在抗炎性多肽与mkk7之间的相互作用进行建模,可以使用任何mkk7蛋白序列。用于建模的mkk7序列通常折叠成功能性mkk7蛋白或其功能片段。用于建模的mkk7蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人mkk7,如果预期受试者为牛,则选择牛mkk7,等等)来选择。用于建模的序列可以是人mkk7序列(ncbi参考序列:np_001284484.1)。maassleqklsrleaklkqenrearrridlnldispqrprpiivitlspapapsqraalqlplandggsrspssesspqhptpparprhmlglpstlftprsmesieidqklqeimkqtgyltiggqryqaeindlenlgemgsgtcgqvwkmrfrktghviavkqmrrsgnkeenkrilmdldvvlkshdcpyivqcfgtfitntdvfiamelmgtcaeklkkrmqgpiperilgkmtvaivkalyylkekhgvihrdvkpsnilldergqiklcdfgisgrlvdskaktrsagcaaymaperidppdptkpdydiradvwslgislvelatgqfpykncktdfevltkvlqeeppllpghmgfsgdfqsfvkdcltkdhrkrpkynkllehsfikryetlevdvaswfkdvmaktesprtsgvlsqphlpffr(seqidno:417)。抗炎性多肽可以例如基于其结合至mkk7上的活性位点和/或干扰或阻断mkk7结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人mkk7(seqidno:417)的选自由以下组成的组的至少一个氨基酸残基:met-142、val-150、lys-152、lys-165、met-212、met-215、thr-217、lys-221、leu-266、cys-276以及asp-277,或者另一种物种的mkk7蛋白中的等效氨基酸残基。可选地,抗炎性多肽可以结合至人mkk7(seqidno:417)的选自由以下组成的组的至少一个氨基酸残基:met-142、val-150、lys-165、met-212、met-215、leu-266以及asp-277,或者另一种物种的mkk7蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人mkk7(seqidno:417),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-1,000kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。对于对潜在抗炎性多肽与核糖核苷酸还原酶(rnr)之间的相互作用进行建模,可以使用任何rnr蛋白序列。用于建模的rnr序列通常折叠成功能性rnr蛋白或其功能片段。用于建模的rnr蛋白序列可以基于抗炎性多肽预期治疗的受试者类型(例如,如果预期的受试者是人,则选择人rnr,如果预期受试者为牛,则选择牛rnr,等等)来选择。用于建模的序列可以是人rnr序列(genbank:ajv34160.1)。myvykrdgrkepvqfdkitarisrlcygldpkhidavkvtqriisgvyegvttieldnlaaetcaymttvhpdyatlaariaisnlhkqttkqfskvvedlyryvnaatgkpapmisddvynivmenkdklnsaivydrdfqysyfgfktlersyllringqvaerpqhlimrvalgihgrdieaaletynlmslkyythasptlfnagtpkpqmsscflvamkedsiegiydtlkecalisktaggiglhihnirstgsyiagtngtsnglipmirvfnntaryvdqggnkrpgafalylepwhadifdfidirknhgkeeirardlfpalwipdlfmkrveengtwtlfsptsapglsdcygdefealytryekegrgktikaqklwysileaqtetgtpfvvykdacnrksnqknlgvikssnlcceiveysapdetavcnlasvalpafietsedgktstynfkklheiakvvtrnlnrvidrnyypveearksnmrhrpialgvqgladtfmllrlpfdseearllniqifetiyhasmeascelaqkdgpyetfqgspasqgilqfdmwdqkpygmwdwdtlrkdimkhgirnsltmapmptastsqilgynecfepvtsnmysrrvlsgefqvvnpyllrdlvdlgiwdegmkqylitqngsiqglpnvpqelkdlyktvweisqktiinmaadrsvyidqshslnlflraptmgkltsmhfygwkkglktgmyylrtqaasaaiqftidqkiadqatenvadisnlkrpsympssasyaasdfvpaavtanatipsldssseasreaspaptgshsltkgmaelnvqeskvevpevpaptkneekaapivddeetefdiynskviacaidnpeacemcsg(seqidno:418)。抗炎性多肽可以例如基于其结合至rnr上的活性位点和/或干扰或阻断rnr结合至其受体能力的能力来鉴别。例如,抗炎性多肽可以结合至人rnr(seqidno:418)的选自由以下组成的组的至少一个氨基酸残基:asn-426、leu-427、cys-428、glu-430、met-606、pro-608以及ala-610,或者在另一种物种的rnr蛋白中的等效氨基酸残基。在某些实施方案中,抗炎性多肽可以结合至人rnr(seqidno:418),其中亲和力为至少-600kcal/mol,并且在某些实施方案中为至少-650、-700、-750、-800、-850、-900、-925、-950、-1,000kcal/mol或更大。需要的结合亲和力可以对应于可以在体外或体内检测到的结合亲和力。可选地,需要的结合亲和力可以对应于可以在计算机上例如使用clusprotm算法检测到的结合亲和力。排除的多肽本发明的组合物任选地排除满足在本申请提交之前本领域已知的本文所述的结构算法的多肽。各种出版物已讨论了合成和天然存在的抗炎性多肽和/或具有条带性亲疏序列的多肽,包括例如美国专利申请号2012/0270770和2003/0109452以及美国专利号6,559,281。因此,此类出版物中描述的一种或多种多肽和/或此类多肽的用途可以从目前公开的组合物和/或方法的范围中排除。例如,肽rp-398(seqidno:155)任选地从本文所述的组合物和/或使用此类组合物的方法中排除。另外,以下表3-9中公开的任一种多肽可以任选地从本文公开的组合物和/或使用此类化合物的方法中排除。连接的抗炎性多肽组合本发明进一步包括已连接在一起的任何两个抗炎性多肽。连接可以通过将第一抗炎性多肽的c-末端连接至第二抗炎性多肽的n-末端的肽接头形成,所述肽接头诸如gly-gly-gly(ggg)、gly-gly-gly-arg(gggr)、gly-pro-gly(gpg)或gly-pro-gly-arg(gpgr)序列。可选地,键联可以是类肽接头(例如,以上肽接头中任一种的聚n-取代形式)、含有g-氨基酸的聚合物(例如,与以上肽接头中任一种相对应)或非肽化学接头。连接的抗炎性多肽可以是本文所公开的多肽中的任一种(例如,在表3-9中),并且可以包括连接来形成同源二聚物的相同多肽或连接来形成异源二聚物的不同多肽。用于经由肽接头和非肽接头连接多个肽的技术为本领域已熟知的,并且预期发明性多肽组合包括所有此类键联。抗炎性多肽可以经由可降解键联诸如二硫键连接至另一个分子。二硫键可以通过抗炎性多肽中可见的半胱氨酸残基的巯基和其他分子中的巯基来介导。半胱氨酸残基可以例如位于抗炎性多肽的c-末端或n-末端。具体实例包括rp-433(fakkfakkfkc,seqidno:384)和rp-434(kfrkafkrffc;seqidno:385),尽管本文所公开的任何肽可以类似地修饰。使用这种类型的二硫键联,本发明的多肽可以便利地连接至各种类型的有用分子。例如,键联可以是使用另一种抗炎性多肽(其任选地包含c-末端或n-末端半胱氨酸残基)、荧光标签(例如,dylight350)、化学治疗剂(例如,通过将巯基添加到紫杉酚环结构上的适当位点,接着使用本发明的含有半胱氨酸的肽氧化来形成的紫杉酚衍生物)等。连接的抗炎性多肽(例如,同源二聚物或异源二聚物)可以结合至靶标分子(例如,靶标蛋白,诸如促炎性信号蛋白),其中结合能大于单独的单体多肽的结合能。因此,例如,连接的抗炎性多肽与nf-kbii类蛋白(例如,relb)的结合能可以是至少-700kcal/mol,并且在一些实施方案中是至少-750、-800、-900、-1000、-1100、-1200、-1250、-1300、-1350、-1400、-1425、-1450、-1475、-1500、-1525、-1550、-1575、-1600kcal/mol或更大。结合能可以例如在计算机上、在体外或在体内使用本领域已熟知的方法(例如,使用clusprotm算法)来测定。修饰的多肽本发明的实施方案包括通过化学或遗传手段对本发明的抗炎性多肽中的任一种进行的修饰。此类修饰的实例包括具有l或d形式的非天然氨基酸和/或天然氨基酸的部分或完全序列的多肽的结构。例如,本文所公开的任一种多肽及其任何变体均可以全部d形式产生。另外,本发明的多肽可以被修饰来含有碳水化合物或脂质部分,诸如糖或脂肪酸,其共价连接至氨基酸的n-末端或c-末端的侧链。另外,本发明的多肽可以被修饰来增强在施用时的溶解度和/或半衰期。例如,聚乙二醇(peg)和相关聚合物已用于增强蛋白质治疗剂在血液中的溶解度和半衰期。因此,本发明的多肽可以通过peg聚合物等来修饰。本发明的多肽也可以被修饰来含有硫、磷、卤素、金属等。并且氨基酸模拟物可以用于产生本发明的多肽(例如,具有基于结构算法的结构或者与本文所公开的抗炎性多肽中任一种类似的结构)。在某些实施方案中,包含氨基酸模拟物的本发明的多肽具有增强的特性,诸如对降解的抗性。例如,本发明的多肽可以包含一个或多个(例如,所有)类肽单体。组合物本发明的组合物包含满足本文所述的结构算法的抗炎性多肽。例如,抗炎性多肽具有条带性亲疏区域,所述区域具有与式i-liv中任一项相符的序列。具体地说,抗炎性多肽可以是表3-9中列出中的任一种多肽或其片段或变体。通常,在本发明的组合物中包含的抗炎性多肽将是合成的多肽(例如,通过化学合成制成和/或重组产生的)。本发明的组合物可以包含单一抗炎性多肽或其组合。所述组合物可以基本上不含有不满足本文所公开的结构算法的蛋白质和其他多肽。如本文所用的,术语“基本上不含蛋白质和其他多肽”意味着小于5%的组合物的蛋白质含量由不是本发明的抗炎性多肽的蛋白质和其他多肽构成。基本上不含本发明的非抗炎性多肽的组合物可以具有小于4%、3%、2%、1%、0.5%、0.1%、0.05%、0.01%或更少的并不满足本文所公开的结构算法的蛋白质或其他多肽。因此,组合物可以基本上不含血液蛋白,诸如血清白蛋白、球蛋白、纤维蛋白原以及凝血因子。可选地,组合物可以基本上不含球蛋白、纤维蛋白原和凝血因子,但是可以包含纯化或重组产生的血清白蛋白。在某些实施方案中,本发明的组合物含有在人或其他哺乳动物或动物中不天然存在的抗炎性多肽。然而,本发明的组合物可以包含在人或其他哺乳动物或动物中天然存在的抗炎性多肽,条件是所述组合物基本上不含与体内抗炎性多肽缔合或与抗炎性多肽共同纯化的生物分子(诸如,非抗炎性多肽、核酸、脂质、碳水化合物以及代谢物)。如本文所用的,术语“基本上不含生物分子”意味着小于5%的组合物干重由不是抗炎性多肽的生物分子构成。基本上不含此类生物分子的组合物可以具有小于4%、3%、2%、1%、0.5%、0.1%、0.05%、0.01%或更小的不是抗炎性多肽的生物分子。因此,例如,组合物可以基本上不含血液中富含的生物分子,诸如以上讨论的蛋白质、脂肪酸、胆固醇、非蛋白凝血因子、代谢物等。另外,组合物可以基本上不含细胞,包括红血细胞、白血细胞和血小板以及细胞碎片。本发明的组合物可以包含至少1mg(例如,至少5、10、20、30、40、50、75、100、150、200、250、300、400、500、600、700、800、900、1000mg或更多)的抗炎性多肽。因此,例如,组合物可以包含等于约1mg至约1000mg的量的抗炎性多肽(例如,约5mg至约900mg、约5mg至约800mg、约5mg至约700mg、约5mg至约600mg、约10mg至约500mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约50mg至约500mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约75mg至约500mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg、约75mg至约100mg、约100mg至约500mg、约100mg至约400mg、约100mg至约300mg、约100mg至约250mg、约100mg至约200mg或含有两个以上端点的任何其他范围)。本发明的组合物可以包含含有至少1mg/ml(例如,至少5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100mg/ml或更多)的抗炎性多肽的溶液。因此,例如,组合物可以包含具有约1mg/ml至约1000mg/ml(例如,约5mg/ml至约900mg/ml、约5mg/ml至约800mg/ml、约5mg/ml至约700mg/ml、约5mg/ml至约600mg/ml、约5mg/ml至约500mg/ml、约10mg/ml至约500mg/ml、约10mg/ml至约400mg/ml、约10mg/ml至约300mg/ml、约10mg/ml至约250mg/ml、约10mg/ml至约200mg/ml、约10mg/ml至约150mg/ml、约10mg/ml至约100mg/ml、约50mg/ml至约500mg/ml、约50mg/ml至约400mg/ml、约50mg/ml至约300mg/ml、约50mg/ml至约250mg/ml、约50mg/ml至约200mg/ml、约50mg/ml至约150mg/ml、约50mg/ml至约100mg/ml、约75mg/ml至约500mg/ml、约75mg/ml至约400mg/ml、约75mg/ml至约300mg/ml、约75mg/ml至约250mg/ml、约75mg/ml至约200mg/ml、约75mg/ml至约150mg/ml、约75mg/ml至约100mg/ml、约100mg/ml至约500mg/ml、约100mg/ml至约400mg/ml、约100mg/ml至约300mg/ml、约100mg/ml至约250mg/ml、约100mg/ml至约200mg/ml、约10mg/ml至约150mg/ml或含有两个以上端点的任何其他范围)的抗炎性多肽抗炎性多肽浓度的溶液。本发明的组合物包括药物组合物。此类药物组合物可以包含一种或多种抗炎性多肽和药学上可接受的载体。药物组合物可以进一步包含除本发明的抗炎性多肽之外的蛋白质和/或化学治疗剂。其他蛋白质可以是治疗剂,诸如治疗抗体。治疗蛋白或抗体可以具有抗炎特性或者本发明的抗炎性多肽所增强的或者增强本发明的抗炎性多肽的其他特性。可选地,其他蛋白质可以是载体蛋白,诸如血清白蛋白(例如,hsa)。血清白蛋白(例如,has、bsa等)可以是纯化或重组产生的。通过将药物组合物中的抗炎性多肽与血清白蛋白混合,抗炎性多肽可以有效地“装载”到血清白蛋白上,从而允许将更大量的抗炎性多肽成功地递送至炎症部位。化学治疗剂可以是例如抗癌性化学治疗剂。此类化学治疗剂包括但不限于吉西他滨、多西他赛、博莱霉素、埃罗替尼、吉非替尼、拉帕替尼、伊马替尼、达沙替尼、尼罗替尼、伯舒替尼、克唑替尼(crizotinib)、色瑞替尼(ceritinib)、曲美替尼(trametinib)、贝伐单抗、舒尼替尼、索拉非尼、曲妥珠单抗、ado-trastuzumabemtansine、利妥昔单抗、依匹单抗(ipilimumab)、雷帕霉素(rapamycin)、坦西莫司(temsirolimus)、依维莫司、甲氨蝶呤、阿霉素、abraxane、folfirinox、顺铂、卡铂、5-氟脲嘧啶、teysumo、紫杉酚、脱氢可的松、左甲状腺素以及培美曲塞(pemetrexed)。方法本发明的抗炎性多肽提供用于减少炎症和/或治疗与过量炎症相关的病状(无论是急性还是慢性)的强效工具。如本文所用的,术语“治疗(treat/treating)”和类似单词应意指使医学病状稳定、减少所述医学病状的症状、预防所述医学病状的发生或者治愈所述医学病状。因此,本发明提供减少至少一种(例如,2、3、4、5或更多种)促炎性细胞因子在受试者炎症部位处的表达水平和/或活性的方法。所述方法包括向所述受试者施用本发明的抗炎性多肽(或者例如包含抗炎性多肽的药物组合物)。促炎性细胞因子可以选自由以下组成的组:nf-kb、tnfα、il-1、il-6、il-8、il-12、il-17、il-23、mcp-1、mmp-1以及mmp-9。所述减少可以是细胞因子的表达或活性减少至少10%(例如,15%、20%、25%、30%、35%、40%、45%、50%或更大)。本发明还提供抑制至少一种(例如,2、3、4、5或更多种)促炎性细胞因子在受试者炎症的潜在部位处的表达水平和/或活性的增加的方法。所述方法包括向所述受试者施用本发明的抗炎性多肽(或者例如包含抗炎性多肽的药物组合物)。促炎性细胞因子可以选自由以下组成的组:nf-kb、tnfα、il-1、il-6、il-8、il-12、il-17、il-23、mcp-1、mmp-1以及mmp-9。所述方法可以通过将增加限制为不超过20%(例如,15%、12.5%、10%、7.5%、5%、4%、3%、2%、1%或更少)来抑制此增加的细胞因子表达和/或活性。本发明还提供一种治疗或预防与慢性炎症相关的病状的方法。与慢性炎症相关的病状可以是易激性肠病、溃疡性结肠炎、结肠炎、克罗恩病(crohn’sdisease)、特发性肺纤维化、哮喘、角膜炎、关节炎、骨关节炎、类风湿性关节炎、免疫性疾病、猫或人免疫缺陷病毒(fiv或hiv)感染、癌症、年龄相关性炎症和/或干细胞功能障碍(例如,在nlrp3表达中的年龄相关性增加、在肌肉干细胞中的年龄相关性socs3升高等等)、移植物抗宿主疾病(gvhd)、疤痕疙瘩、硬皮病、肥胖病、糖尿病、糖尿病创伤、其他慢性创伤、动脉粥样硬化、多发性硬化、帕金森病、阿尔兹海默病、黄斑变性、痛风、胃溃疡、胃炎、粘膜炎、弓形体病以及慢性病毒或微生物疾病(例如,诸如慢性细菌或原生动物感染)。所述方法包括向罹患所述病状或可能发展所述病状的受试者施用本发明的抗炎性多肽(或者例如包含抗炎性多肽的药物组合物)。本发明还提供治疗或预防纤维化的方法。纤维化可以是例如肺纤维化、皮肤纤维化、肝纤维化、肾纤维化或由电离辐射所引起的纤维化。所述方法包括向罹患纤维化或可能发展纤维化的受试者施用本发明的抗炎性多肽(或者例如包含抗炎性多肽的药物组合物)。本发明还提供治疗癌症的方法。癌症可以是结肠癌、乳腺癌、白血病、淋巴瘤、卵巢癌、前列腺癌、肝癌、肺癌、睾丸癌、宫颈癌、膀胱癌、子宫内膜癌、肾癌、黑素瘤、甲状腺癌或脑癌或眼癌。所述方法包括向罹患癌症的受试者施用本发明的抗炎性多肽(或者例如包含抗炎性多肽的药物组合物)。对于任一种以上方法,受试者可以是动物,诸如饲养的动物(例如,马、奶牛、猪、山羊、绵羊、兔、鸡、火鸡、鸭等等)、宠物(例如,狗、猫、兔、仓鼠、沙鼠、鸟、鱼等等)、实验室动物(例如、小鼠、大鼠、猴子、猩猩、猫头鹰、鱼等等)、动物园动物(例如,大猩猩、猩猩、黑猩猩、猴子、象、骆驼、斑马、野猪、狮子、虎、长颈鹿、熊、鸟等等)、野生动物(例如,鹿、狼、美洲狮、鸟等等)或人。与任一种以上方法结合,抗炎性多肽可根据动物类型、动物大小和待治疗的病状以一定的剂量和频率施用。通常,抗炎性多肽以约1mg与约1000mg之间(例如,约5mg至约900mg、约5mg至约800mg、约5mg至约700mg、约5mg至约600mg、约10mg至约500mg、约10mg至约400mg、约10mg至约300mg、约10mg至约250mg、约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约50mg至约500mg、约50mg至约400mg、约50mg至约300mg、约50mg至约250mg、约50mg至约200mg、约50mg至约150mg、约50mg至约100mg、约75mg至约500mg、约75mg至约400mg、约75mg至约300mg、约75mg至约250mg、约75mg至约200mg、约75mg至约150mg、约75mg至约100mg、约100mg至约500mg、约100mg至约400mg、约100mg至约300mg、约100mg至约250mg、约100mg至约200mg或含有两个以上端点的任何其他范围)的量每日施用一次(每隔一天施用一次或每周施用一次)。每日剂量可以每日施用一次,或者分成更小的剂量,在每日多个时间点服用。对于人(以及其他类似大小的哺乳动物),可以每隔一天施用5mg/kg的剂量。抗炎性多肽可以一定间隔(例如,将多肽施用2-3周,等待2-3周,然后重复循环)施用固定时间段(例如,2-3周),或者直到促炎性细胞因子水平已减小或稳定、慢性炎症病状或纤维化已减轻或癌症已得到缓解时。抗炎性多肽(或包含此类多肽的药物组合物)与任一种以上方法结合的施用可以静脉内地、腹膜内地、肠胃外地、原位地、皮下地、局部地、经鼻地、经口地、舌下、眼内地、通过可植入贮库、使用基于纳米粒子的递送系统、微针贴片、微球、珠粒、渗透泵或机械泵和/或其他机械装置来进行。与任一种以上方法结合,抗炎性多肽(或包含此类多肽的药物组合物)可以与设计来减少或预防炎症、治疗或预防慢性炎症或纤维化或治疗癌症的另一种药物组合地施用。在每种情况下,抗炎性多肽可以在施用其他药物之前、同时或者之后施用。对于癌症的治疗,抗炎性多肽可以与选自由以下组成的组的化学治疗剂组合施用:类固醇类、蒽环类、甲状腺激素替代药物、胸苷酸靶向药物、嵌合抗原受体/t细胞治疗剂以及其他细胞治疗剂。特定化学治疗剂包括例如吉西他滨、多西他赛、博莱霉素、埃罗替尼、吉非替尼、拉帕替尼、伊马替尼、达沙替尼、尼罗替尼、伯舒替尼、克唑替尼、色瑞替尼、曲美替尼、贝伐单抗、舒尼替尼、索拉非尼、曲妥珠单抗、ado-trastuzumabemtansine、利妥昔单抗、依匹单抗、雷帕霉素、坦西莫司、依维莫司、甲氨蝶呤、阿霉素、abraxane、folfirinox、顺铂、卡铂、5-氟脲嘧啶、teysumo、紫杉醇、脱氢可的松、左甲状腺素以及培美曲塞。可选地,对于治疗癌症的方法,抗炎性多肽(或包含此类多肽的药物组合物)可以与辐射疗法组合施用。而且,抗炎性多肽可以在施用辐射疗法之前或之后施用。任一种本发明的以上方法进一步包括评估治疗性治疗的功效的步骤。因为本发明的抗炎性多肽具有可证明的在组织和血清(数据未示出)中减少组织炎症并抑制炎症介质诸如il-1、il-6、il-12以及tnfα的产生的能力,所以治疗性治疗的功效可以通过测量此类细胞因子(例如,在血清中)的水平来评估,以确定所述水平是否已适当地响应于所述治疗。根据细胞因子水平,抗炎性多肽的剂量可以按需要向上或向下调整。实施例实施例1:肽设计在计算机上设计多肽,以包含交替的xm模块和yn模块的条带性亲疏区域,其中每个xm模块具有一个至五个亲水性氨基酸残基并且每个yn模块具有一个至五个疏水性残基。初始设计集中于由具有约10个氨基酸残基的总长度的条带性亲疏区域组成的多肽,其中每个xm模块具有一个或两个亲水性氨基酸残基并且每个yn模块具有一个或两个疏水性残基,并且其中疏水性氨基酸残基与亲水性氨基酸残基的比率为约1:1。预测此类多肽具有两亲性的螺旋二级结构,其中在螺旋的一侧上有疏水性表面并且在螺旋的相反侧上有亲水性表面。随后生成另外的肽设计,其维持约10个氨基酸残基的总长度,但是将亲水性或疏水性模块中可能的氨基酸残基的数目从两个扩展至三个并且改变疏水性与亲水性的比率。例如,将具有三个疏水性氨基酸残基的较大疏水性模块与具有一个亲水性氨基酸残基的较短亲水性模块偶联,产生预测具有较强疏水性特征的多肽。预测此类肽维持两亲性的螺旋二级结构,但是在螺旋的一侧上有较大疏水性表面并且在另一侧上相应地有较小亲水性表面。类似地,将具有三个亲水性氨基酸残基的较大亲水性模块与具有一个疏水性氨基酸残基的较短疏水性模块偶联,产生预测具有较强亲水性特征的肽。也预测此类肽维持两亲性的螺旋二级结构,但是在螺旋的一侧上有较大亲水性表面并且在另一侧上相应地有较小疏水性表面。其他肽设计包括:具有四个或五个亲水性氨基酸残基的模块和/或四个或五个疏水性氨基酸残基的模块的多肽;具有约10个氨基酸残基的总长度但是缺乏疏水性氨基酸残基的多肽;具有各自由单个氨基酸残基组成的亲水性模块和疏水性模块的多肽;以及富含脯氨酸的多肽。最后,还生成包含较小肽设计中的两个设计的较大多肽。如以上所述的设计示例性多肽呈现在以下表3-9中。为了使已开发的多肽类型更清楚,将各肽分成多个类别。通常,特定类别的多肽的条带性亲疏区域共享至少六个或七个氨基酸残基长度的疏水性模块和亲水性模块的共有序列。然而,因为数据指示具有相同序列但具有相反的n-末端至c-末端取向的多肽意外地具有类似的抗炎活性,所以已努力将此类多肽保持为相同类别。因此,即使疏水性模块和亲水性模块的共有序列的长度小于六个氨基酸残基,但是一些多肽已分组成相同的类别。另外,一些多肽已不同地分组,因为它们含有超过一个类别的疏水性模块和亲水性模块的共有序列。因此,虽然提供用于围绕结构和功能类似性分组多肽的有用框架,但是分类系统并不捕获不同多肽之间的关系的所有方面。表3呈现了具有包含对应于式i的序列(即,y1a-y1b-y1c-x1a-y2a-y2b-y2c)的条带性亲疏区域的各种i类多肽。在表3中呈现了i类多肽的两种不同类型:具有由对应于式ii的序列(即,y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a)组成的条带性亲疏区域的肽;以及具有由对应于式iii的序列(即,x2a-y3a-x3a-y1a-y1b-y1c-x1a-y2a-y2b-y2c)组成的条带性亲疏区域的肽。另外,呈现了具有含有对应于式i而非式ii或式iii的序列的条带性亲疏区域的肽。表3:i类多肽表4呈现了一些拟i类多肽。这些肽包含与式ii的条带性亲疏序列(即,y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a)类似的序列,但是疏水性氨基酸残基全部被特定亲水性氨基酸残基替换。表4:拟i类多肽*这些肽并不符合式ii的序列要求,而是表示关于式ii的序列要求的“所有亲水性”变化。表5呈现了各种ii类1子类多肽。所呈现的肽具有由对应于式x的序列(即,y1a-y1b-x1a-x1b-y2a-y2b-x2a-x2b-y3a-x3a)组成的条带性亲疏区域或者由对应于式xi的序列(即,x1a-y1a-x2a-x2b-y2a-y2b-x3a-x3b-y3a-y3b)组成的条带性亲疏区域。表5:ii类1子类多肽表6呈现了属于各种不同类别的多肽,包括:ii类肽(具有包含对应于式vi至式xvi中任一种的序列的条带性亲疏区域);ii类2子类(具有包含对应于式viii和式xii的序列的条带性亲疏区域);ii类3子类(具有包含对应于式ix的序列的条带性亲疏区域);ii类4子类(具有包含对应于式xiv和式xv的序列的条带性亲疏区域);ii类5子类(具有包含对应于式xiii和式xvi的序列的条带性亲疏区域);iii类肽(具有包含对应于式xvii至式xx中任一种的序列的条带性亲疏区域);iii类1子类肽(具有包含对应于式xix或式xx的序列的条带性亲疏区域);iv类肽(具有包含对应于式iv和式v的序列的条带性亲疏区域);v类肽(具有包含对应于式xxi的序列的条带性亲疏区域);vi类肽(具有包含对应于式xxii和式xxiii的序列的条带性亲疏区域);vii类肽(具有包含对应于式xxiv至式xxvi中任一种的序列的条带性亲疏区域);viii类肽(具有包含对应于式xxvii至式xxxii中任一种的序列的条带性亲疏区域);viii类3子类和4子类肽(具有分别对应于式xxxi和式xxxii的序列的条带性亲疏区域);ix类肽(具有包含对应于式xxxiii至式xxxviii中任一种的序列的条带性亲疏区域);ix类3子类和4子类肽(具有包含分别对应于式xxxvii和式xxxviii的序列的条带性亲疏区域);以及xiii类(具有包含对应于式l的序列的条带性亲疏区域)。因为viii类3子类和ix类3子类的多肽共享疏水性模块和亲水性模块的相同序列,但是共享相反的n-末端至c-末端取向,所以它们已分组成相同类别和子类。类似地,因为viii类4子类和ix类4子类的多肽共享疏水性模块和亲水性模块的相同序列,但是共享相反的n-末端至c-末端取向,所以它们已分组成相同类别和子类。表6:ii类至ix类和xiii类多肽表7呈现了viii类至xi类多肽。表7中呈现的所有肽均具有包含亲水性模块(具有四个或五个亲水性氨基酸残基)和/或疏水性模块(具有四个或五个疏水性氨基酸残基)的条带性亲疏区域。viii类1子类肽具有包含对应于式xxviii或式xxix的序列的条带性亲疏区域;viii类2子类肽具有包含对应于式xxx的序列的条带性亲疏区域;ix类1子类肽具有包含对应于式xxxiv或式xxxv的序列的条带性亲疏区域;ix类2子类肽具有包含对应于式xxxvi的序列的条带性亲疏区域;x类肽具有包含对应于式xxxix至式xliii中任一种的序列的条带性亲疏区域;并且xi类肽具有包含对应于式xliv至式xlviii中任一种的序列的条带性亲疏区域。因为viii类1子类和ix类1子类的多肽共享疏水性模块和亲水性模块的相同序列,但是共享相反的n-末端至c-末端取向,所以它们已分组成相同类别和子类。类似地,因为viii类2子类和ix类2子类的多肽共享疏水性模块和亲水性模块的相同序列,但是共享相反的n-末端至c-末端取向,所以它们已分组成相同类别和子类。表7:viii类至xi类多肽表8呈现了xii类至xiv类多肽。xii类多肽具有包含对应于式xlix的序列(即,y1a-x1a-y2a-x2a-y3a-x3a)的条带性亲疏区域。预测xii类肽采用β链二级结构。xiv类肽为具有包含对应于式li-liv之一的序列的条带性亲疏区域的富含脯氨酸肽。表8:β链和富含脯氨酸多肽表9呈现了融合肽,其包含通过肽键和任选地短肽接头(例如,三甘氨酸(ggg)接头)连接在一起的i类、ii类和/或iii类肽的组合。表9:肽组合在表3-9中的每一个表中,rp#为用于鉴别特定肽序列的随机分配的指示。“结合e”(参见每个表的第3列)对应于当个别肽结合至nfkbii类蛋白relb的蛋白二聚结构域时释放的能量的预期测量值(参见以下实施例2)。实施例2:肽至relb的预测的结合为了鉴别具有抗炎性活性的肽,选择nf-kb复合物作为靶标,因为已知它是调节炎症的信号路径中的关键组分。通过nf-kbii类蛋白中可见的二聚结构域(例如,rela、relb、crel、nf-kb1以及nf-kb2)介导的nf-kb二聚化(同源或异源)对于nf-kb复合物的活化和促炎性信号的生成为必需的。因此,对于其特异性结合至relb(ncbi登录号np_033072.2)的二聚结构域的能力来选择肽设计,其目标在于此类结合将抑制nf-kb二聚化和活化。在计算机中使用在波士顿大学开发的基于网络的clusprotm算法评价肽与relb的二聚结构域的结合。clusprotm算法过滤蛋白靶标与推定配体之间的停靠构象并且确定表面互补性,从而分级基于成簇特性的构象。自由能滤波器选择具有最低去溶剂化和静电能量的复合物。然后使用成簇润滑局部最小值并选择具有最广泛势阱,这是与结合位点处的自由能相关的特性。使用此方法,可以评价在可以对配体进行分级并且然后测试体外或体内生物活性后配体对特定靶标所具有的亲和力。对于表3-9中的表第三列中的每种肽示出通过clusprotm算法计算的结合能。在表3-9中的每一个表中,根据计算的relb结合能,从最高结合能至最低结合能,对肽进行分级。使用relb结合能探索肽的结构-功能关系,特别是关于(i)增加或降低疏水性,(ii)正电荷/负电荷密度,以及(iii)改变肽的疏水性表面和亲水性表面的弧度。表10(以下)中示出的肽将用于说明研究结果。表10:选定肽与relb的预测的结合*能量值越低,配体对靶标蛋白上的结合位点所具有的亲和力越大。图1示出了nf-kba的relb亚基的结构模型。具有二聚位点的氨基酸被遮挡住,以指示其疏水性或亲水性特征。具体地说,涂成洋红色的氨基酸残基为亲水性的,而涂成蓝绿色的氨基酸残基为疏水性的。假设在二聚结构域的结合袋内的亲水性氨基酸残基和疏水性氨基酸残基的位置不同,明显具有两亲性二级结构的条带性亲疏肽具有位点特异性结合至二聚结构域结合袋的可能性。在图2中建模了rp-182(seqidno:121)的二级结构及其与relb(seqidno:367)的结合。如右侧图上可以看出,rp-182的预测的二级结构具有不同的疏水性侧和亲水性侧,它们包含大约相等的面部弧度(还参见图9)并且具有高容积。总之,rp-182的结构具有高疏水性和高阳离子度(其具有总计五个阳离子氨基酸残基)。以下表11中总结了rp-182的这些特征。基于结构建模,rp-182以高亲和力结合至relb二聚结构域结合袋,其中估计的结合能为-944.8kcal/mol。在图3中建模了rp-166(seqidno:112)的二级结构及其与relb(seqidno:367)的结合。如右侧图上可以看出,rp-166的预测的二级结构也具有不同的疏水性侧和亲水性侧,它们包含大约相等的面部弧度(还参见图9)。这些特征并不出乎意料,因为rp-166的条带性亲疏区域具有与rp-182相同(即使相反)的模块结构(比较式x和xi)。正如rp-182一样,rp-166的疏水性表面和亲水性表面具有高容积,但是rp-166与rp-182相比具有更大的疏水性容积与亲水性容积的比率。另外,rp-166的阳离子度相对于rp-182显著降低,因为rp-166具有相等数目的阳离子氨基酸残基和阴离子氨基酸残基。以下表11中总结了rp-166的这些特征。基于结构建模,rp-166甚至以比rp-182更高的亲和力结合至relb二聚结构域结合袋,其估计的结合能为-1,044.8kcal/mol。在图4中建模了rp-113(seqidno:39)的二级结构及其与relb(seqidno:367)的结合。如右侧图上可以看出,rp-113的预测的二级结构也具有不同的疏水性侧和亲水性侧,但是疏水性侧包含比亲水性侧大得多的面部弧度。如图9所示,rp-113的极性侧的面部弧度仅为60°,而非极性侧的面部弧度为300°。与朝向更大疏水性表面的此偏移一致,rp-113具有比rp-182或rp-166更大的疏水性容积,以及显著更大的疏水性容积与亲水性容积的比率。参见以下表11。与rp-166一样,rp-113的阳离子度相对于rp-182显著降低,因为rp-113具有相等数目的阳离子氨基酸残基和阴离子氨基酸残基。基于结构建模,rp-113甚至以对本发明的肽预测的最高亲和力之一结合至relb二聚结构域结合袋,其估计的结合能为-1,208.9kcal/mol。在图5中建模了rp-387(seqidno:173)的二级结构及其与relb(seqidno:367)的结合。如右侧图上可以看出,rp-387的预测的二级结构具有不同的疏水性侧和亲水性侧。然而,与rp-113相反,rp-387的亲水性侧包含比疏水性侧大得多的面部弧度。如图10所示,rp-387的极性侧的面部弧度仅为245°,而非极性侧的面部弧度为115°。与朝向更大亲水性表面的此偏移一致,rp-387具有比rp-182、rp-166和rp-113中任一种更小的疏水性容积,以及显著更小的疏水性容积与亲水性容积的比率。参见以下表11。关于阳离子度,rp-387类似于rp-182,具有总计五个阳离子氨基酸残基。基于结构建模,rp-387结合至relb二聚结构域结合袋,但结合相对弱,其估计的结合能仅为-338.3kcal/mol。在图6中建模了rp-289(seqidno:232)的二级结构及其与relb(seqidno:367)的结合。如右侧图上可以看出,rp-289的预测的二级结构具有不同的疏水性侧和亲水性侧。然而,rp-289的疏水性侧为筛选的最小肽之一。如图9所示,rp-289的极性侧的面部弧度仅为290°,而非极性侧的面部弧度仅为70°。在表11所列出的肽中,rp-289具有最小的疏水性容积和最小的疏水性容积与亲水性容积的比率。rp-289还具有表11所列出的肽中最高的阳离子度,其具有总计七个阳离子氨基酸残基。基于结构建模,rp-289结合至relb二聚结构域,尽管与rp-182、rp-166和rp-113相比弱许多,其估计的结合能仅为-431.6kcal/mol。表10和表11还鉴别了两种对照肽nf-contr2和nf-contr3,它们是nf-kb的relb亚基的片段。nf-contr2和nf-contr3的序列并不符合结构式i-liii中的任一种。在图7中建模了nf-contr2(seqidno:382)的二级结构及其与relb(seqidno:367)的结合。在图8中建模了nf-contr3(seqidno:383)的二级结构及其与relb(seqidno:367)的结合。据预测两种肽没有在肽的整个长度中采用清楚的两亲性二级结构。此外,尽管clusprotm算法鉴别了nf-contr2和nf-contr3各自与relb的结合相互作用,结合能并不十分强烈并且二者没有显示对与relb二聚结构域结合袋的结合的偏好。表11:选定肽的物理特征*结合能以kcal/mol计。容积以立方埃计。hpl意指亲水性;hpb意指疏水性。“th”是总疏水性(以kcal/mol计),如engleman等,(1986),“identifyingnonpolartransbilayerhelicesinaminoacidsequencesofmembraneproteins,”annu.rev.biophys.bioeng.15:321–53所定义的。图1至图10和表11揭示了本发明的肽的结构-功能关系的一些重要方面。首先,预测结合relb二聚结构域结合袋的所有肽具有两亲性二级结构。其次,疏水性容积越大,疏水性容积与亲水性容积的比率越大,并且更大的疏水性弧度全部与对relb二聚结构域的结合袋的亲和力增加相关联。第三,阳离子度增加与对relb二聚结构域的结合袋的结合亲和力降低相关联。表4列出了i类肽的一些“全部亲水性”变体,该表4似乎潜在地反驳了以下结论:阳离子度增加与对relb二聚结构域的结合袋的结合亲和力降低相关联。在表4中的每个肽中,i类式ii肽的疏水性残基已被单一类型的亲水性残基置换。重要的是,rp-173(hhhrhhhehq;seqidno:99)和rp-195(rrrrrrrerq;seqidno:100)二者均对relb二聚结构域的结合袋具有高亲和力(分别为-1,002.2和-855.2kcal/mol),尽管它们具有通常在溶液中有阳离子电荷的八个氨基酸残基。因为组氨酸和精氨酸具有大侧链,其高relb结合亲和力的潜在说明为侧链中不带电荷的烃基团提供一些疏水性,所述疏水性另外通过从疏水性残基转换成亲水性残基来丧失。另外,当结合至relb时,一些组氨酸和精氨酸残基可采用不带电荷状态。表4因此通过指示组氨酸和精氨酸可以起到类疏水性能力(至少关于肽对relb二聚结构域结合袋的结合亲和力)的作用来进一步阐明本发明的肽的结构-功能关系。因此,在本发明的一些肽中,可以积极有利地将组氨酸或精氨酸与由一个或两个疏水性氨基酸残基构成的疏水性模块相邻地放置。实施例3:参与肽结合的relb氨基酸残基图11中示出了使relb二聚结构域的结合袋成一线的氨基酸残基模型。所述模型显示glu-298、asp-330和his-332为使结合袋成一线的关键性亲水性氨基酸残基,而tyr-300、leu-301、leu-302以及leu-371为重要的疏水性残基。在图12中示出了相同模型,其中添加了rp-182肽(seqidno:121)的符号图。图12中的虚线显示(1)rp-183的lys-7与relb的asp-330之间以及(2)rp-183的lys-4与relb的glu-298之间的离子键。进一步稳定相互作用为在rp-183的arg-8与rp-183的羧基末端lys-10之间形成的离子间键。除了离子键之外,存在许多范德华相互作用。为了清楚起见,仅示出rp-182的phe-9与rel-b的leu-371的相互作用。然而,在rp-183的疏水性表面上的其他疏水性氨基酸残基与rel-b的二聚位点的裂隙的疏水性“底部”相互作用。涉及本发明的不同肽的结合的离子相互作用和范德华相互作用的分析揭示了肽结合至选自由以下组成的组的relb氨基酸残基的子集:leu-281、ile-283、cys-284、glu-298、tyr-300、leu-301、leu-302、cys-303、ile-311、ser-312、ala-329、asp-330、val-331、his-332、gln-334以及leu-371。参见以下表13。tyr-300、leu-302和his-332在文献中指示为对于二聚化而言是关键的。对于通过本发明的肽进行结合而言最关键的氨基酸包括glu-298、tyr-300、leu-302、asp-330、gln-334以及leu-371。实施例4:肽与除relb之外的蛋白靶标的结合在计算机中进一步评价表3-9中所示出的肽的子集,以确定它们是否结合至处除relb之外参与炎症反应的信号蛋白。这样做时,发现nf-kb的relb亚基的二聚化裂隙在许多其他信号分子中具有结构平行。与这些结构平行一致的,预测(通过clusprotm算法)本发明的肽以高亲和力结合至炎症级联中的重要信号分子,包括:tgfβ(ncbi登录号np_000651.3;seqidno:368);notch1(genbank登录号aag33848.1;seqidno:369);wnt8r(ncbi登录号xp_005214377.1;seqidno:370);trail(genbank登录号eaw78466.1;seqidno:371);il6r(ncbi登录号np_786943.1;seqidno:372);il10r(ncbi登录号np_001549.2;seqidno:373);egfr(genbank登录号aar85273.1;seqidno:374);以及cdk6(ncbi登录号np_001250.1;seqidno:375)。在以下表12a和表12b中示出了本发明的代表性肽和肽与这些信号分子各自之间的预测的结合能。表12a:选定肽与不同炎症靶标的预测的结合*所有结合亲和力均以kcal/mol计。表12a:选定肽与不同炎症靶标的预测的结合数据显示和relb的结合强度与和不同炎症靶标的结合强度高度相关。换言之,预测以高亲和力结合至relb的肽同样被预测以高亲和力结合至tgfβ、notch1、wnt8r、trail、egfr、il6r以及il10r。本发明的肽与tgfβ、notch1、wnt8r、trail、egfr、il6r以及il10r各自之间的预测的结合相互作用的更靠近的评价显示肽不仅以高亲和力结合,而且结合至靶标上的功能关键性位点。例如,预测本发明的肽结合至tgfβ上的受体结合位点、notch1上的钙结合位点、wnt8r上的wnt8-结合位点、trail上的受体结合位点、il6r上的il6-结合位点、il10r上的il10-结合位点以及egfr上的一般配体结合位点。表13中示出了这些靶标各自中由本发明的肽所结合的氨基酸残基的非穷举列表。表13:靶标蛋白中由本发明的肽所接触的氨基酸残基假设存在大量的由本发明的肽靶向的免疫学上重要的信号蛋白,数据表明肽以多效性方式起作用,使得许多不同的相互作用加在一起形成广泛的抗炎反应。这可使得疾病状况能够减轻而没有在更高靶向的化学治疗剂的使用中观察到的毒性。实施例5:肽与组蛋白修饰酶和核糖核酸酶还原酶的结合已观察到许多本发明的肽共享组蛋白的n-末端区域的结构特征。因此,在计算机中评价代表性肽结合至组蛋白修饰酶的能力。以这种方式,发现本发明的肽对组蛋白甲基转移酶(hmt)(ncbi登录号np_048968.1;seqidno:376)具有高亲和力,从而紧密结合至所述酶的活性位点。表14中示出了本发明的选定肽对hmt的预测的结合能,其使用clusprotm算法来计算。而且,预测的结合能与结合relb的预测的能量良好相关。表14:选定肽与hmt、mkk7和rnr的结合亲和力*所有结合亲和力均以kcal/mol计。图13中示出了由rp-182结合的组蛋白甲基转移酶(hmt)的模型。橙色氨基酸为组蛋白甲基转移酶的活性位点。预期通过rp-182抑制甲基转移酶,因为rp-182以似乎妨碍对活性位点的接近的方式结合至活性位点的至少一个残基。以上表13中示出了hmt中由本发明的肽所结合的氨基酸残基的非穷举列表。还观察本发明的肽,以显示对map激酶激酶7(mkk7;seqidno:417)的强预测的亲和力,所述激酶为参与对促炎性细胞因子的信号转导介导的细胞反应的分裂素活化的蛋白激酶激酶家族,并且因此可能参与肽的抗炎活性。例如rp-182对于mkk7的预测的亲和力为-738.2kcals/mol。另外,观察到本发明的肽显示对核糖核酸酶还原酶(rnr;seqidno:418)(也称为核苷二磷酸还原酶)的大量预测的亲和力。这是一种催化脱氧核糖核苷酸由核糖核苷酸形成的酶。进而将脱氧核糖核苷酸用于合成dna。由rnr催化的反应在所有活生物体中均为严格保守的。另外,rnr在调节dna合成的总速率方面起关键性作用,以使得dna与细胞质量在细胞分裂和dna修复过程中维持恒定比率。rnr酶的些许不寻常的特征在于它催化经由自由基作用机制进行的反应。rnr的底物为adp、gdp、cdp和udp。dtdp(脱氧胸苷二磷酸)通过另一种酶(胸苷酸激酶)由dtmp(脱氧胞苷单磷酸)合成。例如rp-182对于rnr的预测的亲和力为-814.0kcals/mol。实施例6:肽与和巨噬细胞活化相关联的靶标的结合还预测本发明的肽与和巨噬细胞活性和细胞凋亡(它们是与炎症相关并且与肿瘤发生和转移相关的特性)相关的几种蛋白质相互作用。迄今为止鉴别的靶标包括cd47、sirp-α、cd206、tgm2、legumain、dc-sign、csf1、csf1r以及il34。cd47(或“分化簇47”)也称为整合素相关蛋白(iap),它是属于免疫球蛋白超家族的跨膜蛋白。cd47蛋白与称为整合素的膜结合细胞附着受体配对并且还结合配体血小板反应蛋白-1(tsp-1)和信号调节蛋白α(sirp-α)。cd47参与一个范围的细胞过程,包括细胞凋亡、增殖、附着以及迁移。另外,它在免疫反应和血管生成反应中起到关键性作用。cd47在许多类型的人细胞中表达并且已发现在许多不同类型的肿瘤中过度表达。cd47的过度表达已作为可能的人癌症保护剂接受相当多的注意。通过结合至巨噬细胞表面上的sirp-α,据信cd47发送致使巨噬细胞不能攻击癌细胞的“不要吃我”信号。cd206和tgm2同样已鉴别为巨噬细胞活性的潜在重要的调节物。cd206为c-型凝集素,其主要存在于巨噬细胞和树突状细胞的表面上。它是内吞受体家族的第一个成员,所述家族包括endo180(cd280)、m-型pla2r以及dec-205(cd205)。所述受体识别构成聚糖的末端甘露糖、n-乙酰基葡糖胺和岩藻糖残基,所述聚糖附接至一些微生物的表面上可见的蛋白质。因此,cd206受体似乎在先天性和适应性免疫系统中起作用。另外,肿瘤相关性巨噬细胞可使用cd206消化胶原,从而产生能够滋养自身和肿瘤细胞的降解产物,并且减弱肿瘤细胞的胶原结合以便促进转移。tgm2属于催化蛋白质的钙依赖性翻译修饰的酶家族。在细胞内和细胞外均可见这些家族成员。tgm2由于其多功能性和特有结构而在所述家族中为独特的,其包含四个不同结构域:含有纤连蛋白和整合素结合位点的n-末端β-夹层;含有用于酰基转移反应的催化三联体(cys-277、his-335和asp-358)的催化核心;以及两个c-末端β-桶型结构域,其中第二个具有磷脂酶结合序列。tgm2作为细胞外基质功能的调节剂参与其中,所述功能包括细胞粘附和迁移、细胞生长和分化、细胞凋亡、肿瘤生长以及伤口愈合。尽管tgm2普遍地表达,它在m2巨噬细胞中表达最高。另外,tgm2水平增加与硬皮病、肺和肾纤维化、糖尿病恶化症状、关节炎和eae以及许多不同癌症中的不良结果相关联,所有这些均可以与m2巨噬细胞相关联。表15中示出了使用clusprotm算法计算的本发明的选定肽对cd47(ncbi登录号xp_005247966.1;seqidno:377)、sirp-α(genbank登录号aah26692.1;seqidno:378)、cd206(ncbi登录号np_002429.1;seqidno:379)以及tgm2(genbank登录号aab95430.1;seqidno:380)的预测的结合能。正如以上所讨论的其他靶标一样,预测的结合能与结合relb的预测的能量良好相关。legumain为人中由lgmn基因编码的蛋白质。此基因编码了半胱氨酸蛋白酶,所述蛋白酶为对天冬酰胺键的水解具有严格特异性的豆荚蛋白。这种酶可参与溶酶体/核内体系统中mhcii类呈递的细菌肽和内源性蛋白质的加工。酶活化通过酸性ph触发并且似乎是自动催化的。在单核细胞分化成树突状细胞之后出现蛋白质表达。在成熟树突状细胞中进行脂多糖表达之后产生完全成熟的活性酶。这种基因的过度表达可能与大部分实体肿瘤类型相关联。legumain也在m2巨噬细胞中过度表达,并且预期通过所公开的肽抑制其活性下调m2-活化的巨噬细胞。dc-sign(树突状细胞特异性细胞内粘附分子-3-抓式非整合素)也称为cd209(分化簇209),它是人中由cd209基因编码的蛋白质。dc-sign为c-型凝集素受体,其存在于巨噬细胞和树突状细胞二者的表面上。巨噬细胞上的dc-sign识别并结合至甘露糖类型的碳水化合物,其为病毒、细菌和真菌上常见的一类病原体相关分子模式pamp。此结合相互作用活化了吞噬作用。在髓样和预浆细胞样树突状细胞上,dc-sign介导了树突状细胞与血液内皮细胞的滚动相互作用和cd4+t细胞活化,以及病原体半抗原的识别。dc-sign在m2巨噬细胞中显著过度表达,并且预期通过所公开的肽抑制其活性能下调m2-活化的巨噬细胞。表15:选定肽与cd47、sirp-α、cd206以及tgm2的结合亲和力*所有结合亲和力均以kcal/mol计。图14(左图)示出了cd47二聚物(顶视图)(seqidno:377)的胞外域的模型,其中洋红色和蓝绿色表面分别表示极性和非极性氨基酸,它们参与cd47与sirp-α受体的结合。图14(右图)示出了cd47二聚物当被rp-183(seqidno:121)结合时的胞外域的模型。基于rp-183与cd47之间的此预测的相互作用,预期本发明的肽阻断cd47与sirp-α之间的相互作用。图15示出了sirp-α二聚物(seqidno:378)的模型,其中洋红色和蓝绿色表面分别表示参与其与cd47(参见最左侧的二聚物)的结合的极性和非极性氨基酸。在由rp-183(seqidno:122)结合的相同sirp-α二聚物(参见最右侧二聚物)的稍微倾斜的视图中,可以看出rp-183紧密结合至涉及与cd47受体的结合的氨基酸。因此显然rp-183(以及本发明的其他肽)通过两种不同的机制结合至cd47和sirp-α二者中对应的结合位点来阻断cd47与sirp-α之间的相互作用。因此,与本发明的肽相关联的预测的活性包括阻止对于癌细胞的重要防御机制。还预测本发明的肽阻断cd206受体亚基上的关键性位点。图16示出了由rp-182(seqidno:121)结合的cd206(seqidno:379)的模型。cd206(最左侧分子)的弯曲区域上的蓝绿色酪氨酸残基与靶细胞表面上的甘露糖配体形成平面的疏水性堆叠的相互作用。洋红色氨基酸有助于螯合对于与甘露糖受体的稳定相互作用所需要的要求的钙离子的酸性残基。rp-182肽(在最右侧分子上的孔中可见的)通过与受体亚基上这些关键性位点中的两个相互作用来阻断活性。因此预期本发明的肽减少了m2巨噬细胞的生存力,这已在实验上确认(如以下所列出的)。另外,预测本发明的肽阻断了tgm2的活性位点。图17(左图)示出了具有以蓝色突出显示的活性位点残基的tgm2(seqidno:380)的模型。图17(右图)示出了由rp-182(seqidno:121)结合的tgm2的相同模型,其为洋红色的。正如可以看出的,预测rp-182以完全覆盖活性位点的方式结合至tgm2,从而阻碍底物接近并抑制tgm2功能。重要的是,tgm2水平降低与nf-kb活化减少相关联,因此本发明的多肽与tgm2的相互作用将表现出增强和/或扩大它们的nf-kb活性的抑制。以上表13中示出了cd47、sirp-α、cd206以及tgm2中由本发明的肽所结合的特定氨基酸残基的非穷举列表。实施例7:肽与检查点抑制剂和相关靶标的结合还已观察到本发明的肽显示出对检查点抑制剂蛋白及其配体的大量亲和力。在效应免疫细胞表面上表达的此类蛋白质(包括细胞毒性t-淋巴细胞抗原4(ctla-4)、pd-1和其他抑制性共受体)当活化时似乎耗尽了免疫细胞的活性,从而充当免疫检查点,以便防止不受控制的免疫反应。肿瘤细胞常常表达检查点抑制剂的配体例如pd-l1和pd-l2,从而减弱免疫系统攻击肿瘤的能力。具体地说,程序性细胞死亡蛋白1也称为pd-1和cd279(分化簇279),它是人中由pdcd1基因编码的蛋白质。pd-1为属于免疫球蛋白超家族的细胞表面受体并且在t细胞和促b细胞上表达。pd-1结合至两个配体pd-l1和pd-l2。pd-1用作免疫检查点,在通过防止t细胞活化来下调免疫系统方面起重要作用,这进而减少自身免疫并促进自身耐受。pd-1的抑制作用通过促进淋巴结中抗原特异性t细胞中的细胞凋亡(程序性细胞死亡)同时减少调节性t细胞(抑制性t细胞)中的细胞凋亡的双机制来实现。程序性死亡-配体1(pd-l1)也称为分化簇274(cd274)或b7同源物1(b7-h1),它是人中由cd274基因编码的蛋白质。程序性死亡配体1(pd-l1)为40kda1型跨膜蛋白,其已推断在特定事件诸如妊娠、组织同种异体移植、自身免疫性疾病以及其他疾病状态诸如肝炎过程中抑制免疫系统方面起主要作用。通常,免疫系统对外来抗原反应,其中在淋巴结或脾脏中存在引起抗原特异性cd8+t细胞增殖的一些累积。pd-1受体/pd-l1或b7.1受体/pd-l1配体复合物的形成传输减少这些cd8+t细胞在淋巴结处的增殖和对以下的补充的抑制信号:pd-1还能够通过细胞凋亡来控制在淋巴结中的外来抗原特异性t细胞的累积,所述细胞凋亡进一步通过下调基因bcl-2来介导。由于本发明的肽与检查点抑制剂及其配体的结合的说明,rp-182对pd-1的预测的亲和力为-742.9,并且rp-621的预测的亲和力为-1,008.8。rp-182对pd-l1的亲和力为-677.4,并且rp-621对pd-l1的亲和力为-1,010.6。正如炎症靶标一样,在对若干其他检查点抑制剂及其配体的预测的亲和力内以及已知在调节免疫器官方面起作用的其他蛋白质中存在显著相关性。这些包括:tim-1(据信在t-辅助细胞发展中起作用:对rp-182的预测的亲和力为-850.1);ctla-4(检查点抑制剂:对rp-182的预测的亲和力为-663.2);adora2a(调节中性粒细胞和肥大细胞的活性:对rp-182的预测的亲和力为-938.7);ox40(二次共刺激免疫检查点:对rp-182的预测的亲和力为-759.9);ido(免疫检查点:对rp-182的预测的亲和力为-934.0);lag-3(免疫检查点受体:对rp-182的预测的亲和力为-873.1);cd73(通过腺苷受体信号限制t细胞活性的酶:cd73-i对rp-182的预测的亲和力为-808.7;cd73-ii对rp-182的预测的亲和力为-949.1);精氨酸酶-1(阻断细胞毒性t淋巴细胞的活性:对rp-182的预测的亲和力为-984.2);集落刺激因子1(上调检查点分子的所示阻断以及重新设置巨噬细胞反应;csf1对rp-182的预测的亲和力为-854.7;csf1d对rp-182的预测的亲和力-847.1;csf1r对rp-182的预测的亲和力为-774.1);以及il34(也活化csf1r;对rp-182的预测的亲和力为-828.5)。实施例8:肽与mkk7的结合双特异性促分裂原活化蛋白激酶7也称为map激酶激酶7或mkk7,它是人中由map2k7基因编码的酶。此蛋白是促分裂原活化蛋白激酶激酶家族的成员。mkk7蛋白作为具有三个可能的n-末端(α、β和γ亚型)和两个可能的c末端(1和2亚型)的六种不同亚型存在。mkk7涉及介导对促炎性细胞因子的细胞反应的信号转导以及环境应激。此激酶特异性活化mapk8/jnk1和mapk9/jnk2,并且此激酶本身通过map激酶激酶激酶磷酸化和活化,所述激酶包括map3k1/mekk1、map3k2/mekk2、map3k3/mekk5以及map4k2/gck。实施例9:肽与血清白蛋白的结合已熟知循环中最丰富的蛋白质为血清白蛋白。还已知实体肿瘤将摄取血清白蛋白到其细胞中(通过胞吞作用过程)并且使用它作为能量来源。因此,在计算机中评价本发明的肽结合至人血清白蛋白(hsa)(ncbiacc.no.np_000468.1;seqidno:381)的能力。已发现本发明的肽具有以高亲和力结合至hsa的能力。以下表16中示出了本发明的选定肽结合至hsa的预测的结合能。表16:选定肽与人血清白蛋白(hsa)的结合亲和力*所有结合亲和力均以kcal/mol计。图18为由rp-183(蓝色)结合的hsa(以绿色示出)的模型。计算建模已确定hsa上许多可能的肽结合位点。因此,据信单一hsa分子能够结合至本发明的多个肽。本发明的肽与hsa之间的结合相互作用表明hsa可用作肽的体内载体。以这种方式,hsa可保护肽防止其在血液中降解并且携带肽到作用位点,诸如炎症和/或癌细胞位点,从而增加肽的功效。实施例10:nf-kb活性的体外调节使用利用nfkb-re/gfp构建体稳定转化的3t3-l1前脂肪细胞细胞系监测nf-kb活性,如shen等(2013),“adipocytereporterassays:applicationforidentificationofanti-inflammatoryandantioxidantpropertiesofmangosteenxanthones,”mol.nutr.foodres.00:1-9所述的,所述文献的整个内容以引用的方式并入本文。将nf-kb表达脂肪细胞报道细胞铺板在24孔板的孔的dmem中,接种密度为5x104。在铺板后第二天和第三天,将测试肽单独添加到孔中,最终浓度为.01μm。测试肽包括rp-398(seqidno:155)和rp-185(seqidno:123)。在铺板后第4天,将脂多糖添加到培养基中,最终浓度为20ng/ml。最后,在铺板后第5天,收获细胞并且进行荧光测定以检测gfp表达水平。在此实验中,nf-kb表达相对于未暴露于rp-398或rp-185肽的对照细胞减少大约58%。实施例11:巨噬细胞活性的体内调节与肿瘤发生和转移相关的频繁观察的表型为将巨噬细胞极化成“m2”过渡状态,其中它们处于炎症状态。此类巨噬细胞为表示为“肿瘤相关性巨噬细胞”(tam)的那些。为了确定本发明的肽是否可以影响巨噬细胞极化,进行以下实验。从雄性c57bl/6j(thejacksonlaboratory,barharbor,me)中收集原代骨髓细胞。小鼠骨髓巨噬细胞在体外通过在具有10%fbs和30ng/ml鼠科m-csf(集落刺激因子)的dulbecco最小必需培养基(dmem)中培养6天来由原代骨髓细胞分化。在第7天,将巨噬细胞铺板到12孔板中并且在具有(i)il-4肽(20ng/ml)、(ii)inf-γ(10ng/ml)或(iii)既无il-4也无inf-γ的dmem(10%fbs)中培养24小时。在24小时之后,用纯dmem置换培养基并且将细胞再培养48小时。分别将所得巨噬细胞(i)m2-极化、(ii)m1-极化或者(iii)未分化。将含有每ml大约70,000个未分化巨噬细胞的巨噬细胞样品用100nmrp-182(seqidno:121)孵育72小时。在孵育之后,活细胞计数表明每ml存在68,000个细胞。类似地,将m1-极化的巨噬细胞用100nmrp-182孵育72小时产生每ml68,000个细胞的活细胞计数。因此,rp-182对m1巨噬细胞的生存力几乎不具有影响。相比之下,将m2-极化的巨噬细胞用100nmrp-182孵育72小时产生每ml仅20,000个细胞的活细胞计数。结果表明rp-182减少m2巨噬细胞的生存力。实施例12:检查点抑制剂和配体的下调基于其对检查点抑制剂(例如,pd-1)及其配体(例如,pd-l1和pd-l2)的预测的亲和力,还评价本发明的多肽,以确定处理的组织中的这些蛋白质的浓度在体内是否会下调。在一个实验中,允许转基因p53/kras小鼠中的肿瘤的体积生长至大约100m3,并且然后仅用媒介物或10mg/kgrp-182每日皮下处理动物一次,持续一周,在此之后处死动物并且将肿瘤切下、福尔马林固定并用pd-1(图19)、pd-l1和pd-l2(图20)的抗体染色。从图中可以清楚地看出,检查点抑制剂pd-1及其每个配体pd-l1和pd-l2在体内在使用本公开的肽处理的组织中显著下调。实施例13:肿瘤生长的抑制还测试本发明的多肽对非转移乳腺癌小鼠模型中的肿瘤生长的作用。将mcf-7人非转移乳腺癌细胞在37℃、5%co2下在正常生长培养基中孵育。在80%至90%融合下收获细胞。将免疫功能受损的无胸腺裸小鼠(j:nu)分成2个组(每组9只动物)。用~4.5x106mcf-7细胞注射所有小鼠,所述细胞已用vivotracker680染色并且悬浮在200μlpbs/matrigel混合物中。在处理的动物的背面上使用装备有500μl注射器的22号针皮下注射细胞。向动物分配媒介物和肽处理。用rp-397多肽(seqidno:194)处理肽处理的动物。将新鲜制备的rp-397肽以100μm浓度溶解在无菌盐水中并且将其用于处理肽组的动物。仅使用盐水缓冲液注射媒介物处理的动物。所有处理均使用装备有1ml注射器的271/2号针向肿瘤物质每周注射两次,持续5周。每周测量三次动物体重和肿瘤体积并且进行荧光标记,接着进行vivotracker680和ivis成像。结果示出在以下表17中。表17:使用rp-397的肿瘤生长抑制肿瘤生长速率以mm3/天来测量。“*”表示与媒介物对照的统计学显著差异。数据显示本发明的多肽可以在体内抑制肿瘤生长。实施例14:施用肽与化学疗法的组合假设炎症在肿瘤发生和转移中有重要作用并且已知m2巨噬细胞活性与肿瘤发展相关联,预期施用本发明的肽可有利地影响癌症治疗结果。为了测试此理论,在左上乳头下用~5x106个人三阴性乳腺癌细胞(mda-mb-231)注射免疫功能受损(“裸”)小鼠的组。在此施用之后,一个组仅接受媒介物;两个组接受化学治疗剂吉西他滨,其q4d剂量为40mg/kg体重。这些组之一还接受每日剂量为5mg/kg体重的rp-182(seqidno:121);并且第四组仅接受每日剂量为5mg/kg体重的rp-182。在研究第32天开始,在吉西他滨+rp-182组中,将rp-182的浓度增加至20mg/kg体重。在初始细胞施用之后不同时间点评定肿瘤体积(图21)。在50天之后,处死小鼠。数据表明与仅使用吉西他滨的处理相比,使用吉西他滨和本发明的多肽的组合处理引起平均肿瘤体积的减小。当rp-182浓度增加至20mg/kg体重,肿瘤体积的增加大致上停止。在第二个实验中,将c42b前列腺癌细胞的异种移植物引入到四个小鼠组中,并且在处理之前允许肿瘤生长至大约100m3。一个组仅用媒介物处理;第二个组使用以2.5mg/kg体重每周施用一次多西他赛处理;第三组使用以10mg/kg体重每天皮下施用的rp-182处理;并且第四组使用以2.5mg/kg每周施用一次的多西他赛和以10mg/kg每日施用一次的rp-182二者处理。在初始细胞施用之后的不同时间点评定肿瘤体积(图22);在27天之后,处死小鼠。类似地,施用rp-182加上多西他赛与单独的多西他赛相比引起平均肿瘤体积的降低。预期本发明的肽当与除吉西他滨和多西他赛之外的化学治疗剂以及检查点抑制剂疗法和其他免疫疗法一起施用时将产生协同作用。具体地说,本发明的肽当与最近开发的car-t(嵌合抗原受体/t细胞)疗法结合使用时可以是特别有用的。此类疗法在破坏肿瘤细胞的同时产生非常高的全身性死细胞物质负荷,从而过度刺激免疫系统并产生可能对患者致命的“细胞因子风暴”。实施方案提供以下实施方案以说明本发明的各个方面。1.一种包含肽的抗炎性组合物,其中所述肽的长度为3至24个氨基酸残基并且包含由交替的xm模块和yn模块组成的条带性亲疏区域,其中m和n为鉴别不同模块的正整数,其中每个xm模块由根据式xma-xmb-xmc-xmd-xme的序列组成,其中xma选自由天然存在的亲水性氨基酸、非天然存在的亲水性氨基酸和亲水性氨基酸模拟物组成的组,并且其中xmb、xmc、xmd和xme各自单独地不存在或选自由天然存在的亲水性氨基酸、非天然存在的亲水性氨基酸和亲水性氨基酸模拟物组成的组,其中每个yn模块由根据式yna-ynb-ync-ynd-yne的序列组成,其中yna选自由天然存在的疏水性氨基酸、非天然存在的疏水性氨基酸和疏水性氨基酸模拟物组成的组,其中ynb、ync、ynd和yne各自单独地不存在或者选自由天然存在的疏水性氨基酸、非天然存在的疏水性氨基酸和疏水性氨基酸模拟物组成的组,并且其中所述肽结合至nfkbii类蛋白上的二聚位点。2.如实施方案1所述的抗炎性组合物,其中每个xm模块由根据式xma-xmb-xmc-xmd的序列组成,并且每个yn模块由根据式yna-ynb-ync-ynd的序列组成。3.如实施方案1所述的抗炎性组合物,其中每个xm模块由根据式xma-xmb-xmc的序列组成,并且每个yn模块由根据式yna-ynb-ync的序列组成。4.如实施方案1至3中任一项所述的抗炎性组合物,其中所述肽还结合至人血清白蛋白。5.如实施方案1至4中任一项所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域含有至少两个xm模块(x1、x2和x3)和至少两个yn模块(y1、y2和y3)。6.如实施方案1至5中任一项所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域含有至少七个氨基酸残基。7.如实施方案1至6中任一项所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域具有7至12个氨基酸残基的长度。8.如实施方案1至7中任一项所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域构成所述肽的所述长度的至少25%。9.如实施方案1至8中任一项所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域在生理条件下具有两亲性构象。10.如实施方案9所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域当结合至nfkbii类蛋白时具有两亲性310-螺旋构象、两亲性α-螺旋构象或两亲性π-螺旋构象。11.如实施方案10所述的抗炎性组合物,其中所述两亲性310-螺旋、α-螺旋或π-螺旋构象包含具有至少100°面部弧度的的疏水性部分。12.如实施方案1至11中任一项所述的抗炎性组合物,其中所述条带性亲疏区域含有总容积为至少650立方埃的疏水性氨基酸残基。13.如实施方案1至12中任一项所述的抗炎性组合物,其中所述条带性亲疏区域的特征在于疏水性氨基酸残基的容积的总和与亲水性氨基酸残基的容积的总和的比率,其中所述比率为至少0.75或更高。14.如实施方案9所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域包含至少一个脯氨酸残基并且采用包含富含脯氨酸的螺旋的两亲性构象。15.如实施方案9所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域采用两亲性β链构象。16.如实施方案1至13中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由式i定义的序列的组的序列:y1a-y1b-y1c-x1a-y2a-y2b-y2c(式i)。17.如实施方案16所述的抗炎性组合物,其中所述模块y1a-y2b-y2c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)、leu-leu-leu(lll)、cys-cys-cys(ccc)、met-met-met(mmm)、val-val-val(vvv)以及ile-ile-ile(iii)。18.如实施方案16所述的抗炎性组合物,其中所述模块y1a-y1b-y1c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)和tyr-tyr-tyr(yyy)。19.如实施方案16至18中任一项所述的抗炎性组合物,其中所述模块y2a-y2b-y2c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)、tyr-tyr-tyr(yyy)、leu-leu-leu(lll)、cys-cys-cys(ccc)、met-met-met(mmm)、val-val-val(vvv)以及ile-ile-ile(iii)。20.如实施方案16至18中任一项所述的抗炎性组合物,其中所述模块y2a-y2b-y2c具有选自由以下组成的组的序列:phe-phe-phe(fff)、trp-trp-trp(www)和tyr-tyr-tyr(yyy)。21.如实施方案16所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列:fff-x1a-fff(seqidno:1)、www-x1a-www(seqidno:2)以及yyy-x1a-yyy(seqidno:3)。22.如实施方案16所述的抗炎性组合物,其中所述三个模块的序列选自由以下组成的组:lll-x1a-lll(seqidno:4)、ccc-x1a-ccc(seqidno:5)、mmm-x1a-mmm(seqidno:6)、vvv-x1a-vvv(seqidno:7)以及iii-x1a-iii(seqidno:8)。23.如实施方案16至22中任一项所述的抗炎性组合物,其中x1a选自由以下组成的组:arg(r)、his(h)和lys(k)。24.如实施方案16至22中任一项所述的抗炎性组合物,其中x1a选自由以下组成的组:glu(e)、gln(q)、asn(n)以及asp(d)。25.如实施方案16至24中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由式ii定义的序列的组或由式iii定义的序列的组的序列:y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a(式ii);x2a-y3a-x3a-y1a-y1b-y1c-x1a-y2a-y2b-y2c(式iii)。26.如实施方案25所述的抗炎性组合物,其中x2a和x3a单独地选自由以下组成的组:arg(r)、his(h)、lys(k)、glu(e)、gln(q)、asn(n)以及asp(d)。27.如实施方案25所述的抗炎性组合物,其中x2a和x3a各自单独地选自由以下组成的组:glu(e)、gln(q)、asn(n)以及asp(d)。28.如实施方案25至27中任一项所述的抗炎性组合物,其中y3a选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)以及ile(i)。29.如实施方案25至27中任一项所述的抗炎性组合物,其中y3a选自由以下组成的组:phe(f)、trp(w)、tyr(y)以及leu(l)。30.如实施方案25所述的抗炎性组合物,其中x2a-y3a-x3a的序列选自由以下组成的组:efq、efe、efn、efd、nfq、nfe、nfn、nfd、qfq、qfe、qfn、qfd、dfq、dfe、dfn、dfd、ewq、ewe、ewn、ewd、nwq、nwe、nwn、nwd、qwq、qwe、qwn、qwd、dwq、dwe、dwn、dwd、eyq、eye、efn、eyd、nyq、nye、nyn、nyd、qyq、qye、qyn、qyd、dyq、dye、dyn、dyd、elq、ele、eln、eld、nlq、nle、nln、nld、qlq、qle、qln、qld、dlq、dle、dln、dld、rfr、rfq、rfe、rfn、rfd、rwr、rwq、rwe、rwn以及rwd。31.如实施方案25所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp394、rp108-rp123、rp125-131、rp133、rp135-rp141、rp143-rp146、rp148-rp150、rp152-rp165、rp179、rp395、rp211、rp230、rp232、rp258、rp267、rp268、rp271以及rp273(分别为seqidno:33-95)。32.如实施方案25所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp113(seqidno:39)、rp118(seqidno:44)和rp394(seqidno:33)。33.如实施方案1至13中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由式vii定义的序列的组的序列:y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a(式vii)。34.如实施方案33所述的抗炎性组合物,其中y2a选自由以下组成的组:phe(f)、trp(w)以及tyr(y)。35.如实施方案33所述的抗炎性组合物,其中y2a选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)以及ala(a)。36.如实施方案33至35中任一项所述的抗炎性组合物,其中y2b选自由以下组成的组:phe(f)、trp(w)以及tyr(y)。37.如实施方案33至35中任一项所述的抗炎性组合物,其中y2b选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)以及ala(a)。38.如实施方案33至37中任一项所述的抗炎性组合物,其中x1b选自由以下组成的组:arg(r)、lys(k)以及his(h)。39.如实施方案33至37中任一项所述的抗炎性组合物,其中x1b选自由以下组成的组:asn(n)、gln(q)、asp(d)以及glu(e)。40.如实施方案33至39中任一项所述的抗炎性组合物,其中x2a选自由以下组成的组:arg(r)、lys(k)以及his(h)。41.如实施方案33至39中任一项所述的抗炎性组合物,其中x2a选自由以下组成的组:asn(n)、gln(q)、asp(d)以及glu(e)。42.如实施方案33所述的抗炎性组合物,其中所述序列x1b-y2a-y2b-x2a选自由以下组成的组:lys-phe-phe-lys(kffk)、lys-trp-trp-lys(kwwk)、lys-tyr-try-lys(kyyk)、lys-phe-trp-lys(kfwk)、lys-trp-phe-lys(kwfk)、lys-phe-tyr-lys(kfyk)、lys-tyr-phe-lys(kyfk)、lys-trp-tyr-lys(kwyk)以及lys-tyr-trp-lys(kywk)。43.如实施方案33所述的抗炎性组合物,其中所述序列x1b-y2a-y2b-x2a选自由以下组成的组:arg-phe-phe-arg(rffr)、arg-trp-trp-arg(rwwr)、arg-tyr-try-arg(ryyr)、arg-phe-trp-arg(rfwr)、arg-trp-phe-arg(rwfr)、arg-phe-tyr-arg(rfyr)、arg-tyr-phe-arg(ryfr)、arg-trp-tyr-arg(rwyr)以及arg-tyr-trp-arg(rywr)。44.如实施方案33所述的抗炎性组合物,其中所述序列x1b-y2a-y2b-x2a选自由以下组成的组:his-phe-phe-his(hffh)、his-trp-trp-his(hwwh)、his-tyr-try-his(hyyh)、his-phe-trp-his(hfwh)、his-trp-phe-his(hwfh)、his-phe-tyr-his(hfyh)、his-tyr-phe-his(hyfh)、his-trp-tyr-his(hwyh)以及his-tyr-trp-his(hywh)。45.如实施方案33至44中任一项所述的抗炎性组合物,其中x1a选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。46.如实施方案33至44中任一项所述的抗炎性组合物,其中x1a选自由以下组成的组:arg(r)和gln(q)。47.如实施方案33至46中任一项所述的抗炎性组合物,其中x2b选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。48.如实施方案33至46中任一项所述的抗炎性组合物,其中x2b选自由以下组成的组:arg(r)和gln(q)。49.如实施方案33至48中任一项所述的抗炎性组合物,其中y1a选自由以下组成的组:phe(f)、trp(w)以及tyr(y)。50.如实施方案33至48中任一项所述的抗炎性组合物,其中y1a选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)以及ala(a)。51.如实施方案33至50中任一项所述的抗炎性组合物,其中y3a选自由以下组成的组:phe(f)、trp(w)以及tyr(y)。52.如实施方案33至50中任一项所述的抗炎性组合物,其中y3a选自由以下组成的组:leu(l)、cys(c)、met(m)、val(v)、ile(i)以及ala(a)。53.如实施方案33所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列:f-x1a-x1b-ff-x2a-x2b-f(seqidno:9)、f-x1a-x1b-ff-x2a-x2b-w(seqidno:10)、w-x1a-x1b-ff-x2a-x2b-f(seqidno:11)、f-x1a-x1b-fw-x2a-x2b-f(seqidno:12)、f-x1a-x1b-wf-x2a-x2b-f(seqidno:13)、f-x1a-x1b-ww-x2a-x2b-f(seqidno:14)、w-x1a-x1b-ww-x2a-x2b-f(seqidno:15)、f-x1a-x1b-ww-x2a-x2b-w(seqidno:16)、w-x1a-x1b-ww-x2a-x2b-w(seqidno:17)、f-x1a-x1b-ff-x2a-x2b-y(seqidno:18)、y-x1a-x1b-ff-x2a-x2b-f(seqidno:19)、f-x1a-x1b-fy-x2a-x2b-f(seqidno:20)、f-x1a-x1b-yf-x2a-x2b-f(seqidno:21)、f-x1a-x1b-yy-x2a-x2b-f(seqidno:22)、y-x1a-x1b-yy-x2a-x2b-f(seqidno:23)、f-x1a-x1b-yy-x2a-x2b-y(seqidno:24)以及y-x1a-x1b-yy-x2a-x2b-y(seqidno:25)、y-x1a-x1b-yy-x2a-x2b-w(seqidno:26)、w-x1a-x1b-yy-x2a-x2b-y(seqidno:27)、y-x1a-x1b-yw-x2a-x2b-y(seqidno:28)、y-x1a-x1b-wy-x2a-x2b-y(seqidno:29)、y-x1a-x1b-ww-x2a-x2b-y(seqidno:30)、w-x1a-x1b-ww-x2a-x2b-y(seqidno:31)以及y-x1a-x1b-ww-x2a-x2b-w(seqidno:32)。54.如实施方案53所述的抗炎性组合物,其中x1a、x1b、x2a和x2b各自独立地选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。55.如实施方案53或54所述的抗炎性组合物,其中x1b和x2a各自独立地选自由以下组成的组:arg(r)、lys(k)和his(h)。56.如实施方案33至55中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y1a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为疏水性氨基酸残基。57.如实施方案56所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。58.如实施方案33至55中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y3a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为疏水性氨基酸残基。59.如实施方案58所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。60.如实施方案33至55中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y1a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为亲水性氨基酸残基。61.如实施方案60所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。62.如实施方案33至55中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y3a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为亲水性氨基酸残基。63.如实施方案62所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。64.如实施方案56、57、60或61中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y3a的第二个另外的氨基酸残基,其中所述第二个另外的氨基酸残基为疏水性氨基酸残基。65.如实施方案64所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。66.如实施方案58、59、62或63中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式vii的y1a的第二个另外的氨基酸残基,其中所述第二个另外的氨基酸残基为亲水性氨基酸残基。67.如实施方案66所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。68.如实施方案33所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp124、rp132、rp134、rp142、rp147、rp151、rp166-rp172、rp175、rp177、rp182、rp183、rp185、rp186、rp424、rp190、rp194、rp198、rp199-rp202、rp204、rp206、rp207、rp209、rp210、rp212-rp216、rp218、rp219、rp425、rp225、rp227、rp233-rp239、rp398、rp241-rp247、rp250-rp256以及rp426(分别为seqidno:106-170)。69.如实施方案33所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp124(seqidno:106)、rp166(seqidno:112)、rp182(seqidno:121)以及rp183(seqidno:122)。70.如实施方案1至15中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由式i-xlviii和式l中任一项所定义的序列的组的序列:y1a-y1b-y1c-x1a-y2a-y2b-y2c(式i);y1a-y1b-y1c-x1a-y2a-y2b-y2c-x2a-y3a-x3a(式ii);x2a-y3a-x3a-y1a-y1b-y1c-x1a-y2a-y2b-y2c(式iii);x1a-x1b-x1c-y2a-x2a-x2b-x2c(式iv);y1a-x1a-x1b-x1c-y2a-x2a-x2b-x2c-y3a-x3a(式v);x1a-x1b-y2a-y2b-x2a-x2b(式vi);y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a(式vii);y1a-x1a-x1b-y2a-y2b-x2a-x2b-y3a-y3b-x3a(式viii);y1a-y1b-x1a-x1b-y2a-y2b-x2a-x2b-y3a-y3b(式ix);y1a-y1b-x1a-x1b-y2a-y2b-x2a-x2b-y3a-x3a(式x);x1a-y1a-x2a-x2b-y2a-y2b-x3a-x3b-y3a-y3b(式xi);x1a-y1a-y1b-x2a-x2b-y2a-y2b-x3a-x3b-y3a(式xii);y1a-x1a-x1b-y2a-y2b-x2a-x2b-x2c-y3a-y3b(式xiii);x1a-x1b-x1c-y1a-y1b-x2a-x2b-y2a-y2b-y2c(式xiv);y1a-y1b-y1c-x1a-x1b-y2a-y2b-x2a-x2b-x2c(式xv);y1a-y1b-x1a-x1b-x1c-y2a-y2b-x2a-x2b-y3a(式xvi);y1a-y1b-x1a-x1b-y2a-y2b(式xvii);x1a-y1a-y1b-x2a-x2b-y2a-y2b-x3a(式xviii);y1a-y1b-x1a-x1b-y2a-y2b-x2a-y3a-y3b-x3a(式xix);x1a-y1a-y1b-x2a-y2a-y2b-x3a-x3b-y3a-y3b(式xx);y1a-y1b-x1a-x1b-y2a-x2a-x2b-y3a-y3b(式xxi);x1a-y1a-y1b-x2a-x2b-x2c-y2a-x3a-y3a-y3b(式xxii);y1a-y1b-x1a-y2a-x2a-x2b-x2c-y3a-y3b-x3a(式xxiii);x1a-x1b-y1a-x2a-y2a-x3a-x3b(式xxiv);y1a-y1b-y1c-x1a-x1b-y2a-x2a-y3a-x3a-x3b(式xxv);x1a-x1b-y1a-x2a-y2a-x3a-x3b-y3a-y3b-y3c(式xxvi);x1a-x1b-x1c-y1a-y1b-y1c(式xxvii);x1a-x1b-x1c-x1d-y1a-y1b-y1c-y1d(式xxviii);y1a-x1a-x1b-x1c-x1d-y2a-y2b-y2c-y2d-x2a(式xxix);x1a-x1b-x1c-x1d-x1e-y1a-y1b-y1c-y1d-y1e(式xxx);y1a-y1b-x1a-x1b-x1c-y2a-y2b-y2c-x2a-x2b(式xxxi);x1a-y1a-x2a-y2a-x3a-x3b-x3c-y3a-y3b-y3c(式xxxii);y1a-y1b-y1c-x1a-x1b-x1c(式xxxiii);y1a-y1b-y1c-y1d-x1a-x1b-x1c-x1d(式xxxiv);x1a-y1a-y1b-y1c-y1d-x2a-x2b-x2c-x2d-y2a(式xxxv);y1a-y1b-y1c-y1d-y1e-x1a-x1b-x1c-x1d-x1e(式xxxvi);x1a-x1b-y1a-y1b-y1c-x2a-x2b-x2c-y2a-y2b(式xxxvii);y1a-y1b-y1c-x1a-x1a-x1c-y2a-x2a-y3a-x3a(式xxxviii);y1a-x1a-x1b-x1c-x1d-x1e-y2a(式xxxix);y1a-x1a-x1b-x1c-x1d-x1e-y2a-y2b-y2c-y2d(式xl);y1a-y1b-x1a-x1b-x1c-x1d-x1e-y2a-y2b-y2c(式xli);y1a-y1b-y1c-x1a-x1b-x1c-x1d-x1e-y2a-y2b(式xlii);y1a-y1b-y1c-y1e-x1a-x1b-x1c-x1d-x1e-y2a(式xliii);x1a-y1a-y1b-y1c-y1d-y1e-x2a(式xliv);x1a-y1a-y1b-y1c-y1d-y1e-x2a-x2b-x2c-x2d(式xlv);x1a-x1b-y1a-y1b-y1c-y1d-y1e-x2a-x2b-x2c(式xlvi);x1a-x1b-x1c-y1a-y1b-y1c-y1d-y1e-x2a-x2b(式xlvii);x1a-x1b-x1c-x1d-y1a-y1b-y1c-y1d-y1e-x2a(式xlviii);以及y1a-y1b-x1a-y2a-y2b-x2a-y3a-y3b-x3a-y4a(式l)。71.如实施方案70所述的抗炎性组合物,其中y1a、y1b、y1c、y2a、y2b、y2c、y3a、y3b以及y3c各自单独地选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、cys(c)、met(m)、val(v)、ile(i)以及ala(a)。72.如实施方案70所述的抗炎性组合物,其中y1a、y1b、y1c、y2a、y2b、y2c、y3a、y3b以及y3c各自单独地选自由以下组成的组:phe(f)、trp(w)以及tyr(y)。73.如实施方案70至72中任一项所述的抗炎性组合物,其中x1a、x1b、x1c、x2a、x2b、x2c、x3a以及x3b各自单独地选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。74.如实施方案70至73中任一项所述的抗炎性组合物,其中x1a、x1b、x1c、x2a、x2b、x2c、x3a以及x3b各自单独地选自由以下组成的组:arg(r)、lys(k)、his(h)以及gln(q)。75.如实施方案70至74中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的n末端的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为疏水性氨基酸残基。76.如实施方案70所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。77.如实施方案70至74中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的c末端的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为疏水性氨基酸残基。78.如实施方案77所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。79.如实施方案70至74中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的n末端的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为亲水性氨基酸残基。80.如实施方案79所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。81.如实施方案70至74中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的c末端的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为亲水性氨基酸残基。82.如实施方案81所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。83.如实施方案75、76、79或80中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的c末端的第二个另外的氨基酸残基,其中所述第二个另外的氨基酸残基为疏水性氨基酸残基。84.如实施方案83所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。85.如实施方案77、78、81或82中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式i-xlviii和式l中任一种的n末端的第二个另外的氨基酸残基,其中所述第二个另外的氨基酸残基为亲水性氨基酸残基。86.如实施方案81所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。87.如实施方案70所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由以下组成的组的序列,大致上由所述序列组成或者由所述序列组成:rp396、rp405、rp174、rp176、rp178、rp180-181、rp184、rp408、rp187、rp416、rp188、rp189、rp388、rp417、rp191-rp193、rp404、rp196、rp397、rp197、rp402、rp203、rp409、rp205、rp208、rp217、rp220-rp224、rp226、rp229、rp231、rp240、rp248、rp249、rp415、rp257、rp259-rp266、rp269、rp272、rp406、rp422、rp407、rp400、rp419、rp401、rp423、rp411、rp418、rp428、rp420、rp421、rp429、rp413、rp430、rp270(分别为seqidno:174-224和234-249)。88.如实施方案1至9或15中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含选自由式xlix定义的序列的组的序列:y1a-x1a-y2a-x2a-y3a-x3a(式xlix)。89.如实施方案88所述的抗炎性组合物,其中y1a、y2a和y3a各自独立地选自由以下组成的组:phe(f)、trp(w)、tyr(y)、leu(l)、ile(i)、cys(c)以及met(m)。90.如实施方案88所述的抗炎性组合物,其中y1a、y2a和y3a各自独立地选自由以下组成的组:phe(f)、trp(w)和tyr(y)。91.如实施方案88至90中任一项所述的抗炎性组合物,其中x1a、x2a和x3a各自独立地选自由以下组成的组:arg(r)、lys(k)、his(h)、gln(q)、glu(e)、asn(n)以及asp(d)。92.如实施方案88至90中任一项所述的抗炎性组合物,其中x1a、x2a和x3a各自独立地选自由以下组成的组:arg(r)、lys(k)和his(h)。93.如实施方案88至92中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式xlix的y1a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为亲水性氨基酸残基。94.如实施方案93所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)、his(h)、asn(n)、gln(q)、asp(d)以及glu(e)。95.如实施方案93所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:arg(r)、lys(k)和his(h)。96.如实施方案88至92中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式xlix的x3a的第一个另外的氨基酸残基,其中所述第一个另外的氨基酸残基为疏水性氨基酸残基。97.如实施方案96所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)、(tyr)、leu(l)、ile(i)、cys(c)以及met(m)。98.如实施方案96所述的抗炎性组合物,其中所述第一个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和(tyr)。99.如实施方案93至95中任一项所述的抗炎性组合物,其中所述条带性亲疏区域包含直接结合至式xlix的x3a的第二个另外的氨基酸残基,其中所述第二个另外的氨基酸残基为疏水性氨基酸残基。100.如实施方案99所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)、(tyr)、leu(l)、ile(i)、cys(c)以及met(m)。101.如实施方案99所述的抗炎性组合物,其中所述第二个另外的氨基酸残基选自由以下组成的组:phe(f)、trp(w)和tyr(y)。102.一种包含肽的抗炎性组合物,其中所述肽的长度为3至24个氨基酸残基并且包含与序列nfnfffrfff(rp394,seqidno:33)具有至少70%同一性的条带性亲疏区域,其中所述肽结合至nfkbii类蛋白上的二聚位点。103.如实施方案102所述的抗炎性组合物,其中所述肽还结合至人血清白蛋白。104.如实施方案102或103所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列nfnfffrfff(seqidno:33)之间的差异被限制为保守性或高度保守性氨基酸取代。105.如实施方案102或103所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列nfnfffrfff(seqidno:33)的差异在于用选自由以下组成的组的氨基酸残基取代一个或多个苯丙氨酸(f)残基:trp(w)、tyr(y)、his(h)以及leu(l)。106.如实施方案102或103所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列nfnfffrfff(seqidno:33)的差异在于一个、两个或三个氨基酸的缺失。107.如实施方案106所述的抗炎性组合物,其中所述缺失的氨基酸位于序列nfnfffrfff(seqidno:33)的n末端、c末端或两端。108.一种包含肽的抗炎性组合物,其中所述肽的长度为3至24个氨基酸残基并且包含与序列fffrfffnfn(rp118,seqidno:44)具有至少70%同一性的条带性亲疏区域,其中所述肽结合至nfkbii类蛋白上的二聚位点。109.如实施方案108所述的抗炎性组合物,其中所述肽还结合至人血清白蛋白。110.如实施方案108或109所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列fffrfffnfn(seqidno:44)之间的差异被限制为保守性或高度保守性氨基酸取代。111.如实施方案108或109所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列fffrfffnfn(seqidno:44)的差异在于用选自由以下组成的组的氨基酸残基取代一个或多个苯丙氨酸(f)残基:trp(w)、tyr(y)、his(h)以及leu(l)。112.如实施方案108或109所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列fffrfffnfn(seqidno:44)的差异在于一个、两个或三个氨基酸的缺失。113.如实施方案112所述的抗炎性组合物,其中所述缺失的氨基酸位于序列fffrfffnfn(seqidno:44)的n末端、c末端或两端。114.一种包含肽的抗炎性组合物,其中所述肽的长度为3至24个氨基酸残基并且包含与序列ffrkfakrfk(rp183,seqidno:122)具有至少70%同一性的条带性亲疏区域,其中所述肽结合至nfkbii类蛋白上的二聚位点。115.如实施方案114所述的抗炎性组合物,其中所述肽还结合至人血清白蛋白。116.如实施方案114或115所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列ffrkfakrfk(seqidno:122)之间的差异被限制为保守性或高度保守性氨基酸取代。117.如实施方案114或115所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列ffrkfakrfk(seqidno:122)的差异在于用选自由以下组成的组的氨基酸残基取代一个或多个苯丙氨酸(f)残基:trp(w)、tyr(y)以及leu(l)。118.如实施方案114或115所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列ffrkfakrfk(seqidno:122)的差异在于一个、两个或三个氨基酸的缺失。119.如实施方案118所述的抗炎性组合物,其中所述缺失的氨基酸位于序列ffrkfakrfk(seqidno:122)的n末端、c末端或两端。120.一种包含肽的抗炎性组合物,其中所述肽的长度为3至24个氨基酸残基并且包含与序列kfrkafkrff(rp182,seqidno:121)具有至少70%同一性的条带性亲疏区域,其中所述肽结合至nfkbii类蛋白上的二聚位点。121.如实施方案120所述的抗炎性组合物,其中所述肽还结合至人血清白蛋白。122.如实施方案120或121所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列kfrkafkrff(seqidno:121)之间的差异被限制为保守性或高度保守性氨基酸取代。123.如实施方案120或121所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列kfrkafkrff(seqidno:121)的差异在于用选自由以下组成的组的氨基酸残基取代一个或多个苯丙氨酸(f)残基:trp(w)、tyr(y)以及leu(l)。124.如实施方案120或121所述的抗炎性组合物,其中所述肽的所述条带性亲疏区域与序列kfrkafkrff(seqidno:121)的差异在于一个、两个或三个氨基酸的缺失。125.如实施方案124所述的抗炎性组合物,其中所述缺失的氨基酸位于序列kfrkafkrff(seqidno:121)的n末端、c末端或两端。126.如实施方案1至125中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至relb(seqidno:367)上的二聚位点。127.如实施方案1至126中任一项所述的抗炎性组合物,其中所述肽结合至relb(seqidno:367)上的二聚位点并且直接接触选自由以下组成的组的relb的至少一个氨基酸残基:glu298、tyr-300、leu-301、leu-302、asp-330、his-332以及leu-371。128.如实施方案127所述的抗炎性组合物,其中所述肽当结合至relb上的二聚位点时与asp-330形成离子键,与his-332形成离子键,和/或与leu-371进行疏水性接触。129.如实施方案1至128中任一项所述的抗炎性组合物,其中所述肽结合至选自由以下组成的组至少一个信号分子:tgfβ(seqidno:368)、notch1(seqidno:369)、wnt8r(seqidno:370)、trail(seqidno:371)、il6r(seqidno:372)、il10r(seqidno:373)、egfr(seqidno:374)、cdk6(seqidno:375)、组蛋白甲基转移酶(hmt)(seqidno:376)、cd47(seqidno:377)、sirp-α(seqidno:378)、cd206(seqidno:379)、tgm2(seqidno:380);legumain(seqidno:413)、cd209(seqidno:414)、fas(seqidno:415)、pd-1(seqidno:416)、mkk7(seqidno:417)以及rnr(seqidno:418)。130.如实施方案129所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至tgfβ(seqidno:368)。131.如实施方案129或130所述的抗炎性组合物,其中所述肽结合至tgfβ(seqidno:368)并且直接接触选自由以下组成的组的tgfβ的至少一个氨基酸残基:leu-20、ile-22、phe-24、asp-27、leu-28、trp-30、trp-32、tyr-39、phe-43、pro-80、leu-83、leu-101以及ser-112。132.如实施方案129至131中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至notch1(seqidno:369)。133.如实施方案120至123中任一项所述的抗炎性组合物,其中所述肽结合至notch(seqidno:369)并且直接接触选自由以下组成的组的notch的至少一个氨基酸残基:phe-1520、gln-1523、arg-1524、glu-1526、ala-1553、glu-1556、trp-1557、cys-1562、his-1602、arg-1684、gln-1685、cys-1686、ser-1691、cys-1693、phe-1694以及phe-1703。134.如实施方案129至133中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至wnt8r(seqidno:370)。135.如实施方案129至134中任一项所述的抗炎性组合物,其中所述肽结合至wnt8r(seqidno:370)并且直接接触选自由以下组成的组的wnt8r的至少一个氨基酸残基:tyr-52、gln-56、phe-57、asn-58、met-91、tyr-100、lys-101、pro-103、pro-105、pro-106、arg-137以及asp-145。136.如实施方案129至135中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至trail(seqidno:371)。137.如实施方案120至127中任一项所述的抗炎性组合物,其中所述肽结合至trail(seqidno:371)并且直接接触选自由以下组成的组的trail的至少一个氨基酸残基:arg-130、arg-158、ser-159、gly-160、his-161、phe-163、tyr-189、arg-189、gln-193、glu-195、glu-236、tyr-237、leu-239、asp-267、asp-269、his-270以及glu-271。138.如实施方案129至137中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至il6r(seqidno:372)。139.如实施方案129至138中任一项所述的抗炎性组合物,其中所述肽结合至il6r(seqidno:372)并且直接接触选自由以下组成的组的il6r的至少一个氨基酸残基:glu-163、gly-164、phe-168、gln-190、phe-229、tyr-230、phe-279以及gln-281。140.如实施方案129至139中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至il10r(seqidno:373)。141.如实施方案129至140中任一项所述的抗炎性组合物,其中所述肽结合至il10r(seqidno:373)并且直接接触选自由以下组成的组的il10r的至少一个氨基酸残基:tyr-43、ile-45、glu-46、asp-61、asn-73、arg-76、asn-94、arg-96、phe-143、ala-189、ser-190以及ser-191。142.如实施方案129至141中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至egfr(seqidno:374)。143.如实施方案129至142中任一项所述的抗炎性组合物,其中所述肽结合至egfr(seqidno:374)并且直接接触选自由以下组成的组的egfr的至少一个氨基酸残基:leu-10、thr-40、trp-41、leu-63、his-66、asp-68、leu-88、tyr-101、asp-48以及phe-51。144.如实施方案129至143中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至cdk6(seqidno:375)。145.如实施方案129至144中任一项所述的抗炎性组合物,其中所述肽结合至cdk6(seqidno:375)并且直接接触选自由以下组成的组的cdk6的至少一个氨基酸残基:val-142、arg-144、asp-145、ser-171、val-180、val-181、leu-183、arg-186、val-190、gln-193、tyr-196以及val-200。146.如实施方案129至145中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至组蛋白甲基转移酶(hmt)(seqidno:376)。147.如实施方案129至146中任一项所述的抗炎性组合物,其中所述肽结合至hmt(seqidno:376)并且直接接触选自由以下组成的组的hmt的至少一个氨基酸残基:asn-69、his-70、ser-71、lys-72、asp-73、pro-74以及asn-75。148.如实施方案129至147中任一项所述的抗炎性组合物,其中所述肽以至少-550kcal/mol的结合能结合至cd47(seqidno:377)上的sirp-α结合位点。149.如实施方案129至148中任一项所述的抗炎性组合物,其中所述肽结合至cd47(seqidno:377)并且直接接触选自由以下组成的组的cd47的至少一个氨基酸残基:glu-29、ala-30、glu-35、val-36、tyr-37、lys-39、thr-49、asp-51、glu-97、thr-99、leu-101、thr-102、arp-103、glu-104以及glu-106。150.如实施方案129至149中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至sirp-α(seqidno:378)上的cd47结合位点。151.如实施方案129至150中任一项所述的抗炎性组合物,其中所述肽结合至sirp-α(seqidno:378)并且直接接触选自由以下组成的组的sirp-α的至少一个氨基酸残基:leu-30、gln-37、gln-52、lys-53、ser-66、thr-67、arg-69、met-72、phe-74、lys-96以及asp-100。152.如实施方案129至151中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至cd206(seqidno:379)。153.如实施方案129至152中任一项所述的抗炎性组合物,其中所述肽结合至cd206(seqidno:379)并且直接接触选自由以下组成的组的cd206的至少一个氨基酸残基:glu-725、tyr-729、glu-733、asn-747以及asp-748。154.如实施方案129至153中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至tgm2(seqidno:380)。155.如实施方案129至154中任一项所述的抗炎性组合物,其中所述肽结合至tgm2(seqidno:380)并且直接接触选自由以下组成的组的tgm2的至少一个氨基酸残基:cys-277、his-335和asp-358。156.如实施方案129至155中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至legumain(seqidno:413)。157.如实施方案129至156中任一项所述的抗炎性组合物,其中所述肽结合至legumain(seqidno:413)并且直接接触选自由以下组成的组的legumain的至少一个氨基酸残基:asn-44、arg-46、his-159、glu-189、cys-191、ser-217、ser-218以及asp-233。158.如实施方案129至157中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至cd209(seqidno:414)。159.如实施方案129至158中任一项所述的抗炎性组合物,其中所述肽结合至cd209(seqidno:414)并且直接接触选自由以下组成的组的cd209的至少一个氨基酸残基:phe-269、glu-280、glu-303、asn-305、asn-306、glu-310、asp-311、ser-316、gly-317、asn-321以及lys-324。160.如实施方案129至159中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至fas(seqidno:415)。161.如实施方案129至160中任一项所述的抗炎性组合物,其中所述肽结合至fas(seqidno:415)并且直接接触选自由以下组成的组的fas的至少一个氨基酸残基:lys-251、lys-296、lys-299、leu-303、leu-306、ala-307、glu-308、lys-309、gln-311、ile-314、leu-315、asp-317、ile-318以及thr-319。162.如实施方案129至161中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至pd-1(seqidno:416)。163.如实施方案129至162中任一项所述的抗炎性组合物,其中所述肽结合至pd-1(seqidno:416)并且直接接触选自由以下组成的组的pd-1的至少一个氨基酸残基:val-64、asn-66、tyr-68、met-70、thr-76、lys-78、thr-120、leu-122、ala-125以及ser-127。164.如实施方案129至163中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至mkk7(seqidno:417)。165.如实施方案129至164中任一项所述的抗炎性组合物,其中所述肽结合至mkk7(seqidno:417)并且直接接触选自由以下组成的组的mkk7的至少一个氨基酸残基:met-142、val-150、lys-152、lys-165、met-212、met-215、thr-217、lys-221、leu-266、cys-276以及asp-277。166.如实施方案129至165中任一项所述的抗炎性组合物,其中所述肽以至少-600kcal/mol的结合能结合至rnr(seqidno:418)。167.如实施方案129至166中任一项所述的抗炎性组合物,其中所述肽结合至rnr(seqidno:418)并且直接接触选自由以下组成的组的rnr的至少一个氨基酸残基:asn-426、leu-427、cys-428、glu-430、met-606、pro-608以及ala-610。168.如实施方案1至167中任一项所述的抗炎性组合物,其中所述肽以至少-650kcal/mol的结合能结合至人血清白蛋白(hsa)(seqidno:381)。169.如实施方案1至168中任一项所述的抗炎性组合物,其中所述肽包含排他地由d型氨基酸残基组成的条带性亲疏区域。170.如实施方案1至169中任一项所述的抗炎性组合物,其中所述肽在溶液中的浓度为约0.1mg/ml至约100mg/ml。171.如实施方案1至170中任一项所述的抗炎性组合物,其中所述组合物含有约1mg至约500mg的所述肽。172.如实施方案158或171所述的抗炎性组合物,其中所述组合物基本上不含有除所述肽之外的蛋白质。173.一种抗炎性组合物,其包含如实施方案1至171中任一项所定义的第一肽与如实施方案1至171中任一项所定义的第二肽的组合,其中所述第一肽和所述第二肽可以具有相同的序列或不同的序列。174.如实施方案173所述的抗炎性组合物,其中所述第一肽和所述第二肽通过肽键、肽接头或非肽接头连接在一起。175.如实施方案173所述的抗炎性组合物,其中所述第一肽和所述第二肽通过肽接头连接在一起,其中所述肽接头具有选自由以下组成的组的序列:gly-gly-gly(ggg)、gly-gly-gly-arg(gggr)、gly-pro-gly(gpg)以及gly-pro-gly-arg(gpgr)。176.如实施方案174或175所述的抗炎性组合物,其中所述连接的第一肽和第二肽以至少-700kcal/mol的结合能结合至relb(seqidno:367)上的二聚位点。177.如实施方案1至171和实施方案173至176中任一项所述的抗炎性组合物,其还包含血清白蛋白。178.如实施方案177所述的抗炎性组合物,其中所述组合物基本上不含有除血清白蛋白之外的血液蛋白质。179.一种药物组合物,其包含如实施方案1至178中任一项所述的抗炎性组合物和药学上可接受的载体。180.如实施方案179所述的药物组合物,其中所述组合物包含化学治疗剂。181.一种治疗与慢性炎症相关的病状的方法,所述方法包括向罹患所述病状的受试者施用根据实施方案1至180中任一项所述的组合物。182.如实施方案181所述的方法,其中所述病状选自由以下组成的组:易激性肠病、溃疡性结肠炎、结肠炎、克罗恩病、特发性肺纤维化、哮喘、角膜炎、关节炎、骨关节炎、类风湿性关节炎、自身免疫病、猫或人免疫缺陷病毒(fiv或hiv)感染以及癌症。183.如实施方案181或182所述的方法,其中所述受试者为哺乳动物。184.如实施方案181至183中任一项所述的方法,其中所述受试者为人。185.如实施方案181至184中任一项所述的方法,其中所述抗炎性组合物以包含约1mg与约500mg之间的肽的剂量施用。186.如实施方案181至185中任一项所述的方法,其中所述抗炎性组合物静脉内地、腹膜内地、肠胃外地、原位地、皮下地、局部地、经鼻地、通过可植入贮库、使用基于纳米粒子的递送系统、微针贴片、微球、珠粒、渗透泵或机械泵和/或其他机械装置来施用。187.如实施方案181至186中任一项所述的方法,其中所述抗炎性组合物与已知有效治疗所述病状的另一种药物组合施用。188.如实施方案187所述的方法,其中所述抗炎性组合物在施用所述另一种药物之前、同时或者之后施用。189.一种治疗受试者中的纤维化的方法,所述方法包括向所述受试者施用根据实施方案1至180中任一项所述的组合物。190.如实施方案189所述的方法,其中所述纤维化选自由以下组成的组:肺纤维化、皮肤纤维化、肝纤维化、肾纤维化以及由电离辐射所引起的纤维化。191.如实施方案189或190所述的方法,其中所述受试者为哺乳动物。192.如实施方案189至191中任一项所述的方法,其中所述受试者为人。193.如实施方案189至192中任一项所述的方法,其中所述抗炎性组合物以包含约1mg与约500mg之间的肽的剂量施用。194.如实施方案189至193中任一项所述的方法,其中所述抗炎性组合物静脉内地、腹膜内地、肠胃外地、原位地、皮下地、局部地、经鼻地、通过可植入贮库、使用基于纳米粒子的递送系统、微针贴片、微球、珠粒、渗透泵或机械泵和/或其他机械装置来施用。195.如实施方案189至194中任一项所述的方法,其中所述抗炎性组合物与已知有效治疗纤维化的另一种药物组合施用。196.如实施方案195所述的方法,其中所述抗炎性组合物在施用所述另一种药物之前、同时或者之后施用。197.一种减少罹患慢性炎症病状的受试者中的促炎性细胞因子水平的方法,所述方法包括向所述受试者施用根据实施方案1至180中任一项所述的组合物。198.如实施方案197所述的方法,其中所述慢性炎症病状选自由以下组成的组:易激性肠病、溃疡性结肠炎、结肠炎、克罗恩病、特发性肺纤维化、哮喘、角膜炎、关节炎、骨关节炎、类风湿性关节炎、自身免疫病、猫或人免疫缺陷病毒(fiv或hiv)感染以及癌症。199.如实施方案197或198所述的方法,其中所述方法减小选自由以下组成的组的至少一种细胞因子的水平:nf-kb、tnfα、il1、il6、il12、mmp-1、mmp-9、mcp-1、il8、il17以及il23。200.如实施方案199所述的方法,其中所述至少一种细胞因子的水平减小至少10%。201.如实施方案197至200中任一项所述的方法,其中所述受试者为哺乳动物。202.如实施方案197至201中任一项所述的方法,其中所述受试者为人。203.如实施方案197至202中任一项所述的方法,其中所述抗炎性组合物以包含约1mg与约500mg之间的肽的剂量施用。204.如实施方案197至203中任一项所述的方法,其中所述抗炎性组合物静脉内地、腹膜内地、肠胃外地、原位地、皮下地、局部地、经鼻地、通过可植入贮库、使用基于纳米粒子的递送系统、微针贴片、微球、珠粒、渗透泵或机械泵和/或其他机械装置来施用。205.如实施方案197至204中任一项所述的方法,其中所述抗炎性组合物与已知有效治疗所述受试者所罹患的所述慢性炎症病状的另一种药物组合施用。206.如实施方案205所述的方法,其中所述抗炎性组合物在施用所述另一种药物之前、同时或者之后施用。207.一种治疗受试者中的癌症的方法,所述方法包括向所述受试者施用根据实施方案1至180中任一项所述的抗炎性组合物。208.如实施方案207所述的方法,其中所述癌症选自由以下组成的组:结肠癌和乳腺癌。209.如实施方案207或208所述的方法,其中所述抗炎性组合物与化学治疗剂或细胞治疗剂组合施用。210.如实施方案209所述的方法,其中所述化学治疗剂或细胞治疗剂选自由以下组成的组:类固醇类、蒽环类、甲状腺激素替代药物、胸苷酸靶向药物、检查点抑制剂药物、嵌合抗原受体/t细胞治疗剂以及其他细胞治疗剂。211.如实施方案209所述的方法,其中所述化学治疗剂选自由以下组成的组:吉西他滨、多西他赛、博莱霉素、埃罗替尼、吉非替尼、拉帕替尼、伊马替尼、达沙替尼、尼罗替尼、伯舒替尼、克唑替尼、色瑞替尼、曲美替尼、贝伐单抗、舒尼替尼、索拉非尼、曲妥珠单抗、ado-trastuzumabemtansine、利妥昔单抗、依匹单抗、雷帕霉素、坦西莫司、依维莫司、甲氨蝶呤、阿霉素、abraxane、folfirinox、顺铂、卡铂、5-氟脲嘧啶、teysumo、紫杉醇、脱氢可的松、左甲状腺素以及培美曲塞。212.如实施方案209至211中任一项所述的方法,其中所述抗炎性组合物在施用所述化学治疗剂或细胞治疗剂之前、同时或者之后施用。213.如实施方案207或208所述的方法,其中所述抗炎性组合物与辐射疗法组合施用。214.如实施方案213所述的方法,其中所述抗炎性组合物在所述辐射疗法施用之前或之后施用。215.如实施方案207至214中任一项所述的方法,其中所述受试者为哺乳动物。216.如实施方案207至215中任一项所述的方法,其中所述受试者为人。217.如实施方案207至216中任一项所述的方法,其中所述抗炎性组合物以包含约1mg与约500mg之间的肽的剂量施用。218.如实施方案207至217中任一项所述的方法,其中所述抗炎性组合物静脉内地、腹膜内地、肠胃外地、原位地、皮下地、经鼻地、通过可植入贮库、使用基于纳米粒子的递送系统、微针贴片、微球、珠粒、渗透泵或机械泵和/或其他机械装置来施用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1