用含血浆来源免疫球蛋白M(IgM)的组合物治疗传染病的方法与流程
相关申请的交叉引用
本申请要求2015年8月6日提交的美国临时专利申请号62/201,910的优先权,其全部内容通过引用被明确并入本文。
发明领域
本发明涉及一种用于治疗传染病的方法,所述方法包括向需要其的患者施用包含血浆来源IgM的组合物。本发明还涉及一种用于中和在活跃的微生物感染期间分泌的细胞毒性外毒素的方法,所述方法包括向需要其的患者施用包含血浆来源IgM的组合物。
发明背景
微生物物种可变得对被感染的患者高度有害,如果个体不能清除感染,或者如果患者对治疗不响应的话。感染还可变成脓毒性的,从被感染的器官扩散进血流中。对于患者,这些脓毒性感染具有不良预后(poor outcome),通常导致器官衰竭及死亡。
问题是,大部分的抗生素靶向活的微生物自身以治疗感染。IgM已被表征为防止由微生物内毒素的全身性效应造成的细菌性感染的毒性脓毒性方面。这些内毒素是细胞壁(特别是革兰氏阴性菌中的)的组分。这些治疗方法无一靶向或已显示出靶向微生物外毒素、超抗原或分泌性酶。
尽管血浆来源IgM可结合并防止内毒素介导的对患者的毒性被良好地表征,但这并未解决从微生物主动分泌的其他蛋白及毒素。内毒素的毒性效应通常是对由抗生素或患者的免疫系统引起的细菌死亡或溶菌的响应。这些效应与在微生物感染期间观察到的由微生物主动分泌的蛋白,诸如外毒素引起的毒性事件是不同的。对防止、抑制或减少除了内毒素之外的从微生物分泌的蛋白和毒素的毒性效应的组合物及方法仍存在需求。
发明概述
本发明基于治疗剂量的血浆来源IgM中和在活跃的微生物感染期间分泌的微生物蛋白,诸如分泌的细胞毒性外毒素的有害影响的出乎意料的中和效应的发现。本发明利用了血浆来源IgM对微生物蛋白的特异性。如以上解释的,IgM结合为糖蛋白的微生物内毒素并且该结合利用IgM对糖蛋白和碳水化合物的普遍结合是被熟知的。
在现有技术中,已描述了若干种单克隆抗体,但这些单克隆抗体仅单独地针对单一抗原性靶。另一方面,天然的血浆来源IgM包含过多的能够同时靶向许多不同的抗原的潜在抗原结合位点并因此不依赖于单一治疗模式。
此外,本发明利用来源于标准血液分级过程,例如Grifols’Gamunex分级过程的废物流的IgM来源。
因此,在第一方面,本发明涉及一种用于治疗传染病的方法,所述方法包括向需要其的患者施用包含血浆来源IgM的组合物。换言之,本发明的实施方案提供了一种用于治疗受试者中的传染病的方法,所述方法包括向所述受试者施用组合物,所述组合物包含以下、主要由以下组成或由以下组成:血浆来源IgM和任选地以药物载体形式的一种或更多种赋形剂,其中所述组合物以有效中和所述患者中的微生物蛋白产物的量施用。
在第二方面,本发明涉及一种用于中和在活跃的微生物感染期间分泌的细胞毒性外毒素的方法,所述方法包括向需要其的患者施用包含血浆来源IgM的组合物。换言之,本发明的实施方案提供了一种用于中和受试者中的微生物蛋白产物的方法,所述方法包括向所述受试者施用组合物,所述组合物包含以下、主要由以下组成或由以下组成:血浆来源IgM及任选地以药物载体形式的一种或更多种赋形剂,其中所述组合物以有效中和所述微生物蛋白产物的量施用。
所述细胞毒性外毒素可由若干种微生物分泌,诸如大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、肺炎克雷伯杆菌(Klebsiella pneumoniae)、肺炎链球菌(Streptococcus pneumoniae)、艰难梭菌(Clostridium difficile)、肉毒梭菌(Clostridium botulinum)、黄曲霉(Aspergillus flavus)及其组合。
优选地,包含血浆来源IgM的组合物从标准分级过程的废物流获得。血浆来源IgM具有至少70%(w/v)、更优选地至少90%(w/v)且最优选地至少95%(w/v)的纯度。
还优选地,待被施用的血浆来源IgM的剂量的范围为每千克患者从75mg至1g、优选地从75mg/kg至600mg/kg、更优选地从75mg/kg至300mg/kg。该剂量可以以每日、每隔一日、3x/周或每周一次的方案施用。
任选地,血浆来源IgM的组合物还包含选自小分子抗生素、天然或合成的肽抗微生物剂或具有抗微生物特性的蛋白或者其组合的其他分子。
小分子抗生素的实例是万古霉素和美洛培南。具有抗微生物特性的蛋白的实例是乳铁蛋白。
在本发明的方法中,血浆来源IgM的组合物可单独地或与选自由包括抗炎剂的治疗性分子和免疫调节剂组成的组的其他治疗性分子组合使用。
附图简述
下文将参考以下附图描述本发明的实施方案,其中:
图1示出了IgM对铜绿假单胞菌外毒素A的免疫反应性。示出了代表性ELISA在450nm处的吸光度OD读数。靶抗原铜绿假单胞菌外毒素A(P.A.ExA)被包被在ELISA板上。从Gammunex方法纯化的汇集的血浆或IgM被用作IgM的来源。如指示的,该样品在PBS中的多种稀释物被测试。对照是尚未用抗原包被的孔(未包被的)。对于每个柱示出了标准偏差。
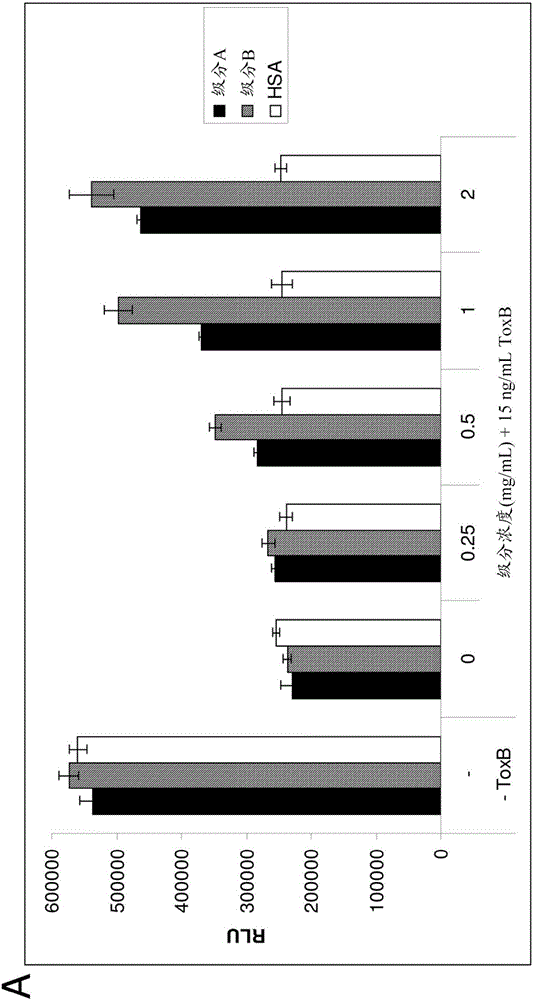
图2A和2B示出了对艰难梭菌毒素B细胞毒性的中和。在推荐的增殖培养基中培养Caco-2细胞(从ATCC获得)。将细胞以每孔8000个细胞接种于96孔板中。在初始铺板后24小时,细胞用如图例中描述的多种IgM制品和/或艰难梭菌毒素B来处理。如通过根据制造商的说明书进行的Cell Titer Glow(Promega Corp.Madison,WI,USA)测定测量的,细胞的相对数目的数据被示为RLU。图2A表明了两个不同批次的IgG和IgM的混合物(对于实心黑色柱和阴影柱,级分浓度分别为45%和70%-80%IgM)对艰难梭菌毒素B(Tox B)的中和特异性,但对于非特异性对照人血清白蛋白(空心柱)并不是这样;图2B还单独表明了增加的浓度的几乎纯的IgM(以微摩尔/L或μL计;实心黑色柱)对艰难梭菌毒素B(ToxB)的中和及对细胞生活力的救护。
图3示出了艰难梭菌毒素诱导的Caco-2通透性的中和。使Caco-2细胞在Transwell多孔板插入装置中通过通常方法分化。在分化21天之后,在处理开始之前即刻测量跨上皮电阻(TEER)。仅具有高于200的TEER测量值的那些孔被包括在该实验中。在16小时处理之后,测量TEER以确定处理对TEER的效应。将对照(未处理的细胞)设置成100%作为比较物。处理组被显示为与对照组TEER相比的相对百分比。对于萤光黄通透性实验,将具有高于200的TEER并按图中描述的处理的细胞与萤光黄(Life Technologies,Grand Island,NY USA)溶液一起在37℃孵育1小时。对Transwell插入装置的顶端隔室和基部隔室取样并评价萤光黄的存在。穿过Caco-2单层的萤光黄的百分比通过样品的荧光测量值来确定。穿过Caco-2单层的萤光黄的百分比数据被表示为通透性相对于被设置为1的值的对照的倍数增加。阐明了对于艰难梭菌毒素B(Tox B)介导的细胞对染料萤光黄的通透性(A)或对于上皮层的电阻(TEER,参见同上)(B)的剂量响应;在两种情况中均包括非毒素B对照(图的左侧)。在萤光黄通透性研究中,阐明了共施用IgM与毒素B(Tox B)的阳性中和效应。对于(C)中的代表性通透性,对照样品(无蛋白,最左边的柱)示出了单独的萤光黄的通透性,而除了在IgM(级分C)的存在下对毒素B(Tox B)的中和效应(从右边数第二个柱)之外,其余的柱,在添加或不添加人血清白蛋白(HSA)的情况下均显示出艰难梭菌毒素B(Tox B)引起的增加的通透性。对于(D)中的代表性跨上皮电阻测量值(TEER),不含蛋白的对照样品(实心柱,最左边)表现出细胞层的正常电阻,所述正常电阻在没有(实心柱,从左边数第二个)和伴有(HSA;实心柱,最右边)人血清白蛋白的艰难梭菌毒素B(Tox B)的存在下均显著降低。在毒素B(ToxB)的存在下,TEER被IgM(级分C)的恢复被示于该图中(Tox B+级分C;从右边数第二个)。
图4A和4B示出了对铜绿假单胞菌外毒素A细胞毒性的中和。在推荐的增殖培养基中培养Caco-2细胞(从ATCC获得)。将细胞以每孔4000个细胞接种于96孔板中。在初始铺板后24小时,将细胞用如图例中描述的多种IgM制品和/或铜绿假单胞菌外毒素A来处理。如根据制造商的说明书通过Cell Titer Glow(Promega Corp.Madison,WI,USA)测定测量的细胞的相对数目的数据被示为RLU。图4A阐明了两个不同批次的IgG和IgM的混合物(对于实心黑色柱和阴影柱,级分浓度分别为45%和70%-80%IgM)对假单胞菌属(Pseudomonas)外毒素A(ExA)的中和的特异性,但对于非特异性对照人血清白蛋白(空心柱)并不是这样;图4B还单独地阐明了增加的浓度的几乎纯的IgM(以微摩尔/L或μM计;实心黑色柱)对假单胞菌属外毒素A(P.A.ExA)的中和及对细胞生活力的救护。
图5示出了对破伤风梭菌(Clostridium tetani)类毒素效应的中和。将人外周血单核细胞在具有10%热灭活的人血清的RPMI中培养。对于增殖测定,使用培养基将3x105个细胞接种在96孔板的每个孔中。如图例中描述的处理细胞。相对细胞增殖通过Cell Titer Glow(Promega Corp.Madison,WI,USA)来确定并且根据制造商的说明书进行。将细胞增殖相对于值为1的实验对照标准化。
图6示出了IgM对细菌铜绿假单胞菌、肺炎链球菌和肺炎克雷伯杆菌的免疫反应性。示出了代表性全细胞(whole cell)ELISA在450nm处的吸光度OD读数。靶抗原是经甲醛处理的铜绿假单胞菌(白色柱)、肺炎链球菌(斜纹柱)及肺炎克雷伯杆菌(黑色柱),完整的细菌细胞被包被在ELISA板上。对照:仅用第二抗体孵育的细菌包被的孔或未用抗原包被的孔。
发明详述
本发明的实施方案提供了用于治疗受试者中的传染病的方法,所述方法包括向所述受试者施用组合物,所述组合物包含以下、主要由以下组成或由以下组成:血浆来源IgM及任选地以药物载体形式的一种或更多种赋形剂,其中组合物以有效中和所述患者中的微生物蛋白产物的量施用。
本发明的另一个实施方案提供了用于中和受试者中的微生物蛋白产物的方法,所述方法包括向所述受试者施用组合物,所述组合物包含以下、主要由以下组成或由以下组成:血浆来源IgM及任选地以药物载体形式的一种或更多种赋形剂,其中所述组合物以有效中和所述微生物蛋白产物的量施用。
本发明的另一个实施方案提供了组合物,所述组合物包含以下、主要由以下组成或由以下组成:血浆来源IgM及任选地以药物载体形式的一种或更多种赋形剂。根据特定的实施方案,一种或更多种赋形剂和/或药物载体是合成的,即,非天然存在的。
如本文使用的,“中和”微生物蛋白产物指减少、防止或消除微生物蛋白产物对受试者的毒性效应,例如,减少、防止或消除外毒素介导的对患者的毒性。
根据特定的实施方案,微生物蛋白产物选自由外毒素、超抗原和分泌性酶组成的组。优选地,微生物蛋白产物不包括微生物内毒素。
根据特定的实施方案,受试者在施用组合物之前已被诊断为患有细菌性感染。
如本文使用的,术语“药学上可接受的载体”指与本发明的血浆来源IgM一起被施用的稀释剂、佐剂、赋形剂或媒介物。此类载体可以是无菌液体,诸如水和油,所述油包括石油、动物、植物和合成来源的那些油,诸如花生油、大豆油、矿物油、芝麻油等,聚乙二醇,甘油,丙二醇或其他合成的溶剂。盐水溶液以及水性右旋糖(dextrose)和丙三醇溶液也可被用作液体载体,尤其是用于可注射溶液的液体载体。根据特定的实施方案,药学上可接受的载体是合成的(即,载体不是天然存在的)。
适合的赋形剂的非限制性实例包括淀粉、葡萄糖、乳糖、蔗糖、明胶、二氧化硅凝胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、丙三醇、丙二醇、水、乙醇等。赋形剂还可包括:润湿剂或乳化剂;或pH缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐;抗细菌剂,诸如苄醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸;以及用于调节张力(tonicity)的试剂,诸如氯化钠或葡萄糖。根据特定的实施方案,一种或更多种赋形剂是合成的(即,赋形剂不是天然存在的)。
细胞毒性外毒素可由若干种微生物分泌,诸如大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、肺炎克雷伯杆菌、肺炎链球菌、艰难梭菌、肉毒梭菌、黄曲霉及其组合。
优选地,包含血浆来源IgM的组合物从标准分级过程的废物流获得。血浆来源IgM具有至少70%(w/v)、更优选地至少90%(w/v)且最优选地至少95%(w/v)的纯度。
还优选地,待被施用的血浆来源IgM的剂量的范围为每千克患者从75mg至1g、优选地从75mg/kg至600mg/kg、更优选地从75mg/kg至300mg/kg。该剂量可以以每日、每隔一日、3x/周或每周一次的方案施用。
任选地,血浆来源IgM的组合物还包含其他分子,诸如小分子抗生素、天然或合成的肽抗微生物剂或具有抗微生物特性的蛋白或者其组合。
小分子抗生素的实例是万古霉素和美洛培南。具有抗微生物特性的蛋白的实例是乳铁蛋白。
在本发明的方法中,血浆来源IgM的组合物可单独地或与选自由包括抗炎剂的治疗性分子和免疫调节剂组成的组的其他治疗性分子组合使用。
本文描述的实施方案被意图是对本发明的示例,而不是对本发明的限制。本领域技术人员将领会到可对本公开内容的实施方案和实例做出修改而不偏离本公开内容的范围。
以上使用术语“包含(comprising)”及其变化形式描述了本发明的实施方案。但是,发明人的意图是,在本文描述的任何实施方案中,术语“包含”可被“由......组成(consisting of)”及“主要由......组成(consisting essentially of)”代替,而不偏离本发明的范围。除非另外指明,否则本文提供的所有值包括多达给定的起始点和结束点并且包括给定的起始点和结束点。
以下实施例进一步阐明本发明的实施方案,并且将被理解为是说明性的且不是对本发明的限制。
实施例
实施例1.IgM与外毒素、分泌性细菌酶和超抗原的免疫反应性.
本发明人开发了若干种ELISA以评价对由细菌铜绿假单胞菌、金黄色葡萄球菌、破伤风梭菌(C.tetani)及艰难梭菌(C.difficile)产生的多种靶抗原的免疫反应性(参见表1)。出乎意料地,所有蛋白性外毒素和酶被血浆来源IgM识别。观察到被评价的来自这些病原体的所有基于蛋白的抗原的阳性反应性。显示纯化的制品和血浆中的IgM的反应性的示例性ELISA示于图1中。
表1.通过ELISA评价的抗原性靶的归纳。符号“+”指示阳性反应性。由于IgM对革兰氏阴性内毒素具有反应性被良好地表征,大肠杆菌LPS被用作阳性对照。
实施例2.艰难梭菌毒素B的细胞毒性效应的中和
本发明的初步目的是提供对IgM中和外毒素的概念性验证(proof-of-concept)。由于艰难梭菌是肠道感染,选择利用生理上相关的细胞系用于研究。Caco-2细胞是常规用于肠道通透性研究的上皮结肠直肠细胞系。培养待在细胞毒性测定中使用的Caco-2。优化孵育时间和艰难梭菌毒素B的浓度(数据未示出)。孵育毒素B24小时未显示出任何毒性,并且随着孵育时间增加,细胞毒性也增加。另外,我们确定了25ng/mL在48小时给出最高的毒性测定窗,并且在该点显示出平稳期。将最后的测定条件设置在15ng/mL毒素B,与正在增殖的细胞一起孵育48小时。使用这些条件,评价并比较毒素与对IgM富集的纯化级分以及纯化的IgM的中和(图2)。级分A包含40%-50%的IgM,且级分B包含70%-80%的IgM。HSA对毒素B毒性没有影响,而包含IgM的2种不同的级分中和该毒素(图2A)。还显示出纯化的IgM(≥95%IgM)在中和艰难梭菌毒素B中是有效的(图2B)。在级分A、级分B和纯化的IgM中明显存在针对艰难梭菌的中和抗体。
实施例3.艰难梭菌毒素B诱导的通透性的中和.
如在前面的实施例中提及的,Caco-2细胞是被良好表征的肠道上皮运输和通透性的模型。艰难梭菌毒素的已知后果之一是肠道通透性。为了测试包含IgM的纯化级分是否能够中和该毒素效应,培养Caco-2用作肠道通透性模型。在该模型中,使Caco-2细胞在具有可渗透膜的孔插入装置上以单层分化21天。在分化后,可通过测量荧光小分子(在该情况中萤光黄)穿过细胞单层的能力以及通过使用TEER法(跨上皮电阻)测量由单层给予的电阻来监测通透性。当细胞具有增加的通透性时,在膜的基底外侧上发现萤光黄的量也增加。在电阻方面,具有较高通透性的细胞具有较低的电阻。为了显示这些差异可被测量,进行艰难梭菌毒素B的剂量响应(图3A和3B)。萤光黄横跨单层的能力以及单层的电阻两者响应于增加的剂量的毒素B均具有适当的相应变化。测试了级分C(富集至90%-95%IgM)中和毒素B介导的通透性的能力。将级分C和毒素B预孵育1小时以允许IgM与毒素结合。在预孵育后,将细胞用级分C和毒素B的混合物处理16小时。在该16小时的时间段之后,对细胞被萤光黄扩散通过单层的通透性(图3C)以及单层TEER(图3D)进行评价。对于两种测定方法,级分C提供针对毒素B的保护,而HSA对毒素B不具有效应。萤光黄具有完全的逆转,而电阻仅显示出部分救护。这也许是由于TEER比萤光黄测定法更灵敏。实施例4.铜绿假单胞菌外毒素A的细胞毒性效应的中和
鉴于来自具有艰难梭菌毒素B的中和的Caco-2细胞的阳性数据,开发了在Caco-2中的类似测定以测试铜绿假单胞菌外毒素A。当在该模型中评价级分A或级分B时,观察到对外毒素A的中和(图4A)。有趣的是,与艰难梭菌毒素B相比,发现了外毒素A对于这些级分的有效性的相反结果;对于外毒素A的中和,级分A比级分B更有效。另外,使用纯化的IgM,我们也观察到对铜绿假单胞菌外毒素A细胞毒性的中和(图4B)。
实施例5.破伤风梭菌类毒素的中和
破伤风毒素是阻断GABA释放的高度有效的神经毒素。美国的大部分个体接种了针对破伤风的疫苗。作为破伤风毒素中和的模型,利用破伤风毒素的无毒性类毒素形式来评价估纯化的IgM是否能够中和该蛋白。显示了IgM与破伤风类毒素的抗原性结合(参见表1)。由于该类毒素未显示出对GABA释放的阻断,IgM的中和效应通过外周血单核细胞(PBMC)的增殖来评价。已知TCR抗原的刺激能够诱导T细胞的增殖,且破伤风是被描述的对于该增殖的刺激物。因此,测试了在IgM的存在和不存在下破伤风类毒素诱导的PBMC增殖(图5)。观察到在单独的破伤风类毒素的存在下细胞数目的3倍增加,而与IgM的共处理在2.5μM下几乎完全阻断该效应,并且在5μM下显示出完全抑制。
实施例6.IgM对不同的微生物具有抗原性识别
为了更好地理解多种靶的多样性,进行了多种ELISA。使用多种商购可得的ELISA试剂盒检测与细菌性和病毒性病原体两者的反应性。另外,利用基于ELISA的测定,在所述测定中将整个的热杀死或甲醛处理的完整微生物包被在ELISA板上。该评价允许评价针对由微生物产生的“全部(global)”抗原靶抗原的反应性。对于所有ELISA和全细胞ELISA的数据被归纳于表2中,并且从这些数据,可得出结论,IgM具有普遍性的抗原识别。使用细菌铜绿假单胞菌、肺炎链球菌和肺炎克雷伯杆菌的全细胞ELISA中的IgM反应性的示例性ELISA数据集被示于图6中。
表2–已通过ELISA和全细胞ELISA评价的抗原性靶的归纳。符号“+”指示基于试剂盒标准对照的阳性IgM反应性,且“+弱”指示基于试剂盒标准对照的弱的IgM反应性。
- 还没有人留言评论。精彩留言会获得点赞!