PreS1用于制备乙肝疫苗以及治疗慢性乙型肝炎的用途的制作方法
本发明属于生物医学技术领域,涉及一种乙型肝炎病毒(hepatitis B virus,HBV)的疫苗及其制备方法,本发明还涉及所述疫苗预防乙肝病毒感染和治疗慢性乙型肝炎(chronic hepatitis B,CHB)感染的用途,以及所述疫苗联合HBsAg疫苗治疗慢性乙型肝炎的用途。
背景技术:
乙型肝炎病毒(hepatitis B virus,HBV)为双链DNA病毒,属于嗜肝性病毒,能够通过血液和体液接触进行传播。在感染肝脏后,HBV能够引发多种疾病,包括急性和慢性肝炎,肝纤维化,肝硬化和肝癌。全球范围内大约有2.4亿慢性乙型肝炎患者,每年有大约100万人死于HBV感染所导致的肝硬化和肝癌(1)。但是目前仍旧没有有效治疗慢性乙型肝炎的策略,现有的HBV治疗方式主要包括抗病毒药物(核苷类似物)和干扰素,它们虽然有一定的治疗效果疗效,但是通常不能诱导有效的免疫应答,从而无法彻底清除HBV感染;而且长期用药导致的副作用较大,抗病毒药物也会产生耐药性。慢性HBV感染是威胁人类身体健康的主要疾病之一,探索慢性乙型肝炎有效的免疫治疗策略迫在眉睫,研制慢性乙型肝炎的治疗性疫苗具有十分重要的社会意义和经济意义。
HBV疫苗研究主要分为三个发展阶段:第一代疫苗以患者血液提取乙肝病毒抗原HBsAg为疫苗;第二代疫苗由基因工程构建酵母表达重组HBsAg疫苗;第三代乙肝疫苗则由真核细胞表达乙肝病毒全长包膜蛋白基因,为含有L-HBsAg,M-HBsAg以及HBsAg的混合疫苗。乙肝病毒有三种包膜蛋白,分别是small HBsAg(S-HBsAg),简称为HBsAg,middle HBsAg(M-HBsAg)和large HBsAg(L-HBsAg)。S-HBsAg由226个氨基酸组成,是目前临床预防性乙肝疫苗的成分,也是慢性乙型肝炎患者血清中假病毒颗粒(pseudovirus)的主要成分;M-HBsAg是在HBsAg的N端连接 有一个55个氨基酸的preS2区域,也是假病毒颗粒的重要组成成分;L-HBsAg是在M-HBsAg的N端连接有一个由108个或119个氨基酸(根据乙肝不同亚型,ay型108个,ad型119个)组成的preS1区域。
目前preS1疫苗的研究,多集中在融合蛋白疫苗,如含有L-HBsAg的第三代HBV预防性疫苗(2),以及将preS1表位融合表达在HBV病毒核衣壳蛋白表面等等,以期提高其免疫原性(3)。研究表明第三代疫苗能够提高HBsAg的抗体应答率,在一些对传统疫苗没有应答的接种者体内,也能够诱导很好的抗体反应(4,5)。但是由于缺乏合适的动物模型,目前尚未明确第三代疫苗对慢性乙型肝炎的临床治疗性效果。另外,preS1N端的豆蔻酰化修饰能够将其插入到内质网膜,从而限制了L-HBsAg的分泌表达,这也成为限制第三代疫苗生产效率的因素(6,7)。再者,这些研究忽略了慢性乙型肝炎感染过程中,HBsAg,HBcAg蛋白的免疫耐受情况,将preS1同免疫耐受的抗原融合表达,很可能在慢性乙型肝炎中诱导preS1的免疫耐受,因而限制preS1疫苗的治疗性效果。
HBV诱导的免疫耐受,是治疗慢性乙型肝炎的瓶颈。在HBV感染过程中,HBV病毒粒子能够抑制pDC分泌一型干扰素(8),血清中大量游离的HBsAg和HBeAg可以抑制TLR受体活化从而影响pDC的功能(9,10)。这些都限制了天然免疫系统对于HBV感染的清除作用。获得性免疫对于HBV清除至关重要(11)。CD8+T细胞能够通过直接杀伤感染的肝脏细胞而控制HBV感染(12),CD4+T helper细胞则可以通过分泌IFN-γ,TNF-α等细胞因子,以及辅助特异性CTL应答来清除细胞内的HBV病毒(13)。另外,CD4+T helper细胞对于特异性病毒抗体的产生具有重要辅助作用。但是在CHB患者中,HBV特异性适应性免疫呈现耐受状态,无法对HBV常规疫苗产生应答,从而导致慢性持续性病毒感染。目前对于CHB免疫耐受机制的阐述仍不明确,有观点认为,CHB感染中持续的高水平的抗原和病毒滴度是导致免疫耐受的重要原因。高滴度病毒和抗原的持续,促使HBV特异性T细胞功能逐渐失活,直至最终凋亡而被清除(14,15)。另外由于肝脏的特殊性,高水平的抗原通常在该器官引起免疫耐受(16)。在临床研究中发现,在CHB感染过程中,HBV特异性T细胞上调多种免疫抑制分子影响其功能,如Bim,CTLA-4,PD-1,TIM-3等等(17-19);而且 CHB患者中存在更多的调节性T细胞(Treg)(20)。这些都限制了获得性免疫清除HBV感染的能力,是导致CHB持续感染的重要原因。
但是也有研究表明慢性HBV感染过程中,不同的病毒抗原存在不同的耐受状态。相对于HBeAg抗原诱导的免疫耐受,HBcAg能够在慢性感染者中诱导特异性IgM反应,但是,由于HBeAg和其序列的同源性,大量游离的HBeAg诱导针对HBcAg的特异性T细胞反应耐受(21,22)。同样Kazuhiro K.等发现,以HBV蛋白聚合酶(polymerase,HBp)作为疫苗可以在HBV转基因小鼠中诱发免疫应答,只是由于CTL数量以及质量的缺陷,HBp疫苗并没有较好的治疗效果(23)。
技术实现要素:
我们认为抗原滴度以及抗原免疫原性在诱导慢性HBV感染免疫反应中,发挥了重要作用。preS1的滴度远远低于HBV其它的包膜蛋白。而且最新的研究已经表明,preS1的N端能够同人肝脏细胞表面NTCP受体结合,从而介导HBV的感染(24)。因而preS1特异性抗体能够中和HBV病毒并且可以保护宿主免受HBV病毒的感染。构建基于preS1蛋白的疫苗能引发相应的抗体应答和T细胞免疫反应。以上特点显示preS1具有作为HBV疫苗的潜力,特别是具有治疗慢性HBV感染的潜力。
在一个方面,本发明提供了一种乙肝病毒感染治疗策略。
在一个方面,本发明提供了一种通过原核表达系统,该系统能够用于表达纯化preS1蛋白。
在一个方面,本发明提供了一种联合佐剂促进preS1免疫反应的策略,通过将preS1抗原和佐剂混合,能够显著增强preS1免疫原性。
在一个方面,本发明提供了一种采用preS1抗原作为疫苗,直接用于预防HBV感染的策略,其同临床使用的HBsAg疫苗具有相同的保护性效果。
在一个方面,本发明提供了一种采用preS1抗原作为疫苗,治疗慢性乙型肝炎的策略,直接以preS1作为疫苗能够在慢性乙型肝炎感染宿主体内诱导强将的免疫应答,显著降低HBV相关抗原的表达,并且清除血清中HBV病毒,同时阻断病毒对于肝脏细胞的感染。
在一个方面,本发明提供了一种采用preS1抗原作为疫苗,联合乙肝包膜蛋白HBsAg蛋白作为慢性乙型肝炎治疗的策略,该策略能够最终诱导慢性乙型肝炎宿主体内HBsAg-HBsAb的血清学转化,同时显著清除肝内的HBV病毒,对于慢性乙型肝炎感染具有一定的治愈效果。
具体地,本发明涉及以下各项:
1.一种用于慢性乙型肝炎病毒感染的治疗性疫苗,所述疫苗的活性成分是氨基酸序列与乙型肝炎病毒包膜蛋白的preS1区域的氨基酸序列相同的蛋白质。
2.根据1所述的疫苗,其中所述preS1区域的氨基酸序列如SEQ ID NO:2或SEQ ID NO:4所示。
3.根据1所述的疫苗,所述疫苗还包含佐剂。
4.根据3所述的疫苗,其中所述佐剂选自铝佐剂(Alum)、Toll样受体4激活剂配体MPLA、Toll样受体9配体,寡聚脱氧核苷酸(CpG-ODN)和弗氏佐剂。
5.氨基酸序列与乙型肝炎病毒包膜蛋白的preS1区域的氨基酸序列相同的蛋白质在制备用于慢性乙型肝炎病毒感染的治疗性疫苗中的用途。
6.如SEQ ID NO:2或SEQ ID NO:4所示的氨基酸序列在制备用于慢性乙型肝炎病毒感染的治疗性疫苗中的用途。
7.如SEQ ID NO:1或SEQ ID NO:3所示的核酸序列在制备用于慢性乙型肝炎病毒感染的治疗性疫苗中的用途。
8.一种用于慢性乙型肝炎病毒感染的治疗性疫苗试剂盒,所述试剂盒包含氨基酸序列与乙型肝炎病毒包膜蛋白的preS1区域的氨基酸序列相同的蛋白质和乙型肝炎病毒包膜蛋白HBsAg。
9.氨基酸序列与乙型肝炎病毒包膜蛋白的preS1区域的氨基酸序列相同的蛋白质联合乙型肝炎病毒包膜蛋白HBsAg在制备用于慢性乙型肝炎病毒感染的治疗性疫苗试剂盒中的用途。
附图说明
图1显示了原核表达系统纯化preS1蛋白的流程和结果。包括纯化过程中不同阶段蛋白聚丙烯酰胺凝胶(SDS-PAGE)电泳结果和纯化后preS1 蛋白SDS-PAG电泳结果和蛋白质印迹(Western Blot)的结果,preS1(ay亚型)为108个氨基酸,蛋白大小约12KD,preS1(ad亚型)为119个氨基酸,蛋白大小约为13KD。
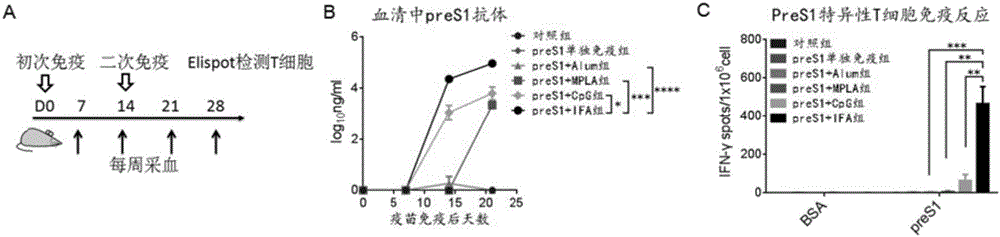
图2显示了preS1疫苗免疫野生小鼠(WT)的流程,及preS1疫苗免疫后产生的抗体应答和特异性T细胞免疫应答。通过以preS1蛋白包被,以ELISA进行抗体检测,通过Elispot检测preS1特异性T细胞免疫应答。
图3显示了preS1作为疫苗预防HBV感染过程中诱导的免疫应答。通过ELISA检测抗体特异性B细胞抗体应答,通过Elispot检测特异性T细胞免疫应答。
图4显示了preS1作为疫苗预防HBV感染的能力。通过preS1通过ELISA检测HBV相关抗原的维持情况,通过荧光定量PCR(Q-PCR)检测血清中HBV病毒滴度。
图5显示了preS1作为疫苗阻断HBV感染肝脏细胞的能力。将anti-preS1抗血清同HBV病毒共孵育后,同时加入到感染细胞HepG2-hNTCP中,感染24h。之后用新鲜培养基洗涤三次,进行换液,以后每隔2天收取感染上清,检测上清中HBsAg,HBeAg抗原的表达水平,同时在感染最后一天收集细胞,提取总RNA,通过反转录荧光定量PCR(RT-qPCR)检测HBV相关基因表达水平。结果显示preS1作为疫苗产生的anti-preS1抗体应答能够显著降低HepG2-hNTCP培养上清中的HBsAg和HBeAg,同时qPCR也显示anti-preS1显著阻断了HBV对肝脏细胞的感染。
图6显示了preS1作为疫苗治疗HBV慢性感染的流程以及在慢性HBV感染模型中诱导特异性免疫应答的能力。通过尾静脉注射AAV-HBV1.3感染小鼠,我们构建了慢性HBV感染模型,该模型表现出同临床CHB一致的病毒学和免疫学表症,为研究慢性HBV感染提供了研究平台。实验结果表明目前临床用HBV疫苗(成分为HBsAg),不能够在慢性HBV感染中产生免疫应答,不具有治疗慢性HBV感染的能力,而preS1疫苗免疫慢性HBV感染能够诱导强劲的免疫应答,包括诱导preS1到anti-preS1的血清学转化,诱导preS1特异性T细胞免疫应答,而且其强度同preS1疫苗在WT小鼠中诱导的免疫应答强度相同。
图7显示了preS1疫苗治疗慢性HBV感染的能力和效果,同时与HBV 传统疫苗(成分为HBsAg)作用于慢性HBV感染进行了对比。传统HBV疫苗对于慢性HBV感染没有任何治疗性效果,但是preS1抗原疫苗能够显著清除血清中HBV相关抗原,并且清除血清中HBV DNA。
图8显示了在慢性HBV感染过程中,preS1疫苗诱导的抗体应答能够阻断HBV对于肝脏细胞的感染。
图9显示了preS1联合HBsAg作为疫苗,在慢性HBV感染中能够打破HBV免疫耐受。
图10显示了preS1HBsAg作为疫苗,在慢性HBV感染中诱导HBsAg-HBsAb血清学转化,并清除肝内HBV病毒感染。达到治愈慢性HBV感染的效果。
具体实施方式
下面的实施例仅用于进一步阐释本发明的内容,而不意欲在任何方面限制本发明。本领域技术人员将领会,可对下述具体实施方式进行修饰而仍不偏离所附的权利要求所要求保护的本发明的范围、精神和主旨。
在下面的所有实施例中,如无特别声明,均采用本领域技术人员惯常所用的方法、仪器、试剂和实验方案等。
实施例1:本疫苗的表达纯化
以AAV-HBV1.3(购自北京五加和分子医学研究所有限公司)感染的小鼠肝脏cDNA(通过提取耐受小鼠肝脏组织总RNA,逆转录获得)为模板,设计特异性引物,通过PCR反应扩增得到HBV PRES1(ay亚型)DNA片段,其核苷酸序列为:
ATGGGGCAGAATCTTTCCACCAGCAATCCTCTGGGATTCTTTCCCGACCACCAGTTGGATCCAGCCTTCAGAGCAAACACAGCAAATCCAGATTGGGACTTCAATCCCAACAAGGACACCTGGCCAGACGCCAACAAGGTAGGAGCTGGAGCATTCGGGCTGGGTTTCACCCCACCGCACGGAGGCCTTTTGGGGTGGAGCCCTCAGGCTCAGGGCATACTACAAACTTTGCCAGCAAATCCGCCTCCTGCCTCCACCAATCGCCAGACAGGAAGGCAGCCTACCCCGCTGTCTCCACCTTTGAGAAACACTCATCCTCAGGC C(SEQ ID NO:1)
其氨基酸序列为:
MGQNLSTSNPLGFFPDHQLDPAFRANTANPDWDFNPNKDTWPDANKVGAGAFGLGFTPPHGGLLGWSPQAQGILQTLPANPPPASTNRQTGRQPTPLSPPLRNTHPQA(SEQ ID NO:2)
另外,HBV PRES1(ad亚型)DNA序列为:
ATGGGAGGTTGGTCATCAAAACCTCGCAAAGGCATGGGGACGAATCTTTCTGTTCCCAACCCTCTGGGATTCTTTCCCGATCATCAGTTGGACCCTGCATTCGGAGCCAACTCAAACAATCCAGATTGGGACTTCAACCCCATCAAGAACCACTGGCCAGCAGCCAACCAGGTAGGAGTGGGAGCATTCGGGCCAGGACTCACCCCTCCACACGGCGGTATTTTGGGGTGGAGCCCTCAGGCTCAGGGCATATTGACCACAGTGTCAACAATTCCTCCTCCTGCCTCCACCAATCGGCAGTCAGGAAGGCAGCCTACTCCCATCTCTCCACCTCTAAGAGACAGTCATCCTCAGGCC(SEQ ID NO:3)
其氨基酸序列为:
MGGWSSKPRKGMGTNLSVPNPLGFFPDHQLDPAFGANSNNPDWDFNPIKDHWPAANQVGVGAFGPGLTPPHGGILGWSPQAQGILTTVSTIPPPASTNRQSGRQPTPISPPLRDSHPQA(SEQ ID NO:4)。
所用引物序列如下:
PRES1-F:5’-CGGGATCCATGGGGCAGAATCTTTCCACCA-3’(SEQ ID NO:5)
PRES1-R:5’-CCGCTCGAGCTAGGCCTGAGGATGAGTGTTTCT-3’(SEQ ID NO:6)
通过限制性内切酶BamHI以及XhoI(购买自New England Biolabs(UK)公司)处理,将得到的preS1核苷酸序列通过T4DNA连接酶(购买自New England Biolabs(UK)公司)构建于sumo-pET-28a(购自Novogen公司)为表达载体,将连接产物转化入Top10感受态细胞(购买自北京天根生化科技有限公司),挑取单克隆菌落并进行菌落PCR鉴定与酶切鉴定。鉴定成功后保存菌落,并命名为sumo-pET-28a-preS1。
将sumo-pET-28a-preS1质粒转化到E.coli BL21(DE3)表达菌株(购买 自北京天根生化科技有限公司),通过0.1-1mM IPTG进行诱导表达,将诱导后菌体收集并进行高压裂解,收集到的细胞上清。通过Ni-NTA进行分离纯化,使用Elution Buffer(PBS Binding Buffer+20mM/50mM/100mM/200mM/500mM咪唑)进行分段梯度洗脱,每个梯度5-10个柱体积,洗脱液分管收集,用蛋白指示液(Bio-Rad protein assay)观察洗脱峰。SDS-PAGE电泳检测洗脱峰蛋白纯度,将纯度大于90%蛋白收集管混合(图1A)。利用Zeba脱盐离心柱或浓缩离心柱(购自Thermo Fisher公司)将目的蛋白溶液置换到所需要的PBS缓冲液中(注意调节缓冲液pH=8左右)。然后将合并在一起的蛋白上清中加入SUMO protease蛋白酶,4℃,过夜酶切,将preS1蛋白N端的SUMO-tag切掉(图1B)。切掉的SUMO tag N端含有his-tag,可以再通过Ni-柱分离his-SUMO和preS1。分离得到的preS1中会含有部分SUMO,为了进一步纯化preS1,通过阴离子交换柱(GE healthcare,HiTrap Q HP)分离纯化。得到的蛋白峰通过SDS-PAGE(图1C)以及Western Blot(图1D)进行鉴定,纯化的preS1组分通过以购买的preS1为标准进行定量,同时用Nano-drop进行定量。
实施例2:以preS1抗原作为疫苗,检测其诱导体内免疫应答效果。
用10μg由实施例1所得到preS1蛋白(单独的,或联合以下佐剂:铝佐剂(购自InvivoGen公司,1:1-1:9混合)、10μg TLR-4配体MPLA佐剂(购自InvivoGen公司)、30μg TLR-9配体CpG佐剂(由Invitrogen公司合成)或弗氏佐剂(IFA)(购自Sigma公司)皮下免疫C57BL/6小鼠(6-8周,雄性,购自北京维通利华实验动物技术有限公司)。免疫流程如图2A所示。免疫后通过ELISA检测血清中抗-preS1抗体应答反应(图2B);通过ELISPOT检测脾脏中preS1特异性T细胞免疫反应(图2C)。实验结果表明preS1蛋白联合佐剂后应用能够诱导强劲的抗体应答和特异性T细胞免疫应答。
实施例3:通过HBV体内感染实验,验证preS1抗原疫苗预防HBV感染的能力。
通过实施例2中的免疫方法,将10μg实施例1中纯化的preS1蛋白联合弗氏佐剂皮下免疫C57BL/6小鼠(6-8周,雄性,购自北京维通利华实 验动物技术有限公司)。免疫流程如图3A所示,间隔14天两次皮下免疫。通过ELISA检测小鼠的血清中测到高滴度preS1特异性抗体抗-preS1(图3B)。然后通过尾静脉感染1x1010vg(viral genome)AAV-HBV1.3(购自北京五加和分子医学研究所有限公司),感染后每周采血检测血清中HBV相关抗原,包括HBsAg抗原、preS1抗原以及HBV-DNA的变化情况。
结果显示相较于未进行蛋白免疫组而言,preS1疫苗免疫能够显著预防HBV感染,免疫后产生的抗-preS1抗体能够很快完全清除血清中preS1抗原(图3C),而且荧光定量PCR(real-time PCR)检测血清中HBV-DNA的水平也表明,preS1疫苗免疫能够清除血清中HBV病毒(图3D)。相较于传统HBsAg疫苗对照组而言,preS1表现出来相同的保护性效果(图3C和图3D)。以上实验结果表明,preS1作为疫苗,能够有效预防HBV感染。
在HBV感染后,我们通过Elispot实验表明,相较于传统HBsAg疫苗(成分为S-HBsAg)对照组而言,preS1疫苗在HBV感染后的小鼠中能够诱导强劲的针对HBsAg特异性B细胞和T细胞免疫应答(图4)。
实施例4:PreS1抗原疫苗能够阻断HBV感染肝脏细胞
我们通过体外感染系统证明preS1疫苗免疫产生的抗体能够抑制HBV感染肝脏细胞。首先通过将实施例1中纯化的preS1抗原联合弗氏佐剂皮下免疫小鼠,总共免疫两次,第一次和第二次免疫间隔14天,得到抗-preS1抗血清。然后分别将preS1抗血清和小鼠IgG对照抗体与HBV病毒共孵育,然后将其加入HepG2-hNTCP细胞(24)中进行感染,24小时之后换液,用DMEM完全培养基洗涤三次,然后加入新鲜PMM完全培养基进行培养,以后每隔2天换液,分别收集上清,检测上清中抗原的表达情况。如果HBV病毒能够感染细胞,那么随着感染时间的增加,培养上清中HBV相关的抗原水平会不断增加,而如果HBV感染被阻断,那么抗原的水平相较于感染组就会有显著的降低。
结果显示相对于对照小鼠IgG抗体而言,抗-preS1抗血清同HBV共孵育之后,能够明显抑制细胞培养上清中HBV相关抗原HBsAg和HBeAg的表达(图5A和5B),表明HBV感染肝脏细胞确实能够被抗-preS1阻断。在HBV感染后,细胞培养的最后一天,我们收集细胞并提取了细胞的总 RNA,之后进行逆转录,通过反转录荧光定量PCR(RT-qPCR)检测细胞中HBV相关RNA,包括3.5Kb RNA和总RNA的情况,实验结果结果同样表明,相对于对照抗体,抗-preS1能够显著减少HBV相关RNA水平(图5C和5D),证明了抗-preS1抗体抑制HBV感染肝脏细胞。
实施例5:PreS1蛋白疫苗能够作为慢性乙型肝炎感染(chronic hepatitis B,HBV)的治疗性疫苗
C57BL/6小鼠(6-8周,雄性,购自北京维通利华实验动物技术有限公司),尾静脉注射1x1010vg(viral genome)AAV-HBV1.3(购自北京五加和分子医学研究所有限公司)。在感染之后4周建立稳定的HBV耐受及慢性HBV感染模型。通过该模型,我们验证preS1蛋白疫苗治疗慢性乙型肝炎的能力(图6A)。
在野生C57BL/6小鼠中,免疫传统HBsAg疫苗(成分为S-HBsAg,5μg,弗氏佐剂,皮下免疫)能够产生强劲的免疫应答反应,包括特异性抗体应答和T细胞免疫反应(图6B和6C)。但是以同样的免疫方式处理HBV耐受小鼠,我们发现,HBsAg特异性的抗体应答和T细胞免疫反应都受到了明显的抑制,表明在慢性乙型肝炎感染的过程中,HBsAg存在着很强的免疫耐受状态,直接以HBsAg作为疫苗,无法在HBV耐受小鼠中产生治疗性效果(图6B和6C)。
但是通过preS1蛋白(实施例1纯化所得,10μg,弗氏佐剂,皮下免疫)疫苗进行免疫,我们发现不论在野生小鼠还是耐受小鼠中,其都能够诱导强劲的抗体应答和T细胞免疫应答(图6D和6E)。通过采集血清,我们检测野生小鼠和耐受小鼠抗体应答情况(图6D)。另外我们分别分离了免疫后的外周组织,包括淋巴结、脾脏以及肝脏中的淋巴细胞,检测preS1特异性T细胞免疫应答(图6E)。不同于HBsAg诱导免疫耐受,免疫preS1能够在慢性乙型肝炎免疫耐受期产生强劲的B细胞和T细胞免疫应答。
之后我们检测preS1疫苗免疫后小鼠血清中preS1抗原,以及血清中HBV-DNA的变化情况。结果显示,在preS1疫苗免疫之后,血清中preS1抗原能够被完全清除(图7A),而且血清中的HBV-DNA最终能够被完全清除(7B),而未处理对照组以及HBsAg疫苗免疫组都没有治疗效果(图7A 和7B)。另外,我们通过体外感染实验也验证了preS1疫苗在HBV耐受模型中产生的抗体能够预防HBV再次感染肝脏细胞(图8)。
通过以上实验,preS1在慢性乙型肝炎中不耐受,以其作为疫苗能够清除HBV耐受模型血清中HBV,并且阻断HBV再次感染肝脏细胞,对于慢性乙型肝炎具有很好的治疗性效果。
实施例6:PreS1疫苗联合HBsAg疫苗应用,能够诱导慢性乙型肝炎感染的HBsAg-HBsAb血清学转化,达到清除肝细胞中HBV病毒感染的目的
在我们的研究中发现,preS1疫苗免疫后能够在感染小鼠中诱导HBsAg特异性免疫应答(图4)。受此启发,我们采用了联合preS1和HBsAg免疫的方式对preS1疫苗诱导的针对HBsAg的免疫反应进行放大。在尾静脉感染AAV-HBV1.3(购买自北京五加和分子医学研究所有限公司)建立的耐受小鼠中(C57BL/6小鼠,6-8周,雄性,购买自北京维通利华实验动物技术有限公司),我们首先通过连续两次的preS1(实施例1纯化所得,10μg,弗氏佐剂,皮下免疫)疫苗免疫,然后采用5ug HBsAg疫苗联合30ug CpG佐剂进行免疫的方式放大HBsAg免疫应答。
我们发现,联合preS1和HBsAg作为治疗慢性乙型肝炎的策略,最终能够打破HBsAg耐受,同时在外周淋巴组织和肝脏中诱导特异性HBsAg免疫反应(图9)。HBV耐受小鼠中产生的免疫反应能够完全清除血清中HBsAg,同时诱导了部分的血清学HBsAb的转化(图10A和10B),这在临床上被认为是HBV治愈的关键指标。另外我们分别通过荧光定量PCR(real-time PCR)的方法检测了肝脏组织中HBV相关的DNA的表达水平,结果显示,相对于单独只免疫HBsAg疫苗对照组而言,preS1联合HBsAg的免疫方式能够最终降低肝脏中HBV相关基因的水平(图10C)。我们还通过免疫组化的方式检测肝脏中HBcAg阳性的细胞,同样表明preS1联合HBsAg能够最终降低肝脏组织中HBV感染水平(图10D)。
通过以上结果,我们发明了联合preS1和HBsAg治疗慢性乙型肝炎的疫苗策略。
文献列表:
1.Organization WH.2015.Hepatitis B.Fact sheet.
2.Akbar SM,Furukawa S,Horiike N,Onji M.2004.Vaccine therapy for hepatitis B virus carrier.Curr Drug Targets Infect Disord 4:93-101
3.Malik IR,Chen A,Brass A,Ahlen G,Rahman M,Sallberg M,Qureshi JA,Frelin L.2012.A bi-functional hepatitis B virus core antigen(HBcAg)chimera activates HBcAg-specific T cells and preS1-specific antibodies.Scand J Infect Dis 44:55-9
4.McDermott AB,Cohen SB,Zuckerman JN,Madrigal JA.1998.Hepatitis B third-generation vaccines:improved response and conventional vaccine non-response--evidence for genetic basis in humans.J Viral Hepat 5Suppl 2:9-11
5.Schumann A,Fiedler M,Dahmen U,Grosse-Wilde H,Roggendorf M,Lindemann M.2007.Cellular and humoral immune response to a third generation hepatitis B vaccine.J Viral Hepat 14:592-8
6.Gallina A,De Koning A,Rossi F,Milanesi G.1994.Intracellular retention of hepatitis B virus surface protein mutants devoid of amino-terminal pre-S1sequences.J Gen Virol 75(Pt 2):449-55
7.Prange R,Clemen A,Streeck RE.1991.Myristylation is involved in intracellular retention of hepatitis B virus envelope proteins.J Virol 65:3919-23
8.Shi B,Ren G,Hu Y,Wang S,Zhang Z,Yuan Z.2012.HBsAg inhibits IFN-alpha production in plasmacytoid dendritic cells through TNF-alpha and IL-10induction in monocytes.PLoS One 7:e44900
9.Isogawa M,Robek MD,Furuichi Y,Chisari FV.2005.Toll-like receptor signaling inhibits hepatitis B virus replication in vivo.J Virol 79:7269-72
10.Jiang M,Broering R,Trippler M,Poggenpohl L,Fiedler M,Gerken G,Lu M,Schlaak JF.2014.Toll-like receptor-mediated immune responses are attenuated in the presence of high levels of hepatitis B virus surface antigen.J Viral Hepat 21:860-72
11.Schmidt J,Blum HE,Thimme R.2013.T-cell responses in hepatitis B and C virus infection:similarities and differences.Emerg Microbes Infect 2:e15
12.Thimme R,Wieland S,Steiger C,Ghrayeb J,Reimann KA,Purcell RH,Chisari FV.2003.CD8(+)T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection.J Virol 77:68-76
13.Guidotti LG,Rochford R,Chung J,Shapiro M,Purcell R,Chisari FV.1999.Viral clearance without destruction of infected cells during acute HBV infection.Science 284:825-9
14.Wherry EJ.2011.T cell exhaustion.Nat Immunol 12:492-9
15.Mueller SN,Ahmed R.2009.High antigen levels are the cause of T cell exhaustion during chronic viral infection.Proc Natl Acad Sci U S A 106:8623-8
16.Tay SS,Wong YC,McDonald DM,Wood NA,Roediger B,Sierro F,McGuffog C,Alexander IE,Bishop GA,Gamble JR,Weninger W,McCaughan GW,Bertolino P,Bowen DG.2014.Antigen expression level threshold tunes the fate of CD8 T cells during primary hepatic immune responses.Proc Natl Acad Sci U S A 111:E2540-9
17.Lopes AR,Kellam P,Das A,Dunn C,Kwan A,Turner J,Peppa D,Gilson RJ,Gehring A,Bertoletti A,Maini MK.2008.Bim-mediated deletion of antigen-specific CD8 T cells in patients unable to control HBV infection.J Clin Invest 118:1835-45
18.Boni C,Fisicaro P,Valdatta C,Amadei B,Di Vincenzo P,Giuberti T,Laccabue D,Zerbini A,Cavalli A,Missale G,Bertoletti A,Ferrari C.2007.Characterization of hepatitis B virus(HBV)-specific T-cell dysfunction in chronic HBV infection.J Virol 81:4215-25
19.Nebbia G,Peppa D,Schurich A,Khanna P,Singh HD,Cheng Y,Rosenberg W,Dusheiko G,Gilson R,ChinAleong J,Kennedy P,Maini MK.2012.Upregulation of the Tim-3/galectin-9 pathway of T cell exhaustion in chronic hepatitis B virus infection.PLoS One 7:e47648
20.Stoop JN,Claassen MA,Woltman AM,Binda RS,Kuipers EJ,Janssen HL,van der Molen RG,Boonstra A.2008.Intrahepatic regulatory T cells are phenotypically distinct from their peripheral counterparts in chronic HBV patients.Clin Immunol 129:419-27
21.Chen M,Sallberg M,Hughes J,Jones J,Guidotti LG,Chisari FV,Billaud JN,Milich DR.2005.Immune tolerance split between hepatitis B virus precore and core proteins.J Virol 79:3016-27
22.Milich DR,Chen MK,Hughes JL,Jones JE.1998.The secreted hepatitis B precore antigen can modulate the immune response to the nucleocapsid:a mechanism for persistence.J Immunol 160:2013-21
23.Kakimi K,Isogawa M,Chung J,Sette A,Chisari FV.2002.Immunogenicity and tolerogenicity of hepatitis B virus structural and nonstructural proteins:implications for immunotherapy of persistent viral infections.J Virol 76:8609-20
24.Yan H,Zhong G,Xu G,He W,Jing Z,Gao Z,Huang Y,Qi Y,Peng B,Wang H,Fu L,Song M,Chen P,Gao W,Ren B,Sun Y,Cai T,Feng X,Sui J,Li W.2012.Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus.Elife 1:e00049 。
- 还没有人留言评论。精彩留言会获得点赞!