基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗及制备方法与流程
本发明属于医药生物
技术领域:
,涉及一种多亚单位疫苗,具体涉及一种基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗及制备方法。
背景技术:
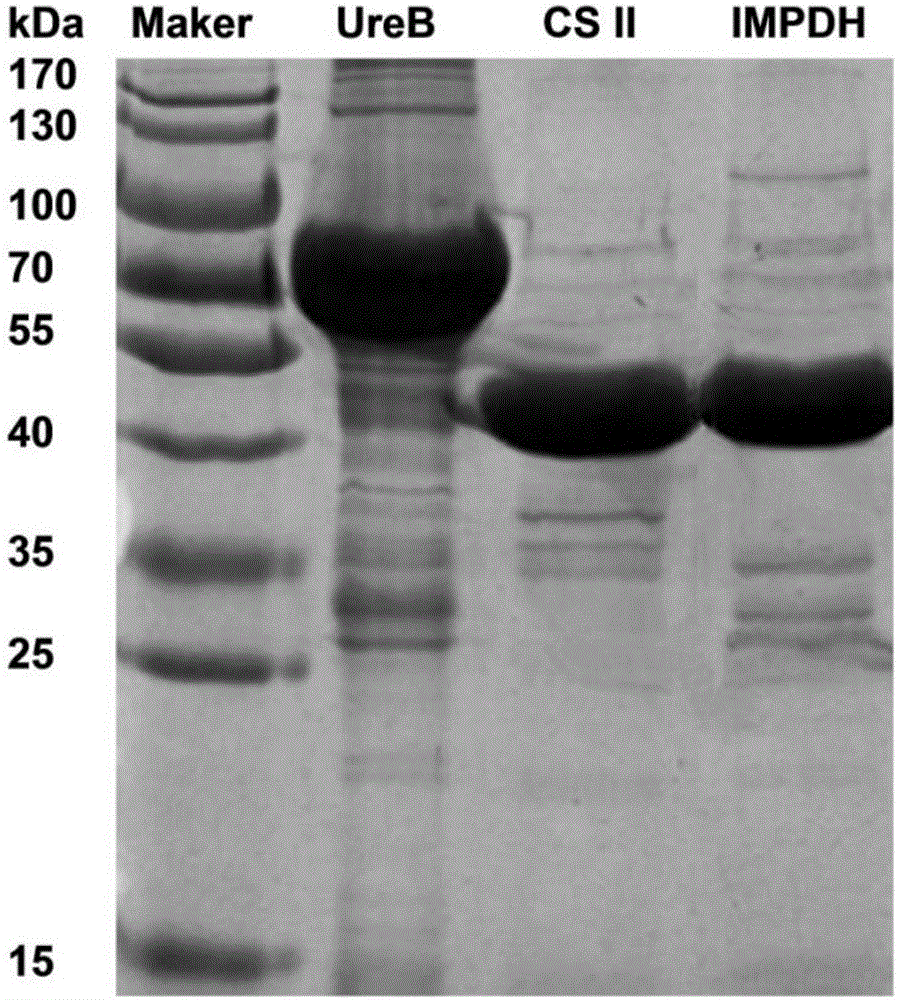
:幽门螺杆菌(Helicobacterpylori,H.pylori)是一种螺旋状的革兰阴性菌,定植于胃粘膜,与慢性胃炎、胃溃疡、胃粘膜相关淋巴组织淋巴瘤以及胃癌等的发生密切相关。全球感染率超过50%,因此迫切需要一种有效的幽门螺杆菌疫苗。中国国家免疫工程技术研究中心开发的口服重组幽门螺杆菌疫苗为解决这一问题取得了重大突破。该疫苗的单一蛋白组分,尿素酶B亚单位(UreB),是依据体液应答筛选而出。但是在开发过程中,并非H.pylori的每一个蛋白均被纳入筛选。三期临床试验显示,该疫苗第一年的保护率为71.8%(95%CI48.2~85.6),第二年锐减到55.0%(95%CI0.9~81.0)。因而,其有效性和稳定性仍有待于进一步提高。现有幽门螺杆菌疫苗的开发基于抗体应答,并且为单亚单位疫苗。体液免疫对于抗幽门螺杆菌感染中具有一定的作用,而单靠体液免疫仍不足以彻底清除幽门螺杆菌。基于此设计的疫苗的保护效果并不理想。技术实现要素:有鉴于此,本发明的目的在于提供一种基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗。本发明还提供了该种多亚单位疫苗的制备方法和应用。另外,本发明还提供了相应的一种基于CD4+T细胞免疫的引物组及其应用。为达到上述目的,本发明提供如下技术方案:基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗,包含三种抗原,分别为次黄嘌呤核苷酸脱氢酶(inosine5'-monophosphatedehydrogenase,IMPDH)、Ⅱ型柠檬酸合酶(typeⅡcitratesynthase,CSⅡ)和尿素酶B亚单位(ureasesubunitbeta,UreB);所述抗原还包括其同源蛋白。优选的,三种抗原的质量比为1:1:1,疫苗总抗原含量为100μg。所述抗原的引物序列如下:次黄嘌呤核苷酸脱氢酶:上游引物:5'-CCGGAATTCATGAGAATTTTACAAAGGGCT-3',如SEQIDNO.1所示;下游引物:5'-CCGCTCGAGTTACCCATAATAATTAGGGGC-3',如SEQIDNO.2所示。Ⅱ型柠檬酸合酶:上游引物:5'-CGCGGATCCATGTCTGTTACTTTA-3',如SEQIDNO.3所示;下游引物:5'-CCGGAATTCTTAATCCCCTACATAG-3',如SEQIDNO.4所示。尿素酶B亚单位:上游引物:5'-CCGGAATTCATGAAAAAGATTAGCAGAAAAG-3',如SEQIDNO.5所示;下游引物:5'-CCGCTCGAGCTTTTCTGCTAATCTTTTTCAT-3',如SEQIDNO.6所示。优选的,所述疫苗还包含医学上可接受的免疫佐剂。进一步优选的,所述免疫佐剂为弗氏佐剂、铝佐剂、CPGODN1826或AddaVax中的任一种或几种。上述的一种基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗的制备方法,包括以下步骤:1)提取幽门螺杆菌DNA,利用次黄嘌呤核苷酸脱氢酶、Ⅱ型柠檬酸合酶和尿素酶B亚单位的引物序列,经聚合酶链式反应(PCR)从幽门螺杆菌DNA中分别扩增,得相应的三个基因序列;2)构建表达载体和工程菌,分别诱导表达相应蛋白,纯化,得三种目的蛋白;3)利用步骤2)所得的三种目的蛋白以质量比1:1:1组成三亚单位疫苗,加入医学上可接受的佐剂进行乳化,即得。优选的,步骤1)中幽门螺杆菌DNA是利用细菌基因组DNA提取试剂盒提取。优选的,步骤1)中聚合酶链式反应的条件如下:1a)94℃,5分钟;1b)94℃,30秒,55℃,30秒,72℃,1分钟;循环次数为30次;1c)72℃,10分钟。优选的,步骤2)中构建表达载体和工程菌的具体方法是:用OMEGA胶回收试剂盒回收目的基因序列,酶切目的基因及pGEX-6P-1质粒,用Takara公司的LigationMix试剂盒构建表达载体,而后依据转入BL21感受态细胞,构建工程菌E.Coli。优选的,步骤2)中的诱导表达条件是,采用1mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)水溶液,诱导温度37℃,诱导时间3小时。优选的,步骤2)中的纯化方法包括步骤:2a)收集培养的细菌,裂解得上清;2b)加入1‰原菌液质量的GST填料,4℃摇晃过夜,使充分结合;2c)离心,弃上清,使用2~3倍填料体积的10mMol/LPBS洗涤2~3次;2d)在4℃条件下,PBS和填料的体积比为1:1,PrescissionProtease酶切过夜;2e)收集上清,即为目的蛋白。上述的一种基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗在制备预防或治疗幽门螺杆菌感染的制剂中的应用。优选的,所述制剂为疫苗,其进一步优选为蛋白疫苗或核酸疫苗。一种基于CD4+T细胞免疫的引物组,包括三对引物:(A)次黄嘌呤核苷酸脱氢酶的引物,包括正向引物和反向引物,序列如下:上游引物:5'-CCGGAATTCATGAGAATTTTACAAAGGGCT-3',如SEQIDNO.1所示;下游引物:5'-CCGCTCGAGTTACCCATAATAATTAGGGGC-3',如SEQIDNO.2所示。(B)Ⅱ型柠檬酸合酶的引物,包括正向引物和反向引物,序列如下:上游引物:5'-CGCGGATCCATGTCTGTTACTTTA-3',如SEQIDNO.3所示;下游引物:5'-CCGGAATTCTTAATCCCCTACATAG-3',如SEQIDNO.4所示。(C)尿素酶B亚单位的引物,包括正向引物和反向引物,序列如下:上游引物:5'-CCGGAATTCATGAAAAAGATTAGCAGAAAAG-3',如SEQIDNO.5所示;下游引物:5'-CCGCTCGAGCTTTTCTGCTAATCTTTTTCAT-3',如SEQIDNO.6所示。上述引物组在制备幽门螺杆菌多亚单位疫苗中的应用。优选的,上述引物组在制备预防或治疗幽门螺杆菌感染的制剂中的应用。本发明的有益效果在于:本发明的幽门螺杆菌疫苗基于CD4+T细胞免疫,CD4+T细胞应答在胃粘膜局部发挥了主要的抗H.pylori感染作用,其可以通过分泌细胞因子等途径,激发更为广泛的下游相关免疫细胞应答,在胃粘膜局部发挥更为广泛和有效的免疫保护作用。同时,本发明为多亚单位,免疫效果更加稳定有效。申请人基于th1和th17细胞应答,成功筛选出了3个保护性CD4+T细胞免疫优势抗原,IMPDH、CSⅡ和UreB。这三个抗原可以激发优势的CD4+T细胞应答。免疫攻毒保护实验也证实,分别用这三个抗原免疫,均发挥了明显的免疫保护效果。本发明三价亚单位疫苗在小鼠模型中进行了临床前研究。同时,通过该三价亚单位疫苗特异性CD4+T细胞过继实验,确认了CD4+T细胞在该三价亚单位疫苗中的保护功能,明确了保护机制。这为该新型三价亚单位疫苗的后期优化和临床研究提供了理论和实验基础。附图说明为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:图1为三种幽门螺杆菌(Helicobacterpylori,H.pylori)保护性CD4+T细胞免疫优势抗原,IMPDH、CSⅡ和UreB,目的基因扩增及表达载体构建;图2为IMPDH、CSⅡ和UreB三种蛋白的纯化;图3a、图3b、图3c和图3d为多亚单位疫苗攻毒保护实验,胃粘膜幽门螺杆菌定植量及炎症评分;图4a、图4b和图4c为多亚单位疫苗攻毒保护实验中免疫应答检测;图5a、图5b和图5c为多亚单位疫苗特异性CD4+T细胞过继实验;附图中,*P<0.05,**P<0.01,***P<0.001,NS无统计学差异(P>0.05)。具体实施方式下面将结合附图,对本发明的优选实施例进行详细的描述。本发明涉及的幽门螺杆菌菌株B0是在BALB/c小鼠体内驯化得到。材料与方法(一)菌种和小鼠幽门螺杆菌菌株B0:此菌株为幽门螺杆菌在BALB/c小鼠体内驯化得到的驯化株,其特点是更易于在BALB/c小鼠胃部定植,并导致病理反应。从幽门螺杆菌携带者胃组织分离培养幽门螺杆菌菌株,通过“三线法”接种于含10%(体积比)兔血的脑心浸液琼脂培养基。挑取单一菌落进行培养,并通过基因测序鉴定为幽门螺杆菌,命名为幽门螺杆菌菌株M。而后用幽门螺杆菌菌株M感染BALB/c小鼠。继而重复上述分离纯化方案,从BALB/c小鼠胃组织分离幽门螺杆菌。由此获得的更易于定植于BALB/c小鼠的幽门螺杆菌菌株,命名为幽门螺杆菌菌株B0。幽门螺杆菌菌株B0在含10%(体积比)兔血的脑心浸液琼脂培养基中,37℃微需氧条件下培养。两天后,将幽门螺杆菌菌株从平板转移到10%(体积比)胎牛血清(FBS)布氏肉汤培养基扩大培养。取指数生长期的幽门螺杆菌用于感染和体外实验。六至八周龄的无特定病原(SPF)雌性BALB/c小鼠,购于第三军医大学实验动物中心。(二)主要试剂及来源具体见表1。表1.本发明的主要试剂及来源实施例1:图1和图2示出了IMPDH、CSII和UreB三种目的基因扩增及表达载体构建,以及诱导表达和纯化过程。IMPDH、CSII和UreB三种蛋白的表达纯化1.IMPDH、CSII和UreB三种蛋白目的基因的扩增引物序列:IMPDH上游引物:5'-CCGGAATTCATGAGAATTTTACAAAGGGCT-3',如SEQIDNO.1所示;下游引物:5'-CCGCTCGAGTTACCCATAATAATTAGGGGC-3',如SEQIDNO.2所示;CSⅡ上游引物:5'-CGCGGATCCATGTCTGTTACTTTA-3',如SEQIDNO.3所示;下游引物:5'-CCGGAATTCTTAATCCCCTACATAG-3',如SEQIDNO.4所示;UreB上游引物:5'-CCGGAATTCATGAAAAAGATTAGCAGAAAAG-3',如SEQIDNO.5所示;下游引物:5'-CCGCTCGAGCTTTTCTGCTAATCTTTTTCAT-3',如SEQIDNO.6所示。PCR反应条件见表2。表2.PCR反应条件2.表达载体构建用OMEGA胶回收试剂盒回收目的基因序列。酶切目的基因及pGEX-6P-1质粒。用Takara公司的LigationMix试剂盒构建表达载体。而后依据转入BL21感受态细胞,构建工程菌。3.诱导表达诱导条件:IPTG1mmol/L,37℃,3小时。4.蛋白纯化方案2a)收集培养的细菌,裂解得上清;2b)加入1‰原菌液质量的GST填料,4℃摇晃过夜,使充分结合;2c)离心,弃上清,使用2~3倍填料体积的10mMol/LPBS洗涤2~3次;2d)在4℃条件下,PBS和填料的体积比为1:1,PrescissionProtease酶切过夜;2e)收集上清,即为目的蛋白。表3示出了这三种蛋白的氨基酸数和碱基数情况。表3.三种蛋白的氨基酸数和碱基数情况蛋白名称相对分子量(kD)氨基酸数碱基数IMPDH51.804811443CSⅡ48.324261278UreB61.555691707实施例2:多亚单位疫苗免疫保护功能评价1.动物免疫及攻毒实验方案实验动物:BALB/c小鼠雌性6-8周龄。抗原:多亚单位疫苗、H.pylori灭活全菌,100μg/只。等量PBS对照。佐剂:弗氏佐剂。100μl/只。免疫方式:皮下注射。免疫体积:200μl/只。免疫方案:皮下免疫3次(第0,2,4周)。第一次用完全弗氏佐剂,第二次用不完全弗氏佐剂,第三次不加佐剂。末次免疫后一周,1.0×109CFU幽门螺杆菌灌胃,每天一次,连续4天。攻毒后第4周处死小鼠,检测小鼠胃组织中幽门螺杆菌定值量、病理损伤、CD4+T细胞应答,分析其免疫保护效果。2.小鼠胃粘膜幽门螺杆菌定值量检测实时定量PCR检测胃内幽门螺杆菌定植量。用细菌基因组提取试剂盒提取细菌DNA,依据幽门螺杆菌16SrDNA检测其定植量。结果见图3a。幽门螺杆菌16SrDNA的序列如下:上游引物:5’-TTTGTTAGAGAAGATAATGACGGTATCTAAC-3’,如SEQIDNO.7所示;下游引物:5’-CATAGGATTTCACACCTGACTGACTATC-3’,如SEQIDNO.8所示。荧光探针的序列如下:FAM-CGTGCCAGCAGCCGCGGT-TAMRA,如SEQIDNO.9所示。3.小鼠胃粘膜炎症评分沿胃大弯纵向取少量胃组织,用福尔马林固定,石蜡包埋,5μm切片,并用苏木精-伊红染色。然后显微镜下进行组织病理学评分。评分标准为:0、无显著性病变;0.5、有轻微的异常,如小的炎性浸润灶或广泛的无炎症的粘膜化生;1.0,一种轻度的炎性细胞浸润,通常侵及腺体基底部;1.5、轻度浸润,再加上轻微的上皮增生或广泛的粘液细胞化生;2.0,炎症细胞侵及腺体和/或粘膜下层;2.5、炎性细胞侵及腺体,同时粘膜下层有粘液细胞化生和/或轻度上皮细胞增生;3.0、大片炎症侵及腺体和黏膜下层,常伴有中度粘液细胞化生和轻度至中度上皮增生;3.5,3.0以上的炎症伴明显上皮细胞增生;4.0、侵及粘膜层的强烈的炎症浸润,腺体正常结构破坏,并通常伴有明显的上皮增生和广泛的粘液细胞化生;4.5、严重的炎症伴有粘膜局灶性溃疡;5.0,广泛侵及黏膜和黏膜下的炎症,伴有腺体结构破坏和溃疡。结果见图3b。4.小鼠胃粘膜CD4+T细胞应答检测沿胃大弯和胃小弯解剖小鼠胃组织,用无菌PBS轻柔洗涤2次,以去除食物残渣。而后放入10mlHank's平衡盐溶液(HBSS,不含Ca,My)中,含1mM二硫苏糖醇(DTT),1mM乙二胺四乙酸(EDTA),和2%胎牛血清(FCS),37℃孵育45min。然后,将所得混合物通过无菌钢网以除去未消化的组织得到单细胞悬液。消化后的单细胞悬液用无菌PBS洗两次。而后用Trizol法提取其总RNA,反转录成cDNA,并用SYBRGreen掺入法通过实时定量PCR检测IFN-γ和IL-17A的表达(图4a)。IFN-γ的序列如下:上游引物:5’-GATCCTTTGGACCCTCTGACTT-3’,如SEQIDNO.10所示;下游引物:5’-TGACTGTGCCGTGGCAGTAA-3’,如SEQIDNO.11所示。IL-17A的序列如下:上游引物:5’-CTCCAGAAGGCCCTCAGACTAC-3’,如SEQIDNO.12所示;下游引物:5’-GGGTCTTCATTGCGGTGG-3’,如SEQIDNO.13所示。5.小鼠脾细胞抗原特异性CD4+T细胞应答检测研磨法分离H.pylori感染小鼠脾淋巴细胞。然后1×107淋巴细胞与100μg三价疫苗抗原共培养,加5U/ml重组小鼠白细胞介素-2(rmIL-2),3ml/孔完全RPMI1640培养基,12孔板。37℃,5%CO2孵箱培养5天后,采用Ficoll梯度离心去除死细胞。将活细胞传代,加20U/mlrmIL-2,完全RPMI1640培养,至第十二天得H.pylori全菌特异性淋巴细胞。在这期间,需要时进行半量换液。将制备的特异性淋巴细胞1×105与分别递呈了IMPDH、CSII和UreB3种抗原的APC细胞1×105在96孔圆底板中共培养5小时,每孔加200μL含BDgolgistop完全RPMI1640培养基。然后用荧光标记抗体FITC-CD3、APC-CD4、PE-IFN-γ、PerCP-Cy5.5-IL-17A进行染色并用流式细胞仪分析。结果见图4b和4c。实施例3:多亚单位疫苗特异性CD4+T细胞过继保护功能评价1.小鼠脾细胞抗原特异性CD4+T细胞培养及磁珠分选研磨法分离H.pylori感染小鼠脾淋巴细胞。然后1×107淋巴细胞与100μg三价疫苗抗原或者灭活的幽门螺杆菌共培养,加5U/ml重组小鼠白细胞介素-2(rmIL-2),3ml/孔完全RPMI1640培养基,12孔板。37℃,5%CO2孵箱培养5天后,采用Ficoll梯度离心去除死细胞。将活细胞传代,加20U/mlrmIL-2,完全RPMI1640培养,至第十二天得H.pylori全菌特异性淋巴细胞。用美天旎免疫磁珠分选试剂盒分选CD4+T细胞,并用流式细胞仪检测分选纯度。2.小鼠脾细胞抗原特异性CD4+T过继及幽门螺杆菌攻毒实验动物:BALB/c小鼠雌性6-8周龄。过继方式:尾静脉注射。过继细胞量:2×106/只。细胞过继后一周,1.0×109CFU幽门螺杆菌灌胃,每天一次,连续4天。攻毒后第4周处死小鼠,检测小鼠胃组织中幽门螺杆菌定值量、病理损伤、CD4+T细胞应答,分析其免疫保护效果。3.小鼠胃粘膜幽门螺杆菌定值量检测实时定量PCR检测胃内幽门螺杆菌定植量。用细菌基因组提取试剂盒提取细菌DNA,依据幽门螺杆菌16SrDNA检测其定植量。结果见图5a。幽门螺杆菌16SrDNA的序列如下:上游引物:5’-TTTGTTAGAGAAGATAATGACGGTATCTAAC-3’,如SEQIDNO.7所示;下游引物:5’-CATAGGATTTCACACCTGACTGACTATC-3’,如SEQIDNO.8所示。荧光探针的序列如下:FAM-CGTGCCAGCAGCCGCGGT-TAMRA,如SEQIDNO.9所示。4.小鼠胃粘膜炎症评分沿胃大弯纵向取少量胃组织,用福尔马林固定,石蜡包埋,5μm切片,并用苏木精-伊红染色。然后显微镜下进行组织病理学评分。评分标准为:0、无显著性病变;0.5、有轻微的异常,如小的炎性浸润灶或广泛的无炎症的粘膜化生;1.0、一种轻度的炎性细胞浸润,通常侵及腺体基底部;1.5、轻度浸润,再加上轻微的上皮增生或广泛的粘液细胞化生;2.0、炎症细胞侵及腺体和/或粘膜下层;2.5、炎性细胞侵及腺体,同时粘膜下层有粘液细胞化生和/或轻度上皮细胞增生;3.0、大片炎症侵及腺体和黏膜下层,常伴有中度粘液细胞化生和轻度至中度上皮增生;3.5、3.0以上的炎症伴明显上皮细胞增生;4.0、侵及粘膜层的强烈的炎症浸润,腺体正常结构破坏,并通常伴有明显的上皮增生和广泛的粘液细胞化生;4.5、严重的炎症伴有粘膜局灶性溃疡;5.0、广泛侵及黏膜和黏膜下的炎症,伴有腺体结构破坏和溃疡。结果见图5b。5.小鼠脾细胞抗原特异性CD4+T细胞应答监测。研磨法分离小鼠脾淋巴细胞。然后1×105淋巴细胞与分别递呈了三价疫苗抗原或者灭活的幽门螺杆菌的APC细胞1×105在96孔圆底板中共培养5小时,每孔加200μL含BDgolgistop完全RPMI1640培养基。然后用荧光标记抗体FITC-CD3、APC-CD4、PE-IFN-γ、PerCP-Cy5.5-IL-17A进行染色并用流式细胞仪分析。结果见图5c最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。SEQUENCELISTING<110>中国人民解放军第三军医大学<120>基于CD4+T细胞免疫的幽门螺杆菌多亚单位疫苗及制备方法<130><160>13<170>PatentInversion3.3<210>1<211>30<212>DNA<213>人工序列<220><223>次黄嘌呤核苷酸脱氢酶上游引物<400>1ccggaattcatgagaattttacaaagggct30<210>2<211>30<212>DNA<213>人工序列<220><223>次黄嘌呤核苷酸脱氢酶下游引物<400>2ccgctcgagttacccataataattaggggc30<210>3<211>24<212>DNA<213>人工序列<220><223>Ⅱ型柠檬酸合酶上游引物<400>3cgcggatccatgtctgttacttta24<210>4<211>25<212>DNA<213>人工序列<220><223>Ⅱ型柠檬酸合酶下游引物<400>4ccggaattcttaatcccctacatag25<210>5<211>31<212>DNA<213>人工序列<220><223>尿素酶B亚单位上游引物<400>5ccggaattcatgaaaaagattagcagaaaag31<210>6<211>31<212>DNA<213>人工序列<220><223>尿素酶B亚单位下游引物<400>6ccgctcgagcttttctgctaatctttttcat31<210>7<211>31<212>DNA<213>人工序列<220><223>幽门螺杆菌16SrDNA上游引物<400>7tttgttagagaagataatgacggtatctaac31<210>8<211>28<212>DNA<213>人工序列<220><223>幽门螺杆菌16SrDNA下游引物<400>8cataggatttcacacctgactgactatc28<210>9<211>18<212>DNA<213>人工序列<220><223>荧光探针<400>9cgtgccagcagccgcggt18<210>10<211>22<212>DNA<213>人工序列<220><223>IFN-γ上游引物<400>10gatcctttggaccctctgactt22<210>11<211>20<212>DNA<213>人工序列<220><223>IFN-γ下游引物<400>11tgactgtgccgtggcagtaa20<210>12<211>22<212>DNA<213>人工序列<220><223>IL-17A上游引物<400>12ctccagaaggccctcagactac22<210>13<211>18<212>DNA<213>人工序列<220><223>IL-17A下游引物<400>13gggtcttcattgcggtgg18当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1