miR‑1255在制备治疗膀胱癌药物中的应用的制作方法
本发明涉及生物技术领域,具体的,涉及一种microRNA在制备治疗膀胱癌的药物中的应用。
背景技术:
microRNA(miR),是一种大小约21-23个碱基的单链小分子RNA,通过和靶基因mRNA碱基配对引导沉默复合体(RISC)降解mRNA或抑制mRNA的翻译,通常在转录后水平调控蛋白表达(最近发现microRNA也能在转录水平调控基因表达)。随着对microRNA研究的不断深入,越来越多的证据表明microRNA分子在肿瘤发生发展的各个环节中发挥着原癌基因或抑癌基因的作用。
膀胱癌是指发生在膀胱黏膜上的恶性肿瘤。是泌尿系统最常见的恶性肿瘤,也是全身十大常见肿瘤之一。占我国泌尿生殖系肿瘤发病率的第一位,而在西方其发病率仅次于前列腺癌,居第2位。2012年全国肿瘤登记地区膀胱癌的发病率为6.61/10万,列恶性肿瘤发病率的第9位。膀胱癌可发生于任何年龄,甚至于儿童。其发病率随年龄增长而增加,高发年龄50~70岁。男性膀胱癌发病率为女性的3~4倍。膀胱癌包括膀胱尿路上皮癌、膀胱鳞状细胞癌、膀胱腺癌,其他罕见的还有膀胱透明细胞癌、膀胱小细胞癌、膀胱类癌。其中最常见的是膀胱尿路上皮癌,约占膀胱癌患者总数的90%以上。临床上,手术或放疗针对局限膀胱癌是有效的,并且针对转移性膀胱癌治疗仍然缺乏有效的药物。
因此有必要寻找与膀胱癌发生、发展有关的miRNA,从而为临床上治疗转移性膀胱癌提供一种有效手段。
技术实现要素:
本发明的一个目的是提供一种如下1)-4)中任一所述物质在制备具有促进肿瘤功能的产品中的应用:
1)miR-1255;
2)含有miR-1255的编码基因的重组载体;
3)含有miR-1255的编码基因的重组病毒;
4)含有miR-1255的编码基因的重组病毒载体。所述促进肿瘤功能为促进肿瘤细胞的迁移、扩散和/或侵袭。所述肿瘤为膀胱癌。
所述产品为药物;
所述microRNA-145的核苷酸序列为序列表中的序列1。
本发明的第二个目的是提供一种重组细胞。
本发明提供的重组细胞,为将所述miR-1255、所述含有miR-1255的编码基因的重组载体、所述含有miR-1255的编码基因的重组病毒或含有miR-1255的编码基因的重组病毒载体导入出发细胞中得到的重组细胞。
所述出发细胞为肿瘤细胞;所述肿瘤细胞具体为膀胱癌细胞。
所述的重组细胞在筛选和/或制备抑制肿瘤细胞的迁移、扩散和/或侵袭药物中的应用也是本发明保护的范围。
本发明的第三个目的是提供一种具有促进肿瘤功能的产品。
本发明提供的产品,其活性成分为所述miR-1255、所述含有miR-1255的编码基因的重组载体、所述含有miR-1255的编码基因的重组病毒或含有microRNA-145的编码基因的重组病毒载体。
所述促进肿瘤为促进肿瘤细胞的迁移、扩散和/或侵袭。
所述肿瘤为膀胱癌;
所述产品为药物。
抑制miR-1255活性或者表达的物质在制备具有抑制肿瘤功能的产品中的应用也是本发明保护的范围。
所述抑制肿瘤为抑制肿瘤细胞的迁移、扩散和/或侵袭,所述肿瘤具体为膀胱癌。
本发明的实验证明,miR-1255过表达后并未能影响SW780细胞的生长,但可显著增强高转移性膀胱癌细胞的侵袭和迁移能力,在膀胱癌转移过程中可能起重要作用,因此说明,
miR-1255与膀胱癌转移相关。
附图说明
图1为荧光显微镜下观察慢病毒载体介导GFP-miR-1255在SW780细胞中的表达情况和RT-PCR检测细胞中miR-1255的相对含量;
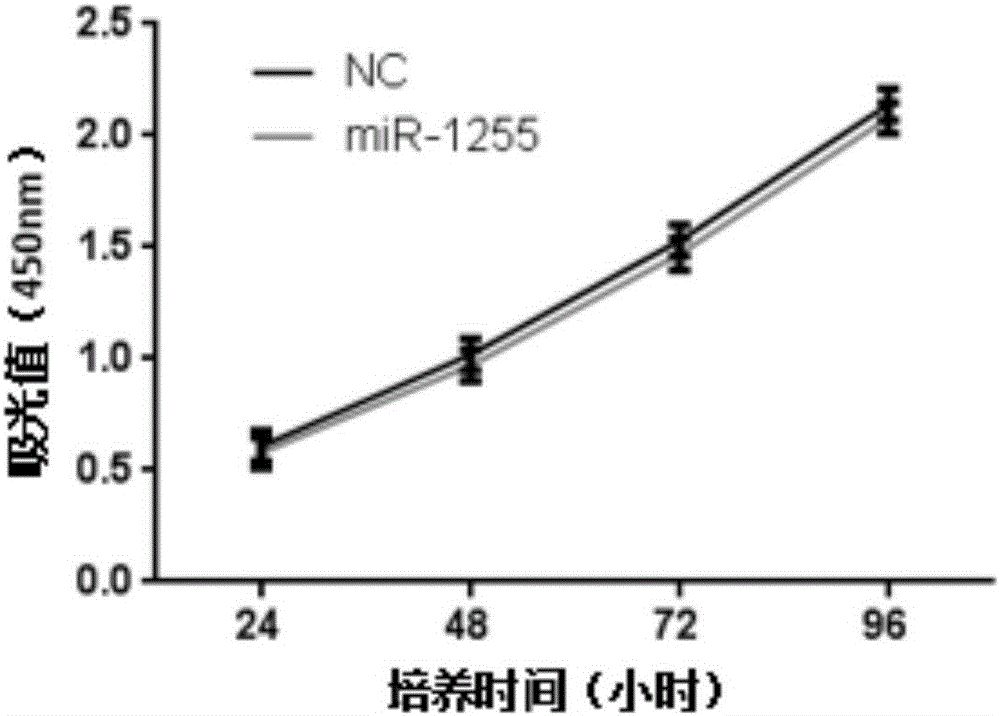
图2为利用CCK-8绘制SW780-miR-1255,SW780-nc的生长曲线;
图3为miR-1255对SW780细胞迁移能力的影响;
图4为miR-1255对SW780细胞侵袭能力的影响。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、稳定高表达miR-1255的转移性膀胱癌细胞系的获得
一、膀胱癌细胞系的获得
大肠癌细胞系SW780(ATCC),其培养基为含有10%的胎牛血清(Hyclone)和浓度为0.2%的青链霉素(Invitrogen)的DMEM培养基(Invitrogen,31053036)。
A、细胞复苏
(1)取出SW780(ATCC)的冻存管,立即放入37℃-40℃水浴中,快速摇晃直至完全融化。
(2)将细胞悬液转入10ml冷PBS中,放入15ml离心管中,用水平离心机离心细胞(1000转/分钟,8分钟)后弃上清。
(3)用适量新鲜培养基悬浮细胞,将细胞悬液转入培养瓶中,置37℃二氧化碳培养箱中培养。
B、细胞培养
将膀胱癌细胞系放入培养基中,于37℃,5%CO2的细胞培养箱中培养,根据细胞生长情况,每天或者隔天更换新鲜培养基,细胞浓度约为培养瓶培养面积80%-90%时进行传代。
C、细胞冻存
(1)选取处于指数生长期的细胞,冻存前1天给细胞换液1次。
(2)贴壁细胞以常规方法消化,制备成单细胞悬液。收集悬液,离心(1000转/分钟,5分钟)。
(3)弃上清,用冻存管重悬细胞,调整细胞浓度至5×106/mL。
(4)将细胞悬液移入冻存管,扭紧管盖,注明细胞名称和冻存日期,放入冻存盒,置于-80℃冰箱24小时后,移至液氮中保存。
D、细胞传代
(1)倒掉培养瓶中的培养基,加入37℃PBS轻轻洗涤细胞,吸出PBS,加入胰蛋白酶(25cm2培养瓶加500微升胰酶,75cm2和10cm直径培养皿加入1毫升胰酶),在显微镜下观察消化过程,待细胞变圆、细胞间连接断开。
(2)加入十倍于胰酶体积的PBS,用一次性吸管将细胞轻轻吹打,成细胞悬液。
(3)收集悬液于15或者50mL离心管中,离心(1000转/分钟,5分钟)。
(4)用新鲜培养基重悬细胞,按1∶2移入新的培养平或培养皿,得到传代后SW780细胞。
二、细胞转染
1、转染
GFP-miR-1255慢病毒表达系统(其中外源基因为miR-1255,Genebank号为NR_031656.1,即为序列1,购自上海吉凯基因化学技术有限公司,为能表达microRNA1255的慢病毒颗粒),根据该公司的操作指南进行细胞转染:
1)、分别将生长良好的步骤一得到的传代后SW780细胞于转染前一天接种到96孔板中(正常培养,37℃,5%CO2培养箱),转染时细胞密度达到30%。
2)、每孔中弃去原培养液,加入100μL培养基及1μL慢病毒试剂(GFP-miR-1255慢病毒表达系统),温和混匀。
3)、37℃培养24小时后,换正常培养基终止转染。
4)、然后37℃培养72小时后,得到SW780-high细胞系。
采用同样的方法将NC慢病毒表达系统(购自上海上海吉凯基因化学技术有限公司,其与GFP-miR-1255慢病毒表达系统相比没有外源基因miR-1255)转染SW780细胞,得到SW780-NC。
2、检测细胞中miR-1255的表达
1)、荧光显微镜观察
将上述获得的SW780-high细胞系和SW780-NC分别置于荧光倒置显微镜下,检测其表达miR-1255情况,结果如图1中A和B所示,miR-1255为SW780-high细胞系,NC为SW780-NC,从图中可以看出,SW780-high细胞系稳定高表达miR-1255(有荧光反应)。
荧光显微镜下观察到其转染效率高达86%(通过流式细胞仪计数得到)。
2)、RT-PCR检测
利用Trizol(Invitrogen,15596-018)提取上述获得的SW780-high细胞系和SW780-NC细胞总RNA,以提出的总RNA为模板,miR-1255引物进行RT-PCR,以U6为内参(引物购买自Qiagen,货号为MS00033740);以未转染病毒的SW780细胞和SW780(NC)细胞为对照。
结果如图1C所示:SW780-high细胞系的miR-1255的相对表达率为2245;SW780-NC的miR-1255的相对表达率为1;未转染病毒的SW780细胞中的miR-1255的相对表达率为1;可以看出,miR-1255在SW780high细胞系中稳定过表达。
实施例2、SW780-high细胞系稳定高表达miR-1255的功能研究
1、细胞生长曲线
(1)取转染后24小时,生长状态良好的由实施例1得到的SW780-high,采用一般传代 方法进行消化,制成细胞悬液。计数,精准地将细胞种在96孔板中,每孔细胞总数要求一致(2000个/孔),加入培养剂的量也要一致,并设置空白对照(即同样体积的培养基),每孔终体积为100μL。置37℃,5%CO2培养箱中孵育24小时。
(2)每孔加入10ul的CCK-8溶液(购自日本同仁化学研究所货号:CK04)。可根据具体情况增加或减少CCK-8溶液的用量。
(3)正常培养条件(37℃,5%CO2培养箱)下培养4小时(培养时间取决于所使用的细胞类型和细胞浓度)。
(4)水平晃动约10秒后用酶标仪测量450nm波长的OD值,保存好数据。
(5)每天依次法测定,共7天。每培养2天要给未计数的细胞换液。
(6)以培养时间为横轴,OD值为纵轴,描绘在半对数坐标纸上,连接曲线后即成该细胞的生长曲线。
实验重复三次,结果取平均值。
结果为图2所示,可以看出SW780-high在加入CCK-8溶液后24、48、72、96小时的96孔板中每孔细胞的OD值分别为0.58、0.97、1.47、2.08。空白对照在加入CCK-8溶液24、48、72、96小时的96孔板中每孔细胞的总数分别为0.61、1.02、1.53、2.14;可以看出,miR-1255过表达后并未能影响SW780细胞的生长。
2、细胞迁移实验
(1)将Transwell小室(购自Corning公司)用无血清DMEM培养基(Invitrogen,31053036)平衡至少一个小时或过夜,有助于更好贴附和生长。
(2)实验前一天,将由实施例1得到的SW780-high细胞在无血清培养基中饥饿培养。
(3)将Transwell放入24孔板,在Transwell下室中加入600μL含有10%血清的培养基作为趋化因子。
(4)先取转染后24小时并无血清饥饿过的细胞,消化后进行活细胞计数,调整细胞浓度为4×105/mL,再在每个Transwell小室中加入100μL由实施例1得到的SW780-high细胞悬液(饥饿培养后,4×104细胞)。每组设三个平行样本。置于孵箱中培养。
(5)24小时后吸去上室液体,用PBS湿润棉签擦去膜上面未穿过聚碳酸酯膜上小孔的细胞,生理盐水漂洗,稍干。
(6)0.5mL甲醇结晶紫溶液染色30分钟,流水冲洗3-5次。
(7)用小刀片将聚碳酸酯膜小心切下,置膜于载玻片上,膜底面朝上,滴树脂后用盖玻片封片,显微镜下随机计数5个视野的细胞数,求和,进行统计学检验,实验重复三次,结果取平均值。
以转染NC的SW780-NC为阴性对照(NC)。
实验重复三次,结果取平均值。
结果如图3所示,miR-1255组为SW780-high,NC组为SW780-NC,miR-1255组的细胞数为132,NC组的细胞数为45,miR-1255组大约为NC组的3倍(P<0.01),这说明miR-1255能够促进细胞的垂直迁移能力。
3、细胞侵袭试验
(1)将枪头、Eppendorf管、Matrigel胶(购自BD公司)、Transwell室、24孔板置于4℃过夜,由实施例1得到的SW780-high细胞换无血清培养基中饥饿培养过夜。消化细胞,无血清培养基吸打,调整细胞浓度在1×106/mL。
(2)4℃溶解Matrigel基质过夜,用预冷的枪头将Matrigel胶混匀。
(3)将培养基置于冰上,预冷枪头取20μL Matrigel胶(1∶3)于Transwell小室的上室,37℃放置30分钟。
(4)预温无血清培养基轻柔洗涤已凝固的Matrigel,加100μL细胞悬液(1×105细胞),每组设三个平行孔。
(5)下室加入600μL含10%胎牛血清的培养基。
(6)置于37℃、5%CO2的培养箱中孵育24小时,棉签拭去滤膜上表面未穿透的细胞。
(7)对已穿透的细胞进行固定、结晶紫染色、封片,每个样本均计数5个高倍镜视野,取其平均值。各组细胞穿透滤膜的数量的多少作为评价其侵袭能力的指标。
以转染NC的SW780为阴性对照为对照(NC)。
结果如图4所示,miR-1255组为SW780-high,NC组为SW780-NC,miR-1255组的细胞数为98,NC组的细胞数为31,miR-1255组较对照组(NC组)细胞明显增多。
这些体外功能预实验证实miR-1255过表达可显著增强高转移性膀胱癌细胞的侵袭和迁移能力,高度提示其在膀胱癌转移过程中可能起重要作用。
- 还没有人留言评论。精彩留言会获得点赞!