一种轮状病毒感染乳鼠实验模型的构建方法与流程
本发明属于实验动物学领域,具体涉及一种轮状病毒感染乳鼠实验模型的构建方法。
背景技术:
轮状病毒是导致5岁以下婴幼儿急性腹泻和死亡的重要病原体,占所有肠道感染病因的50%以上。每年全世界大约有2亿婴幼儿感染RV并发生腹泻,约100万儿童死于该疾病。目前尚缺乏有效的治疗手段。为此,通过建立轮状病毒感染的动物模型,用于研究轮状病毒致病机理以及相关疫苗和药物的疗效的受到越来越多国内外学者的重视。
目前,关于轮状病毒动物模型的构建,有以无菌小猪、猕猴和兔子作为实验动物的,建模成功率不高,且实验动物价格昂贵、饲养条件高。因此建立一种稳定、操作简便、经济高效、符合婴幼儿轮状病毒性急性胃肠炎的实验动物模型是十分必要的。
技术实现要素:
本发明的目的是针对上述现有技术中存在的问题提供一种操作简便、经济高效的轮状病毒感染乳鼠实验模型的构建方法,该实验模型可以模拟婴幼儿轮状病毒感染急性胃肠炎的特征。
为实现上述目的,本发明所采用的技术方案如下:
一种轮状病毒感染乳鼠实验模型的构建方法,其特征在于,包括下述步骤:
以7日龄ICR乳鼠为实验动物,用1ml改良注射器(即将针头换成软管的注射器),经灌胃方式给予0.2ml轮状病毒液。
优选地,所述7日龄ICR乳鼠为随机选取的体重在5.0-7.0g之间的常规7日龄ICR乳鼠。
优选地,所有乳鼠在灌胃前后分别禁奶2小时。
优选地,所述轮状病毒为非唾液酸(SA)依赖的人源轮状病毒WA株。
优选地,所述轮状病毒还包括扩增步骤,方法如下:
将原始病毒液从-80℃冰箱中取出,4℃溶解;将生长成单层的MA104细胞用PBS冲洗2次,后加入原始病毒液,放入37℃二氧化碳培养箱(含5%二氧化碳)中孵育2h后,弃去病毒液,加入无胎牛血清的DMEM培养液,然后放37℃二氧化碳培养箱(含5%二氧化碳)中培养并观察,至病毒感染MA104细胞病变(cytopathic effect,CPE)达到+++~++++时,置于-80℃冻存,再4℃融解,如此反复冻融3次,低温高速12000rpm离心10min,取上清收获病毒液;再同上法重复1次病毒在细胞中传代实验,收获病毒,分装,-80℃保存。
优选地,所述MA104细胞在含10%胎牛血清,100μ/mL青霉素,100μg/mL链霉素的DMEM培养液中生长成单层。
本发明的有益效果如下:
1、本模型能够模拟婴幼儿轮状病毒感染急性胃肠炎的特征,快速构建轮状病毒感染乳鼠实验模型,获得足够数量的感染轮状病毒的乳鼠。
2、本发明的技术方案建模时间短,12h即可得到感染轮状病毒的乳鼠,且乳鼠感染病毒的时间可持续至少5天,均有持续稳定性。
3、此外,本发明提供的技术方案选用的低龄动物体重轻,容易获得,所用病毒剂量小,节约实验成本,适于批量建模。
4、采用本发明的技术方案建立的感染轮状病毒的乳鼠实验模型稳定性好,可重复,建模成功性高几乎为100%。
附图说明
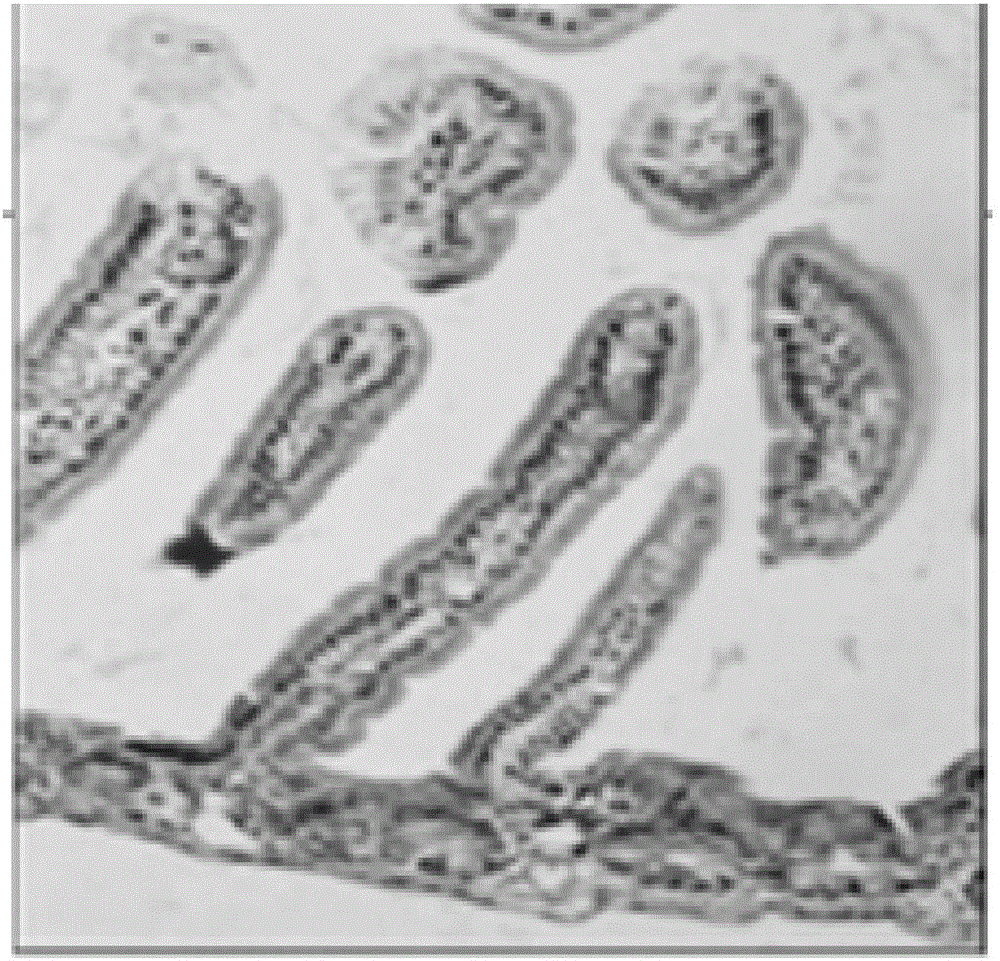
图1为效果实施例1中正常组乳鼠在2天后的小肠病理切片。
图2为效果实施例1中模型组乳鼠在2天后的小肠病理切片。
具体实施方式
下面结合实施例对本发明做进一步详细的说明,但是此说明不会构成对本发明的限制。实施例
(一)轮状病毒培养
1、细胞培养:
MA104细胞在含10%胎牛血清,100μ/mL青霉素,100μg/mL链霉素的DMEM培养液中生长和传代。
2、病毒扩增:
MA104细胞在培养瓶中生长至单层时接种RV。将原始病毒液,即非唾液酸(SA)依赖的人源轮状病毒WA株(可市售获得),从-80℃冰箱中取出,4℃溶解。将长成单层的MA104细胞用PBS冲洗2次。随后加入病毒液,放入37℃二氧化碳培养箱(含5%二氧化碳)中孵育2h后,弃去病毒液,加入无胎牛血清的DMEM培养液。然后放37℃二氧化碳培养箱(含5%二氧化碳)中培养并观察,至病毒感染MA104细胞病变(cytopathic effect,CPE)达到+++~++++时,将培养瓶放入-80℃冻存,再4℃融解,如此反复冻融3次,2~4℃高速(12000rpm)离心10min,取上清收获病毒液;再同上法重复1次病毒在细胞中传代实验,收获病毒。分装,-80℃保存。
3、病毒滴度测定:
用不含血清的DMEM培养液将其病毒按照1∶10稀释成10-1、10-2、10-3……10-10等系列浓度,将培养成单层MA104细胞的96孔板用PBS冲洗2次,再将不同稀释度的病毒加入到96孔细胞培养板中。放入37℃二氧化碳培养箱(含5%二氧化碳)中孵育2h后吸出病毒液,加入不含血清的细胞培养液,200μL/孔。放入37℃二氧化碳培养箱(含5%二氧化碳)中孵育,连续观察。当能够出现细胞病变CPE的最低稀释度的病毒孔中不再继续出现CPE时,计数每个稀释度出现CPE的细胞孔数,按照Reed-Munch方法计算病毒的TCID50(Tissue cultureinfective dose)。
(二)动物实验模型构建
1、随机选择体重在5.0-7.0g之间的7日龄ICR乳鼠为实验动物,实验前,采集粪便,采用胶体金法进行轮状病毒抗原检测。
2、选取结果为阴性7日龄ICR乳鼠9只设定为模型组,每只乳鼠分别用1ml改良注射器(将针头换成软管的注射器,可市售获得),一次性经口腔灌入0.2ml含轮状病毒的培养液。所有乳鼠在灌胃前后均禁奶2小时,以保证病毒充分吸收。
3、同时,选取结果为阴性7日龄ICR乳鼠9只设定为对照组,每只乳鼠分别用1ml改良注射器,一次性经口腔灌入0.2ml细胞培养液。所有乳鼠在灌胃前后均禁奶2小时。
4、各组动物隔离饲养观察。
(三)效果测定:
1、抗原检测
模型组的9只乳鼠在灌入轮状病毒12h后,均出现黄色软便,用无菌棉签收集粪便于无菌试管中,用金标法检测粪便中轮状病毒抗原,结果均呈阳性,定义为乳鼠感染轮状病毒,实验模型建模成功,成功率为100%。之后1~5天,连续采集乳鼠粪便进行轮状病毒抗原检测,9只乳鼠粪便均能检测到轮状病毒抗原,可见模型有效持续期较长。
而对照组的乳鼠,用金标法检测粪便中轮状病毒抗原,结果均呈阴性。
2、乳鼠观察
模型组的9只乳鼠在灌入轮状病毒后,均出现精神反应差且活动减少、皮毛光泽差的情况。随后,9只乳鼠逐渐出现腹胀腹泻现象,肛门红肿,尾部有粪便粘附,皮肤干燥褶皱增多,肛周有大便污染痕迹。在第3天9只乳鼠腹泻达到高峰,此后症状逐渐减轻,至第5天腹泻情况消失。
而对照组的乳鼠精神反应佳,活力充沛,皮肤红润有弹性,肛门无红肿,粪便性状正常。
3、乳鼠体重动态变化
模型组的9只乳鼠在灌入轮状病毒后,0-5天,乳鼠体重变化如表1所示,模型组在感染第3天,乳鼠体重较对照组明显降低(P<0.05),在观察时间内乳鼠体重较对照组一直处于低水平状态。
表1灌入轮状病毒或细胞液后各组乳鼠体重变化情况
4、乳鼠小肠病理检测
2天后的病理切片显示,正常组乳鼠(见图1)的小肠粘膜层较厚,绒毛密集。模型组乳鼠(见图2)的小肠肌层变薄,粘膜肿胀、充血,大量淋巴细胞浸润,小肠绒毛脂肪变性稀疏,肠腔上皮细胞完整性破坏。
- 还没有人留言评论。精彩留言会获得点赞!