一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法与流程
本发明涉及胰岛素给药载体技术领域,具体涉及一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法。
背景技术:
胰岛素是治疗糖尿病最常用和最有效的药物。目前,胰岛素最常用的给药方式是皮下注射给药。这种给药方式容易引起感染、过敏反应以及注射位点的脂肪代谢障碍,并且注射疼痛、需要专人进行给药等缺点也给患者带来很大困扰。因此,亟需研究开发更加经济、方便和无痛的新型胰岛素给药系统。
口服胰岛素给药系统是近年来发展的一种新型胰岛素给药系统,这一系统的生理作用机制与胰岛素在体内分泌后的内生通路相似,即胰岛素首先经过肝脏而不是直接到达血液循环系统。肝脏在血糖水平调节中起着重要作用,它是第一个也是最重要的胰腺分泌胰岛素的目标器官。然而,采用皮下注射给药时只有一小部分(大约为20%)的胰岛素到达了肝脏,大量胰岛素直接进入血液循环系统,极易引发低血糖症。口服胰岛素给药系统模拟人体葡萄糖代谢的生理机制,胰岛素被吸收后首先经过肝脏,降低在系统循环中的胰岛素水平,从而减小低血糖症发作的风险。但是,口服胰岛素给药系统的实现仍然面临很多问题。胰岛素的口服给药需要通过胃肠道中的极端环境,酸性的胃液和碱性的肠液以及多种消化酶,并且还需要通过肠道粘液屏障以及上皮细胞层屏障。胰岛素作为一种蛋白质类药物,在人体胃肠道内很容易被蛋白酶水解,失去生物功能。这为胰岛素口服给药的实现带来了极大的挑战。
在过去的几十年内,纳米科技和纳米药物的快速发展为口服生物分子类药物带来了新的发展契机。研究者们设计开发了多种药物载体,如聚合物纳米颗粒、脂质体、胶束、微胶囊、微凝胶等,对胰岛素进行包覆修饰。这些药物载体能够保护胰岛素的结构和功能不被破坏,从而提高胰岛素的吸收率。目前,口服胰岛素载体的构筑基元主要包括壳聚糖、葡聚糖、海藻酸钠和透明质酸等天然聚合物,以及聚乳酸、聚丙烯胺和聚己内酯等合成聚合物。然而,这些药物载体的制备过程常常需要使用高温、超声、剧烈的搅拌等手段,极易对胰岛素的结构和生物活性造成破坏。因此,科研人员一直在寻找更好的胰岛素载体的制备方法和材料。
近年来,多巴胺由于在弱碱性条件下能够发生氧化自聚合反应生成聚多巴胺,并且这种自聚合反应可以发生在各种无机和有机材料的表面上,而成为一种新颖的制备表面涂层材料的仿生构筑基元。据文献报道,聚多巴胺这种极强的粘附性质是因为其分子结构与水生生物贻贝的粘着斑的化学结构相近,二者均富含3,4-二羟基-L-苯丙氨酸和赖氨酸结构单元。此外,聚多巴胺涂层表面的酚羟基和氨基基团赋予其较高的化学反应活性,如酚羟基与巯基的脱水缩合反应、酚羟基与多种金属离子的络合反应、氨基基团的迈克尔加成和希夫碱反应等,使其能够与多种化学分子发生反应。研究者们常利用这些反应对聚多巴胺涂层进行表面修饰,从而制备多功能的复合材料。聚多巴胺涂层除具有极强的粘附能力和较高的化学反应活性外,还具有非常优良的生物相容性,从而使其在生物医药领域具有很大的应用前景。
上述分析结果表明,很难通过温和、快速和可控的反应制备具有良好的生物相容性、能够克服胃肠道屏障的口服胰岛素给药载体,仿生聚多巴胺材料为胰岛素给药系统的制备带来新的发展机遇。
技术实现要素:
为了克服上述现有技术的缺点,本发明的目的在于提供一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,该载体具有良好的生物相容性,能够克服胃肠道屏障,具有胰岛素释放速率可控的优点。
为了达到上述目的,本发明采取的技术方案为:
一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)将胰岛素粉末溶解在酸性溶液中使浓度达到5-50mg/mL,向其中加入氯化钠,使氯化钠的含量为0.5-5mol/L,通过盐析法制备胰岛素微纳米颗粒;
2)将胰岛素微纳米颗粒分散在多巴胺的弱碱性溶液中,使得胰岛素的浓度为10-80mg/mL,多巴胺的浓度为0.5-5mg/mL,震荡下反应,得到聚多巴胺包覆的胰岛素核壳结构;
3)将聚多巴胺包覆的胰岛素核壳结构分散在功能性分子的溶液中,使得聚多巴胺包覆的胰岛素核壳结构的浓度为10-80mg/mL,功能性分子的浓度为5-10mg/mL,在核壳结构表面修饰功能性分子,得到能够克服肠道屏障的生物相容性的聚多巴胺微胶囊口服胰岛素给药载体。
所述的胰岛素为人胰岛素、牛胰岛素、猪胰岛素、羊胰岛素、马胰岛素、狗胰岛素或猫胰岛素中的一种或多种。
所述的酸性溶液为盐酸溶液,其pH为1-2。
所述的通过盐析法制备胰岛素微纳米颗粒的水浴反应温度为5-20℃;反应条件为震荡、搅拌或是超声处理;反应时间为0.5-3h。
所述的盐析法制备胰岛素微纳米颗粒,制备后通过分散在2mol/L氯化钠溶液中进行清洗,离心分离,得到纯净的胰岛素微纳米颗粒。
所述的弱碱性溶液为Tris-HCl溶液、Tris-HCl及H2O2溶液、或者NaOH及H2O2溶液,溶液的pH为7.5-10.5。
所述的震荡下反应的震荡转速为500-1500rpm;反应时间为12-48h;反应温度为4-30℃。
所述的聚多巴胺包覆的胰岛素核壳结构通过离心、分散在弱碱性溶液中清洗,并保存在4℃环境中。
所述的功能性分子为能够与疏水性的、带负电荷的肠道粘液发生较强的相互作用或是能够与肠道粘液内的糖蛋白进行特异性识别的生物靶向分子,包括聚乙二醇、壳聚糖、阳离子脂质体和凝集素,这些分子可以提高载体在胃肠道中的稳定性,延长其在肠道粘液内的停留时间,进而提高胰岛素的吸收率。
所述的步骤3)通过共价键或非共价键相互作用在聚多巴胺微胶囊表面修饰功能性分子。
所述的步骤3)功能性分子的具体反应为通过与戊二醛的希夫碱反应在聚多巴胺微胶囊表面修饰壳聚糖、阳离子脂质体和凝集素,通过酚羟基与巯基的脱水缩合反应修饰带巯基的聚乙二醇分子。
上述聚多巴胺微胶囊口服胰岛素给药载体的应用,包括测试聚多巴胺微胶囊胰岛素给药载体与粘蛋白的相互作用,评估功能性修饰的载体克服肠道屏障的能力;测试聚多巴胺微胶囊胰岛素给药载体的胰岛素释放行为;测试聚多巴胺微胶囊胰岛素给药载体的细胞相容性,聚多巴胺微胶囊胰岛素给药载体用于制备治疗下述疾病的产品:人类糖尿病、牛糖尿病、猪糖尿病、羊糖尿病、马糖尿病、狗糖尿病和猫糖尿病。
本发明的有益效果为:
1)本发明聚多巴胺微胶囊口服胰岛素给药载体首次通过温和、快速和可控的反应制备具有良好的生物相容性、能够克服肠道屏障的仿生聚多巴胺微胶囊口服胰岛素给药载体。
2)本发明聚多巴胺微胶囊口服胰岛素给药载体可以通过改变反应过程中胰岛素的浓度,盐析时氯化钠的浓度,多巴胺的浓度,缓冲溶液的类型、pH值,以及反应时间、温度、震荡速度等反应条件,实现对聚多巴胺微胶囊壁厚和尺寸的调控,从而调控负载药物胰岛素的释放速率。
3)本发明聚多巴胺微胶囊口服胰岛素给药载体生物相容性好,能够克服肠道屏障,在肠道粘液内的停留时间长,从而提高胰岛素的吸收率,提高给药系统的给药效率。
附图说明
图1为实施例1制备的(a)未包覆、(b)包覆了聚多巴胺微胶囊壳层的胰岛素颗粒的扫描电镜照片。
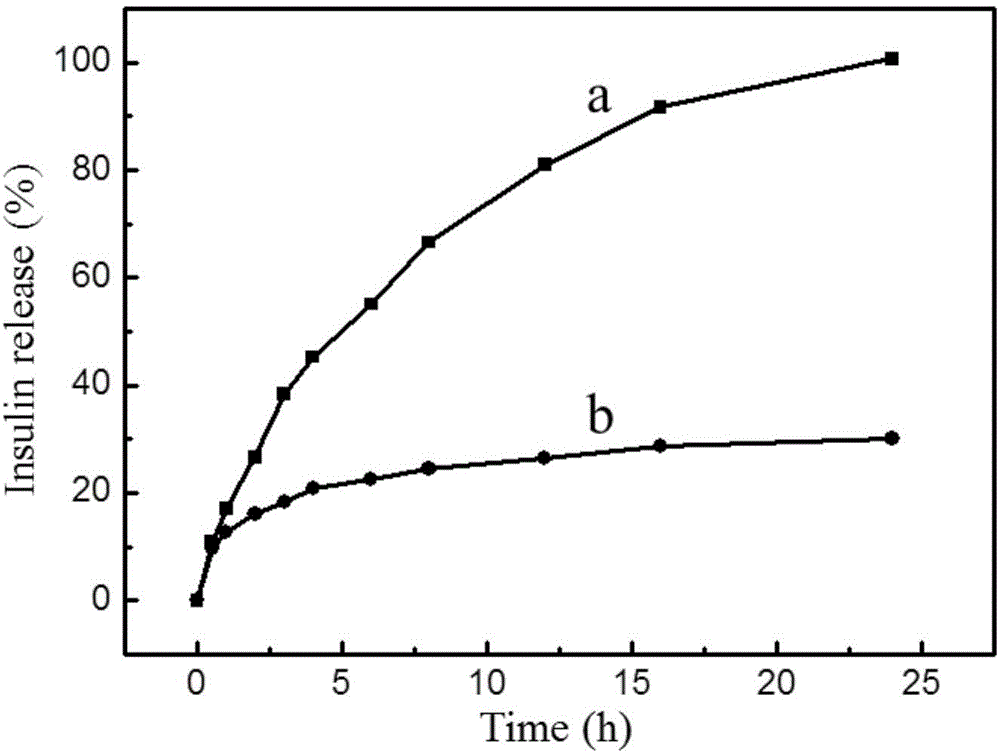
图2为实施例1制备的壳聚糖修饰的口服胰岛素给药载体的胰岛素释放曲线:(a)pH 7.4的PBS缓冲溶液,(b)pH 5.4的PBS缓冲溶液。
图3为实施例1制备的壳聚糖修饰的口服胰岛素给药载体的细胞毒性测试,(a)为对照样,(b)、(c)分别为加入20,40μL的壳聚糖修饰的口服胰岛素给药载体后人脐静脉内皮细胞的存活率。
具体实施方式
下面结合实施例对本发明进行详细描述。除非在本发明说明书中另有定义,否则在此所有的技术术语都是根据本领域一般技术人员所通常使用和理解的惯用定义来使用。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
实施例1,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为2的盐酸溶液溶解胰岛素粉末,使其浓度为10mg/mL,向其中加入氯化钠晶体,直到氯化钠的量达到0.6mol/L,15℃水浴中震荡下反应1h,观察到白色的胰岛素颗粒逐渐析出,离心分离产品,并采用2mol/L氯化钠溶液清洗产品2次,离心分离,得到胰岛素微纳米颗粒;
2)首先,配制pH 7.5的Tris-HCl缓冲溶液;其次,将胰岛素微纳米颗粒分散于Tris-HCl缓冲溶液,使得胰岛素的浓度为10mg/mL,加入多巴胺粉末,使其浓度为2mg/mL,将以上反应体系置于室温下以900rpm的转速震荡反应24h,反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色;最后,离心收集颗粒,采用Tris-HCl缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;其微观结构如图1所示,图1a显示新制的胰岛素颗粒略显粗糙,而在包覆了聚多巴胺壳层之后,胰岛素变得很光滑,如图1b所示;
3)首先,将聚多巴胺包覆的胰岛素核壳结构,分散到0.025%戊二醛的PBS溶液中(pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为10mg/mL,吸附24小时;洗涤三次后,加入5mg/mL壳聚糖的PBS溶液,吸附12小时,洗涤三次;离心分离,得到壳聚糖修饰的口服胰岛素给药载体,保存在4℃环境中。
本实施例壳聚糖修饰的口服胰岛素给药载体的有益效果:
(1)粘蛋白吸附实验:
配制0.5mg/mL、pH 5.5的粘蛋白溶液。将上述制备的壳聚糖修饰的口服胰岛素给药载体分散在粘蛋白溶液中,37℃环境中相互作用5h。离心分离,测量上清液中粘蛋白的含量,从而计算出给药载体吸附粘蛋白的质量,评价给药载体与粘液作用的强弱。
(2)胰岛素释放行为测试:
分别采用pH 7.4及pH 5.4的两种PBS缓冲溶液研究口服胰岛素给药载体的胰岛素释放行为。将口服胰岛素给药载体分别分散于两种缓冲溶液中(2mL),在200rpm的条件下震荡释放胰岛素。总共测试时间为24h。在特定的时间点离心取出0.5mL的上清液,并替换为新制缓冲溶液。通过考马斯亮兰溶液测试上清液中的胰岛素浓度,从而得出胰岛素在两种缓冲溶液中的释放曲线。口服胰岛素给药载体的胰岛素释放性能如图2所示。图2说明,口服胰岛素给药载体的胰岛素释放呈现pH响应性,在pH 5.4的缓冲溶液中,胰岛素的释放很少。而在pH 7.4的缓冲溶液中,胰岛素实现完全的释放。这种响应性的释放行为,有利于该载体通过口服的方式进行给药。
(3)口服胰岛素给药载体的细胞相容性:
以人脐静脉内皮细胞(HUVEC)为例进行细胞毒性测试。HUVEC细胞接种密度大约为2×104cells/mL。细胞在聚苯乙烯培养皿中培养。培养基中含10%(v/v%)的胎牛血清,1%的链霉素和青霉素,培养基每两天更换一次。培养箱温度设定为37℃,含有5%(v/v%)CO2的潮湿空气。当细胞达到90%的生长期时,用标准的消化技术将他们分在24孔板中进行培养。根据细胞的培养情况,约两天后,吸取培养液,换新液,其中一列中不加入任何样品,作为参比样,另外几列中分别加入不同体积(20,40μL)口服胰岛素给药载体溶液,继续培养12小时。为了测定细胞的活性,在每孔中各加入100μL MTT溶液(浓度为5mg/mL),用铝箔包裹培养板在培养箱中温育4h。去除孔中的培养基和MTT,然后在各孔中分别加入200μL DMSO,震荡10min,充分溶解沉淀在培养板底部的MTT-甲臜晶体。立即使用紫外-可见光谱仪检测其在570nm处的吸光值,以防止产物变质。结果如图3所示。由图3可知,微胶囊的加入没有对细胞的生长造成影响,说明微胶囊无细胞毒性,是生物相容的。
实施例2,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为1的盐酸溶液溶解胰岛素粉末,使其浓度为50mg/mL;向其中加入氯化钠晶体,直到氯化钠的量达到0.5mol/L;5℃水浴中震荡下反应3h,观察到白色的胰岛素颗粒逐渐析出;离心分离,采用2mol/L氯化钠溶液进行清洗2次,离心分离,得到胰岛素微纳米颗粒;
2)配制pH 7.5的Tris-HCl缓冲溶液,将胰岛素微纳米颗粒分散于Tris-HCl缓冲溶液,使得胰岛素的浓度为80mg/mL,加入多巴胺粉末,使其浓度为2mg/mL;将以上反应体系置于室温下以900rpm的转速震荡反应24h,反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色;离心收集颗粒,采用Tris-HCl缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;
3)将聚多巴胺包覆的胰岛素核壳结构分散到0.025%戊二醛的磷酸盐缓冲溶液中(PBS pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为80mg/mL,吸附24小时;洗涤三次后,加入10mg/mL壳聚糖的PBS溶液,吸附12小时,洗涤三次;离心分离,得到壳聚糖修饰的口服胰岛素给药载体,保存在4℃环境中。
实施例3,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为1.5的盐酸溶液溶解胰岛素粉末,使其浓度为20mg/mL;向其中加入氯化钠晶体,直到氯化钠的量达到2mol/L;15℃水浴中震荡下反应1h,观察到白色的胰岛素颗粒逐渐析出;离心分离,采用2mol/L氯化钠溶液进行清洗2次,离心分离,得到胰岛素微纳米颗粒;
2)配制pH 8.5的Tris-HCl缓冲溶液,将上胰岛素微纳米颗粒分散于Tris-HCl缓冲溶液,使得胰岛素的浓度为40mg/mL,加入多巴胺粉末,使其浓度为2mg/mL;将以上反应体系置于室温下以900rpm的转速震荡反应24h;反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色。离心收集颗粒,采用Tris-HCl缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;
3)将聚多巴胺包覆的胰岛素核壳结构分散到0.025%戊二醛的磷酸盐缓冲溶液中(PBS pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为40mg/mL,吸附24小时;洗涤三次后,加入10mg/mL壳聚糖的PBS溶液,吸附12小时,洗涤三次;离心分离,得到壳聚糖修饰的口服胰岛素给药载体,保存在4℃环境中。
实施例4,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为2的盐酸溶液溶解胰岛素粉末,使其浓度为0.5mg/mL;向其中加入氯化钠晶体,直到氯化钠的量达到5mol/L;10℃水浴中震荡下反应1h,观察到白色的胰岛素颗粒逐渐析出;离心分离,采用2mol/L氯化钠溶液进行清洗2次,离心分离,得到胰岛素微纳米颗粒;
2)配制pH 10的Tris-HCl缓冲溶液,将上胰岛素微纳米颗粒分散于Tris-HCl缓冲溶液,使得胰岛素的浓度为30mg/mL,加入多巴胺粉末,使其浓度为2mg/mL;将以上反应体系置于室温下以900rpm的转速震荡反应12h,反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色。离心收集颗粒,采用Tris-HCl缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;
3)首先,将聚多巴胺包覆的胰岛素核壳结构分散到0.025%戊二醛的磷酸盐缓冲溶液中(PBS pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为30mg/mL,吸附24小时;洗涤三次后,加入8mg/mL壳聚糖的PBS溶液,吸附12小时,洗涤三次;离心分离,得到壳聚糖修饰的口服胰岛素给药载体,保存在4℃环境中。
实施例5,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为1.5的盐酸溶液溶解胰岛素粉末,使其浓度为20mg/mL;向其中加入氯化钠晶体,直到氯化钠的量达到2mol/L;15℃水浴中震荡下反应1h,观察到白色的胰岛素颗粒逐渐析出,离心分离,采用2mol/L氯化钠溶液进行清洗2次,离心分离,得到胰岛素微纳米颗粒;
2)配制pH 8.5的NaOH及H2O2混合溶液,将胰岛素微纳米颗粒分散于NaOH及H2O2混合溶液,使得胰岛素的浓度为50mg/mL,加入多巴胺粉末,使其浓度为0.5mg/mL;将以上反应体系置于室温下以900rpm的转速震荡反应24h。反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色,离心收集颗粒,采用PBS缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;
3)将聚多巴胺包覆的胰岛素核壳结构分散到0.025%戊二醛的磷酸盐缓冲溶液中(PBS pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为50mg/mL,吸附24小时;洗涤三次后,加入8mg/mL壳聚糖的PBS溶液,吸附12小时,洗涤三次;离心分离,得到壳聚糖修饰的口服胰岛素给药载体,保存在4℃环境中。
实施例6,一种聚多巴胺微胶囊口服胰岛素给药载体的制备方法,包括以下步骤:
1)使用pH为1.5的盐酸溶液溶解胰岛素粉末,使其浓度为20mg/mL;向其中加入氯化钠晶体,直到氯化钠的量达到2mol/L;15℃水浴中震荡下反应1h,观察到白色的胰岛素颗粒逐渐析出;离心分离,采用2mol/L氯化钠溶液进行清洗2次,离心分离,得到胰岛素微纳米颗粒;
2)配制pH 10.5的Tris-HCl缓冲溶液,将胰岛素微纳米颗粒分散于Tris-HCl缓冲溶液,使得胰岛素的浓度为50mg/mL,加入多巴胺粉末,使其浓度为5mg/mL;将以上反应体系置于室温下以900rpm的转速震荡反应24h,反应过程中,溶液的颜色由粉红色,逐渐转变为棕色、深棕色,离心收集颗粒,采用Tris-HCl缓冲溶液清洗颗粒,得到聚多巴胺包覆的胰岛素核壳结构,保存在4℃环境中;
3)将聚多巴胺包覆的胰岛素核壳结构分散到0.025%戊二醛的磷酸盐缓冲溶液中(PBS pH 7.4),使得聚多巴胺包覆的胰岛素核壳结构的浓度为50mg/mL,吸附24小时;洗涤三次后,加入10mg/mL凝集素的PBS溶液,吸附12小时,洗涤三次;离心分离,得到凝集素修饰的口服胰岛素给药载体,保存在4℃环境中。
按照实施例1中的方法,采用粘蛋白吸附实验、胰岛素释放行为测试、MTT细胞活性实验,分别对实施例2-6制备的口服胰岛素给药载体的应用性能进行评估。结果表明,实施例2-6制备的口服胰岛素给药载体呈现出与粘蛋白有较强的相互作用,并且载体的细胞相容性很好,具有可调控的、pH响应性的胰岛素释放行为,有望应用于人类和动物的糖尿病的治疗。
- 还没有人留言评论。精彩留言会获得点赞!