一种多甲氧基黄酮在制备治疗皮肤乳头状瘤的药物上的应用的制作方法
本发明涉及一种多甲氧基黄酮在制备治疗皮肤乳头状瘤的药物上的应用。
背景技术:
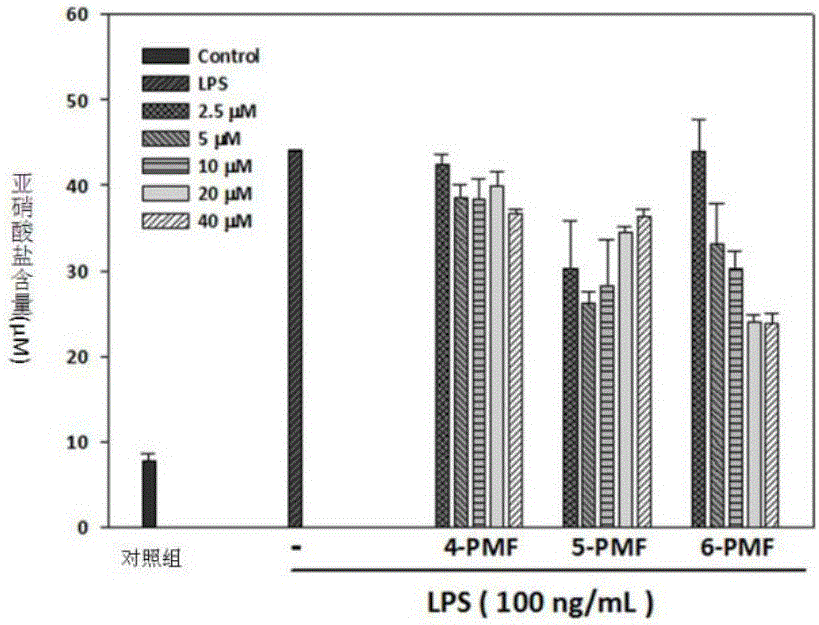
:在防御机制中,体内适当的发炎反应可以活化免疫系统,并启动免疫与发炎反应,清除外来物的伤害。当外来物被清除及组织修补后,急性发炎即停止;若外来物清除不完全、免疫系统不全或解除发炎作用的信号传递失调等,就会形成慢性发炎反应,正常细胞或组织受到发炎或免疫细胞产生的自由基的破坏,导致血管过度舒张、组织坏死,产生致癌性影响,其中包含引起DNA碱基突变及蛋白质的结构修饰,影响细胞膜功能或造成细胞内蛋白质或酶的功能丧失。炎症细胞开始转变成肿瘤细胞并不断增生[Allavena,P.,Garlanda,C.,Borrello,M.G.,Sica,A.,andMantovani,A.(2008)Pathwaysconnectinginflammationandcancer.Curr.Opin.Genet.Dev.,18,3-10.]。化学致癌作用通常是在化合物的作用下,诱发肿瘤形成。早在1947年,Bernblum及Shubik的研究结果就证实,在小鼠皮肤表面局部涂抹化学致癌药物,会使相应部位皮肤形成乳头状肿瘤[Berenblum,I.andShubik,P.(1949)Thepersistenceoflatenttumourcellsinducedinthemouse'sskinbyasingleapplicationof9:10-dimethyl-1:2-benzanthracene.Br.J.Cancer,3,384-386.]。这种处理方法能够缩短长期致癌实验的时间,涂抹过程中可以清楚观察到肿瘤生长的动态,有助于了解致癌物在肿瘤发生与发展的不同阶段,对肿瘤形成与发展的作用机制[Mueller,M.M.(2006)Inflammationinepithelialskintumours:oldstoriesandnewideas.Eur.J.Cancer,42,735-744.]。化学致癌作用较常使用的化学致癌剂包括二甲基苯并蒽(7,12-dimethylbenzanthraene,DMBA)和三(2-吡啶甲基)胺(12-O-Tetradecanoyl-phorbol13-Acetate,TPA)。作为一种多环的芳香烃基类多潜能致癌物,DMBA经皮肤吸收后进入生物体内,能诱发DNA的多位点突变,影响一系列癌基因和抑癌基因的表达,启动细胞的癌变。在小鼠皮肤的局部涂抹TPA会造成氧化自由基的增加,导致氧化压力上升及局部发炎的现象。TPA将造成细胞内抗氧化系统失衡,使肿瘤组织维持在发炎的微环境,促进细胞发生癌变。在发炎反应中,诱导型一氧化氮合酶(induciblenitricoxidesynthase,iNOS)及其产物一氧化氮(NitrogenMonoxide,NO)的含量要高于正常组织,会导致DNA损伤、破坏错误复制DNA的修复能力,导致所表达的蛋白质发生变化,使其丧失原有的功能与活性;NO具有促进血管新生、白细胞的黏附、浸润与肿瘤细胞的转移。已有许多研究证实,在不同慢性炎症性疾病和恶性肿瘤组织中,都具有较高含量的NO。在细胞外,NO极不稳定,几秒钟后便转化为亚硝酸盐,通常都通过测定亚硝酸盐的含量来检测细胞内NO的含量[Moncada,S.,Palmer,R.M.,andHiggs,E.A.(1991)Nitricoxide:physiology,pathophysiology,andpharmacology.Pharmacol.Rev.,43,109-142.]。环氧合酶-2(cyclooxygenase,COX-2)是由前列腺素合成,COX-2的合成受到肿瘤坏死因子-α(tumornecrosisfactoralpha,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)及表皮生长因子(Epidermalgrowthfactor,EGF)的诱发,在发炎反应时期,COX-2的表达会增加血管通透性,提升白血球与免疫细胞的趋化性,扩大发炎反应的范围[Tsujii,M.,Kawano,S.,Tsuji,S.,Sawaoka,H.,Hori,M.,andDuBois,R.N.(1998)Cyclooxygenaseregulatesangiogenesisinducedbycoloncancercells.Cell,93,705-716.];另有研究指出,在DMBA和TPA处理之前,用iNOS与COX-2抑制剂预处理小鼠皮肤后,能够明显降低DMBA和TPA所诱发的肿瘤发生率与形成肿瘤的数量[Chun,K.S.,Cha,H.H.,Shin,J.W.,Na,H.K.,Park,K.K.,Chung,W.Y.,andSurh,Y.J.(2004)Nitricoxideinducesexpressionofcyclooxygenase-2inmouseskinthroughactivationofNF-kappaB.Carcinogenesis,25,445-454.]。所以,从发炎的诱导到发展成肿瘤的过程中,iNOS与COX-2都起着重要作用。皮肤乳头状瘤是由于表皮乳头样结构的上皮组织增生后形成的。皮肤乳头状瘤的发病率呈现出逐年增高及年轻化的趋势,由于该病诱发因素较多,病因复杂,确切发病机理仍不清楚。在临床治疗上,皮肤乳头状瘤具有容易恶变成为皮肤癌、手术治疗后容易复发、多发性和产生组织破坏等特点。目前,国内外关于皮肤乳头状瘤治疗方面的研究报道相对较少,如何有效控制该病的发生,提高治疗效果,防止肿瘤的复发和恶变,具有非常重要的意义。近年来,众多的研究结果证实,部分从植物中提取的天然物质,具有较强的预防肿瘤细胞生长的活性。多甲氧基黄酮属于黄酮类化合物,在柑橘果皮中具有较高的含量。此类化合物的C6-C3-C6骨架上接有两个以上的甲氧取代基,因极性较低而具有较好的生物可利用率。现有的研究结果表明,多甲氧基黄酮类物质具有抗发炎的生物活性[MiddletonEJr,Kandaswami,C.,andTheoharides,T.C.(2000)Theeffectsofplantflavonoidsonmammaliancells:implicationsforinflammation,heartdisease,andcancer.Pharmacol.Rev.,52,673-751.Manthey,J.A.,Grohmann,K.,andGuthrie,N.(2001)Biologicalpropertiesofcitrusflavonoidspertainingtocancerandinflammation.Curr.Med.Chem.,8,135-153.]。许多研究证实,多甲氧基黄酮具有和未被甲基化黄酮相似的活性,如抗癌、抗病毒等,并且生物可利用率高于未被甲基化的黄酮[Nielsen,S.E.,Breinholt,V.,Cornett,C.,andDragsted,L.O.(2000)Biotransformationofthecitrusflavonetangeretininrats.Identificationofmetaboliteswithintactflavanenucleus.FoodChem.Toxicol.,38,739-746.]。本发明所使用的多甲氧基黄酮化合物为以下三种:5,7,3’,4’-四甲氧基黄酮(3’,4’,5,7-Tetramethoxyflavone,4-PMF)、5,7,3’,4’,5’-五甲氧基黄酮(5,7,3’,4’,5’-pentamethoxyflavones,5-PMF)以及5,6,7,3’,4’,5’-六甲氧基黄酮(5,6,7,3’,4’,5’-Hexamethoxyflavone,6-PMF),三者都属于多甲氧基黄酮,而4-PMF为月橘(Murrayapaniculata)与黑姜(Kaempferiaparviflora)中主要的多甲氧基黄酮之一,这些植物的提取物已被证实具有抗发炎、抗肿瘤以及抗氧化等生物活性[Kinoshita,T.andShimada,M.(2002)IsolationandstructureelucidationofanewprenylcoumarinfromMurrayapaniculatavar.omphalocarpa(Rutaceae).Chem.Pharm.Bull.(Tokyo),50,118-120.Yenjai,C.,Prasanphen,K.,Daodee,S.,Wongpanich,V.,andKittakoop,P.(2004)BioactiveflavonoidsfromKaempferiaparviflora.Fitoterapia,75,89-92.]。本专利为多甲氧基黄酮在制备治疗皮肤乳头状瘤上的应用,达到治疗皮肤乳头状瘤的目的。技术实现要素:针对大多皮肤乳状瘤具有易恶变为皮肤癌、术后易复发、多发性生长并易产生组织破坏的特点,本发明提供了一种多甲氧基黄酮在制备治疗皮肤乳头状瘤的药物上的应用。通过细胞实验和动物实验,发现该类化合物对皮肤乳头状瘤具有明显的作用效果。所述的多甲基黄酮包括所有C6-C3-C6骨架上接有两个以上的甲氧取代基的黄酮,包括,4-PMF(结构式见图1)、5-PMF(结构式见图1)以及6-PMF(结构式见图1)。化学试剂的配制:DMBA:准确称取1.2815mgDMBA,用200μL丙酮溶解后,配制成1μmol/mL的DMBA溶液,现配现用。TPA:准确称取5mgTPA,用200μL丙酮溶解后配制成100nmol/200μL的TPA贮备液,使用前用丙酮稀释成5nmol/200μL。4-PMF、5-PMF、6-PMF:准确称取0.0342g4-PMF、0.0372g5-PMF、0.0402g6-PMF,分别用200μL丙酮溶解后,配制成100μmol/200μL的储备液,使用前用丙酮稀释成所需要的浓度。该多甲氧基黄酮的使用浓度为2.5-40μmol/L。本发明所述的多甲氧基黄酮对小鼠巨噬细胞RAW264.7生长抑制作用的使用方法为:将细胞培养在含100U/ml的青霉素和100μg/ml的链霉素、10%胎牛血清的DMEM培养基中,培养温度为37℃,二氧化碳浓度为5%的条件下,当细胞生长到8分满时,分别在DMEM培养基加入终浓度为100ng/mL的脂多糖(Lipopolysaccharides,LPS)和终浓度为2.5-10μmol/L以丙酮溶解的多甲氧基黄酮,培养24h后,收集细胞培养液的上清液,测定亚硝酸盐含量。本发明所述的多甲氧基黄酮对化学诱导ICR小鼠皮肤乳头状瘤生长抑制作用的使用方法为:将ICR小鼠按6只/笼随机分配至各个笼子,二笼为一组(即一组共有12只),共分为诱导组,对照组、5μmol/200μL4-PMF处理组、5μmol/200μL5-PMF处理组和5μmol/200μL6-PMF处理组。适应饲养一周后,用小型剃刀将ICR小鼠背部靠近尾巴部位剔除一块面积约2cm2区域的毛发。在剔除毛发部位涂抹200μL浓度为1μmol/mL的DMBA,2天后再在相同部位涂抹200μL相同浓度的DMBA。经过DMBA处理一星期后,在剔除毛发部位,诱导组持续每星期用5nmol/200μL浓度的TPA涂抹2次;对照组持续每星期用200μL的丙酮涂抹2次;4-PMF处理组持续每星期用200μL浓度为5μmol/200μL的4-PMF涂抹2次;5-PMF处理组持续每星期用200μL浓度为5μmol/200μL的5-PMF涂抹2次;6-PMF处理组持续每星期用200μL浓度为5μmol/200μL的6-PMF涂抹2次,在第2次DMBA处理后,所有组再持续处理20周。每周记录直径大于1mm并持续存在2星期以上的肿瘤数量,并测量肿瘤大小。20周后处死小鼠,统计肿瘤数量、肿瘤发生率(%)及肿瘤大小。本发明具有的有益效果:本发明中所选用的多甲氧基黄酮,均能够从植物中提取分离,属于植物天然化合物,来源广泛,也能够直接从试剂公司购买。与诱导组相比,分别以5mol/L浓度的4-PMF、5-PMF或6-PMF处理后,小鼠皮肤肿瘤数量分别减少24.2%、42.5%与54.2%。实验结果表明,多甲氧基黄酮对皮肤乳头状瘤的治疗效果显著。本发明可指导开发新的皮肤乳头状瘤治疗方法,为今后开发利用多甲氧基黄酮类化合物提供了新的方向和策略。附图说明图1为4-PMF、5-PMF和6-PMF的分子结构。图2为RAW264.7细胞用100ng/ml的LPS和不同浓度多甲氧基黄酮处理24h后培养基中亚硝酸盐的含量。图3为不同组ICR小鼠背部皮肤中iNOS和COX-2的表达情况。图4为不同组ICR小鼠背部皮肤中DNMT1和DNMT3b的表达情况。图5为不同组ICR小鼠背部皮肤中GPR55的表达情况。图6为不同组ICR小鼠背部皮肤中p38和p-p38的表达情况。图7为不同组ICR小鼠背部皮肤中p-PI3K和p-Akt的表达情况。图8为多甲氧基黄酮对DMBA/TPA诱导的ICR小鼠皮肤肿瘤数量的作用。图9为不同组ICR小鼠皮肤肿瘤诱导百分率。图10为多甲氧基黄酮对DMBA/TPA诱导的ICR小鼠皮肤肿瘤的抑制作用。具体实施方式实施例1多甲氧基黄酮对小鼠巨噬细胞RAW264.7亚硝酸盐含量的影响所培养的细胞为小鼠巨噬细胞RAW264.7,培养基为DMEM培养基,含有终浓度为100U/ml的青霉素和100μg/ml的链霉素、体积比为10%的胎牛血清,培养温度为37℃,二氧化碳浓度为5%。将小鼠巨噬细胞RAW264.7培养在24孔细胞培养板中,当细胞生长到8分满后,分别在不同孔中加入终浓度为100ng/mL的脂多糖(Lipopolysaccharides,LPS)和终浓度为2.5μmol/L、5μmol/L、10μmol/L、20μmol/L、40μmol/L的4-PMF、5-PMF或6-PMF,继续培养24小时后,分别取100μL上述各处理的培养基上清液至96孔板中,每孔加入100μL格里斯试剂(含有1%磺胺和0.1%盐酸萘乙二胺的水溶液)混合均匀后,在波长570nm下,用酶标仪检测吸光値。吸光值检测结果如图2所示,与诱导组相比,4-PMF处理组的NO含量减少3.39~16.42%,抑制效果与诱导组相比并无显著性差异;在浓度2.5、5及10M时,5-PMF处理组有明显抑制NO合成的效果,NO含量分别减少30.96%、40.38%与35.75%;浓度为2.5、5、10、20和40M的6-PMF对NO合成的抑制率分别为0.11%、24.60%、31.12%、45.38%与45.76%,呈现剂量依赖的现象,且与诱导组相比具有显著性差异。从上述结果得知,多甲氧基黄酮具有抑制NO合成的能力,且随着甲氧基数量的增加,其抑制现象愈明显,以6-PMF抑制能力最佳。实施例2多甲氧基黄酮对DMBA/TPA诱导ICR小鼠皮肤乳头状瘤生长的影响实验用ICR小鼠购自乐斯科生物科技股份有限公司,按6只/笼随机分配至各个笼子,二笼为一组(即一组共有12只),共分为诱导组,对照组、5μmol/200μL4-PMF处理组、5μmol/200μL5-PMF处理组和5μmol/200μL6-PMF处理组。饲养环境保持25℃恒温,每天光照12小时/黑暗12小时,垫料及饮用水每周更换2次。适应饲养一周后,用刀片将ICR小鼠背部靠近尾巴部位剔除一块面积约为2cm2的毛发。在剔除毛发部位涂抹200μL浓度为1μmol/mL的DMBA,2天后再在相同部位涂抹200μL相同浓度的DMBA。经过DMBA处理一星期后,在剔除毛发部位,各组按如下处理方法连续处理20周:诱导组持续每星期用5nmol/200μL浓度的TPA涂抹2次;对照组持续每星期用200μL的丙酮涂抹2次;4-PMF处理组持续每星期用200μL浓度为5μmol/200μL的4-PMF涂抹2次,每次涂完4-PMF30分钟后,在相同部位涂抹5nmol/200μL的TPA;5-PMF处理组持续每星期用200μL浓度为5μmol/200μL的5-PMF涂抹2次,每次涂完5-PMF30分钟后,在相同部位涂抹5nmol/200μL的TPA;6-PMF处理组持续每星期用200μL浓度为5μmol/200μL的6-PMF涂抹2次,每次涂完6-PMF30分钟后,在相同部位涂抹5nmol/200μL的TPA。实验全程使用标准可灭菌饲料与单蒸水供实验动物食用。每周记录直径大于1mm并持续存在2星期以上肿瘤的数量并测量肿瘤大小。20周后,在最后一次TPA处理24小时后处死小鼠,统计肿瘤数量、肿瘤发生率(%)及肿瘤大小(图3、图4、图10)。外观变化:持续处理TPA20周后,诱导组每只小鼠的背部都有乳头状瘤生成;对照组则没有肿瘤发生;预处理PMFs的组别中,4-PMF、5-PMF与6-PMF处理组都有抑制肿瘤数量与大小的现象(图3、图4、图10)。肿瘤生长情形:实验20周后,各组小鼠肿瘤数量与发生率的统计结果如图3、图4。实验过程中诱导组小鼠持续涂抹TPA至第7周后,即开始有乳头状瘤的生成,到第20周后,每只小鼠只肿瘤数量平均为21颗,肿瘤发生率达百分之百;对照组则直到实验20周结束都没有形成乳头状瘤,表明该实验的肿瘤诱导模式是成立的;4-PMFs组每只小鼠肿瘤数量平均为12.0颗,肿瘤发生率为92%;5-PMF组每只小鼠肿瘤数量平均为9.1颗,肿瘤发生率为83%;6-PMF组每只小鼠肿瘤数量平均为4.7颗,肿瘤发生率为100%。肿瘤数量与大小分布:诱导组ICR小鼠皮肤肿瘤大小为:1-3mm3的有7.8±3.8颗;3-5mm3的有3.0±1.1颗;≧5mm3的有10.3±6.9颗。4-PMF组肿瘤大小为1-3mm3的有6.4±2.4颗;3-5mm3的有2.2±2.2颗;≧5mm3的有3.5±3.8颗。5-PMF组肿瘤大小为1-3mm3的有5.4±4.3颗;3-5mm3的有0.8±1.0颗;≧5mm3的有2.9±3.3颗。6-PMF组肿瘤大小为1-3mm3的有2.1±2.0颗;3-5mm3的有0.8±1.0颗;≧5mm3的有1.8±2.0颗。从上述结果得知,用浓度为5μmol/L的4-PMF、5-PMF或6-PMF处理后,实验小鼠的肿瘤数量均明显减少,与诱导组相比,分别减少24.2%、42.5%与54.2%。据此,我们推论,随着PMFs甲氧基数量的增加,PMF抑制DMBA/TPA所导致的肿瘤数量、大小的效果愈明显,并且达到统计上的显著性,但对于肿瘤发生率却无法改善,其原因可能是因为PMFs无法抑制第一周DMBA诱导过程中的基因突变,随后,涂抹TPA持续刺激皮肤组织,氧化压力逐渐增加,最终无法抑制乳头状瘤的发生。实施例3多甲氧基黄酮对DMBA/TPA诱导ICR小鼠基因表达的影响按实施例2的方法处理小鼠,处死后,收集处理部位的皮肤。把皮肤组织剪成细小的碎片后,按照每20mg皮肤组织加入150-250μL裂解液(含150mmol/L的NaCl、1mmol/L的EDTA、1g/mL的亮抑酶肽、1g/mL的抑蛋白酶肽、1g/mL的胃蛋白酶抑制剂和1mmol/L的PMSF)的比例加入组织裂解液,用玻璃匀浆器匀浆至充分裂解后,10,000rpm离心5分钟,取上清。以2mg/mLBSA溶液为浓度标准液,用酶标仪测定595nm处的吸光值,换算样本内蛋白浓度。蛋白质经聚丙烯酰胺凝胶电泳、转膜、结合一抗、二抗后,检测目的蛋白GPR55、phospho-p38、phospho-PI3K、phospho-Akt、DNMT1、DNMT3b、iNOS和COX-2表达水平的变化。每个样品重复3次,实验结果均以平均值±标准偏差表示,并分析各组间的差异,当p值小于0.05时即表示在统计学上具有显著性差异。实验结果显示,诱导组与对照组相比,GPR55的蛋白质表达量明显增加,表明GPR55参与TPA诱使小鼠皮肤产生病变的过程;多甲氧基黄酮预处理组中,以5-PMF组与6-PMF组的抑制现象最为显明,其中5-PMF的抑制效果优于6-PMF(图5)。由此可知,多甲氧基黄酮可通过降低TPA引致皮肤中GPR55的作用,进而达到减轻发炎等现象的产生。诱导组小鼠皮肤中的phospho-p38蛋白表达量显著高于对照组,而4-PMF、5-PMF与6-PMF处理组中,TPA诱导phospho-p38的表达作用都受到了一定的抑制,其中5-PMF处理组的抑制活性最强(图6);此外,诱导组的phospho-PI3K和phospho-Akt表达水平与对照组相比均有明显增加,4-PMF、5-PMF与6-PMF处理组的phospho-PI3K、phospho-Akt的表达水平与对照组相比显著降低,其中又以5-PMF与6-PMF处理组的抑制作用最为明显(图7);由图8可知,诱导组的两个重要的DNA甲基转移酶:DNMT1和DNMT3b都没有被活化,而多甲氧基黄酮处理组的DNMT1和DNMT3b表达水平都有增加,5-PMF处理组对DNMT1的表达水平最高,6-PMF处理组的DNMT3b的表达水平最高。综合上述两项结果可以推测,多甲氧基黄酮可通过调控DNMT1和DNMT3b的表达来调节iNOS的转录活性。由此可知,PMFs抑制发炎因子的表达可能是通过调控phospho-p38MAPK途径与PI3K/Akt途径,以抑制NF-κB转移至细胞核内并转录出下游iNOS和COX-2(图9),进而达到抑制发炎反应的效果。实施例4多甲氧基黄酮对ICR小鼠的生物毒性评价按实施例2的方法处理小鼠,处死小鼠后,称量各组ICR小鼠的体重、肝、脾、肾重量,以心脏采血方式采集血液,室温放置1h后,4℃3000rpm离心10min,收集血清,储存于-80℃冰箱中。以全自动生化分析仪检测肝功能生化指数:天门冬酸转氨酶(aspartateaminotransferase,AST)、丙氨酸转氨酶(alanineaminotransferase,ALT)、三酸甘油脂(triglyceride,TG)及总胆固醇(totalcholesterol,T-cho),检测结果见表1。从检测结果可以看出,两组数据间不存在显着性差异,多甲氧基黄酮对ICR小鼠没有表现出生物毒性。表1多甲氧基黄酮对ICR小鼠的生物毒性评价组别肝脏/体重肾脏/体重脾脏/体重GOT(Unit/L)GPT(Unit/L)TG(mg/dl)T-cho(mg/dl)诱导组3.91±0.250.85±0.070.25±0.0393.4±9.723.2±4.8113.7±28.978.9±4.24-PMF处理组3.95±0.350.89±0.020.23±0.0493.6±7.224.1±4.9112.4±28.976.5±4.15-PMF处理组3.92±0.280.83±0.070.24±0.0393.1±8.122.5±3.6114.3±15.676.2±3.66-PMF处理组3.99±0.310.88±0.040.26±0.0594.1±6.324.9±5.2113.1±20.379.3±4.7当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 包含甲氧基黄酮的NOX抑制剤及NFκB抑制剤的制作方法与工艺
- 一种多甲氧基黄酮、组合物及其制剂用于预防或治疗糖尿病的用途的制作方法与工艺
- 一种1‑(2‑羟基‑3‑甲氧苯基)乙酮的制备工艺的制作方法与工艺
- 一种多甲氧基黄酮在制备预防心血管炎症药物上的应用的制作方法与工艺
- 3’-羟基染料木黄酮用于制备抑制黑色素生成的组合物的用途的制作方法与工艺
- 合成5,6,4'‑三羟基黄酮‑7‑0‑D‑葡萄糖醛酸有关物质及其制备方法和应用与流程
- 5‑(4‑羟基‑3‑甲氧基苯亚甲基)‑2‑(2‑硝基苯亚胺基)噻唑烷酮及应用的制作方法与工艺
- 制备荷羟酮(甲基)丙烯酸酯的方法与流程
- 从瓯柑果实中分离纯化多甲氧基黄酮类化合物的方法与流程
- 一种多甲氧基黄酮在制备治疗黑色素瘤的药物上的应用的制造方法与工艺