用于长期抑制或预防机会性微生物感染症状的二元微生物制品的制作方法
本发明涉及用于长期抑制机会性微生物感染,尤其是生态失调(dysbiosis)(微生物平衡破坏)导致的机会性微生物感染,症状的二元微生物制品。
发明背景
机会性微生物感染、发炎的难愈合伤口、由侵袭性共生酵母形式引起的感染以及由皮肤癣菌引起的霉菌感染的发生率有上升趋势,这些问题目前影响很大一部分人口。这主要由以下导致:这类疾病的发生率增加通常不是由外部流行病学因素或遗传缺陷引起,所述遗传缺陷导致宿主免疫反应的生理程序受到根本性破坏。现在,机会性微生物感染的主要原因是免疫系统和自然防御反应的暂时性削弱,其最常作为运动员、女性或繁重劳动者或老年人中压力、严苛的生活方式、对生物体过度张力的结果,其与免疫反应的自然减弱有关。同样,其可能是严重伴随疾病和临床表现影响的结果,如糖尿病、肥胖、食物过敏、自身免疫性疾病等。大部分机会性微生物感染中的常见和明显伴随的临床表现是生态失调,其是指人体各部分特征性健康微生物菌群组成的生理平衡受到破坏。因此,上面指定的临床表现呈现(assume)大规模且对人群医疗状况的影响超出传统病因(损伤、感染、遗传缺陷)。
机会性微生物感染的现有治疗在没有理解生物体内微妙平衡的情况下推进,尤其是从长远角度来看。频繁使用抗生素、抗真菌和抗菌物质具有用反应性化学物质加重生物体负担的风险,所述物质很少没有毒性副作用。此外,唑类抗真菌剂有内分泌干扰作用,其破坏生物体的天然激素调节。抗生素的不妥当使用虽然已知并受到批评,但却继续发生,这是治疗机会性微生物感染的非生理性和非因果方法的典型示例,导致持续破坏皮肤表面和多种粘膜表面上天然微生物菌群的敏感的平衡。抗生素最常破坏天然微生物菌群的有益维生素成分,对致病微生物的影响极小,尤其是对能生成微生物生物膜的那些病原体。之后其长期使用仅产生由抗生素、抗真菌剂、抗菌剂引起的抗性,意味着这些物质很快失去其剩余效力。对可用抗生素的抗性已经到了流行病的程度并成为专业医学专家以及公众担心的原因。机会性微生物感染在直接威胁生命的疾病中不是最常见的,但其确实在根本上恶化生命质量。此后,使用化学制品治疗这些感染的不足在这些感染和其症状于先前“成功”治疗后的频繁复发中显现。通过此过程,反复感染的频率继续上升,直到患者陷入感染、治疗、再感染、治疗等的永久循环内。
机会性微生物感染的最重要病例是齿龈炎和牙周病,导致难愈合的伤口并发症的微生物炎症,影响泌尿生殖道膜的机会性酵母感染,人和动物中的脚癣,和通过建立生物膜复杂化的微生物感染。对于所有传染病,所有这些疾病包括强大的环境影响。出于此原因,关心干净的工作和生活环境目前被视作现代的、有效的传染病治疗的重要组成部分。
急性牙龈炎和慢性牙周病是口腔生态失调的2个阶段,导致免疫系统的炎性反应,引起牙周组织破坏和牙周膜弱化及其最终完全丧失[20]。在口腔的侵袭性环境中,口腔致病菌在生态失调情况下非生理性扩增,成为称作生物膜的多微生物群落一部分,这使其能耐受免疫系统防御反应以及局部或整体服用的抗生素[30],[9],[4],[5],[27]。现代研究已经以足够精度鉴定健康口腔微生物组,其表征为存在绿色微生物复合体,含有链球菌(streptococcus)、普氏菌属(prevotella)、韦荣氏球菌属(veilonella)、孪生球菌属(gemella)、颗粒链菌属(granulicatella)、艾肯菌属(eikenela)和噬胞菌属(cypnocytophaga),以及表征橙色和红色微生物复合体(其发生就高级生态失调而言是典型的)的从g+好氧细菌转变成g-厌氧类型中间普雷沃菌(prevotellaintermedia)、具核梭杆菌(fusobacteriumnucleatum)、牙龈卟啉单胞菌(porphyromonasgingivalis)、福赛斯坦纳菌(tannerellaforsythia)和齿垢密螺旋体(treponemadenticola)[1],[11],19]。致病菌在口腔中过度繁殖尤其引起牙龈出血,其通过pbi指数(乳头出血指数)的值鉴定,并引起牙齿情况和其预后总体恶化,其通过社区牙周治疗需要指数(cpitn)根据who鉴定[2],[25]。现有方法由使用局部或全身抗生素、局部消毒剂(氯己定等)或仅物理清洗和美白牙齿组成,并不带来期望的长期效果[5]。替代性方法由使用益生菌组成,效果不会过度,这主要是因为迄今使用的“保护性”微生物成分获自口腔以外人体环境中的正常微生物组[35]。
伤口的微生物炎症是在患有以及没有糖尿病的人中治疗静脉曲张性溃疡的重要复杂化因素[15]。此疾病的社会负担在于从不能工作角度而言的长期后果和针对患者的社会歧视,且主要在于其巨大的传播,仅eu(欧盟)国家每年就占多至98万例。同样值得一提的是治疗的巨大费用,估计eu国家为约65亿欧元[12]。静脉曲张性溃疡本身的慢性过程使得易感染性增加,这是因为皮肤屏障损伤、循环问题和抑制免疫系统防御性反应[37]。临床感染的症状包括特别是发红、疼痛、产生水肿、气味症状和排脓,其可能变成威胁生命的败血性病症[8]。ewma(欧洲伤口管理协会)的近期出版物高度批评了用局部抗生素或抗菌剂治疗微生物感染,并需要新的解决方法。然而,创新性方法的数量非常有限且清除难愈合伤口炎症的产品的85%全球市场仍然基于使用很久以前已知的银制品,无论我们现在关于正常皮肤微生物组的详细了解如何[18],[13]。
最近,我们对于致病酵母在皮肤和粘膜表面机会性感染病因的了解大幅增加,尽管这仅不幸地体现在设计新治疗方式的有限程度方面。作为致病酵母,酵母白色念珠菌(candidaalbicans)和其相关物种的实际命名不完全准确。这是在环境中大量存在的生物体,在该处其作为共生微生物于人皮肤和粘膜表面上生活,且大多对健康个体无害。然而,其擅长识别免疫学削弱,尽管短暂,并开始向免疫低下个体进行侵袭性作用。同时,其使用单独毒力因子,其分子性质在1990年代后得到更好理解,如负责强结合宿主上皮细胞表面的粘附蛋白,负责从单细胞到菌丝相形态变化的因子,和由分泌性天冬氨酸蛋白酶或磷脂酶例示的水解酶[6]。其它毒力因子具有释放性可溶性葡聚糖的性质,这遏制单核细胞的细胞因子信号转导且还抑制依赖于t淋巴细胞的特异免疫[29]。随后,念珠菌(单细胞酵母)可能对永久免疫抑制患者构成很大的威胁,因为其甚至能在循环系统中存活并导致致命感染[14]。然而,口腔和阴道念珠菌感染在免疫仅略削弱的个体中十分常见[21]。关于念珠菌感染自然机制的知识迄今仅使用极少。针对所有上述致病因子的抗体是在实验室测试阶段发现的,是分泌性天冬氨酸蛋白酶的化学抑制剂。然而,它们尚未实现更大的临床应用[10]。对酵母免疫应答的机制一直得到推进,但其生物学敌人迄今无一被鉴定[16]。
同样对于脚癣中的念珠菌(酵母)感染,免疫系统永久削弱能导致系统性感染。近期对数种皮肤癣菌基因组的测序开辟了鉴定其感染基因和开发分子诊断的方法[3]。然而,这些疾病的治疗仍主要依赖于使用化学抗真菌剂,其由于副作用和仅暂时抑制感染而名声不佳。
脚癣是在人和动物广泛传播的真菌感染。我们将其分类为人畜共患病,因为人中的感染通常源自动物。当然,从人到动物的反向传播也是可能的。此类传播的风险目前也在上升,因为真菌感染不仅影响农民,即直接接触养来用于吃的动物和马的饲养者[28],而且影响生活在城市的那些人,其中感染传播通过密切接触留在家里的宠物而发生,在家中宠物与其主人有密切的日常接触[24]。通常在完全健康个体情况中难以建立动物感染。然而,发生这类感染在免疫系统弱化的受胁迫的宠物和对皮肤疾病有遗传易感性的品种中相对常见。这种疾病也以继发感染形式出现,其显著阻碍原发病进程。皮肤寄生虫感染在大型物中常见。当检疫未在新动物到达后维持且当动物卫生情况未在各品种中未仔细观察时,爆发大量发生。在饲养家畜的情况中,这能导致重大经济损失。毛癣菌属(trichophyton)引起的人畜共患病必须向主管当局报告,这是强制性的。因此,用经典化学产品治疗这些感染是对动物和其主人的负担。在其产品如肉和奶到达食物链的动物中,这类治疗使得在所设保护时间限制内加工这些原材料不可能,从而消费者不被置于所用治疗剂剩余部分引起的风险中。
针对机会性微生物感染问题的方法仅在近期成为焦点并以复杂方式处理,这是基于广泛的大型研究和对其病因的良好了解,同时强调与所谓生物治疗相关的有效自然方法。增加生物方法流行性的一个根本益处以最近来自人类微生物组计划联盟的结果流形式出现,其根据现代分子遗传学方法,完成对皮肤、粘膜表面上以及呼吸、消化和泌尿生殖道中出现的个体微生物生理群落的详细分析[22]。根据这些国际认可且不断补充的分析,科学和医疗公众首次得知在人体不同部分构建微生物群落,该事实仅在当时部分阐明,这是基于来自健康个体的充足、统计上显著的数据集。这能从全新的角度看待其个体变化、随着时间的稳定性,且尤其是在明确病理状况下这些群落的变化。
人类微生物组计划联盟公布结果后,科学和医疗公众期望迅速使用该知识来促进新和有效的治疗过程,除了在治疗机会性微生物感染的范围内,其与微生物生态失调的关联得到大量证据支持。从上述期待的角度,可以评论,使用上面革新性知识的经实践测试治疗过程数目以及基于任何生物治疗方法的过程数目仍然远远落后于预期。从使用生物方法治疗机会性感染的角度,需要提及cz9883u(18.4.2000)[36],其描述用生物制剂形式的卵菌寡雄腐霉(pythiumoligandrum)来保护皮肤的产品,用于抑制脚癣起源物,其含有卵孢子形式的所提及的生物体作为活性成分,而卵孢子总数最高为2x105每1g制品。
随后,使用寡雄腐霉微生物作为与真菌和其它感染生物斗争的工具在cz302297(9.2.2011)[34]中显著拓宽,其由本发明申请者提交和拥有。该发明描述含真菌生物寡雄腐霉的抗真菌混合物,意在抑制人类和动物中的真菌、细菌或其它来源的疾病以及破坏人和兽医学所用外来材料上的生物膜并清除来自与人或动物接触的多种物品的微生物菌群。所设计的抗真菌混合物使用混合惰性成分的寡雄腐霉卵菌活性物质。寡雄腐霉“真菌”生物的活性在接触水分的时候于混合物中出现。考虑cz302297[34]所述方案,涉及医学应用寡雄腐霉卵菌以抑制一定范围的不同真菌来源疾病的症状。根据此专利,其拥有者以及本发明申请的申请者同时决定开发、测试和销售一系列化妆品。这些产品在药店销售且来自捷克共和国的兽医,同时根据eu要求在相关欧洲化妆品门户网站上通知。涉及医学应用时,必须强调低毒性,该事实目前一方面由一些用户体验支持,另一方面由国家主管机关要求实验室检测评估化妆品安全性来支持。长期使用该本质上单成分制品与活性物质寡雄腐霉,被证明非常成功。然而,已显示其在长期上不适合某些患者。已显示这些人是免疫削弱或另外受破坏的患者。
使用生物制品作为抵御机会性感染的保护,也是一些国外专利和专利申请的主题。us5,190,746(2.3.1993)[7]提出使用分子质量959的己糖,分离自口腔微生物口腔链球菌(streptococcusoralis),用于阻断该链球菌与牙菌斑的成分黄褐二氧化碳嗜纤维菌(capnocytophagaochracea)的相互作用。尽管寡糖的效果仅在实验室测试中确定,本发明假定其能有效预防、抑制或破坏牙菌斑的微生物沉积,例如当用于牙膏或漱口水时。ca2374938a1(30.11.2001)[31]描述在哺乳动物中抑制伤口感染的方法,该方法由直接向伤口施用益生菌生物组成,其中数株乳酸杆菌被推荐为益生菌生物,例如鼠李糖乳杆菌(lactobacillusrhamnosus)、嗜酸乳杆菌(lactobacillusacidophilus)、发酵乳杆菌(lactobacillusfermentum)等。同一方法被建议用于抑制生物膜形成,但是在多种手术仪器上,而不是难愈合伤口。wo2008/077251a(3.7.2008)[32]涉及使用乳酸杆菌来消除耐甲氧西林病原体金黄色葡萄球菌(staphylococcusaureus),这是基于实验室测试。wo2013/122931a2(22.8.2013)[26]描述使用益生元支持健康共生生物在皮肤中发展,即表皮链球菌(streptococcusepidermidis)、杰氏棒杆菌(corynebacteriumjeikeium)和疮疱丙酸杆菌(propionibacteriumacnes),旨在改善皮肤的生理状况和外观。这些微生物的定殖用体内测试证实。然而,研究中没有证据显示微生物的正面效应以此方式用于皮肤或用于治疗。
成功的结果记录于科学和医学文献,采用乳酸杆菌来增加女性对复发性外阴阴道酵母感染的抗性。特别值得一提的是用lactinv制剂在临床测试中实现的结果,该制剂由欧赛(osel)公司制备,测试由华盛顿大学资助。这些研究iia和iib期结果可获自科学出版物[参见参考文献33],显示泌尿生殖道复发性感染在用lactinv治疗的15%女性中出现,而在未治疗女性中发病率更高,约27%。补充的乳酸杆菌定殖用基因检测证实,并能确定以此方式鉴定的定殖与复发性阴道感染和泌尿生殖道感染发病率降低之间的统计上显著关联。
然而,上面所示的本发明具有某些根本不足。所有呈现的原理仅在实验室测试中证明,或最多在动物实验模型中证明。此缺陷是根本的,因为该领域专家已知动物模型所得结果不总是需要在人治疗的情况中应用,且甚至在兽医治疗时不需要普遍应用(即就一个动物物种得到的调查结果不可能总有效用于另一动物物种)。此外,与治疗领域无生理相关性的微生物用作益生菌生物,最常是乳酸杆菌,其构成阴道微生物的主要微生物成分,但实际上在其它微生物组中不生理性存在。仅在us5,190,734a[7]和wo2013/122931a2[26]所述解决方案的情况中,天然、生理性微生物的成分分别用于口腔或皮肤。然而,这些情况中,这些成分涉及益生元,而不是益生菌。益生元是能够但不必需刺激相关益生菌生物生长和繁殖的化合物。同样是这些情况中,这些制品的有效性仅在实验室测试中证实,而不是临床研究的实际情况下证实,引起异议。
技术实现要素:
根据本发明,上面列举的缺点在二元微生物制品中消除或显著受限,长期抑制症状或预防机会性微生物感染,尤其是由生态失调导致的所述感染。本发明的本质在于:双成分微生物制品包含2种基本微生物成分,即微观卵菌寡雄腐霉和微生物组成分,其中生理性微生物组成分是人或动物来源的微生物组成分,或在环境中存在的微生物群落。所述微观卵菌以繁殖体以及多种具有大分子和低分子性质的释放物质形式(作为不可分离的成分)存在。
第二成分是临床研究中确认的生理性微生物组中发现的细菌,提供到二元微生物制品内,直至在人或动物机体中建立所需微生物平衡。生理性微生物组成分具有人或动物来源,或来自环境。人来源的生理性微生物组成分用于消除或防止人中生态失调导致的症状,其中有必要考虑该生态失调的拓扑定位。例如,使用口腔微生物组成分仅考虑用于口腔。动物来源的生理性微生物组成分用于消除或防止动物中生态失调导致的症状,其中有必要考虑该生态失调的拓扑定位。例如,使用皮肤微生物组成分仅考虑用于皮肤或动物皮毛的皮肤癣菌感染。来自环境的微生物组用于建立微生物平衡,其有利于消除和防止来自生活及工作环境的真菌和酵母。
本发明的主要益处是二元微生物制品带来健康微生物组在施用区域的连续和长期稳定状态。此方案的主要优势是微生物二元制品的基本成分用强化和相互作用(协同)机制与宿主免疫系统相互作用,以消除某些病理状况的物质和环境。在通过寡雄腐霉独特活性来促进致病病因消除后,此卵菌在施用区域保持静止状态,而第二微生物成分加强正常健康微生物组的弱化的生理学成分,且通过其代谢过程,在施用区域稳定和建立所需健康微环境。
一个极其重要的优势是本发明所述二元微生物制品的长期正面效应,这使其与通常仅有短期效果的替代化学制品区分。该短期效果仅能通过重复使用化学制品来补偿,然而在此期间,靶致病生物开始显示对这些化学化合物的抗性。克服此抗性的唯一方式是逐步使用剂量越来越高的化学制品,这显然增加这些化学物的任何副作用和毒性作用。使用生物制品具有毫无疑问的优势,使用完全不同的机制,与消除致病感染和长期稳定效果更协调作用。
在根据就本发明所提出的二元微生物制品的特定情况中,结果显示所用2种微生物各自表现出其在施用区域的自身群体曲线,由其生物学性质引起。一种成分寡雄腐霉显示在初始阶段迅速增加,这取决于存在潜在的真菌或酵母营养物,且最终在清洁施用区域和抑制病原体后以孢子化形式于施用用区域内存活。正常健康微生物组的第二、稳定化成分在施用区域存活时间更长,并使已存在正常微生物菌群的协助其稳定的正面效应加强。
本发明所述二元微生物制品有助于在人和动物中抑制和消除机会性真菌、酵母和细菌感染以及在受酵母感染影响的口腔和难愈合伤口表面及粘膜表面建立健康微生物组,其破坏是因为压力、不健康生活方式、强体力活动或在个人卫生中过度使用化学制品。
所提交的发明主要适合根据稳定健康的生理性微生物组来抑制一些病理性症状,所述微生物组的自然平衡在压力、体力负荷过度、生物体削弱、遗传病或其它疾病的情况下受到破坏。所提交的发明是基于微观卵菌寡雄腐霉的协同作用,其主要作用是清洁施用微环境,去除真菌或酵母负担、破坏施用区域的微生物生物膜和抑制致病菌及健康生理性微生物组主要微生物成分的生长。
当微观卵菌寡雄腐霉和生理性微生物组成分以促进其萌发、后续增殖和定殖靶组织的形式存在时是有益的,在该处其根据局部条件应用其正常代谢活性,包括将生物活性大分子或低分子物质释放入其周围的能力。同时,生理调节机制以及皮肤和粘膜的有限表面容量可共同有效防止提供过量生理性微生物组成分的可能性,因为在这类情况中,表面结构容量迅速饱和且过剩成分被自动移出。
本发明所述二元微生物制品优选包含有效鉴定范围的2种基本成分,即微观卵菌寡雄腐霉,量为103-107优选104-105菌落形成单位(cfu)每一克制品,与相关微生物组主要成分组合,量为5x106-5x1010优选5x107-5x109菌落形成单位(cfu)每一克制品。已确定所要求保护的范围的成分更低的值不够有效,而更高的值可能对人类有机体造成不必要的负担。同时,所用2种微生物成分之比适当利用所用2种微生物生物合成能力的相互比例,这本质上由所用2种细胞类型体积之比定义。因此,其特征为约2350的转换因子,这考虑到寡雄腐霉卵菌的平均尺寸为18x18x18μm且细菌为1x1x2μm。
寡雄腐霉卵菌生长期间发酵的基质能用作本发明所述二元微生物制品中2种微生物成分的营养源。营养物和益生元能潜在支持2种微生物成分的代谢。
本发明所述二元微生物制品的最优施用由辅助成分支持,其包含至少一种来自下述各组的辅助成分,包括:干燥剂如二氧化硅;缓冲系统成分如柠檬酸、碳酸氢钠和碳酸钠,在施用期间带来正确的ph;防结块物质如山梨醇或聚乙二醇;和生成生理性渗透环境的物质如氯化钠。
在与不同人体部分接近的条件下相互作用的特异性测试确定,相关微生物组的靶微生物成分总是相关微生物组的主要微生物成分,其在各表面位置条件下相关。
对于长期抑制牙周疾病症状和长期维持健康口腔,当健康人微生物组成分是健康口腔微生物组成分时,其是优势,即绿色复合体的微生物之一如生痰二氧化碳嗜纤维菌(capnocytophagasputigena),其中其定量对应于该成分在生理性微生物组中的含量。
类似地,为确保长期抑制非糖尿病患者难愈合伤口的临床感染症状和难愈合伤口的生物膜破坏,包括嗜麦芽黄杆菌(stenotrophomonasmaltophila)及绿脓假单胞菌(pseudomonasaeruginosa)微生物引起的生物膜,以及为长期维持健康皮肤,当人微生物组成分即健康皮肤微生物组成分之一如表皮葡萄球菌(staphyloccocusepidermidis)以生理量使用时,其是有益的。
为确保长期抑制泌尿生殖道和皮肤及阴道膜的酵母感染,当人微生物组成分即健康阴道微生物组成分之一如生成过氧化物的卷曲乳杆菌(lactobacilluscrispatus)是生理性微生物组成分时,其是有益的。
出于化妆目的或用于免疫削弱患者,当寡雄腐霉微观卵菌或者人或动物来源的生理性微生物组成分在二元微生物制品中以非生命成分如死细胞、细胞提取物或分离细胞部分的形式存在时,其是有益的。
已鉴定,为去除动物皮肤霉菌症药剂和确保长期维持健康皮肤,当酵母自溶物(量为二元微生物制品总量的0.1%-10%重量)用作寡雄腐霉微观卵菌的微生物激活物时,其是有益的。
为确保本发明所述二元微生物制品施用更简单,当辅助物质采用油膏、油、乳膏或栓剂形式或者采用液体水性制品形式时,其是合适的。
涉及微观卵菌寡雄腐霉的温度生长限制时,施用本发明所述二元微生物制品时的温度应总是低于生理温度,如约35℃的温度。此限制几乎排除了使用本发明所述二元微生物制品以用于内部使用。出于此原因,其施用限于口腔和泌尿生殖道的皮肤和粘膜,其能用所提出制品的水溶液冲洗,所用温度略低于人体温度。
施用时,二元微生物制品通过接触水分而活化。混合物中二元微生物制品的活性在该制品接触水分或湿润惰性成分时产生,施用湿润、活化制品主要通过冲洗受影响区域或其它湿式施用方法完成,或成分能以油膏、乳膏、油或栓剂形式、这些化妆品所含干燥冻干混合物形式或液体水性制品形式提供。
为了抑制或破坏耐受单独经分离成分作用的生物膜,在破坏由微生物如嗜麦芽黄杆菌或绿脓假单胞菌引起的生物膜时以及为了去除来自环境的真菌、酵母和致病菌,当微生物成分是细菌之一尤其是杆菌时,其是有益的,所述成分能抑制环境中的真菌发育,量为105-1012菌落形成单位(cfu)每一克。优选来自环境的微生物成分是解淀粉芽孢杆菌(bacillusamyloliquefaciens)。
附图简要说明
本发明在实施例中进一步详细描述,并结合所附示意图更详细解释,其中:
图1a、图1b和图1c显示就个体患者(编号)而言二元微生物制品对口腔的有效性测试:对于左手边的“响应患者”,在对应本发明所述双成分微生物制品施用的条件下;对于右手边的“无响应”患者,在对应基于发明cz302297b6所述寡雄腐霉的单成分制品施用的条件下,和
图1a更详细描述施用前、施用后2个月和施用后6个月,牙龈pbi(乳头出血指数)的依赖性;
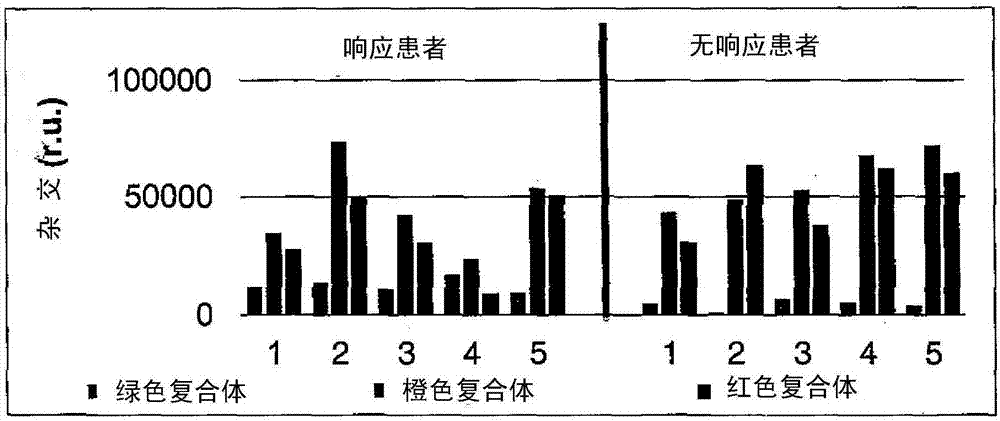
图1b显示对杂交强度的依赖性,采用相对单位(r.u.),对应于涉及指定微生物复合体的微生物的每分钟分解(dpm)数;
图1c显示对生痰二氧化碳嗜纤维菌和侵蚀艾肯菌(eikenellacorrodens)绿色复合体的细菌含量的依赖性,表示为杂交信号百分比;
图2显示用于治疗口腔中齿龈炎(牙龈炎)和牙周病症状的二元微生物制品成分时间稳定性,显示菌落形成单位(cfu)数分别对寡雄腐霉和生痰二氧化碳嗜纤维菌保存月份的依赖性;
图3显示二元制品对难愈合伤口的有效性测试,显示的是原始条件的百分比:对于左手边的“响应患者”,在对应本发明所述双成分微生物制品施用的条件下;对于右手边的“无响应”患者,在对应基于发明cz302297b6所述寡雄腐霉的单成分制品施用的条件下;
图4显示用于难愈合伤口的二元微生物制品成分的时间稳定性,即菌落数分别对寡雄腐霉和表皮葡萄球菌保存月份的依赖性;
图5a、图5b、图5c显示二元制品就个体患者而言对易受酵母影响的粘膜的有效性测试:对于左手边的“响应患者”,在对应本发明所述双成分微生物制品施用的条件下;对于右手边的“无响应”患者,在对应基于发明cz302297b6所述寡雄腐霉的单成分制品施用的条件下;其中
图5a显示临床评估,按照1-6的尺度,在施用前和施用后3个月,其中“1”指示消除6个所监控的症状之一而6指示消除全部6个所监控的症状,所述症状描述为不适、刺激、灼伤(burning)、流出物、疼痛和变红;和
图5b显示采用任意单位的酵母数,其中“1”指示仅在培养后发生,“2”指示零星发生,“3”指示频繁发生,“4”指示大规模发生,所有都是在施用开始前和施用后3个月;
图5c显示在施用开始前和施用后3个月的乳酸杆菌数,采用上面列举的任意单位;
图6显示用于皮肤和膜的二元微生物制品的时间稳定性,所述皮肤和膜易受致病酵母细胞增殖影响,显示菌落数分别对寡雄腐霉和卷曲乳杆菌保存月份的依赖性;
图7显示用于足部真菌病的二元微生物制品的体外效力测试;显示菌落形成单位(cfu)数的依赖性,采用相对于安慰剂的%形式,其中k是对应于安慰剂的对照,po是寡雄腐霉,ka是酵母自溶产物,po+ka是寡雄腐霉和酵母自溶产物;所测皮肤癣菌株是集合菌株指间毛癣菌(trichophytoninterdigitale)dmf2477(tidmf2477)、指间毛癣菌dmf3857(tidmf3857)、意瑞奈斯氏毛癣菌(trichophytonerinacei)p837(tep837)、意瑞奈斯氏毛癣菌p852(tep852)、絮状小孢子菌(microsporumfloccosum)me1236(mfme1236)、絮状小孢子菌p245(mfp245)和犬小孢子菌(microsporumcanis)dmf2374(mcdmf2374);
图8a、图8b显示空气中真菌孢子数的影响测试和2个不同房间内刮下的真菌污染测试的结果,后者中一些真菌发生在墙上,主要发生的是黑曲霉(aspergillusniger)和枝孢属(cladosporiumspp.)真菌,其中ck是对应于无任何处理的对照的值,p.o是对应于使用单成分制品的值,所述制品基于发明cz302297b6所述的寡雄腐霉,b.a.是对应于单独施用解淀粉芽孢杆菌的值且p.o.+b.a.是对应于施用本发明所述双成分微生物制品的值,其中
图8a显示在收集皮氏培养皿上的辐射尘(fall-out)后用omeljan法鉴定的受污染房间内每1m3空气的真菌孢子数,根据who标准,该值应低于500的限值;
图8b显示来自刮料的微生物样品和培养的结果,以医学评估1-4的尺度采用任意单位表示,其中“1”指示仅培养后发生,“2”指示零星发生,“3”指示频繁发生,“4”指示大规模发生。
优选的实施方案
我们提出的解决方案是基于化妆品实验室和实际检测结果的详细分析而可行,所述化妆品是基于上面列举的专利cz302297b6[34],其详细配制就产品而言优化,例如涉及帮助消除口腔chytrá
实施例1
(图1a、图1b、图1c、图2)
在多中心研究中检测泡腾片形式的制品chytrá
通过结果的统计学评价确定,化学消毒剂氯己定的效果仅是短期的,因为仅在监控后2个月而不是4个月后研究结束时,出现统计上显著pbi降低,p≤0.05。相反,采用生物制品的组的长期结果极好。在短期评估中实现统计上显著pbi降低(p≤0.05),在长期评估中实现统计上高度显著pbi降低(p≤0.01)。此外,观察到6个月后牙齿情况稳定,就其而言监测研究参与者。然而,与上述2组相反,科希策牙科诊所的最大参与者组中的结果不一,在统计学评价后未达到预期的疗效。为阐明此情况,使用详细临床记录,在该组参与者中监测口腔微生物的完整微生物分布,在施用制品前使用基因检测。临床和实验室结果的互相关使得可以如下描述:此不均一组由3个亚组组成,表示为低风险、中等风险和高风险组。高风险组的显著特征是低含量的生理性口腔细菌,称为绿色保护性复合菌,纳入所分析菌株侵蚀艾肯菌和生痰二氧化碳嗜纤维菌。
结果示于图1a、1b和1c。图1a显示pbi(乳头出血指数)值,一方面,图上示为“无响应患者”的患者所处条件对应于施用带寡雄腐霉的制品,另一方面,图上示为“响应患者”的患者所处条件对应于施用二元微生物制品,所有这些在施用前、施用后2个月和施用后6个月。
在施用前的研究开始时(黑柱),组之间没有显著统计学差异。“无响应患者”的pbi值为38.8±5.8,“响应患者”的pbi值为44.6±4.7。两组之间不相似性的概率值是p=0.121;意味着两组患者因而没有统计学显著差异。在6个月后的研究结束时,“无响应患者”显示pbi值在统计上高于“响应患者”,前者所处条件对应于施用寡雄腐霉,后者所处条件对应于施用本发明所述二元微生物制品。就所处条件对应于单独施用寡雄腐霉的患者而言,6个月后计算的出血指数是39.4±10.8,而所处条件对应于施用本发明所述二元微生物制品的值是10.6±2.4。两组不相似性的概率值是p=0.0003。涉及cpitn(社区牙周治疗需要指数)的结果类似;然而,这是不太直接的指示物,对口腔状况的反应更慢,并因而反映长期趋势。
图1b显示遗传探针杂交强度的依赖性,所述探针检测与绿色、橙色或红色复合体有关的口腔微生物个体组。图1b显示存在绿色口腔复合体(浅灰色柱)、橙色口腔复合体(深灰色柱)和红色口腔复合体(黑色柱)的所选定的微生物的遗传分析结果,以对应于每分钟放射性标记dna探针的崩解数的单位说明。对照组的参与者所处条件对应于施用chytrá
这些结果确认,用于口腔的本发明所述二元微生物制品相较于标准制品,显示统计上显著更佳结果。基于这些结果,我们考虑和寻求解决方案用于寡雄腐霉卵菌对消除牙周炎和齿龈炎症状的有效和长期效果,并检测和开发实验以证明微生物寡雄腐霉与健康口腔微生物组微生物成分的协作,尤其是生痰二氧化碳嗜纤维菌。
共制备3种形式的二元微生物制品用于口腔,这类制品的稳定性得到证实,也在牙周病患者中完成临床测试。所得结果的详细描述在下文的本发明示范性实施方案中更详细呈现。总之,此测试结果证明,施用以泡腾片形式用于口服灌洗的本发明所述二元微生物制品时(该形式为大部分单成分制品使用者的优选形式),对以干燥状态存储的任何成分稳定性没有负面影响。在施用冲洗口腔形式的二元制品这一就使用者而言单一过程后,正常口腔微生物组成分出现有效定殖和加强,这使得在根据标准指数评估情况下消除患者症状的成功率显著增加。
1.制备、控制和测试二元微生物制品的效力,所述制品适合消除口腔齿龈炎和牙周炎症状。
1.1制备用于口腔的二元微生物制品的实验方案(protocol)。
1.1.1制备寡雄腐霉m1atcc38472技术制品。
用于培养微观卵菌寡雄腐霉菌株m1atcc38472的接种体用“主细胞库”-“工作细胞库”共同系统(corporatesystom)制备。专有菌株寡雄腐霉m1atcc38472通过长期冷冻干燥保存于主细胞库。有限量的等分样品根据实验方案从主细胞库中生成,用于工作细胞库,从而繁殖的代数总共不超过50。这确保专有菌株的遗传稳定性。接种体的培养在往复式振荡机中进行,摆动10.5cm和每分钟96摆,在28℃的温度持续48小时。
同时,制备小米(millet)基质用于固体培养寡雄腐霉m1:500g脱壳黍(panicummiliaceum)小米在液氮中于–150℃长期冷冻。随后在200ml蒸馏水中溶解:50mgznso4,150mgkh2po4,50mgmgso4和250mgcacl2。溶液随之加热到沸点并倒在经洗涤的小米上。沸腾后,盖上装有小米的容器并静置30分钟。然后,在滤纸上铺开小米薄层并保持凉爽和干燥。
此中制备的30克小米随后加入500ml锥形瓶,灭菌在蒸汽高压灭菌锅中进行,在120℃的温度持续40分钟。24小时后重复灭菌且小米在每轮灭菌后轻微摇动。
我们用4ml接种体接种经灭菌小米,采用上示过程。接种后,小米与接种体充分摇晃,最终通过轻拍平坦形成均匀层。
小米基质上的固体培养在温度调节器中进行,温度为28℃且相对湿度为70%,持续14天。带有寡雄腐霉培养物生长的发酵的基质随之在干燥机中30℃干燥,持续48小时,直至达到5%的终湿度。
以此种方式获得的发酵的基质用球磨机研磨成尺寸小于0.6mm的颗粒。
然后,每1g制品的卵孢子数和活力在根据上示过程所述方法制备的具有技术品质的制品中测定。约1g所制备的寡雄腐霉技术制品以分析级精确称重并在混合器的蒸馏水中混合1分钟,从而维持每升精确2g的浓度。随后,约1ml悬液转入sedgewick-rafter计数室且在显微镜下计数个体特征性卵孢子和集群中的卵孢子,从而总共计数最少100个卵孢子。完整测量重复3次,其中卵孢子悬液在各样品放入室前仔细混合。最后,每1g制品的卵孢子数用下式计算
n=(a.c)/(b.d.e),其中
a是鉴定的卵孢子数;
b是室内一个正方形的体积(1x1x0.1mm=1x10-4ml);
c是用于制备样品的蒸馏水体积,以ml计(500ml);
d是样品重量,以g计(1g),和;
e是室内的正方形数,所鉴定的卵孢子数实际上在所述室内计数。
寡雄腐霉技术制品的萌发(活力)如下测定:以分析级精确称重约10mg技术制品,用涡旋混合器在水中混合,浓度为1mg/ml。后续制备3个10倍稀释,采用以此方式制备的悬液,然后在mea(麦芽提取物琼脂(meltextractagar))培养基上接种100ml的各稀释物。
在干燥机中28℃培养8小时和16小时后,对萌发进行读取,在培养7天后,读取总菌落数。
所得卵孢子数范围是每克本发明所述制品0.8-1.4x106,这取决于所用批次。萌发(活力)通常范围是2-10%。用于实施示例1的批次具有1.0x106个卵孢子/g和13.1%的萌发,意味着其包含0.131x106菌落形成单位(cfu)每1g。
1.1.2制备生痰二氧化碳嗜纤维菌ccm3712技术制品。
初始生痰二氧化碳嗜纤维菌ccm3712培养物在从微生物保藏中心递送后保存于-70℃的温度。为了培养,少量培养物首先转入带“巧克力琼脂”的器皿,其包含胰蛋白胨大豆琼脂,带有0.1%酵母提取物和5%脱纤维马血。所述器皿在5%co2,37℃培养过夜。第二天,菌落转入含胰蛋白胨大豆基质的液体培养基,其包括0.1%酵母提取物、0.002%马hemineiii、0.0001%甲萘醌和0.1%碳酸氢钠。培养物在定轨摇床中于5%co2大气下振荡,每分钟200转。一旦培养物达到109个细胞每ml的对数期中间部分,10000xgav离心20分钟沉淀细菌且随后在0.1m柠檬酸三钠缓冲溶液,ph6.0中洗涤3次。最终洗涤后,细菌沉淀物与剩余缓冲溶液仔细分离并用冷冻干燥(冻干)来干燥。
用此程序从1升培养物中获得1克冻干细菌,每一毫克粉末含有109cfu。
1.1.3制备用于口腔的二元制品的最终配制物(formula)。
3种不同形式的制品用于最终配制物,彼此在其生痰二氧化碳嗜纤维菌ccm3712相对含量方面不同。这3种形式用缩写名称plaquea、plaqueb和plaquec标记。就一次施用而言,制备制品用于压成总重3g的泡腾片,为此,单个配制物转化成该重量。单个制品的成分如表1所示。
寡雄腐霉成分包含于微生物制品plaquea、plaqueb和plaquec,量为0.6663x104cfu每1g。
生痰二氧化碳嗜纤维菌ccm3712成分包含于二元微生物制品plaquea,量为0.333x108cfu每1克;包含于plaqueb制品,量为0.333x109cfu每1克;包含于plaquec制品,量为3.333x1010cfu每1克。
表1
1.2用于口腔的二元微生物制品的稳定性测试。
用于口腔的二元微生物制品的稳定性测试必须确定,2种微生物成分是否在所制备的制品存储期间,至少在进行体外和体内效力测试的时间段,对彼此产生负作用。有plaquea、plaqueb或plaquec制品的一片片剂溶于100ml温水,温度约35℃。完全溶解后,用1ml测定腐霉萌发和0.1ml测定嗜二氧化碳噬细胞菌cfu。
为测定嗜二氧化碳噬细胞菌的cfu,我们稀释了样品,使用10倍连续稀释的一系列样品。为测定cfu,就plaquea使用第三稀释例如103x稀释,就plaqueb使用第四稀释例如104x稀释,且就plaquec使用第五稀释例如105x稀释。
稳定性测试在完成制品后立即进行并在1、2、3、4、5和6个月后再次进行。典型稳定性测试的结果如图2所示,其描述菌落数对存储月份的依赖性。可从结果推断,在6个月储存和后续的制品使用期间,腐霉的存在首先有所下降且随后在对应约75%最初申报标称值的值稳定。相反,对于嗜二氧化碳噬细胞菌,活力在测试阶段中没有显著变化,活力保持最初申报的值。图2所示结果涉及称为plaqueb的制品。用plaquea和plaquec制品所得结果基本相同,因而不示于图中(为确保图更清晰)。
因此可以表示为,将初始活性成分压成泡腾片或其在使用本发明所述二元微生物制品前激活,不会以任何显著方式降低用于口腔的任何二元制品成分的活力。
1.3用体外测试的所制备混合物的效力测试。
体外效力测试旨在证明寡雄腐霉m1atcc38472卵菌和绿色口腔复合体细菌生痰二氧化碳嗜纤维菌ccm3712的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。从这个角度看,选择标准实验室测试,抑制3种不同菌丝形成型菌株的白色念珠菌致病酵母生长,所述菌株获自捷克共和国帕尔杜比采医院的临床分离物,并移送捷克科学院微生物学研究所(
关于用大量本发明所述二元微生物制品进行的临床测试的苛刻性质,作为最有效制品的plaqueb被选为临床前和临床测试的制品。
表2
实施例2
(图3、图4)
化妆品biomycosin具有活性物质寡雄腐霉,应帕尔杜比采区域医院要求对2组糖尿病和非糖尿病患者进行测试,所述患者具有微生物发炎的难愈合伤口。研究参与者没有随机化,但监测其糖尿病状态,这使得可以在研究结束时将数据分成糖尿病和非糖尿病组。就涉及非糖尿病患者而言,其平均年龄是63.7±13.1岁,其中患者在37–79岁范围内。所监测的患者的总数是19,14名女性和5名男性,因为发炎性静脉曲张性溃疡在女性中的发病率高于男性。biomycosin的施用在医务人员监督下于医院中进行。门诊病人在施用制品阶段住院。一包biomycosin用于3个(每8小时)湿式施用,其中所述施用在总共连续4天中完成。在最终施用后3天,取样用于微生物检测且门诊病人出院。然后,在门诊病人和住院患者中实施常规每月控制,在施用后持续6个月。结果明确显示微生物负担显著下降,尤其是g-杆菌、厌氧微生物和致病酵母。g9+球菌的微生物负担降低与非糖尿病患者临床感染情况改善之间的负相关性在就这些患者所得结果的相关性分析中得到清楚证明。此负相关性就“其它葡萄球菌”类别而言尤其突出,其中表皮葡萄球菌特别对皮肤具有根本重要性。其它葡萄球菌的负相关性(y)特征为等式y=-0.56x+85.8,相关系数r2=0.87。
关于此疾病治疗进程对年龄和性别的依赖性,由于女性更易受影响,患者首先必须分成2组并根据年龄和性别随机化。对照组的患者平均年龄是77.6±9.8岁,所述组对应于用仅含寡雄腐霉的制品治疗的情况。实验组的此参数是78.0±10.3岁,所述组对应于用二元制品治疗。因此,2组患者的年龄之间没有统计学显著差异。2组都纳入3名女性和2名男性,因而2组的女性百分比相同,为67%。2种施用方法后的所得结果示于图3。去除的葡萄球菌量与感染临床症状改善减少之间的互反关系从所得结果中完全清楚。制品治疗期间高含量的所维持的葡萄球菌就图3左手侧所示临床响应患者而言绝对清楚,所述制品具有一定含量的寡雄腐霉卵菌,并且感染临床征兆的明显改善同样清楚,最多为20%-50%的初始病症。相反,临床无响应患者组显示通过培养鉴定的葡萄球菌数出现非常独特的减少(包括表皮葡萄球菌株),所述患者的结果示于图3右手侧;然而,去除感染临床症状的进展在这些患者中极慢。
基于这些结果,我们考虑和确认以下假设:不需要抑制某些g+球菌,因为其影响生理性微生物群落代表。如下检测此工作假设:制备总共3种形式的本发明所述二元微生物制品,用于长期消除难愈合伤口的临床感染症状。这类制品的稳定性得到证明且其效力用相关实验室测试监测。所得结果的详细描述在此实施例的下文中更详细呈现。总之,此测试结果证明当保存干燥制品形式时,对任何二元制品成分没有负面影响。相较迄今使用的基于寡雄腐霉的单成分制品,使用微生物二元制品时,出现微生物酵母负荷的统计学显著下降和临床感染发展的改善。
2.制备、控制和测试二元微生物制品的效力,所述制品适合消除非糖尿病患者难愈合伤口的临床感染症状。
2.1制备用于非糖尿病患者难愈合伤口的二元微生物制品的实验方案。
2.1.1制备寡雄腐霉m1atcc38472技术制品。
用于此制品的过程与章节1.1.1所述过程相同。
用于示范性实施方案2的批次具有1.1x106个卵孢子每g和14.3%的萌发,意味着其包含0.157x106菌落形成单位(cfu)每1g。
2.1.2制备表皮葡萄球菌ccm2124技术制品。
初始表皮葡萄球菌ccm2124培养物在从微生物保藏中心递送后保存于-70℃的温度。为了培养,少量培养物首先转入具有胰蛋白胨大豆琼脂cm131oxoid的器皿。所述器皿在37℃培养过夜。良好分离的菌落转入含500ml培养基的2升锥形瓶,所述培养基包含每升30g蛋白胨、每升10g酵母自溶产物、5g/lnacl、0.1gcacl2.2h2o和1ml三丁酸甘油酯(trybutyrin);培养基的ph调至8.0。细菌培养到对数期中间部分,并10000xgav离心20分钟沉淀,且随后在0.1m柠檬酸三钠缓冲溶液,ph6.0中洗涤3次。最终洗涤后,细菌沉淀物与剩余缓冲溶液仔细分离并用冷冻干燥(冻干)来干燥。
从1升培养物获得约0.6g冻干细菌,每一毫克粉末含有108cfu。
2.1.3制备二元制品的最终配制物,用于非糖尿病患者难愈合伤口。
3种不同形式的制品用于制备最终配制物,区别在于其表皮葡萄球菌ccm2124相对含量;这3种形式用缩写暂定名称nonheala、nonhealb和nonhealc命名。就一次施用而言,制备制品用于含10g松散制剂的单包装。个体制品的成分示于下一页的下表3。
寡雄腐霉成分包含于二元微生物制品nonheala和nonhealb,量为7.85x103cfu每1g;包含于nonhealc制品,量为7.85x103cfu每1g。
表皮葡萄球菌ccm2124成分包含于二元微生物制品nonheala,量为1x106cfu每1g;包含于nonhealb制品,量为1x107cfu每1g;包含于nonhealc制品,量为1x108cfu每1g。
2.2用于非糖尿病患者难愈合伤口的二元微生物制品的稳定性测试。
用于非糖尿病患者难愈合伤口的二元微生物制品的稳定性测试必须确定,2种微生物成分是否在所制备制品存储期间,至少在进行体外和体内效力测试的时间段中,对彼此产生负作用。单包装的10gnonheala、nonhealb或nonhealc制品重悬于250ml微温生理溶液9g/lnacl,温度约35℃。完全重悬后,用1ml测定腐霉萌发和0.1ml测定葡萄球菌cfu。为测定葡萄球菌的cfu,通过10倍连续稀释来稀释样品,为测定cfu,就nonheala使用1x稀释例如10x稀释,就nonhealb使用2x稀释例如102x稀释,且就nonhealc使用3x稀释例如103x稀释。稳定性测试在完成制品后立即进行并在1、2、3、4、5和6个月后再次进行。典型稳定性测试的结果如图4所示。可从结果推断,在6个月存储和后续制品使用期间,腐霉的活力首先有所下降且随后在对应约75%最初申报标称值的值稳定。相反,对于葡萄球菌,活力在测试阶段中没有显著变化,活力几乎保持最初申报的值。图4所示结果涉及称为nonhealb的制品。用nonheala和nonhealc制品所得结果非常相似,因而不示于图中(为确保图更清晰)。
表3
因此,可以表述为,用于难愈合伤口的任何二元微生物制品成分的活力不会由于在使用本发明所述制品前,干燥活性成分并在硅胶存在下保存其而不激活而减少。
2.3使用体外测试的所制备的二元微生物制品混合物的效力测试。
体外效力测试旨在证明寡雄腐霉m1atcc38472卵菌和正常皮肤微生物组细菌表皮葡萄球菌ccm2124的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。从这个角度看,选择标准实验室测试,抑制3种不同菌丝形成型菌株的白色念珠菌致病酵母生长,所述菌株获自捷克共和国帕尔杜比采医院的临床分离物,并移送捷克科学院微生物学研究所用于进一步实验。所述测试的实际进行由使用标准施用方案组成,其总是开始于重悬干燥制品,所述制品仅含有腐霉(biomycosin制品)或称为nonheala、b或c的上述测试制品之一。制品重悬于250ml微温生理溶液,温度约35℃。12.5ml的此悬液随后直接混合12.5ml两倍浓缩混合物以制备cda(察氏琼脂)琼脂板。然后,获自临床分离物的105白色念珠菌致病酵母均匀涂于冷却后以此方法准备的平板。28℃培养一周后,读取菌落数,与对照器皿比较,其中与对照相反的菌落数下降是腐霉效力的量度。此测试结果示于下表4。结果显示单独腐霉对抑制实验器皿中的酵母生长有显著作用,其与葡萄球菌的组合产生进一步增强的效果。体外条件下3种致病酵母株的最有效制品是制品nonhealb,称为nonheala和nonhealc的制品达到此效力的约50%。
关于用大量本发明所述二元微生物制品进行的临床测试的苛刻的性质,作为最有效制品的nonhealb被建议为临床前和临床测试的起始制品。
表4
所示实施例不限于使用此示范性实施方案列举的二元微生物制品用于皮肤上的难愈合伤口。自然存在这里未指定的其它可能用途;例如用于伴随皮肤生态失调的机会性微生物感染的不同病例,如特应性湿疹和牛皮癣。
实施例3
(图5a、图5b、图5c、图6)
从口腔健康、难愈合伤口和抑制阴道念珠菌病中酵母的护理领域的临床观察中获得令人信服的证据,寡雄腐霉抑制并杀死念珠菌和马拉色氏霉菌株的致病酵母。此结论随后由布拉格的捷克科学院微生物学研究所的实验室培养测试独立确认。在实验室竞争测试中测试总共4种分离自帕尔杜比采医院的致病酵母白色念珠菌临床株,确定其通过菌丝生长的能力,其作为这些菌株临床侵袭的证据。参与的菌株是白色念珠菌2508、2548、2558和2944。在mea(麦芽提取物琼脂)用作培养基的情况下,寡雄腐霉在竞争测试中完全生长快于所有4种测试菌株。实验10天后,意味着一旦实验结束,与腐霉过度生长的酵母株剩余物被转入cda(察氏琼脂)培养基。酵母在此培养基中生长,但寡雄腐霉不生长。然而,酵母在此测试培养基中没有生长,显示寡雄腐霉不仅生长快于致病酵母细胞,而且还杀死它们。因此,跟踪这些实验室测试结果,与布拉格、克涅什纳河畔里赫诺夫(rychnovnad
用于证明乳酸杆菌作用的研究用双盲法进行,其中制备具有制品的包封并由未实际参与研究进程的管理工作人员计数。在确认第一微生物样品的临床诊断后,患者签署知情同意书并得到指示如何施用制品。施用采用连续5天冲洗的形式进行,使用所提供的阴道塞药器。妇科医生在研究开始时进行专业检查,且3个月后再次进行,一直检查酵母感染水平和乳酸杆菌的阴道膜定殖水平。临床研究结果以图形格式清楚示于图5a、5b和5c。
从研究开始和结束时的临床评估角度看,施用仅含寡雄腐霉的经典制品的对照组可变:如图5a清楚可见,某些女性中的症状有效消除,但其他患者中没有。出于此原因,患者分成2组,即图5左手边的临床响应患者和图右手边的临床无响应患者。
所有情况下,3个月后临床响应患者中的白色念珠菌酵母发病率显著下降,而无响应患者没有这种下降(一个患者实际经历增加-图5b)。然而,仍然有趣的是,所有情况下,乳酸杆菌在响应患者中的存在远远更高,在研究期间增加到生理上的高值(图5c),而在无响应患者中酵母存在明显更低,2个个案中伴随进一步下降。
这些结果确认,用于抑制和消除致病酵母的二元微生物制品相较标准制品在所有参数方面显示统计上显著更好的结果。
因此,我们验证并测试该假设:制备总共3种形式的本发明所述二元微生物制品以用于阴道念珠菌病并证明这类制品的稳定性,也在有这种诊断的患者中完成临床测试。所得结果的详细描述示于下面的本发明实施例3。此测试的综合结果显示,有效的微生物成分在干燥和干燥条件下存储期间对彼此没有负面影响。实验室测试结果显示二元制品vaginalb的效力最高。
3.制备、控制和测试本发明所述二元微生物制品的效力,所述制品施用于易受致病酵母发生率影响的皮肤和膜。
3.1制备施用于易受酵母发生率影响的皮肤和膜的二元微生物制品的实验方案。
3.1.1制备寡雄腐霉m1atcc38472技术制品。
用于此制品的过程与章节1.1.1所述过程相同。用于示范性实施方案3的批次具有0.8x106个卵孢子每g和12.8%的萌发,意味着其包含0.102x106菌落形成单位(cfu)每1g制品。
3.1.2制备卷曲乳杆菌ccm7010技术制品。
初始卷曲乳杆菌ccm7010培养物在从微生物保藏中心递送后保存于-70℃的温度。为了培养,少量培养物首先转入具有用于培养乳酸杆菌的培养基的琼脂器皿,包含5g每升酵母自溶产物、10g每升牛提取物、10g每升蛋白胨、20g每升葡萄糖、5ml每升tween80、2g每升k2hpo4、5g每升乙酸钠、2g每升柠檬酸二铵、0.2g每升mgso4.7h2o和0.05g每升mnso4.7h2o。在加入所有成分后调节ph至ph6.2–6.6。所述器皿在37℃培养过夜。将10个良好分离的菌落转入含500ml培养基6的2升锥形瓶,所述培养基包括上面指定的成分。细菌培养到对数期中间部分,并10000xgav离心20分钟沉淀,且随后在0.1m柠檬酸三钠缓冲溶液,ph6.0中洗涤3次。最终洗涤后,细菌沉淀物与剩余缓冲溶液仔细分离并用冷冻干燥(冻干)来干燥。
从1升培养物获得约0.8g冻干细菌,每一毫克粉末含有109cfu。
3.1.3制备二元微生物制品的最终配制物,用于施用于易受酵母发生率影响的皮肤和膜。
3种不同形式的制品用于制备最终配制物,区别在于卷曲乳杆菌ccm7010相对含量;这3种形式用缩写名称vaginala、vaginalb和vaginalc命名。就一次施用而言,制备制品用于含2g松散制剂的单包装。个体制品的成分示于下一页的下表5。制品中的活性成分是腐霉和乳酸杆菌。加入硅胶作为干燥剂以保存原有性能和2种活性成分的出现。少量加入的氯化钠有助于更好激活生物剂,洋甘菊香(chamomilearoma)用作香水。
寡雄腐霉成分包含于二元微生物制品vaginala和vaginalb,量为19.2x103cfu每1g;包含于vaginalc制品,量为19.2x103cfu每1g。
卷曲乳杆菌ccm7010成分包含于二元微生物制品vaginala,量为0.5x108cfu每1g;包含于vaginalb制品,量为0.5x109cfu每1g以及包含于vaginalc制品,量为0.5x1010cfu每1g。
3.2用于易受酵母存在影响的皮肤和膜的二元制品的稳定性测试。
用于易受酵母发生率影响的皮肤和膜的二元微生物制品的稳定性测试必须确定,2种微生物成分是否在所制备制品存储期间,至少在进行体外和体内效力测试的时间段中,对彼此产生负作用。单包的2gvaginala、vaginalb或vaginalc制品重悬于500ml温水,温度约35℃。完全重悬后,用1ml测定寡雄腐霉萌发和0.1ml测定乳酸杆菌单位的cfu。为测定乳酸杆菌的cfu,通过10倍连续稀释来稀释样品,为测定cfu,就vaginala使用1x稀释-100x稀释-就vaginalb使用2x稀释-103x稀释-就vaginalc使用3x稀释-104x稀释。稳定性测试在完成制品后立即进行并在1、2、3、4、5和6个月后再次进行。典型稳定性测试的结果如图6所示。可从结果推断,在6个月存储和后续制品使用期间,腐霉的活力首先有所下降且随后在对应约80%最初申报标称值的值稳定。相反,对于乳酸杆菌,活力在测试阶段中仅略微下降,约10%。图6所示结果涉及称为vaginalb的制品。用vaginala和vaginalc制品所得结果非常相似,因而不示于图中(为确保图更清晰)。
表5
因此,可以表述为,用于口腔的任何二元微生物制品成分的出现不会由于在使用本发明所述制品前,干燥初始活性成分并在硅胶存在或其激活而显著减少。
3.3使用体外测试的所制备的混合物的效力测试。
体外效力测试旨在证明寡雄腐霉m1atcc38472和正常阴道微生物组健康细菌卷曲乳杆菌ccm7010的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。从这个角度看,选择标准实验室测试,抑制3种不同菌丝形成型菌株的白色念珠菌致病酵母生长,所述菌株获自捷克共和国帕尔杜比采医院的临床分离物,并移送捷克科学院微生物学研究所(
关于用大量制品进行的临床测试的苛刻性质,作为最有效二元微生物制品的vaginalb被选择用于临床前和临床测试。
实施例4
(图7)
就糖尿病和非糖尿病患者而言,以相同方式观察到酵母存在与难愈合伤口感染临床病症改善之间的正相关性。相关关联系数是0.4和1.0。
表6
此相关性引起考虑,酵母或其成分的存在是否可能导致寡雄腐霉微生物激活。由于同时含有3种不同微生物的生物学测试从其执行和评估角度而言非常复杂,选择替代方式,包括死的酿酒酵母(saccharomycescerevisiae)烘焙酵母,采用所谓酵母自溶产物形式,其通常市售可得。使用琼脂mea上的标准平板测试。其成分如下:20g每升麦芽提取物、20g每升葡萄糖、1g每升蛋白胨和20g每升琼脂。监测寡雄腐霉卵菌与皮肤癣菌指间毛癣菌dmf2477和粉小孢子菌(microsporumfulvum)p245的相互作用,先前对其进行测试以显示其抑制这些皮肤癣菌的生长到未抑制的生长的约50%。然而,腐霉在酵母提取物以1g每升的浓度加入琼脂载体后活化,就毛癣菌而言生长抑制增加到75%且就小孢子菌而言生长抑制增加到80%。因此,该结果还显示腐霉抑制某些皮肤癣菌的生物学能力结果如何依赖于其生理状态,其生物学能力甚至能通过灭活的靶生物体的存在或另一形式的其经加工成分和提取物来显著提高,此情况中是商业酵母自溶产物。能从这些结果获得以下工作假设,即使灭活的酵母可对增加寡雄腐霉卵菌有效性产生作用。
在足部真菌病(包括脚底、脚趾之间和指甲下(甲癣)的皮肤癣菌感染)患者中测试用于消除真菌病(脚癣)媒介的最优二元制品。疗效由皮肤科医生临床评估,微生物测试也在所考虑阶段开始和结束时完成。患者随机分成2组。第一组中,用带寡雄腐霉卵菌的单成分制品提供治疗,第二组中,给予具有酵母自溶产物含量的联合制品。结果显示仅含寡雄腐霉的制品的良好临床效力,但二元微生物制品的临床效力甚至更佳(对照3.0±0,实验3.6±0.5,t测试,p=0.01)。图9c所述的微生物学改善类似(对照2.0±0,实验2.6±0.5,t测试,p=0.01)。
这些结果确认,用于足部真菌病的本发明的二元微生物制品相较于标准单成分制品表现出统计上显著更好的结果。
总共对25只荷兰猪(caviaporcellus)进行研究以监测含寡雄腐霉卵菌的单成分制品效果。所述制品的效果由兽医评估并通过在所考虑阶段开始和结束时获取微生物样品来确认,其中所有样本就实验结束时存在皮肤癣菌真菌和酵母而言为阴性。对制品效果的临床评估总分是1.72±0.87,p<0.05,1=效果极好且4=没有效果。科学家经常描述的皮肤癣菌感染的动物传染特征确保,动物中这些感染的机制与人中的真菌感染相同。关于临床测试的苛刻性质和评估单成分制品效力所得结果对应于所测试人和动物组的比较,可参考章节4.3以进一步验证二元制品的效力。
如上完成的实验系列都显示,酵母或其代谢产物对含寡雄腐霉制品在消除脚癣媒介方面效力的作用增强。此增强作用能通过活酵母激活引起或其代谢产物激活来引起,而不直接需要存在活酵母。终选择显示自身更可能在系统研究中,因此提出以下假设:寡雄腐霉通过涉及酵母代谢的某些成分来刺激其消除皮肤癣菌的能力。
由此,检测此工作假设:制备总共3种形式的本发明的二元微生物制品,用于足部真菌病,这类制品的稳定性得到证明,临床测试也在有该病的患者中完成。所得结果的详细描述在本发明的实施例4中呈现。总之,此测试结果显示,相较活的形式的二元微生物制品,必须加入相对大量的灭活、死的伴侣微生物或其成分,在所测试的酵母自溶产物的情况中,加入多至约10%重量证明有效。以此方式制备的制品效力相比经典单成分制品有统计上显著增加。此增加等同于内源出现酵母感染(作为天然发生共感染的结果)的情况中所观察到的增加,其在约20%病例中出现。
4.制备、控制和测试本发明的二元微生物制品的效力,所述制品适用于足部真菌病情况,包括人中的甲癣和动物中的皮肤癣菌。
4.1制备用于人和动物真菌病的二元制品的实验方案。
4.1.1制备寡雄腐霉m1atcc38472技术制品。用于此制品的过程与章节1.1.1所述过程相同。用于示范性实施方案4的批次具有1.3x106个卵孢子/g和14.5%的萌发,意味着其包含0.189x106菌落形成单位(cfu)每1g制品。
4.1.2制品中的第二成分酵母自溶产物购自oxoid。
4.1.3制备二元微生物制品的最终配制物,应用于真菌病。
3种不同形式的制品用于制备终公式,彼此在其酵母自溶产物相对含量方面不同。这3种形式用缩写名称mycosina、mycosinb和mycosinc给出。制备制品用于压成总重3g的泡腾片,为此,各个配制物转化成该重量。各个制品的成分如下表7所示。
寡雄腐霉成分包含于二元微生物制品mycosina、mycosinb和mycosinc,量为12.6x103cfu每1g。
酵母自溶产物包含于mycosina二元微生物制品的含量为50mg每3g片剂,意味着一片1.66重量%的量;包含于mycosinb制品的含量为100mg每3g片剂,意味着一片3.33%的量;和包含于mycosinc制品的含量为150mg每3g片剂,意味着一个3g片剂5重量%的量。
表7
4.2适用于真菌病和脚癣的二元制品的稳定性测试。
没有对讨论中的制品进行稳定性测试,因为根据文献来源众所周知,干燥制品中存在酵母自溶产物不会影响寡雄腐霉卵菌特性。
4.3使用体外测试的所制备的混合物的效力测试。
体外效力测试旨在证明寡雄腐霉m1atcc38472卵菌和酵母自溶产物所含灭活酵母成分的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。从这个角度看,选择标准实验室测试,抑制4种类型的皮肤癣菌生长,已证明其是具有动物传染特性的真菌病的已知媒介。特别地,用4种常见皮肤癣菌进行测试,各使用2种不同菌株:指间毛癣菌(ti)、意瑞奈斯氏毛癣菌(te)、粉小孢子菌(mf)和犬小孢子菌(mc)。测定个体制品活性的结果示于图7,所形成皮肤癣菌菌落数与无活性物质的对照有关。图7所示结果涉及mycosinb制品,用mycosina和mycosinc制品所得结果在定性上相似,但所得抑制皮肤癣菌的能力仅比对照增加约30%。图7结果清楚显示仅含寡雄腐霉作为活性物质的简单制品具有抑制皮肤癣菌的能力,达到50–60%对照生长的抑制水平。酵母自溶产物自身在所用测试中没有抑制皮肤癣菌生长的能力,结果与对照实验的水平大致相同。就二元制品显示效力在统计上显著增加,水平为对照样品中约10%感染。
关于用大量本发明所述制品进行的临床测试的苛刻性质,作为最有效制品的mycosinb被建议为临床前和临床测试的起始制品。
实施例5
微观卵菌寡雄腐霉通过健康微生物群落成分激活其它独特能力也值得注意。技术物质寡雄腐霉破坏难愈合伤口处繁殖的致病菌所形成生物膜的独特能力在我们先前的研究中得到证实。研究结果在1月23和24日于巴尔杜比采大学健康研究学院举行的第12届国际“治疗伤口和皮肤缺损的跨学科协作”会议上发布。所进行的测量显示,临床分离自难愈合伤口的160个测试菌株中的129个建立生物膜。还在生物膜阳性菌株中用biomycosin制品证明加入寡雄腐霉卵菌后生物膜建立下降70%,在所测试的菌株中的43%生物膜减少非常显著,生物膜建立活性减少超过50%。在17%体外检测菌株中记录的生物膜建立强度没有变化,而在剩余13%所监测的菌株中没有获得重复性结果。在观察的嗜麦芽寡养单胞菌(stenotrophomonasmaltophilia)和绿脓假单胞菌株的情况中,至少能体外影响生物膜生成。然而,如果向孵育混合物加入正常皮肤微生物组细菌表皮葡萄球菌(除了卵菌细菌),甚至在已提及的2个棘手菌株中,生物膜建立下降超过50%。这一有趣的现象与已发表的知识[32]共同显示,除了其代谢调节功能,正常生理性微生物组成分也可在降低致病微生物参与建立的生物膜强度方面发挥作用。
体外效力测试旨在证明寡雄腐霉m1atcc38472卵菌和正常皮肤微生物组健康细菌的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。另一必须验证的极其重要因素是这种作用的特异性。生理性微生物组成分通常用于先前实验的益生菌制品,没有一定维持拓扑特异性。以此方式提供的制品效力大部分极低,其与处于人体不同拓扑学位置的不同生理性微生物组微生物成分有较好的相关性,具有不同的接触外界环境水平和不同的代谢生态位。因此,生物膜建立的简单实验室测试用于验证此假设,如此示范性实施方案所述。在蓝色微生物染料吸收的基础上测量生物膜建立,其描述生物膜建立强度,其中各实验一式三份地独立进行3次[38]。此活力用文献[39]所述活体染色测试测量以证明微生物活力对生物膜的影响。
这些测定的结果明确显示生物膜最优破坏总是仅在包括具有相关拓扑结构的微生物组所含生理性微生物成分的二元制品的情况中出现,所述测定一方面用仅含发明cz302297b所述微观卵菌寡雄腐霉的制品进行且另一方面用本发明所述示范性实施方案1、2和3所述优化二元微生物制品进行。因此,口腔的生物膜被含有此位置优势生理性微生物的二元微生物制品最有效破坏,而其它生理性成分的效果较小。在皮肤和阴道微生物组的情况中,也显示类似的特异性证据。
以此方式所得的结果非常重要,因为它们显示没有适合长期抑制机会性微生物感染症状的通用益生菌或二元微生物制品-仅具有一定含量拓扑相关微生物成分的制品总是有效。
表8
*吸收均值±标准偏差,计算自3个独立测定,各自一式三份进行(3次独立测量)。
5.1二元微生物制品对破坏含口腔细菌的生物膜的影响。
此测试中,对生物膜建立和活力进行简单实验室测试,使用2种口腔细菌格氏链球菌和具核梭杆菌作为监测成分。这些细菌都在口腔微生物生物膜建立中发挥关键作用:链球菌是能在口腔侵袭环境中直接抓住牙釉质的唯一细菌,而梭杆菌属的大(在尺寸方面)细菌建立重要的保留中心用于伴放线放线杆菌(aggregatibacteractinomycetemcommitans)型侵入性病原体中的橙色和红色复合体的细菌定殖。实验室测试结果如表8(上面)所示。结果清楚显示就仅含寡雄腐霉卵菌的单一制品而言,对生物膜的影响较小,仅使用plaqueb二元制品会很明显地破坏和限制口腔生物膜活力。feelfresh制品和vaginalb导致的更显著生物膜破坏可以归因于此制品中更高百分比含量的腐霉。
5.2二元微生物制品对破坏难愈合伤口处含细菌的生物膜的影响
此测试中,对生物膜建立和活力进行简单实验室测试,使用在难愈合伤口中建立生物膜的2种细菌嗜麦芽寡养单胞菌和绿脓假单胞菌作为监测成分。这些细菌出于以下原因:在由帕尔杜比采医院临床微生物学科的karelmencl医生进行的先前测试中,这2种菌株耐受生物膜破坏,采用仅含寡雄腐霉卵菌的单一制品。表9所示结果清楚显示,二元微生物制品能有效克服此缺点和确保在这些抗性类型中有效破坏生物膜,所述制品用于改善难愈合伤口的临床感染并包含正常皮肤微生物组成分表皮葡萄球菌。也就含乳酸杆菌的vaginalb制品记录某些较小影响,所述制品的这类活性已有描述[33]。
表9
*吸收均值±标准偏差,计算自3个独立测定,各自一式三份进行(3次独立测量)。
5.3二元微生物制品对破坏致病酵母所建立生物膜的影响
此测试中,对生物膜建立和活力进行简单实验室测试,使用白色念珠菌酵母作为监测成分。更有效的此生物膜破坏通过用二元微生物制品vaginalb而发生,如从上表10所示结果明显可见。该知识可能具有普遍意义,因为致病酵母白色念珠菌通常联合建立。
表10
*吸收均值±标准偏差,计算自3个独立测定,各自一式三份进行(3次独立测量)。
5.3二元微生物制品对破坏致病酵母所建立生物膜的影响
此实验中,使用简单实验室测试和生物膜活力,采用监测成分白色念珠菌。更有效的此生物膜破坏通过用二元微生物制品vaginalb而发生,如从上表10的结果明显可见。这些知识可能具有普遍意义,因为致病酵母白色念珠菌通常联合某些类型的致病细菌,建立组合的微生物膜。
实施例6
(图8a、图8b)
所提交发明的二元微生物制品的主要优点是使用它们用于预防的机会,为此,基于在施用点有效定殖和长期增殖的可能性,可以采用多至低10倍的活性成分值。寡雄腐霉卵菌的有效重寄生作用和某些其它微生物菌株的抗真菌作用显然也可用于保护生活和工作环境免于霉菌影响。医学文献中已明确描述,生活和工作环境中出现的霉菌可将有害孢子射到其周围。如果其在空气中的平均浓度超过500个活孢子每1m3,导致过敏、呼吸疾病和甚至抑郁的有害影响可以根据世界卫生组织(who)所设标准完全显现。
开发了防霉产品biorepel并在发明cz302297基础上成功使用,所述产品包含寡雄腐霉并主要用于从墙壁、天花板、地板和其它受污染房间区域中去除霉菌。其它微生物制品也用于此目的,所述制品能在抗菌原理基础上去除霉菌且为这类目的主要使用丰富的分布广泛的解淀粉芽孢杆菌。
在现场实验中于其实际使用的条件下,检测二元制品基于2种上述微生物的组合从生活环境去除霉菌和酵母的效力。例如,实验目的是,对于潮湿房间中甚至发生黑霉黑曲霉(aspergillusniger)的墙壁,我们在施用前和施用后6个月测量房间内孢子浓度并在取自墙壁的材料涂片中以标准方式直接定量评估霉菌的存在。就施用而言,3g制品分成2包,包a含有1g制品且包b含有2g制品。包a重悬于10升温水,全部受影响区域用浸泡于此制品的海绵来擦。温和干燥后,同一区域用浸泡于溶液b的海绵来擦,所述溶液通过将包b重悬于1.5升温水来制备。为确认效力的样品在1个月、3个月和6个月后采集,在该时间现场实验结束。制品在以下情况中被认为有效:掉落物(fall)中的孢子数降至小于500(who标准)和用培养测试确认的霉菌存在降至水平1(仅在培养后零星存在)。在2个不同位置的现场实验具体结果示于图8。显然仅当用二元制品时,即使其成分都显示针对对照的某些下降,大气中孢子浓度的所需下降在所观察的2个位置都降至小于500的值(图8a)。类似地,仅二元制品使墙壁中霉菌的实际发生率减少到约1.0的目标值,由涂片检查证实。此情况中也如此,单独制品的效果仅是部分的且未达到目标值(图8b)。这些结果确认以下假设:用于从生活环境去除霉菌和酵母的二元微生物制品显示比标准制品更佳的结果。
进一步测试和验证此假设。作为此验证的一部分,我们根据此示范性实施方案所述过程制备3种不同形式的联合制品并确认其在体外条件下对靶标霉菌的效力。
6.制备、控制和测试二元微生物制品的效力,所述制品适用于从生活环境去除霉菌和酵母。
6.1制备用于从生活环境去除霉菌和酵母的二元微生物制品的实验方案。
6.1.1制备寡雄腐霉m1atcc38472技术制品。
用于此制品的过程与章节1.1.1所述过程相同。用于示范性实施方案6的批次具有1.0x106个卵孢子/g和12.6%的萌发,意味着其包含0.126x106菌落形成单位(cfu)每1g制品。
6.1.2制备解淀粉芽孢杆菌ccm1084技术制品。
初始解淀粉芽孢杆菌ccm1084培养物在从微生物集合中递送后保存于-70℃的温度。为了培养,少量培养物首先转入带琼脂和培养杆菌的培养基10的器皿,所述培养基包括蛋白胨5g每升,牛提取物3g每升和mnso4.h2o0.01g每升;培养基的ph调至7.0。所述器皿在37℃培养过夜。10个良好分离的菌落转入含500ml培养基10的2升锥形瓶,所述培养基包括上面指定的成分。细菌培养到对数期中间部分,并10000xgav离心20分钟沉淀,且随后在0.1m柠檬酸三钠缓冲溶液,ph6.0中洗涤3次。最终洗涤后,细菌沉淀物与剩余缓冲溶液仔细分离并用冷冻干燥(冻干)来干燥。
从1升培养物获得约0.6g冻干细菌,每一克粉末含有108cfu。
6.1.3制备二元制品最终配制物用于从生活环境去除霉菌和酵母。
3种不同形式的制品用于制备终公式,区别在于解淀粉芽孢杆菌ccm1084相对含量;这3种形式用缩写名称molda、moldb和moldc命名。制备制品用于含3g松散制剂的单包装(包a含有1g且包b含有2g制品)。个体制品的成分示于下表11。
表11
6.2用于从生活环境去除霉菌和酵母的二元制品的稳定性测试。
用于从生活环境去除霉菌和酵母的二元制品的稳定性测试必须确定,2种微生物成分是否在所制备制品存储期间对彼此产生负作用,至少在进行体外和体内效力测试的时间段中持续。单包(3g)制品molda、moldb或moldc重悬于10000ml温水(温度约35℃)。完全重悬后,用10ml测定腐霉萌发和1ml测定芽孢杆菌cfu。为测定芽孢杆菌的cfu,通过10倍连续稀释来稀释样品,为测定cfu,就molda使用未稀释制品(1x稀释),就moldb使用1x稀释(10x稀释)且就moldc使用2x稀释例如(102x稀释)。稳定性测试在完成制品后立即进行并在1、2、3、4、5和6个月后再次进行。可从结果推断,在6个月存储和后续制品使用期间,腐霉的活力首先有所下降且随后在对应约75%最初申报标称值的值稳定。相反,对于芽孢杆菌,活力在测试阶段中没有显著变化,活力几乎保持最初申报的值。
因此,可得出结论,任何二元制品成分的出现不会由于干燥初始活性成分并在硅胶存在情况下保存而显著减少。
6.3用体外测试的所制备的混合物的效力测试。
体外效力测试旨在证明寡雄腐霉m1atcc38472卵菌和环境细菌解淀粉芽孢杆菌的组合会协同作用,意味着寡雄腐霉卵菌的某些可测量体外活性会增加。从这个角度看,选择标准实验室测试,抑制墙壁上污染黑曲霉的生长。所述测试的实际进行由使用标准施用操作组成,其总是开始于重悬干燥制品,所述制品仅含有腐霉(biorepel制品)或称为molda、b或c的上述测试制品之一。制品重悬于温度约35℃的250ml生理盐水溶液,12.5ml的此悬液随后直接混合12.5ml两倍浓缩混合物以制备mea琼脂板。然后,105真菌小分生孢子黑曲霉均匀涂于冷却后以此方法准备的平板。28℃培养一周后,读取相较对照器皿所形成的菌落数,其中与对照相反的菌落数下降是腐霉效力的量度。此测试结果示于下表12。结果显示单独腐霉对抑制实验器皿中的酵母生长有显著作用,其与葡萄球菌的组合产生进一步增强的效果。体外条件下3种致病酵母株的最有效制品是moldb制品,称为molda和moldc的制品达到此效力的约50%。关于现场实验的苛刻性质,作为最有效制品的moldb被建议用于进一步的现场实验。
表12
用于此示范性实施方案所指定二元微生物制品的所示实施例不限于从周围环境去除霉菌或酵母。此类二元制品能正面地用于预防生活和工作环境中的霉菌和酵母发生,这可能对患有机会性微生物感染的人重要。
工业实用性
所述方案旨在施用以确保健康口腔,施用于难愈合伤口如静脉曲张性溃疡,施用于皮肤,以及施用以抑制上述位置和泌尿生殖道粘膜及人体其它位置上出现的酵母,尤其是受真菌或酵母感染影响的皮肤。
引用的文献
[1]aasja,pasterbj,stokesln等(2005)jclinmicrobiol43,5721-5732.
[2]ainamoj,barmesd,baegricd(1982)intdentj32,281-289.
[3]arabatzismetal(2007)brjdermatol157,681-689.
[4]berezovab,darveaurp(2011)periodontol200055,36-47.
[5]burnera,zengl,ahnsj等(2012)advdentres24,77-80.
[6]calderonera,fonziwa(2001)trendsmicrobiol9,327-335.
[7]us5,190,746a(1993年3月2日授权),casselsjf,londonj.
[8]cuttingkf,whiter(2004)brjcommunitynurs9:s6-s15.
[9]darveaurp(2010)natrevmicrobiol8,481-490.
[10]debernardisf,liuh,o‘mahonyr等(2007)jinfectdis195,149-157.
[11]dewhirstfe,chent,izardj等(2010)jbacteriol192,5002-5017.
[12]ewmapatientoutcomegroup(2010)jwoundcare19,239-268.
[13]findleyk,ohj,yangj等(2013)nature498,367-370.
[14]frandinc,kretschmarm,nichterleint等(2003)molmicrobiol47,1523-1543.
[15]gottrupe,apelqvistj,bjansholtt等(2013)jwoundcare22,s1-s89.
[16]gownar,hubeb(2012)curropinmicrobiol15,406-412.
[18]griceea,segreja(2012)annurevgenomicshumangenet13,151-170.
[19]hajishengalisg,liangs,paynema等(2011)cellhostµbe10,497-506.
[20]holtsc,ebersolejl(2005)periodontol200038,72-122.
[21]hubeb(2004)curropinmicrobiol7,336-341.
[22]humanmicrobiomeprojectconsortium(2012)nature486,207-214.
[23]kostovg,angelevm,denkovaz等(2011)englifesci11,517-527.
[24]kotnikt(2007)slovvetres,44(3):63-73.
[25]langnp,adlerr,jossa等(1990)jclinperiodontol17,714-721.
[26]wo2013/122931a2(22.8.2013公开),lanzalacoac,charbonneaudl,howardbw.
[27]liub,fallerrr,klitgordn等(2012)plosone7,e37919.
[28]morrellj,stratmane(2011)jagromedicine,16:4,244-250.
[29]nakagaway,ohnon,murait(2003)jinfectdis187,710-713.
[30]okudak,katot,ishiharak(2004)oraldis10,5-12.
[31]ca2374938a1(30.11.2000公开)reidg,brucea.
[32]wo2008/077251(3.7.2008公开),smoragiewiczw,karska-wysocki,bazo,ruizliquet.
[33]stapletonae等(2011)clininfectdis52,1212-1217.
[34]cz302297b6(29.12.2010公开),suchánekm,
[35]teughelsw,durukana,ozceliko等(2013)jclinperiodontol40,1025-1035.
[36]cz9883u(14.4.2000出版).
[37]woundsuk(2010)aberdeen:woundsuk2010.bestpracticestatement:useoftopicalantiseptic/antimicrobialagentsinwoundmanagement.
[38]moskowitzsm,fosterjm,emersonj等(2004)jclinmicrobiol42,1915-1920.
[39]bruzuali,rigglerp,hadleys等(2007)jantimicrobchemother59,441-450.
- 还没有人留言评论。精彩留言会获得点赞!