人参皂苷M1用于预防或治疗痛风的用途的制作方法
相关申请
本申请主张2015年3月17日申请的美国临时申请第62/134,227号的优先权,其内容在此全部并入作为参考资料。
本发明有关于人参皂苷m1用于治疗或预防痛风的新颖用途。
背景技术:
痛风是一种尿酸结晶累积在关节引起的关节炎。症状包含疼痛、肿胀及发红于受影响的关节。
人参皂苷是人参的主要活性成分,已知具有多种药理学活性,例如,抗肿瘤、抗疲劳、抗过敏及抗氧化活性。人参皂苷类具有相同的基础结构,其由具17个碳原子排成四个环的甾烷类固醇核心(gonanesteroidnucleus)组成。人参皂苷会在体内代谢,近来许多研究指出,在体内易吸收而作为活性成分的是人参皂苷代谢物而非天然存在的人参皂苷。其中,人参皂苷m1已知为原人参二醇型(protopanaxadiol-type)人参皂苷代谢物之一,其经由人体肠道细菌的绞股蓝皂苷(gypenoside)途径生成。迄今,尚未有现有技术报导人参皂苷m1用于痛风的治疗功效。
技术实现要素:
本发明不可预期地发现,人参皂苷m1可有效减轻或延迟痛风的发病或恶化。因此,本发明提供一种用于个体治疗或预防痛风的新颖方法。
具体而言,本发明提供一种在需要的个体中治疗痛风的方法,其包含将有效量的人参皂苷m1投予至该个体。
特定而言,本发明的治疗方法有效地抑制单钠尿酸盐结晶(msu)或脱水焦磷酸钙(cppd)引起的nlrp3发炎体活化。更特定地,本发明的治疗方法有效地抑制msu或cppd通过nlrp3发炎体引起的介白素(il)1β产生。
在部分具体实施例中,人参皂苷m1是以肠外或肠内的路径投予。
本发明还提供一种人参皂苷m1用于制造供需要的个体治疗痛风的药物的用途。
本发明的一或多个具体实施例的详述列于下方的说明中。本发明的其他特征或优势可由下列数个具体实施例的详细说明及权利要求书而更加清楚。
附图说明
为了说明本发明,图式具体实施例如下。然而,应理解到,本发明未局限于所示的优选的具体实施例。在图式中:
图1显示小鼠j774a.1巨噬细胞连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps培养30分钟(人参皂苷m1仍然存在或缺少),接着连同或不加连同或不加100μg/mlmsu培养24小时。培养基中il-1β量由elisa测量。***表示相较于单独msu组,显著差异等级p<0.001。
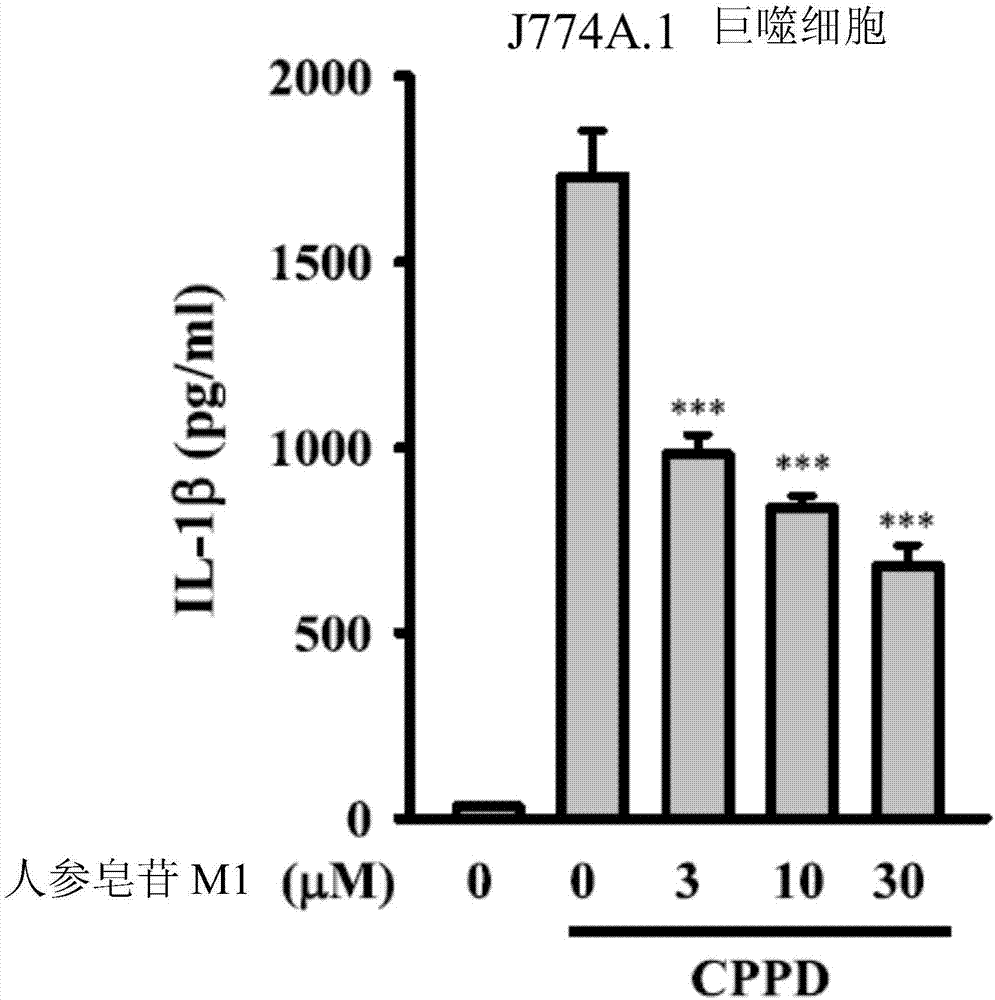
图2显示小鼠j774a.1巨噬细胞连同或不加连同或不加人参皂苷m1培养30分钟,再连同或不加连同或不加1μg/mllps培养30分钟(人参皂苷m1仍然存在或缺少),接着连同或不加连同或不加100μg/mlcppd培养24小时。培养基中il-1β量由elisa测量。***表示相较于单独cppd组,显著差异等级p<0.001。
图3显示小鼠j774a.1巨噬细胞连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps培养6小时(人参皂苷m1仍然存在或缺少)。细胞裂解液中nlrp3量及proil-1β由西方墨点法测量。
图4显示人类thp-1巨噬细胞连同或不加1μg/mllps培养6小时,再连同或不加人参皂苷m1培养30分钟(lps仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中il-1β量由elisa测量。*及***表示分别相较于单独msu组,显著差异等级p<0.05及p<0.001。
图5显示人类thp-1巨噬细胞连同或不加1μg/mllps培养6小时,再连同或不加人参皂苷m1培养30分钟(lps仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中tnf-α量由elisa测量。*及***表示分别相较于单独msu组,显著差异等级p<0.05及p<0.001。
图6显示人类thp-1巨噬细胞连同或不加1μg/mllps培养6小时,再连同或不加人参皂苷m1培养30分钟(lps仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中il-6量由elisa测量。***表示相较于单独msu组,显著差异等级p<0.001。
图7显示腹腔冲洗液中il-1β量(分离自对照组小鼠、注射msu小鼠及口腔投予人参皂苷m1加上注射msu小鼠)由elisa测量。***表示相较于注射msu组,显著差异等级p<0.001。
图8显示腹腔冲洗液中il-6量(分离自对照组小鼠、注射msu小鼠及口腔投予人参皂苷m1加上注射msu小鼠)由elisa测量。***表示相较于注射msu组,显著差异等级p<0.001。
图9显示腹腔冲洗液中嗜中性球量(分离自对照组小鼠、注射msu小鼠及口腔投予人参皂苷m1加上注射msu小鼠)由流式细胞仪。***表示相较于注射msu组,显著差异等级p<0.001。
具体实施方式
除非另有定义,本文所使用的技术性及科学性术语具有本发明领域的技术人员所能常规理解的意义。除非另有指明,本文所使用的下列术语具有赋予其的涵义。
本文所使用的冠词“一”与“一者”是指一个或多于一个(也即,至少一者)的该冠词语法对象。举例而言,“一组件”是指一个组件或多于一个的组件。
il-1β是一种重要的细胞激素,通过脂多醣(lps)活化巨噬细胞中的转录活性,快速地合成无活性的未成熟型态(il-1β的先驱因子,proil-1β)(hsuandwen,2002)。不像其他细胞激素,成熟il-1β的分泌需要通过蛋白酶-1(一种半胱氨酸蛋白酶)处理其先驱型态proil-1β(milleretal.,1997)。il-1β的释放是由包含蛋白酶-1的多蛋白复合物控制(称为nlrp3发炎体),其控制蛋白酶-1活性和il-1β的释放(casseletal.,2011;jinandflavell,2010)。nlrp3发炎体完整的活性需要同时有一个来自lps刺激tlr4的启动信号及一个来自次级刺激物的活化信号,如单钠尿酸盐(msu),前者控制nlrp3及proil-1β表现及后者控制蛋白酶-1活性(martinonetal.,2009;schroderandtschopp,2010;davisetal.,2011;casseletal.,2011;jinandflavell,2010)。痛风及假性痛风是发炎性关节炎,其特征是msu及脱水焦磷酸钙(cppd)晶体分别沉积在关节中造成的突然自体限制攻击的发炎反应。nlrp3发炎体与发炎疾病的发展间的密切连结越趋明显。近期研究指出介白素-1β(il-1β)是在痛风病征中一个关键的免疫调节细胞激素(martinetal.,2009;torresetal.,2009;terkeltaubetal.,2009;mcgonagleetal.,2007;soetal.,2007)。研究显示msu活化巨噬细胞nlrp3发炎体相关的il-1β分泌(martinonetal.,2006)。在临床上,痛风与关节的浮肿及红斑、连续严重的疼痛、关节内及关节周围区域严重嗜中性球浸润情形有关。在以结晶诱导腹膜炎的体内模型中,缺乏nlrp3发炎体小鼠或缺乏il-1β受器小鼠发现受损的嗜中性球内流(martinonetal.,2006)。msu活化巨噬细胞nlrp3发炎体相关的il-1β分泌的工作模型已经被建立,用以研究痛风病征(martinonetal.,2006)。抑制msu引起的nlrp3发炎体活化及il-1β产生预防及缓和痛风。
本发明不可预期地发现,人参皂苷m1有抗痛风效果,至少包含人参皂苷m1可以减少msu引起的il-1β产生(图1)及cppd引起的il-1β产生(图2)及巨噬细胞中lps引起的nlrp3及proil-1β表现(图3)。这些结果指出lchk168可以预防及缓和痛风。
因此,本发明提供一种在需要的个体中治疗痛风的方法,其包含投予该个体有效量的人参皂苷m1,以治疗该个体。本发明也提供人参皂苷m1用于制造一种药物以在需要的个体中治疗痛风。
具体而言,此治疗方法有效地抑制msu或cppd引起的nlrp3发炎体活化。更具体地,此治疗方法有效地抑制msu或cppd通过nlrp3发炎体引起的il-1β产生。
人参皂苷m1,即20-β-d-吡喃葡萄糖基原人参二醇(20-o-β-d-glucopyranosyl-20(s)-protopanaxadiol),为本领域熟知的皂素代谢物之一。人参皂苷m1的化学结构如下:
人参皂苷m1已知为原人参二醇型人参皂苷的代谢物之一,其经由人体肠道细菌的绞股蓝皂苷途径产生。人体服用人参后,可于血液或尿液中发现人参皂苷m1。人参皂苷m1可制备自人参植物,其以本领域熟知的方法如真菌发酵方式进行,例如,中国台湾发明专利申请第094116005号(i280982)及美国专利第7,932,057号,其全部内容在此列入本申请以作为参考数据。在部分具体实施例中,用于制备人参皂苷m1的人参植物包括五加科(araliaceae)、人参属(panaxgenus),如人参(p.ginseng)及假人参(p.pseudo-ginseng)(也称作三七)。一般而言,人参皂苷m1的制备方法包括步骤:(a)提供人参植物材料(如叶或茎)的粉末;(b)提供真菌,以进行人参植物材料的发酵,其中发酵温度范围为20至50℃、发酵湿度范围为70至100%、ph值范围为4.0至6.0、及发酵时间范围为5至15天;(c)萃取及收集发酵产物;以及(d)自发酵产物分离20-β-d-吡喃葡萄糖基原人参二醇。
在本发明中,当以“分离”或“纯化”描述人参皂苷m1时,其应理解为非绝对的分离或纯化,而是相对的分离或纯化。举例而言,纯化的人参皂苷m1是指相较于其天然存在形式而言,纯度更高。在一个具体实施例中,含有纯化的人参皂苷m1的制剂可包含的人参皂苷m1的含量为总制剂的50%以上、60%以上、70%以上、80%以上、90%以上、或100%(w/w)。应理解的是,当以某数字显示比例或剂量时,该数字通常包括其10%上下的范围,或更特别地,包括其5%上下的范围。
本文所使用的“个人”或“个体”等词包括人类或非人类动物,例如陪伴动物(如狗、猫等)、农场动物(如牛、绵羊、猪、马等)、或实验动物(如大鼠、小鼠、天竺鼠等)。
本文所使用的“治疗”一词是指施加或投予包括一或多种活性药剂的组合物至具有疾病、疾病的症状或病况、或疾病恶化的个体,其目的在于治疗、治愈、缓解、减轻、改变、补救、改善、改进、或影响疾病、疾病的症状或病况、疾病引发的失能、或疾病恶化。
本文所使用的“治疗有效量”一词是指在治疗的个体中产生治疗功效的活性成分的量。举例而言,用于治疗痛风的有效量为可抑制msu或cppd引起的nlrp3发炎体活化,更具体地,可以抑制msu或cppd通过nlrp3发炎体引起的介白素-1β产生的剂量。
治疗有效量可因各种因素而有所变化,如投予途径及频率、接受该药物的个体的体重及物种、及投予目的。本领域的技术人员可基于本文公开、建立的方法、及其本身的经验确定各情况的剂量。举例而言,在部分具体实施例中,本发明所使用的人参皂苷m1口服剂量为每日10至1,000mg/kg。在部分实例中,本发明所使用的人参皂苷m1口服剂量为每日100至300mg/kg、每日50至150mg/kg、每日25至100mg/kg、每日10至50mg/kg、或每日5至30mg/kg。此外,在本发明的部分具体实施例中,人参皂苷m1周期性投予一段时间,例如,每日投予达至少15天、一个月或二个月或更久。
依据本发明,人参皂苷m1可作为活性成分,以治疗痛风。在一个具体实施例中,针对输送及吸收目的,治疗有效量的活性成分可与医药上可接受载体配制成适当形式的医药组合物。依据投予模式,本发明的医药组合物优选为包含约0.1%重至约100%重的活性成分,其中百分比重是以组合物的总重量为基准计算。
本文所使用的“医药上可接受”一词是指载体与组合物的活性成分兼容,且优选为可稳定该活性成分且对于接受治疗的个体具安全性。该载体可为活性成分的稀释剂、载剂、赋形剂、或介质。适用的赋形剂的一些实例包括乳糖、葡萄糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、无菌水、糖浆、及甲基纤维素。本组合物可额外包含润滑剂如滑石、硬脂酸镁、及矿物油;润湿剂;乳化剂及悬浮剂;防腐剂如甲基及丙基羟基苯甲酸酯;增甜剂;以及调味剂。在投予至病患后,本发明的组合物可提供活性成分快速、持续、或缓慢释放的效果。
依据本发明,该组合物的形式可为片剂、丸剂、粉剂、锭剂、囊剂、扁囊剂、酏剂、悬剂、乳液、溶液、糖浆、软与硬明胶胶囊、栓剂、无菌注射液、及包装粉剂。
本发明的组合物可经由任何生理上可接受途径输送,例如,口服、非口服(如肌内、静脉、皮下、及腹腔)、经皮、栓剂、及鼻内方法。关于非口服投予,优选为使用无菌水溶液,其可包含其他物质,如足以使溶液与血液等张的盐类或葡萄糖。水溶液可视需求适当地经缓冲(优选为具ph值3至9)。本领域技术人员可由熟知的标准药理学技术于无菌条件下制备适合的非口服组合物。
依据本发明,含有以人参皂苷m1作为活性成分的人参皂苷m1或组合物可用于治疗罹患痛风或有罹患痛风风险的个人。特定而言,含有以人参皂苷m1作为活性成分的人参皂苷m1或组合物可投予至罹患痛风的个人或具有罹患痛风风险的个人,通过抑制msu或cppd引起的nlrp3发炎体活化,以预防疾病发生或改善症状或推迟症状恶化。
本发明进一步以下列实施例说明,其目的旨在阐述而非局限。
实施例
1.材料及方法
人参皂苷m1,即20-β-d-吡喃葡萄糖基原人参二醇(20-o-β-d-glucopyranosyl-20(s)-protopanaxadiol)(以下命名为lchk168),是以本领域熟知的方法制备,如中国台湾专利申请第094116005号(i280982)及美国专利第7,932,057号所公开。
msu由过饱和尿酸溶液于弱碱性环境结晶化。简言之,250mg尿酸(sigma;cat.no.u2875)加入至45ml包含300μl5mnaoh的双重蒸馏水,再煮沸溶液至尿酸溶液完全溶解。将溶液通过0.2-μm过滤器,再加入5mnacl至热溶液,接着储存于26℃。7天后,以乙醇和丙醇冲洗得到的msu结晶。针状的msu结晶(三斜晶)长5-25μm且对偏振光形成双折射。所有的msu结晶由鲎变形细胞裂解液分析法确定其无内毒素(<0.01eu/10mg)。
小鼠巨噬细胞细胞株j774a.1及人类单和白血球细胞株thp-1购于美国菌种保存中心(rockville,md)并培养在添加10%以高温去活性的胎牛血清及2mml-谷氨酰胺的rpmi1640培养基(均购于lifetechnologies,carlsbad,ca)于37℃、5%co2培养箱中。为了诱导单核球分化成巨噬细胞,thp-1以添加100nm佛波醇12-肉豆蔻酸酯13-乙酸酯(sigma-aldrich)培养在rpmi-1640中48小时。
图1及图2中,j774a.1巨噬细胞(1x105细胞/500μl培养基/孔槽)连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps(来自大肠杆菌0111:b4,购于sigma,stlouis,mo)培养30分钟(人参皂苷m1仍然存在或缺少),接着连同或不加100μg/mlmsu或100μg/mlcppd培养24小时(均购于invivogen,sandiego,ca)。培养基中il-1β量由elisa测量。
图3中,j774a.1巨噬细胞(2x106细胞/2ml培养基/盘)连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps(来自大肠杆菌0111:b4,购于sigma,stlouis,mo)培养6小时(人参皂苷m1仍然存在或缺少)。细胞裂解液中nlrp3及proil-1β由西方墨点法测量。简言之,治疗后,收集细胞并在4℃裂解于包含蛋白酶抑制剂组合物(sigma,stlouis,mo)的裂解缓冲液中(25mmtris-氯化氢,ph7.5,100mm氯化钠,2mmedta,2.5mmegta,20mm氟化钠,1mm正钒酸钠,20mmβ甘油磷酸钠,10mm焦磷酸钠,0.5%tritonx-100),然后完整的细胞裂解液以sds-page分离再电转至pvdf膜。将膜于阻断溶液中(5%脱脂牛奶在含0.1%tween20的磷酸盐缓冲盐水)室温反应1小时,再与nlrp3或proil-1β抗体于阻断溶液中室温反应2小时。以含0.1%tween20的pbs冲洗三次后,膜与hrp-共轭次级抗体于阻断溶液中室温反应1小时并以强化化学发光西方墨点法侦测系统显色。
在图4-6中,thp-1巨噬细胞(1x105细胞/500μl培养基/孔槽)连同或不加1μg/mllps培养6小时,再连同或不加人参皂苷m1培养30分钟(lps仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中il-1β量由elisa测量。
在图7-9中,动物实验均于宜兰大学实验动物照护及使用委员会的伦理审议下进行,并符合nih实验动物照护及使用指南的伦理规范。雄性c57bl/6小鼠购于实验动物中心(台北,中国台湾)。小鼠饲养在22-24℃,相对湿度40-70%,12小时光暗循环,自由饮食饮水。第0、1及2天,每日以管喂方式口腔投予人参皂苷m1(60mg/kg体重)。急性痛风发炎反应是在第0天及第2天投予人参皂苷m11小时后,以腹腔注射0.5ml含3mgmsu的磷酸缓冲盐水中(pbs)至每只小鼠诱导。对照组小鼠接受0.5ml不含msu的pbs(n=6)。四小时后,所有小鼠均以断颈方式处死,再以腹腔注射5mlpbs至小鼠。接着收集腹腔冲洗液,每只老鼠的腹腔冲洗液约为4ml。以pbs冲洗和重新悬浮收集到的腹腔渗液细胞。细胞以抗嗜中性球专一性表面标记ly-6g及cd45(ebioscience,sandiego,ca,usa)的荧光抗体进行染色,于37℃黑暗中反应20分钟,再以facscan流式细胞仪(becton-dickinson,sanjose,ca)分类其细胞族群。腹腔冲洗液中il-1β量及il-6量以elisa分析。
elisa方法,加入50μl生物素标记抗体反应物及50μl培养基至预先以抗老鼠il-1β或il-6涂层的stripwell培养盘,培养于室温2小时。以冲洗缓冲液冲洗盘3次后,加入100μl稀释的hrp(辣根过氧化物酶)标记链霉亲和素浓缩物至各个孔槽并培养于室温30分钟。重复冲洗流程,然后加入100μl预先混合的四甲基联苯胺基底溶液至各个孔槽并显色于黑暗中室温30分钟。接着另外加入100μl提供的停止溶液至各个孔槽以停止反应,以微量盘分析仪测量培养盘在波长450nm的吸光值。
2.结果
2.1人参皂苷m1减少j774a.1巨噬细胞中msc引起的il-1β产生
小鼠j774a.1巨噬细胞连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps培养30分钟(人参皂苷m1仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中il-1β量由elisa测量。如图1所示,结果显示人参皂苷m1减少il-1β分泌,并指出人参皂苷m1减少痛风相关的发炎反应。***表示相较于单独msu组,显著差异等级p<0.001。
2.2人参皂苷m1减少j774a.1巨噬细胞中cppd引起的il-1β产生
小鼠j774a.1巨噬细胞连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps培养30分钟(人参皂苷m1仍然存在或缺少),接着连同或不加100μg/mlcppd培养24小时。培养基中il-1β量由elisa测量。如图2所示,结果显示人参皂苷m1减少il-1β分泌,并指出人参皂苷m1减少痛风相关的发炎反应。***表示相较于单独cppd组,显著差异等级p<0.001。
2.3人参皂苷m1减少lps引起的nlrp3及il-1β表现
j774a.1巨噬细胞连同或不加人参皂苷m1培养30分钟,再连同或不加1μg/mllps培养6小时(人参皂苷m1仍然存在或缺少)。细胞裂解液中nlrp3量及proil-1β量由西方墨点法测量。如图3所示,结果显示人参皂苷m1减少lps活化的j774a.1巨噬细胞中nlrp3量及proil-1β量。
总而言之,我们的研究显示人参皂苷m1有效地减少巨噬细胞中msu引起的il-1β产生(图1)及cppd引起的il-1β产生(图2)以及lps引起的nkrp3及proil-1β表现(图3)。这些发现指出人参皂苷m1有效地预防及缓和痛风。
2.4人参皂苷m1减少thp-1巨噬细胞中msc引起的il-1β、tnf-α及il-6产生
为了确认人参皂苷m1抗发炎活性,人类thp-1巨噬细胞连同或不加1μg/mllps培养6小时,再连同或不加人参皂苷m1培养30分钟(lps仍然存在或缺少),接着连同或不加100μg/mlmsu培养24小时。培养基中il-1β量由elisa测量。如图4-6所示,结果显示人参皂苷m1减少il-1β产生(图4)、tnf-α产生(图5)以及il-6产生(图6),并指出人参皂苷m1减少人类巨噬细胞中痛风相关的发炎反应。*及***表示分别相较于单独msu组,显著差异等级p<0.05及p<0.001。
2.5人参皂苷m1减少msc引起的腹膜炎
相较于对照组小鼠,腹腔注射msu显著地提高小鼠腹腔冲洗液中il-1β(图7)及il-6(图8)产生。口腔投予人参皂苷m1显著地减少小鼠腹腔冲洗液中msu引起的il-1β(图7)及il-6(图8)产生。msu也显著地刺激ly-6g+嗜中性球数量,而人参皂苷m1显著地减少msu引起的ly-6g+嗜中性球量(图9)。
本发明领域的技术人员可基于本文的阐述最大限度利用本发明,而毋须进一步说明。因此,应理解到,所提供的说明及权利要求仅用于示例的目的,而非以任何方式局限本发明的范围。
参考文献
casselsl,jolys,sutterwalafs.2009.thenlrp3inflammasome:asensorofimmunedangersignals.seminimmunol21(4):194-198.
davisbk,wenh,tingjp.2011.theinflammasomenlrsinimmunity,inflammation,andassociateddiseases.annurevimmunol29:707-735.
hsuhy,wenmh.2002.lipopolysaccharide-mediatedreactiveoxygenspeciesandsignaltransductionintheregulationofinterleukin-1geneexpression.jbiolchem277(25):22131-22139.
jinc,flavellra.2010.molecularmechanismofnlrp3inflammasomeactivation.jclinimmunol30(5):628-631.
martinonf,pétrilliv,mayora,tardivela,tschoppj.2006.gout-associateduricacidcrystalsactivatethenalp3inflammasome.nature:440(7081):237-241.
martinonf,mayora,tschoppj.2009.theinflammasomes:guardiansofthebody.annurevimmunol27:229-265.
martinwj,waltonm,harperj.2009.residentmacrophagesinitiatinganddrivinginflammationinamonosodiumuratemonohydratecrystal-inducedmurineperitonealmodelofacutegout.arthritisrheum60(1):281-289.
mcgonagled,tanal,shankaranarayanas,maddenj,emeryp,mcdermottmf.2007.managementoftreatmentresistantinflammationofacuteonchronictophaceousgoutwithanakinra.annrheumdis66(12):1683-1684.
millerdk,myersonj,beckerjw.1997.theinterleukin-1betaconvertingenzymefamilyofcysteineproteases.jcellbiochem64(1):2-10.
schroderk,tschoppj.2010.theinflammasomes.cell140(6):821-832.
soa,desmedtt,revazs,tschoppj.2007.apilotstudyofil-1inhibitionbyanakinrainacutegout.arthritisresther9(2):r28.
terkeltaubr,sundyjs,schumacherhr,murphyf,bookbinders,biedermanns,wur,melliss,radina.2009.theinterleukin1inhibitorrilonaceptintreatmentofchronicgoutyarthritis:resultsofaplacebo-controlled,monosequencecrossover,non-randomised,single-blindpilotstudy.annrheumdis68(10):1613-1617.
torresr,macdonaldl,crollsd,reinhardtj,dorea,stevenss,hyltondm,rudgejs,liu-bryanr,terkeltaubra,yancopoulosgd,murphyaj.2009.hyperalgesia,synovitisandmultiplebiomarkersofinflammationaresuppressedbyinterleukin1inhibitioninanovelanimalmodelofgoutyarthritis.annrheumdis68(10):1602-1608.
- 还没有人留言评论。精彩留言会获得点赞!