用于治疗疾病的KDM1A抑制剂的制作方法
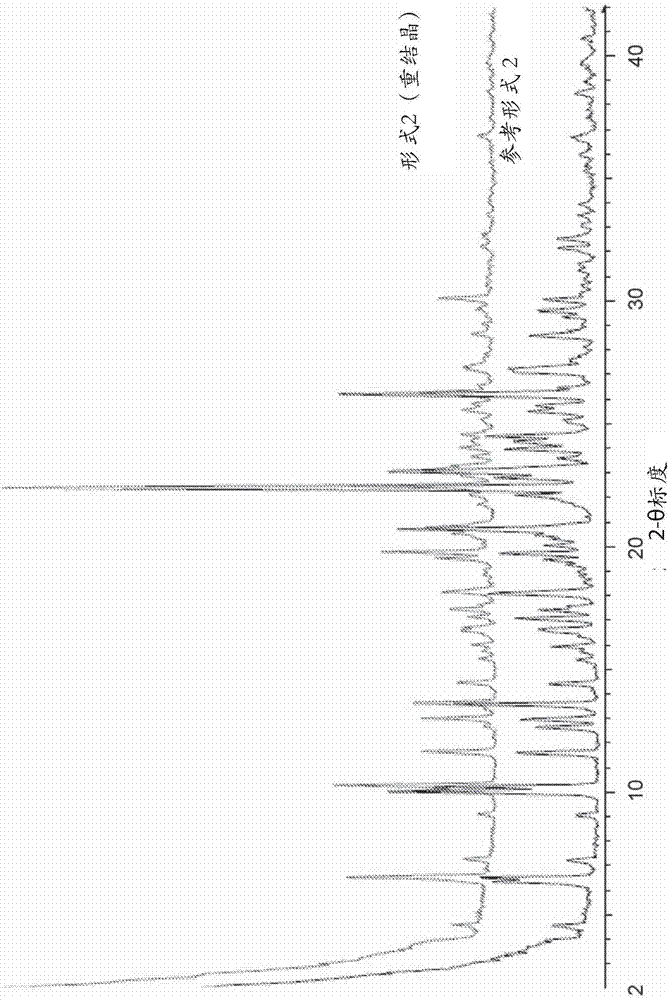
本申请要求于2015年2月12日提交的美国临时申请号62/115,474优先权的权益,将其披露内容通过引用以其全文特此结合(就像本文所写)。本披露涉及新化合物和组合物以及其作为药物制剂用于治疗疾病的用途。抑制酶kdm1a(又称为赖氨酸特异性脱甲基化酶1、lsd1、含黄素的含胺氧化酶结构域的蛋白、aof2、braf35-hdac复合物蛋白bhc110、fad-结合蛋白braf35-hdac复合物)可改变细胞中的基因表达,所述改变足以恢复这些细胞的固有生理学功能或恢复组织、器官或患者整体的固有生理学功能。这可通过增强病理上沉默的一个基因或多个基因的转录(例如,如在一些癌细胞以及遗传病的情况下)或通过减弱参与病理状态的一个基因或多个基因的转录来实现。如此,抑制kdm1a可用于治疗疾病,如癌症,以及遗传病,如威尔逊病、心肌病和血红蛋白病。通过将rna聚合酶ii转录装置募集至dna模板来调节基因表达。这个大的多蛋白复合物达到dna转录起始处或附近并且行进通过基因的整个编码区的可能性部分地由被称为启动子和增强子的特异性dna序列、对在转录起始附近处dna序列的修饰、结合至dna的蛋白以及dna模板本身的拓扑结构所确定。增加蛋白编码基因的rna合成可能性的因子被称为转录因子,这些转录因子中的一些参与所有蛋白编码基因的转录,并且其中的一些特异性转录个别基因。转录控制的一个主要机制由限制转录调节区对能启动或完成转录的蛋白的物理可及性组成;结合至启动子或增强子dna序列的蛋白可阻挡活化因子使其无法结合这些dna序列,导致更少的转录起始或经活化的行进性rna聚合酶复合物的更少的延伸。同样,不允许模板dna充分地解开以允许rna聚合酶在所述模板上稳定行进的拓扑约束也用于限制转录速率。影响使用dna模板进行体内rna合成的最重要的一般因子是组蛋白的修饰,这些修饰控制除其他因子之外的用于转录的dna模板的拓扑结构以及rna聚合酶复合物对其的可及性。组蛋白的小家族-h2a、h2b、h3以及h4-组合以产生称为组蛋白八聚体的支架,在其上dna沿着dna的长度被空间地以及拓扑地组织成称为核小体的整齐的重复结构。组蛋白、其他蛋白、各种rna以及dna的集合体被称为染色质。dna和组蛋白均以这种方式被化学修饰,以吸引以及结合或排斥其他具有增强或抑制转录效果的蛋白。dna以及相关rna和影响转录和复制调节的蛋白的修饰称为表观遗传的,所述转录和复制调节不涉及规范的dna碱基的取代。这些表观遗传影响涉及四种dna碱基本身的可逆化学修饰或对于染色质蛋白以及与dna相关的rnd的翻译后化学改变。这些表观遗传过程可在使基因表达激活或沉默中发挥举足轻重的作用;此外,表观遗传修饰可维持生物体的一生或可响应于起源于细胞内或细胞外的特异性生物化学信号进行动态改性。这些染色质改变能很快发生或非常稳定,例如在基因表达的激素诱导过程中,位于特定基因座处的染色质结构可在几秒钟内根本性地改变以允许最高的转录,或染色质结构可被修饰以完全抑制基因表达,染色质的这种状态可以稳定地维持多次细胞分裂并且甚至可以跨代。位于5’位置处的胞嘧啶的甲基化是常见的dna碱基修饰,这种修饰进而被最经常与转录阻遏相关的一类蛋白识别。类似地,对组蛋白进行化学修饰,但具有较为多种多样的化学加合物,每种加合物单独或组合增强或抑制附近基因的转录。这些组蛋白修饰尤其包括甲基化、乙酰化、苏素化、磷酸化、泛素化、以及豆蔻酰化,它们被其他染色质相关蛋白识别,这些蛋白进而影响转录速率以及dna复制。基因表达的动态以及相关染色质的状态暗示组蛋白修饰不是永久的,而是根据在个体发育、成年人生命以及环境的变化影响过程中的特定时间所述细胞对于特定基因产物的需求进行添加以及去除。实际上,组蛋白的特异性化学修饰是各自由作用于特异位点的多种类别的酶完成。这些组蛋白修饰酶类转而经受严格调节。这些酶类可潜在地被化合物靶向,这些化合物抑制这些酶的活性,结果是在治疗学的意义上改变基因表达。现在已知组蛋白甲基化的状态变化在细胞周期和生长的正常调节、对dna损伤和应激的响应、以及产前发育(包括分化)中都发挥关键作用。病理状态(如癌症)与改变的组蛋白修饰模式以及调节异常的组蛋白修饰酶类(包括染色质修饰酶类)相关。严密地调节组蛋白修饰的需要被组蛋白甲基化状态与人类发病(包括衰老)的关联所证实。组蛋白甲基化可出现在以下三种碱性氨基酸残基中的任何一种上-赖氨酸(k)、精氨酸(r)、以及组氨酸(h)。组蛋白h3的4(h3k4)、9(h3k9)、27(h3k27)、36(h3k36)以及79(h3k79)位处的赖氨酸上的甲基化是研究最充分的影响基因表达的组蛋白修饰之一。组蛋白h3上位置4(h3k4me3)处赖氨酸三甲基化是通常与基因表达激活相关的组蛋白标记,而h3k9me1或h3k27me3与基因转录的抑制相关。h3k4me1与基因转录的dna增强子相关,而h3k4me3与基因启动子活性相关。同样,h3k4上甲基基团的缺失与基因表达的抑制相关。因此,在h3k4上添加以及去除甲基基团构成基因转录开关。还显而易见的是,可以用单-、二-或三甲基基团修饰赖氨酸,每种修饰通过吸引识别所述位点处那些特异甲基化修饰的不同蛋白而具有不同的生物效应。组蛋白甲基化状态调整的一个关键方面是将甲基转移酶和脱甲基化酶募集至特定的基因位点。dna序列特异性结合蛋白,包括转录因子,是通过集聚蛋白质复合物负责该募集的一类蛋白,这些蛋白质复合物结合那些甲基转移酶。仔细研究过的实例是黑腹果蝇三空腔结构蛋白质组(trithroraxgroup)(trxg)反应元件(tre),这些反应元件通过识别tredna序列的转录因子将h3k4甲基转移酶trx募集至特定基因。这些组蛋白甲基化标记被不同蛋白中的甲基-结合结构域识别;这些结构域包括phd指、wd40、和锚蛋白重复序列、cw和pwwp结构域、以及蛋白质的royal超家族。这些蛋白进而决定哪些另外的活性被募集到染色质位点以及最终地决定在给定的基因座处的转录状态。实际上,取决于哪个甲基识别蛋白结合标记的组蛋白,同样的甲基-赖氨酸修饰对转录可具有相反作用。h3k4me2和h3k4me3与转录激活相关,但是当与含phd-结构域的辅阻抑蛋白生长抑制因子家族成员2(ing2)结合时,相关组蛋白去乙酰化酶复合物稳定从而抑制基因表达。因而,这些识别甲基-赖氨酸组蛋白修饰的效应蛋白显著影响转录活性的水平。有选择地通过修饰染色质的状态以改变基因表达的能力允许一种新颖的治疗策略以诱导或抑制基因的表达,这可以提供益处,特别是对以下基因:其表达被病理机制抑制(如某些癌症的情况),或其被生理机制抑制但其去抑制可以在表型上抑制具有互补功能的旁系同源基因中的突变。由于基因复制,基因组中许多基因是基因家族的成员。这些基因被称为彼此的旁系同源物。基因复制后,两个基因的表达模式将以不同的方式演变以部分地控制基因剂量的影响。基因复制后,由自然发生的突变引起的随机遗传漂变和随后的核苷酸序列的选择通常首先在重复基因的非编码区观察到,通常在转录调节区域。调节序列中的dna改变可以影响基因表达的任何或所有方面:表达的量级、它的发展时间、受细胞外刺激的诱导(包括激素或代谢信号)、以及其中表达受限制的细胞类型。在其中复制是最近在进化时间中或其中自然选择保持了高度的蛋白质编码序列相似性的实例中,一种旁系同源物基因a的基因产物可以互补另一旁系同源物基因b的病理性损失或沉默,如果基因a的表达在相同的细胞中不受限制的话。改变基因表达模式可为遗传状况提供重大的治疗益处,其中旁系同源基因的增强表达“拯救”旁系同源物中由突变引起的表型。这可被称为自体同源基因互补。就由atp7b中突变造成的威尔逊病来说,通过atp7a(密切相关铜转运蛋白)的药理学诱导增强的表达可能拯救atp7b(另一种铜转运蛋白)中的突变。每个铜转运蛋白的基本功能已经被保存,但在共同祖先基因的复制之后,这两个基因的表达已经被空间地分开,一个局限于肠上皮细胞,另一个局限于肝细胞。这是旁系同源基因众多实例中的一个实例,其中如果在同一细胞或组织中适当地表达,一个基因可以互补第二基因的损失。旁系同源基因家族的显著实例是充分研究的用于编码血红蛋白的α和β亚单位的α和β球蛋白基因家族。五个各自通过基因重复产生的β-样基因彼此相邻排列在16号染色体上,每个基因按时间特异的方式在人类胚胎和胎儿发育的9个月过程中转录。五个β-样球蛋白具有很高的蛋白质序列相似性,如此之高以至于使成人β球蛋白基因失活的基因突变在临床上可以没有症状,如果β-样球蛋白家族的其他4个亚单元成员中任何一个的表达足够的话。表达激活以及随后的每个特定胚胎和胎儿β-样球蛋白基因的转录沉默部分地由表观遗传机制调节。通过表观遗传沉默的临床药理学操纵经由一个或多个其他β-样基因的转录诱导,β球蛋白基因中突变的拯救(这些突变负责重型地中海贫血或镰状细胞贫血等疾病)在临床上是有益的。相比于用野生型(正常)拷贝替换或修复变异的基因,用突变或病理上沉默基因的功能互补性旁系同源物的药理学剂的自体同源激活可以是一个更有效的治疗策略。对于针对治疗效果来影响组蛋白修饰的活性的兴趣源于观察:在表观遗传调控下特定基因的表达可以通过改变如甲基化等表观遗传标记被改变。就癌症而论,伴随组蛋白脱甲基化酶的过度表达而失去特定的组蛋白甲基化标记与那些伴随更差结果的癌症的复发相关。这些研究表明,特定的肿瘤抑制基因由于甲基化修饰的损失而沉默,进而增强肿瘤性细胞的存活和生长势。这就导致了以下主张,即抑制组蛋白脱甲基化酶活动可能有治疗价值。kdm1a(又称为赖氨酸特异性脱甲基化酶1(lsd1)或aof2或bhc110)是第一种具有特异性赖氨酸脱甲基化酶活性的酶,已被描述明确地表明,组蛋白修饰是可逆的,而不是永久性的。在它的脱甲基化酶底物之中,kdm1a是组蛋白h3赖氨酸脱甲基化酶,其催化h3k4mel或me2以及h3k9mel或me2而非底物h3k4me3的氧化脱甲基。这种酶也使非组蛋白蛋白质(如p53和gfi1)脱甲基。kdm1a含有胺氧化酶结构域,所述结构域以类似于其他单胺(mao)和聚胺氧化酶抑制剂的黄素腺嘌呤二核苷酸(fad)依赖性方式使h3kme底物脱甲基。实际上,mao酶的非特异性抑制剂可以抑制kdm1a的脱甲基化酶活性。kdm1a在许多人类癌症中过度表达,包括肾母细胞瘤、小细胞肺癌、膀胱癌、前列腺癌、乳腺癌、头颈癌、结肠癌和卵巢癌,并且与更频繁的复发相关。kdm1a是前列腺癌中雄激素受体、乳腺癌中雌激素受体、以及神经母细胞瘤中tlx受体介导的转录调节所需要的。敲除kdm1a表达减少癌细胞的增生。kdm1a也在以下癌细胞中过量表达,这些癌细胞是细胞核激素受体非依赖性的,包括er-阴性乳腺癌。kdm1a的强、选择性小分子抑制剂应所述可以用于其中kdm1a活性过多的这些癌症以及其他癌症的治疗。染色质的结构和状态也会影响病原性病毒插入宿主dna、进行转录和复制的能力。由α疱疹病毒单纯性疱疹病毒(hsv)和水痘-带状疱疹病毒(vsv病毒)引起的感染影响感染宿主细胞后染色质的重塑,对抗含有具有转录抑制性标记的组蛋白核小体的快速沉积,这是通过使用病毒编码的转录因子来募集宿主hcf-1助激活因子复合物,所述复合物含有kdm1a和组蛋白h3k4甲基转移酶set1或mll家庭成员。已经证明,抑制感染hsv1的细胞中的kdm1a可以抑制hsvie基因表达、抑制裂解性感染并且减少病毒载量。类似地,抑制kdm1a导致感染有人巨细胞病毒和腺病毒的细胞中的立即早期基因的表达减少,这表明kdm1a在病毒的发病机理中更广泛的作用。kdm1a活性对特定基因转录的影响依赖于通过dna结合蛋白将kdm1a募集至特定基因启动区。就雄激素依赖性基因表达而论,kdm1a与雄激素类固醇受体相关,所述受体特异性靶向雄激素响应基因的启动子中的dna结合位点。因此,结合kdm1a的蛋白质决定脱甲基化酶活性沿着染色体何处靶向。已经报道,许多蛋白质与kdm1a相互作用,包括corest、ctbp、nurd、braf35复合物、dnmt1、mta1/2、mi2beta、rbap46/48、hdac1、2、以及3、tif1β、blimp-1、znf217以及znf198,它们的亚单位形成更大的以及在某些情况下彼此互相排斥的复合物。kdm1a/corest复合物,其可以还包括dnmt1和nurd,在其他因素中,对于特定基因表达的抑制尤其重要。通过位点特异性转录因子将kdm1a募集至基因的启动区。此类因子尤其包括雄激素受体、雌激素受体α、snail1、slug、hivtat、zeb1、rbp-j、pit1、rest、nr2c1、nr2c2以及gfi1b的同种型。取决于细胞类型和特异性转录因子,这些转录因子可募集kdm1a参与基因表达的激活或基因表达的沉默。许多调节染色质状态的酶活性别构性地受到影响或需要作为辅因子代谢中间物、介质或细胞代谢的终产物。基因表达和代谢之间的这些分子间关系为细胞提供了将细胞内部和外部环境(包括营养素)与基因调节表达机制进行连接的信号传导途径。这种细胞传感可以将短期和长期两种调整改变为基因表达模式,其构成历史代谢状态和环境条件的表观遗传记忆。例如β-羟基丁酸酯(长链脂肪酸代谢的产物和哺乳动物在饥饿或长时间运动期间能量的主要来源)抑制i类组蛋白脱乙酰基酶(hdac)而非2b类hdac。因此,饥饿和营养损失的影响可以表观遗传编码和保存。乙酰辅酶a、烟酰胺腺嘌呤二核苷酸(nad)和α-酮戊二酸盐也影响组蛋白甲基化和乙酰化状态。黄素腺嘌呤二核苷酸(fad)是kdm1a需要的辅因子。fad,结合nad和nadp作为细胞氧化还原传感器。kdm1a暂时将fad转化为fadh,之后电子受体(可能是o2及其他受体)通过再生fad以及h2o2完成所述催化性循环。因此,细胞氧化还原态通过其氧化fadh和其他电子受体的能力影响kdm1a活性。在一般意义上,染色质状态(因此的基因表达)可以通过代谢中间物的变化的浓度而改变,并且在kdm1a的特定情况中,活性完全依赖于fad,其浓度随细胞的活力波动。此外,已经显示,kdm1a的抑制可以降低血清葡萄糖、减少肝糖原,并且是强劲的胰岛素促分泌素。因此,kdm1a活性的药物操纵可证明有用于疾病的治疗,这些疾病代表细胞能量状态的病理畸变,包括代谢综合征、血脂异常、糖尿病、肥胖症、厌食、生长不良、恶病质、脂肪代谢障碍和脂肪性肝炎。类固醇激素雌二醇和睾酮及相关化合物在正常发育和病理状态中起着关键的作用,如乳腺癌和前列腺癌,其中肿瘤细胞生长依赖于激素信号。类固醇激素的生物效应由结构上和功能上不同的配体结合受体介导,这些受体起募集至特定的dna结合位点的转录因子的作用。结合配体的类固醇受体作为激素效应的主要转录调节因子。所有类固醇依赖性激素的基因表达的转录激活依赖于染色质结构和辅因子的存在。雌激素受体使用,例如,辅因子src1、src2、aib1、pelp1、cbp、p300、pcaf、carm1、prmt1以及辅阻抑物如ncor、smrt以及mta1。对激素刺激的转录响应依赖于这些辅因子和辅阻抑物之间的相互作用以及染色质的状态,尤其是通过与辅助调节因子相关的组蛋白修饰酶类对组蛋白的修饰。雌激素和雄激素刺激在靶标基因的启动子处诱导若干组蛋白修饰,这些修饰改变乙酰化、磷酸化和局部组蛋白的甲基化状态。为了影响激素应答性基因的最大转录速率,kdm1a活性是需要的。因此,kdma1应所述证明作为用于削弱或消除激素依赖性肿瘤细胞的药物制剂的治疗靶标有用。这种同样的治疗逻辑适用于其他配体-依赖性转录因子,其转录激活部分或完全依赖kdm1a活性,以改变染色质状态以充分促进转录-这些的实例包括维生素d、类视黄醇和脂质-活化的受体。已鉴定出许多治疗剂具有改变基因表达的作用,直接或间接作用于改变染色质状态的蛋白质,通常是酶。尽管它们作用的确切机制尚未完全阐明,这些机制可以从我们对于参与激活特定基因表达的蛋白质复合物的理解推断出来。这些治疗剂包括5’-氮杂胞苷以及5’-氮杂-2’脱氧胞苷(地西他滨),其抑制dnmt1或已知在如γ球蛋白启动子的沉默基因的启动子位点存在并且有活性的其他dna甲基转移酶;伏立诺他和帕比司他或其他组蛋白脱乙酰酶(hdac)酶抑制剂;羟基脲(hu)、丙戊酸钠和丁酸钠及其类似物,每者都可干扰孤核受体的活性。所有这些治疗剂主要在肿瘤性疾病的处理中具有一些临床使用。尽管已经证明这些治疗剂用于其他疾病状态有一些临床效用,这些治疗剂还没有被广泛采用,因为它们适中的治疗效果和它们的毒性。使用对任何驻留在结合至基因启动子的蛋白复合物中的酶活性进行抑制的治疗剂有可能破坏对γ球蛋白基因表达的阻抑,并且导致胎儿血红蛋白(也称为血红蛋白f(hbf))水平的提高。这些靶标包括任何特定蛋白质-蛋白质接触的界面,例如,nurd复合物和kdm1a;例如nr2c1和nr2c2的dna结合识别结构域;例如nr2c1和nr2c2的配体结合域;酶活性,如赖氨酸脱甲基化酶,例如,kdm1a;组蛋白脱乙酰酶(hdac),例如hdac1,2或3;dna甲基转移酶,例如,dnmt1。仍需要用于在细胞和组织中改变基因表达的组合物和方法,所述组合物和方法足以将细胞或组织恢复至正常生理功能(包括,例如在癌症的情况下,适当的细胞凋亡),或足以通过诱导一个或多个基因的充分表达以抑制病理状态来改变细胞、组织、器官或生物体的病理表型。因此,诸位发明人在本文披露了新的化合物、组合物以及用于治疗与kdm1a活性相关疾病的方法。附图说明图1示出无定形的实例1双-甲苯磺酸盐的xrpd衍射图。图2示出实例1双-甲苯磺酸盐形式2的xrpd衍射图;上层是从半结晶固体重结晶的。图3示出从半结晶固体重结晶的实例1双-甲苯磺酸盐形式2的1hnmr光谱。图4示出从半结晶固体重结晶的实例1双-甲苯磺酸盐形式2的dcs和tga。图5示出实例1双-甲苯磺酸盐形式2的xrpd衍射图;上层是在acn中合成的。图6示出在acn中合成的实例1双-甲苯磺酸盐形式2的1hnmr光谱。图7示出在acn中合成的实例1双-甲苯磺酸盐形式2的dcs和tga。图8示出实例1双-甲苯磺酸盐形式2(a)、3(e)、4(d)、和5(分别来自高分辨率和高通量扫描的b和c)的xrpd衍射图;额外的峰与形式2相比,用虚线标注,提示形式3、4、和5的另外的特征。图9示出来自四氢呋喃(f)和甲苯(g)的实例1双-甲苯磺酸盐形式2以及半晶形3的xrpd衍射图;额外的峰与形式2相比,用虚线标注,提示另外的特征。图10示出在各种溶剂的盐实验中回收的固体物质的xrpd衍射图。a是弱结晶硫酸盐;b是无定形的磷酸盐;c是无定形的酒石酸盐;d是无定形的硫酸盐;e是无定形的磷酸盐;f是无定形的酒石酸盐;g是无定形的富马酸盐;h是无定形的硫酸盐;i是无定形的磷酸盐;j是无定形的酒石酸盐;以及k是弱结晶的富马酸盐。图11示出熟化后在各种溶剂的盐实验中回收的固体物质的xrpd衍射图。a是来自mtbe的无定形盐酸盐;b是部分结晶的硫酸盐模式1;c是来自ipa的无定形甲磺酸;d是部分结晶的磷酸盐模式1;e是无定形酒石酸盐;f是无定形的富马酸盐;g是无定形的硫酸盐;h是来自mtbe的无定形甲磺酸;i是无定形的磷酸盐;j是无定形的酒石酸盐;k是无定形的富马酸盐;l是无定形的硫酸盐;m是来自mtbe的无定形甲磺酸;n是无定形磷酸盐;o是无定形的酒石酸盐;以及p是弱结晶的富马酸盐模式1。图12示出在甲基乙基酮的盐实验中回收的固体物质的xrpd衍射图。a是无定形的硫酸盐;b是无定形的草酸盐;c是半乳糖二酸;d是无定形的酒石酸盐;e是无定形的硫酸盐;f是p-tsa(甲苯磺酸盐)形式1;g是无定形的草酸盐;h是半乳糖二酸;i是弱结晶抗坏血酸盐;j是无定形的酒石酸盐。图13示出熟化后在甲基乙基酮的盐实验中回收的固体物质的xrpd衍射图。a是硫酸盐模式2;b是草酸盐形式1;c是半乳糖二酸;d是无定形的酒石酸盐;e是半乳糖二酸;以及f是弱结晶的酒石酸盐。图14示出在mecn的盐实验中回收的固体物质的xrpd衍射图。a是弱结晶硫酸盐;b是弱结晶草酸盐;c是半乳糖二酸;d是无定形的硫酸盐;e是甲苯磺酸盐形式2;f是无定形的草酸盐;g是半乳糖二酸;h是无定形的酒石酸盐。图15示出熟化后在mecn的盐实验中回收的固体物质的xrpd衍射图。a是硫酸盐模式3;b是草酸盐形式1;c是半乳糖二酸;d是无定形的酒石酸盐;e是无定形的草酸盐;f是半乳糖二酸;g是无定形的酒石酸盐。图16是酒石酸盐形式2盐的高分辨率xrpd衍射图。图17是草酸盐形式1盐的高分辨率xrpd衍射图。图18是酒石酸盐形式1盐的高分辨率xrpd衍射图。图19是酒石酸盐形式3盐的高分辨率xrpd衍射图。图20是草酸盐形式2盐的高分辨率xrpd衍射图。图21示出来自第二盐实验的硫酸盐形式的xrpd衍射图。图22示出来自第二盐实验的苯磺酸盐形式的xrpd衍射图。图23示出来自第二盐实验的草酸盐形式的xrpd衍射图。图24是来自第二盐实验的富马酸盐形式的xrpd衍射图。图25是来自第二盐实验的苯磺酸盐的xrpd衍射图。图26是来自第二盐实验的l-苹果酸盐的xrpd衍射图。图27是来自第二盐实验的l-苹果酸盐的xrpd衍射图。具体实施方式因此,本文提供了具有化学式(i)的化合物:或其盐、多晶型物、或溶剂化物,其中:y选自键、nr4a、o、c(o)nh、nhc(o)、s、so2、choh、以及ch2;z选自键、nr4b、o、c(o)nh、nhc(o)、s、so2、以及ch2;m选自0、1、2、3、4、和5;n选自0、1、2、和3;r1和r2各自独立地选自烷基、氨基烷基、烷基磺酰基烷基、烷氧基烷基、芳基、芳基烷基、环烷基、环烷基烷基、苯基、联苯、杂芳基、杂芳基烷基、杂环烷基、以及杂环烷基烷基,并且r1和r2连同它们附接的氮一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被0和3个之间的r6基团取代;r3选自烷基氨基、环烷基氨基、芳基氨基、杂芳基氨基、杂环烷基氨基、环烷基、环烷基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基、杂环烷基、以及杂环烷基烷基,这些基团中的任意基团可任选地被0和3个之间的r6基团取代;r4、r4a、以及r4b独立地选自氢、烷基、烯基、炔基、以及环烷基;r5选自芳基以及杂芳基,所述基团中的任意基团可任选地被0和3个之间的r6基团取代;每个r6独立地选自氢、卤素、烷基、烷基磺酰基芳基、烯基、炔基、环烷基、卤代烷基、卤代烷氧基、卤代芳基、烷氧基芳基、芳基、芳氧基、芳烷基、杂环烷基、杂芳基、烷基杂芳基、杂芳基烷基、氰基、烷氧基、烷氧基芳基、氨基、烷基氨基、二烷基氨基、氧代、cor7、so2r7、nhso2r7、nhso2nhr7、nhcor7、nhconhr7、conhr7、以及conr7r8;并且r7和r8独立地选自氢、芳基、和低级烷基;或r7和r8可以一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被低级烷基取代。在某些实施例中,所述化合物具有化学式ia、ib、ic、或id::或其盐、多晶型物、或溶剂化物,其中所有基团是如针对化学式i所定义的。在某些实施例中,所述化合物具有化学式ii或iii:或其盐、多晶型物、或溶剂化物,其中所有基团是如针对化学式i所定义的。在某些实施例中,所述化合物具有化学式iia、iib、iic、或iid:或其盐、多晶型物、或溶剂化物,其中所有基团是如针对化学式i所定义的。考虑到所有的顺式和反式异构体。在某些实施例中,z是nr4b。在某些实施例中,r4b选自甲基和氢。在某些实施例中,r4b是氢。在某些实施例中,所述烷基,不论其本身还是作为另一个非环状取代基的指定部分,是c1-c8烷基。在某些实施例中,r3是芳基,所述芳基可任选地被0和3个之间的r6基团取代。在某些实施例中,r3选自芳基和杂芳基,其中的任一者被r6基团(称为r6a)取代,所述r6基团选自杂芳基、氰基、和s(o)2n(ch3)2。在某些实施例中,r3保持任选地被1-2个另外的r6基团取代。在某些实施例中,m是0;y是ch2;并且n选自0、1、和2。在某些实施例中,m是0;y是ch2;并且n是2。在某些实施例中,r3选自苯基和杂芳基,其中的任一者被r6基团(称为r6a)取代,所述r6基团选自杂芳基、氰基、和s(o)2n(ch3)2。在某些实施例中,r6a选自氰基、s(o)2n(ch3)2、在某些实施例中,r6a是杂芳基。在某些实施例中,r6a选自:在某些实施例中,r6a是在某些实施例中,r4是氢。在某些实施例中,由r1和r2连同它们附接到其上的氮一起形成的含氮杂环烷基或杂芳基环含有3至8个原子。在某些实施例中,r1和r2一起形成含氮杂环烷基,所述含氮杂环烷基可任选地被0和3个之间的r6基团取代。在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基是:在某些实施例中,所述含氮杂环烷基任选地被选自烷基和氧代的0和3个之间的r6基团取代。在某些实施例中,r5是苯基,所述苯基可任选地被0和3个之间的r6基团取代。在某些实施例中,r5是:其中r6b选自卤素和羟基。在某些实施例中,r6b选自氟、甲氧基、和羟基。在某些实施例中,r6b是氟。在某些实施例中,r4b选自甲基和氢。在某些实施例中,r4b是氢。在某些实施例中,所述化合物具有化学式iv:或其盐、多晶型物、或溶剂化物,其中:y选自键、nr4a、o、c(o)nh、nhc(o)、s、so2、choh、以及ch2;z选自键、nr4b、o、c(o)nh、nhc(o)、s、so2、以及ch2;m选自0、1、2、3、4、和5;n选自0、1、2、和3;r1和r2各自独立地选自烷基、氨基烷基、烷基磺酰基烷基、烷氧基烷基、芳基、芳基烷基、环烷基、环烷基烷基、苯基、联苯、杂芳基、杂芳基烷基、杂环烷基、以及杂环烷基烷基,并且r1和r2连同它们附接的氮一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被0和3个之间的r6基团取代;r3选自烷基氨基、环烷基氨基、芳基氨基、杂芳基氨基、杂环烷基氨基、环烷基、环烷基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基、杂环烷基、以及杂环烷基烷基,这些基团中的任意基团可任选地被0和3个之间的r6基团取代;r4a和r4b独立地选自氢、烷基、烯基、炔基、以及环烷基;r5选自芳基以及杂芳基,所述基团中的任意基团可任选地被0和3个之间的r6基团取代;r6a选自杂芳基、氰基、和s(o)2n(ch3)2;每个r6独立地选自氢、卤素、烷基、烷基磺酰基芳基、烯基、炔基、环烷基、卤代烷基、卤代烷氧基、卤代芳基、烷氧基芳基、芳基、芳氧基、芳烷基、杂环烷基、杂芳基、烷基杂芳基、杂芳基烷基、氰基、烷氧基、烷氧基芳基、氨基、烷基氨基、二烷基氨基、氧代、cor7、so2r7、nhso2r7、nhso2nhr7、nhcor7、nhconhr7、conhr7、以及conr7r8;并且r7和r8独立地选自氢、芳基、和低级烷基;或r7和r8可以一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被低级烷基取代。在某些实施例中,z是nr4b。在某些实施例中,r4b选自甲基和氢。在某些实施例中,r4b是氢。在某些实施例中,所述烷基,不论其本身还是作为另一个非环状取代基的指定部分,是c1-c8烷基。在某些实施例中,m是0;y是ch2;并且n选自0、1、和2。在某些实施例中,n是2。在某些实施例中,r1和r2各自独立地选自烷基、氨基烷基、烷基磺酰基烷基、烷氧基烷基、以及杂芳基,并且r1和r2连同它们附接的氮一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被0和3个之间的r6基团取代。在某些实施例中,由r1和r2连同它们附接到其上的氮一起形成的含氮杂环烷基或杂芳基环含有3至8个原子。在某些实施例中,r1和r2一起形成含氮杂环烷基,所述含氮杂环烷基可任选地被0和3个之间的r6基团取代。在某些实施例中,所述含氮杂环烷基任选地被0和3个之间的r6基团取代,所述r6基团选自烷基、烷氧基、烷氧基烷基、卤素、卤代烷基、卤代烷氧基、羟基、羟基烷基、烷基磺酰基、烷基磺酰基烷基、氘、三氘代甲基、氨基、-cooh、-conh2、-so2ch3、氰基、螺-杂环烷基、杂芳基、以及氧代。在某些实施例中,所述含氮杂环烷基任选地被0和3个之间的r6基团取代,所述r6基团选自烷基、卤素、conh2、so2ch3、氰基、螺-杂环烷基、以及氧代。在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基是:在某些实施例中,r6a是杂芳基。在某些实施例中,r6a选自氰基、s(o)2n(ch3)2、在某些实施例中,r6a选自在某些实施例中,r5是苯基,所述苯基可任选地被0和3个之间的r6基团取代。在某些实施例中,r5是:其中r6b选自卤素、羟基、和甲氧基。在某些实施例中,r6b选自氟、甲氧基、和羟基。在某些实施例中,r6b是氟。在某些实施例中,所述化合物具有化学式v:或其盐、多晶型物、或溶剂化物,其中:r1和r2各自独立地选自烷基、氨基烷基、烷基磺酰基烷基、烷氧基烷基、芳基、芳基烷基、环烷基、环烷基烷基、苯基、联苯、杂芳基、杂芳基烷基、杂环烷基、以及杂环烷基烷基,并且r1和r2连同它们附接的氮一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被0和3个之间的r6基团取代;r4b选自氢、烷基、烯基、炔基、以及环烷基;r6a选自杂芳基、氰基、和s(o)2n(ch3)2;每个r6和每个r6b独立地选自氢、卤素、烷基、烷基磺酰基芳基、烯基、炔基、环烷基、卤代烷基、卤代烷氧基、卤代芳基、烷氧基芳基、芳基、芳氧基、芳烷基、杂环烷基、杂芳基、烷基杂芳基、杂芳基烷基、氰基、烷氧基、烷氧基芳基、氨基、烷基氨基、二烷基氨基、氧代、cor7、so2r7、nhso2r7、nhso2nhr7、nhcor7、nhconhr7、conhr7、以及conr7r8;并且r7和r8独立地选自氢、芳基、和低级烷基;或r7和r8可以一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被低级烷基取代。在某些实施例中,r4b选自甲基和氢。在某些实施例中,r4b是氢。在某些实施例中,r6a选自氰基、s(o)2n(ch3)2、在某些实施例中,r1和r2各自独立地选自烷基、氨基烷基、烷基磺酰基烷基、烷氧基烷基、以及杂芳基,并且r1和r2连同它们附接的氮一起形成含氮杂环烷基或杂芳基环,所述含氮杂环烷基或杂芳基环可任选地被0和3个之间的r6基团取代。在某些实施例中,由r1和r2连同它们附接到其上的氮一起形成的含氮杂环烷基或杂芳基环含有3至8个原子。在某些实施例中,r1和r2一起形成含氮杂环烷基,所述含氮杂环烷基可任选地被0和3个之间的r6基团取代。在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基选自:在某些实施例中,所述含氮杂环烷基是:在某些实施例中,r6b选自氟、甲氧基、和羟基。在某些实施例中,r6b是氟。还提供了一些实施例,其中以上段落[057]-[0122]中上述任何实施例可与这些实施例中一个或多个组合,只要所述组合不互相排斥。如本文使用的,当一个被定义为不能与另一个重叠时,两个实施例“是互相排斥的”。例如,其中y是ch2的实施例与其中y是nr4b的实施例是互相排斥的。然而,其中r1和r2一起形成含氮杂环烷基的实施例与其中r5是任选地被氟取代的苯基的实施例不互相排斥。在某些实施例中,所述化合物选自本文披露的实例、或其盐、多晶型物、或溶剂化物。在某些实施例中,所述化合物选自本文披露的实例、或其盐、多晶型物、或溶剂化物,其中r6a选自杂芳基、氰基、和s(o)2n(ch3)2。在某些实施例中,所述化合物选自本文披露的实例、或其盐、多晶型物、或溶剂化物,其中r6a选自杂芳基和氰基。在某些实施例中,所述化合物选自本文披露的实例、或其盐、多晶型物、或溶剂化物,其中r6a是杂芳基。表1:化合物实例本文还提供了如本文披露的化合物的盐、或其多晶型物或溶剂化物。在某些实施例中,所述盐具有化学式vi:或其多晶型物或溶剂化物,其中:x选自甲苯磺酸盐、硫酸盐、酒石酸盐、草酸盐、苯磺酸盐、富马酸盐、柠檬酸盐、乙磺酸盐、以及苹果酸盐;并且q是选自1和2的整数。在某些实施例中,x是甲苯磺酸盐。在某些实施例中,q是2。本文提供了n-((s)-5-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基)-4-(1h-1,2,3-三唑-1-基)苯甲酰胺双-甲苯磺酸盐,或其多晶型物。本文还提供了n-((s)-5-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基)-4-(1h-1,2,3-三唑-1-基)苯甲酰胺双-甲苯磺酸盐形式2。本文还提供了如本文披露的化合物的甲苯磺酸盐,或其多晶型物或溶剂化物。本文还提供了如本文披露的化合物的双-甲苯磺酸盐,或其多晶型物或溶剂化物。本文还提供了化合物、或其盐、多晶型物、或溶剂化物,如本文披露的提供用作药物。本文还提供了如本文披露的化合物、或其盐、多晶型物、或溶剂化物,用于制造用于在预防或治疗kdm1a-介导的疾病的药物。本文还提供了如本文披露的化合物,用于制造用于预防或治疗疾病或病症的药物,所述疾病或病症选自镰状细胞病、重型地中海贫血、及其他β-血红蛋白病。本文还提供了药物组合物,所述药物组合物包含如本文披露的化合物,连同药学上可接受的载体。在某些实施例中,将所述药物组合物配制成用于口服给予。在某些实施例中,所述药物组合物另外包含另一种治疗剂。本文还提供了抑制kdm1a的方法,所述方法包括将kdm1a与如本文披露的化合物接触。本文还提供了用于治疗kdm1a-介导的疾病的方法,所述方法包括向对其有需要的患者给予治疗有效量的如本文披露的化合物、或其盐、多晶型物、或溶剂化物。在某些实施例中,所述疾病是癌症。在某些实施例中,所述癌症选自尤因氏肉瘤、多发性骨髓瘤、t细胞白血病、肾母细胞瘤、小细胞肺癌、膀胱癌、前列腺癌、乳腺癌、头/颈癌、结肠癌、以及卵巢癌。在某些实施例中,所述疾病是骨髓性疾病。在某些实施例中,所述骨髓性疾病选自骨髓纤维化、真性红细胞增多症、原发性血小板增多症、骨髓增生异常综合症(mds)、急性骨髓性白血病(aml)、以及慢性骨髓性白血病(cml)。在某些实施例中,所述疾病是炎性疾病。在某些实施例中,所述炎性疾病选自炎性肠病、类风湿关节炎、或系统性红斑狼疮。本文还提供了用于治疗球蛋白-介导的疾病的方法,所述方法包括向对其有需要的患者给予治疗有效量的如本文披露的化合物、或其盐、多晶型物、或溶剂化物。本文还提供了用于在患者中达到效果的方法;所述方法包括给予治疗有效量的如本文披露的化合物;其中所述效果选自:红血细胞计数增加;含有胎儿血红蛋白的红细胞的红血细胞计数增加;红细胞中胎儿血红蛋白的总浓度升高;网织红细胞中胎儿血红蛋白的总浓度升高;骨髓源性红细胞前体例如原成红细胞中γ球蛋白基因的转录增加;单位时间内患者经历镰状细胞危象的次数减少;停止或预防在例如心脏、脾、脑或肾中由镰状化细胞引起的组织损伤;根据在体外测定中使用患者血液测量的、在相对缺氧的生理条件下经历镰状化的红细胞的比例降低;使用衍生自受治疗患者的细胞、根据chip所测定在γ球蛋白启动子处或附近,在赖氨酸位置4(h3k4me1以及h3k4me2)处组蛋白3赖氨酸甲基化的数量增加、和/或在赖氨酸位置9(h3k9me1或h3k4me2)处组蛋白3甲基化的数量减少。本文还提供了抑制至少一种kdm1a功能的方法;所述方法包括将kdm1a与如本文披露的化合物接触的步骤;其中通过以下来测量所述抑制:培养的或者在人类或小鼠或含有人类β球蛋白基因座或其部分的转基因小鼠体内的红细胞或其前体的表型,癌细胞增生的能力,已知受kdm1a活性调节的特定基因(如γ球蛋白)的表达,组蛋白甲基化状态的变化,已知被kdm1a脱甲基化的蛋白(如g9a或suv39h1)的甲基化状态的变化,受kdm1a-调节的基因的表达,或kdm1a与天然结合配偶体(如corest、dnmt1或hdac)的结合。单独抑制kdm1a(lsd1)活性对于一些疾病的治疗可为充分治疗;对于其他如癌症的疾病,组合疗法通常具有加成或协同治疗效果,并且甚至可能必然实现所需的全部临床益处。存在具体的科学证据使得kdm1a的抑制剂与全反式维甲酸(atra)、三氧化二砷、dna甲基转移酶的抑制剂(如5’-氮杂胞苷以及5’-氮杂-2’脱氧胞苷)、nfκb信号的抑制剂(如舒林酸)或常规的抗肿瘤剂(如蒽环类抗肿瘤抗生素)或核苷类似物(如胞嘧啶阿拉伯糖苷)的组合合理化。同样地,诱导白血病干细胞进入细胞周期的治疗剂(g-csf、gm-csf、干细胞因子、促血小板生成素(tpo))或使细胞因子(tpo、ccl3(mip-1))在重建癌症干细胞生态位中的贡献作用无效的治疗剂可用作包括lsd1抑制剂的组合的一部分。缩写与定义为了有助于对本披露的理解,如本文使用的大量术语和缩写定义如下:当介绍本披露或其一个或多个优选实施例的要素时,冠词“一个/一种”(“a”、“an”)、“所述”(“the”和“said”)旨在表示存在这些要素中的一个或多个。术语“包含”、“包括”和“具有”旨在为包括在内的并且意指可存在除所列要素之外的另外的要素。当术语“和/或”在两项或更多项的列表中使用时,意指所列出项的任何一项可以单独或与所列出项的任何一项或多项组合使用。例如,表述“a和/或b”旨在意指a和b之一或二者,即单独a、单独b或a和b组合。表述“a、b和/或c”旨在意指单独a、单独b、单独c、a和b组合、a和c组合、b和c组合或a、b和c组合。如本文使用的术语“约”当是指一个可测量的值如化合物的量、剂量、时间、温度等时意在涵盖与指定量的20%、10%、5%、1%、0.5%、或甚至0.1%的变化。“治疗有效量”的药物是药物或其药学上可接受的盐消除、减轻或为其所针对的疾病的症状提供缓解所给予的数量。“对其有需要的受试者”是展示疾病的一种或多种症状或指标的人类或非人动物。当披露数值范围,以及使用符号“从n1…至n2”或“在n1…和n2之间”时,其中n1和n2是数字,则除非另外说明,该符号旨在包括这些数字本身以及它们之间的范围。此范围可以是整的或在这些端值之间连续的并且包括这些端值。通过举例,范围“从2至6个碳原子”旨在包括两个、三个、四个、五个以及六个碳原子,因为碳原子以整数单位出现。比较,通过举例,范围“从1至3μm(微摩尔)”(其旨在包括1μm、3μm、以及之间所有数)与有效数字的任何数字(例如,1.255μm、2.1μm、2.9999μm等)。当在“0个碳原子”的上下文中n设定为0时,其旨在表明一个键或无。如本文使用的,术语“烷基磺酰基”意指如本文所定义的烷基基团,其通过如本文所定义的磺酰基基团附加于母体分子部分。烷基磺酰基的代表性实例包括但不限于甲基磺酰基和乙基磺酰基。如本文使用的术语“烷基磺酰基烷基”表示如本文所定义的烷基磺酰基基团,其通过如本文所定义的烷基附加于母体分子部分。烷基磺酰基烷基的代表性实例包括但不限于甲基磺酰基甲基和乙基磺酰基甲基。如本文单独或组合使用的,术语“酰基”是指附接到烯基、烷基、芳基、环烷基、杂芳基、杂环、或任何其他部分上的羰基,其中附接到羰基上的原子是碳。“乙酰基”基团是指-c(o)ch3基团。“烷基羰基”或“烷酰基”基团是指通过羰基基团附接到母体分子部分上的烷基基团。此类基团的实例包括甲基羰基和乙基羰基。酰基基团的实例包括甲酰基、烷酰基和芳酰基。如本文单独或组合使用的,术语“烯基”是指具有一个或多个双键且含有从2至20个碳原子的直链或支链烃基团。在某些实施例中,所述烯基包含从2至6个碳原子。术语“亚烯基”是指附接在两个或更多个位置处的碳-碳双键系统,如亚乙烯基[(-ch=ch-),(-c::c-)]。合适烯基基团的实例包括乙烯基、丙烯基、2-甲基丙烯基、1,4-丁二烯基等。除非另外说明,术语“烯基”可包括“亚烯基”基团。如本文单独或组合使用的,术语“烷氧基”是指烷基醚基团,其中术语烷基是如下所定义的。合适烷基醚基团的实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基等。如本文单独或组合使用的,术语“烷基”是指含有从1至20个碳原子的直链或支链烷基基团。在某些实施例中,所述烷基包含从1至10个碳原子。在另外的实施例中,所述烷基包含从1至6个碳原子。烷基基团可以如本文限定的可任选地进行取代。烷基基团的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基、辛基、壬基等。如本文单独或组合使用的,术语“亚烷基”是指衍生自附接在两个或更多个位置处的直链或支链饱和烃的饱和脂肪族基团,如亚甲基(-ch2-)。除非另外说明,术语“烷基”可包括“亚烷基”基团。如本文单独或组合使用的,术语“烷基氨基”是指通过氨基基团附接到母体分子部分上的烷基基团。适合的烷基氨基基团可以是单烷基化的或二烷基化的形成的基团,像例如n-甲基氨基、n-乙基氨基、n,n-二甲基氨基、n,n-乙基甲基氨基等。如本文单独或组合使用的,术语“亚烷基”是指烯基基团,其中碳-碳双键的一个碳原子属于烯基所附接的部分。如本文单独或组合使用的,术语“烷硫基”是指烷基硫醚(r-s-)基团,其中术语烷基是如上所定义的,并且其中硫可以是单或双氧化的。适合的烷基硫醚基团的实例包括甲硫基、乙硫基、正丙硫基、异丙硫基、正丁硫基、异丁硫基、仲丁硫基、叔丁硫基、甲磺酰基、乙磺酰基等。如本文单独或组合使用的,术语“炔基”是指具有一个或多个三键并且含有从2至20个碳原子的直链或支链烃基团。在某些实施例中,所述炔基包含从2至6个碳原子。在另外的实施例中,所述炔基包含从2至4个碳原子。术语“亚炔基”是指附接在两个位置处的碳-碳三键,如亚乙炔基(-c≡c-)。炔基基团的实例包括乙炔基、丙炔基、羟丙炔基、丁炔-1-基、丁炔-2-基、戊炔-1-基、3-甲基丁炔-1-基、己炔-2-基等。除非另外说明,术语“炔基”可包括“亚炔基”基团。如本文单独或组合使用的,术语“酰胺基”和“氨甲酰基”是指如下所述通过羰基基团附接到母体分子部分上的氨基基团,或反之亦然。如本文单独或组合使用的,术语“c-酰胺基”是指-c(=o)-nr2基团,其中r是如本文所定义的。如本文单独或组合使用的,术语“n-酰胺基”是指rc(=o)nh-基团,其中r如本文所定义的。如本文单独或组合使用的,术语“酰基氨基”包括通过氨基基团附接到母体部分上的酰基基团。“酰基氨基”基团的实例是乙酰基氨基(ch3c(o)nh-)。如本文单独或组合使用的,术语“氨基”是指-nrr’,其中r和r’独立地选自氢、烷基、羟基烷基、酰基、杂烷基、芳基、环烷基、杂芳基、以及杂环烷基,这些基团中的任何基团可以本身被任选取代。此外,r和r’可以结合以形成杂环烷基,这两个基团中的任一者可以任选地被取代。如本文单独或组合使用的,术语“氨基酸”是指-nhchrc(o)o-基团,可以将所述基团附接至母体分子部分以给出n-末端或c-末端的氨基酸,其中r独立地选自氢、烷基、芳基、杂芳基、杂环烷基、氨基烷基、酰胺基、酰胺基烷基、羧基、羧烷基、胍烷基、羟基、硫醇、以及硫代烷基,这些基团中的任何基团可以本身被任选地取代。如本文单独或组合使用的,术语c-末端是指母体分子部分,所述母体分子部分在氨基基团处结合至氨基酸以给出如本文描述的酰胺,伴有非结合的羧基基团,产生末端羧基基团,或相应的羧酸阴离子。如本文单独或组合使用的,术语n-末端是指母体分子部分,所述母体分子部分在羧基基团处结合至氨基酸以给出如本文描述的酰胺,伴有非结合的氨基基团,产生末端仲胺,或相应的铵阳离子。换言之,c-末端是指-nhchrc(o)oh或是指-nhchrc(o)o-,并且n-末端是指h2nchrc(o)o-或是指h3n+chrc(o)o-。如本文单独或组合使用的,术语“氨基烷基”是指将如本文所定义的氨基基团通过烷基基团连接至母体部分。如本文单独或组合使用的,术语“芳基”意指含有一个、两个或三个环的碳环芳香族系统,其中此类多环的环系统被融合在一起。术语“芳基”包括芳香族基团,如苯基、萘基、蒽基和菲基。如本文单独或组合使用的,术语“芳基烯基”或“芳烯基”是指通过烯基基团附接到母体分子部分上的芳基基团。如本文单独或组合使用的,术语“芳基烷氧基”或“芳烷氧基”是指通过烷氧基基团附接到母体分子部分上的芳基基团。如本文单独或组合使用的,术语“芳基烷基”或“芳烷基”是指通过烷基基团附接到母体分子部分上的芳基基团。如本文单独或组合使用的,术语“芳基炔基”或“芳炔基”是指通过炔基基团附接到母体分子部分上的芳基基团。如本文单独或组合使用的,术语“芳基烷酰基”或“芳烷酰基”或“芳酰基”是指衍生自芳基取代的链烷羧酸的酰基基团,如苯甲酰基、萘甲酰基、苯基乙酰基、3-苯基丙酰基(氢肉桂酰基)、4-苯基丁酰基、(2-萘基)乙酰基、4-氯氢肉桂酰基等。如本文单独或组合使用的,术语“芳氧基”是指通过氧基附接到母体分子部分上的芳基基团。如本文单独或组合使用的,术语“苯并(benzo)”和“苯并(benz)”是指衍生自苯的二价基团c6h4=。实例包括苯并噻吩和苯并咪唑。如本文使用的,术语“联苯”是指在每个环上的一个碳位点处连接的两个苯基基团。如本文单独或组合使用的,术语“氨基甲酸酯”是指氨基甲酸的酯(-nhcoo-),其可以从氮或酸端附接到母体分子部分上,并且其可以如本文所定义的任选地被取代。如本文单独或组合使用的,术语“o-氨甲酰基”是指-oc(o)nrr’基团,其中r和r’如本文所定义的。如本文单独或组合使用的,术语“n-氨甲酰基”是指roc(o)nr’-基团,其中r和r’是如本文所定义的。如在此使用的,术语“羰基”当单独时包括甲酰基[-c(o)h],并且当组合时是-c(o)-基团。如本文使用的,术语“羧基(carboxyl)”或“羧基(carboxy)”是指-c(o)oh或对应的“羧酸”阴离子,如在羧酸盐中。“o-羧基”基团是指rc(o)o-基团,其中r是如本文所定义的。“c-羧基”基团是指-c(o)or基团,其中r是如本文所定义的。如本文单独或组合使用的,术语“氰基”是指-cn。如本文单独或组合使用的,术语“环烷基”或可替代地“碳环”是指饱和的或部分饱和的单环的、二环的或三环的烷基基团,其中每个环部分含有从3至12个碳原子环成员,并且其可以任选地是如本文所定义的任选地被取代的苯并稠合环系统。在某些实施例中,所述环烷基包含从5至7个碳原子。此类环烷基基团的实例包括环丙基、环丁基、环戊基、环己基、环庚基、四氢萘基、茚满基、八氢萘基、2,3-二氢-1h-茚基、金刚烷基等。如本文使用的,“二环的”和“三环的”旨在包括两种稠合环系统,如十氢萘、八氢萘以及多环的(多中心的)饱和或部分不饱和类型。通常,异构体的后者类型通过以下各项来例示:二环[1,1,1]戊烷、樟脑、金刚烷和二环[3,2,1]辛烷。如本文单独或组合使用的,术语“酯”是指对在碳原子处连接的两个部分进行桥接的羧基基团。如本文单独或组合使用的,术语“醚”是指对在碳原子处连接的两个部分进行桥接的氧基基团。如本文单独或组合使用的,术语“胍”是指-nhc(=nh)nh2,或相应的胍基阳离子。如本文单独或组合使用的,术语“卤基”或“卤素”是指氟、氯、溴或碘。如本文单独或组合使用的,术语“卤代烷氧基”是指通过氧原子附接到母体分子部分上的卤代烷基基团。如本文单独或组合使用的,术语“卤代烷基”是指具有如以上限定的相同含义的烷基基团,其中将一个或多个氢原子被卤素代替。确切地包括了单卤代烷基、双卤代烷基和多卤代烷基基团。举一个实例,单卤代烷基可以在所述基团内具有碘、溴、氯或氟原子。二卤和多卤代烷基可以具有两个或多个相同的卤原子或不同的卤素基团的组合。卤代烷基基团的实例包括氟甲基、二氟甲基、三氟甲基、氯甲基、二氯甲基、三氯甲基、五氟乙基、七氟丙基、二氟氯甲基、二氯氟甲基、二氟乙基、二氟丙基、二氯乙基和二氯丙基。“卤亚烷基”是指附接在两个或更多个位置处的卤代烷基基团。实例包括氟亚甲基(-cfh-)、二氟亚甲基(-cf2-)、氯亚甲基(-chcl-)等。如本文单独或组合使用的,术语“杂烷基”是指稳定的直链烃基或支链烃基、或环烃基基团、或其组合,其为完全饱和的或含有从1至3个不饱和度,其由所述数量的碳原子和从1至3个选自o、n、和s的杂原子组成,并且其中可以将所述氮和硫原子任选地氧化并且可以将氮杂原子任选地季铵化。一种或多种杂原子o、n和s可以放置在杂烷基基团的任意内部位置处。多达两个杂原子可以是连续的,像例如-ch2-nh-och3。如本文单独或组合使用的,术语“杂芳基”是指3至7元不饱和的杂单环,或稠合的单环的、二环的或三环的环系统,其中稠环中至少一个是芳香族的,其含有至少一个选自o、s和n的原子。在某些实施例中,所述杂芳基将包含从5至7个碳原子。所述术语还包括稠合的多环基团,其中将杂环与芳基环稠合,其中将杂芳基环与其他杂芳基环稠合,其中将杂芳基环与杂环烷基环稠合,或其中将杂芳基环与环烷基环稠合。杂芳基基团的实例包括吡咯基、吡咯啉基、咪唑基、吡唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三唑基、吡喃基、呋喃基、噻吩基、噁唑基、异噁唑基、噁二唑基、噻唑基、噻二唑基、异噻唑基、吲哚基、异吲哚基、吲嗪基、苯并咪唑基、喹啉基、异喹啉基、喹喔啉基、喹唑啉基、吲唑基、苯并三唑基、苯并间二氧杂环戊烯、苯并吡喃基、苯并噁唑基、苯并噁二唑基、苯并噻唑基、苯并噻二唑基、苯并呋喃基、苯并噻吩基、色酮基、香豆素基、苯并吡喃基、四氢喹啉基、四唑并哒嗪基、四氢异喹啉基、噻吩并吡啶基、呋喃并吡啶基、吡咯并嘧啶基、氮杂卓基、二氮杂卓基、苯并氮杂卓基等。示例性三环杂环基团包括咔唑基、苯并吲哚基、菲咯啉基、二苯并呋喃基、吖啶基、菲啶基、咕吨基等。如本文单独或作为其他基团的部分使用的,术语“杂芳基烷基”是指如以上定义的的具有杂芳基取代基的烷基基团。如本文单独或组合使用的,术语“杂环烷基”和可互换地“杂环”每个是指含有至少一个杂原子作为环原子的饱和、部分不饱和的、或完全不饱和的单环、二环、或三环杂环基团,其中每个所述杂原子可以独立地选自氮、氧、和硫。在某些实施例中,所述杂环烷基包含从1至4个杂原子作为环成员。在另外的实施例中,所述杂环烷基包含从1至2个杂原子作为环成员。在某些实施例中,所述杂环烷基在每个环中包含从3至8个环成员。在另外的实施例中,所述杂环烷基在每个环中包含从3至7个环成员。在又另外的实施例中,所述杂环烷基在每个环中包含从5至6个环成员。“杂环烷基”和“杂环”旨在包括砜、亚砜、叔氮环成员的n-氧化物,和碳环稠合环系统以及苯并稠合环系统;此外,两个术语也包括杂环的环稠合至(如本文定义的)芳基基团或另外的杂环基团的系统。杂环基基团的实例包括吖丙啶基、氮杂环丁烷基、1,3-苯并间二氧杂环戊烯、二氢异吲哚基、二氢异喹啉基、二氢噌啉基、二氢苯并二噁英基、二氢[1,3]噁唑并[4,5-b]吡啶基、苯并噻唑基、二氢吲哚基、二氢吡啶基、1,3-二噁烷基、1,4-二噁烷基、1,3-二氧戊环基、咪唑烷基、异异二氢吲哚基、吗啉基、噁唑烷基、异噁唑烷基、哌啶基、哌嗪基、甲基哌嗪基、n-甲基哌嗪基、吡咯烷基、吡唑烷基、四氢呋喃基、四氢吡啶基、硫代吗啉基、噻唑烷基、二氮杂卓基等。除非明确地禁止,可以将杂环基团任选地进行取代。如本文单独或组合使用的,术语“肼基”是指由单键接合的两个氨基基团,即-n-n-。如本文单独或组合使用的,术语“羟基”是指-oh。如本文单独或组合使用的,术语“羟基烷基”是指通过烷基基团附接到母体分子部分上的羟基基团。如本文单独或组合使用的,术语“氧肟酸”是指-c(=o)nhoh,其中母体分子部分借助碳原子附接至氧肟酸基团。短语“在主链中”是指起始于基团到具有本文披露的化学式中任一项的化合物的附接点的碳原子的最长连续链或邻链。短语“原子的线性链”是指原子的最长直链,这些原子独立地选自碳、氮、氧和硫。如本文单独或组合使用的,在没有另外明确定义的情况下,术语“低级”意指含有从1至6个碳原子,并且包括6个碳原子。如本文单独或组合使用的,术语“低级芳基”意指苯基或萘基,其如所提供的可任选地进行取代。如本文单独或组合使用的,术语“低级杂芳基”意指1)包含五个或六个环成员的单环杂芳基,其中在一和四个所述成员之间可以是选自o、s、和n的杂原子,或2)二环杂芳基,其中每个稠环包含五个或六个环成员,这些稠环在其中包含一至四个选自o、s、和n的杂原子。如本文单独或组合使用的,术语“低级环烷基”意指具有三个和六个环成员之间的单环的环烷基。低级环烷基可以是不饱和的。低级环烷基的实例包括环丙基、环丁基、环戊基和环己基。如本文单独或组合使用的,术语“低级杂环烷基”意指具有三个和六个环成员之间的单环杂环烷基,这些环成员中的一个和四个之间可以是选自o、s和n的杂原子。低级杂环烷基的实例包括吡咯烷基、咪唑烷基、吡唑烷基、哌啶基、哌嗪基和吗啉基。低级杂环烷基可以是不饱和的。如本文单独或组合使用的,术语“低级氨基”是指-nrr’,其中r和r’独立地选自氢、低级烷基、以及低级杂烷基,这些基团中的任何基团可以被任选地取代。此外,低级氨基基团的r和r’可以结合以形成五元或六元杂环烷基,其中的任一者可以任选地被取代。如本文单独或组合使用的,术语“硝基”是指-no2。如本文单独或组合使用的,术语“氧基”或“氧杂”是指-o-。如本文单独或组合使用的,术语“氧代”是指=o。术语“全卤代烷氧基”是指烷氧基基团,其中所有的氢原子都被卤素原子代替。如本文单独或组合使用的,术语“全卤代烷基”是指烷基基团,其中所有的氢原子都被卤素原子代替。如本文单独或组合使用的,术语“磷酸酯”是指-p(=o)(or)2基团,其中r选自烷基和芳基。如本文单独或组合使用的,术语“磷酸”是指-p(=o)(oh)2基团。如本文单独或组合使用的,术语“磺酸(sulfonate、sulfonicacid和sulfonic)”是指-so3h基团并且以盐形式使用其作为磺酸的阴离子。如本文单独或组合使用的,术语“磺酰基”是指-s-。如本文单独或组合使用的,术语“亚磺酰基”是指-s(o)-。如本文单独或组合使用的,术语“磺酰基”是指-s(o)2-。术语“n-磺酰胺基”是指rs(=o)2nr’-基团,其中r和r’是如本文所定义的。术语“s-磺酰胺基”是指-s(=o)2nrr’基团,其中r和r’是如本文所定义的。如本文单独或组合使用的,术语“硫杂”和“硫代”是指-s-基团或醚,其中氧被硫代替。硫代基团的被氧化的衍生物(即亚磺酰基和磺酰基)被包括在硫杂和硫代的定义中。如本文单独或组合使用的,术语“硫醇”是指-sh基团。如本文使用的,术语“硫代羰基”当单独时包括硫代甲酰基-c(s)h,并且当组合时是-c(s)-基团。术语“n-硫代氨甲酰基”是指roc(s)nr’-基团,其中r和r’是如本文所定义的。术语“o-硫代氨甲酰基”是指-oc(s)nrr’基团,其中r和r’是如本文所定义的。术语“氰硫基”是指-cns基团。术语“三卤代甲氧基”是指x3co-基团,其中x是卤素。本文的任何定义可以与任何其他定义结合使用,来描述复合结构基团。按照惯例,任何此类定义的尾随元素是附接到母体部分上的元素。例如,复合基团烷基酰胺基表示通过酰胺基基团附接到母体分子上的烷基基团,并且术语烷氧基烷基表示通过烷基基团附接到母体分子上的烷氧基基团。当基团被定义为“无”时,意指所述基团是不存在的。类似地,当指定如“n(其可以选自一组整数或一定范围的整数)”指定为0,如果在末端位置中,那么它指定的基团是不存在的,或者如果它在两个其他基团之间,那么缩合形成键。术语“可任选取代的”意指前述基团可以被取代或不被取代。当被取代时,“任选地被取代的”基团的取代基可以包括但不限于独立地选自下组或具体指定基团组的一种或多种取代基,单独地或组合地:低级烷基、低级烯基、低级炔基、低级烷酰基、低级杂烷基、低级杂环烷基、低级卤代烷基、低级卤代烯基、低级卤代炔基、低级全卤代烷基、低级全卤代烷氧基、低级环烷基、苯基、芳基、芳氧基、低级烷氧基、低级卤代烷氧基、氧代、低级酰氧基、羰基、羧基、低级烷基羰基、低级羧酸酯、低级甲酰胺基、氰基、氢、卤素、羟基、氨基、低级烷基氨基、芳基氨基、氨基、硝基、硫醇、低级烷基硫代、低级卤代烷硫基、低级全卤代烷硫基、芳硫基、磺酸酯、磺酸、三取代的甲硅烷基、n3、sh、sch3、c(o)ch3、co2ch3、co2h、吡啶基、噻吩、呋喃基、低级氨基甲酸酯、以及低级脲。可以将两个取代基连接在一起,以形成稠合的五元、六元或七元的由零至三个杂原子组成的碳环或杂环,例如形成亚甲基二氧基或亚乙基二氧基。任选地被取代的基团可以是未取代的(例如,-ch2ch3)、完全取代的(例如,-cf2cf3)、单取代的(例如,-ch2ch2f)或在完全取代和单取代之间的一定水平的取代(例如,-ch2cf3)。在叙述取代基而未定性为取代的情况下,涵盖取代形式和未取代形式两者。在取代基被定性为“取代的”情况下,尤其意指取代形式。此外,针对特定部分的不同组的任选取代基可以根据需要来定义;在这些情况下,所述任选取代将是如所定义的,通常紧接着短语,“被任选地取代”。当构建体是如本文使用的,由()m和()n封闭的亚烷基基团可以是m个或n个碳原子长。除非另有定义,术语r或术语r’,独自出现并且没有数字指定的情况下,是指选自以下各项中的部分:氢、烷基、环烷基、杂烷基、芳基、杂芳基以及杂环烷基,这些基团中的任何基团可以被任选取代。应当理解的是,此类r和r’基团如本文所定义的任选地被取代。无论r基团是否具有数字指定,应当理解的是,每个r基团(包括r、r’和rn,其中n=(1,2,3,…n))、每个取代基以及每个术语就从组的选择而论是独立于所有其他的。如果任何变量、取代基或术语(例如,芳基、杂环、r等)在化学式或通用结构中出现不止一次,那么在每次出现时其定义应当是独立于在所有其他出现时的定义。本领域的技术人员应进一步认识到,某些基团可以附接到母体分子上或可以在从如所写的任一端的元件的链中占据位置。因此,仅通过举例,不对称的基团如-c(o)n(r)-可以在碳或氮处附接到母体部分上。不对称中心存在于本文披露的化合物中。这些中心由符号“r”或“s”指定,取决于手性碳原子周围的取代基的构型。应当理解,本发明涵盖所有立体化学异构体形式,包括非对映异构体、对映异构体、以及差向异构体形式,连同d-异构体和1-异构体,及其混合物。化合物的单独立体异构体可以用含有手性中心的可商购起始物质合成制备,或者通过制备对映异构体产物的混合物,然后分离(如转化成非对映异构体混合物),然后是分离或重结晶,层析技术,在手性层析柱上直接分离对映异构体,或本领域已知的任何其他适当方法来制备。特定立体化学的起始化合物是可商购的,或可以通过本领域已知的技术来制备和拆分。另外,本文披露的化合物可以作为几何异构体存在。本发明包括所有顺式(cis)、反式(trans)、同式(syn)、逆式(anti)、异侧(e)以及同侧(z)异构体连同其适当混合物。另外,化合物可以作为互变异构体存在;本发明提供了所有互变异构体。另外,本文披露的化合物可以按非溶剂化形式以及与药学上可接受的溶剂如水、乙醇等的溶剂化形式存在。通常,认为这些溶剂化形式等效于非溶剂化形式。术语“键”是指当由所述键连接的原子被认为是较大子结构的一部分时两个原子或两个部分之间的共价连接。键可以是单键、双键、或三键,除非另外说明。在分子图中的两个原子之间的虚线指示另外的键可以在那个位置处存在或不存在。如本文使用的,术语“疾病”旨在为一般同义的,并且可以与术语“障碍”和“病症”(在医学症状时)互换使用,其中所有这些都反映了人类或动物体的或者损害了其正常功能的部分之一的异常情况,典型表现为区别的体征和症状,并且使人或动物有减少的寿命期限或生活质量。术语“组合疗法”意指给予两种或更多种治疗剂来治疗本披露中所述的治疗的病症或障碍。这种给予包括以基本上同时的方式共给予这些治疗剂,如在具有固定比例活性成分的单个胶囊中或者在针对每种活性成分的多个分开的胶囊中。此外,这种给予还包括以连续方式使用每种类型的治疗剂。在任一情况下,治疗方案将在治疗本文所述的病症或障碍中提供药物组合的有益作用。短语“治疗有效的”旨在限定在疾病或障碍的治疗中使用的活性成分的量。该量将实现减少或消除所述疾病或障碍的目的。术语“治疗上可接受的”是指适用于与患者组织接触而不产生过度毒性、刺激和过敏反应的化合物(或盐、前药、互变异构体、两性离子形式等),它们具有合理受益/风险比,可有效用于预定用途。如本文使用的,提及“治疗”患者旨在包括预防。术语“患者”意指包括人类的所有哺乳动物。患者的实例包括人类、牛、狗、猫、山羊、绵羊、猪、以及兔子。优选地,患者是人类。术语“前药”是指在体内变得更具活性的化合物。本文披露的某些化合物还可以作为前药存在,如在hydrolysisindrugandprodrugmetabolism:chemistry,biochemistry,andenzymology[在药物和前药代谢中的水解:化学、生物化学、以及酶学](testa,bernard和mayer,joachimm.wiley-vhca,苏黎世,瑞士2003)中所描述。本文所述化合物的前药是以下化合物的结构改良型:所述化合物在生理条件下容易进行化学变化来提供所述化合物。此外,在离体环境中,通过化学方法或生物化学方法可以将前药转变成所述化合物。例如,当前药置于经皮贴片贮器内部时用适合的酶试剂或化学试剂可以将前药缓慢地转变成化合物。因为在一些情况下前药比化合物或母体药物更容易进行给予,所以它们经常是有用的。例如,它们可以是通过口服给予而生物可利用的,而这种母体药物却不行。前药还可以在药物组合物中具有改进的超过母体药物的溶解性。本领域中已知多种多样的前药衍生物,如依赖于前药的水解裂解或氧化激活的那些。前药的实例(但不限于)是作为酯(所述“前药”)给予的化合物,但是然后代谢水解为羧酸,活性实体。另外的实例包括化合物的肽基衍生物。本文披露的化合物可以作为治疗上可接受的盐存在。本发明包括以上以盐形式列出的化合物,所述盐形式包括酸加成盐。适合的盐包括用有机或无机酸形成的那些。此类酸加成盐通常是药学上可接受的。然而,非药学上可接受的盐的盐可以是在所讨论的化合物的制备和纯化中是有效用的。也可以形成碱加成盐,并且是药学上可接受的。对于盐的制备和选择的更完整的讨论,参考以下文献:pharmaceuticalsalts:properties,selection,anduse[药用盐:特性、选择与使用](stahl,p.heinrich.威利-vhca,苏黎世,瑞士,2002)。如本文使用的,术语“治疗上可接受的盐”表示本文披露的化合物的盐或两性离子形式,其是水溶性的或油溶性的或可分散的并且是如本文所定义的治疗上可接受的。这些盐可以在化合物的最后分离和纯化期间制备,或是通过游离碱形式的适当的化合物的与适合的酸反应分开地制备。代表性酸加成盐包括乙酸盐、己二酸盐、海藻酸盐、l-抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐(苯磺酸盐)、重硫酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、二葡萄糖酸盐、甲酸盐、延胡索酸盐、龙胆酸盐、戊二酸盐、甘油磷酸盐、乙醇酸盐、半硫酸盐、庚酸盐、己酸盐、马尿酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟乙磺酸盐(羟乙基磺酸盐)、乳酸盐、马来酸盐、丙二酸盐、dl-扁桃酸盐、均三甲苯磺酸盐、甲磺酸盐、萘磺酸盐、烟酸盐、2-萘磺酸盐、草酸盐、双羟萘酸盐、果胶盐、过硫酸盐、3-苯丙酸盐、磷酸盐、苦味酸盐、匹伐酸盐、丙酸盐、焦谷氨酸盐、琥珀酸盐、磺酸盐、酒石酸盐、l-酒石酸盐、三氯乙酸盐、三氟乙酸盐、磷酸盐、谷氨酸盐、碳酸氢盐、对-甲苯磺酸盐(p-托西酸盐)、以及十一烷酸盐。并且,可以将在本文披露的化合物中的碱性基团用甲基、乙基、丙基、以及丁基的氯化物、溴化物、以及碘化物;二甲基、二乙基、二丁基、正二烯丙基的硫化物;癸基、月桂基、肉豆蔻基和硬脂基的氯化物、溴化物和碘化物;以及苄基和苯乙基的溴化物进行季铵化。可以采用以形成治疗上可接受的加成盐的酸的实例包括无机酸(如硝酸、硼酸、盐酸、氢溴酸、硫酸、和磷酸)和有机酸(如草酸、马来酸、琥珀酸、和柠檬酸)。盐还可以通过这些化合物与碱金属或碱土离子的配位形成。因此,本发明考虑了本文披露的化合物的钠、钾、镁、以及钙盐等。碱加成盐可以在化合物最后的分离和纯化期间制备,通过将羧基基团与适合的碱如金属阳离子的氢氧化物、碳酸盐、或碳酸氢盐,或者与氨或有机伯、仲、叔胺反应。治疗上可接受的盐的阳离子包括锂、钠、钾、钙、镁、和铝,以及无毒季胺阳离子如铵、四甲铵、四乙铵、甲胺、二甲胺、三甲胺、三乙胺、二乙胺、乙胺、三丁胺、吡啶、n,n-二甲基苯胺、n-甲基哌啶、n-甲基吗啉、二环己胺、普鲁卡因、二苄胺、n,n-二苄基苯乙胺、1-二苯羟甲胺和n,n’-二苄基乙二胺。可用于形成碱加成盐的其他的代表性有机胺包括乙二胺、乙醇胺、二乙醇胺、哌啶以及哌嗪。化合物的盐可以通过将游离碱形式的适当的化合物与适当的酸反应来制备。本文披露的化合物可以作为多晶型物和其他不同的固体形式如溶剂化物、水合物等存在。化合物可以是盐或游离碱或酸的多晶型物、溶剂化物、或水合物。虽然本文披露的化合物可能作为原料化学品给予,但是还可以将它们呈现为药物配制品(等同地,“药物组合物”)。因此,本文提供了药物配制品,这些药物配制品包含本文披露的某些化合物中的一种或多种,或者其一种或多种药学上可接受的盐、酯、前药、酰胺或溶剂化物,以及一种或多种其药学上可接受的载体和任选地一种或多种其他治疗成分。这种或这些载体必须在与配制品的其他成分相容且对于其接受者无害的意义上是“可接受的”。适当的配制品取决于所选择的给予途径。任何熟知的技术、载体和赋形剂可合适地使用,并且是本领域已知的;例如在remington'spharmaceuticalsciences[雷明顿的药物科学]中。本文披露的药物组合物可以用本领域中已知的任何方式进行制造,例如通过常规的混合、溶解、造粒、造糖衣丸、磨细、乳化、包囊、包埋或压片方法。配制品包括适用于以下各项的那些:口服、肠胃外(包括皮下、真皮内、肌内注射、静脉内、关节内、脂肪内(intraadiposal)、动脉内、颅内、病灶内、鼻内、眼内、心包内、腹膜内、胸膜内、前列腺内、直肠内、鞘内、气管内、肿瘤内、脐静脉内、阴道内、囊内、玻璃体内、和髓内)、腹膜内、直肠、局部(topical)(包括但不限于:真皮、口腔、舌下、阴道、直肠、鼻、耳和眼)、局灶(local)、粘膜、舌下、皮下、透粘膜、透真皮、透口腔、透真皮、和阴道;脂质体、在霜剂中、在脂质组合物中、经由导管、经由灌洗、经由连续输注、经由输注、经由吸入、经由注射、经由局部递送、通过局部灌注、直接浸浴靶细胞、或其任何组合。给予的最适合的途径尽管可以取决于例如受体的病症和障碍。配制品可方便地以单位剂型存在,且可通过配药学领域公知的任何方法制备。典型地,这些方法包括使本文披露的化合物或其药学上可接受的盐、酯、酰胺、前药或溶剂化物(“活性成分”)与构成一种或多种辅助成分的载体结合的步骤。通常配制品通过以下步骤制备:均匀地并密切地将活性成分与液体载体或细粉碎的固体载体或与这两者混合,然后如果需要的话,使得到的产物成形,得到所希望的配制品。适合用于口服给予的本文披露的化合物的配制品能以不连续单位形式呈现,如各自含有预定量的活性成分的硬胶囊或软胶囊、糯米纸囊剂、扁囊剂或片剂;呈粉末或颗粒剂;呈水性液体或非水性液体中的糖浆、酏剂、溶液或悬浮液;或呈水包油型液体乳剂或油包水型液体乳剂、或分散于脂质体中的化合物。活性成分还可作为大丸剂、药糖剂或糊剂呈现。可口服使用的药物制剂包括片剂、由明胶制成的插接式胶囊(push-fitcapsule)以及由明胶和增塑剂(如甘油或山梨醇)制成的密封式软胶囊。可以通过任选地与一种或多种辅助成分一起压制或模压来制造片剂。可以通过在适合的机器中压制处于自由流动形式(如粉末或颗粒)的活性成分来制备压制片,这些活性成分任选地与粘合剂、惰性稀释剂或润滑剂、表面活性剂或分散剂混合。模制片可以通过在适合的机器中将用惰性液体稀释剂润湿的粉状化合物的混合物模塑而制造。所述片剂可任选地被包衣或刻痕,且可以配制以便提供其中活性成分的延迟的、缓慢或受控释放或吸收。组合物可以进一步包含增强溶解性和分散性的治疗剂。用于口服给予的所有配制品都应当给予适宜于这种给予方式的剂量。插接式-胶囊可以含有与填充剂(如乳糖)、粘合剂(如淀粉)和/或润滑剂(如滑石或硬脂酸镁)以及任选地稳定剂相混合的活性成分。在软胶囊中,活性化合物可以溶解或悬浮于适合的液体(如脂肪油、液体石蜡或液体聚乙二醇)中。此外,可以添加稳定剂。糖衣丸的芯配有适合的包衣。为此目的,可以使用浓缩的糖溶液,这些糖溶液可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆胶、聚乙二醇和/或二氧化钛、漆溶液、以及适合的有机溶剂或溶剂混合物。可以将染料或着色剂添加至片剂或糖衣丸包衣中,以用于鉴别或表征活性化合物剂量的不同组合。依据给予途径,可将化合物或其颗粒剂或颗粒包被于物质中以保护所述化合物免受可能导致所述化合物失活的酸和其他自然条件的作用。可以配制这些化合物用于通过注射进行肠胃外给予,例如,通过向身体或向疾病或伤口的位点弹丸式注射或连续输注。用于注射的配制品可以与所添加的防腐剂一起以单位剂型(例如,在安瓿瓶或多-剂量容器中)呈递。组合物可以采取此类形式,如在油性或水性运载体中的悬浮液、溶液或乳液,且可以含有配制剂如助悬剂、稳定剂和/或分散剂。配制品可以存在于单位剂量或多剂量容器(例如密封的安瓿瓶和小瓶)中,并且可以按粉末形式储存或储存在仅需要在使用之前立即添加无菌液体载体(例如,盐水或灭菌无热原水)的冷冻干燥(冻干)条件下。临时注射溶液和悬浮液可以由前述种类的无菌粉末、颗粒剂和片剂制备。用于肠胃外给予的配制品包括活性化合物的水性和非水性(油性)无菌注射溶液,其可含有抗氧化剂、缓冲剂、抑菌剂和使得所述配制品与预期的接受者的血液等渗的溶质;以及水性和非水性无菌悬浮液,其可以包括悬浮剂和增稠剂。适合的亲脂性溶剂或运载体包括脂肪油如芝麻油或合成的脂肪酸酯如油酸乙酯或甘油三酯,或者脂质体。水性注射悬浮液可以含有增加悬浮液粘度的物质,如羧甲基纤维素钠、山梨醇或葡聚糖。可任选地,所述悬浮液还可以含有多种适宜的稳定剂类或治疗剂类,它们增加了这些化合物的溶解度以允许制备高度浓缩的溶液。为了通过除胃肠外给予以外的其他途径给予治疗化合物,可能必需用防止所述化合物失活的物质对其进行包衣或者将所述化合物与所述物质一起共同给予(例如,通过脂质体配制品)。除了先前描述的配制品之外,这些化合物还可被配制成贮库制剂。此类长效配制品可通过植入(例如皮下或肌内)或通过肌内注射来给予。因而,例如,所述化合物可用适合的聚合物或疏水物质(例如作为在可接受的油中的乳液)或离子交换树脂来配制,或配制为微溶的衍生物,例如微溶的盐。对于含服或舌下给予,这些组合物可以按常规方式采用片剂、锭剂、软锭剂、或凝胶剂的形式。此类组合物可以包含调味基料如蔗糖和阿拉伯胶或黄芪胶中的活性成分。所述化合物还可被配制成直肠组合物(如栓剂或保留灌肠剂),例如包含常规的栓剂基质(如可可脂、聚乙二醇、或其他甘油酯)。可以将本文披露的某些化合物局部给予,即通过非全身性给予。这包括将本文披露的化合物施用于表皮外部或口腔以及将这样一种化合物滴入耳、眼以及鼻内,这样使得所述化合物不显著地进入血流。相比之下,全身性给予是指口服给予、静脉内给予、腹膜内给予以及肌内给予。适合用于局部给予的配制品包括适合用于透过皮肤到达炎症位点的液体或半液体制剂,如凝胶剂、搽剂、洗剂、乳膏剂、软膏剂或糊剂,以及适合用于给予于眼、耳或鼻的滴剂。局部给予的活性成分可以是配制品的例如从0.001%至10%w/w(按重量计)。在某些实施例中,所述活性成分可以是多达10%w/w。在其他实施例中,它可以是少于5%w/w。在某些实施例中,所述活性成分可以是从2%w/w至5%w/w。在其他实施例中,它可以是配制品的从0.1%至1%w/w。除活性成分之外,本文披露的局部眼、耳、以及鼻配制品还可以包含赋形剂。在此类配制品中通常使用的赋形剂包括但不限于:张度剂、防腐剂、螯合剂、缓冲剂、以及表面活性剂。其他赋形剂包含增溶剂、稳定剂、舒适增强剂、聚合物、软化剂、ph调节剂和/或润滑剂。任何多种赋形剂可以在本文披露的配制品中使用,这些赋形剂包括水、水和水混溶性溶剂(如c1-c7烷醇)的混合物、包含从0.5%至5%无毒水溶性聚合物的植物油或矿物油、天然产物(如海藻酸盐、果胶、黄芪胶、梧桐胶、瓜尔胶、黄胞胶、角叉菜聚糖、琼脂和阿拉伯胶)、淀粉衍生物(如淀粉乙酸酯和羟丙基淀粉)、以及还有其他合成产品(如聚乙烯醇、聚乙烯吡咯烷酮、聚乙烯基甲基醚、聚氧乙烯,优选地交联聚丙烯酸以及这些产品的混合物)。所述赋形剂的浓度典型地是所述活性成分的浓度的从1至100,000倍。在优选的实施例中,因为赋形剂对配制品的活性成分组分的惰性,通常选择配制品中要包括赋形剂。相对于眼、耳、以及鼻配制品,适合的张力调节剂包括但不限于:甘露醇、氯化钠、甘油、山梨糖醇等。合适的缓冲剂包括但不限于磷酸盐、硼酸盐、乙酸盐等。适合的表面活性剂包括但不限于离子以及非离子表面活性剂(尽管非离子性界面活性剂是优选的)、rlm100、poe20鲸蜡基硬脂基醚如cs20和泊洛沙姆如f68。本文列出的配制品可以包含一种或多种防腐剂。此类防腐剂的实例包括对羟基苯甲酸酯、过硼酸钠、亚氯酸钠、醇(如氯丁醇、苯甲醇或苯基乙醇)、胍衍生物(如聚六亚甲基双胍)、过硼酸钠、聚季铵盐-1、氨基醇(如amp-95)、或山梨酸。在某些实施例,配制品可以自我保存这样使得不需要防腐剂。在某些局部的实施例中,使用缓冲系统制备配制品,所述缓冲系统维持配制品在约4.5的ph至约8的ph。在另外的实施例中,ph是从7至8。用于局部或经皮给予的凝胶总体上可以包含挥发性溶剂、非挥发性溶剂、以及水的混合物。在某些实施例中,缓冲溶剂系统的挥发性溶剂组分包括低级(c1-c6)烷基醇、低级烷基二醇和低级二醇聚合物。在另外的实施例中,挥发性溶剂是乙醇。挥发性溶剂组分被认为是充当渗透促进剂,同时当它蒸发时也对皮肤产生冷却作用。缓冲溶剂系统的非挥发性溶剂部分选自低级亚烷基二醇和低级二醇聚合物。在某些实施例中,使用丙二醇。非挥发性溶剂减慢了挥发性溶剂的蒸发并且减小了缓冲溶剂系统的蒸气压力。该非挥发性溶剂组分的量,如同挥发性溶剂一样,是通过使用的药物化合物或药物确定的。当在系统中非挥发性溶剂太少时,药物化合物可能由于挥发性溶剂的蒸发而结晶,而过量可能导致由于从溶剂混合物中释放药物不良造成的缺乏生物有效性。缓冲溶剂系统的缓冲液组分可以选自本领域中通常使用的任何缓冲液;在某些实施例中,使用的是水。成分的常见比例为约20%的非挥发性溶剂、约40%的挥发性溶剂、以及约40%的水。可以将若干任选的成分添加至局部组合物。这些包括但不限于螯合剂和胶凝剂。适当的胶凝剂可以包括但不限于半合成纤维素衍生物(如羟丙基甲基纤维素)以及合成聚合物、半乳糖甘露聚糖聚合物(如瓜尔胶及其衍生物)、以及美容剂。洗剂包括适用于施用于皮肤或眼的那些。洗眼液可以包含任选地含有杀细菌剂的无菌水性溶液,并且可以通过与制备滴剂的那些方法类似的方法来制备。涂抹到皮肤的洗剂或搽剂也可以包括促进皮肤干燥和使皮肤凉爽的试剂(如醇或丙酮)和/或保湿剂(如甘油)或油(如蓖麻油或花生油)。霜剂、软膏剂或糊剂是用于外用的活性成分的半固体配制品。这些配制品可以通过将细粒或粉状的活性成分(单独或在水性或非水性流体中的溶液或悬浮液中)借助于适合的机械与油状或非油状的基质混合来制备。基质可以包含碳氢化合物如硬的、软的或液体石蜡、甘油、蜂蜡、金属皂;粘液;天然起源的油如杏仁油、玉米油、花生油、蓖麻油、或橄榄油;羊毛脂或其衍生物或脂肪酸如硬脂或油酸,与醇如丙二醇或大粒凝胶一起。所述配制品可以掺入任何适合的表面活性剂如阴离子、阳离子、或非离子型表面活性剂如脱水山梨糖醇酯或其聚氧化乙烯衍生物。还可以包括助悬剂(如天然树胶)、纤维素衍生物或无机物质(如硅质硅石)以及其他成分(如羊毛脂)。滴剂可以包含无菌水性或油性溶液或悬浮液,并且可以通过将活性成分溶解于杀细菌剂和/或杀真菌剂和/或任何其他适合的防腐剂(并且在某些实施例中包括表面活性剂)的适合的水溶液中来制备。然后可以通过过滤澄清所得溶液,转移至适合的之后密封的容器中并且通过高压处理或维持在98℃-100℃持续半小时来进行灭菌。可替代地,可以将所述溶液通过过滤进行灭菌,并且通过无菌技术转移至容器中。适合包含在滴剂中的杀细菌剂和杀真菌剂的实例为硝酸苯汞或乙酸盐(0.002%)、苯扎氯铵(0.01%)和乙酸氯己定(0.01%)。用于制备油性溶液的适合的溶剂包括甘油、稀释的醇以及丙二醇。用于在嘴中局部给予的配制品(例如含服给予或舌下给予)包括锭剂,这些锭剂包含在调味基料(如蔗糖和阿拉伯胶或黄芪胶)中的活性成分;和喉片,这些喉片包含在基料(如明胶和甘油或蔗糖和阿拉伯胶)中的活性成分。针对于通过吸入给予,化合物可以方便地从吹入器、喷雾器加压包或其他递送气雾剂喷雾的方便的手段来递送。加压包可以包含适合的推进剂如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他适合的气体。在加压气雾剂的情况下,剂量单位可以通过提供用于递送一个计量的量的阀门来确定。可替代地,针对通过吸入或吹入给予,根据本发明的化合物可以采取干燥粉末组合物的的形式,例如,化合物和适合的粉末基质如乳糖或淀粉的粉末混合物。粉末组合物可以单位剂量形式出现,例如,在胶囊、药筒、明胶或泡罩包装中,从这些中所述粉末可以借助于吸入器或吹入器给予。治疗化合物还可以经脊柱内或脑内给予。针对给予的这些类型,可在甘油、液体聚乙二醇,及其混合物,和油中制备分散体。在普通贮存和使用条件下,此类制剂可以含有防腐剂以防止微生物生长。适合于可注射使用的药物组合物包括无菌水溶液(在水溶性的情况下)或分散体以及用于临时制备无菌可注射溶液或分散液液的无菌粉末。在所有情况下,所述组合物必须是无菌的并且必须具有达到容易注射的程度的流动性。它在制造和存储的条件下必须是稳定的并且必须抗微生物(如细菌和真菌)的污染作用而保存。所述载体可以是溶剂或分散介质,包含例如水、乙醇、多元醇(如,甘油、丙二醇和液体聚乙二醇等)、它们适当的混合物以及植物油。恰当的流动性可例如通过应用包衣如卵磷脂来维持,在分散体的情况下通过维持所需的颗粒大小来维持,以及通过应用表面活性剂来维持。防止微生物的作用可以通过不同的抗细菌以及抗真菌剂,例如对羟苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,优选在组合物中包括等渗剂,例如糖、氯化钠、或多元醇如甘露醇和山梨糖醇。按照需要,通过将治疗化合物以需要的量加入具有以上列举的组分中的一种或多种的组合的适当溶剂中,随后进行无菌过滤,可以制备无菌注射液。通常,通过将治疗化合物掺入含有基本的分散介质和所需要的药理学上提到的其他成分的无菌载体中制备分散体。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,这产生了活性成分(即,治疗化合物)的粉剂加来自其先前无菌过滤溶液的任何另外所希望的成分。特别有利的是以剂量单位形式配制胃肠外组合物以便于给予和剂量统一。如本文使用的剂量单位形式是指适合作为单一剂量用于待治疗受试者的物理上离散的单位;每个单位含有经计算以产生与所需的药物载体组合产生期望的治疗效果的治疗化合物的预定量。针对本发明的剂量单位形式的说明受指示于并直接依赖于以下各项:(a)治疗化合物的特质和待实现的特定疗效,和(b)在复合用于治疗患者中所选病症的此类治疗化合物的领域中固有的限制。应当理解的是,除了以上具体提及的成分之外,考虑到所讨论的配制品的类型,以上所述配制品可以包括本领域中常规的其他试剂,例如适合用于口服给予的那些可以包括调味剂。每天可以按从0.1至500mg/kg的剂量给予化合物。针对于成人,剂量范围一般从5mg至2g/天。以离散的单位提供的片剂或其他呈现形式可以便利地含有一定量的一种或多种化合物,所述形式以此剂量或作为此剂量的倍数是有效的,例如,单位包含5mg至500mg,通常约10mg至200mg。优选的单位剂量配制品是包含活性成分的如在下文所述的有效剂量或其适当部分的那些。在某些实施例中,本文披露的配制品每天给予一次。然而,这些配制品还可以针对以任何给予频率来给予进行配制,这些给予频率包括每周一次、每5天一次、每3天一次、每2天一次、每天两次、每天3次、每天4次、每天5次、每天6次、每天8次、每小时、或更高频率。此类给药频率还维持根据治疗方案而变化的持续时间。具体治疗方案的持续时间可从一次性剂量至延续数月或数年的方案而变化。这些配制品以不同的剂量给予,但典型剂量是每次给予时一至两滴,或凝胶或其他配制品的可比较的量。本领域普通技术人员熟悉确定具体适应症的治疗方案。可以与载体物质组合以产生单一剂型的活性成分的量将取决于治疗的宿主和具体给予方式而变化。类似地,向患者给予的化合物的精确量将是主治医师的责任。针对任何特定患者的具体剂量水平取决于多种因素,这些因素包括所使用的具体化合物的活性、年龄、体重、一般健康情况、性别、饮食、给予时间、给予途径、排泄速率、药物组合、所治疗的确切的障碍以及所治疗适应症或病症的严重程度。此外,给予途径可以取决于病症及其严重程度而变化。在某些情况下,可以适当地与另一种治疗剂结合给予本文所述化合物中的至少一种(或其药学上可接受的盐、酯或前药)。仅通过举例,如果当接受本文化合物之一时患者经历的副作用之一是炎症,那么可适当地与初始治疗剂结合以给予消炎剂。可替代地,仅通过举例,本文所述化合物之一的治疗有效性可以通过给予佐剂来提高(即,佐剂自身可以仅具有最小的治疗益处,但与另一种治疗剂组合时,增强了对患者的整体治疗益处)。甚至还有可能,两种化合物,本文所述的化合物之一以及第二化合物可以一起实现任何一种单独都不能实现的所希望的疗效。可替代地,仅通过举例,患者所经历的益处可以通过给予本文所述化合物之一与另一种也具有治疗益处的治疗剂来增加。仅通过举例,在涉及给予本文所述化合物之一针对急性髓细胞性白血病或镰状细胞贫血的治疗中,增加的治疗益处也可以通过向患者提供针对镰状细胞贫血或针对急性髓细胞性白血病的另一种治疗剂来得到。在任何情况下,无论所治疗的疾病、障碍或病症,患者所经历的整体益处可以是两种治疗剂的简单叠加,或者这两种治疗剂在患者中可以具有协同疗效。有效的组合疗法可以用单一组合物或包括两种治疗剂的药理学配制品,或同时用两种不同组合物或配制品来实现,其中一种组合物包括本披露的化合物,并且另一种包括一种或多种第二药剂。可替代地,所述疗法可以在另一种治疗剂治疗之前或之后的范围从数分钟至数月的间隔时间。考虑到药物的毒性(如果有的话),向患者给予本披露的化合物将遵从用于给予药物的一般方案。预期必要时重复治疗周期。可能的组合疗法的具体的非限制性实例包括与以下治疗剂和治疗剂类别一起使用本发明的某些化合物:抑制dna甲基转移酶的治疗剂如地西他滨或5’-氮杂-胞苷;抑制组蛋白脱乙酰基酶、组蛋白脱苏素化酶、组蛋白脱泛素酶、或组蛋白磷酸酶的活性的治疗剂(如羟基脲);可能抑制在γ球蛋白启动子中的dr位点处结合的蛋白复合物的其他组分的表达的反义rna;抑制klf1作用或klf1表达的治疗剂;抑制bcl11a作用或bcl11a表达的治疗剂;以及抑制细胞周期进程的治疗剂如羟基脲、阿糖胞苷或道诺霉素;诱导白血病细胞分化的治疗剂如全反式维甲酸(atra)。因此,在另一方面,本发明提供用于治疗需要此治疗的人类或动物受试者的疾病或障碍的方法,所述治疗包括向所述受试者给予一定量的可有效地减少或防止受试者中所述障碍的本文披露的化合物,任选地与用于治疗本领域已知的所述障碍的至少一种另外的治疗剂结合。作为单一疗法或与其他药剂结合使用的情况下,本文披露的化合物在预防和/或治疗β-血红蛋白病如重型地中海贫血、镰状细胞病、血红蛋白e/地中海贫血、以及中间型地中海贫血中是有用的。可以在治疗疾病中使用本文披露的化合物,其中通过表观遗传调节因子的操作(如kdm1a的抑制)增加转录对患者是有益的。这适用于如下疾病,所述疾病包括但不限于功能缺失性突变、导致单倍不足的突变、遗传物质的缺失和复制,或改变一个基因或多个基因的正常表达谱的表观遗传调节机制,所述机制具有改变一种或多种基因产物的剂量的作用。此类疾病可以包括后天性或先天性疾病两种,其中,例如,影响免疫功能的细胞因子的表达被改变,x连锁智力障碍和受损的认知或运动功能的其他形式如阿尔茨海默病和帕金森病(无论它们是否是后天性或先天性形式),脂质失调如高胆固醇、低密度脂蛋白、极低密度脂蛋白或甘油三酸酯,i型和ii型糖尿病、以及孟德尔遗传疾病。可以通过本文披露的化合物有利治疗的其他障碍或病症包括炎症和炎性病症。炎性病症包括但不限于:关节炎,所述关节炎包括亚型以及相关的病症如类风湿关节炎、脊椎关节病、痛风性关节炎、骨关节炎、系统性红斑狼疮、幼年型关节炎、急性风湿性关节炎、肠病性关节炎、神经病性关节炎、银屑病关节炎、以及化脓性关节炎;骨质疏松症、肌腱炎、粘液囊炎、以及其他相关的骨和关节障碍;胃肠道病症,如反流性食管炎、腹泻、炎性肠病、克罗恩病、胃炎、肠道易激综合症、溃疡性结肠炎、胰脏的急性和慢性炎症;肺部炎症,如与病毒感染和囊性纤维病相关的那种;皮肤相关病症,如银屑病、湿疹、烧伤、晒斑、皮炎(如接触性皮炎、特异性皮炎、以及过敏性皮炎)、以及荨麻疹;胰腺炎、肝炎、皮肤瘙痒和白癜风。此外,本发明的化合物在器官移植患者中,在单独或与常规免疫调节剂组合的情况下,也都是有用的。自身免疫障碍可以通过用本文披露的化合物治疗来改善。自身免疫障碍包括克罗恩病、溃疡性结肠炎、皮炎、皮肌炎、1型糖尿病、古德帕斯丘氏综合征、格雷夫斯氏病、格林-巴利综合征(gbs)、自身免疫性脑脊髓炎、桥本氏病、特发性血小板减少性紫癜、红斑狼疮、混合性结缔组织病、多发性硬化症(ms)、重症肌无力、昏睡病、寻常型天疱疮、恶性贫血、银屑病、银屑病关节炎、多发性肌炎、原发性胆汁性肝硬变、类风湿关节炎、斯耶格伦氏综合征、硬皮病、颞动脉炎(又称“巨细胞动脉炎”)、血管炎、以及韦格纳氏肉芽肿病。本文披露的化合物对于治疗与重度烧伤、败血症、创伤、伤口、和出血或复苏诱导的低血压相关的器官和组织损伤也是有用的,并且在如下此类疾病中也是如此:血管病,偏头痛,库斯毛耳氏病,甲状腺炎,再生障碍性贫血,何杰金氏病,硬皮病,风湿热,i型糖尿病,神经肌肉接点疾病包括重症肌无力,白质疾病包括多发性硬化症,结节病,肾炎,肾病综合征,贝切特氏综合征,多发性肌炎,龈炎,牙周病学,在损伤后发生的肿胀,缺血包括心肌缺血、心血管缺血、以及心脏停搏继发性缺血等。本文披露的化合物对治疗神经系统的某些疾病和障碍也是有用的。在kdm1a抑制中有用的中枢神经系统障碍包括皮质性痴呆包括阿尔茨海默病,由中风造成的中枢神经系统损害,缺血包括脑缺血(局灶性脑缺血、血栓性脑中风和全脑缺血(例如,心脏停搏继发性的)),以及创伤。kdm1a抑制在其中是有用的神经退行性障碍包括在以下各种障碍中的神经变性或神经坏死,这些障碍如缺氧、低血糖、癫痫,以及在中枢神经系统(cns)创伤(如脊髓和头部损伤)的情况下,包括高压氧诱导的惊厥和毒性、痴呆例如早老性痴呆、以及aids相关的痴呆、恶病质、西登哈姆氏舞蹈病、亨廷顿氏病、帕金森病、肌萎缩性侧索硬化(als)、科尔萨科夫氏病、与脑血管病变相关的认知障碍、超敏反应、睡眠障碍、精神分裂症、抑郁症、与经前期综合征(pms)相关的抑郁症或其他症状、以及焦虑。由本文披露的化合物(单独或与医护标准尤其是通过在恶性细胞中恢复肿瘤抑制基因来靶向肿瘤生长的那些治疗剂结合)有利治疗的其他的障碍或病症包括预防或治疗过度增生性疾病,尤其是癌症。可以治疗或预防的恶性血液病和非恶性血液病包括但不限于:多发性骨髓瘤、急性和慢性白血病和造血增殖性障碍和造血肿瘤性障碍(包括骨髓增生异常综合征(mds)、急性髓细胞性白血病(aml)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、以及慢性髓细胞性白血病(cml))、淋巴瘤(包括何杰金氏淋巴瘤和非何杰金氏淋巴瘤(低、中、以及高级))、连同脑实体瘤以及恶性肿瘤、头颈部实体瘤以及恶性肿瘤、乳腺实体瘤以及恶性肿瘤、肺实体瘤以及恶性肿瘤(包括非小细胞肺癌)、生殖道实体瘤以及恶性肿瘤、上消化道实体瘤以及恶性肿瘤、胰腺实体瘤以及恶性肿瘤、肝脏实体瘤以及恶性肿瘤、肾系统实体瘤以及恶性肿瘤、膀胱实体瘤以及恶性肿瘤、前列腺实体瘤以及恶性肿瘤和结肠直肠实体瘤以及恶性肿瘤。本发明化合物和方法还可以用来治疗纤维化,如伴随着放射治疗发生的纤维化。本发明化合物和方法可以用来治疗患有腺瘤性息肉的受试者或者预防腺瘤性息肉的进展,这些受试者包括患有家族性腺瘤性息肉病(fap)或结节病的那些。非癌性增生性障碍另外包括牛皮癣、湿疹、以及皮炎。本发明还可以用于共同疗法,部分地或完全地,代替其他常规消炎疗法,如与类固醇、nsaid、cox-2选择性抑制剂、5-脂肪氧合酶抑制剂、ltb4拮抗剂以及lta4水解酶抑制剂一起。当与抗细菌剂或抗病毒剂治疗性结合时候,本文披露的化合物还可以用来预防组织损害。本文披露的化合物对治疗代谢障碍也是有用的。使用黄素腺嘌呤二核苷酸(fad)作为辅因子,取决于细胞fad可用性,kdm1a在表观遗传学上调节脂肪细胞中能量消耗基因。此外,kdm1a功能的缺失诱导许多能量消耗和线粒体代谢的调节子,导致线粒体呼吸作用的活化。此外,在来自高脂肪的饮食饲养的小鼠中的脂肪组织中,kdm1a-靶基因的表达减少。代谢性综合征(又称代谢性综合征x),表征为具有至少以下症状中的至少三种:胰岛素抗性;腹部脂肪-在男性中该腹部脂肪限定为40英寸的腰围或更多,在女性中35英寸的腰围或更多;高血糖-在禁食后至少110毫克/分升(mg/dl);高甘油三酯-血流中至少150mg/dl;低hdl-低于40mg/dl;血栓前状态(例如,血液中高纤维蛋白原或纤维酶原激活物抑制剂);或130/85mmhg或更高的血压。发现了在代谢综合征和其他病症(如肥胖症、高血压和高水平的ldl胆固醇)之间的联系,所有这些都是心血管疾病的危险因素。例如,已经显示出代谢综合征和动脉硬化之间增加的关联。患有代谢综合征的人还更倾向于发展为2型糖尿病、连同在女性中的pcos(多囊卵巢综合征)以及男性中的前列腺癌。如以上所描述的,胰岛素抗性可以通过多种方式来表现,包括2型糖尿病。2型糖尿病是最明显与胰岛素抗性关联的病症。代偿性高胰岛素血症有助于维持正常血糖水平,在显性糖尿病形成前通常持续数十年。最终,胰腺的β细胞无法通过分泌过多克服胰岛素抗性。血糖水平上升,并且可以作出糖尿病的诊断。患有2型糖尿病的患者存在血胰岛素过多,直至他们处于疾病的晚期。如以上所描述的,胰岛素抗性还可能与高血压相关。患有特发性高血压的患者中一半是胰岛素抗性的并且血胰岛素过多,并且有证据表明,血压与胰岛素抗性程度相关。高血脂症也与胰岛素抗性相关。患有2型糖尿病的患者的脂质谱包括增加的血清极低密度脂蛋白(vldl)胆固醇和甘油三酯水平并且,有时,降低的低密度脂蛋白(ldl)胆固醇水平。在具有低水平高密度脂蛋白(hdl)的人中已经发现了胰岛素抗性。还已经将胰岛素水平与vldl合成的和血浆甘油三酯水平相关联。待通过本文披露的化合物、组合物、以及方法治疗的特定代谢性疾病与症状是至少部分通过kdm1a调节的那些。因此,本文披露了如下方法:用于治疗受试者的胰岛素抗性;用于降低受试者的糖原积累;在受试者中用于提高hdl或hdlc,降低ldl或ldlc,从小密度至正常ldl转化ldl颗粒大小,降低vldl,降低甘油三脂,或抑制胆固醇吸收;在受试者中用于减少胰岛素抗性,提高葡萄糖利用或降低血压;用于减少受试者的内脏脂肪;用于减少受试者的血清转氨酶;用于诱导受试者的线粒体呼吸;或用于治疗疾病;所有这些都包括向对其有需要的患者给予治疗量的如本文描述的化合物。在另外的实施例中,待治疗的疾病可以是代谢疾病。在另外的实施例中,代谢疾病可以选自下组,所述组由以下各项组成:肥胖症、糖尿病(尤其是2型糖尿病)、血胰岛素过多症、葡萄糖耐受不良、代谢性综合征x、血脂障碍、高甘油三酯血症、血胆固醇过多、以及肝性脂肪变性。在其他实施例中,待治疗的疾病可以选自下组,所述组由以下各项组成:心血管疾病,包括血管病、动脉硬化、冠心病、脑血管病、心力衰竭以及外周血管病变。在优选的实施例中,以上方法并没有产生低血糖状态的诱导或保持。除了可用于人类治疗外,本文披露的某些化合物和配制品同样可用于兽医治疗宠物、珍奇动物(exoticanimal)及家畜,包括哺乳动物、啮齿动物等。更优选的动物包括马、狗以及猫。方法用于制备化合物的通用合成法以下发明进一步由如下实例说明。在以下实例和贯穿本披露,可以使用以下缩写:ptfe=聚四氟乙烯;rm=反应混合物;rh=相对湿度;rt=室温;sm=起始物质;mecn=乙腈;clph=氯酚;dce=二氯乙烷;dcm=二氯甲烷;dipe=二异丙醚;dma=二甲基乙酰胺;dmf=二甲基甲酰胺;dmso=二甲亚砜;et2o=二乙醚;etoac=乙酸乙酯;etoh=乙醇;h2o=水;ipa=丙-2-醇;i-proac=异乙酸丙酯;mek=甲基乙基酮;meoh=甲醇;mibk=甲基异丁基酮;mtbe=甲基叔丁基醚;n-buoac=正丁基乙酸酯;n-buoh=正丁醇;nmp=正甲基吡咯烷酮;n-proh=正丙醇;s-buoac=仲丁基乙酸酯;t-buoh=叔丁醇;tfa=三氟乙酸;thf=四氢呋喃;tmp=2,2,4-三甲基戊烷;1h-nmr=质子核磁共振;dsc=差示扫描量热法;dvs=动态蒸汽吸附;gvs=重量蒸汽吸附;hplc=高效液相色谱法;hs=顶部空间;hsm=热台显微镜法;ic=离子色谱法;idr=固有溶出速率;kf=卡尔-费希尔;mas=魔角旋转;mdsc=调制示差扫描量热法;plm=偏振光显微术;pvm=粒子图像和测量;scxrd=单晶x射线衍射法;ss-nmr=固态核磁共振;tga=热重量分析;uv=紫外线辐射;vh-xrpd=可变湿度x射线粉末衍射;vt-xrpd=可变温度x射线粉末衍射;以及xrpd=x射线粉末衍射。可以使用其他缩写,并且联系上下文对于本领域技术人员将是熟悉的。实例1方案11的合成4-(1h-1,2,3-三唑基-1-基)苯甲酰氯(201)在100-ml圆底烧瓶中,将在亚硫酰氯(20ml)中的4-(1h-1,2,3-三唑-1-基)苯甲酸(1.2g,6.34mmol,1.00当量)溶液合并。将所得溶液在80℃下搅拌1h,然后在真空下浓缩,提供1.2g(78%)呈灰白色固体的产物(作为其盐酸盐)。1-(4-(1h-1,2,3-三唑-1-基)苯甲酰基-2-甲氧羰基氮杂环丙烷(203)在250-ml圆底烧瓶中添加在ch2cl2(80ml)和et3n(3g,29.65mmol,3.00当量)中的甲基氮杂环丙烷-2-甲酸酯(1g,9.89mmol,1.00当量)溶液,随后在0℃下在搅拌下,逐滴添加在ch2cl2(20ml)中的4-(1h-1,2,3-三唑-1-基)苯甲酰氯(2.3g,11.08mmol,1.12当量)溶液。将所得溶液在25℃下搅拌1h,然后用1x50ml的水和1x50ml的盐水洗涤,经na2so4干燥,并且在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(1:3)的硅胶柱上。这形成2.5g(93%)呈白色固体的产物。甲基3-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]丙酸酯在50-ml圆底烧瓶中,将在先前步骤中产生的化合物(1.5g,5.51mmol,1.00当量)、ch3cn(20ml)、(1s,2r)-2-(4-氟苯基)环丙-1-胺盐酸盐(2.6g,13.86mmol,2.50当量)、以及et3n(1.4g,13.84mmol,2.48当量)进行合并。将所得溶液在80℃下在油浴中搅拌16h,然后用50ml的etoac稀释,用1x30ml的水和1x30ml的盐水洗涤,经na2so4干燥,并且在真空下浓缩。将残余物施加到硅胶柱(其中etoac/石油醚(2:1))上,提供1g(43%)呈灰白色固体的ph-ima-2013-003-362-11。甲基3-[[(1r,2s)-2-(4-氟苯基)环丙基](叔丁氧基羰基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]丙酸酯(204)在50-ml圆底烧瓶中,将在先前步骤中产生的化合物(1g,2.36mmol,1.00当量)、ch2cl2(20ml)、et3n(500mg,4.94mmol,2.09当量)、以及二碳酸二-叔丁酯(780mg,3.57mmol,1.51当量)合并。将所得溶液在25℃下搅拌16h。将所得混合物用1x30ml的水和1x30ml的盐水洗涤,经na2so4干燥,并且在真空下浓缩。将残余物施加到硅胶柱(其中etoac/石油醚(1:2))上,提供600mg(49%)呈白色固体的ph-ima-2013-003-362-12。3-[[(1r,2s)-2-(4-氟苯基)环丙基](叔丁氧基羰基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]丙酸(205)向50-ml圆底烧瓶中添加在先前步骤中产生的化合物(600mg,1.15mmol,1.00当量)在thf(25ml)中的溶液,随后添加在水(6ml)中的lioh(41mg,1.71mmol,1.49当量)。将所得溶液在25℃下搅拌2h。将所述溶液的ph值用hcl(2m)调节至5。将所得溶液用2x30ml的etoac提取,并且合并这些有机层,并且用1x30ml的盐水洗涤,经无水na2so4干燥,并且在真空下浓缩,提供580mg(99%)呈白色固体的产物。n-[3-[[(1r,2s)-2-(4-氟苯基)环丙基](叔丁氧基羰基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代丙-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(206)在100-ml圆底烧瓶中,将来自先前步骤的化合物(580mg,1.14mmol,1.00当量)、thf(40ml)、和3-(二乙氧基磷酰基氧基)-1,2,3-苯并三嗪-4(3h)-酮(“depbt”)(530mg,1.77mmol,1.56当量)进行合并,随后在0℃下添加咪唑(120mg,1.76mmol,1.55当量)。将所述混合物搅拌40min。在0℃下在搅拌下,向该混合物中逐滴添加在thf(10ml)中的1-甲基哌嗪(180mg,1.80mmol,1.58当量)溶液。将所得溶液在25℃下搅拌16h,用50ml的etoac稀释,然后用1x50ml的饱和nahco3和1x50ml的盐水洗涤。将所述有机层经na2so4干燥,并且在真空下浓缩,提供600mg(89%)呈浅黄色油的产物。n-[3-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代丙-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(1)在50-ml圆底烧瓶中,将来自先前步骤的化合物(600mg,1.01mmol,1.00当量)、ch2cl2(20ml)、和cf3cooh(4ml)进行合并。将所得溶液在25℃下搅拌2h。将所述溶液的ph值用饱和nahco3调节至9。将所得溶液用3x30ml的etoac提取,并且将这些有机层合并,并且用1x50ml的盐水洗涤。将这些有机层经na2so4干燥,并且在真空下浓缩。将所述粗产物(5ml)通过制备型hplc,用以下条件(2#-分析型hplc-shimadzu(hplc-10))进行纯化:柱,xbridgec18obd制备型柱,100?10μm,19mmx250mm;流动相,waters(10mmol/lnh4hco3)和acn--waters(在6min内20.0%的acn--waters高达60.0%);检测器,uv254/220nm。获得150ml产物。这形成330mg(66%)呈白色固体的1。实例4方案24的合成4-苯基苯甲酰氯在250-ml圆底烧瓶中,将4-苯基苯甲酸(15g,75.67mmol,1.00当量)和亚硫酰氯(30ml)合并。在80℃下,在油浴中,将所得溶液搅拌16h,然后在真空下浓缩,形成15g(91%)呈灰白色固体的产物。(2s)-2-[(4-(苯基)苯基)甲酰胺基]-4-[(叔丁基联苯甲硅烷基)氧基]丁酸将用于制备203的方法与(2s)-2-氨基-4-[(叔丁基联苯甲硅烷基)氧基]丁酸(6.8g,19.02mmol,1.00当量)和4-苯基苯甲酰氯(5g,23.08mmol,1.20当量)一起使用,提供8g(78%)呈黄色油的ph-ima-2013-003-174-2。n-[1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代-4-((叔丁基联苯甲硅烷基)氧基)-丁-2-基]-4-苯基苯甲酰胺将用于制备206的方法与来自先前步骤的化合物(5g,9.29mmol,1.00当量)和硫代吗啉-1,1-二氧化物盐酸盐(2.4g,13.98mmol,1.50当量)一起使用,以提供5g(83.3%)呈灰白色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[4-(苯基)苯基)甲酰胺基]-1-丁醇(207)在250-ml圆底烧瓶中,将来自先前步骤的化合物(22g,33.59mmol,1.00当量)和thf(150ml)进行合并。在0℃下在搅拌下,将bu4nf(66ml,66mmol,在thf中1.0m)逐滴添加。将所得溶液在25℃下搅拌16h,在真空下浓缩,用100ml的etoac稀释,并且用4x100ml的水和2x100ml的盐水洗涤。将合并的有机层经na2so4干燥,并且施加到具有etoac的硅胶柱上以提供10g(71%)呈灰白色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[4-(苯基)苯基)甲酰胺基]-1-丁醛(208)在吹扫并保持在氮惰性气氛下的500-ml烧瓶中,在ch2cl2(250ml)中将在先前步骤中产生的化合物(10g,24.01mmol,1.00当量)进行合并。这随后将戴斯-马丁高碘烷(20.4g,48.11mmol,2.00当量)在0℃下逐份添加。在25℃下,将所得溶液搅拌1h,然后经硅藻土过滤出,在减压下浓缩,用30mlch2cl2稀释,并且施加到硅胶柱(其中etoac/石油醚(1:1))上以提供9g(90%)呈白色固体的产物。n-[(2s)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基]-4-苯基苯甲酰胺(4)在吹扫并保持在氮惰性气氛下的50-ml烧瓶中,将来自先前步骤的化合物(450mg,1.09mmol,1.00当量)的溶液、ch2cl2(10ml)、和(1r,2s)-2-(4-氟苯基)环丙-1-胺(30mg,0.39mmol,1.20当量)进行合并。这随后将nabh(aco)3(552mg,2.60mmol,2.40当量)在0℃下逐份添加。在25℃下,将所得溶液搅拌10min。然后通过添加5ml的水将所述反应淬灭。将所得溶液用3x10ml的ch2cl2提取,并且将所述有机层合并,经na2so4干燥,在减压下浓缩,并且用制备型hplc纯化,以提供223.9mg(38%)呈白色固体的产物。实例12方案312的合成4-(1h-吡唑-1-基)苯甲酰氯将用于制备201的方法与4-(1h-吡唑-1-基)苯甲酸(100mg,0.53mmol)一起使用,提供110mg(粗)呈黄色固体的4-(1h-吡唑-1-基)苯甲酰氯。叔丁基n-[(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[[4-(1h-吡唑-1-基)苯基]甲酰胺基]丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯将用于制备203的方法与叔丁基n-[(3s)-3-氨基-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯(227mg,0.48mmol,1.00当量)和4-(1h-吡唑-1-基)苯甲酰氯(110mg,0.53mmol,1.10当量)一起使用,提供150mg(49%)呈黄色油的产物。n-[(2s)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基]-4-(1h-吡唑-1-基)苯甲酰胺在50-ml圆底烧瓶中,将来自先前步骤的化合物(150mg,0.23mmol,1.00当量)、cf3cooh(1ml)、和ch2cl2(10ml)进行合并。将所述溶液在室温下搅拌12h,然后在减压下浓缩,并且通过制备型hplc进行纯化,提供63.1mg(42%)呈白色固体的12三氟乙酸盐。实例20方案420的合成乙基4-甲磺酰基苯基苯甲酸酯在吹扫并保持在氮惰性气氛下的500-ml圆底烧瓶中,将在二噁烷(200ml)中的4-溴苯甲酸乙酯(5g,21.83mmol,1.00当量)溶液、(4-甲磺酰基苯基)硼酸(5.2g,26.00mmol,1.19当量)、和在水(20ml)中的k2co3(6g,43.41mmol,1.99当量)溶液、pd(pph3)4(2.5g)进行合并。将所得溶液在100℃下在油浴中搅拌16h,然后冷却至室温,用500ml的h2o稀释,并且用3x200ml的etoac进行提取。将这些有机层合并,用1x500ml的盐水洗涤,经na2so4干燥,并且在减压下浓缩。将所述粗产物通过重结晶从etoac中进行纯化,以提供6g呈白色固体的产物。4-甲磺酰基苯基苯甲酸(209)在250-ml圆底烧瓶中,将来自先前反应的产物(9g,29.57mmol,1.00当量)、甲醇(150ml)、naoh(3g,75.00mmol,2.54当量)进行合并。将所得溶液在25℃下搅拌5h,然后在真空下浓缩,并且用200ml的h2o稀释。将所述水性溶液的ph值用hcl(2m)调节至2。将形成的这些固体通过过滤收集,并且在烘箱中干燥,提供6g(73%)呈白色固体的产物。4-甲磺酰基苯基苯甲酰氯将用于制备201的方法与来自先前步骤的化合物(5g,18.10mmol)一起使用,提供5g(94%)呈浅黄色固体的产物。n-((s)-4-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-(4-(甲基磺酰基)哌嗪-1-基)-1-氧代丁-2-基)-4'-(甲基磺酰基)联苯-4-甲酰胺合成的其余部分如方案2那样进行。实例21方案521的合成4-(甲氧基羰基)苯甲酰氯将用于制备201的方法与4-(甲氧基羰基)苯甲酸(2g,11.10mmol)一起使用,以提供2.2g(100%)呈黄色固体的产物。n-(2,2-二乙氧基乙基)-4-(甲氧基羰基)苯甲酰胺将用于制备203的方法与来自先前步骤的化合物和2,2-二乙氧基乙-1-胺(1.22g,9.16mmol)一起使用,以提供3g(92%)呈黄色固体的产物。甲基4-(噁唑-2-基)-苯甲酸酯向吹扫并保持在氮惰性气氛下的500-ml圆底烧瓶中放置来自先前步骤的产物(3g,10.16mmol,1.00当量)、甲磺酸(150ml)、五氧化二磷(8.52g,59.18mmol,5.00当量)。将所得溶液在140℃下在油浴中搅拌2h,冷却至室温,并且用3x150ml的etoac进行提取。将这些有机层合并,经na2so4干燥,在减压下浓缩,并且施加到硅胶柱(其中etoac/石油醚(1:1))上,提供1.5g(73%)呈黄色固体的产物。4-(噁唑-2-基)-苯甲酸将用于制备209的方法与来自先前步骤的产物(1.5g,7.38mmol,1.00当量)一起使用,以提供1.2g(86%)呈黄色固体的产物。n-((s)-4-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基)-4-(噁唑-2-基)苯基-4-甲酰胺合成的其余部分如方案2那样进行。实例23方案623的合成(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-3-基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊酸将用于制备203的方法与(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-氨基戊酸(800mg,2.61mmol,1.00当量)和4-(1h-1,2,3-三唑-1-基)苯甲酰氯(800mg,3.85mmol,1.50当量)一起使用,以提供550mg(44%)呈黄色固体的产物。n-[(2s)-1-(4-(叔丁基氧基羰基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备206的方法与来自先前步骤的化合物(250mg,0.52mmol,1.00当量)和4-(叔丁基氧基羰基)哌嗪(148mg,0.79mmol,1.50当量)一起使用,以提供210mg(62%)呈黄色固体的产物。n-[(2s)-1-(4-(叔丁基氧基羰基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(210)向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置来自先前步骤的化合物(210mg,0.32mmol,1.00当量)、thf(30ml)、巴比妥酸(127mg,0.81mmol,2.50当量)、以及四(三苯基膦)钯(94mg,0.08mmol,0.25当量)。将所得溶液在50℃下在油浴中搅拌2h,然后在减压下浓缩,施加到硅胶柱(其中ch2cl2/甲醇(10:1))上,提供150mg(76%)呈黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代-1-(1h-1,2,3-三唑-1-基)戊-2-基]-4-(嘧啶-2-基)苯甲酰胺三氟乙酸盐将用于制备1的程序与在先前步骤中产生的化合物(150mg,0.25mmol,1.00当量)一起使用,以提供53.2mg(43%)呈灰白色固体的产物。实例35方案735的合成n-[(2s)-1-(3-氰基氮杂环丁烷-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-氧代戊-2-基]-4-(1h-吡唑-1-基)苯甲酰胺将用于制备206的方法与(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(1h-吡唑-1-基)苯基]甲酰胺基]戊酸(400mg,0.84mmol,1.00当量)和氮杂环丁烷-3-甲腈一起使用,以提供301mg(66%)呈浅黄色油的产物。n-[(2s)-1-(3-氰基氮杂环丁烷-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(1h-吡唑-1-基)苯甲酰胺(35)将用于制备210的方法与在先前步骤中产生的化合物(301mg,0.56mmol,1.00当量)一起使用,以提供72.1mg(26%)呈灰白色固体的35。实例86方案886的合成n-[(2s)-1-(4-(叔丁基氧基羰基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺将用于制备206的方法与(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊酸(250mg,0.51mmol,1.00当量)和1-叔丁基-1^3,3,6-氧杂二氮杂环辛烷-2-酮(143mg,0.76mmol,1.50当量)一起使用,以提供280mg(66%)呈黄色固体的产物。n-[(2s)-1-(4-(叔丁基氧基羰基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺将用于制备210的方法与在先前步骤中产生的化合物(280mg,0.43mmol)一起使用,以提供0.2g(76%)呈黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代-1-(哌嗪-1-基)戊-2-基]-4-(嘧啶-2-基)苯甲酰胺三氟乙酸盐(86)将用于制备1的方法与在先前步骤中产生的化合物(200mg,0.32mmol)一起使用,以提供70mg(34%)呈白色固体的86。实例91方案991的合成n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-乙氧羰基哌啶-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备206的方法与(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊酸(200mg,0.42mmol,1.00当量)和甲基哌啶-4-甲酸酯(80mg,0.56mmol,1.33当量)一起使用,以提供180mg(71%)呈无色油的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-乙氧羰基哌啶-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备210的方法与在先前步骤中产生的化合物(180mg,0.30mmol)一起使用,以提供100mg(60%)呈橙色油的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-羧基哌啶-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(91)在50-ml圆底烧瓶中,将在thf(20ml)中的来自先前步骤的化合物(100mg,0.17mmol,1.00当量)和在水(5ml)中的lioh(20mg,0.84mmol,4.82当量)进行合并。将所得溶液在25℃下搅拌16h,然后在真空下浓缩。将所述粗产物通过制备型hplc纯化,提供52.9mg(46%)呈浅黄色固体的产物。实例92方案1092的合成4-氰基-n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]苯甲酰胺(211)在100-ml圆底烧瓶中,将4-氰基苯甲酸(136.7mg,0.93mmol,1.20当量)、ch2cl2(20ml)、i-pr2net(298mg,2.31mmol,3.00当量)、和1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶3-氧化六氟磷酸酯(“hatu”)(439mg,1.15mmol,1.50当量)的溶液进行合并。将所述混合物搅拌1h,然后添加(2s)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)戊-1-酮(300mg,0.77mmol,1.00当量)在ch2cl2(5ml)中的溶液。将所得溶液在25℃下搅拌60min,然后在真空下浓缩,并且施加到硅胶柱(其中ch2cl2/甲醇(10:1))上,提供480mg(120%)呈浅黄色液体的产物。4-氰基-n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]苯甲酰胺(92)将用于制备210的方法与在先前步骤中产生的化合物(480mg,0.93mmol)一起使用,以提供46.7mg(11%)呈浅黄色固体的92。实例109方案11109的合成甲基4-[[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]氨甲酰基]苯甲酸酯将用于制备211的方法与4-(甲氧基羰基)苯甲酸(231.4mg,1.28mmol,1.00当量)和(2s)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)戊-1-酮(500mg,1.28mmol,1.00当量)一起使用,以提供420mg(59%)呈浅黄色油的产物。甲基4-[[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]氨甲酰基]苯甲酸酯(109)将用于制备210的方法与在先前步骤中产生的化合物(420mg,0.76mmol)一起使用,以提供650mg(99%)呈橙色油的产物。4-[[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]氨甲酰基]苯甲酸(109)在100-ml圆底烧瓶中,将来自先前步骤的化合物(650mg,1.27mmol,1.00当量)、lioh(60mg,2.51mmol,2.00当量)、甲醇(20ml)、以及水(13ml)进行合并。将所得溶液在室温下搅拌3h。将所得混合物在真空下浓缩。将所述粗产物通过制备型hplc进行纯化,以提供45.1mg(7%)呈橙色固体的产物。实例109方案12110的合成n-[(2r)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]氨基甲酸酯将用于制备211的方法与2-[[(叔丁氧基)羰基]氨基]-5-[[2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸(1g,2.46mmol,1.00当量)和1-甲基哌嗪(500mg,4.99mmol,2.00当量)一起使用,以提供1.1g(95%)呈灰白色油的产物。4-(1h-1,2,3-三唑-1-基)苯甲酸(926mg,4.90mmol)(2r)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)戊-1-酮将用于制备1的程序与在先前步骤中产生的化合物(2.4g,4.91mmol)一起使用,以提供1.8g(95%)呈灰白色油的产物。n-[(2r)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物(1.9g,4.89mmol,1.00当量)一起使用,以提供1.2g(44%)呈灰白色油的产物。n-[(2r)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(110)将用于制备210的方法与在先前步骤中产生的化合物(1.2g,2.14mmol)一起使用,以提供15.1mg(1%)呈白色固体的110。实例111方案13111的合成(2s)-2-[[(叔丁氧基)羰基]氨基]-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸在250-ml圆底烧瓶中,将(2s)-2-氨基-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸;cf3cooh(2g,4.76mmol,1.00当量)、1,4-二噁烷(100ml)、boc2o(1.44g,6.60mmol,1.39当量),以及在h2o(25ml)中的na2co3(1.4g,13.21mmol,2.78当量)溶液进行合并。将所得溶液在室温下搅拌1h,在真空下浓缩,用40ml的dmf稀释,并且施加到c18柱(其中mecn/h2o(1:1))上,提供1.8g(93%)呈浅黄色油的产物。叔丁基n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]氨基甲酸酯将用于制备206的方法与(2s)-2-[[(叔丁氧基)羰基]氨基]-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸(900mg,2.21mmol,1.00当量)和哌啶-4-醇(335mg,3.31mmol,1.50当量)一起使用,以提供1.2g(98%)呈浅黄色油的产物。(2s)-2-氨基-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)戊-1-酮;三氟乙酸盐将用于制备1的方法与在先前步骤中产生的化合物(1.2g,2.45mmol,1.00当量)一起使用,以提供880mg(71%)呈黄色油的产物。n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物(400g,794.39mmol,1.00当量)和4-(1h-1,2,3-三唑-1-基)苯甲酸(205mg,1.08mmol)一起使用,以提供300mg呈黄色固体的产物。n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-羟基哌啶-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(111)将用于制备210的方法与在先前步骤中产生的化合物(300mg,0.54mmol)一起使用,以提供(23%)呈灰白色固体的111。实例117方案14117的合成叔丁基n-[(2r)-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-氧代-1-(3-(二甲基氨基)-氮杂环丁烷-1-基)-戊-2-基]氨基甲酸酯将用于制备206的方法与(2s)-2-[[(叔丁氧基)羰基]氨基]-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸(400mg,0.98mmol,1.00当量)和n,n-二甲基氮杂环丁烷-3-胺(147.9mg,1.48mmol,1.50当量)一起使用,以提供490mg(99%)呈灰白色固体的产物。1-氧代-1-(3-(二甲基氨基)-氮杂环丁烷-1-基)-(2r)-2-氨基-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-戊烷将用于制备1的程序与在先前步骤中产生的化合物(490mg,1.00mmol,1.00当量)一起使用,以提供470mg(99%)呈浅黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(3-(二甲基氨基)-氮杂环丁烷-1-基-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)-苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物(470mg,1.21mmol,1.00当量)一起使用,以提供608mg(90%)呈浅黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(3-(二甲基氨基)-氮杂环丁烷-1-基-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)-苯甲酰胺(117)将用于制备210的方法与在先前步骤中产生的化合物(978mg,1.75mmol,1.00当量)一起使用,以提供61.0mg(7%)呈灰白色固体的117。实例126方案15126的合成2-[4-[(2s)-2-[(4-氰基苯基)甲酰胺基]-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]戊酰基]哌嗪-1-基]乙酸酯(126)在100-ml圆底烧瓶中,将在thf(20ml)中的乙基2-[4-[(2s)-2-[(4-氰基苯基)甲酰胺基]-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]戊酰基]哌嗪-1-基]乙酸酯(150mg,0.27mmol,1.00当量)溶液和在水(5ml)中的lioh(13.1mg,0.55mmol,2.00当量)溶液进行合并。将所得溶液在25℃下搅拌2h。将所述溶液的ph值用水性hcl(2m)调节至3至4。将所得混合物在真空下浓缩。将所述残余物施加到反相硅胶柱(其中mecn/h2(1:10))上。将所述粗产物(5ml)通过制备型hplc进行纯化,以提供108mg(64%)呈浅黄色固体的126。实例127方案16127的合成n-苄基n-[(1r,2s)-2-(4-氟苯基)环丙基]-n-[(4r)-5-(4-甲基哌嗪-1-基)-5-氧代-4-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊基]氨基甲酸酯(127)在吹扫并保持在氮惰性气氛下的50-ml圆底烧瓶中,将在四氢呋喃(5ml)中n-[(2r)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(40mg,0.08mmol,1.00当量)的溶液、tea(23mg,0.23mmol,3.00当量)、cbzcl(19.7mg,0.12mmol,1.50当量)进行合并。将所得溶液在室温下搅拌1h,并且然后通过添加15ml的水/冰将其淬灭,用3x20ml的etoac进行提取。将这些有机层合并,用3x20ml的盐水洗涤,经na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中二氯甲烷/甲醇(20:1))上,以提供49.5mg(98%)呈灰白色固体的127。实例128方案17128的合成(2s)-5-甲氧基-5-氧代-2-[(4-苯基苯基)甲酰胺基]戊酸将用于制备203的方法与(2s)-2-氨基-5-甲氧基-5-氧代戊酸(4.9g,30.41mmol,1.00当量)和4-苯基苯甲酰氯(5g,23.08mmol,0.76当量)一起使用,以提供4g(39%)呈白色固体的产物。甲基(4s)-5-(4-甲磺酰基哌嗪-1-基)-5-氧代-4-[(4-苯基苯基)甲酰胺基]戊酸酯将用于制备206的方法与(2s)-5-甲氧基-5-氧代-2-[(4-苯基苯基)-甲酰胺基]戊酸(2g,5.86mmol,1.00当量)和1-甲磺酰基哌嗪(1.15g,7.00mmol,1.20当量)一起使用,以提供2.5g(88%)呈灰白色固体的产物。(4s)-5-(4-甲磺酰基哌嗪-1-基)-5-氧代-4-[(4-苯基苯基)甲酰胺基]戊酸在250-ml圆底烧瓶中,将来自先前步骤的化合物(1g,2.05mmol,1.00当量)、lioh(73mg,3.05mmol,1.49当量)、和thf/h2o(50/12ml)进行合并。将所得溶液在室温下搅拌1h。将所述溶液的ph值用hcl(2m)调节至2。将所得溶液用3x30ml的etoac提取,并且将这些有机层进行合并,并且经na2so4干燥,并且在真空下浓缩,提供700mg(72%)呈灰白色固体的产物。(4s)-5-(4-甲磺酰基哌嗪-1-基)-5-氧代-4-[(4-苯基苯基)甲酰胺基]-1-戊醇(202)在100-ml圆底烧瓶中,将在thf(10ml)中的来自先前步骤的化合物(700mg,1.48mmol,1.00当量)溶液和bh3(在thf中1m)(2.2ml)进行合并。将所得溶液在室温下搅拌2h。然后将所述反应通过添加20ml的水淬灭,然后用3x20ml的etoac进行提取。将这些有机层合并,经na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:1))上,以提供400mg(59%)呈黄色油的产物。(4s)-5-(4-甲磺酰基哌嗪-1-基)-5-氧代-4-[(4-苯基苯基)甲酰胺基]戊基甲烷磺酸酯在50-ml圆底烧瓶中,将在ch2cl2(5ml)中的来自先前步骤的化合物(300mg,0.65mmol,1.00当量)和et3n(132mg,1.30mmol,2.00当量)溶液进行合并。在0℃下在搅拌下,随后将甲烷磺酰氯(90mg,0.78mmol,1.20当量)逐滴添加。将所得溶液在室温下搅拌30min。然后将所述反应通过添加10ml的水淬灭。将所得溶液用3x10ml的ch2cl2提取,并且将这些有机层进行合并,并且经无水na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:2))上,以提供200mg(57%)呈灰白色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲磺酰基哌嗪-1-基)-1-氧代戊-2-基]-4-苯基苯甲酰胺(128)在吹扫并保持在氮惰性气氛下的50-ml圆底烧瓶中,将来自先前步骤的化合物(200mg,0.37mmol,1.00当量)、ipr2net(96mg,0.74mmol,2.00当量)、ki(62mg)、(1r,2s)-2-(4-氟苯基)环丙-1-胺(62mg,0.41mmol,1.10当量)、以及ch3cn(10ml)进行合并。将所得溶液在油浴中在50℃下搅拌12h。然后将所述反应通过添加10ml的水淬灭。将所得溶液用3x10ml的etoac提取,并且将这些有机层进行合并,并且经无水na2so4干燥,并且在真空下浓缩。将所述粗产物通过制备型hplc进行纯化,提供12.7mg(6%)呈灰白色固体的128。实例129方案18129的合成(2s)-5-甲氧基-5-氧代-2-[[4-(1h-1,2,3-三唑-1-基)苯基]]-戊酸将用于制备203的方法与(2s)-2-氨基-5-甲氧基-5-氧代戊酸(3g,18.63mmol,1.00当量)和4-(1h-1,2,3-三唑-1-基)苯甲酰氯(4.65g,22.36mmol,1.20当量)一起使用,以提供2.5g(40%)呈黄色油的产物。甲基(4s)-5-(4-甲基哌嗪-1-基)-5-氧代-4-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]-戊酸酯将用于制备206的方法与在先前步骤中产生的化合物(2.5g,7.53mmol,1.00当量)和1-甲基哌嗪(1.13g,11.30mmol,1.50当量)一起使用,以提供2g(64%)呈黄色油的产物。(4s)-5-(4-甲基哌嗪-1-基)-5-氧代-4-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]-戊酸将用于制备205的方法与在先前步骤中产生的化合物(2g,4.83mmol)一起使用,以提供1.8g(93%)呈灰白色固体的产物。(4s)-5-(4-甲基哌嗪-1-基)-5-氧代-4-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]-1-戊醇在100-ml圆底烧瓶中,将在thf(20ml)中的来自先前步骤的产物(1.6g,4.00mmol,1.00当量)溶液、n-甲基吗啉(983mg,8.40mmol,2.10当量)、和叔丁基氯甲酸酯(1151mg,8.40mmol,2.10当量)进行合并。将所得混合物在-20℃下搅拌2h,然后添加在甲醇(10ml)中的nabh4(1.52g,40.0mmol,10.00当量)。将所得溶液在-20℃下在液氮浴中搅拌2h。将所得混合物在真空下浓缩。将所述残余物施加到硅胶柱(其中乙酸乙酯/石油醚(10:1))上,提供450mg(29%)呈灰白色固体的产物。(4s)-5-(4-甲基哌嗪-1-基)-5-氧代-4-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]-戊醛将用于制备208的方法与在先前步骤中产生的化合物(200mg,0.52mmol,1.00当量)一起使用,以提供150mg(75%)呈灰白色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-甲氧基苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(129)在25-ml圆底烧瓶中,将来自先前步骤的化合物(150mg,0.391mmol,1.00当量)、(1r,2s)-2-(4-甲氧基苯基)环丙胺(76mg,0.47mmol,1.20当量)、nabh(oac)3(199mg,0.94mmol,2.40当量)、和ch2cl2(20ml)的溶液进行合并。将所得溶液在25℃下搅拌10min,然后用30ml的h2o进行稀释,并且用2x20ml的ch2cl2提取。将这些有机层合并,经na2so4干燥,并且在真空下浓缩。将所述粗产物通过制备型hplc进行纯化,提供5.9mg(2.8%)呈灰白色固体的129。实例130方案19130的合成甲基4-叠氮基-2-氟苯甲酸酯向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置在氯化氢(5ml)中的甲基4-氨基-2-氟苯甲酸酯(1g,5.91mmol,1.00当量)溶液、在水(5ml)中的nano2(407mg,5.90mmol,1.00当量)溶液、在水(5ml)中的nan3(575mg,8.85mmol,1.50当量)溶液。将所得溶液在0℃下搅拌15min。将这些固体过滤出。将所得混合物在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(1:1)的硅胶柱上。这形成800mg(69%)呈黄色固体的产物。甲基2-氟-4-[5-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基]苯甲酸酯向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置在甲醇(20ml)中的甲基4-叠氮基-2-氟苯甲酸酯(800mg,4.10mmol,1.00当量)溶液、乙炔基三甲基硅烷(603mg,6.14mmol,1.50当量)、cui(1.2g,6.30mmol,1.50当量)、tea(1.2g,11.88mmol,3.00当量)。将所得溶液在室温下搅拌16h。然后将反应通过添加50ml的水/冰淬灭。将所得溶液用3x50ml的乙酸乙酯提取并且将有机层合并并在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(1:1)的硅胶柱上。这形成700mg(58%)呈黄色固体的产物。甲基2-氟-4-(1h-1,2,3-三唑-1-基)苯甲酸酯向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置在四氢呋喃(10ml)中的甲基2-氟-4-[5-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基]苯甲酸酯(700mg,2.39mmol,1.00当量)溶液、tbaf(1.25g,4.78mmol,2.00当量)、acoh(144mg,2.40mmol,1.00当量)。将所得溶液在室温下搅拌2天。然后将反应通过添加50ml的水/冰淬灭。将所得溶液用3x50ml的乙酸乙酯提取并且将有机层合并并在真空下浓缩。将残余物施加到硅胶柱(其中二氯甲烷/甲醇(100:1))上。这形成550mg(粗)呈黄色固体的产物。2-氟-4-(1h-1,2,3-三唑-1-基)苯甲酸将用于制备205的程序与在先前步骤中产生的化合物一起使用,以提供450mg(87%)呈浅黄色固体的产物。2-氟-n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物(160mg,0.77mmol,1.00当量)和(2s)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)戊-1-酮(300mg,0.77mmol,1.00当量)一起使用,以提供250mg(56%)呈黄色固体的产物。2-氟-n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(130)将用于制备210的方法与在先前步骤中产生的化合物(250mg,0.43mmol)一起使用,以提供33.2mg(14%)呈浅棕色固体的130。实例131方案20131的合成叔丁基4-氨甲酰基-4-氟哌啶-1-甲酸酯在250-ml圆底烧瓶中,将1-[(叔丁氧基)羰基]-4-氟哌啶-4-甲酸(3g,12.13mmol,1.00当量)、dmf(50ml)、nh4cl(1.75g,32.72mmol,1.50当量)、hatu(9.23g,24.27mmol,2.00当量)、以及ipr2net(3.13g,24.22mmol,2.00当量)进行合并。将所得溶液在25℃下搅拌过夜。将所得溶液用200ml的etoac进行提取,并且将这些有机层进行合并,用5x50ml的h2o洗涤,然后施加到具有乙酸乙酯/石油醚的硅胶柱上,提供2.7g(90%)呈白色固体的产物。叔丁基4-氰基-4-氟哌啶-1-甲酸酯在250-ml圆底烧瓶中,将来自先前步骤的化合物(1.6g,6.50mmol,1.00当量)、吡啶(15ml)、tfaa(10ml)、以及thf(30ml)进行合并。将所得溶液在0℃下在水/冰浴中搅拌1h。将所述粗产物(50ml)用以下条件(intelflash-1)通过快速制备型hplc进行纯化:柱,c18硅胶;流动相,30min内mecn/h2o=0/100增加至mecn/h2o=50/50;检测器,uv254nm。获得10ml产物,提供1.2g(81%)呈白色固体的产物。4-氟哌啶-4-甲腈在250-ml圆底烧瓶中,将来自先前步骤的化合物(800mg,3.50mmol,1.00当量)、cf3cooh(1ml)、和ch2cl2(5ml)进行合并。将所得溶液在25℃下搅拌1h,然后在真空下浓缩,以提供350mg(78%)呈白色固体的产物。n-[(2s)-1-(4-氰基-4-氟哌啶-1-基)-1-氧代-5-[[(1r,2s)-2-苯基环丙基](丙-2-烯-1-基)氨基]戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备206的方法与(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊酸(700mg,1.47mmol,1.00当量)和4-氟哌啶-4-甲腈(350mg,2.73mmol,2.00当量)一起使用,以提供816mg(98%)呈黄色油的产物。n-[(2s)-1-(4-氰基-4-氟哌啶-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(131)将用于制备210的方法与来自先前步骤的化合物一起使用,以提供40.7mg(5%)呈白色固体的产物。实例132方案21132的合成(4s)-n-甲基-n-甲氧基-5-(叔丁氧基)-4-[(叔丁氧基羰基)氨基]-5-氧代戊酰胺在1-l圆底烧瓶中,将在ch2cl2(200ml)中的(4s)-5-(叔丁氧基)-4-[[(叔丁氧基)羰基]氨基]-5-氧代戊酸(20.0g,65.93mmol,1.00当量)溶液、edci(18.9g,98.59mmol,1.50当量)、hobt(13.4g,98.80mmol,1.50当量)、甲氧基(甲基)胺盐酸盐(9.7g,98.94mmol,1.50当量)、以及et3n(20.0g,197.65mmol,3.00当量)进行合并。将所得溶液在25℃下搅拌3h。然后用3x100ml的h2o进行洗涤,经na2so4干燥,在真空下浓缩,然后施加到硅胶柱(其中etoac/石油醚(1:3))上,以提供22.1g(96%)呈浅黄色油的产物。(4s)-n-甲基-n-甲氧基-5-(叔丁氧基)-4-[二(叔丁氧基羰基)氨基]-5-氧代戊酰胺将用于制备204的方法与来自先前步骤的化合物(19.1g,54.99mmol,1.00当量)一起使用,以提供23.6g(96%)呈浅黄色油的产物。(4s)-5-(叔丁基氧基)-4-[二(叔丁氧基羰基)氨基]-5-氧代戊醛在吹扫并保持在氮惰性气氛下的500-ml3-颈圆底烧瓶中,将在thf(50ml)中的来自先前步骤的化合物(6g,13.42mmol,1.00当量)溶液进行合并,随后在-78℃下在搅拌下经30min逐滴添加二异丁基氢化铝(30ml,2.50当量)。将所得溶液在-78℃下搅拌30min,然后通过添加50mlnh4cl(溶液)进行淬灭。将所得溶液用3x100ml的etoac进行提取。将这些有机层进行合并,经na2so4干燥,并且在真空下浓缩,提供6.3g呈浅黄色油的(粗)产物。叔丁基(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-2-[二(叔丁氧基羰基)氨基]戊酸酯在吹扫并保持在氮惰性气氛下的500-ml圆底烧瓶中将来自先前步骤的化合物(6.3g,16.26mmol,1.00当量)、2-(4-氟苯基)环丙-1-胺盐酸盐(2.45g,13.06mmol,0.80当量)、nabh(oac)3(8.25g,38.93mmol,2.40当量)、和甲醇(150ml)进行合并。将所得溶液在25℃下搅拌30min。将所得混合物在真空下浓缩,然后用100mletoac进行稀释。将所得混合物用3x20ml的h2o洗涤,干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:4))上,提供3.1g(36%)呈浅黄色油的产物。叔丁基(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-2-[二(叔丁氧基羰基)氨基]戊酸酯在吹扫并保持在氮惰性气氛下的500-ml圆底烧瓶中,将在dmf(10ml)中的来自先前步骤的化合物(3.1g,5.93mmol,1.00当量)溶液、k2co3(2.45g,17.78mmol,3.00当量)、和3-溴丙-1-烯(1.43g,11.85mmol,2.00当量)进行合并。将所得溶液在25℃下搅拌2h。将所得溶液用50ml的etoac进行稀释,然后用3x5ml的h2o洗涤,经na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:7))上,以提供3g(90%)呈浅黄色油的产物。(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-2-氨基戊酸在500-ml圆底烧瓶中,将来自先前步骤的化合物(3g,43.01mmol,1.00当量)和cf3cooh(10ml)进行合并。将所得溶液在25℃下搅拌16h,然后在真空下浓缩。将所述粗产物通过快速制备型hplc(其中ch3cn:h2o(1:100-15:1))进行纯化,以提供2g(83%)呈浅黄色固体的产物。(2s)-5-[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-2-[(叔丁氧基羰基)氨基]戊酸在500-ml圆底烧瓶中放置在二噁烷(20ml)中的来自先前步骤的化合物(2g,6.51mmol,1.00当量)溶液、(boc)2o(2.13g,9.77mmol,1.50当量)、在h2o(20ml)中的na2co3(2.07g,19.54mmol,3.0当量)。将所得溶液在室温下搅拌2h。将所述固体通过过滤去除,并且将所得溶液在真空下浓缩。将所述粗产物通过快速制备型hplc(其中ch3cn:h2o(1:100-1:1))进行纯化,以提供2.3g(86%)呈黄色油的产物。(2s)-2-[(叔丁氧基羰基)氨基]-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊烷将用于制备206的方法与来自先前步骤的化合物(2.3g,5.67mmol,1.00当量)和n-甲基哌嗪(850mg,8.50mmol,1.5当量)一起使用,以提供2.3g(83%)呈黄色油的ph-ima-2013-003-384-8。(2s)-2-[(叔丁氧基羰基)氨基]-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊烷将用于制备211的方法与来自先前步骤的化合物一起使用,以提供1.8g呈黄色油的产物。(2s)-n-[5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-2-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备211的方法与来自先前步骤的化合物(1.8g,4.63mmol,1.0当量)和4-(1h-1,2,3-三唑-1-基)苯甲酸(875mg,4.63mmol,1.0当量)一起使用,以提供1.7g(66%)呈黄色固体的产物。(2s)-n-[5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(132)将用于制备210的方法与来自先前步骤的化合物一起使用,以提供281.8mg(18%)呈浅黄色固体的132。实例134方案22134的合成甲基4-(2-吡嗪基)苯甲酸酯在吹扫并保持在氮惰性气氛下的250-ml圆底烧瓶中,将在1,4-二噁烷(30ml)中的[4-(甲氧基羰基)苯基]硼酸(1g,5.56mmol,1.20当量)溶液、2-溴吡嗪(800mg,5.03mmol,1.00当量)、na2co3(1.5g,14.15mmol,3.00当量)在水(30ml)中的溶液、以及pd(ph3p)2cl2(330mg,0.47mmol,0.10当量)进行合并。将所得溶液在90℃下在油浴中搅拌16h。将这些固体过滤出。将所得溶液用3x30ml的etoac进行提取,并且将这些有机层进行合并,并且在真空下浓缩。这形成0.8g(74%)呈白色固体的产物。4-(2-吡嗪基)苯甲酸在100-ml圆底烧瓶中,将在甲醇(20ml)中的甲基4-(吡嗪-2-基)苯甲酸酯(800mg,3.73mmol,1.00当量)溶液、在水(20ml)中的naoh(150mg,3.75mmol,1.00当量)溶液进行合并。将所得溶液在80℃下在油浴中搅拌16h。将所述溶液的ph值用hcl(1m)调节至7。将所述固体通过过滤收集。将所得混合物在真空下浓缩。这形成0.65g(87%)呈白色固体的产物。4-(2-吡嗪基)-苯甲酰氯在100-ml圆底烧瓶中,将4-(吡嗪-2-基)苯甲酸(650mg,3.25mmol,1.00当量)和亚硫酰氯(20ml)进行合并。将所得溶液在油浴中在80℃下搅拌16h。将所得混合物在真空下浓缩。这形成0.7g(99%)呈浅黄色固体的产物。(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(2-吡嗪基)苯基]甲酰胺基]戊酸将用于制备203的方法与在先前步骤中产生的化合物(500mg,1.63mmol,1.00当量)和4-(吡啶-2-基)苯甲酰氯(393mg,1.81mmol,1.10当量)一起使用,以提供360mg(45%)呈黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(吡嗪-2-基)苯甲酰胺将用于制备206的方法与在先前步骤中产生的化合物(360mg,0.74mmol,1.00当量)和1-甲基哌嗪(111mg,1.11mmol,1.50当量)一起使用,以提供300mg(71%)呈黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(吡嗪-2-基)苯甲酰胺(134)将用于制备210的方法与在先前步骤中产生的化合物(300mg,0.53mmol,1.00当量)一起使用,提供88.8mg(32%)呈灰白色固体的产物。实例135方案23135的合成甲基4-(嘧啶-5-基)苯甲酸酯在吹扫并保持在氮惰性气氛下的250-ml圆底烧瓶中,将在mecn(60ml)中的5-溴嘧啶(2.2g,13.84mmol,1.10当量)溶液进行合并。这随后逐份添加[4-(甲氧基羰基)苯基]硼酸(2.26g,12.56mmol,1.00当量)。在室温下在2min内,在搅拌下,向这一溶液中逐滴添加在水(30ml)中的na2co3(2.9g,27.36mmol,2.00当量)溶液。向所述混合物中逐份添加pd(pph3)4(1.45g,1.25mmol,0.10当量)。将所得溶液在90℃下搅拌4h,将这些固体通过过滤去除。将所得混合物在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(1:1)的硅胶柱上。这形成1.31g(49%)呈黄色固体的产物。4-(嘧啶-5-基)苯甲酸将用于制备209的方法与在先前步骤中产生的化合物(1.31g,6.12mmol,1.00当量)一起使用,以提供0.7g(57%)呈白色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(嘧啶-5-基)苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物(250mg,0.50mmol,1.00当量)一起使用,以提供(70%)呈黄色泡沫的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(嘧啶-5-基)苯甲酰胺(135)将用于制备210的方法与在先前步骤中产生的化合物(200mg,0.35mmol)一起使用,以提供15mg(8%)呈灰白色固体的135。实例137方案24137的合成叔丁基4-(d3)-甲基哌嗪-1-甲酸酯在100-ml圆底烧瓶中,将叔丁基哌嗪-1-甲酸酯(1g,5.37mmol,1.00当量)、k2co3(2.23g,16.13mmol,3.01当量)、和thf(40ml)进行合并。将所得溶液在室温下搅拌1h。这随后在-12℃下在搅拌下,逐滴添加碘甲烷-d3(780mg,5.38mmol,1.00当量)。将所得溶液在室温下搅拌过夜。将这些固体通过过滤去除,并且将所述粗产物通过制备型hplc进行纯化。将所得溶液用3x30ml的5:1ch2cl2:meoh进行提取,并且将所述有机层进行合并,并且在真空下浓缩,提供500mg(46%)呈无色油的产物。1-(d3)-甲基哌嗪将用于制备1的方法与在先前步骤中产生的化合物(500mg,2.46mmol,1.00当量)一起使用,以提供250mg(99%)呈无色油的产物。(2s)-2-[[(叔丁氧基)羰基]氨基]-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸将用于制备204的方法与(2s)-2-氨基-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]戊酸(1.29g,4.21mmol,1.00当量)和1,4-二噁烷(50ml)一起使用,提供1.3g(76%)呈白色固体的产物。叔丁基n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-[4-(d3)-甲基哌嗪-1-基]-1-氧代戊-2-基]氨基甲酸酯将用于制备206的方法与在先前步骤中产生的化合物(1.075g,2.64mmol,1.00当量)和1-(d3)-甲基哌嗪(300mg,2.91mmol,1.10当量)一起使用,以提供650mg(50%)呈黄色油的产物。(2s)-2-氨基-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-[4-(d3)-甲基哌嗪-1-基]戊-1-酮;三氟乙酸盐将用于制备1的方法与在先前步骤中产生的化合物(650mg,1.32mmol,1.00当量)一起使用,以提供710mg(96%)呈黄色油的产物。n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-[4-(d3)-甲基哌嗪-1-基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺将用于制备211的方法与在先前步骤中产生的化合物和4-(1h-1,2,3-三唑-1-基)苯甲酸(231mg,1.22mmol,1.23当量)一起使用,以提供700mg(96%)呈浅黄色油的产物。n-[(2s)-5-[[(2s)-2-(4-氟苯基)环丙基]氨基]-1-[4-(d3)-甲基哌嗪-1-基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(137)将用于制备210的方法与在先前步骤中产生的化合物(850mg,1.51mmol)一起使用,以提供112.2mg(14%)呈浅黄色固体的137。实例138方案25138的合成1-(叔丁氧基羰基)-(2,2,3,3,5,5,6,6-d8)哌嗪向250-ml圆底烧瓶中添加在甲醇(10ml)中的(2,2,3,3,5,5,6,6-d8)哌嗪二盐酸盐(1g,5.98mmol,1.00当量)溶液,随后添加在甲醇(10ml)中的naoh(480mg,12.00mmol,2.00当量)溶液。将所述混合物搅拌30min,然后添加cf3cooh(682mg,5.98mmol,1.00当量)。将所述反应混合物再搅拌15min,然后添加水(20ml)。将所述溶液搅拌30min,然后添加在甲醇(40ml)中的boc2o(1.3g,5.96mmol,1.00当量)和i2(152mg,0.60mmol,0.10当量)溶液。将所得溶液在25℃下搅拌3h,然后在真空下浓缩。将所述溶液的ph值用naoh(20%)调节至11。将这些固体通过过滤去除,并且将所得溶液用3x30ml的etoac提取。将这些有机层进行合并,用1x50ml的盐水洗涤,然后经na2so4干燥。将所得溶液在真空下浓缩,以提供1g(86%)呈灰白色固体的产物。1-(叔丁氧基羰基)-4-甲基-(2,2,3,3,5,5,6,6-d8)哌嗪在100-ml圆底烧瓶中,将来自先前步骤的化合物(1g,5.15mmol,1.00当量)、thf(30ml)、和k2co3(2.14g,15.48mmol,3.01当量)进行合并。将所述混合物搅拌1h,然后在-12℃下在搅拌下,将ch3i(730mg,5.14mmol,1.00当量)在thf(10ml)中的溶液逐滴添加。将所得溶液在25℃下搅拌16h。将形成的固体通过过滤去除。将所得溶液在真空下浓缩,用50ml的h2o稀释,并且用3x30ml的etoac提取。将这些有机层进行合并,用1x50ml的盐水洗涤,经na2so4干燥,并且在减压下浓缩,以提供500mg(47%)呈浅黄色油的产物。1-甲基-(2,2,3,3,5,5,6,6-d8)哌嗪将用于制备1的程序与在先前步骤中产生的化合物(500mg,2.40mmol,1.00当量)一起使用,以提供200mg(37%)呈浅黄色固体的ph-ima-2013-003-336-3。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基-(2,2,3,3,5,5,6,6-d8)-哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)-苯甲酰胺将用于制备206的方法与在先前步骤中产生的化合物和(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊酸(300mg,0.63mmol,1.00当量)一起使用,以提供150mg(42%)呈无色油的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基-(2,2,3,3,5,5,6,6-d8)-哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)-苯甲酰胺(138)将用于制备210的方法与在先前步骤中产生的化合物(150mg,0.26mmol)一起使用,以提供65.7mg(47%)呈白色固体的138。实例142方案26142的合成(2s)-2-[(4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]-己二酸在500-ml圆底烧瓶中,将在水(50ml)和二噁烷(50ml)中的(2s)-2-氨基己二酸(3g,18.62mmol,1.00当量)溶液,在h2o(50ml)中的na2co3(5.9g,55.67mmol,2.99当量)溶液进行合并。然后将在二噁烷(50ml)中的4-(1h-1,2,3-三唑-1-基)苯甲酰氯(4.26g,20.52mmol,1.10当量)溶液逐滴添加。将所得溶液在25℃下搅拌1h。将所述溶液的ph值用hcl(2m)调节至2。将所得溶液用3x150ml的etoac提取,并且将这些有机层进行合并,用1x300ml的盐水洗涤,经na2so4干燥,在真空下浓缩,并且施加到具有ch2cl2/甲醇的硅胶柱上,以提供4.5g呈灰白色固体的产物。(2s)-6-甲氧基-6-氧代-2-[(4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]-己酸在100-ml圆底烧瓶中添加在甲醇(40ml)中的(2s)-2-[(4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]-己二酸(2500mg,7.52mmol,1.00当量)溶液,随后在0℃下在搅拌下,逐滴添加accl(700mg)。将所得溶液在0℃下搅拌100min。将所述溶液的ph值用饱和nahco3调节至9。将所得溶液用2x20ml的etoac提取,并且将这些水层进行合并。使用hcl(2m)将ph调节至2。将所得溶液用3x50ml的etoac提取,并且将这些有机层进行合并,用1x50ml的盐水洗涤,经na2so4干燥,并且在真空下浓缩,提供1.5g(58%)呈无色油的产物。甲基(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]己酸酯将用于制备206的方法与来自先前步骤的化合物(1.5g,4.33mmol,1.00当量)和1-甲基哌嗪(500mg,4.99mmol,1.73当量)一起使用,以提供1g(54%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]己酸将用于制备205的方法与来自先前步骤的化合物(1g,2.33mmol)一起使用,以提供950mg(98%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]己醇(212)在100-ml圆底烧瓶中,将来自先前步骤的产物(980mg,2.36mmol,1.00当量)、n-甲基吗啉(500mg,4.94mmol,2.09当量)、和thf(50ml)进行合并,随后在-20℃下在搅拌下,逐滴添加i-buococl(500mg,3.65mmol,1.54当量)。将该混合物在-20℃下搅拌2h。在-20℃下在搅拌下,向该混合物中逐滴添加在甲醇(20ml)中的nabh4(1g,26.43mmol,11.18当量)溶液。将所得溶液在25℃下搅拌2h,在真空下浓缩,并且施加到硅胶柱(其中ch2cl2/甲醇(5:1))上,以提供300mg(32%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(1h-1,2,3-三唑-1-基)苯基)甲酰胺基]己醛将用于制备208的方法与来自先前步骤的化合物(300mg,0.75mmol,1.00当量)一起使用,以提供200mg(67%)呈灰白色固体的产物。n-[(2s)-6-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代己-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(142)将用于制备4的方法与来自先前步骤的化合物(200mg,0.50mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺(76mg,0.50mmol,1.00当量)一起使用,以提供21.4mg(7%)呈无色油的142。实例143方案27143的合成(2s)-2-[(4-氰基苯基)甲酰胺基]-己二酸将用于制备203的方法与(2s)-2-氨基己二酸(5g,31.03mmol,1.00当量)和4-氰基苯甲酰氯(5.2g,31.41mmol,1.01当量)一起使用,以提供7g(78%)呈无色油的产物。(2s)-2-[(4-氰基苯基)甲酰胺基]-6-羟基己酸在吹扫并保持在氮惰性气氛下的250-ml3-颈圆底烧瓶中,将来自先前步骤的产物(2g,6.89mmol)和thf(100ml)进行合并,随后在0℃下在搅拌下逐滴添加bh3(17ml,在thf中1m)。将所得溶液在0℃下搅拌2h。然后将所述反应通过添加5ml的甲醇进行淬灭。将所得混合物在减压下浓缩,用50ml的饱和na2co3稀释,并且用3x30ml的etoac洗涤。将这些水层进行合并,并且用hcl(2m)将其ph调节至2。将所得溶液用3x50ml的etoac提取,并且将有机层进行合并,用1x50ml的盐水洗涤,经na2so4干燥,并且在减压下浓缩,提供1g(53%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[(4-氰基苯基)甲酰胺基]己醇将用于制备206的方法与(2s)-2-[4-氰基苯基)甲酰胺基]-6-羟基己酸(1g,3.62mmol,1.00当量)和1-甲基哌嗪(540mg,5.39mmol,1.49当量)一起使用,以提供1g(77%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[(4-氰基苯基)甲酰胺基]己醛将用于制备208的方法与(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[(4-氰基苯基)甲酰胺基]己醇(500mg,1.39mmol)一起使用,以提供450mg(91%)呈灰白色固体的产物。n-[(2s)-6-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代己-2-基]-4-氰基苯甲酰胺(142)将用于制备4的方法与(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[(4-氰基苯基)甲酰胺基]己醛(450mg,1.26mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺(250mg,1.65mmol,1.31当量)一起使用,以提供174.1mg(28%)呈白色固体的产物。实例144方案28144的合成(2s)-2-氨基-6-甲氧基-6-氧代-己酸在250-ml圆底烧瓶中,将在甲醇(40ml)中的亚硫酰氯(6.2ml)溶液和(2s)-2-氨基己二酸(10g,62.05mmol,1.00当量)进行合并。将所得溶液在0℃下在水/冰浴中搅拌10min。然后将所述反应混合物倒入et2o(200ml)中,并且搅拌10min.。将形成的固体通过过滤收集,提供10g(92%)呈白色固体的产物。(2s)-6-甲氧基-6-氧代-2-[(4-(嘧啶-2-基)苯基)甲酰胺基]-己酸将用于制备203的方法与(2s)-2-氨基-6-甲氧基-6-氧代-己酸(3g,14.17mmol,1.00当量)和4-(嘧啶-2-基)苯甲酰氯(3g,13.72mmol,0.97当量)一起使用,以提供3g(59%)呈灰白色固体的产物。甲基(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己酸酯将用于制备206的方法与(2s)-6-甲氧基-6-氧代-2-[(4-(嘧啶-2-基)苯基)甲酰胺基]-己酸(3g,8.39mmol,1.00当量)和1-甲基哌嗪(1.3g,12.98mmol,1.55当量)一起使用,以提供1g(27%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己酸将用于制备205的方法与甲基(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己酸酯(1g,2.28mmol,1.00当量)一起使用,以提供600mg(62%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己醇将用于制备212的方法与(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己酸(600mg,1.41mmol,1.00当量)一起使用,以提供300mg(52%)呈无色油的产物。(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己醛将用于制备208的方法与(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己醇(300mg,0.73mmol)一起使用,以提供150mg(50%)呈灰白色固体的产物。n-[(2s)-6-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代己-2-基]-4-(嘧啶-2-基)苯甲酰胺(144)将用于制备4的方法与(5s)-6-(4-甲基哌嗪-1-基)-6-氧代-5-[4-(嘧啶-2-基)苯基)甲酰胺基]己醛(150mg,0.37mmol,1.00当量)和(1s,2r)-2-(4-氟苯基)环丙-1-胺(80mg,0.53mmol,1.44当量)一起使用,以提供9.2mg(5%)呈浅黄色半固体的144。实例145方案29145的合成(2r)-2-[(4-氟苯基)甲酰胺基]-3-[(2-羟乙基)磺酰基]丙酸在250-ml圆底烧瓶中放置在n,n-二甲基甲酰胺(50ml)中的(2r)-2-[(4-氟苯基)甲酰胺基]-3-巯基丙酸(5g,20.55mmol)溶液和k2co3(5.7g,40.94mmol),随后在0℃下在搅拌下,逐滴添加在n,n-二甲基甲酰胺(20ml)中的2-溴乙醇(2.8g,22.41mmol)溶液。将所得溶液在室温下搅拌5h,然后用200ml的h2o进行稀释。用hcl(2m)将溶液的ph调节至3。将所得溶液用2x200ml的etoac提取,并且将这些有机层进行合并,经na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中ch2cl2/甲醇(20:1))上,提供4g(68%)呈黄色油的产物。4-氟-n-[(2r)-3-[(2-羟乙基)磺酰基]-1-(吗啉-4-基)-1-氧代丙-2-基]苯甲酰胺在250-ml圆底烧瓶中,将在thf(50ml)中的(2r)-2-[(4-氟苯基)甲酰胺基]-3-[(2-羟乙基)磺酰基]丙酸(4g,13.92mmol,1.00当量)溶液、depbt(6.25g,20.90mmol,1.50当量)、和咪唑(1.42g,20.88mmol,1.50当量)进行合并。将所述混合物在0℃下搅拌30min,然后添加吗啉(1.2g,13.77mmol,0.99当量)。将所得溶液在室温下搅拌12h,用200ml的etoac稀释,并且用1x100ml的盐水洗涤。将这些有机层经na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:10))上,提供3g(60%)呈黄色油的产物。n-[(2r)-3-([2-[(叔丁基二甲基甲硅烷基)氧基]乙基]磺酰基)-1-(吗啉-4-基)-1-氧代丙-2-基]-4-氟苯甲酰胺在250-ml圆底烧瓶中,将在ch2cl2(30ml)中的4-氟-n-[(2r)-3-[(2-羟乙基)磺酰基]-1-(吗啉-4-基)-1-氧代丙-2-基]苯甲酰胺(3g,8.42mmol,1.00当量)溶液和咪唑(1.14g,16.76mmol,1.99当量)进行合并。随后在0℃下逐滴添加tbscl(1.9g,12.58mmol,1.49当量)。将所得溶液在室温下搅拌6h。然后将所述反应通过添加50ml的水淬灭。将所得溶液用2x100ml的ch2cl2提取,并且将这些有机层进行合并,并且经无水na2so4干燥,并且在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(1:30)的硅胶柱上。这形成2g(50%)呈白色固体的产物。n-[(2r)-3-([2-[(叔丁基二甲基甲硅烷基)氧基]乙基]磺酰基)-1-(吗啉-4-基)-1-氧代丙-2-基]-4-氟苯甲酰胺在250-ml圆底烧瓶中,将在ch2cl2(20ml)中的n-[(2r)-3-([2-[(叔丁基二甲基甲硅烷基)氧基]乙基]磺酰基)-1-(吗啉-4-基)-1-氧代丙-2-基]-4-氟苯甲酰胺(2g,4.25mmol,1.00当量)溶液和m-cpba(1.84g,10.66mmol,2.51当量)进行合并。将所得溶液在室温下搅拌6h,然后用50ml的ch2cl2稀释。将所得混合物用1x50ml的饱和na2co3,然后用1x50ml的盐水进行洗涤。将这些有机层经无水na2so4干燥,并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:30))上,提供1.3g(61%)呈白色固体的产物。4-氟-n-[(2r)-3-[(2-羟基乙烷)磺酰基]-1-(吗啉-4-基)-1-氧代丙-2-基]苯甲酰胺在50-ml圆底烧瓶中,将在thf(10ml)中的n-[(2r)-3-([2-[(叔丁基二甲基甲硅烷基)氧基]乙基]磺酰基)-1-(吗啉-4-基)-1-氧代丙-2-基]-4-氟苯甲酰胺(500mg,0.99mmol,1.00当量)溶液和bu4nf(2m)(1.5ml)进行合并。将所得溶液在室温下搅拌10h,然后用50ml的etoac进行稀释。将所得混合物用2x10ml的盐水洗涤,经无水na2so4干燥,并且在真空下浓缩。将残余物施加到硅胶柱(其中etoac/石油醚(1:20))上,提供300mg(78%)呈黄色油的产物。2-[[(2r)-2-[(4-氟苯基)甲酰胺基]-3-(吗啉-4-基)-3-氧代丙基]磺酰基]乙基甲烷磺酸酯在50-ml圆底烧瓶中,将在thf(5ml)中的4-氟-n-[(2r)-3-[(2-羟乙基)磺酰基]-1-(吗啉-4-基)-1-氧代丙-2-基]苯甲酰胺(300mg,0.77mmol,1.00当量)溶液和et3n(156mg,1.54mmol,2.00当量)进行合并。这随后在0℃下在搅拌下,逐滴添加甲烷磺酰氯(134mg,1.17mmol,1.51当量)。将所得溶液在室温下搅拌2h。然后将所述反应通过添加10ml的水淬灭。将所得溶液用3x10ml的乙酸乙酯提取。将合并的有机层经na2so4干燥并且在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:50))上,提供200mg(56%)呈白色固体的产物。乙基(1r)-2-(4-氟苯基)-1-甲基环丙烷-1-甲酸酯在吹扫并保持在氮惰性气氛下的100-ml3-颈圆底烧瓶中,将在乙二醇二甲醚(20ml)中的乙基2-(二乙氧基磷酰基)丙酸酯(3.45g,14.48mmol,2.00当量)溶液进行合并,随后在0℃下在搅拌下,逐滴添加n-buli(2.5m)(5.8ml)。将所得溶液在室温下搅拌30min。向其中添加2-(4-氟苯基)环氧乙烷(1g,7.24mmol,1.00当量)。允许所得溶液反应,在搅拌下,再持续12h,同时在油浴中将温度保持在80℃。将所述反应混合物冷却至室温,并且然后通过添加20ml的水进行淬灭。将所得溶液用3x50ml的etoac提取,并且将这些有机层进行合并,经无水na2so4干燥,在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:100))上,提供1g(62%)呈黄色油的产物。(1r)-2-(4-氟苯基)-1-甲基环丙烷-1-甲酸在50-ml圆底烧瓶中,将在甲醇/h2o(10/2ml)中的乙基(1r)-2-(4-氟苯基)-1-甲基环丙烷-1-甲酸酯(1g,4.50mmol,1.00当量)溶液和koh(1.26g,22.46mmol,4.99当量)进行合并。将所得溶液在室温下搅拌10h,并且然后用20ml的h2o进行稀释。将所述溶液的ph值用hcl(2m)调节至2。将所得溶液用3x20ml的etoac提取,并且将这些有机层进行合并,经na2so4干燥无水,并且在真空下浓缩,提供800mg(92%)呈黄色油的产物。叔丁基n-[(1r)-2-(4-氟苯基)-1-甲基环丙基]氨基甲酸酯在吹扫并保持在氮惰性气氛下的50-ml3-颈圆底烧瓶中,将在甲苯(10ml)中的(1r)-2-(4-氟苯基)-1-甲基环丙烷-1-甲酸(400mg,2.06mmol,1.00当量)溶液、联苯磷酰基叠氮化物(680mg,2.47mmol,1.20当量)、和et3n(312mg,3.08mmol,1.50当量)进行合并。将所得溶液在90℃下在油浴中搅拌30min,然后添加叔丁醇(2ml)。允许所得溶液反应,在搅拌下,再持续12h,同时在油浴中将温度保持在90℃。将所述反应混合物冷却至室温,然后用50ml的etoac进行稀释。将所得混合物用30ml的h2o洗涤,经无水na2so4干燥,然后在真空下浓缩。将所述残余物施加到硅胶柱(其中etoac/石油醚(1:100))上,提供350mg(64%)呈黄色油的产物。(1r,2s)-2-(4-氟苯基)-1-甲基环丙-1-胺向50-ml圆底烧瓶中添加在甲醇(hcl)(10ml)中的叔丁基n-[(1r,2s)-2-(4-氟苯基)-1-甲基环丙基]氨基甲酸酯(350mg,1.32mmol,1.00当量)溶液。将所得溶液在室温下搅拌2h,然后用10ml的h2o进行稀释。将所述溶液的ph值用饱和na2co3调节至9。将所得溶液用3x10ml的etoac提取,并且将这些有机层进行合并,并且经无水na2so4干燥,并且在真空下浓缩,提供200mg(92%)呈黄色油的产物。4-氟-n-[(2r)-3-[(2-[[(1r,2s)-2-(4-氟苯基)-1-甲基环丙基]氨基]乙烷)磺酰基]-1-(吗啉-4-基)-1-氧代丙-2-基]苯甲酰胺(145)在吹扫并保持在氮惰性气氛下的25-ml圆底烧瓶中,将在mecn(10ml)中的2-[[(2r)-2-[(4-氟苯基)甲酰胺基]-3-(吗啉-4-基)-3-氧代丙烷]磺酰基]乙基甲烷磺酸酯(200mg,0.43mmol,1.00当量)溶液、i-pr2net(110mg,0.85mmol,1.99当量)、ki(71mg,0.43mmol,1.00当量)、和(1r,2s)-2-(4-氟苯基)-1-甲基环丙-1-胺(71mg,0.43mmol,1.00当量)进行合并。将所得溶液在50℃下在油浴中搅拌12h,并且然后用30ml的etoac进行稀释。将所得混合物用1x20ml的h2o洗涤,经na2so4干燥,然后在真空下浓缩。将所述粗产物通过hplc进行纯化,提供64.3mg(28%)呈白色固体的产物。实例146方案30146的合成4-(3,5-二甲基吡唑-1-基)苯甲酸在250-ml圆底烧瓶中,将4-肼基苯甲酸(8.8g,57.84mmol,1.00当量)、acoh(100ml)、和戊烷-2,4-二酮(5.8g,57.93mmol,1.00当量)进行合并。将所得溶液在118℃下在油浴中搅拌16h,并且在真空下浓缩。将所得固体用3x100ml的etoac洗涤,并且在真空下干燥,提供9.2g(74%)呈浅棕色固体的产物。(2s)-2-[(4-(3,5-二甲基吡唑-1-基)苯基)甲酰胺基]-4-[(叔丁基联苯甲硅烷基)氧基]丁酸将用于制备211的方法与来自先前步骤的化合物(5g,23.12mmol,1.50当量)和(2s)-2-氨基-4-[(叔丁基联苯甲硅烷基)氧基]丁酸(5.52g,15.44mmol,1.00当量)一起使用,以提供1g(12%)呈黄色固体的产物。(2s)-n-[1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代-4-((叔丁基联苯甲硅烷基)氧基)-丁-2-基]-4-(4-(3,5-二甲基吡唑-1-基)苯甲酰胺将用于制备206的方法与在先前步骤中产生的化合物(5g,9.00mmol,1.00当量)和硫代吗啉-1,1-二氧化物(1.46g,10.8mmol,1.20当量)一起使用,以提供1g(17%)呈黄色油的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[[4-(3,5-二甲基吡唑-1-基)苯基]甲酰胺基]-丁醇将用于制备207的方法与来自先前步骤的化合物(1g,1.49mmol,1.00当量)一起使用,以提供300mg(46%)呈黄色油的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[[4-(3,5-二甲基吡唑-1-基)苯基]甲酰胺基]-丁醛将用于制备208的方法与来自先前步骤的化合物(50mg,0.11mmol,1.00当量)一起使用,以提供45mg(91%)呈浅黄色固体的产物。n-[(2s)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基]-4-(3,5-二甲基吡唑-1-基)苯甲酰胺(146)将用于制备4的方法与来自先前步骤的化合物(45mg,0.10mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺(19mg,0.125mmol,1.20当量)一起使用,以提供11.7mg(20%)呈白色固体的146。实例148方案31148的合成(2s)-4-[(叔丁基联苯甲硅烷基)氧基]-2-[[(9h-芴-9-基甲氧基)羰基]氨基]丁酸在吹扫并保持在氮惰性气氛下的1000-ml圆底烧瓶中,将在mecn(300ml)中的(2s)-2-氨基-4-[(叔丁基联苯甲硅烷基)氧基]丁酸(10g,27.97mmol,1.00当量)溶液、5%水性nahco3(300ml)、和fmoc-osu(10.4g,30.86mmol,1.10当量)进行合并。将所得溶液在室温下搅拌12h。将所述溶液的ph值用hcl(2m)调节至3。将所得溶液用3x200ml的etoac提取。将这些有机层进行合并,经na2so4干燥,在减压下浓缩,并且施加到硅胶柱(其中etoac/石油醚(1:1))上,以提供11g(68%)呈黄色固体的产物。9h-芴-9-基甲基n-[(2s)-4-[(叔丁基联苯甲硅烷基)氧基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基]氨基甲酸酯将206的程序与来自先前步骤的化合物和硫代吗啉-1,1-二氧化物(3.9g,22.59mmol,1.19当量)一起使用,以提供9g(68%)呈黄色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[((9h-芴-9-基甲基)氧基羰基)氨基]-1-丁醇将用于制备207的方法与来自先前步骤的化合物(5g,7.17mmol,1.00当量)一起使用,以提供1.7g呈灰白色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[((9h-芴-9-基甲基)氧基羰基)氨基]-1-丁醛将用于制备208的方法与来自先前步骤的化合物(1.7g,3.71mmol)一起使用,以提供1.2g(71%)呈黄色固体的产物。9h-芴-9-基甲基n-[(2r)-1-(硫代吗啉-1,1-二氧化物-4-基)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代丁-2-基]氨基甲酸酯将用于制备4的方法与来自先前步骤的化合物(1.2g,2.63mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺(476mg,3.15mmol,1.20当量)一起使用,以提供1.4g(90%)呈黄色固体的产物。叔丁基n-[(3r)-4-(硫代吗啉-1,1-二氧化物-4-基)-3-[[(9h-芴-9-基甲氧基)羰基]氨基]-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯将用于制备204的方法与来自先前反应的产物(1.4g,2.37mmol,1.00当量)一起使用,以提供1.5g(92%)呈黄色固体的产物。叔丁基n-[(3s)-3-氨基-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯在100-ml圆底烧瓶中,将来自先前步骤的化合物(1.5g,2.17mmol,1.00当量)、哌啶(5ml)、和dmf(20ml)进行合并。将所得溶液在室温下搅拌12h,然后用100ml的h2o进行稀释。将形成的这些固体通过过滤去除。将所得溶液用3x20ml的etoac提取,并且将这些有机层进行合并,经na2so4干燥,并且在减压下浓缩,提供800mg(79%)呈黄色油的产物。叔丁基n-[(3s)-3-[[4-(2,5-二甲基-1h-吡咯-1-基)苯基]甲酰胺基]-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯将用于制备211的方法与来自先前步骤的产物(397mg,0.85mmol,1.00当量)和4-(2,5-二甲基-1h-吡咯-1-基)苯甲酸(200mg,0.93mmol,1.10当量)一起使用,以提供200mg(35%)呈黄色油的产物。4-(2,5-二甲基-1h-吡咯-1-基)-n-[(2s)-1-(硫代吗啉-1,1-二氧化物-4-基)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代丁-2-基]苯甲酰胺,三氟乙酸盐将用于制备1的方法与来自先前步骤的产物(120mg,0.18mmol,1.00当量)一起使用,以提供12mg(10%)呈浅黄色固体的产物。实例150方案32(1r,2s)-2-(4-氟苯基)环丙烷甲酸向250-ml圆底烧瓶中放置在二噁烷(100ml)和h2so4(30ml)中的(1r)-n-(2-羟基-1-苯基乙基)-2-(4-氟苯基)-1-甲基环丙烷-1-甲酰胺(5g,16.70mmol,1.00当量)溶液。将所得溶液在油浴中在100℃下搅拌16h。然后将所得溶液用300ml的ch2cl2进行稀释。将经合并的这些有机层用2x200ml的h2o和1x500ml的盐水洗涤,经na2so4干燥,并且在减压下浓缩,以提供2g(66%)呈无色油的产物。n-(叔丁氧基羰基)-(1r,2s)-2-(4-氟苯基)环丙基]胺在吹扫并保持在氮惰性气氛下的250-ml圆底烧瓶中,将在甲苯(100ml)中的来自上述步骤的化合物(2g,11.10mmol,1.00当量)溶液进行合并。然后在室温下添加dppa(4.6g,16.72mmol,1.51当量)和et3n(1.7g,16.80mmol,1.51当量)。将所述反应混合物在110℃下在油浴中搅拌。30min后,将所述反应混合物冷却至90℃。然后将t-buoh(20ml)添加至溶液。将所得溶液在90℃下搅拌5h,然后用3x100ml的etoac提取。将经合并的这些有机层用盐水洗涤,经na2so4干燥,在减压下浓缩,并且施加到硅胶柱(其中etoac/石油醚(1:10))上,以提供2g(72%)呈白色固体的产物。(1r,2s)-2-(4-氟苯基)环丙基]胺在100-ml圆底烧瓶中,将来自先前步骤的化合物(2g,7.93mmol)和hcl/meoh(50ml)的溶液进行合并。将所得溶液在室温下搅拌1h。然后将所述反应混合物在减压下浓缩,提供1.4g(92%)呈无色油的产物。n-[(2s)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代丁-2-基]-4-苯基苯甲酰胺将用于制备4的方法与来自上述反应的产物(137mg,0.72mmol,1.50当量)和(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[4-(苯基)苯基)甲酰胺基]-1-丁醛(200mg,0.48mmol,1.00当量)一起使用,以提供106.9mg(34.4%)呈白色固体的产物。实例152方案33152的合成叔丁基n-[(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-3-[[4-(4-甲磺酰基苯基)苯基]甲酰胺基]-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯在吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中,将叔丁基n-[(3s)-3-氨基-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代丁基]-n-[(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯(100mg,0.21mmol,1.00当量)、et3n(43mg,0.42mmol,2.00当量)、ch2cl2(10ml)进行合并,随后在搅拌下,逐滴添加在ch2cl2(5ml)中的4-(4-甲磺酰基苯基)苯甲酰氯(70mg,0.24mmol,1.12当量)溶液。将所得溶液在室温下搅拌2h,然后通过添加10ml的水淬灭。将所得溶液用3x10ml的ch2cl2提取。将经合并的这些有机层经na2so4干燥,在减压下浓缩,并且施加到硅胶柱(其中etoac/石油醚(1:5))上,以提供100mg(65%)呈黄色油的产物。n-[(2s)-1-(硫代吗啉-1,1-二氧化物-4-基)-4-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代丁-2-基]-4-(4-甲磺酰基苯基)苯甲酰胺三氟乙酸盐在50-ml圆底烧瓶中,将来自先前步骤的化合物(100mg,0.14mmol,1.00当量)、cf3cooh(1ml)、和ch2cl2(10ml)进行合并。将所得溶液在室温下搅拌2h,然后在减压下浓缩。将所述粗产物通过制备型hplc进行纯化,提供51.5mg(52%)呈白色固体的产物。实例158方案34(a)158的合成4-(1h-1,2,3-三唑基-1-基)苯甲酰氯(1)在100-ml圆底烧瓶中,将4-(1h-1,2,3-三唑-1-基)苯甲酸(1g,5.29mmol,1.00当量)和亚硫酰氯(20ml)进行合并。将所得溶液在油浴中在80℃下搅拌16h。然后将所得混合物在减压下浓缩,提供1g(91%)呈黄色固体的中间物(1)。(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-3-基)氨基]-2-[[4-(1h-1,2,3-三唑-1-基)苯基]甲酰胺基]戊酸(2)在100-ml圆底烧瓶中,将(2s)-2-氨基-5-[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基戊酸(500mg,1.63mmol,1.00当量)、et3n(494mg,4.88mmol,3.00当量)、和thf(20ml)进行合并。这随后在0℃下在搅拌下,在30min内逐滴添加在thf(20ml)中的来自先前步骤的中间物(1)(1g,4.82mmol,2.95当量)溶液。将所得溶液在0℃下在冰/盐浴中搅拌1h,然后在减压下浓缩,并且施加到硅胶柱(其中ch2cl2/甲醇(10:1))上。将收集的这些级分进行合并,并且在减压下浓缩,提供400mg(51%)呈灰白色固体的中间物(2)。n-[(2s)-1-(4-(甲基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(3)在100-ml圆底烧瓶中,将来自先前步骤的中间物(2)(400mg,0.84mmol,1.00当量)、depbt(375mg,1.25mmol,1.50当量)、和thf(20ml)进行合并,随后添加咪唑(85mg,1.25mmol,1.50当量)。将所述混合物在0℃下搅拌30min,此时在0℃下在搅拌下在3min内逐滴添加1-甲基哌嗪(127mg,1.27mmol,1.50当量)。将所得溶液在20℃下搅拌16h,然后在减压下浓缩。将所述残余物施加到硅胶柱(其中ch2cl2/甲醇(10:1))上。将收集的这些级分进行合并,并且在真空下浓缩,提供300mg(64%)呈黄色固体的中间物(3)。n-[(2s)-1-(4-(甲基)哌嗪-1-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(3)向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(1h-1,2,3-三唑-1-基)苯甲酰胺(300mg,0.54mmol,1.00当量)、1,3-二甲基-1,3-二嗪农-2,4,6-三酮(210mg,1.34mmol,2.50当量)、pd(pph3)4(155mg,0.13mmol,0.25当量)。将所得溶液在油浴中在45℃下搅拌2h。将所得混合物在真空下浓缩。将所述粗产物(10ml)通过快速制备型hplc进行纯化。这形成65mg(23%)呈黄色固体的实例158。可替代地,实例158和其双-甲苯磺酸盐可以通过以下方法制备。方案34(b)实例162方案35162的合成甲基4-(吡啶-2-基)苯甲酸酯在吹扫并保持在氮惰性气氛下的250-ml圆底烧瓶中,将在二噁烷(50ml)中甲基4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酸酯(5g,0.019mol,1.00当量)的溶液、na2co3(6.04g,0.057mol,3.00当量)、2-溴吡啶(4.5g,0.028mol,1.50当量)、和pd(ph3p)4(1.1g,0.001mmol,0.05当量)进行合并。将所得溶液在80℃下搅拌16h。将所得溶液通过水/冰淬灭,并且用3x50mletoac提取。将经合并的这些有机层用盐水洗涤,经na2so4干燥,在减压下浓缩,并且通过快速色谱(其中etoac/石油醚(1:5))进行纯化,以提供3.5g(86%)呈浅黄色固体的产物。4-(吡啶-2-基)苯甲酸将用于制备209的方法与在meoh(50ml)中的来自先前步骤的化合物(3.5g,0.016mol,1.00当量)一起使用,以提供3g(92%)呈灰白色固体的产物。4-(吡啶-2-基)苯甲酰氯将用于制备201的方法与来自先前反应的化合物(3g,0.015mol,1.00当量)一起使用。将所述粗产物不经进一步纯化而用于下一步骤。(s)-5-甲氧基-5-氧代-2-(4-(吡啶-2-基)苯甲酰胺基)戊酸向吹扫并保持在氮惰性气氛下的250-ml圆底烧瓶中放置在二噁烷(25ml)中的(2s)-2-氨基-5-甲氧基-5-氧代戊酸(2g,12.41mmol,1.00当量)溶液,在水(50ml)中的na2co3(3.94g,37.17mmol,3.00当量)溶液。然后在0℃下,逐滴添加在n-甲基-2-吡咯烷酮(100ml)中的4-(吡啶-2-基)苯甲酰氯(粗)。将所得溶液在0℃下搅拌1h。将所述溶液的ph值用hcl(1m)调节至6。将所得混合物在减压下浓缩。将所述残余物通过反相快速色谱(其中ch3cn/h2o(1%-20%))进行纯化,提供1.9g(45%)呈浅黄色固体的产物。甲基(4s)-5-氧代-5-[1-(硫代吗啉-1,1-二氧化物-4-基)]-4-[(4-(2-吡啶基)苯基)甲酰胺基]戊酸酯将用于制备206的方法与来自先前步骤的产物(1.9g,5.56mmol,1.00当量)和硫代吗啉-1,1-二氧化物(1.13g,8.34mmol,1.50当量)一起使用,以提供1.4g(55%)呈棕色固体的产物。(4s)-5-氧代-5-[1-(硫代吗啉-1,1-二氧化物-4-基)]-4-[(4-(2-吡啶基)苯基)甲酰胺基]戊酸将用于制备205的程序与来自先前步骤的化合物(1.4g,3.04mmol,1.00当量)一起使用,以提供1.2g(89%)呈灰白色固体的产物。(4s)-5-氧代-5-[1-(硫代吗啉-1,1-二氧化物-4-基)]-4-[(4-(2-吡啶基)苯基)甲酰胺基]戊醇将用于制备212的方法与来自先前步骤的产物(800mg,1.8mmol,1.00当量)一起使用,以提供550mg(71%)呈棕色固体的产物。(4s)-5-氧代-5-[1-(硫代吗啉-1,1-二氧化物-4-基)]-4-[(4-(2-吡啶基)苯基)甲酰胺基]戊醛将用于制备208的方法与来自先前步骤的化合物(550mg,1.27mmol,1.00当量)一起使用,以提供350mg(64%)呈灰白色固体的产物。[(2s)-1-(硫代吗啉-1,1-二氧化物-4-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]4-(吡啶-2-基)-苯甲酰胺将用于制备4的方法与来自先前步骤的化合物(350mg,0.82mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺盐酸盐(231mg,1.23mmol,1.50当量)一起使用,以提供61.9mg(13.4%)呈白色固体的产物。实例163方案36163的合成4-(4h-1,2,4-三唑-4-基)苯甲酰氯将用于制备201的方法与4-(4h-1,2,4-三唑-4-基)苯甲酸(2g,10.57mmol,1.00当量)一起使用,以提供2g(91%)呈白色固体的产物。(2s)-5-甲氧基-5-氧代-2-[[4-(4h-1,2,4-三唑-4-基)苯基]甲酰胺基]戊酸在500-ml圆底烧瓶中,将(2s)-2-氨基-5-甲氧基-5-氧代戊酸(1.55g,9.62mmol,1.00当量)、二噁烷(100ml)、水(100ml)、和na2co3(3.06g,28.87mmol,3.00当量)进行合并,随后在0℃下在搅拌下,逐滴添加在nmp(50ml)中的4-(4h-1,2,4-三唑-4-基)苯甲酰氯(2g,9.63mmol,1.00当量)溶液。将所得溶液在室温下搅拌2h,然后在真空下浓缩,并且通过制备型hplc进行纯化,以提供2g(63%)呈黄色固体的产物。甲基(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(4h-1,2,4-三唑-4-基)苯基]甲酰胺基]戊酸酯将用于制备206的方法与来自先前步骤的产物(2g,6.02mmol,1.00当量)和硫代吗啉-1,1-二氧化物(1.22g,8.96mmol,1.49当量)一起使用,以提供1.4g(52%)呈黄色油的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(4h-1,2,4-三唑-4-基)苯基]甲酰胺基]戊酸将用于制备205的方法与来自先前步骤的化合物(1.4g,3.11mmol,1.00当量)一起使用,以提供1g(74%)呈白色固体的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(4h-1,2,4-三唑-4-基)苯基]甲酰胺基]戊醇将用于制备202的方法与来自先前步骤的化合物(900mg,2.07mmol,1.00当量)一起使用,以提供450mg(52%)呈黄色油的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(4h-1,2,4-三唑-4-基)苯基]甲酰胺基]戊醛将用于制备208的方法与来自先前步骤的化合物(450mg,1.07mmol,1.00当量)一起使用,以提供300mg(67%)呈黄色油的产物。n-[(2s)-1-(硫代吗啉-1,1-二氧化物-4-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(4h-1,2,4-三唑-4-基)苯甲酰胺将用于制备4的方法与来自先前步骤的产物(300mg,0.72mmol,1.00当量)一起使用,以提供17mg(4%)呈灰白色固体的产物。实例164方案37164的合成4-(1h-1,2,3-三唑-1-基)-苄腈在100-ml圆底烧瓶中,将4-氟苄腈(2g,16.51mmol,1.00当量)、cs2co3(10.8g,2.00当量)、1h-1,2,3-三唑(1.4g,1.20当量)、和n,n-二甲基甲酰胺(50ml)进行合并。将所得溶液在80℃下搅拌4h,然后用50ml的h2o进行稀释,并且用3x50ml的etoac提取。将这些有机层进行合并,用1x100ml的盐水洗涤,经na2so4干燥,在减压下浓缩,并且施加到具有etoac的硅胶柱上,提供1.2g(43%)呈黄色固体的产物。4-(1h-1,2,3-三唑-1-基)-苯甲酸在100-ml圆底烧瓶中,将来自先前反应的化合物(1g,5.88mmol,1.00当量)溶解在h2so4(20ml,9mol/l)中。将所得溶液在25℃下搅拌16h。将形成的这些固体通过过滤收集,提供1g(90%)呈灰色固体的产物。4-(1h-1,2,3-三唑-1-基)-苯甲酰氯在100-ml圆底烧瓶中,将来自先前步骤的化合物(7g,37.04mmol,1.00当量)和亚硫酰氯(30ml)进行合并。将所得溶液在油浴中在80℃下搅拌16h。将所得混合物在真空下浓缩,提供6g(80%)呈浅黄色固体的产物。n-((2s)-5-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-氧代-1-(硫代吗啉代-4,4-二氧化物-1-基)-戊-2-基)-4-(1h-1,2,3-三唑-1-基)苯甲酰胺合成的其余部分如方案18那样进行。实例166方案38166的合成1-苯基-1h-吡唑-4-羰基氯盐酸盐将用于制备201的方法与1-苯基-1h-吡唑-4-甲酸(5g,26.57mmol,1.00当量)一起使用,以提供5g(77%)呈黄色固体的粗产物。(2s)-5-甲氧基-5-氧代-2-[(1-苯基-1h-吡唑-4-基)甲酰胺基]戊酸将用于制备203的方法与(2s)-2-氨基-5-甲氧基-5-氧代戊酸(2.76g,17.13mmol,1.00当量)和1-苯基-1h-吡唑-4-羰基氯盐酸盐(5g,20.57mmol,1.20当量)一起使用,以提供2.7g(48%)呈灰白色固体的产物。甲基(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[(1-苯基-1h-吡唑-4-基)甲酰胺基]戊酸酯将用于制备206的方法与来自先前步骤的化合物(2.7g,8.15mmol,1.00当量)和硫代吗啉-1,1-二氧化物(1.34g,9.84mmol,1.21当量)一起使用,以提供1.8g(49%)呈灰白色固体的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[(1-苯基-1h-吡唑-4-基)甲酰胺基]戊酸将用于制备205的方法与来自先前步骤的化合物(1.8g,4.01mmol)一起使用,以提供1.22g(70%)呈灰白色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[4-(1h-吡唑-1-基)苯基)甲酰胺基]-1-丁醇将用于制备202的方法与来自先前步骤的化合物一起使用,以提供0.8g(68%)呈灰白色固体的产物。(3s)-4-(硫代吗啉-1,1-二氧化物-4-基)-4-氧代-3-[4-(1h-吡唑-1-基)苯基)甲酰胺基]-1-丁醛将用于制备208的方法与来自先前步骤的化合物(800mg,1.90mmol,1.00当量)一起使用,以提供480mg(60%)呈灰白色固体的产物。n-[(2s)-1-(硫代吗啉-1,1-二氧化物-4-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-1-苯基-1h-吡唑-4-甲酰胺将用于制备4的方法与来自先前反应的化合物(480mg,1.15mmol,1.00当量)和(1r,2s)-2-(4-氟苯基)环丙-1-胺(208mg,1.38mmol,1.20当量)一起使用,以提供33.5mg(5%)呈白色固体的产物。实例168方案39168的合成甲基4-(嘧啶-2-基)苯甲酸酯在250-ml圆底烧瓶中,将[4-(甲氧基羰基)苯基]硼酸(5g,27.78mmol,1.00当量)、二噁烷(100ml)、2-溴嘧啶(5.3g,33.34mmol,1.20当量)、na2co3(5.89g,55.57mmol,2.00当量)、水(10ml)、和pd(ph3p)2cl2(3.2g,2.77mmol,0.10当量)进行合并。将所得溶液在80℃下搅拌16h。将形成的这些固体通过过滤去除。将所得溶液用3x50ml的etoac提取。将这些有机层进行合并,并且施加到硅胶柱(其中ch2cl2/甲醇(10:1))上,以提供4.4g(74%)呈浅黄色固体的产物。4-(嘧啶-2-基)苯甲酸在250-ml圆底烧瓶中,将来自先前步骤的化合物(4.4g,20.54mmol,1.00当量)、naoh(2.4g,60.00mmol,2.92当量)、和甲醇(50ml)进行合并。将所得溶液在室温下搅拌2h。将所述溶液的ph值用hcl(1m)调节至7。将形成的这些固体通过过滤收集,提供3.15g(77%)呈浅黄色固体的产物。4-(嘧啶-2-基)苯甲酰氯将用于制备201的方法与来自先前步骤的化合物(3.15g,15.73mmol,1.00当量)一起使用,提供3.20g(80%)呈浅黄色固体的粗4-(嘧啶-2-基)苯甲酰氯盐酸盐。(2s)-5-甲氧基-5-氧代-2-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊酸将用于制备203的方法与来自先前步骤的化合物(1.68g,10.42mmol,0.83当量)和4-(嘧啶-2-基)苯甲酰氯盐酸盐(3.20g,12.54mmol,1.00当量)一起使用,以提供1.75g(41%)呈灰白色固体的产物。甲基(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊酸酯将用于制备206的方法与来自先前步骤的化合物(1.7g,4.95mmol,1.00当量)和硫代吗啉-1,1-二氧化物(800mg,5.87mmol,1.19当量)一起使用,以提供1.35g(59%)呈浅黄色固体的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊酸将用于制备205的方法与来自先前步骤的产物(1.35g,2.93mmol,1.00当量)一起使用,以提供0.98g(75%)呈灰白色固体的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊醇将用于制备212的方法与来自先前步骤的化合物(980mg,2.19mmol,1.00当量)一起使用,以提供710mg(75%)呈固体的产物。(4s)-5-(硫代吗啉-1,1-二氧化物-4-基)-5-氧代-4-[[4-(嘧啶-2-基)苯基]甲酰胺基]戊醛将用于制备208的方法与来自先前步骤的化合物(710mg,1.64mmol,1.00当量)一起使用,以提供(72%)呈白色固体的产物。n-[(2s)-1(硫代吗啉-1,1-二氧化物-4-基)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺将用于制备4的方法与来自先前步骤的化合物(510mg,1.18mmol,1.00当量)一起使用,以提供59.9mg(9%)呈灰白色固体的产物。实例180方案40180的合成乙基4-(1h-吡咯-1-基)苯甲酸酯在250-ml圆底烧瓶中,将在ch2cl2(100ml)中的乙基4-氨基苯甲酸酯(4g,24.21mmol,1.00当量)溶液、在水(30ml)中的acoh(300mg,5.00mmol,0.20当量)溶液、naoac(2g,24.39mmol,1.00当量)、和2,5-二甲氧基氧代戊环(4.8g,36.32mmol,1.50当量)进行合并。将所得溶液在油浴中在90℃下搅拌16h。将所得混合物在真空下浓缩,提供3.5g(67%)呈灰白色固体的产物。4-(1h-吡咯-1-基)苯甲酸在250-ml圆底烧瓶中,将来自先前步骤的化合物(3.5g,16.26mmol,1.00当量)、甲醇(100ml)、和naoh(1.3g,32.50mmol,2.00当量)进行合并。将所得溶液在油浴中在50℃下搅拌16h。将所述溶液的ph值用hcl(1m)调节至7。将形成的这些固体通过过滤收集,提供3g(99%)呈白色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙烯-3-基)氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代戊-2-基]-4-(1h-吡咯-1-基)苯甲酰胺将211的程序与来自先前步骤的化合物(100mg,0.53mmol,1.50当量)和(2s)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)戊-1-酮(150mg,0.35mmol,1.00当量)一起使用,提供150mg(72%)呈黄色固体的产物。n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(硫代吗啉-1,1-二氧化物-4-基)-1-氧代戊-2-基]-4-(1h-吡咯-1-基)苯甲酰胺将用于制备210的方法与来自先前步骤的化合物一起使用,以提供41.5mg(30%)呈浅黄色固体的产物。实例181方案41向250-ml圆底烧瓶中放置(2s)-2-氨基-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)戊-1-酮(1.04g,2.68mmol,1.00当量)、二氯甲烷(50ml)、hatu(1.71g,4.50mmol,1.68当量)、diea(1.16g,8.98mmol,3.35当量)。这随后在0℃下在搅拌下,逐滴添加在ch2cl2(5ml)中的4-(嘧啶-2-基)苯甲酸(450mg,2.25mmol,0.84当量)溶液。将所得溶液在室温下搅拌过夜。将所得混合物在真空下浓缩。将所得溶液用3x50ml的etoac提取,并且将这些有机层进行合并。这形成0.52g(34%)呈红色固体的n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺。向吹扫并保持在氮惰性气氛下的100-ml圆底烧瓶中放置n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基](丙-2-烯-1-基)氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺(520mg,0.91mmol,1.00当量)、thf(15ml)、1,3-二甲基-1,3-二嗪农-2,4,6-三酮(426mg,2.73mmol,2.99当量)、pd(pph3)4(210mg,0.18mmol,0.20当量)。将所得溶液在油浴中在50℃下搅拌2h。将这些固体过滤出。将所得溶液用3x50ml的etoac提取,并且将这些有机层进行合并,并且在真空下浓缩。将所述混合物经na2so4干燥。通过制备型hplc纯化粗产物。这形成180.9mg(37%)呈浅黄色固体的n-[(2s)-5-[[(1r,2s)-2-(4-氟苯基)环丙基]氨基]-1-(4-甲基哌嗪-1-基)-1-氧代戊-2-基]-4-(嘧啶-2-基)苯甲酰胺。实例182方案42182的合成(s)-甲基1-三苯甲基氮杂环丙烷-2-甲酸酯[2]向在氯仿(30ml)的(s)-甲基3-羟基-2-(三苯甲基氨基)丙酸酯(1,2.00g,5.54mmol)溶液中添加三乙胺(2.08ml,14.95mmol)和二甲基氨基吡啶(67mg,0.55mmol),随后添加甲烷磺酰氯(888mg,7.75mmol)。将所述反应混合物在65℃下,在氮气氛下搅拌16h。在此之后,将所述反应冷却至室温,并且用水(50ml)稀释。将这些层分离,并且将所述水层用乙酸乙酯(2×100ml)提取。将经合并的这些有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,并且在减压下浓缩。将所得残余物从乙醇中重结晶,以提供呈灰白色固体的2(1.20g,63%)。(s)-甲基氮杂环丙烷-2-甲酸酯三氟乙酸盐[3]在0℃下,向在甲醇(3.0ml)和氯仿(3.0ml)的混合物里的2(1.00g,2.91mmol)搅拌溶液中添加三氟乙酸(2.1ml)。将所述混合物在氮气氛下,在室温下搅拌2h。在此之后,将所述反应混合物在减压下浓缩,以提供呈无色液体的粗的3(600mg),将其不经进一步纯化使用。4-(1h-吡唑-1-基)苯甲酰氯[4]向4-(1h-吡唑-1-基)苯甲酸(400mg,2.12mmol)在亚甲基氯(8.0ml)的溶液中添加草酰氯(270mg,2.12mmol),随后添加二甲基甲酰胺(0.05ml)。将所述反应混合物在氮气氛下,在室温下搅拌2h。在此之后,将所述反应混合物在减压下浓缩,以提供呈灰白色固体的粗的4(400mg,in-mrg-k-163-1),将其不经进一步纯化使用。(s)-甲基1-[4-(1h-吡唑-1-基)苯甲酰基]氮杂环丙烷-2-甲酸酯[5]向3(600mg,3.03mmol)在氯仿(10ml)的溶液中添加4(756mg,3.63mmol),随后添加三乙胺(1.0ml,7.57mmol),并且将所述反应混合物在氮气氛下,在室温下搅拌16h。在此之后,将所述反应混合物用水(10ml)进行稀释。将这些层分离,并且将所述水层用氯仿(2×20ml)提取。将经合并的这些有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,并且在减压下浓缩。将所得残余物通过色谱法(硅胶,ch3oh/ch2cl2,梯度)进行纯化,以提供呈灰白色固体的5[480mg,60%用于两个步骤]。(s)-甲基2-[4-(1h-吡唑-1-基)苯甲酰胺基]-3-{[(1r,2s)-2-(4-氟苯基)环丙基]氨基}丙酸酯[7]向5(450mg,1.66mmol)在乙腈(10ml)的溶液中添加6(776mg,4.15mmol),随后添加三乙胺(0.6ml,4.15mmol)。将所述反应混合物在氮气氛下在80℃下搅拌16h。在此之后,将所述反应混合物冷却,并且用水(10ml)稀释。将这些层分离,并且将所述水层用乙酸乙酯(2×20ml)提取。将经合并的这些有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,并且在减压下浓缩。将所得残余物通过ms-引发的制备型hplc进行纯化,以提供呈棕红色胶质的7tfa(100mg,14%)。使用sunfirec18柱,obd,10μ(30×250mm)进行ms-引发的制备型hplc纯化,其中在220nm处进行uv检测,使用溶剂梯度程序(15%至55%乙腈/水与0.1%三氟乙酸)。(s)-甲基2-[4-(1h-吡唑-1-基)苯甲酰胺基]-3-[(叔丁氧基羰基)[(1r,2s)-2-(4-氟苯基)环丙基]氨基]丙酸酯[8]向在亚甲基氯(5.0ml)的7(100mg,0.23mmol)溶液中添加boc酸酐(0.7ml,0.35mmol),随后添加三乙胺(0.06ml,0.47mmol)。将所述反应混合物在氮气氛下,在室温下搅拌2h。在此之后,将所述反应混合物用水(5.0ml)进行稀释。将这些层分离,并且将所述水层用氯仿(2×10ml)提取。将经合并的这些有机层用盐水(5.0ml)洗涤,经无水硫酸钠干燥,并且在减压下浓缩。将所得残余物通过色谱法(硅胶,etoac/己烷,梯度)进行纯化,以提供呈灰白色固体的8(60mg,48%)。(s)-2-[4-(1h-吡唑-1-基)苯甲酰胺基]-3-[(叔丁氧基羰基)[(1r,2s)-2-(4-氟苯基)环丙基]氨基]丙酸[9]向在四氢呋喃(2.0ml)和水(1.0ml)的混合物里的8(60mg,0.11mmol)溶液中添加氢氧化锂一水化物(8.9mg,0.17mmol)。将所述反应混合物在室温下搅拌2h。在此之后,将所述反应混合物用水(5ml)进行稀释,并且用2n水性hcl将所述混合物酸化至ph5。将所述混合物用乙酸乙酯(2×10ml)提取。将经合并的这些有机层用盐水(10ml)进行洗涤,经无水na2so4干燥,并且在减压下浓缩,以提供呈灰白色固体的9(50mg,86%)。叔丁基[(s)-2-[4-(1h-吡唑-1-基)苯甲酰胺基]-3-(4-甲基哌嗪-1-基)-3-氧代丙基][(1r,2s)-2-(4-氟苯基)环丙基]氨基甲酸酯[10]向在四氢呋喃(3.0ml)中的9(50mg,0.09mmol)溶液中添加(3-(二乙氧基磷酰基氧基)-1,2,3-苯并三嗪-4(3h)-酮)(depbt,44mg,0.14mmol),随后添加咪唑(10mg,0.147mmol)。将所述反应混合物在氮气氛下,在0℃下搅拌40min。在此之后,在0℃下添加1-甲基哌嗪(15mg,0.14mmol)。将所述反应加热至室温,并且在氮气氛下搅拌16h。在此之后,将所述反应混合物通过硅藻土过滤,并且用乙酸乙酯(10ml)进行冲洗。将所述滤液用盐水(5.0ml)洗涤,经无水硫酸钠干燥,并且在减压下浓缩。将所得残余物通过色谱法(硅胶,ch3oh/ch2cl2,梯度)进行纯化,以提供呈灰白色固体的10(30mg,51%)。n-[(s)-3-{[(1r,2s)-2-(4-氟苯基)环丙基]氨基}-1-(4-甲基哌嗪-1-基)-1-氧代丙-2-基]-4-(1h-吡唑-1-基)苯甲酰胺盐酸盐向在三氟乙醇(3.0ml)中的10(30mg,0.05mmol)溶液中添加三甲基氯硅烷(0.1ml)。将所述反应混合物在氮气氛下在0℃下搅拌2h。在此之后,将反应混合物在减压下浓缩。将所得残余物用甲基叔丁醚和戊烷进行研磨,以提供呈吸湿性灰白色固体的产物(20mg,71%)。实例186方案43186的合成向250-ml圆底烧瓶中放置4-(苯基磺酰基)苯甲酸(2g,7.63mmol,1.00当量),含硫二氯化物(sulfurooyldichloride)(20ml)。将所得溶液在油浴中在80℃下搅拌16h。将所得混合物在真空下浓缩。这形成2g(93%)呈灰白色固体的(1)。向1000-ml圆底烧瓶中放置在h2o(50ml)中的(2s)-2-氨基-4-[(叔丁基联苯甲硅烷基)氧基]丁酸(2.12g,5.93mmol,1.00当量)溶液、二噁烷(50ml)、在水(20ml)中的碳酸钠(1.89g,17.79mmol,3当量)溶液。这随后在0℃下在搅拌下,逐滴添加在二噁烷(40ml)中的(1)(2g,7.12mmol,1.20当量)溶液。将所得溶液在水/冰浴中在0℃下搅拌1h。将所述溶液的ph值用氯化氢(2mol/l)调节至2。将所得溶液用3x100ml的乙酸乙酯提取并且将有机层合并。将所得混合物用1x100ml的盐水洗涤。将所述混合物经无水硫酸钠干燥。将所得混合物在真空下浓缩。将所得混合物用20ml的dcm进行洗涤。将这些固体过滤出。这形成3g(70%)呈黄色油的(2)。向100-ml3-颈圆底烧瓶中放置在四氢呋喃(100ml)中的(2)(3g,4.98mmol,1.00当量)溶液,depbt(2235mg,7.48mmol,1.50当量)。这随后在0℃下添加咪唑(508mg,7.48mmol,1.50当量),搅拌40min。在0℃下在搅拌下,向其中逐滴添加在四氢呋喃(10ml)中的硫代吗啉-1,1-二氧化物(807mg,5.98mmol,1.20当量)溶液。将所得溶液在25℃下搅拌16h。将这些固体过滤出。将所得混合物在真空下浓缩。将所得溶液用100ml的h2o稀释。将所得溶液用3x100ml的乙酸乙酯提取,并且将有机层进行合并,并且经无水硫酸钠干燥。将所述残余物施加到使用乙酸乙酯/石油醚(1:3)的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成2.5g(70%)呈黄色油的(3)。向50-ml圆底烧瓶中放置在四氢呋喃(30ml)中的(3)(1500mg,2.09mmol,1.00当量)溶液,tbaf(4.2ml,2.00当量)。将所得溶液在25℃下搅拌16h。将所得混合物在真空下浓缩。将所得溶液用50ml的h2o稀释。将所得溶液用3x50ml的乙酸乙酯提取,并且将这些有机层进行合并,并且经无水硫酸钠干燥。将所述残余物施加到具有乙酸乙酯的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成700mg(70%)呈黄色油的(4)。向25-ml圆底烧瓶中放置在二氯甲烷(20ml)中的(4)(200mg,0.42mmol,1.00当量)溶液,戴斯-马丁(353mg,0.83mmol,2.00当量)。将所得溶液在25℃下搅拌30min。将所述残余物施加到具有乙酸乙酯的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成150mg(75%)呈浅黄色固体的(5)。向25-ml圆底烧瓶中放置(5)(150mg,0.31mmol,1.00当量)在二氯甲烷(20ml)中的溶液、(1r,2s)-2-(4-氟苯基)环丙-1-胺(57mg,0.38mmol,1.20当量)、nabh(aco)3(159mg,0.75mmol,2.40当量)。将所得溶液在25℃下搅拌10min。将所得溶液用30ml的h2o稀释。将所得溶液用2x20ml的二氯甲烷提取,并且将这些有机层进行合并,并且经无水硫酸钠干燥,并且在真空下浓缩。通过制备型hplc纯化粗产物。这形成19.2mg(10%)呈白色固体的n-((s)-4-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-氧代-1-(硫代吗啉代-4,4-二氧化物-1-基)-丁-2-基)-4-(苯基磺酰基)苯甲酰胺。实例187方案44187的合成向250-ml圆底烧瓶中放置在四氢呋喃(50ml)中的(2s)-4-[(叔丁基联苯甲硅烷基)氧基]-2-[[4-(4-氟苯基)苯基]甲酰胺基]丁酸(2g,3.60mmol,1.00当量)溶液,depbt(1.62g,5.41mmol,1.50当量)。这随后在0℃下添加咪唑(370mg,5.44mmol,1.50当量),搅拌40min。在0℃下在搅拌下在30min内,向其中逐滴添加在四氢呋喃(20ml)中的硫代吗啉-1,1-二氧化物(890mg,6.58mmol,1.50当量)溶液。将所得溶液在25℃下搅拌16h。将所得混合物在真空下浓缩。将所得溶液用50ml的h2o稀释。将所得溶液用3x50ml的乙酸乙酯提取,并且将这些有机层进行合并。将所述残余物施加到使用乙酸乙酯/石油醚(1:1)的硅胶柱上。这形成2g(82%)呈灰白色固体的(1)。向100-ml圆底烧瓶中放置在四氢呋喃(10ml)中的n-[(2s)-4-[(叔丁基联苯甲硅烷基)氧基]-1-氧代-1-(硫代吗啉-1,1-二氧化物-4-基)-丁-2-基]-4-(4-氟苯基)-苯甲酰胺(2g,2.97mmol,1.00当量)溶液,tbaf(6ml,2.00当量)。将所得溶液在25℃下搅拌16h。将所得混合物在真空下浓缩。将所述残余物施加到具有乙酸乙酯的硅胶柱上。这形成1g(77%)呈灰白色固体的(2)。向50-ml圆底烧瓶中放置在二氯甲烷(10ml)中的4-(4-氟苯基)-n-[(2s)-4-羟基-1-氧代-1-(硫代吗啉-1,1-二氧化物-4-基)-丁-2-基]苯甲酰胺(200mg,0.46mmol,1.00当量)溶液,戴斯-马丁(389mg,0.92mmol,2.00当量)。将所得溶液在25℃下搅拌1h。将所述残余物施加到具有乙酸乙酯的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成150mg(75%)呈黄色油的(3)。向50-ml圆底烧瓶中放置在二氯甲烷(15ml)中的n-[(2s)-1,4-二氧代-1-(硫代吗啉-1,1-二氧化物-4-基)-丁-2-基]-4-(4-氟苯基)苯甲酰胺(150mg,0.35mmol,1.00当量)溶液、(1r,2s)-2-(4-氟苯基)环丙-1-胺(63.2mg,0.42mmol,1.20当量)、nabh(aco)3(147mg,0.69mmol,2.00当量)。将所得溶液在28℃下搅拌10min。将所得混合物在真空下浓缩。通过制备型hplc纯化粗产物。这形成37.1mg(19%)呈白色固体的4'-氟-n-((s)-4-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-氧代-1-(硫代吗啉代-4,4-二氧化物-1-基)-丁-2-基)联苯-4-甲酰胺。实例188方案45188的合成向500-ml圆底烧瓶中放置在四氢呋喃(200ml)中的(2s)-2-[(4-氟苯基)甲酰胺基]-5-甲氧基-5-氧代戊酸(3.4g,12.00mmol,1.00当量)溶液、depbt(5.4g,1.50当量)。这随后在0℃下添加咪唑(1.2g,1.50当量),搅拌40min。在0℃下在搅拌下,在10min内,向其中逐滴添加氮杂环丁烷(1.1g,19.27mmol,1.50当量)。在20℃下将所得溶液搅拌16h。将所得混合物在真空下浓缩。将所述残余物施加到使用乙酸乙酯/石油醚(10:1)的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成3.5g(90%)呈黄色油的ph-(1)。向250-ml圆底烧瓶中放置在四氢呋喃(100ml)中的甲基(4s)-5-(氮杂环丁烷-1-基)-4-[(4-氟苯基)甲酰胺基]-5-氧代戊酸酯(2g,6.20mmol,1.00当量)溶液,在水(20ml)中的锂醇化物(lithiumol)(270mg,11.27mmol,1.80当量)溶液。将所得溶液在20℃下搅拌2h。将所得混合物在真空下浓缩。这形成1.5g(78%)呈浅黄色固体的(2)。向100-ml圆底烧瓶中放置在四氢呋喃(20ml)中的(4s)-5-(氮杂环丁烷-1-基)-4-[(4-氟苯基)甲酰胺基]-5-氧代戊酸(500mg,1.62mmol,1.00当量)溶液。这随后在0℃下添加nmm(350mg,3.46mmol,2.10当量),搅拌40min。在-20℃下,向其中添加氯(2-甲基丙氧基)甲酮(470mg,3.44mmol,2.10当量),搅拌60min。向所述混合物中添加nabh4(650mg,17.18mmol,10.00当量)、甲醇(5ml)。将所得溶液在油浴中在30℃下搅拌1h。将所述残余物施加到使用乙酸乙酯/石油醚(10:1)的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成350mg(73%)呈黄色油的(3)。向100-ml圆底烧瓶中放置n-[(2s)-1-(氮杂环丁烷-1-基)-5-羟基-1-氧代戊-2-基]-4-氟苯甲酰胺(350mg,1.19mmol,1.00当量)在二氯甲烷(20ml)中的溶液,戴斯-马丁(1g,2.36mmol,2.00当量)。将所得溶液在30℃下在油浴中搅拌60min。将所述残余物施加到使用乙酸乙酯/石油醚(10:1)的硅胶柱上。将收集的级分合并并且在真空下浓缩。这形成230mg(66%)呈黄色油的(4)。向100-ml圆底烧瓶中放置在二氯甲烷(20ml)中的n-[(2s)-1-(氮杂环丁烷-1-基)-1,5-二氧代戊-2-基]-4-氟苯甲酰胺(230mg,0.79mmol,1.00当量)溶液、(1r,2s)-2-(4-氟苯基)环丙-1-胺(176mg,1.16mmol,1.20当量)、nabh(aco)3(422mg,2.40当量)。将所得溶液在20℃下搅拌5min。将所得混合物在真空下浓缩。将所述粗产物(1ml)通过快速制备型hplc进行纯化。这形成86mg(26%)呈灰白色固体的n-((s)-1-(氮杂环丁烷-1-基)-5-((1r,2s)-2-(4-氟苯基)环丙基氨基)-1-氧代戊-2-基)-4-氟苯甲酰胺。下表披露了针对化合物的物理数据;将上述未列出的实例根据上述披露的方法合成,根据所鉴定的方案形成实例。此类化合物还可以由本领域技术人员根据在本领域中已知的方法进行合成。表2:物理数据和合成方法本发明通过以下实例进一步进行说明,这些实例还可能尚未制成或进行测试。以下示例的方法还可以外推到本文披露的化合物,这些化合物可能尚未制成或进行测试。各种立体化学排列如下所示,并且旨在证明可以考虑所有外消旋的、(r)、(s)、顺式和反式异构体。盐和多晶型物实例1游离碱形式是在经受高湿度时潮解,并且在环境条件下随时间降解的不稳定的,无定形的,和吸湿性的物质。合成后不久通过hplc分析各种大量的实例1(从合成后1-24小时分析),并且在一个单位时间之后再次测定纯度。结果在表3中给出。表3.在以下盐和多晶型物的实验中,以下的反离子形成以下盐并且简称如下:2,5-二羟基苯甲酸-二羟基苯甲酸盐-dhba;己二酸-己二酸盐-ada;苯磺酸-苯磺酸盐(benzenesulfonate或besylatesalt)-bsa;苯甲酸-苯甲酸盐-ba;辛酸-辛酸盐-cya;柠檬酸-柠檬酸盐-ca;d-葡萄糖醛酸-葡萄糖醛酸盐-ga;乙磺酸-乙磺酸盐(ethanesulfonate或esylate)-esa;富马酸-富马酸盐-fua;半乳糖二酸-半乳糖二酸盐-ga;羟基乙酸-羟乙酸盐-glya;马尿酸-马尿酸盐-hpa;盐酸-盐酸盐-hcl;酮戊二酸-酮戊二酸盐-kga;l-抗坏血酸-抗坏血酸盐-asba;l-天冬氨酸-天冬氨酸盐-asp;l-谷氨酸-谷氨酸盐-glu;l-乳酸-乳酸盐-la;l-苹果酸-苹果酸盐-ma;l-酒石酸-酒石酸盐-tar;马来酸-马来酸盐-mea;丙二酸-丙二酸盐-mlna;烟酸-烟酸盐-na;乳清酸-乳清酸盐-ora;草酸-草酸盐-oxa;磷酸-磷酸盐-phoa;丙酸-丙酸盐-proa;对甲苯磺酸(一水化物)-甲苯磺酸盐-ptsa;琥珀酸-琥珀酸盐-suca;硫酸-硫酸盐-sul或so4;以及硫氰酸-硫氰酸盐-tca。盐可以按化学计量比在反离子之间形成,例如1:1(单盐)或2:1(双盐)。实例1的盐的制备盐形式由各种溶剂和技术制备,包括冷却、熟化、蒸发、和抗溶剂添加。针对多种反离子,还研究了形成单盐和双盐的可能性。溶剂。将实例1用递增体积的溶剂(2-丙醇(ipa)、丙酮、甲基乙基酮、乙酸乙酯、四氢呋喃、乙腈、1,4-二噁烷、90:10ipa:水、90:10thf:水、叔丁基甲基醚(mtbe)、以及正庚烷)进行处理,直到所述物质充分溶解或直到使用了最大100体积。每次添加溶剂后,将所述系统在25℃下搅拌10min,然后添加新的溶剂等分试样。实例1在2-丙醇(ipa)、丙酮、甲基乙基酮、乙酸乙酯、四氢呋喃、乙腈、1,4-二噁烷、90:10ipa:水、以及90:10thf:水中是易溶的,容易溶解于10体积的溶剂中。当实例1在100体积的溶剂中是不可溶时,mtbe和正庚烷被鉴定为抗溶剂。盐酸盐。将实例1的溶液用纯hcl(37wt%(12m),4.8μl)处理。然后将这些样品在25℃下搅拌1小时。将这些溶液在冰箱中冷却(约4℃)24小时。如果没有获得悬浮液,那么将这些样品在环境温度/50℃下在8小时循环中熟化4天(8.11节)。通过xrpd对任何获得的固体进行分析。在将hcl添加至实例1在各种溶剂中的溶液时,许多样品形成沉淀物,将所述沉淀物进一步搅拌后变成胶质。通过xrpd对这些固体的分析发现所有固体将是无定形的。结果在表4中给出。表4.第一盐实验。进行若干个盐实验以确定是否可以鉴定实例1的稳定的,非吸湿性的晶形。从hcl、磷酸、硫酸、l-酒石酸、富马酸、对甲苯磺酸、和草酸中分离出具有不同结晶度的盐。通常,分离的这些固体的结晶度差。盐实验1。将实例1溶解在溶剂(在2.4ml中240mg,10体积)中以形成原液,并且然后分配到小瓶中(每小瓶中400μl/约40mg)。将这些溶液使用原液用1当量的反离子进行处理(对于盐酸(hcl)、硫酸(h2so4或“so4”)、甲磺酸(甲磺酸盐或“msa”)、磷酸(h3po4或“phoa”)、和l-酒石酸(tar),77μl用于1m;对于富马酸(fua),154μl用于0.5m)。然后将这些溶液/悬浮液以0.2℃/min冷却至0℃,并且在0℃下搅拌过夜。将这些所得固体通过xrpd进行分析,并且然后将那些无定形的或较差结晶的固体熟化5天。如果冷却至0℃后,获得澄清溶液或胶质,将这些母液从这些小瓶中移除,分成两部分,并且将抗溶剂(mtbe或庚烷,400μl)添加至每个等分试样中。抗溶剂添加后,将这些样品熟化5天。熟化后,允许澄清溶液和胶质在环境条件下进行蒸发。将悬浮液过滤,风干,并且由xrpd来表征。任何所得结晶固体由高分辨率xrpd、1hnmr、hplc来表征,并且在40℃和75%rh下储存一周。将结晶固体从涉及ipa中的硫酸、磷酸、l-酒石酸的实验中分离。从在乙酸乙酯中的富马酸中也发现了另外的弱结晶固体。发现所有其他的固体将是无定形的,尽管这些固体中的一些通过nmr示出峰移位,这些峰移位是盐形成的指示。结果在表5中给出。表5.在获得的16种固体中发现4种固体有待部分地结晶:ipa中的硫酸、磷酸、l-酒石酸。从在乙酸乙酯中的富马酸中也发现了另外的弱结晶固体。发现所有其他的固体将是无定形的。将通过xrpd分析的所有样品置于40℃和75%rh下储存一周。然而,一天之后,除了酒石酸盐之外的所有样品已被潮解,并且因此未被进一步表征。在40℃和75%rh下一周后,通过xrpd分析酒石酸盐,并且没有观察到在形式上的变化,并且通过tga和dsc进行进一步分析。热分析示出了tga的初始重量损失,所述初始重量损失对应于dsc中的宽吸热。这些可能是由于来自样品中的ipa和水的损失。相比对于输入实例1的93.6%1,通过hplc,样品的纯度为89.7%。实验2。在环境条件下,将实例1溶解在甲基乙基酮(mek)或乙腈(mecn)(在200μl中20mg,10体积)中。然后将这些溶液加热至50℃,用1.1或2.1当量的酸进行处理,并且在此温度下搅拌1小时。然后将这些所得溶液/悬浮液以0.1℃/min冷却至5℃,并且保持过夜。将获得的任何固体通过xrpd进行分析,并且然后将无定形的或较差结晶的那些固体在50℃/环境温度之间在8小时循环中进行熟化。在环境条件下,将任何澄清溶液放置以进行缓慢蒸发。如果将这些样品蒸发至形成胶质,将这些胶质溶解在ipa(10体积,200μl)中,并且然后进行熟化。还将具有存在的胶质的任何溶液在50℃/环境温度之间在8小时循环中进行熟化。将任何所得结晶固体由高分辨率xrpd、nmr、hplc、ic(对于无机反离子)来表征,并且在40℃和75%rh下储存一周。表4示出了测试的实验条件。表6将下述实验在mek中以1:1当量进行。表7a.将下述实验在mek中以2:1当量进行。表7b.将下述实验在mecn中以1:1当量进行。表7c.将下述实验在mecn中以2:1当量进行。表7d.从在mek中冷却获得总共10种固体。发现使用2.1当量的对甲苯磺酸一水化物的这些固体中的一者是结晶(ptsa形式1)的,并且来自抗坏血酸的另一种固体是弱结晶的糊剂。从半乳糖二酸获得的固体与针对该反离子的参考衍射图是一致的。从冷却中获得的其他固体是无定形的。熟化后,在从1.1当量添加的硫酸(sulf模式1)和草酸(oxa形式1)中的样品中发现结晶固体。冷却后,将七种固体从mecn中分离,并且通过xrpda进行分析。发现来自2.1当量的甲苯磺酸一水化物的固体是结晶的,并且展示出针对所述酸以及从mek实验(ptsa模式1)获得的其他甲苯磺酸盐固体的参考模式不同的xrpd衍射图(ptsa形式2)。发现来自添加1.1当量的硫酸和草酸的样品是弱结晶的,其中熟化后结晶度改进了。针对硫酸盐(sulf模式3)的衍射图与在原始实验和在mek(分别是sulf模式1和2)中先前观察到的那些是不同的。冷却和熟化后获得的所有其他固体是无定形的。将在mek和mecn中冷却而获得的澄清溶液放置进行蒸发,并且形成胶质。将这些胶质再溶解于ipa,并且进行熟化。熟化后,所述样品中的一些产生固体。然而,所有这些固体具有相同的xrpd图谱,尽管具有不同的反离子(苯甲酸和琥珀酸)和所添加的酸当量。1hnmr证实所有这些样品已经降解成相同的结晶产物,其中存在痕量的反离子。这些样品的降解可能是由于这些样品在初始冷却后进行的进一步处理(在升高的温度下)的量引起的。如果盐形成是不完全的,则已知不稳定的无定形游离碱的存在也可能促成降解成未知结晶化合物。实例1和s36(来自mek的以1:1当量的琥珀酸)由1d和2dnmr实验的范围进行表征,以进一步理解该降解。由于少量的s36分离,13cnmr谱不能完全分配。很明显,已经失去了氟化物的苯环。主要的降解产物很可能是该环失去后的伯胺。盐的特征。进一步使用一系列的技术来表征结晶和部分结晶的盐。甲苯磺酸盐。对两种甲苯磺酸盐的初始hplc分析表明,相比具有81.4%纯度的实例1,盐形成使纯度增加至88.0%和90.6%。发现的两种形式中,ptsa形式2是更稳定的。在分离时,其他盐,ptsa形式1,变成无定形的,并且在40℃和75%rh下储存后还转变为ptsa形式2。结果示于下表8中。表8硫酸盐。发现两种硫酸盐具有不同的xrpd衍射图(sulf模式2和3),所述衍射图与在初始盐实验中获得的硫酸盐不一致,所述盐酸盐在40℃和75%rh(sulf模式1)下储存时潮解。在40℃和75%rh下储存后,两种固体展示出相同的衍射图,sulf模式2。结果示于下表9中。表9草酸盐.两种草酸盐都展示出相同的xrpd衍射图(oxa图谱1),尽管与其他盐一样,来自mek的固体在分离时失去一些结晶度。在40℃和75%rh下储存后,两种草酸盐变为相同的形式(oxa形式2)。结果示于下表10中。表10放大试验.选择三种最结晶的盐形式,单酒石酸盐(tar形式1)、单草酸盐(oxa形式1)、和双甲苯磺酸盐(ptsa形式2)进行放大试验和进一步表征。这包括初步的多态性评估。酒石酸盐。tar形式1没有在放大试验时获得。相反,分离了新的溶剂化形式,tar形式2。发现这种形式对湿度不稳定,其中结晶度降低,转变成新形式(tar形式3),并且观察到纯度显著降低。在第一实验中,在环境条件下将实例1溶解在ipa(在1ml中100mg,10体积)中。然后将所述溶液加热至50℃,用1.1当量的l-酒石酸(在thf1m中,212μl)进行处理,并且在50℃下搅拌1小时。然后将所得悬浮液以0.1℃/min冷却至5℃过夜。xrpd仅示出无定形的固体,然后将这些固体在50℃/环境温度之间在8小时循环中熟化7天。1hnmr(dmso-d6)仅示出峰移位至游离碱(约0.5当量的ipa)。在该实验中,甚至在进一步熟化后没有获得结晶的酒石酸盐。通过dsc对无定形的酒石酸盐的分析表明没有结晶的证据。在第二实验中,在环境条件下将实例1溶解在ipa(10体积,在5ml中500mg)中。在25℃下然后将所述溶液搅拌,并且用1.1当量的l-酒石酸(1030μl,在thf中1m)进行处理。在25℃下然后将所述样品搅拌1小时,以0.2℃/min冷却至0℃,并且置于0℃下过夜。通过xrpd对任何获得的固体进行分析,并且然后在50℃/环境温度之间在8小时循环中熟化2天。在熟化过程中取等分试样的样品,并且通过xrpd进行分析来监测结晶度。所述样品保持低结晶度,并且2天后接种结晶的酒石酸盐(s7)。将接种的样品恢复熟化再持续4天,然后将散装样品进行过滤,并在环境条件下真空干燥过夜。将任何所得结晶固体进行表征。冷却后发现酒石酸盐是弱结晶的,其中熟化2天后没有看到改进。将样品接种以帮助形成结晶物质,但在另外的4天熟化后xrpd分析后显示样品是无定形的。分离和干燥后,高分辨率xrpd显示所述样品已经结晶成新的形式,tar形式2。通过1hnmr,酒石酸盐含有约1当量的ipa,并且这与新的xrpd(tar形式2)衍射图相结合证实了已经获得最可能溶剂化的不同的形式。加热到在tga中的第一次重量损失后温度点处(75℃),并通过xrpd分析,观察到tar形式1和2的混合物。该物质的1hnmr显示出存在的ipa量的减少。vt-xrpd表明在120℃下样品再次变化,这对应于在dsc中宽吸热的结束。在降解前的放热中注意到其他复杂的热行为。gvs显示,酒石酸盐吸湿性很强,吸收约30%w/w的水,其中通过gvs后的xppd注意到结晶度降低和形式变化。两种储存条件导致结晶度和形式的变化,但在40℃和75%rh下储存也导致纯度(>30%)的显著损失。将来自该实验的结果示于下表12中。甲苯磺酸盐。将双甲苯磺酸盐,ptsa形式2成功地放大,并展示了经研究的所有盐中的最佳固态特性。这种形式被认为是通道水合物,因为水可以从结构中吸收和损失而不改变晶形。在研究过程中观察到的甲苯磺酸盐的唯一其他的晶形,在升高的温度和升高的湿度下储存时,ptsa形式1转化为ptsa形式2。对甲苯磺酸盐的有限的稳定性研究表明它具有比游离形式改进的化学稳定性。相比对应的游离碱,双-甲苯磺酸盐具有更高的纯度。在第一实验中,在环境条件下,将实例1溶解在mek或mecn(在1ml中100mg,10体积)中。然后将这些溶液加热至50℃,用2.1当量的对甲苯磺酸一水化物(在thf中1m,405μl)进行处理,并且在恒定温度下搅拌1小时。然后将所得悬浮液以0.1℃/min冷却至5℃过夜。将获得的任何固体通过xrpd进行分析,并且然后将无定形的弱结晶的那些固体在50℃/环境温度之间在8小时循环中熟化7天。任何所得的结晶固体通过高分辨率xrpd、1hnmr、hplc、tga、dsc来表征,并且在40℃和75%rh下储存一周。将甲苯磺酸盐冷却后,这些固体展示出与之前观察到相同的xrpd衍射图、ptsa形式1和2。然而,进一步熟化以尝试和改进结晶度后,通过xrpd两种甲苯磺酸盐与ptsa形式2是一致的。在两种情况下发现,相比游离碱,这种盐是具有更高纯度的双甲苯磺酸盐,尽管来自mecn的固体明显更好。结果示于下表11中。表11在甲苯磺酸盐的tga中的第一重量损失对应于在dsc中的宽吸热。基于1hnmr,其没有显示大量的残留溶剂,这表明ptsa形式2是水合形式。甲苯磺酸盐的可变温度xrpd(vt-xrpd)示出没有对物质的晶形的变化,最高至170℃,在170℃之后样品熔化。这表明ptsa形式2可以是通道水合物,其中水可以在结构内外移动而不影响晶格。在第二实验中,在环境条件下将实例1溶解在乙腈(10体积,在5ml中500mg)中。然后将所述溶液在50℃下搅拌,并且用2.1当量的对甲苯磺酸一水化物(2060μl,在thf中1m)进行处理。然后将所述样品在50℃下搅拌1小时,以0.1℃/min冷却至5℃,并且置于5℃下过夜。通过xrpd对任何获得的固体进行分析,并且然后在50℃/环境温度之间在8小时循环中熟化1天。在熟化过程中取等分试样的样品,并且通过xrpd进行分析来监测结晶度。熟化之前和之后在xrpd衍射图之间没有观察到在结晶度上的显著变化。将散装样品在环境条件下过滤并且在真空下干燥过夜。将任何所得结晶固体进行表征。尽管甲苯磺酸盐在冷却后是结晶的,但是将其熟化以观察是否可以获得结晶度的任何增加。1天后,当通过xrpd未观察到样品变化时,将样品从熟化中去除。如所期望的,发现甲苯磺酸盐的xrpd衍射图与ptsa形式2是一致的。在tga中的重量损失对应于在dsc中的宽吸热,表明这是水合形式。这被1hnmr进一步支持,所述1hnmr示出没有大量的残余溶剂。所述样品展示出在dsc中的融化、吸热(起始170℃)。所述物质的gvs示出所述样品具有完全可逆的吸水和损水,在一个完整的循环内仅吸收约5%w/w的水。没观察到形式变化。在40℃和75%rh以及25℃和95%rh两种情况下储存示出样品的形式或纯度无变化。将来自该实验的结果示于下表12中。草酸盐。在放大试验中还获得了一种新形式的草酸盐。这种名为oxa形式3的物质与初始实验中分离的oxa形式1非常相似。oxa形式3被认为是一种水合物形式,所述oxa形式3在暴露于湿度时易于转化为较高的水合物。这种较高的水合物,oxa形式2是吸湿性的,但对于提高的湿度而言是稳定的。在多态性评估中,还通过在thf:水(95:5)中oxa形式3的熟化获得了该形式。在环境条件下,将实例1溶解在乙腈(10体积,在5ml中500mg)中。然后将所述溶液在50℃下搅拌,并且用1.1当量的草酸(1030μl,在thf中1m)进行处理。然后将所述样品在50℃下搅拌1小时,以0.1℃/min冷却至5℃,并且置于5℃下过夜。通过xrpd对任何获得的固体进行分析,并且然后在50℃/环境温度之间在8小时循环中熟化2天。在熟化过程中取等分试样的样品,并且通过xrpd进行分析来监测结晶度。熟化之前和之后在xrpd衍射图之间没有观察到在结晶度上的显著变化。将散装样品在环境条件下过滤并且在真空下干燥过夜。将任何所得结晶固体进行表征。尽管草酸盐在冷却后是结晶的,但是将其熟化以观察是否可以获得结晶度的任何增加。2天后,当通过xrpd未观察到样品变化时,将样品从熟化中去除。发现草酸盐具有类似于oxa形式1具有一些差异的xrpd衍射图。oxa形式3可以是oxa形式1结晶更多的样品。在dsc中的宽吸热和在tga中的第一重量损失表明草酸盐是水合形式。发现高达140℃的温度未改变草酸盐的形式,表明水是在通道中的,并且在晶体结构内是未结合的。与酒石酸盐一样,在dsc中在降解前草酸盐显示放热。虽然草酸盐的形式没有被温度改变,但是它被湿度改变。在40℃和75%rh以及在25℃和95%rh两种情况下储存都将物质的形式改变为oxa形式2,其中对这些样品的纯度没有影响。oxa形式2可能是较高水合形式。gvs示出所述样品是吸湿性的,在完整的循环中吸收约12%w/w的水,gvs后的xrpd示出形式变为gvs后的oxa形式2。将来自该实验的结果示于下表12中。来自上述更大的放大实验中的结果示于下表12中。表12.在25℃下在搅拌下,将无定形的实例1(10mg)用递增体积的溶剂进行处理(表#)。在大多数情况下观察到澄清溶液。对于没有观察到溶解的那些情况,将所述样品置于50℃下保持10分钟。向仍在悬浮液中的所有样品中另外添加10体积的溶剂,并且将所述样品置于25℃。然后将温度再次增加至50℃,并且保持直到所述实验结束。添加另外的溶剂直到所述物质充分溶解,或直到已经使用了最大70体积。然后将盐酸(1.1当量)添加至所有样品中。将降温设置为以0.1℃/min至5℃,并且将这些溶液或油在此温度下搅拌过夜,产生油或溶液。将溶液蒸发至干燥(环境条件),或用抗溶剂(tbme,150μl,在25℃下搅拌)进行处理。任何油或胶质经受声处理,随后在室温和50℃之间的每个温度下熟化大约4小时(7.7节)。随后用抗溶剂对油进行处理,并且在上述条件下进一步熟化。结果示于下表13中。表13在大多数溶剂中在25℃(10体积)下观察到无定形的实例1的溶解。例外是水、二乙醚、和环己烷,其中最终形成油。添加盐酸后,没有获得固体。在大多数情况下,在添加酸时观察到混浊,但在降温后观察到油,并且还在随后的声处理之后,在搅拌和/或熟化下添加抗溶剂。第二盐实验。在25℃下,将无定形的实例1溶解在1-丙醇、丙酮、或乙酸异丙酯(在13.8ml中1380mg,10体积)中。将30mg的实例1(300μl)的等价物吸取进小瓶中,然后将这些小瓶置于50℃下。在50℃下添加所选的酸。将温度保持1小时,并且将以0.1℃/min至5℃的降温设置过夜。将观察到的任何沉淀物进行过滤,并且通过xrpd进行分析。将剩余的油或溶液经受抗溶剂添加。将tbme(10体积)用作抗溶剂用于1-丙醇实验。正庚烷(10体积)是加入到丙酮实验中的抗溶剂,并且将己烷(7体积)添加至乙酸异丙酯实验中。当可用时,将这些样品通过熟化、冷却、或蒸发进一步处理。最终,在室温下将所有的油和胶质在真空下干燥一周。添加另外的溶剂(ipa/5%水、硝基甲烷或甲苯、8体积)。建立在环境条件和50℃之间的熟化,在每个温度处熟化4小时,持续总共11天。针对硫酸盐、苯磺酸盐、草酸盐、富马酸盐、l-苹果酸盐、柠檬酸盐、以及乙磺酸盐,将结晶或部分结晶的物质进行分离。没有对草酸盐进行表征,因为这些盐在先前的盐选择项目中进行了报道。对于尝试的硫酸盐观察到许多不同的xrpd模式,包括在上述实验中观察到的一种(sul3)。在三种情况下,从1-丙醇和丙酮中观察到一种形式的苯磺酸盐。从ipac/tbme观察到一种形式的富马酸盐,与使用的酸的量无关。在ipa/5%水中熟化后观察到另一种较差结晶的富马酸盐(表示为fua2)。最后,观察到部分结晶的l-苹果酸盐,柠檬酸盐和乙磺酸盐。将这些结果汇总在表12a-12c中。将来自在1-丙醇中进行的盐实验的结果给出在以下表14a中。表14a.将来自在丙酮中进行的盐实验的结果给出在下表14b中。表14b.将来自在乙酸异丙酯中进行的盐实验的结果给出在下表14c中。表14c.熟化后,从ipa/5%水(fua2)中获得的富马酸盐是较差结晶的。进行1hnmr分析表明,尽管已经发生了盐形成(化学位移与其他盐一致),但是存在过量的富马酸。从在ipac中的辛酸获得的较差结晶的固体与先前实验过程中鉴定的结晶杂质是一致的。1hnmr光谱与贯穿此项目形成的其他盐不一致,并表明降解(积分不同,并且有许多不归因于化合物或辛酸的额外的峰)。在有足够的物质的情况下进行硫酸盐、苯磺酸盐、富马酸盐、乙磺酸盐、l-苹果酸盐、和柠檬酸盐的基本表征。在物质不足以表征的情况下,以稍大的规模重复制备。盐的特征。将在整个研究中所获得的结晶或部分结晶新颖的盐进行进一步表征。在50℃下,将无定形的实例1溶解在1-丙醇或丙酮(在0.6ml中60mg,10体积)中。在50℃下添加所选的酸(详见下表)。在50℃下从两种硫酸盐形成尝试中观察到沉淀物。在50℃下,将抗溶剂添加至苯磺酸盐尝试中,其中观察到沉淀物(tbme,0.6ml,10体积)。将温度保持1小时,并且以0.1℃/min至5℃的降温设置过夜。在环境条件下将固体过滤,在真空下干燥过夜,并且通过xrpd进行分析。结果示于下表15中。表15.将在整个研究中获得的结晶或部分结晶的盐被进一步表征,例如,化学计量、溶剂含量、通过hplc的化学纯度以及在提高的温度和湿度下的稳定性。硫酸盐。sul3和sul5二者是结晶的,并通过离子色谱法确认为单盐。尽管通过xrpd观察到变化,但两种物质在40℃/75%rh下储存4天后仍然保持为固体(sul3示出变化,而sul5变为无定形的)。两种物质在热重分析实验中加热时显示出重量损失(分别为在190℃以下6.2%,在175℃以下4.4%)。通过1hnmr,sul3还含有大约1摩尔当量的1-丙醇,表明它可以是溶剂化形式。该形式的hplc分析示出98.8%的纯度。苯磺酸盐。bsa1是部分结晶的,并且通过1hnmr被确认为双苯磺酸盐。dsc示出宽吸热,与150℃以下的5.1%的tg重量损失相一致,随后是在115.5℃下起始的更剧烈的吸热。该物质在40℃/75%rh下储存过夜时潮解,并且具有97.8%的纯度。富马酸盐。fua1是较差结晶的,并且通过1hnmr被证实为是单富马酸盐。在150℃下还观察到3.6%w/w的tg重量损失。在多个未溶解的事件的情况下,所述样品的dsc分析是复杂的。该物质具有94.3%的纯度,并且在40℃/75%rh下储存过夜时潮解。部分结晶的esa1被证实为是双乙磺酸盐。该物质在40℃/75%rh下储存过夜时被潮解。在150℃以下观察到2.8%w/w的重量损失。还对部分结晶的ma1进行了表征。由于在1hnmr光谱中的重叠峰,不能准确地确定化学计量。该物质具有94.7%的纯度,并且在40℃/75%rh下储存过夜时潮解。在150℃以下观察到7.4%w/w的tg重量损失。最终,还对部分结晶的ca1进行了表征。纯度是所有分离盐中最低的,值为87.8%。所述物质在40℃/75%rh下储存过夜时也潮解,并且由于在1hnmr光谱中的重叠峰,不能准确地确定化学计量。结果示于下表16中。表16.实例1的盐的多晶型物的制备在三种最结晶的盐形式上进行初始多态性评估,单酒石酸盐(tar形式1)、单草酸盐(oxa形式1)、和双甲苯磺酸盐(ptsa形式2)。在25℃下,将每种盐用相关的溶剂(10体积,在300μl中30mg)进行处理。将所述样品搅拌10分钟,并且然后加热至50℃持续1小时。将所得悬浮液熟化24小时,并且允许任何所得溶液进行缓慢蒸发。熟化或蒸发后,将所述固体过滤并且风干,然后通过xrpd进行分析。如果分离的固体量是充足的,示出新的xrpd模式的任何固体由1hnmr,ic(如果在nmr中没有看到反离子),和在40℃和75%rh下储存一周进行表征。酒石酸盐。使用的溶剂和结果示于以下表17中。表17.在这种小型多态性评估中使用的10种溶剂中,5种酒石酸盐样品在形式上发生变化。来自dcm和硝基甲烷的样品变为tar形式1,所述tar形式1先前在初始盐实验中获得。从2-甲氧基乙醇,thf:水和和丙酮:水中发现了新的模式,tar形式3。在所述样品上进行有限的表征。这些研究表明通过xrpd与tar形式1一致的所述样品在储存时转化为tar形式3。通过高分辨率xrpd注意到来自2-甲氧基乙醇的样品展示出与来自其他两种tar形式3样品衍射图的一些差异。应所述注意的是,在放大的酒石酸盐(tar形式2)的表征期间在储存时降解的样品展示出类似于tar形式3的峰。由于物质的可用性,在多态性评估后和储存条件下不可能评估所述样品的纯度。结果示于下表18中。表18.甲苯磺酸盐.使用的溶剂和结果示于以下表19中。表19.在使用的10种溶剂中,在9种甲苯磺酸盐样品中没有观察到晶形的变化。来自thf:水样品的无定形痕量是由于样品熟化后成为胶质。在这种情况下,与其他溶剂不同,所述样品在50℃下完全溶解,并且当冷却时沉淀出胶质。该发现表明这不是用于获得结晶甲苯磺酸盐的良好溶剂系统。尽管在这个小型多态性评估中,其他样品中没有一个改变形式,但实验表明甲苯磺酸盐具有至少2种形式。草酸盐.使用的溶剂和结果示于以下表20中。表20.在对草酸盐的这种小型多态性评估中使用的10种溶剂中,仅观察到一种形式变化。发现来自thf:水的样品是oxa形式2,所述oxa形式2先前在oxa形式1和3暴露于高湿度时观察到。据信这种形式是草酸盐的另一种水合形式。结论。发现酒石酸盐在温度和湿度条件下都会发生变化,其中在后一种情况下会注意到纯度降低。还显示出了多态性倾向,其中一半样本在多态性评估中改变了形式。酒石酸盐也是一种高吸湿性物质,并且显示出复杂的热行为。草酸盐在湿度下改变形式,但不在温度条件下改变。只有一个来自浆化实验的样品改变了形式。然而,所述物质是吸湿性的并且具有不希望的热行为。甲苯磺酸盐,ptsa形式2,在大多数测试条件下(包括多态性评估浆),没有改变形式。除此之外是在thf:水中,其中获得无定形的固体。它也是在实验过程中确定的最结晶的盐,并显示出最佳的固态特性。甲苯磺酸盐多晶型物的另外的特征。首先,为了研究其固体形式和化学特性,对实例1的游离碱形式进行了表征。与先前的批次一致,所述物质是无定形的,纯度为约97.6%。所述物质在提高的储存条件下是不稳定(在25℃/97%rh和40℃/75%rh下潮解)。1h-nmr通常与结构一致,并且除了水之外不显示任何大量的残余溶剂。水的量通过kf定量为2.3%。无定形的双甲苯磺酸盐的制备和特征。除了热力学最稳定的之外,初始转化为无定形状态增加了鉴定亚稳态形式的可能性。为此,使用无定形双甲苯磺酸盐用于本实验。在环境条件下,将无定形的实例1溶解于dcm中(在10ml中1g)。在环境条件下,将所得溶液用对甲苯磺酸一水化物(4044μl,在thf中1m,2.1当量)进行处理。将溶液在旋转蒸发器上快速蒸发,并且将回收的固体通过xrpd进行分析。第一这样的程序产生了不同于形式2的半结晶模式,将其再溶解于dcm(10ml)中,快速蒸发并通过xrpd再次分析,并证实为形式2。以下描述的第二程序产生了形式2。对如上制备的无定形的实例1双甲苯磺酸盐进行了简单表征,以便于研究其固体形式和化学特性。xrpd分析证实了所述物质是无定形的;1h-nmr与结构相一致,并且指示2当量的甲苯磺酸盐反离子;kf分析指示仅2.0%w/w的水;并且hplc分析指示与起始物质一致的97.6%的纯度。形式2双甲苯磺酸盐的制备和特征。在环境条件下,将实例1溶解于acn(在20ml中2g)中。在50℃下将所得溶液进行搅拌,并且用对甲苯磺酸一水化物(8088μl,在thf中1m,2.1当量)进行处理。在50℃下搅拌1h后,将所述澄清溶液冷却至-4℃(0.1℃/min),并且然后保持在-4℃下过夜。在真空下将所述回收的固体(形式2,批次1)进行过滤,并且风干2h,并且在烘箱中干燥(rt,真空)过夜。在尝试制备无定形的双甲苯磺酸盐后,回收上述第二批次(形式2,批次2)。通过xrpd最初观察到半结晶痕量,并且添加dcm(20体积)以尝试将其再次溶解。然而,形成了悬浮液。在40℃下搅拌2小时后,将所述悬浮液过滤,在烘箱中干燥(室温/真空)。通过xrpd,两个批次与形式2相一致。热分析显示对应于水损失的事件,随后在约170℃下样品融化。在提高的条件下两个批次也稳定1周。这些结果与在先前实验中获得的形式2相关。在两个批次的plm分析中,观察到不同的形态。代替迄今为止观察到的团聚颗粒,在通过在dcm中浆化获得的样品中存在针状结晶。尽管这些结晶太小而不能通过单晶分析,但这表明可能存在生长合适晶体的可能性。结果示于下表21中。表21.浆化实验。在环境条件下,将无定形的双甲苯磺酸盐悬浮在溶剂系统下(在150μl中30mg)。在环境温度和50℃之间的温度下,将这些悬浮液在熟化室中震荡19小时(8h循环),然后允许这些悬浮液在环境条件下静置10min。将固体的等分试样风干,并通过xrpd分析,并且然后在40℃/75%rh下放置1周并重新分析。如果回收溶液,则允许溶剂在环境条件下蒸发,并且开始通过xrpd分析这些残余物。结果示于下表22中。表22.溶解性。将结晶的双甲苯磺酸盐形式2(30mg)用递增体积的溶剂(正庚烷、二乙醚、乙酸乙酯、乙酸异丙酯、甲基异丁基酮、2-丙醇、甲基乙基酮、丙酮、二甲基亚砜、水、叔丁基甲基醚、环己烷、1,4-二噁烷、甲苯、氯仿、1,2-二甲氧基乙烷、四氢呋喃、n,n-二甲基甲酰胺、乙腈、硝基甲烷、n-甲基吡咯烷酮、四氢呋喃:水95:5、2-丙醇:水95:5、或处于5、10、20、30、50、70、或100总体积的)丙酮:水95:5)进行处理,直到所述物质充分溶解或直到已经添加了最大100体积。每次添加溶剂后,将所述系统在50℃下轻轻震荡10分钟,并且然后允许所述系统在环境条件下静置5分钟,然后添加新的等分试样的溶剂。所述评估结束后,将获得的任何悬浮液进行熟化,并且将澄清溶液冷却至4℃并保持等温。实例1双甲苯磺酸盐形式2在除了二甲基亚砜和n,n-二甲基甲酰胺的所有溶剂中在高达100体积中重保持悬浮液,其中实例1双甲苯磺酸盐形式2是处于5体积的溶液,并且四氢呋喃:水95:5,其中实例1双甲苯磺酸盐形式2是处于10体积的溶液。熟化。在溶解度评估后,在环境温度和50℃之间的温度下,将获得的悬浮液在熟化室中震荡(8h循环)。4天后,将这些固体过滤并风干。开始通过xrpd分析获得的固体。在正庚烷、二乙醚、乙酸乙酯、乙酸异丙酯、甲基异丁基酮、2-丙醇、甲基乙基酮、丙酮、叔丁基甲基醚、环己烷、1,4-二噁烷、甲苯、氯仿、1,2-二甲氧基乙烷、四氢呋喃、乙腈、硝基甲烷、以及2-丙醇:水95:5中的熟化产生形式2的经过滤的固体。缓慢蒸发和冷却。允许来自熟化实验的上清液和从冷却所得的溶液在环境条件下缓慢蒸发。将这些残余物通过xrpd进行分析。由以下上清液缓慢蒸发产生:二甲基亚砜,油;水,油;n,n-二甲基甲酰胺,胶质;n-甲基吡咯烷酮,油;四氢呋喃:水95:5,胶质;以及丙酮:水95:5,胶质。将溶解度评估后获得的溶液置于冰箱(4℃)中2天,并在冷冻器(-20℃)中再放置2天。没有回收固体。从两个批次的正庚烷溶液进行缓慢蒸发产生来自一个批次的胶质和来自另一个批次的形式2。在4℃或60℃下的浆化。将结晶的双甲苯磺酸盐形式2(30mg)悬浮于溶剂系统(10体积,300μl)中。在4℃或60℃下将悬浮液搅拌一周。4℃实验的xrpd特征产生来自乙酸乙酯、2-丙醇、甲基乙基酮、叔丁基甲基醚、n,n-二甲基甲酰胺、乙腈、乙醇、以及硝基甲烷的形式2,针对四氢呋喃:水95:5的胶质,以及针对n-甲基吡咯烷酮的溶液。60℃实验的xrpd特征产生来自乙酸乙酯、2-丙醇、甲基乙基酮、叔丁基甲基醚、丙酮、1,4-二噁烷、乙腈、乙醇、硝基甲烷、以及n-甲基吡咯烷酮的形式2。结果。在双-甲苯磺酸盐多晶型物实验中分离的大多数样品与形式2是一致的。然而,三种结晶固体(形式3(来自甲基异丁基酮的p35)、形式5(来自甲基乙基酮的p37)、和形式4(来自1,4-二噁烷的p43))显示出一些差异。将这些固体通过高分辨率x射线粉末衍射(hr-xrpd)进行分析。将结果示于图#中。在形式3和形式4中注意到一些额外的峰。决定通过hplc、1h-nmr和dsc对这两种新模式进一步表征。通过高分辨率,形式5与形式2一致,然而,当初始衍射图(高通量(ht)红色迹线)与新的(高分辨率)进行比较时,可以看到变化。基于所述物质被认定为亚稳态形式的这些发现,所述亚稳态形式迅速转变为更稳定形式(形式2),此时将其进行分离并通过hr-xrpd进行分析。将无定形的样品再熟化7天,但是没有观察到结晶度的改进。还将这些半结晶固体熟化更长的时间,但在另外的6天循环后没有显示出结晶度的任何改进。因为通过xrpd,这些(来自四氢呋喃的半晶形3(p44)和来自甲苯的半晶形3(p47))显示出与形式2的一些差异,所以通过dsc、hplc、和1h-nmr对其进行进一步研究。还将所有获得的固体在40℃和75%rh下储存7天,并且通过xrpd再次分析。形式2是这段时间后观察到的唯一的形式。形式3。对来自形式3(p35)的固体的热分析示出在37.6℃下的吸热事件,表明形式3可能是水合物。还在145.8℃下观察到宽吸热。通过vt-xrpd的分析显示在135℃下对与形式2相似的某些形式的改变。这与在40℃/75%rh下7天后看到的衍射图(数据未显示)是相关的,表明形式3是亚稳态形式,所述形式3在热和/或湿度下容易地转变为形式2。形式4。形式4的1h-nmr揭示了2当量的1,4-二噁烷。该结果与在dsc中观察到的在大约70.4℃下的吸热相关。去溶剂化后,看到在169.3℃下的吸热。该熔体与形式2相同,表明一旦溶剂释放形式4就转化为形式2。由于所获得的物质的量,tga和kf分析不能在样品上进行。在40℃/75%rh下的7天后通过xrpd的再分析证明形式4是亚稳态形式,所述形式4在热和/或潮湿下转化为形式2。这种形式的hplc纯度也低于其他。分析及仪器方法x射线粉末衍射(xrpd)。使用cukα辐射(40kv,40ma)、自动xyz平台、用于自动样品定位的激光视频显微镜、以及histar2维区域检测器,在brukeraxsc2gadds衍射仪上收集x射线粉末衍射图谱。x射线光学元件由与0.3mm的针孔准直器相结合的单个多层镜组成。使用认证的标准nist1976刚玉(平板)进行每周性能检查。光束发散度,即在样品上的x射线束的有效尺寸为大约4mm。使用θ-θ连续扫描模式,其中样品-检测器距离为20cm,所述检测器距离给出3.2°-29.7°的有效2θ范围。通常,样品将暴露于x射线束120秒。用于数据收集的软件是针对xp20004.1.43的gadds,并使用diffracplusevav15.0.0.0对数据进行分析和呈现。使用如所接收的没有研磨的粉末作为平板样品制备了在环境条件下运行的样品。将大约1-2mg的样品轻轻地压在载玻片上以获得平整的表面。将在非环境条件下运行的样品安装在具有导热化合物的硅晶片上。然后将所述样品以20℃/min加热到合适的温度,并且随后在数据收集开始之前等温保持1分钟。高分辨率xrpd。使用cukα辐射(40kv,40ma)、θ-2θ测角仪、以及v4和接收狭缝的发散度、ge单色仪、以及lynxeye检测器,在brukerd8衍射仪上收集x射线粉末衍射图谱。使用认证的刚玉标准(nist1976)进行仪器的性能检查。用于数据采集的软件是diffracplusxrdcommanderv2.6.1,并使用diffracplusevav15.0.0.0对数据进行分析和呈现。在环境条件下作为平板试样使用如所接收的粉末运行样品。将样品轻轻地包装到切割成抛光的零背景(510)硅晶片的空腔中。在分析过程中,将样品在其自身的平面中旋转。数据收集的细节是:角度范围:2至42°2θ;步长:0.05°2θ;收集时间:0.5s/步。核磁共振(nmr)。在配备有自动采样器并由drx400操纵台控制的bruker400mhz仪器上收集nmr谱。使用用topspinv1.3运行的icon-nmrv4.0.7使用标准的bruker加载实验获得了自动化实验。对于非常规光谱学,通过单独使用topspin获得数据。样品在dmso-d6中制备,除非另有说明。使用acdspectrusprocessor2012或2014进行离线分析。差示扫描量热法(dsc)。ta仪器q2000:在配备有50位自动进样器的ta仪器q2000上收集dsc数据。使用蓝宝石进行热容量的校准,并使用经过认证的铟进行能量和温度的校准。通常将在针孔铝盘中的0.5mg-3mg的每个样品以10℃/min从25℃加热至300℃。在样品上保持以50ml/min进行干燥氮气的吹扫。使用2℃/min的基础加热速率和±0.318℃(振幅)每60秒(周期)的温度调节参数进行调节温度dsc。仪器控制软件对q系列v2.8.0.394和thermaladvantagev5.5.3是有力的,以及使用universalanalysisv4.5a进行数据分析。ta仪器发现dsc:在配备有50位自动进样器的ta仪器发现dsc上收集dsc数据。使用蓝宝石进行热容量的校准,并使用经过认证的铟进行能量和温度的校准。通常将在针孔铝盘中的0.5mg-3mg的每个样品以10℃/min从25℃加热至260℃-300℃。在样品上保持以50ml/min进行干燥氮气的吹扫。仪器控制和数据分析软件是triosv3.2.0.3877。热重量分析(tga)。在配备有25位自动进样器的ta仪器发现tga上收集tga数据。使用认证的铝和镍对仪器进行温度校准。通常将5mg-10mg的每个样品加载到预去皮重的铝dsc盘上,并以10℃/min从环境温度加热至350℃。对样品保持25ml/min的氮气吹扫。仪器控制和数据分析软件是triosv3.2.0.3877。偏振光显微术(plm)。将样品在具有用于图像捕获的数字摄像机的leicalm/dm偏振光学显微镜上进行研究。将少量每个样品放置在载玻片上,安装在浸油中并用玻璃滑块覆盖,将单个颗粒尽可能地分离。用适当的放大率和部分偏振光观察样品,与λ假色彩滤光片相连。通过hplc的化学纯度确定。在配备有二极管阵列检测器的agilenthp1100系列系统上,并且使用chemstationsoftwarevb.04.03,利用以下详述的方法中的一者进行纯度分析:通常,在环境条件下将5mg-20mg的样品放入去皮重的网格不锈钢篮中。在40%rh和25℃(典型室内条件)下,加载和卸载样品。如下所述进行水分吸附等温线(2次扫描给出1次完整的循环)。标准等温线在25℃下,在0-90%rh范围内,以10%rh间隔进行。利用microsoftexcel使用dvsanalysissuitev6.2(或6.1或6.0)进行数据分析。蒸汽吸附重量分析(gvs)。使用由dvs固有控制软件v1.0.1.2(或v1.0.1.3)控制的smsdvs内在水分吸附分析仪来获得吸附等温线。通过仪器对照将样品温度保持在25℃。通过混合干燥和湿的氮气流控制湿度,其中总流速为200ml/min。通过位于样品附近的校准rotronic探针(动态范围为1.0-100%rh)来测量相对湿度。通过微量天平(精度±0.005mg)不断监测作为%rh的函数的样品的重量变化(质量松弛)。通常,在环境条件下将5mg-20mg的样品放入去皮重的网格不锈钢篮中。在40%rh和25℃(典型室内条件)下,加载和卸载样品。如下所述进行水分吸附等温线(2次扫描给出1次完整的循环)。标准等温线在25℃下,在0-90%rh范围内,以10%rh间隔进行。利用microsoftexcel使用dvsanalysissuitev6.2(或6.1或6.0)进行数据分析。水溶解度。通过将足够的化合物悬浮在水中以给出最大终浓度≥10mg/ml的母体游离形式的化合物来确定水溶解度。在25℃下,将悬浮液平衡24小时,然后测量ph。然后将悬浮液通过玻璃纤维c过滤器进行过滤。然后将滤液通过适当的因子进行稀释。参考在dmso中大约0.2mg/ml的标准溶液通过hplc进行定量。注射不同体积的标准的经稀释和未经稀释的样品溶液。使用通过在与标准注射中的主峰相同的保留时间发现的峰的积分确定的峰面积来计算溶解度。在配备有二极管阵列检测器的agilenthp1100系列系统上,并且使用chemstation软件vb.04.03进行分析。离子色谱法(ic)。在具有858专业自动进样器和800dosimo剂量单位监控器的metrohm930compacticflex上,使用icmagicnet软件v3.1来收集数据。制备精确称重的样品作为适当溶解的溶液中的原液,并在测试前进行适当地稀释。通过与正在分析的已知离子浓度的标准溶液进行比较来实现定量化。熟化/浆熟化。将用于熟化的悬浮液放置在平台摇床培养箱(heidolphtitramax/inkubator1000)中,并在从环境温度至50℃下振荡(8小时循环:加热至50℃保持4小时,并且然后关闭加热,并将样品逐渐冷却至环境条件持续另外4小时)经受一系列的加热-冷却循环。通过卡尔费舍尔法滴定法(kf)的水确定。在150℃下,使用hydranalcoulomatag烘箱试剂和氮气吹扫,在metrohm874烘箱样品处理器上用851titranocoumeter测量每个样品的水含量。将称重的固体样品引入密封的样品小瓶中。每次滴定使用大约10mg的样品,并进行重复确定。使用tiamov2.2进行数据的收集和分析。生物学活性以上实例的活性可以在以下测定中说明。以上列出的化合物(这些化合物可能还没有制备出和/或测试过)预期在这些测定中具有活性。测定kdm1a的抑制可以在体外、培养细胞中、以及动物中确定。存在多种分光光度法检测甲基化赖氨酸的脱甲基化的结果,即,检测kdm1a脱甲基化酶氧化活性对代表组蛋白h3底物的n-末端的至少18个氨基酸的肽片段的产物,所述组蛋白h3底物在第四赖氨酸残基处含有单甲基。过氧化氢(kdm1a脱甲基化酶反应的一种产物)与辣根过氧化物酶和二羟吩嗪(adhp)反应以产生荧光化合物试卤灵(激发=530-560nm:发射=590nm)。kdm1a脱甲基化酶酶活性可以获得自哺乳动物细胞或组织,这些哺乳动物细胞或组织从内源或重组基因表达kdm1a,并且从全细胞提取物中纯化或测定。这些方法可以用来确定披露的化合物的浓度,这些化合物可以抑制50%的酶活性(ic50)。在一方面,所披露的方法展现出以少于500nm、少于100nm、少于50nm或少于10nm的浓度抑制50%的kdm1a酶活性。可以通过本领域技术人员已知的各种体外和体内方法来确定kdm1a与其他蛋白的关联。例如,可以在电迁移率改变测定(emsa)中确定kdm1a与相关蛋白的中断。在多个方面中,由所披露的化合物造成的kdm1a与corest的物理相关的中断可以使用emsa观察到。在另一个实施例中,kdm1a与相关蛋白的中断可以通过免疫沉淀法,随后通过质谱或通过凝胶电泳分离共同沉淀的蛋白来确定。在另一个实施例中,kdm1a与相关corest的中断可以通过kdm1a作用于含有k4或k9甲基化组蛋白h3的核小体底物的能力来确定,所述底物需要kdm1a和corest二者的存在。使用核小体底物,所披露的化合物可以用来测定与kdm1a相关的corest的抑制;此类化合物可以不抑制kdm1a酶活性,如通过使用组蛋白h3k4甲基化的肽底物所确定的。在基于细胞的测定中,可以确定kdm1a的抑制。例如,kdm1a是必需的酶并且延长抑制kdm1a将导致细胞死亡,因此可以测定细胞生长抑制、细胞生长停滞或细胞死亡。在另一方面,由雄激素和雌激素诱导的基因需要kdm1a活性;由所披露的化合物抑制kdm1a在用雄激素和雌激素治疗的细胞中废除了基因表达的诱导。可以测量这些作用,例如,使用mrna的定量pcr来测量雄激素和雌激素依赖性基因的基因表达量。针对抑制特定基因的转录需要kdm1a活性。由所披露的化合物造成的kdm1a的抑制可以脱抑制细胞中此类基因的表达。这些基因包括meis1、veg-a、aim1、hmox1、vim、skap1、bmp、eomes、foxa2、hnf4、sox17、gh、psa、ps2、greb1、gr-1b、prl、tshb、syn1、hbg、scn1a、scn2a、和scn3a,这些基因的表达可以在用披露的化合物治疗细胞之前和之后的不同时间使用mrna的定量pcr进行测定。在另一方面,kdm1a是白血病干细胞潜能的调节子并且是针对通过mll-af9的骨髓细胞至急性骨髓性白血病(aml)的致癌性转化所需要的。在培养物中生长的mll-af9转化的细胞中的kdm1a的抑制克服了在分化成产生表达cd11b表面抗原(单核细胞抗原)的更熟化细胞方面的停滞。因此,使用aml细胞系如培养物中生长的thp-1可以测定kdm1a的抑制,使用荧光激活细胞分选术(facs)量化新表达cd11b抗原的细胞的比例。还可以使用类似的使用facs来计数展现cd14或cd86的细胞的测定,其各自特征为顺着巨噬细胞/单核细胞谱系的更熟化的细胞。源自患有急性骨髓性白血病的其他细胞系如mv4;11或molm-13细胞可以用于该测定。沿着巨噬细胞/单核细胞谱系的分化的其他标志物可以类似地通过facs如cd14和cd86进行测定。针对诱导以上提及的特定基因或分化标志物连同细胞生长和细胞凋亡的诱导,通过膜联蛋白v染色和facs计数,可以测定其他aml细胞系如mplm-13或mv4;11。可以通过测定所披露的化合物针对其他fad依赖性氨基氧化酶如单胺氧化酶a(mao-a)、单胺氧化酶b(mao-b)、il4i1、kdm1b、或smox的ic50,来确定所披露的化合物针对kdm1a的选择性。像这样,所披露的化合物将抑制kdm1a,并且具有低于mao-a或mao-b50倍、或100倍或250倍或500倍的ic50。另外的脱甲基化酶测定组蛋白脱甲基化酶测定可以基本如shi,y等人,cell[细胞]199,941-953(2004)中所描述的进行。简言之,在37℃下,将散装组蛋白、组蛋白肽或核小体用纯化的人类重组kdm1a,在组蛋白脱甲基化酶活性(hdm)测定缓冲液1(50mmtrisph8.5,50mmkcl,5mmmgcl,0.5%bsa,以及5%甘油)中进行孵育从30分钟至4小时。在100微升中进行典型反应,其中将20微克的纯化的散装组蛋白或3微克的修饰的组蛋白肽用作底物。将范围从1-20微克的不同量的kdm1a用于所述反应中,必要时,与其他辅因子如fad或corest一起,这取决于所选择的底物。将反应混合物通过以下进行分析:使用组蛋白甲基特异性抗体通过sds-page和蛋白质印迹法或通过甲醛形成测定以检测甲基基团的去除以及向甲醛的转化,或者在肽底物的情况下通过质谱来鉴别脱甲基化的组蛋白肽。在378c下,在10ml的终体积中,将散装组蛋白(例如,4mg)用指示量的重组蛋白或复合物在组蛋白脱甲基化酶(hdm)测定缓冲液(50mmtrisph8.5,50mmkcl,5mmmgcl,5%甘油,0.2mm苯甲基磺酰氟以及1mm二硫苏糖醇)中进行孵育12h-16h。针对核小体(0.3mg)或单核小体(0.3mg)可以使用含有0.1%np40的hdm缓冲液a。然后可以通过sds-page,随后蛋白质印迹法来分析所述反应混合物。对组蛋白h3和组蛋白h3的乙酰基--k9/k14中的单或二甲基k4具有抗性的抗体被用来分别检测甲基化和乙酰化的程度。然后通过密度测定法或通过发光强度量化蛋白质印迹。可替代地,可以使用标准荧光测定,其中使用与组蛋白甲基化底物共轭的生物素和在珠上的链霉亲和素(sa)或附接于板的sa,将甲基化的组蛋白底物拴系于96孔板底部(或拴系于安置于板中的珠)以保护生物素酰化的底物。在组蛋白脱甲基化酶缓冲液a中孵育kdm1a酶后,可以使用脱甲基化h3k4底物的特异性抗体检测脱甲基化的组蛋白底物,所述脱甲基化h3k4底物与荧光剂或一些其他可检测治疗剂共轭。所述测定方法的变化形式使用了针对组蛋白的甲基化形式的抗体,其中在用酶孵育之前和之后量化底物的量。类似测定的另一个变形使用了检测的荧光共振能量转移(fret)系统,其中将识别甲基化形式的抗体与实体,例如珠或大载体分子共轭或以其他方式连接到其上,在所述珠或大载体分子上附接了荧光团(供体)并且所述荧光团(受体)结合至与底物连接的实体。可替代地,在kdm1a反应过程中,h2o2的产生可以进行荧光计量法监测。在该系统中,在暴露于底物、辅因子以及酶之后,使用adhp(10-乙酰基-3,7-二羟吩嗪)作为针对辣根过氧化物酶(hrp)的荧光底物,在hdm测定缓冲液中检测h2o2的产生。adhp(又称amplex红试剂)是最稳定的并且是hrp的敏感荧光底物。所述荧光产物是试卤灵。敏感性可以低至10-15m的靶蛋白。在530-560nm和590nm的激发和发射波长下,分别使用荧光酶标仪读取信号。此外,kdm1a反应可以包括其他因子,这些因子可以影响kdm1a的活性。此类因子可能包括corest、nurd复合物、dnmt1、hdac1、hdac2、和hdac3,例如,当蛋白已知与含kdm1a或kdm1a的复合物相关的时候。可以测定影响kdm1a活性任何方面的相互作用,这些方面包括模板特异性、底物、km、kcat,或对fad浓度的敏感性。例如,可以进行在kdm1a和corest之间的体外相互作用测定,添加重组kdm1a(例如,10mg)和corest(例如,5mg),混合并且4℃-8℃下孵育1h,通过superdex200凝胶过滤柱在含有20mmtris-hclph7.9、500mmkcl、10%甘油、0.2mmedta、1mm二硫苏糖醇、0.1%诺纳p40以及0.2mm苯甲基磺酰氟的缓冲液中进行分级,并且然后通过银染色进行分析。针对具有kdm1a和corest的单核小体的免疫共沉淀,可以将核小体(1.5mg)与微球菌核酸酶一起消化,并且在4℃-8℃下,用重组kdm1a(例如,1mg)、corest(例如,500ng)或二者蛋白在含有0.1%np40的hdm缓冲液a中孵育1h。添加针对附接于亲和树脂的kdm1a或corest的抗体,并且在用含有0.1%np40的hdm缓冲液a彻底洗涤后,用洗涤缓冲液洗脱结合蛋白。可以在洗脱液中测定kdm1a活性,或者通过定量蛋白质印迹确定kdm1a的浓度。起始于100μm,用3倍连续稀释,在10-剂量ic50模荧光偶联酶测定中,一式两份检验化合物。作为lsd1对10μm组蛋白h3(1-21)k4me2肽底物的脱甲基化酶活性的结果的fad依赖性h2o2的产生是通过与hrp和amplex红偶联以产生试卤灵来测量的(在envision上在ex/em=535/590nm下测量的荧光,珀金埃尔默(perkinelmer))。结果在下表1中给出。表2:生物学活性纯化的人类cd34+细胞离体分化成红血球谱系从健康供体的静脉血分离的人类cd34+细胞,在通过粒细胞集落刺激因子(g-csf)动员后,使用两相培养法离体生长并分化持续14天孵育,所述两相培养法描述于cui,s.,等人.molcellbiol[分子细胞生物学]31,3298-3311(2011)中。使用血细胞计数器对细胞进行计数,并且通过台盼蓝排除法确定活力。在第4天开始至第14天,在测试浓度的范围下,将溶解于可与生理条件配伍的适当的溶剂中的测试品(候选化合物)每日添加至新鲜的培养基中。通过瑞氏-吉姆萨染色法(wright-giemsastaining)确定分化的细胞形态学以及阶段。确定分化表面标志物以及hbf含量的流式细胞术。将培养的红系细胞用藻红蛋白(pe)-cy7-共轭的抗-cd34、pe-共轭的抗-cd71、以及pecy5-共轭的抗-血型糖蛋白a抗体进行染色。为了确定细胞质hbf的浓度,将细胞固定于0.05%戊二醛10分钟,用0.1%曲通x-100透化5分钟,并且用别藻蓝蛋白-共轭的抗-hbf抗体进行染色。使用facs分析仪分类并计数染色的细胞。蛋白印迹法来确定kdm1a和组蛋白h3和h3修饰的存在与浓度。将细胞溶解于laemmli样品缓冲液中并且进行sds-page。将蛋白从凝胶转移至硝化纤维素,并且用针对kdm1a、和/或组蛋白h3、单甲基(h3k4me1)和/或二甲基组蛋白h3k4(h3k4me2)的抗体进行探测,并且然后用荧光-共轭的第二抗体进行探测。用成像系统量化蛋白浓度。染色质免疫沉淀(chip)测定来确定在基因组-特异位点处蛋白的占有率。在有或没有sds的情况下(取决于kdm1a抗体对sds的敏感度),在免疫沉淀反应(ip)缓冲液中进行chip测定。简言之,典型地,每kmd1achip使用3x107个细胞,并且每h3k4me2chip使用3x106个细胞。在10分钟的0.75%甲醛处理后,收获细胞,并且在chip裂解缓冲液(1%曲通x-100、10mmedta、50mmtris-hcl以及蛋白酶抑制剂)中超声处理以产生具有在300和1000bp之间平均尺寸的可溶染色质。然后将染色质样品在稀释缓冲液(5mmedta、25mmtris-hcl、167mmnacl、以及蛋白酶抑制剂的混合物)中稀释10倍,并且使用鲑精dna/蛋白a琼脂糖珠预清洁1小时。然后将十微克的兔抗kdm1a抗体,3微升的抗h3k4me2或对照抗体添加至各样品中,并且在4℃下孵育过夜。为了收集免疫复合物,将40微升的鲑精dna/蛋白a琼脂糖珠添加至样品,在4℃下持续1小时。将珠在洗涤缓冲液(0.1%曲通x-100、5mmedta、30mmtris-hcl、150mmnacl)中洗涤三次并且在洗涤缓冲液2(1%曲通x-100、5mmedta、30mmtris-hcl、150mmnacl)中洗涤一次。将结合的蛋白-dna复合物用100微升的洗脱缓冲液(1%sds、0.1mnahco3、250mmnacl、以及0.2微克蛋白酶k)进行洗脱并且在65℃下脱交联4hr。将脱交联的染色质dna进一步通过qiaquick聚合酶链式反应(pcr)纯化试剂盒(qiagen公司)纯化,并且在100微升te缓冲液中洗脱。针对各pcr反应使用四微升的洗脱的dna样品。三十六个pcr循环可以用于kdm1achip并且32个pcr循环可以用于h3k4mme2chip。使用感兴趣的位点(例如,γ球蛋白基因)的适当的引物。针对球蛋白特异性chip分析,如在cui,s.,等人,molcellbiol[分子细胞生物学]31,3298-3311(2011)中所述的进行这些测定。例如,可以将乙二醇双(琥珀酰亚胺琥珀酸酯)或甲醛用作交联剂。针对靶蛋白如kdm1a和组蛋白h3的抗体,在有或没有甲基修饰的情况下,可以用于免疫沉淀反应。在免疫沉淀物中所含有的dna可以通过实时定量pcr(rt-qpcr)测定,使用针对人类胚胎、γ-球蛋白、以及成人β-球蛋白启动子序列的引物进行量化;可以将针对在胚胎球蛋白和γg-球蛋白基因之间的基因间区域的引物用作阴性对照。通过hplc的血红蛋白分析将细胞裂解,并且使用配备有离子交换hplc管柱(hercules)的伯乐ii型血红蛋白测试系统(bio-radvariantiihemoglobintestingsystem),针对血红蛋白组成进行分析。用于测试γ球蛋白基因表达的诱导的小鼠模型将测试品溶解于生理学兼容的溶剂,用于注射到正常小鼠或具有含有整个人类β-球蛋白基因座(如tanabe,o.,等人,emboj[欧洲分子生物学组织杂志]26,2295-2306(2007)中所述)或部分人类β-球蛋白基因座的酵母人工染色体(yac)的转基因小鼠中。可以将测试品每天以适当试验剂量向腹膜内或经皮下或通过管饲法进行给予,持续高达26周。每隔一段时间,收获外周全血和骨髓细胞以通过以下各项的rt-qpcr来确定基因表达:小鼠胚胎β样球蛋白基因,或红细胞裂解物的β样球蛋白组合物,或在携带人类β样球蛋白基因的情况下,人类和小鼠胎儿γ-球蛋白和成年β-球蛋白基因。针对人类γ球蛋白基因表达或hbf的诱导的测试。患有血红蛋白病(包括镰状细胞病和β-地中海贫血)的患者可能会从用kdm1a的抑制剂的治疗中受益。在适当的给药后,可以如以上所描述确定hbf的测量值。γ球蛋白基因表达可以在骨髓细胞中使用qpcr进行分析。此外,包括hbf的治疗剂的临床益处可以测量为总血红蛋白量的增加、镰状细胞危象的减少、输血依赖性的降低、无效造血的减少、以及炎性生物标标物如gdf15的血浆水平的降低等。药物代谢动力学以上实例的药物代谢动力学特性,包括吸收、分布、代谢、以及排泄,可以在以下测定中进行说明。以上列出的化合物(这些化合物可能还没有制备出和/或测试过)预期在这些测定中具有活性。在人类和鼠类肝微粒体中的代谢稳定性根据以下方案可以确定在池化的人类肝微粒体(hlm)和池化的雄性小鼠肝微粒体(mmlm)中本文披露的化合物的代谢稳定性,其中通过lc/ms/ms评估在反应系统中的化合物的浓度,用于估计肝微粒体中的稳定性。研究设计池化的人类肝微粒体(hmmcpl;pl050b)和池化的雄性小鼠肝微粒体(msmcpl;ms033)是购自cellzdirect(invitrogen[英杰公司])。在使用之前,将微粒体储存在-80℃下。制备母液,所述母液含有微粒体(原液浓度5mg/ml,体积50μl,终浓度0.5mg/ml)、mgcl2溶液(原液浓度50mm,体积50μl,终浓度5mm)、磷酸盐缓冲液(原液浓度200mm,体积250μl,终浓度100mm)、以及水(体积95μl)。然后添加5μl的200μm测试化合物或对照溶液(对照化合物:维拉帕米)。在反应系统中测试化合物或维拉帕米的终浓度为2μm。将所述混合物在37℃下预热5min。添加50μl终浓度为1mm的10mmnadph溶液开始反应,并且在37c下进行。在阴性对照中使用50μl超纯h2o替代nadph。在0时和30min时从反应溶液中取50μl的等分试样。在所指定的时间点处,通过添加具有is(200nm丙咪嗪、200nm拉贝洛尔、和2μm酮洛芬)的3体积的冷甲醇将所述反应停止。在16,000g下将样品离心10分钟,以沉淀蛋白。通过100μl超纯h2o稀释上清液的100μl的等分试样,并且将所述混合物用于lc/ms/ms分析。可以将所有实验一式两份进行。生物分析方法使用液相色谱-质谱法分析样品。lc系统可以包含岛津(shimadzu)液相色谱分离系统,所述液相色谱分离系统配备有脱气装置dgu-20a3、溶剂递送单元lc-20ad、系统控制器cbm-20a、柱温箱cto-10asvp、以及ctc分析htcpal系统。色谱条件可以包括phenomenex柱,5.0μc18(2.0×50mm);0.1%甲酸在乙腈中和0.1%甲酸在水中的流动相;500μl/min的洗脱率;柱温25℃;注射体积10μl。使用来自ab公司(加拿大)的具有esi界面的api4000仪器进行质谱分析。例如,使用来自abi公司的分析师1.5.1软件创建数据采集和控制系统。在多反应监测(mrm)扫描中使用涡轮喷雾离子源和电喷射离子化。另外的参数包括:撞击气体,6l/min;气帘气体,30l/min;喷雾器气体,50l/min;辅助气体,50l/min;温度,500℃;离子喷射电压,+5500v(阳性mrm)。将四极杆q1和q3分别设置为456.2和200.2;将去簇电压(dp)、入口电压(ep)、和碰撞室入口电压(ce)分别设置为120、10、和55v;碰撞室出口电压(cxp)为12v。分析可以使用microsoftexcel进行所有的计算。从提取的离子色谱图确定峰面积。所述测定中包括对照化合物。拒绝不在规定限度内任何化合物的值,并且重复试验。将没有辅因子的反应系统用于排除由于化学品自身的不稳定性造成的任何误导因素。结果在制药化学和药物化学中,通常希望具有赋予药物开发适用性的特性的有效化合物,如溶解度、稳定性、和合成可靠性。例如,包含部分-(ch2)m-y-(ch2)n-z-形成的化合物已被证明可以合成,其中很少有不期望的副产物和/或相对较好的稳定性。此外,如在上表中所披露的,其中r3是被杂芳基、氰基、或-s(o)2n(ch3)2(称为r6或r6a)取代的芳基,所述化合物具有通常表现出的良好效力。组合物以下是可以用来递送本文披露的化合物的组合物的实例。这些可以使用本领域已知的方法进行囊封或湿法造粒。组合物实例1组合物实例2成分浓度(w/w%)具有化学式i的化合物50%乳糖48%硬脂酸镁2%通过以上的说明,本领域的技术人员可以很容易地确定本发明的实质特征并且在不偏离本发明的精神和范围的情况下可以对本发明作不同变化和变更,以使它适应不同用途和条件。其他实施例提供以上列出的详细说明以帮助本领域技术人员实践本披露。然而,本文描述和要求保护的披露不限于本文披露的特定实施例的范围,因为这些实施例旨在作为本披露几个方面的说明。任何等价的实施例都旨在处于本披露的范围之内。事实上,除了本文示出并且描述的那些,本披露的各种修改从前述说明书对于本领域技术人员来说也将变得清楚,这不偏离本发明的精神或范围。这样的修改也旨在落入所附权利要求的范围内。在本说明书中引用的所有参考文献都通过引用而特此结合。本文的参考文献的讨论只是为了总结其作者做出的主张,并非承认任何参考文献构成与专利性有关的现有技术。申请人保留质疑提及的参考文献的准确性和相关性的权利。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1