一种表面结合载药纳米粒的干细胞肿瘤靶向系统的构建的制作方法
本发明属于生物医药技术和纳米医学技术领域,具体涉及一种表面结合载药纳米粒的干细胞肿瘤靶向系统的构建。
背景技术:
尽管经历了30年的发展,传统的抗癌药物仍然存在非特异性靶向肿瘤部位、剂量依赖性毒副作用的缺点。将缓控释技术和靶向递送技术相结合有助于攻克上述难题。纳米技术的出现为抗肿瘤药物的有效递送提供了可能。包封药物的聚合物纳米粒能达到长期缓释或环境响应型释放的效果,使药物浓度长期维持在治疗范围内,减少了毒副作用。载药纳米粒也能通过EPR效应被动靶向肿瘤部位,或者通过表面连接配体主动靶向。但是这样的靶向递送方式仍然存在体内循环不稳定易被网状内皮系统(RES)快速消除、难以跨越生理屏障而无法在肿瘤部位有效蓄积达到治疗浓度等问题。
受病原体吸附于红细胞表面而有效逃避RES消除作用的启发,细胞载体开始被应用于抗肿瘤药物靶向递送。间充质干细胞(MSCs)因为具有本质的肿瘤趋向性和迁移能力、低免疫原性和内因性突变率、易于分离和体外培养等优点而成为最具有应用价值的细胞载体。目前对于以MSCs为载体的研究主要集中于递送细胞因子(肿瘤坏死因子相关的诱导凋亡配体TRAIL、白细胞介素IL-12)、酶和前药(胞嘧啶脱氨酶CD和5-氟胞嘧啶5-FC)、溶瘤病毒,用于治疗脑胶质瘤。
近年来也有研究尝试以MSCs为细胞载体,与载药纳米粒通过细胞内吞或膜表面结合的方式,构建干细胞-纳米粒混合载体以高效递送抗肿瘤药物的递送系统。CN 104771764 A公布了一种内载纳米前药的干细胞肿瘤靶向系统stem cells-(RGD-PPCD)n,以细胞内吞的方式将纳米前药加载于干细胞内制备抗肿瘤靶向系统,结合了纳米前药的靶向、缓释与酸敏释放特性和干细胞载体的远程靶向肿瘤原发灶及转移灶的特性。但是,在MSCs膜表面结合载药纳米粒构建干细胞-纳米粒混合载体的领域还少有涉及。通过膜表面结合的方式构建的系统,抗肿瘤药物不会直接作用于干细胞载体,能减少对其活性、肿瘤趋向性的影响;纳米粒释药也不会受到干细胞载体P糖蛋白外排、膜被动扩散的影响,更容易调控释放曲线,以实现药物在肿瘤部位有效富集并持续释放的目的。
技术实现要素:
本发明的目的是提供一种干细胞表面结合载药纳米粒的技术,应用于肿瘤靶向治疗。
具体而言,是以合成材料Bio-Chi作为抗肿瘤药物Cur的纳米粒载体,再以生物素化的MSCs作为细胞载体,通过亲和素架桥连接纳米粒表面生物素和MSCs表面生物素,制备干细胞-纳米粒混合载体用于肿瘤靶向递送,具有以下通式:Cur/Bio-Chi-S-B-MSCs。
所述的MSCs为鼠源脂肪间充质干细胞。
所述的Bio-Chi是由生物素的羧基与壳聚糖的氨基经缩合反应形成酰胺键制得,结构为:
其中Bio-Chi的壳聚糖分子量为5-200k,生物素取代度为1.91-45.82%。优选的分子量为200k,取代度为45.82%。
合成方法如下:将壳聚糖溶于1%盐酸溶液中溶胀过夜,用pH=5.5的2-吗啉乙磺酸钠缓冲液稀释至所需浓度。将生物素、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、N-羟基丁二酰亚胺溶于DMSO与DMF的混合溶剂中,室温搅拌2h。将活化的生物素逐滴加入搅拌中的壳聚糖溶液中,持续搅拌24h,过滤除去不溶物。置于透析袋中用去离子水透析2天,冷冻干燥。
所述的载药纳米粒Cur/Bio-Chi的制备方法如下:将含1mg Cur的乙醇溶液,以体积比1/4-3/4,滴加入浓度为2-10mg/mL的含10mg Bio-Chi的1%醋酸溶液中。置于50℃水浴中持续搅拌30min。用50W探头超声处理30min,透析6h,过0.8μm亲水性微孔滤膜,用PBS稀释到所需浓度。
在上述制备过程中,乙醇溶液与1%醋酸溶液的体积比为1/4,Bio-Chi的浓度为10mg/mL。
将制得的Cur/Bio-Chi置于透析袋(MWCO=14,000)中,两端扎紧,浸入pH=7.4、6.5、5.5的释放介质中。在预定时间点收集释放介质,加入等量乙醇剧烈涡旋,根据λ=431nm处的吸光度值计算释放量,绘制释放曲线。
所述的干细胞-纳米粒混合载体,通过亲和素架桥连接Cur/Bio-Chi表面生物素和B-MSCs表面生物素。首先检测药物、聚合物材料、载药纳米粒对MSCs的细胞毒性。将含2-200μg/mL Cur的Cur溶液、Cur/Bio-Chi溶液,含0.05-5mg/mL的Bio-Chi溶液与MSCs共同孵育24h,用MTT法检测细胞生存率。
制备方法如下:将MSCs与0.5mL浓度为0.1-1mg/mL的sulfo-NHS-LC-Biotin的PBS溶液孵育20min。同时,将0.25mL浓度为100-200μg/mL的RBITC-亲和素的PBS溶液与0.25mL含25-100μg/mL Cur的Cur/Bio-Chi的PBS溶液避光孵育20min。将0.5mL RBITC-亲和素和Cur/Bio-Chi的混合溶液与B-MSCs孵育20min。
在上述制备过程中,sulfo-NHS-LC-Biotin的浓度为0.5mg/mL,RBITC-亲和素的浓度为150μg/mL,Cur/Bio-Chi的浓度为100μg/mL Cur。
将与MSCs孵育前、孵育后的Cur/Bio-Chi溶液适当稀释后,加入等量乙醇剧烈涡旋,根据λ=431nm处的吸光度差值定量计算细胞载药量。将孵育完成后的Cur/Bio-Chi-S-B-MSCs用倒置荧光显微镜观察,并用胰酶消化,PBS重悬,用流式细胞仪对RBITC、Cur的荧光进行检测,定性检测MSCs对Cur/Bio-Chi的加载。
本发明构建的表面结合载药纳米粒的干细胞肿瘤靶向系统,将具有如下优势:
1、将抗肿瘤药物特异性递送至肿瘤部位,并在肿瘤部位富集。
2、抗肿瘤药物能在肿瘤部位持续缓慢释放。
3、抗肿瘤药物不会直接作用于干细胞载体,减少对其活性、肿瘤趋向性的影响。
4、抗肿瘤药物的释放只与聚合物载体的相互作用有关,释放曲线易于控制。
附图说明
图1 Chi与Bio-Chi的红外图谱
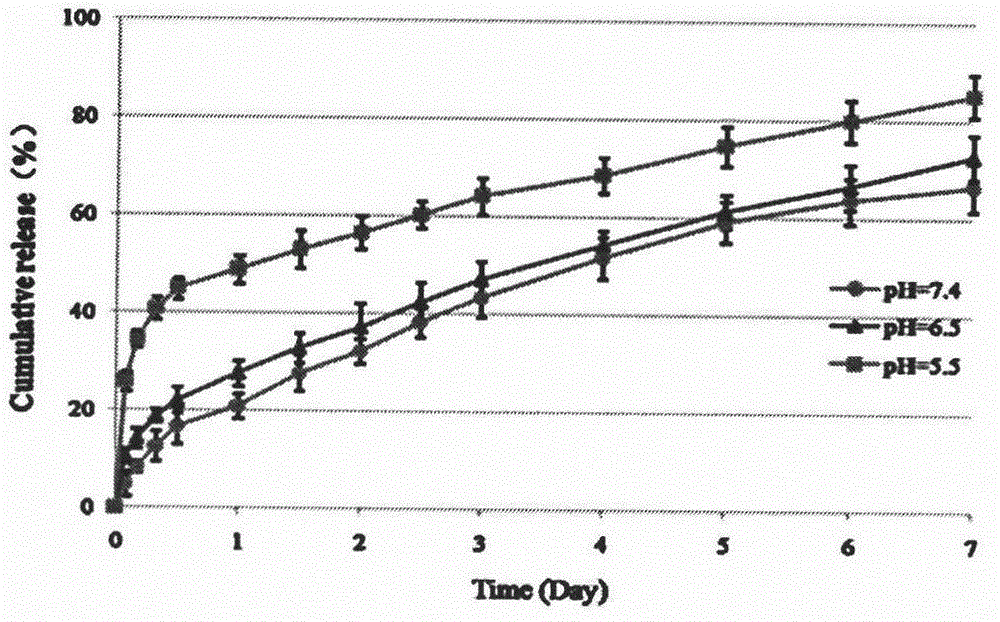
图2 Bio-Chi在不同pH的介质中的释放曲线
图3 Bio-Chi对MSCs的细胞毒性
图4 Cur、Cur/Bio-Chi对MSCs的细胞毒性
图5 MSCs的生物素化检验
图6 亲和素浓度对MSCs表面结合载药纳米粒的影响
图7 Cur/Bio-Chi浓度对MSCs表面结合载药纳米粒的影响
具体实施方式
下面具体实施例是对本发明的进一步说明,但下述仅用于说明本发明而非用于限定本发明的范围。
实施例1:Bio-Chi的合成与表征
将90mg壳聚糖溶于1%盐酸溶液中溶胀过夜,用pH=5.5的2-吗啉乙磺酸钠缓冲液稀释至20mL。将120mg生物素、84mg EDC、56mg NHS溶于6mL DMSO与DMF的混合溶剂中,室温搅拌2h。将活化的生物素逐滴加入搅拌中的壳聚糖溶液中,持续搅拌24h,过滤除去不溶物。置于透析袋中去离子水透析2天,冷冻干燥。
对合成的Bio-Chi进行红外光谱分析,结果显示在1635.6cm-1处出现酰胺键的伸缩振动峰,在1531.9cm-1处出现生物素咪唑酮环的酰胺键的伸缩振动峰,表明生物素与壳聚糖已经化学键合(附图1)。
实施例2:Cur/Bio-Chi的制备与表征
称取10mg Bio-Chi,溶于1mL 1%醋酸溶液中,溶胀过夜。室温搅拌下,将0.25mL 4mg/mL的Cur乙醇溶液滴加入Bio-Chi溶液中。50℃水浴中持续搅拌30min,50W探头超声处理30min,透析6h除去有机溶剂,过0.8μm亲水性微孔滤膜,用PBS稀释到所需浓度。
用激光粒度分析仪测定Cur/Bio-Chi的粒径为360.2±2.6nm,电位为9.6±1.9mV。取适量纳米粒溶液,加入等量乙醇剧烈涡旋,测定λ=431nm处的吸光度值,根据标准曲线计算纳米粒溶液中的Cur含量,并按照下式计算包封率:包封率%=WCur纳米粒/WCur投料×100%。计算得到Cur/Bio-Chi的包封率为54.7±2.4%。
实施例3:Cur/Bio-Chi的释放曲线
取0.4mL Cur/Bio-Chi,用10mM PBS 7.4稀释至2mL,置于透析袋(MWCO=14,000)中,两端扎紧,浸入5mL含0.1%吐温80的10mM PBS(pH=7.4、6.5、5.5)中。在恒温37℃,转速为100rpm条件下进行释放。在预定时间点2、4、8、12、24、36、48、60、72、96、120、144、168h,收集释放介质并更换5mL新鲜介质。取1mL收集的释放介质,加入1mL乙醇,剧烈涡旋5min,紫外-可见分光光度计测定λ=431nm处的吸光度值,计算释放量,绘制释放曲线。
结果表明,在pH=7.4环境中,Cur/Bio-Chi能保持持续缓慢释放Cur长达7天以上;在酸性环境中,Cur/Bio-Chi出现了一个突释,而后再持续释放,释放更完全、释放速度更快(附图2)。
实施例4:药物与载体材料的细胞毒性
将对数生长期的MSCs按每孔1×104个细胞接种于96孔板,100μL DMEM高糖完全培养基/孔,培养24h,使细胞汇合度为70-80%。吸去培养基,每孔加入200μL含2-200μg/mL Cur的Cur溶液、Cur/Bio-Chi溶液、含0.05-5mg/mL的Bio-Chi溶液。24h后,吸去培养基,PBS清洗,每孔加入100μL含10%MTT溶液(5mg/mL,pH=7.4PBS)的DMEM高糖完全培养基,37℃继续孵育4h。轻轻吸除培养基,每孔加入150μL DMSO,室温振荡10min,用酶联免疫测定仪于570nm测定吸光度。以未经阳离子聚合物处理的细胞作为对照,计算细胞生存率,细胞生存率(%)=OD570(实验组)/OD570(对照组)×100。
结果表明,Bio-Chi的细胞毒性小,细胞相容性好(附图3)。Cur对MSCs有一定的细胞毒性,但是经Bio-Chi包封后,细胞毒性显著减小,在100μg/mL Cur的高浓度下孵育24h,细胞生存率仍能达到80%以上,所以孵育20min以及负载低浓度的Cur/Bio-Chi产生的细胞毒性可忽略不计(附图4)。
实施例5:MSCs的细胞表面生物素化与检验
将MSCs接种于24孔板,37℃培养过夜。将MSCs与0.5mL浓度为0.1-1mg/mL的sulfo-NHS-LC-Biotin的PBS溶液室温孵育20min,以0.5mL PBS溶液为空白对照。吸除介质,避光加入0.5mL浓度为50μg/mL的RBITC-亲和素的PBS溶液,室温孵育20min。吸除介质,胰酶消化后用PBS重悬,用流式细胞仪对RBITC的荧光强度进行检测。
结果表明,未经生物素化的MSCs(PBS组)几乎不结合RBITC-亲和素。经浓度为0.1、0.5、1mg/mL的sulfo-NHS-LC-Biotin生物素化后,B-MSCs结合的RBITC荧光逐渐增强。当达到一定浓度后(≥0.5mg/mL),荧光标记细胞数与荧光强度都趋于稳定(附图5)。
实施例6:Cur/Bio-Chi-S-B-MSCs的最佳亲和素浓度考察
将MSCs接种于24孔板,37℃培养过夜。将MSCs与0.5mL浓度为0.5mg/mL的sulfo-NHS-LC-Biotin的PBS溶液室温孵育20min。同时,将0.25mL浓度为100-200μg/mL的亲和素的PBS溶液与0.25mL含50μg/mL Cur的Cur/Bio-Chi的PBS溶液避光孵育20min。将0.5mL亲和素和Cur/Bio-Chi的混合溶液与B-MSCs孵育20min。吸除介质,胰酶消化后用PBS重悬,用流式细胞仪对Cur的荧光强度进行检测。
结果表明,随亲和素浓度增加,能结合更多的Cur/Bio-Chi使细胞表面载药量增加。但到达一定浓度后(>150μg/mL)细胞表面载药量会达到饱和(附图6)。
实施例7:Cur/Bio-Chi-S-B-MSCs的最佳Cur/Bio-Chi浓度考察
将MSCs接种于24孔板,37℃培养过夜。将MSCs与0.5mL浓度为0.5mg/mL的sulfo-NHS-LC-Biotin的PBS溶液室温孵育20min。同时,将0.25mL浓度为150μg/mL的亲和素的PBS溶液与0.25mL含25-100μg/mL Cur的Cur/Bio-Chi的PBS溶液避光孵育20min。将0.5mL亲和素和Cur/Bio-Chi的混合溶液与B-MSCs孵育20min。吸除介质,胰酶消化后用PBS重悬,用流式细胞仪对Cur的荧光强度进行检测。
结果表明,随Cur/Bio-Chi的浓度增加,细胞表面载药量明显增加。但考虑到细胞毒性的影响,Cur/Bio-Chi的浓度不宜过大,所以确定浓度为100μg/mL(附图7)。
实施例8:Cur/Bio-Chi-S-B-MSCs的载药量检测
将MSCs接种于24孔板,37℃培养过夜。将MSCs与0.5mL浓度为0.5mg/mL的sulfo-NHS-LC-Biotin的PBS溶液室温孵育20min。同时,将0.25mL浓度为150μg/mL的亲和素的PBS溶液与0.25mL含25-100μg/mL Cur的Cur/Bio-Chi的PBS溶液避光孵育20min。将0.5mL亲和素和Cur/Bio-Chi的混合溶液与B-MSCs孵育20min。将与B-MSCs孵育前、后的Cur/Bio-Chi溶液,分别与等量乙醇混合,涡旋混合,测定λ=431nm处的吸光度值差值。计算细胞表面载药量。
结果表明,MSCs表面载药量为54.26±4.18pg Cur/细胞。
实施例1-8结果表明,干细胞-纳米粒混合载体可以通过亲和素架桥连接Cur/Bio-Chi表面生物素和B-MSCs表面生物素的方式构建。本发明构建的一种表面结合载药纳米粒的干细胞肿瘤靶向系统,能减小对干细胞载体活性的影响,在肿瘤部位富集并持续缓慢释放药物以达到疗效,为干细胞作为肿瘤靶向药物递送载体提供一种新的途径。
以上所述仅是本发明的具体实施方式,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!