PET/MRI双模态显像剂SPIO‑NOTA‑68Ga及其制备方法与用途与流程
本发明涉及pet/mri双模态显像剂spio-nota-68ga及其制备方法与用途,属于医学领域。
背景技术:
在肿瘤的临床诊断中,正电子发射断层成像(positronemissiontomography,pet)与核磁共振成像(magneticresonanceimaging,mri)发挥着越来越重要的作用,但单一模式的pet及mri在诊断中均有一定的局限性,因此,pet/mri的融合技术已成为当前影像技术不可避免的趋势。2011年pet/mri扫描仪已进入临床,但到目前为止仍未有用于临床的双模态显像药物问世。故而设计一种有效的双模态显像药物就成为了一项重要的研究工作。本文报道了一种新的pet/mri双模态药物的合成和初步性质的研究。
超顺磁性氧化铁纳米粒子(superparamagneticironoxidenanoparticles,spion)因优良的磁学性质以及良好的生物相容性而广泛用于医学领域的研究,对其进行修饰后,可以将发射正电子的核素、多肽等靶向分子连接在其上面,达到靶向载药、mrit2wi阴性造影剂、细胞磁性分离以及纯化dna的效果。
技术实现要素:
本发明的目的在于克服上述缺陷而提供一种新型的pet/mri双模态探针,所述探针具有良好的稳定性和生物相容性,可在活体血液中循环,为pet/mri双模态显像提供了良好的基础。
为实现上述目的,本发明采取的技术方案为:一种化合物spio-nota-68ga。
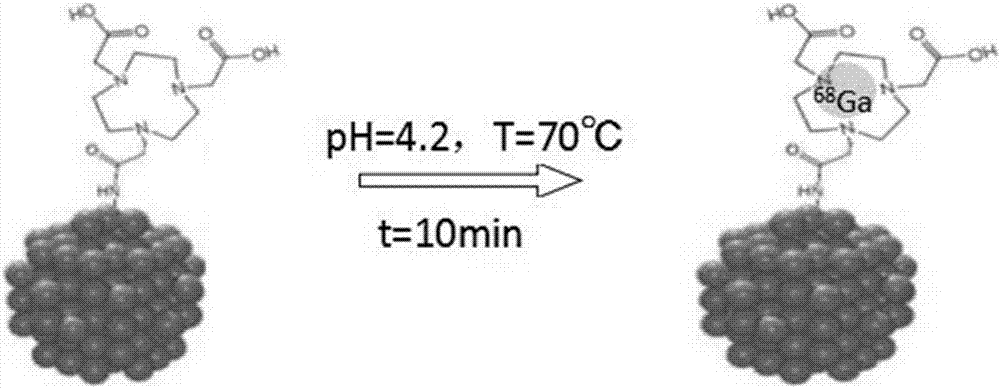
另外,本发明公开了化合物spio-nota-68ga的制备方法:采用68ga对前体spio-peg2000-nota进行放射性标记,即得化合物spio-nota-68ga。
68ga(t1/2=68min,β+=89%,ec=11%)作为优良的正电子显像核素,其可直接由68ge/68ga发生器制备,操作简便,半衰期68min,血液清楚快,病人受到的辐射较少,68ga离子半径(0.062nm)大小合适,适合nota的三氮环配体空穴,二者螯合形成的产物热力学和动力学稳定性比较高,在体内可长期保持完整,因此本申请发明人使用68ga对spio进行放射性标记,得到化合物spio-nota-68ga。
优选的,前体spio-peg2000-nota的制备方法为:使用peg2000修饰的spio将nota偶联入纳米表面,即得前体spio-peg2000-nota。
本申请发明人以spio为基础将正电子核素和mri造影剂相结合形成一种新型显像探针,其使用聚乙二醇衍生物(peg2000)修饰的spio利用表面的氨基将双功能螯合剂1,4,7-三氮环壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triaceticacid,nota)偶联入纳米表面,获得标记前体spio-peg2000-nota。
优选的,前体spio-peg2000-nota的制备方法包括以下步骤:(1)将nota-nhs溶解于去离子水中,搅拌混匀,至nota-nhs完全溶解;(2)将spio-peg2000-nh2溶于去离子水中,加入naoh调节ph至弱碱性;(3)将步骤(1)中溶解好的nota-nhs加入步骤(2)中的spio-peg2000-nh2溶液中,加热、超声,反应结束即得前体spio-peg2000-nota。
优选的,步骤(2)中加入naoh调节ph至9.0-10.0。
优选的,步骤(3)中加热温度为40℃,超声时间为5min。
优选的,前体spio-peg2000-nota的制备方法还包括步骤(4)使用超滤管提纯、离心,即获得纯前体spio-peg2000-nota。
优选的,超滤管的大小为30k,离心时间为24h。
另外,本发明公开了化合物spio-nota-68ga在肿瘤临床诊断中的用途。
优选的,spio-nota-68ga在pet/mri双模态显像中的用途。
本发明的有益效果在于:本发明所述化合物spio-nota-68ga具有很高的放化纯度、良好的体外稳定性和水溶性,有利于spio-nota-68ga在小鼠活体中的血液循环,为活体内的生物学分布提供了基础。本发明所述spio-nota-68ga的制备方法,通过在spio表面连接大环配体nota,成功合成了标记前体spio-peg2000-nota,并使用正电子放射性核素68ga对其进行了标记,此反应合成时间更短(10min),反应步骤简单,一步合成,条件温和(70℃),且标记率高达99%,无需进一步纯化即可用于下一步实验,具有转化为临床应用的潜质。
附图说明
图1为标记前体spio-peg2000-nota的合成路线;
图2为产物spio-nota-68ga的合成路线;
图3为spio-peg2000-nota纳米粒子的粒径和形貌(tem)图;
图4为spio-peg2000-nh2(a)和spio-peg2000-nota(b)的水合动力学直径分布图;
图5为spio-peg2000-nh2(a)和spio-peg2000-nota(b)的zeta电位图;
图6为spio-peg2000-nh2(a)、spio-peg2000-nota(b)的红外光谱图;
图7为spio-peg2000-nota的磁滞回线,其中横坐标为外磁场强度,纵坐标为纳米粒子磁化强度;
图8为产物spio-nota-68ga的itlc图谱;
图9为spio-nota-68ga在pbs和小牛血清(fbs)中的稳定性比较图,其中横坐标为时间,纵坐标为放射化学纯度;
图10为spio-nota-68ga在正常昆明小鼠的体内分布图(n=3),其中横坐标依次为血液、心脏、肺、肝脏、脾、肾、胃、十二指肠、胰腺、脑、肌肉、骨、皮肤;
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例及附图对本发明作进一步说明。
1.材料与方法
1.1试剂与仪器
spio-peg2000-nh2(1mg/ml,南京先丰纳米材料科技有限公司),nota-nhs(法国chematech公司),稀盐酸(12.5mol/l,德国默克公司)乙酸钠、冰乙酸等(上海百灵威化学技术有限公司),mem培养液、胎牛血清、0.25%胰蛋白酶、pbs液等(美国gibco公司),正常昆明小鼠,雄性,18~22g(南方医科大学实验动物中心)。
jem-200cx透射电镜(日本jeol公司),nanozs纳米粒度电位仪(英国malvern公司),振动样品磁强计vsm7407(美国lakeshore公司),iraffinity-1傅里叶变换红外光谱仪(日本shimadazu公司),锗-镓发生器(德国itg公司),radio-tlc(日本岛津公司),fc-3200放射检测器(美国bioscan公司),sn-695γ放射免疫计数器(上海核所日环光电仪器有限公司),df-101s集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),水浴锅(上海精宏实验设备有限公司dk-s22型);电子天平(瑞士mettlertoledo)。
1.2前体spio-peg2000-nota的合成
前体spio-peg2000-nota的合成路线示于图1。取3mgnota-nhs溶解于适量去离子水中,搅拌混匀,待nota-nhs完全溶解;取磁纳米颗粒(spio-peg2000-nh2)5mg溶于水中,加入naoh调节ph至9.0;通n2,将溶解好的nota-nhs加入调好ph的纳米颗粒中,加温40℃,超声分散5min,搅拌过夜,反应24h后反应停止;使用超滤管(30k)提纯,离心24h,获得标记前体spio-peg2000-nota。
1.3基本性质检测
1.3.1透射电镜(tem)测定:取适量spio-peg2000-nota纳米粒子进行研磨,以乙醇作分散剂,超声分散后,取部分悬浮液置于铜网,自然干燥,采用高分辨透射电子显微镜观测粒子的形态、粒径。
1.3.2动态光散射(dls)检测:取1%(ω/v)的spio-peg2000-nh2及spio-peg2000-nota水溶液加入石英比色皿中,使用633nm的he/ne激光在nanozs纳米粒度电位分析仪样品室中进行扫描测定。
1.3.3zeta电位测定:使用nanozs纳米粒度电位分析仪测量spio-peg2000-nh2及spio-peg2000-nota电位。
1.3.4磁性分析:取适量spio-peg2000-nh2及spio-peg2000-nota装入约7mm的棉签管中,两端封口于振动样品磁强计(vsm7407)样品舱中测试。
1.3.5傅里叶变换红外光谱(ft-ir)测定:取适量冻干后的spio-peg2000-nh2及spio-peg2000-nota粉末分别与kbr混合后,研磨压片,在iraffinity-1样品舱中测定。
1.4spio-nota-68ga的制备
产物spio-nota-68ga的合成路线示于图2。取200μlfe浓度为1mg/ml的spio-peg2000-nota于2ml小反应瓶中,并加入500μl0.05n稀盐酸淋洗下来的68ga(148mbq),再加入32.5μl乙酸钠(1mol/l),涡旋均匀后,在70℃条件下反应10min,完成标记。
1.5标记率的测定
标记率采用快速薄层层析法(itlc)测定。取2μl反应液点样于itlc-sg纸(10mm×150mm上),于超纯水中上行展开,空气中自然晾干。用bioscan放射性薄层扫描仪进行扫描,计算标记率(%)。
1.6稳定性评价
取100ul反应液,分别加入到500μl的小牛血清和500μl的pbs(ph=7.24,0.02mol/l)中。置于37℃的水浴箱中孵育0.5、1、1.5、2h,分别于不同时间点取约2ul样品用itlc法测定其放化纯度,重复三次,取平均值。
1.7脂水分配系数测定
分别取10μl反应液于1.5ml离心管中(含500μl正辛醇和500μlpbs),用胶膜密封,充分涡旋2min后,高速离心3min(10000rpm/min),至两相平衡。用移液枪从有机相和水相各取样10μl分置于两支γ计数管中,测量其放射性计数。按下式计算脂水分配系数(logp)。重复取样测定3次,取平均值。
logp=log(cts正辛醇/ctspbs),其中,cts正辛醇和ctspbs分别为正辛醇和pbs中的γ计数。
1.8正常小鼠体内的生物分布
分别取100μl反应液(7.4mbq),经尾静脉注射入12只昆明鼠体内,分别于注射后5min、30min、60min、120min眼球静脉取血后,断颈处死并解剖,分别取血液、心脏、肺、肝脏、脾脏、肾脏、胃、小肠、胰腺、脑、肌肉、骨骼、皮肤等器官或组织,称重,γ计数,经衰减校正后测定其每克组织的百分注射剂量率(%id/g)。
1.9结果分析与处理统计学分析应用spss13.0软件包,计量数据用均数±标准差
2.结论
2.1前体spio-peg2000-nota的合成参考jarrettbr的报道,经过设计的spio-peg2000-nh2末端含有大量氨基,其与nota-nhs酯上的羰基(碱性条件下解离出游离羧基)进行反应,如图1红线所示,得到前体spio-peg2000-nota。此反应步骤简单,条件温和,快速、高效。
2.2基本表征检测
2.2.1前体spio-peg2000-nota可溶于超纯水中,为浅棕色透明溶液。
2.2.2前体spio-peg2000-nota透射电镜(tem)图像示于图3,电镜下纳米粒径为8~12nm左右,呈球形,大小均匀,分散均一。
2.2.3dls分析结果如图4,连接nota前(a)与后(b)的dls图均显示为单峰,连接前后纳米的达尔文粒径分别约34nm和89nm,连入nota后,达尔文粒径明显增大,且分布范围较窄。
2.2.4zeta电位结果如图5,连接nota前(a)与后(b),由于纳米表面大量氨基为羧基所取代,电位形成了翻转(11.6mv~-29mv)。
2.2.5红外检测结果如图6,nota修饰后红外光谱(曲线b)1632.2cm-1处(图6b中红线)出现了新的吸收峰,考虑是由新形成酰胺键中nh-co内的n-h弯曲振动和c-n的伸缩振动相互作用而产生的。
2.2.6磁性分析结果如图7,磁滞回曲线示,随外磁场强度增大,纳米粒子磁化强度增大,外加磁强度达到一定值(2000oe)时,磁强度增速趋于缓慢,渐达磁饱和状态。spio-peg2000-nota比饱和磁化强度为56.04emu/g,具有良好的超顺磁性,提示此前体可作为mri显像剂的潜力。
2.3标记率测定
标记产物spio-nota-68ga经itlc分离后,用薄层放射性扫描仪检测,结果如图8,显示在此展开体系中,spio-nota-68ga保留在原点附近(rf为0~0.1),游离的68ga离子随溶剂移动到层析纸前沿,其rf为0.8~1.0,系统自动积分测得其标记率约为99%。
2.4稳定性评价
37℃的环境下,产物spio-nota-68ga在pbs和fbs中分别孵育0.5、1、1.5、2h后,用radio-tlc测定其放射化学纯度,结果见图9。由图知,直至120min,spio-nota-68ga无论在pbs还是fbs中均具有良好的稳定性,放化纯度均在95%以上,表明其具有良好的体外稳定性
2.5脂水分配系数
spio-nota-68ga的脂水分配系数logp=-2.60±0.13(n=3),表现为亲水性。这与其表面修饰有大量peg有关,其亲水特性可提高纳米在活体内的分布运转,延长体内循环时间。
2.6正常小鼠体内的生物学分布
spio-nota-68ga在正常昆明小鼠体内生物学分布数据见图10及表1,结果示spio-nota-68ga主要为肝脾摄取,且随时间延长,摄取增高,120min达最高。肾脏内仅见少量放射性积聚,随时间延长,放射性明显减低。探针在血液中的廓清速度很快,随时间延长,血液中的放射性明显减低。在其他脏器中均未见明显摄取。
表1spio-nota-68ga在正常昆明小鼠的体内分布结果
3.结论分析
本实验制备了水溶性极佳的标记前体spio-peg2000-nota。通过tem、dls等手段表征,表明制备的前体形貌较好,分散性好,粒径小且均一,本实验测得的spio-peg2000-nota的tem粒径为10nm左右,dls粒径达89nm,其与文献描述一致,主要由于电镜测量的为颗粒核心粒径,而纳米粒度仪测量的是水合粒径,包含了纳米外层的水溶性包膜。弛豫率测试表明所得的纳米颗粒有较高的r2弛豫率,可作为构建pet/mri双模态显像剂的良好平台。史旭东等使用64cu对spio-dopa-peg-dota/rgd进行了标记,得到了pet/mri的双模态探针,但其标记率相对较低,只有71%,需要dtpa进行进一步的纯化;madrur使用99tcm标记了spio,得到了spect/mri双模态探针用于淋巴结显像;却少有使用68ga标记spio的报道,本研究采用68ga标记spio得到spio-nota-68ga,此反应合成时间更短(10min),反应步骤简单,一步合成,条件温和(70℃),且标记率高达99%,无需进一步纯化即可用于下一步实验,具有转化为临床应用的潜质。
spio-nota-68ga在pbs与fbs中均表现了很高的放化纯度,表明其具有良好的体外稳定性,为进一步的体内生物学评价奠定了良好的基础。由于该纳探针表面修饰有peg,其表面亲水,内核亲脂,良好的水溶性和生物相容性有利于纳米在小鼠活体中的血液循环,为活体内的生物学分布提供了基础。
正常小鼠体内分布示,血液中放射性摄取在5min时最高((31.87±2.89)%id/g),随时间延长迅速下降,30min时即达((2.85±0.82)%id/g),120min即降至((1.83±0.72)%id/g)表明其在血液廓清迅速;放射性标记物主要聚集于肝脏和脾脏,且随时间延长,放射性摄取进一步升高,120min达最高,肝脏为((68.00±7.78)%id/g),脾脏为((52.24±8.32)%id/g);而其他器官的摄取相对较低,表明该标记物主要通过肝、脾代谢。这与粒径<100nm的纳米体内生物分布和代谢途径基本一致。网状内皮系统(res,包括肝脏、脾脏、肺及骨髓组织)含丰富巨噬细胞,可将特定大小的纳米作为异物吞噬,截留于肝脾等脏器中。laurents报道粒径100~200nm的颗粒很快被网状内皮系统的巨噬细胞吞噬而清除,到达kupffer氏细胞的溶酶体中;粒径50~100nm颗粒可进入肝实质,<50nm的则主要分布于脾和骨髓中,本发明中spio-nota-68ga的粒径约为89nm,因此主要被肝、脾摄取。
4.结论
通过在spio表面连接大环配体nota,成功合成了标记前体spio-peg2000-nota,并使用正电子放射性核素68ga对其进行了标记,反应时间10min,反应温度70℃,标记率可达99%。该标记物具有较高的体外稳定性且具有良好的水溶性。正常小鼠体内的生物学分布揭示了其主要通过肝脾代谢,可用于后续的pet/mri双模态显像。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质。
- 还没有人留言评论。精彩留言会获得点赞!