抗IL‑36R抗体的制作方法
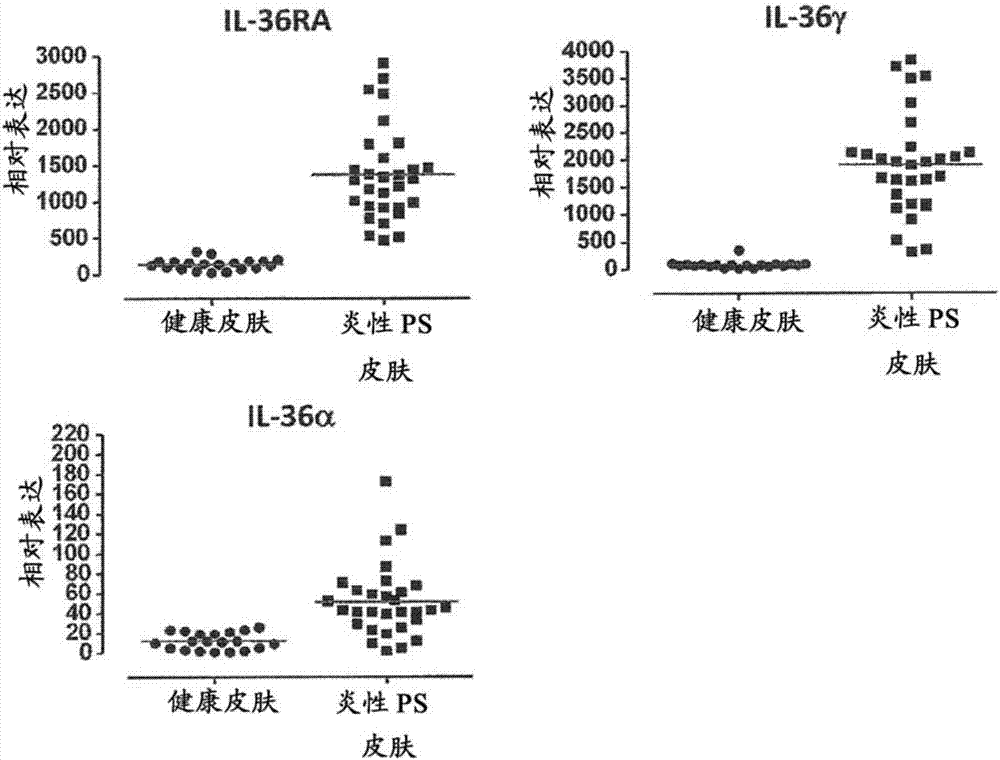
本申请是中国专利申请号201280054425.x(申请日:2012年11月14日;发明名称:抗il-36r抗体)的分案申请。序列表本申请案含有已以ascii格式经由efs-web递交的序列表且其以引用的方式整体并入本文中。该ascii拷贝在2012年11月12日创建,命名为09-0583wo.txt且大小为147,390个字节。【发明所属的
技术领域:
】一般而言,本发明是关于用于诊断及治疗用途的抗il-36r抗体。该等抗体可用于包含该等化合物的医药组合物及套组中。该等抗体可用于治疗人类中的各种疾病或病症(例如免疫学疾病、发炎性疾病、自体免疫疾病、纤维变性疾病及呼吸疾病)的方法。
背景技术:
:细胞因子的il-1家族是由11个不同配体组成,即il-1α(亦称为il-1f1)、il-1β(il-1f2)、il-1受体拮抗剂(il-1ra或il-1f3)、il-18(il-1f4)、il-1f5至il-1f10及il-1f11(或il-33)。已知il-1α及il-1β诱导与i型il-1受体(il-1ri)结合的促发炎活性及常见共受体il-1受体辅助蛋白(il-1racp)的募集,而il-1ra作为与il-1ri结合的il-1的竞争性抑制剂起作用,从而发挥抗发炎活性。大量研究报导il-18是为ifn-γ的诱导物的促发炎细胞因子,而il-33是阐述为参与(具体而言)th2反应的控制的免疫调节细胞因子。藉助在dna数据库中搜索il-1的同系物来识别-1家族的新成员(包括il-1f5、il-1f6、il-1f8及il-1f9)。在人类及小鼠中,所有编码该等细胞因子的基因映像至小于300kb的染色体2q,其中其由il1a、il1b及il1rn基因侧接。il-1f6、il-1f8及il-1f9与il-1及il-1ra共享21%至37%氨基酸序列同源性,而il-1f5与il-1ra展示52%氨基酸序列同源性,此表明il-1f5可代表内源性受体拮抗剂。il-1f6、il-1f8及il-1f9与il-1rrp2(il-1r家族的受体)结合,且使用il-1racp作为共受体来刺激与那些由il-1诱导的信号类似的细胞内信号,而显示il-1f5抑制过表达il-1rrp2的jurkatt细胞中il-1f9诱导的nf-κb活化。如il-1β一般,所有该等il-1同系物缺少前导肽且不能藉助常规分泌途径来释放,但研究表明il-1rrp2激动剂的释放可藉由与那些调节il-1β分泌的机制不同的机制来控制。为认可该等细胞因子的具体生物学效应并确认其全部与同一受体结合,最近已提出修正il-1同系物的命名法。因此,il-1rrp2现称为il-36r,且其配体命名为il-36α(il-1f6)、il-36β(il-1f8)及il-36γ(il-1f9)。另外,已显示发挥受体拮抗剂活性的il-1f5已重命名为il-36ra。il-36α、il-36β及il-36γ的信使rna在若干组织中、具体而言在暴露于病原体及皮肤中的内部上皮组织中大量表达。令人感兴趣的,il-36ra及il-36α的表达在il-1β/tnf-α刺激的人类角化细胞中显著上调,且il-36ra及il-36γmrna在牛皮癣损伤皮肤中极大增加。此外,在tnf-α及ifn-γ刺激后,人类角化细胞中的il-36γ蛋白质产生提高。在慢性肾病中亦报导升高的il-36αmrna及蛋白质表达。在角化细胞中过表达il-36α的转基因小鼠呈现与牛皮癣共有一些特征的发炎性皮肤损伤。当转基因小鼠与缺乏il-36ra的小鼠杂交时,此表现型更严重,此支持il-36ra在活体内的调节功能。若利用12-o-十四酰基佛波醇13-乙酸酯治疗角化细胞特异性il-36α转基因小鼠,则该等小鼠中的发炎皮肤病状与人类牛皮癣甚至更类似,其在组织学上、分子上及在其对治疗法的反应上与人类疾病类似。此外,当利用抗il-36r抗体治疗免疫缺陷型小鼠时,移植至该小鼠的人类牛皮癣损伤皮肤正常化,此证明需要il-36轴来维持人类牛皮癣皮肤中的损伤表现型。该等数据合起来指示il-36r配体(包括il-36α、il-36β及il-36γ)在活体外及活体内发挥促发炎效应且il-36ra作为天然拮抗剂起作用,由此模拟il-1/il-1ra系统。因此,有证据证明许多疾病病状中涉及il-36r配体,且业内需要靶向此途径、具体而言用于治疗发炎性疾病的新治疗剂。技术实现要素:本发明藉由提供与il-36r结合的生物治疗药物、具体而言抗体来解决上文需要。在一方面中,本发明抗体阻断il36配体介导的信号传导(α、β及/或γ)。在一方面中,本发明抗体可用于(例如)治疗诸如牛皮癣、发炎性肠疾病、硬皮病、copd及慢性肾病等疾病中上皮介导的发炎/纤维变性。在一方面中,本发明提供抗具有一或多种以下性质的il-36r抗体。在一方面中,本发明的抗il-36r抗体具有较高分子/细胞结合效能。在一方面中,本发明的抗il-36r抗体以kd<0.1nm与人类il-36r结合。在又一方面中,本发明的抗il-36r抗体、具体而言人类化抗il-36r抗体以kd<50pm与人类il-36r结合。在一方面中,本发明的抗il-36r抗体以ec90<5nm与il-36r表达细胞结合。在另一方面中,本发明的抗il-36r抗体具有较高的基于细胞的功能阻断效能。在一方面中,本发明的抗il-36r抗体在疾病相关细胞以及原代细胞中以ic90<5nm阻断所有三种il-36r激动配体(α、β、γ)。在一方面中,本发明的抗il-36r抗体具有上文所述的分子/细胞结合效能及基于细胞的功能阻断效能。在又一方面中,本发明的抗il-36r抗体对人类il-1r1或il-36r阴性细胞是具有高选择性、例如大于1000倍的选择性。在又一方面中,本发明的抗il-36r抗体不与人类il-1r1或il-36r阴性细胞是结合。在实施方案一中,本发明提供抗il-36r抗体或其抗原结合片段,其以等于或<0.1nm的kd与人类il-36r结合。在实施方案二中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或抗原结合片段是单克隆抗体或其抗原结合片段。在实施方案三中,本发明提供根据实施方案一或二的抗il-36r抗体或其抗原结合片段,其中该抗体或抗原结合片段是人类化的抗体或其抗原结合片段。在实施方案四中,本发明提供根据实施方案三的抗il-36r抗体或其抗原结合片段,其以等于或<50pm的kd与人类il-36r结合。在实施方案五中,本发明提供根据实施方案一至实施方案四中任一者的抗il-36r抗体或其抗原结合片段,其不与人类il-1r1结合。在实施方案六中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:35、102、103、104、105、106或140(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案七中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:102(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案八中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:103(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案九中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:104(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案十中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:105(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案十一中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:106(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案十二中,本发明提供根据实施方案六的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:140(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案十三中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含seqidno:76、77、78、79、80、81、82或83中的任一者的氨基酸序列的轻链可变区;及包含seqidno:87、88、89、90、91、92、93、94或95中的任一者的氨基酸序列的重链可变区。在实施方案十四中,本发明提供根据实施方案十三的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:87的重链可变区;或包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:88的重链可变区;或包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:89的重链可变区。在实施方案十五中,本发明提供抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:87的重链可变区;或包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:88的重链可变区;或包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:89的重链可变区。在实施方案十六中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:63或64(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。在实施方案十七中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含seqidno:84、85或86中的任一者的氨基酸序列的轻链可变区;及包含seqidno:96、97、98、99、100或101中的任一者的氨基酸序列的重链可变区。在实施方案十八中,本发明提供根据实施方案十七的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:85的轻链可变区;及包含氨基酸序列seqidno:100的重链可变区;或包含氨基酸序列seqidno:85的轻链可变区;及包含氨基酸序列seqidno:101的重链可变区。在实施方案十九中,本发明提供根据实施方案十七的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:86的轻链可变区;及包含氨基酸序列seqidno:100的重链可变区;或包含氨基酸序列seqidno:86的轻链可变区;及包含氨基酸序列seqidno:101的重链可变区。在实施方案二十中,本发明提供抗il-36r抗体,其中该抗体包含:包含seqidno:114、115、116、117、118、119、120或121中任一者的氨基酸序列的轻链;及包含seqidno:125、126、127、128、129、130、131、132或133中的任一者的氨基酸序列的重链。在实施方案二十一中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:125的重链。在实施方案二十二中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:126的重链。在实施方案二十三中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:127的重链。在实施方案二十四中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:125的重链。在实施方案二十五中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:126的重链。在实施方案二十六中,本发明提供根据实施方案二十的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:127的重链。在实施方案二十七中,本发明提供抗il-36r抗体,其中该抗体包含:包含seqidno:122、123或124中的任一者的氨基酸序列的轻链;及包含seqidno:134、135、136、137、138或139中的任一者的氨基酸序列的重链。在实施方案二十八中,本发明提供根据实施方案二十七的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:138的重链。在实施方案二十九中,本发明提供根据实施方案二十七的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:139的重链。在实施方案三十中,本发明提供根据二十七的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:124的轻链;及包含氨基酸序列seqidno:138的重链。在实施方案三十一中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:103(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案三十二中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:104(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。在实施方案三十三中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。在实施方案三十四中,本发明提供根据实施方案一的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。在一实施方案中,根据实施方案一至三十四中的任一者的抗体或其抗原结合片段是单克隆抗体。在一实施方案中,根据实施方案一至三十四中的任一者的抗体或其抗原结合片段是人类化的抗体。在一实施方案中,根据实施方案一至三十四中的任一者的抗体或其抗原结合片段是单克隆人源化抗体。在实施方案三十五中,本发明提供抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:轻链可变区,其包含氨基酸序列seqidno:21(l-cdr1);氨基酸序列seqidno:30(l-cdr2);氨基酸序列seqidno:39(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:48(h-cdr1);氨基酸序列seqidno:57(h-cdr2);氨基酸序列seqidno:67(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:22(l-cdr1);氨基酸序列seqidno:31(l-cdr2);氨基酸序列seqidno:40(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:49(h-cdr1);氨基酸序列seqidno:58(h-cdr2);氨基酸序列seqidno:68(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:23(l-cdr1);氨基酸序列seqidno:32(l-cdr2);氨基酸序列seqidno:41(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:50(h-cdr1);氨基酸序列seqidno:59(h-cdr2);氨基酸序列seqidno:69(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:24(l-cdr1);氨基酸序列seqidno:33(l-cdr2);氨基酸序列seqidno:42(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:51(h-cdr1);氨基酸序列seqidno:60(h-cdr2);氨基酸序列seqidno:70(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:25(l-cdr1);氨基酸序列seqidno:34(l-cdr2);氨基酸序列seqidno:43(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:52(h-cdr1);氨基酸序列seqidno:61(h-cdr2);氨基酸序列seqidno:71(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:35(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:28(l-cdr1);氨基酸序列seqidno:37(l-cdr2);氨基酸序列seqidno:46(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:55(h-cdr1);氨基酸序列seqidno:65(h-cdr2);氨基酸序列seqidno:74(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:29(l-cdr1);氨基酸序列seqidno:38(l-cdr2);氨基酸序列seqidno:47(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:56(h-cdr1);氨基酸序列seqidno:66(h-cdr2);氨基酸序列seqidno:75(h-cdr3)。在实施方案三十六中,本发明提供抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:1的轻链可变区;及包含氨基酸序列seqidno:11的重链可变区;或包含氨基酸序列seqidno:2的轻链可变区;及包含氨基酸序列seqidno:12的重链可变区;或包含氨基酸序列seqidno:3的轻链可变区;及包含氨基酸序列seqidno:13的重链可变区;或包含氨基酸序列seqidno:4的轻链可变区;及包含氨基酸序列seqidno:14的重链可变区;或包含氨基酸序列seqidno:5的轻链可变区;及包含氨基酸序列seqidno:15;的重链可变区或包含氨基酸序列seqidno:6的轻链可变区;及包含氨基酸序列seqidno:16的重链可变区;或包含氨基酸序列seqidno:7的轻链可变区;及包含氨基酸序列seqidno:17的重链可变区;或包含氨基酸序列seqidno:8的轻链可变区;及包含氨基酸序列seqidno:18的重链可变区;或包含氨基酸序列seqidno:9的轻链可变区;及包含氨基酸序列seqidno:19的重链可变区;或包含氨基酸序列seqidno:10的轻链可变区;及包含氨基酸序列seqidno:20的重链可变区。在又一实施方案三十七中,本发明提供医药组合物,其包含根据先前实施方案中的任一者的抗体或抗原结合片段及医药上可接受的载剂。在又一实施方案三十八中,本发明提供根据先前实施方案中的任一者的抗体或抗原结合片段或医药组合物,其用于医学中。在又一实施方案三十九中,本发明提供根据实施方案1至37中任一者的抗体或抗原结合片段或医药组合物,其中该用途是治疗发炎性疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性或癌症。在又一实施方案四十中,本发明提供根据实施方案1至37中任一者的抗体或抗原结合片段或医药组合物,其中该用途是用于治疗牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘或关节粘连性脊椎炎。在又一实施方案四十一中,本发明提供根据实施方案1至37中任一者的抗体或抗原结合片段或医药组合物,其中该用途是用于治疗发炎性肠疾病。在再一实施方案四十二中,本发明提供根据实施方案41的抗体或抗原结合片段或医药组合物,其中该疾病是克隆氏病(crohnsdisease)。在另一实施方案四十三中,本发明提供治疗疾病的方法,该方法包含向有需要的患者投与根据实施方案1至37中任一者的抗体或抗原结合片段或医药组合物,其中该疾病是选自发炎性疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性及癌症。在另一实施方案四十四中,本发明提供根据实施方案43的方法,其中该疾病是选自牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘及关节粘连性脊椎炎。在再一实施方案四十五中,本发明提供治疗克隆氏病的方法。本发明的其它实施方案涵盖:-分离多核苷酸,其包含编码本发明的抗il-36r抗体或抗原结合片段的序列,较佳dna或rna序列;-本发明的分离多核苷酸,其编码藉由seqidno.1至140中的一或多者定义的序列;-载体,其包含本发明的多核苷酸,较佳为表达载体,更佳为包含本发明多核苷酸与表达控制序列功能联结的载体;-宿主细胞,其包含本发明多核苷酸及/或本发明载体;-产生本发明的抗il-36r抗体或抗原结合片段的方法,较佳重组产生方法,其包含使用本发明多核苷酸及/或本发明载体及/或本发明宿主细胞;-此一方法较佳包含以下步骤:(a)在允许抗il-36r抗体或抗原结合片段表达的条件下培养宿主细胞及(b)回收抗il-36r抗体或抗原结合片段;-诊断套组或诊断方法,其包含本发明的抗il-36r抗体或抗原结合片段或其使用;-本发明的诊断套组或诊断方法,其用于诊断发炎性疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性、癌症、牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘、关节粘连性脊椎炎或克隆氏病。【附图简述】图1:il-36拮抗配体(il-36ra/il1f5、il-38/ilf10)抑制信号传导级联。图2:基因芯片分析表明il-36r配体在牛皮癣皮肤中上调(il-36ra、il-36α及il-36γ)。图3:使用人类皮肤切片的表现剖面。经福尔马林(formalin)固定,石蜡包埋且使用抗体33d10进行抗体滴定。图4:评估人类皮肤切片的表皮厚度的方法。【实施方式】本发明是关于抗il-36r抗体。在一方面中,本发明抗体在(例如)人类中是用于诊断及治疗用途。本发明提供与il-36r、具体而言人类il-36r结合的抗体。本发明亦是关于结合il-36r的人源化抗体。在具体实施方案中,已基于某些主要小鼠抗体的序列确定该等人源化抗体的序列。不希望受此理论限制,认为抗il-36r抗体或其抗原结合片段与人类il-36r结合且从而干扰il-36激动剂的结合,且这样做时至少部分地阻断自il-36r至发炎媒介物的信号传导级联。此藉由图1来图解说明。在一方面中,本发明抗体是用于人类疾病模型。il-36r亦称为il-1rl2及il-1rrp2。已报导,il-36激动配体(α、β或γ)藉由接合il-36受体、然后与il-1受体辅助蛋白(il-1racp)形成异源二聚体来起始信号传导级联。il-36拮抗配体(il-36ra/il1f5、il-38/ilf10)抑制信号传导级联(参见图1)。在一方面中,本发明提供抗具有一或多种以下性质的il-36r抗体。在一方面中,本发明的抗il-36r抗体具有较高分子/细胞结合效能。在一方面中,本发明的抗il-36r抗体以kd<0.1nm与人类il-36r结合。在又一方面中,本发明的抗il-36r抗体、具体而言人类化抗il-36r抗体以kd<50pm与人类il-36r结合。在一方面中,本发明的抗il-36r抗体以ec90<5nm与il-36r表达细胞结合。在另一方面中,本发明的抗il-36r抗体具有较高的基于细胞的功能阻断效能。在一方面中,本发明的抗il-36r抗体在疾病相关细胞以及原代细胞中以ic90≤5nm阻断所有三种il-36r激动配体(α、β、γ)。在一方面中,本发明的抗il-36r抗体具有上文所述的分子/细胞结合效能及基于细胞的功能阻断效能。在一方面中,本发明的抗il-36r抗体是人源化抗体。在一方面中,本发明的抗il-36r抗体是单克隆抗体。在一方面中,本发明的抗il-36r抗体是全长抗体。在一方面中,本发明的抗il-36r抗体是人类化单克隆抗体,例如全长人类化单克隆抗体。本发明的抗体或其抗原结合片段识别特异性“il-36r抗原表位”或“il-36r表位”。如本文所用,该等术语是指能够与抗il-36r抗体产生免疫反应性的分子(例如,肽)或分子片段。最常见表位是蛋白质、短寡肽、寡肽模拟物(即,模拟il-36r抗原的抗体结合性质的有机化合物)或其组合。认为抗体的肽或多肽表位的最小尺寸是约4个至5个氨基酸。肽或多肽表位含有(例如)至少7个氨基酸或(例如)至少9个氨基酸或(例如)介于约15个至约20个之间的氨基酸。由于抗体可识别呈三级形式的抗原肽或多肽,故包含表位的氨基酸不需为邻接的,且在一些情形下,可甚至不在同一肽链上。表位可藉由业内已知的各种技术来测定,例如x射线结晶学、氢/氘交换质谱法(hxms)、定点诱变、丙胺酸扫描诱变及肽筛选法。抗体或免疫球蛋白的一般化结构为本领域技术人员所熟知。该等分子是通常为约150,000道耳顿(dalton)的异源四聚体糖蛋白,其由两个相同轻(l)链及两个相同重(h)链组成且通常称为全长抗体。每一轻链是藉由一个二硫键与重链共价连接而形成异源二聚体,且异源四聚体分子是藉助异源二聚体中两个相同重链之间的共价二硫键来形成。尽管轻链及重链是藉由一个二硫键连接在一起,但两个重链间的二硫键数可随免疫球蛋白同型而变。每一重链及轻链亦具有规则间隔的链内二硫键。每一重链在胺基末端具有可变结构域(vh),的后是三个或四个恒定结构域(ch1、ch2、ch3及ch4),以及ch1与ch2之间的铰链区。每一轻链具有两个结构域,即胺基末端可变结构域(vl)及羧基末端恒定结构域(cl)。vl结构域与vh结构域非共价结合,而cl结构域通常经由二硫键与ch1结构域共价连接。据信,特定氨基酸残基在轻链可变结构域与重链可变结构域的间形成接口(chothia等人,1985,j.mol.biol.186:651-663)。可变结构域在本文中亦称为可变区。在不同抗体间,可变结构域内的某些结构域广泛不同,即具有“超变性”。该等超变结构域含有直接参与每一特定抗体与其特异性抗原决定簇的结合及特异性的残基。轻链可变结构域与重链可变结构域二者中的超变性均集中于三个称为互补决定区(cdr)或超变环(hvl)的区段中。cdr是藉由以下文献中的序列比较来定义:kabat等人,1991,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.,而hvl(在本文中亦称为cdr)是根据可变结构域的三维结构在结构上定义,如chothia及lesk,1987,j.mol.biol.196:901-917中所述。其中该两种方法识别的cdr略有不同。如由kabat所定义,在轻链可变结构域中,cdr-l1大致位于残基24-34处,cdr-l2大致位于残基50-56处,且cdr-l3大致位于残基89-97处;在重链可变结构域中,cdr-h1大致位于残基31-35处,cdr-h2大致位于残基50-65处,且cdr-h3大致位于残基95-102处。涵盖特定cdr的确切残基数将视cdr的序列及尺寸而变。给定抗体的可变区氨基酸序列,本领域技术人员可以常规方式确定哪些残基包含特定cdr。重链及轻链的cdr1、cdr2、cdr3由此界定对于给定抗体具有特异性的独特功能性质。每一重链及轻链内的三个cdr是由框架区(fr)来间隔,框架区含有可变性往往较低的序列。自重链及轻链可变结构域的胺基末端至羧基末端,fr及cdr是以以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3及fr4。fr的较大β-折迭构型使每一链内的cdr彼此紧邻且与另一链中的cdr紧邻。所得构象有助于抗原结合位点(参见kabat等人,1991,nihpubl.第91-3242号,第i卷,第647页-第669页),但并非所有cdr残基均必须直接参与抗原结合。fr残基及ig恒定结构域并不直接参与抗原结合,但有助于抗原结合及/或介导抗体效应子功能。人们认为,一些fr残基以至少三种方式对抗原结合产生显著效应:直接与表位非共价结合,与一或多个cdr残基相互作用,及影响重链与轻链之间的接口。恒定结构域并不直接参与抗原结合,但介导各种ig效应子功能,例如介导抗体参与抗体依赖性细胞毒性(adcc)、补体依赖性细胞毒性(cdc)及抗体依赖性细胞吞噬作用(adcp)。可基于恒定结构域的氨基酸序列将脊椎动物免疫球蛋白的轻链分配至两个显著不同的类别(卡帕(κ)及兰布达(λ))中的一类中。藉由比较,根据恒定结构域的序列将哺乳动物免疫球蛋白的重链分配至五个主要类别中的一类中:iga、igd、ige、igg及igm。将igg及iga进一步分为亚类(同型),例如igg1、igg2、igg3、igg4、iga1及iga2。与免疫球蛋白的不同类别相对应的重链恒定结构域分别称为α、β、ε、γ及μ。各天然免疫球蛋白类别的亚单元结构及三维构型为人所熟知。术语“抗体”、“抗il-36r抗体”、“人类化抗il-36r抗体”、“人类化抗il-36r表位抗体”及“变体人类化抗il-36r表位抗体”具体涵盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)及抗体片段,例如抗体中呈现期望生物学活性(例如,il-36r结合)的可变结构域及其它部分。术语“单克隆抗体”(mab)是指具有高度特异性且针对单一抗原决定簇(“表位”)的抗体。因此,修饰词“单克隆”指示针对相同表位的抗体,且不应理解为需要藉由任何特定方法来产生该抗体。应理解,单克隆抗体可藉由业内已知的任何技术或方法来制备;包括(例如)融合瘤方法(kohler等人,1975,nature256:495),或业内已知的重组dna方法(例如,参见美国专利第4,816,567号),或使用噬菌体抗体文库并使用以下文献中所述技术分离以重组方式产生的单克隆抗体的方法:clackson等人,1991,nature352:624-628;及marks等人,1991,j.mol.biol.222:581-597。术语“单体”是指抗体的均质形式。例如,对于全长抗体而言,单体意指具有两个相同重链及两个相同轻链的单体抗体。嵌合抗体是由来自一物种(例如,非人类哺乳动物,例如小鼠)的抗体的重链及轻链可变区及另一物种(例如,人类)抗体的重链及轻链恒定区组成,且可藉由以下方式来获得:连接来自第一物种(例如,小鼠)的编码抗体可变区的dna序列与来自第二物种(例如人类)的编码抗体恒定区的dna序列,并用含有该等经连接序列的表达载体转化宿主,从而使其产生嵌合抗体。或者,嵌合抗体亦可是其中重链及/或轻链中的一或多个区域或结构域与来自另一免疫球蛋白类别或同型的单克隆抗体中的对应序列相同、同源或是其变体,或来自共有序列或种是序列者。嵌合抗体可包括该等抗体的片段,限制条件是抗体片段呈现其亲代抗体的期望生物学活性,例如与相同表位结合(例如,参见美国专利第4,816,567号;及morrison等人,1984,proc.natl.acad.sci.usa81:6851-6855)。术语“抗体片段”、“抗il-36r抗体片段”、“抗il-36r表位抗体片段”、“人类化抗il-36r抗体片段”、“人类化抗il-36r表位抗体片段”、“变体人类化抗il-36r表位抗体片段”是指全长抗il-36r抗体的一部分,其中保留可变区或功能能力,例如,特异性il-36r表位结合。抗体片段的实例包括(但不限于)fab、fab'、f(ab')2、fd、fv、scfv及scfv-fc片段、双链抗体、线性抗体、单链抗体、微小抗体、自抗体片段形成的双链抗体及自抗体片段形成的多特异性抗体。可用诸如木瓜酶或胃蛋白酶等酶处理全长抗体以生成可用抗体片段。使用木瓜酶消化来产生两个相同的称作“fab”片段的抗原结合抗体片段(各自具有单一抗原结合位点)及残留“fc”片段。fab片段亦含有轻链的恒定结构域及重链的ch1结构域。胃蛋白酶处理产生f(ab')2片段,其具有两个抗原结合位点且仍能交联抗原。fab'片段与fab片段的不同的处在于在ch1结构域的c末端存在额外残基,包括一或多个来自抗体铰链区的半胱胺酸。f(ab')2抗体片段是藉由铰链区中的半胱胺酸残基连接的fab'片段对。亦已知抗体片段的其它化学偶合。“fv”片段含有完整抗原识别及结合位点,该位点是由一个重链可变结构域与一个轻链可变结构域呈紧密非共价连接的二聚体组成。在此构型中,每一可变结构域的三个cdr相互作用,从而在该vh-vl二聚体的表面上界定抗原结合位点。该六个cdr共同赋予该抗体抗原结合特异性。“单链fv”或“scfv”抗体片段是包含抗体的vh及vl结构域的单链fv变体,其中该等结构域存于单一多肽链中。单链fv能识别并结合抗原。scfv多肽视情况亦可含有位于vh结构域与vl结构域之间的多肽连接体,以促进scfv形成用于抗原结合的期望三维结构(例如,参见pluckthun,1994,inthepharmacologyofmonoclonalantibodies,第113卷,rosenburg及moore编辑,springer-verlag,newyork,第269页-第315页)。“双链抗体”是指具有两个抗原结合位点的小抗体片段,该等片段包含在同一多肽链(vh-vl或vl-vh)中连接至轻链可变结构域(vl)的重链可变结构域(vh)。双链抗体是更充分地阐述于(例如)holliger等人(1993)proc.natl.acad.sci.usa90:6444-6448中。其它已识别抗体片段包括那些包含串联fd区段(vh-ch1-vh-ch1)对以形成抗原结合区对者。该等“线性抗体”可具有双特异性或单特异性,如于(例如)zapata等人,1995,proteineng.8(10):1057-1062中所阐述。“人源化抗体”或“人源化抗体片段”是特定类型的嵌合抗体,其包括免疫球蛋白氨基酸序列变体或其片段,其能与预定抗原结合,且其包含一或多个实质上具有人类免疫球蛋白氨基酸序列的fr及一或多个实质上具有非人类免疫球蛋白氨基酸序列的cdr。此常称作“导入”序列的非人类氨基酸序列通常取自“导入”抗体结构域,具体而言可变结构域。通常,人源化抗体至少包括非人类抗体的cdr或hvl,其插入人类重链或轻链可变结构域的fr的间。本发明阐述具体人类化抗il-36r抗体,其含有源自小鼠单克隆抗体的cdr或人类化cdr,该等cdr插入人类种是序列重链及轻链可变结构域的fr的间。应理解,某些小鼠fr残基可对人源化抗体的功能具有重要意义,且因此修饰某些人类种是序列重链及轻链可变结构域残基以使其与对应小鼠序列中的那些相同。在另一方面中,人类化抗il-36r抗体包含实质上所有的至少一个(且通常两个)可变结构域(例如含于(例如)fab、fab'、f(ab')2、fabc及fv片段中者),其中所有或实质上所有cdr均与非人类免疫球蛋白中的那些相对应,且在本文中具体而言,所有cdr均是下文中所详述的小鼠或人类化序列,且所有或实质上所有fr均是人类免疫球蛋白共有序列或种是序列中的那些。在另一方面中,人类化抗il-36r抗体亦包括免疫球蛋白fc区的至少一部分,通常是人类免疫球蛋白中者。通常,抗体可含有轻链以及至少重链的可变结构域二者。若适宜,抗体亦可包括重链的ch1、铰链、ch2、ch3及/或ch4区中的一或多者。人类化抗il-36r抗体可选自任一免疫球蛋白类别(包括igm、igg、igd、iga及ige)及任一同型(包括igg1、igg2、igg3、igg4、iga1及iga2)。例如,恒定结构域可是补体固定的恒定结构域,其中期望人源化抗体呈现细胞毒性活性,且同型通常是igg1。若不期望该细胞毒性活性,则恒定结构域可为另一同型,例如igg2。替代性人类化抗il-36r抗体可包含来自不止一个免疫球蛋白类别或同型的序列,且本领域技术人员可选择特定恒定结构域来优化期望效应子功能。在具体实施方案中,本发明所提供抗体是igg1抗体,且更具体而言是剔除效应子功能的igg1抗体。人类化抗il-36r抗体的fr及cdr或hvl不需要与亲代序列精确对应。例如,可藉由取代、插入或缺失来改变(例如,诱变处理)导入cdr或hvl或共有或种是fr序列中的一或多个残基,从而使得所得氨基酸残基不再与任一亲代序列中对应位置的原始残基相同,但抗体仍保留与il-36r结合的功能。该改变通常可并非广泛改变且可是保守改变。通常,至少75%的人源化抗体残基可与亲代共有或种是fr及导入cdr序列中的那些残基相对应,更通常有至少90%、且最通常有超过95%或超过98%或超过99%的残基相对应。影响重链与轻链可变区之间的接口(“vl-vh接口”)的免疫球蛋白残基是那些影响两条链相对于彼此的接近或定向者。某些可能参与链间相互作用的残基包括vl残基34、36、38、44、46、87、89、91、96及98以及vh残基35、37、39、45、47、91、93、95、100及103(采用kabat等人,sequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.,1987)中所述的编号系统)。美国专利第6,407,213号亦论述,诸如vl残基43及85以及vh残基43及60等残基亦可能参与此相互作用。尽管仅针对人类igg阐述该等残基,但其亦适用于其它物种。选择合理地预期参与链间相互作用的重要抗体残基用于共有序列中的取代。术语“共有序列”及“共有抗体”是指在任一特定类别、同型或亚单元结构的所有免疫球蛋白(例如人类免疫球蛋白可变结构域)中的每一位置处包含最常出现的氨基酸残基的氨基酸序列。共有序列可是基于特定物种或多个物种的免疫球蛋白。“共有”序列、结构或抗体可理解为涵盖某些实施方案中所述的共有人类序列,且是指在任一特定类别、同型或亚单元结构的所有人类免疫球蛋白中的每一位置处包含最常出现的氨基酸残基的氨基酸序列。因此,共有序列含有在每一位置处具有存于一或多种已知免疫球蛋白中的氨基酸的氨基酸序列,但其可能并不完全复制任一单一免疫球蛋白的整个氨基酸序列。可变区共有序列并非自任一天然产生的抗体或免疫球蛋白获得。kabat等人,1991,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.及其变化形式。人类种是序列天然存于人类种群中。该等种是基因的组合产生抗体多样性。抗体轻链的种是抗体序列来自保守人类种是κ或λv-基因及j-基因。类似地,重链序列来自种是v-、d-及j-基因(lefranc,m-p及lefranc,g,“theimmunoglobulinfactsbook”academicpress,2001)。如本文所用,“变体”、“抗il-36r变体”、“人类化抗il-36r变体”或“变体人类化抗il-36r”各自是指至少具有轻链可变鼠类cdr的人类化抗il-36r抗体。变体包括那些在轻链或重链可变结构域的一或两者中具有一或多处氨基酸变化者,限制条件是该等氨基酸变化不会实质上损害抗体与il-36r的结合。“经分离”抗体是已经识别且已自其天然环境的组份中分离及/或回收的抗体。抗体天然环境中的污染物组份是那些可干扰抗体的诊断或治疗用途的材料,且可是酶、激素或其它蛋白质性或非蛋白质性溶质。在一方面中,可将抗体纯化至以抗体重量计至少大于95%的分离度。由于抗体天然环境中的至少一种组份不会存在,故分离抗体包括产生其的重组细胞内的原位抗体。然而,分离抗体通常可藉由至少一个纯化步骤来制备,其中移除重组细胞材料。术语“抗体性能”是指有助于抗体识别抗原或抗体的活体内效力的因素。抗体的氨基酸序列的变化可影响诸如折迭等抗体性质,且可影响诸如以下等物理因素:抗体与抗原结合的初始速率(ka)、抗体与抗原的解离常数(kd)、抗体对抗原的亲和常数(kd)、抗体构象、蛋白质稳定性及抗体半衰期。本文所用术语“经表位标记”是指抗il-36r抗体与“表位标签”融合。“表位标签”是具有足量氨基酸以为抗体产生提供表位的多肽,且其经设计以使得其不干扰人类化抗il-36r抗体的期望活性。表位标签通常具有充分独特性以使得针对该表位标签产生的抗体实质上不会与其它表位发生交叉反应。适宜标签多肽通常含有至少6个氨基酸残基且通常含有约8个至50个氨基酸残基或约9个至30个残基。表位卷标及结合表位的抗体的实例包括流感ha卷标多肽及其抗体12ca5(field等人,1988mol.cell.biol.8:2159-2165);c-myc标签及其8f9、3c7、6e10、g4、b7及9e10抗体(evan等人,1985,mol.cell.biol.5(12):3610-3616);及疱疹单纯型病毒糖蛋白d(gd)标签及其抗体(paborsky等人,1990,proteinengineering3(6):547-553)。在某些实施方案中,表位标签是“补救受体结合表位”。本文所用术语“补救受体结合表位”是指igg分子(例如igg1、igg2、igg3或igg4)的fc区中的表位,其负责延长igg分子的活体内血清半衰期。在一些实施方案中,本发明抗体可与细胞毒性剂偶联。此是抑制或防止细胞功能及/或引起细胞破坏的任何物质。该术语意欲包括放射性同位素(例如i131、i125、y90及re186)、化学治疗剂及毒素(例如细菌、真菌、植物或动物源的酶促活性毒素)及其片段。该等细胞毒性剂可使用标准程序与本发明的人源化抗体偶合,且可用于(例如)治疗适用抗体疗法的患者。“化学治疗剂”是可用于治疗癌症的化学化合物。化学治疗剂有多种实例可与本发明的治疗性抗体偶联。该等化学治疗剂的实例包括烷基化剂,例如噻替哌(thiotepa)及环磷酰胺;磺酸烷基酯,例如白消安(busulfan)、英丙舒凡(improsulfan)及哌泊舒凡(piposulfan);氮杂环丙烷,例如苯并多巴(benzodopa)、卡波醌(carboquone)、美妥替哌(meturedepa)及乌瑞替哌(uredepa);伸乙亚胺及甲基密胺,包括六甲密胺(altretamine)、三伸乙基密胺、三伸乙基磷酰胺、三伸乙基硫代磷酰胺及三羟甲基密胺;番荔枝内酯(acetogenin)(尤其是布拉它辛(bullatacin)及布拉它辛酮(bullatacinone));喜树碱(camptothecin)(包括合成类似物托泊替康(topotecan));苔藓虫素(bryostatin);卡利抑制素(callystatin);cc-1065(包括其合成类似物阿多来新(adozelesin)、卡泽来新(carzelesin)及比泽来新(bizelesin));克利特非辛(cryptophycin)(尤其是克利特非辛1及克利特非辛8);尾海兔素(dolastatin);奥里斯他汀(auristatin)(包括类似物单甲基-奥里斯他汀e及单甲基-奥里斯他汀f);多卡米星(duocarmycin)(包括合成类似物kw-2189及cbi-tmi);艾榴塞洛素(eleutherobin);水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥(nitrogenmustard),例如苯丁酸氮芥(chlorambucil)、萘氮芥(chlomaphazine)、氯磷酰胺(cholophosphamide)、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、二氯甲二乙胺(mechlorethamine)、盐酸甲氧氮芥(mechlorethamineoxidehydrochloride)、霉法兰(melphalan)、新氮芥(novembichin)、苯乙酸氮芥胆甾醇酯(phenesterine)、泼尼莫司汀(prednimustine);曲磷胺(trofosfamide)、尿嘧啶氮芥;硝基脲,例如卡莫司汀(carmustine)、氯脲菌素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)及雷莫司汀(ranimnustine);抗生素,例如烯二炔抗生素(例如,卡奇霉素(calicheamicin),尤其是卡奇霉素γ1i及卡奇霉素(例如,参见agnew,chem.intl.ed.engl.,33:183-186);达内霉素(dynemicin),包括达内霉素a;双膦酸盐,例如氯屈膦酸盐(clodronate);埃斯培拉霉素(esperamicin);以及新制癌菌素发色团(neocarzinostatinchromophore)及相关色蛋白烯二炔抗生素发色团)、阿克拉霉素(aclacinomycin)、放线菌素(actinomycin)、安曲霉素(authramycin)、偶氮丝胺酸、博莱霉素(bleomycin)、放线菌素c(cactinomycin)、卡拉霉素(carabicin)、洋红霉素(carminomycin)、嗜癌霉素(carzinophilin)、色霉素(chromomycin)、放线菌素d(dactinomycin)、柔红霉素(daunorubicin)、地托比星(detorubicin)、6-重氮基-5-侧氧基-l-正亮氨酸、多柔比星(doxorubicin)(adriamycintm)(包括吗啉基-多柔比星、氰基吗啉基-多柔比星、2-吡咯啉基-多柔比星及脱氧多柔比星)、表柔比星(epirubicin)、依索比星(esorubicin)、伊达比星(idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素(mitomycin)(例如丝裂霉素c)、霉酚酸(mycophenolicacid)、诺拉霉素(nogalamycin)、橄榄霉素(olivomycin)、培洛霉素(peplomycin)、泊非霉素(porfiromycin)、嘌呤霉素(puromycin)、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链黑霉素(streptonigrin)、链脲霉素(streptozocin)、杀结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他汀(zinostatin)、佐柔比星(zorubicin);抗代谢物,例如甲胺蝶呤及5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸(denopterin)、甲胺蝶呤、蝶罗呤(pteropterin)、曲美沙特(trimetrexate);嘌呤类似物,例如氟达拉滨(fludarabine)、6-巯基嘌呤、硫咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,例如安西他滨(ancitabine)、阿扎胞苷(azacitidine)、6-氮杂尿苷(6-azauridine)、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、二脱氧尿苷、脱氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷(floxuridine);雄激素,例如卡普睪酮(calusterone)、丙酸屈他雄酮(dromostanolonepropionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睪内酯(testolactone);抗肾上腺素,例如胺鲁米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂,例如亚叶酸;乙酰葡醛酸内酯(aceglatone);醛磷酰胺糖苷(aldophosphamideglycoside);胺基乙酰丙酸(aminolevulinicacid);恩尿嘧啶(eniluracil);安吖啶(amsacrine);百思布什(bestrabucil);比生群(bisantrene);依达曲沙(edatrexate);地磷酰胺(defosfamine);秋水仙胺(demecolcine);地吖醌(diaziquone);依氟鸟胺酸(eflomithine);依利醋铵(elliptiniumacetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖(lentinan);氯尼达明(lonidamine);类美坦辛(maytansinoid),例如美坦辛(maytansine)及安丝菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidamol);二胺硝吖啶(nitracrine);喷托他汀(pentostatin);蛋胺氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸;2-乙基酰肼;丙卡巴肼(procarbazine);雷佐生(razoxane);根霉素(rhizoxin);西佐喃(sizofiran);锗螺胺(spirogermanium);细格孢氮杂酸(tenuazonicacid);三亚胺醌(triaziquone);2,2',2”-三氯三乙胺;新月毒素(尤其是t-2毒素、疣疱菌素a(verracurina)、杆孢菌素(roridina)及蛇形菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露莫司汀(mannomustine);二溴甘露醇(mitabronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);噶萨托辛(gacytosine);阿拉伯糖苷(arabinoside)(“ara-c”);环磷酰胺;噻替哌;紫杉烷(taxoid),例如紫杉醇(paclitaxel)(bristol-myerssquibboncology,princeton,n.j.)及多西紫杉醇(doxetaxel)(rhone-poulencrorer,antony,france);苯丁酸氮芥;吉西他滨(gemcitabine)(gemzartm);6-硫鸟嘌呤;巯基嘌呤;甲胺蝶呤;铂类似物,例如顺铂(cisplatin)及卡铂(carboplatin);长春花碱(vinblastine);铂;依托泊苷(etoposide)(vp-16);异环磷酰胺;米托蒽醌;长春新碱(vincristine);长春瑞滨(vinorelbine)(navelbinetm);诺安托(novantrone);替尼泊苷(teniposide);依达曲沙(edatrexate);道诺霉素(daunomycin);胺基蝶呤(aminopterin);希罗达(xeloda);伊班膦酸盐(ibandronate);cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟胺酸(dmfo);类视色素,例如视黄酸;卡培他滨(capecitabine);及上述药剂中任一者的医药上可接受的盐、酸或衍生物。此定义中亦包括用于调节或抑制激素对肿瘤的作用的抗激素剂,例如抗雌激素及选择性雌激素受体调节剂(serm),包括(例如)他莫昔芬(tamoxifen)(包括nolvadextm)、雷洛昔芬(raloxifene)、屈洛昔芬(droloxifene)、4-羟基他莫昔芬、曲沃昔芬(trioxifene)、盐酸雷洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)及托瑞米芬(toremifene)(farestontm);抑制酶芳香酶的芳香酶抑制剂,其调节肾上腺中的雌激素产生,例如4(5)-咪唑、胺鲁米特、乙酸甲地孕酮(megestrolacetate)(megacetm)、依西美坦(exemestane)、福美司坦(formestane)、法屈唑(fadrozole)、伏罗唑(vorozole)(rivisortm)、来曲唑(letrozole)(femaratm)及阿那曲唑(anastrozole)(arimidextm);及抗雄激素,例如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林(leuprolide)及戈舍瑞林(goserelin);及上述药剂中任一者的医药上可接受的盐、酸或衍生物。该等药剂中的任何一或多者可与本发明人源化抗体偶联以提供用于治疗各种病症的有用治疗剂。亦可使抗体与前药偶联。“前药”是医药活性物质的前体或衍生物形式,其对肿瘤细胞的细胞毒性与母体药物相比较小,且能酶促活化或转化为活性更强的形式。例如,参见wilman,1986,“prodrugsincancerchemotherapy”,biochemicalsocietytransactions,14,第375页-第382页,615thmeetingbelfast;及stella等人,1985,“prodrugs:achemicalapproachtotargeteddrugdelivery”,directeddrugdelivery,borchardt等人(编辑),第247页-第267页,humanapress。有用前药包括(但不限于)含有磷酸根的前药、含有硫代磷酸根的前药、含有硫酸根的前药、含有肽的前药、经d-氨基酸修饰的前药、糖基化前药、含有β-内酰胺的前药、含有视情况经取代的苯氧基乙酰胺的前药及含有视情况经取代的苯基乙酰胺的前药、5-氟胞嘧啶前药及其它5-氟尿苷前药,其可转化成具有更高活性的无细胞毒性药物。可衍生为前药形式的细胞毒性药物的实例包括(但不限于)那些上文所述的化学治疗剂。出于诊断性以及治疗性监测目的,亦可使本发明抗体与标记(单独的标记或标记及额外第二药剂(前药、化学治疗剂及诸如此类))偶联。标记与其它第二药剂不同,其是指可检测化合物或组合物药剂,且其可与本发明人源化抗体直接或间接偶联。标记可是自身可检测(例如,放射性同位素标记或荧光标记),或在酶标记情形下,标记可催化受质化合物或组合物发生可检测的化学变化。可制备经标记人类化抗il-36r抗体并用于各种应用中,包括活体外及活体内诊断学。可将本发明抗体调配为脂质体制剂的一部分以影响其活体内递送。“脂质体”是由各种类别的脂质、磷脂及/或表面活性剂组成的小囊泡。脂质体可用于向哺乳动物递送化合物或调配物,例如本文所揭示的人类化抗il-36r抗体,该抗体视情况与一或多种医药活性剂及/或标记偶合或组合。脂质体的组份通常以双层结构排列,此与生物膜的脂质排列类似。本发明某些方面是关于分离核酸,其编码本发明人源化抗体的一或多个结构域。“经分离”核酸分子是自至少一种污染物核酸分子识别并分离的核酸分子,其在抗体核酸的天然来源中通常与该污染物核酸分子相结合。分离核酸分子与存于天然细胞中的核酸分子不同。在本发明的各种方面中,可重组表达人源化抗体的一或多个结构域。该重组表达可采用一或多种控制序列,即在特定宿主生物体中表达可操作连接的编码序列所需的多核苷酸序列。适用于原核细胞中的控制序列包括(例如)启动子、操纵子及核糖体结合位点序列。真核控制序列包括(但不限于)启动子、聚腺苷酸化信号及增强子。该等控制序列可用于在原核及真核宿主细胞中表达及产生人类化抗il-36r抗体。在使核酸序列与另一核酸序列具有功能性联是时,该核酸序列经“可操作地连接”。例如,若核酸前序列或分泌前导序列表达为参与多肽分泌的前蛋白,则该核酸前序列或分泌前导序列与编码该多肽的核酸可操作地连接;若启动子或增强子影响编码序列的转录,则该启动子或增强子与该序列可操作地连接;或若核糖体结合位点经定位以促进转译,则该核糖体结合位点与编码序列可操作地连接。通常,“可操作连接”意指所连接的dna序列是邻接序列,且在分泌前导序列情形下是邻接序列且位于读码框内。然而,增强子视情况邻接。可藉由在便捷的限制位点处接合来完成连接。若不存在该等位点,则可使用合成寡核苷酸衔接子或连接体。本文所用表达“细胞”、“细胞是”及“细胞培养物”可互换使用,且所有该等名称均包括其子代。因此,“转化体”及“转化细胞”包括原代个体细胞及源自其的培养物而不考虑转移次数。用于治疗目的的术语“哺乳动物”是指任何归类为哺乳动物的动物,包括人类、家畜及农场动物,以及动物园动物、运动用动物或宠物,例如狗、马、猫、牛及诸如此类。较佳地,哺乳动物是人类。本文所用“病症”是可受益于利用本文所述人类化抗il-36r抗体治疗的任何病状。该术语包括慢性及急性病症或疾病,包括那些使哺乳动物易患所述病症的病理学病状。本文欲治疗的非限制性实例或病症包括发炎性病症、血管生成病症、自体免疫病症及免疫性病症、呼吸病症、癌症、血液恶性肿瘤、良性肿瘤及恶性肿瘤、白血病及淋巴恶性肿瘤。术语“癌症”及“癌性”是指或描述哺乳动物中特征通常在于细胞生长失调的生理学病状。癌症的实例包括(但不限于)癌瘤、淋巴瘤、母细胞瘤、肉瘤及白血病。il-36r相关病症亦包括免疫系统疾病及病症,例如自体免疫病症及发炎性病症。该等病状包括(但不限于)类风湿性关节炎(ra)、系统性红斑狼疮(sle)、硬皮症、休格伦氏症候群(sjogren'ssyndrome)、多发性硬化症、牛皮癣、牛皮癣性关节炎、发炎性肠疾病(例如,溃疡性结肠炎及克隆氏病(crohn'sdisease))、肺炎、气喘及特发性血小板减少性紫癜(itp)、上皮性发炎病症、纤维变性及关节粘连性脊椎炎。术语“静脉内输注”是指药剂引入动物或人类患者的静脉中经大于约15分钟、通常介于约30分钟至90分钟之间的时间。术语“静脉内快速浓注(bolus)”或“静脉内推注”是指药物投与动物或人类的静脉中以使身体在约15分钟或更短、通常5分钟或更短时间内接受药物。术语“皮下投与”是指药物引入动物或人类患者的皮肤下、较佳在皮肤与基底组织之间的囊内,由药物贮器相当缓慢持续递送。将皮肤向上捏离或拉离基底组织可产生囊。术语“皮下输注”是指药物引入动物或人类患者的皮肤下、较佳在皮肤与基底组织之间的囊内,由药物贮器相当缓慢持续递送一段时间,包括(但不限于)30分钟或更短、或90分钟或更短。视情况,可由皮下植入药物递送帮浦植入动物或人类患者的皮肤下来实施输注,其中该帮浦递送预定量的药物经预定时间,例如30分钟、90分钟或跨越整个治疗方案的时间。术语“皮下快速浓注”是指药物投与动物或人类患者的皮肤下,其中快速浓注药物递送短于约15分钟;在另一方面中,短于5分钟;且在又一方面中,短于60秒。在再一方面中,投与皮肤与基底组织之间的囊内,其中该囊可由将皮肤向上捏离或拉离基底组织来产生。所用术语“治疗有效量”是指活性剂缓解或改善所治疗病症的一或多种症状的量。在另一方面中,治疗有效量是指已显示可有效例如减慢疾病进展的目标血清浓度。可以常规方式测量功效,视欲治疗病状而定。本文所用“治疗”及“疗法”及诸如此类意欲包括针对疾病或病症的治疗性以及预防性或抑制性措施,其产生任何临床上期望或有益的效应,包括(但不限于)减轻或缓解疾病或病症的一或多个症状、使疾病或病症消退、减慢或停止疾病或病症的进展。因此,例如,术语治疗包括在疾病或病症的症状发作的前或的后投与药剂,由此预防或消除疾病或病症的一或多个体征。作为另一实例,该术语包括在疾病的临床表现后投与药剂,从而抵抗该疾病的症状。此外,在发作后及在已出现临床症状后投与药剂包含本文所用“治疗”或“疗法”,其中不论该治疗是否引起疾病改善,投与均影响疾病或病症的临床参数,例如组织损伤度或转移的量或程度。此外,只要单独或与另一治疗剂组合的本发明组合物与未使用人类化il-36r抗体组合物时相比减轻或改善所治疗病症的至少一个症状,不论是否减轻该病症的所有症状,该结果即应视为可有效治疗潜在病症。所用术语“包装插页”是指通常包括于治疗产品的商业包装内的说明书,其含有关于适应症、用法、投与、禁忌及/或关于使用该等治疗产品的警告的信息。抗体在一方面中,本文阐述并揭示抗il-36r抗体、具体而言人类化抗il-36r抗体,及包含本发明的一或多种抗il-36r抗体、具体而言一或多种人类化抗il-36r抗体的组合物及制品。亦阐述包括抗il-36抗体、具体而言人类化抗il-36r抗体的抗原结合片段的结合剂。本发明的代表性抗体的可变区及cdr是揭示于下文中:抗il-36r小鼠抗体序列本发明的代表性小鼠前导抗体的可变区及cdr(小鼠前导序列)是显示于下文中:轻链可变区(vk)氨基酸序列____________________________________重链可变区(vh)氨基酸序列____________________________________轻链cdr-1(l-cdr1)氨基酸序列>33d10g1l-cdr1tasssvsssylh(seqidno:21)>172c8b12l-cdr1lasqtigtwla(seqidno:22)>67e7e8l-cdr1lasqtigtwlg(seqidno:23)>78c8d1l-cdr1rssqnivhsngntylq(seqidno:24)>81a1d1l-cdr1rasqdiykyln(seqidno:25)>81b4e11l-cdr1tasssvsssyfh(seqidno:26)>73c5c10l-cdr1kasqdvgtnvl(seqidno:27)>73f6f8l-cdr1kasqdvgtnvl(seqidno:27)>76e10e8l-cdr1kasqnvgrava(seqidno:28)>89a12b8l-cdr1lasqtigtwlg(seqidno:29)___________________________________轻链cdr-2(l-cdr2)氨基酸序列>33d10b12l-cdr2stsnlas(seqidno:30)>172c8b12l-cdr2aatslad(seqidno:31)>67e7e8l-cdr2rsttlad(seqidno:32)>78c8d1l-cdr2kvsnrfs(seqidno:33)>81a1d1l-cdr2ytsglhs(seqidno:34)>81b4e11l-cdr2rtsnlas(seqidno:35)>73c5c10l-cdr2sasyrhs(seqidno:36)>73f6f8l-cdr2sasyrhs(seqidno:36)>76e10e8l-cdr2sasnryt(seqidno:37)>89a12b8l-cdr2ratslad(seqidno:38)______________________________________轻链cdr-3(l-cdr3)氨基酸序列>33d10b12l-cdr3hqhhrspvt(seqidno:39)>172c8b12l-cdr3qqvyttplt(seqidno:40)>67e7e8l-cdr3qqlysapyt(seqidno:41)>78c8d1l-cdr3fqgshvpft(seqidno:42)>81a1d1l-cdr3qqdskfpwt(seqidno:43)>81b4e11l-cdr3hqfhrsplt(seqidno:44)>73c5c10l-cdr3qqysryplt(seqidno:45)>73f6f8l-cdr3qqysryplt(seqidno:45)>76e10e8l-cdr3qqyssyplt(seqidno:46)>89a12b8l-cdr3qqlysgpyt(seqidno:47)________________________________________重链cdr-1(h-cdr1)氨基酸序列>33d10b12h-cdr1gntvtsywmh(seqidno:48)>172c8b12h-cdr1gytftdnymn(seqidno:49)>67e7e8h-cdr1gfnikddyih(seqidno:50)>78c8d1h-cdr1gfsltkfgvh(seqidno:51)>81a1d1h-cdr1gfslssyein(seqidno:52)>81b4e11h-cdr1gysftsswih(seqidno:53)>73c5c10h-cdr1gfsltnyavh(seqidno:54)>73f6f8h-cdr1gfsltnyavh(seqidno:54)>76e10e8h-cdr1gfsltnygvh(seqidno:55)>89a12b8h-cdr1gfnikddyih(seqidno:56)_____________________________________重链cdr-2(h-cdr2)氨基酸序列>33d10b12h-cdr2eilpstgrtnynenfkg(seqidno:57)>172c8b12h-cdr2rvnpsngdtkynqnfkg(seqidno:58)>67e7e8h-cdr2ridpangntkyapkfqd(seqidno:59)>78c8d1h-cdr2viwaggptnynsalms(seqidno:60)>81a1d1h-cdr2viwtgittnynsalis(seqidno:61)>81b4e11h-cdr2einpgnvrtnynenf(seqidno:62)>73c5c10h-cdr2viwsdgstdfnapfks(seqidno:63)>73f6f8h-cdr2viwsdgstdynapfks(seqidno:64)>76e10e8h-cdr2viwpvgstnynsalms(seqidno:65)>89a12b8h-cdr2ridpangntkydprfqd(seqidno:66)___________________________________重链cdr-3(h-cdr3)氨基酸序列>33d10b12h-cdr3vyfgnpwfay(seqidno:67)>172c8b12h-cdr3tknfyssysyddamdy(seqidno:68)>67e7e8h-cdr3sfpnnyysyddafay(seqidno:69)>78c8d1h-cdr3qiyystlvdy(seqidno:70)>81a1d1h-cdr3gtgtgfyyamdy(seqidno:71)>81b4e11h-cdr3vfygepyfpy(seqidno:72)>73c5c10h-cdr3kggysgswfay(seqidno:73)>73f6f8h-cdr3kggysgswfay(seqidno:73)>76e10e8h-cdr3mdwddffdy(seqidno:74)>89a12b8h-cdr3sfpdnyysyddafay(seqidno:75)_________________________________________抗il-36r小鼠cdr序列主要小鼠抗体的cdr序列的概述是显示于下文中:抗il-36r人源化抗体序列基于框架同源性、cdr结构、保守标准残基、保守接口封装残基及其它参数来选择小鼠前导序列的人类框架序列以产生人类化可变区(参见实例5)。源自抗体81b4及73c5的代表性人类化可变区是显示于下文中。轻链可变区(vk)氨基酸序列重链可变区(vh)氨基酸序列上文所示源自抗体81b4及73c5的人类化可变区的cdr序列是描述于下文中。l-cdr1氨基酸序列>81b4vk32_3l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_105l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_116l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_127l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_138l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_140l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_141l-cdr1tasssvsssyfh(seqidno:26)>81b4vk32_147l-cdr1tasssvsssyfh(seqidno:26)>73c5vk39_2l-cdr1kasqdvgtnvl(seqidno:27)>73c5vk39_7l-cdr1kasqdvgtnvl(seqidno:27)>73c5vk39_15l-cdr1kasqdvgtnvl(seqidno:27)l-cdr2氨基酸序列>81b4vk32_3l-cdr2(seqid102)rtstlas>81b4vk32_105l-cdr2(seqid103)rtsilas>81b4vk32_116l-cdr2(seqid104)rtsrlas>81b4vk32_127l-cdr2(seqid104)rtsrlas>81b4vk32_138l-cdr2(seqid104)rtsrlas>81b4vk32_140l-cdr2(seqid105)rtsqlas>81b4vk32_141l-cdr2(seqid106)rtsklas>81b4vk32_147l-cdr2(seqid140)rtshlas>73c5vk39_2l-cdr2sasyrhs(seqidno:36)>73c5vk39_7l-cdr2sasyrhs(seqidno:36)>73c5vk39_15l-cdr2sasyrhs(seqidno:36)l-cdr3氨基酸序列>81b4vk32_3l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_105l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_116l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_127l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_138l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_140l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_141l-cdr3hqfhrsplt(seqidno:44)>81b4vk32_147l-cdr3hqfhrsplt(seqidno:44)>73c5vk39_2l-cdr3qqysryplt(seqidno:45)>73c5vk39_7l-cdr3qqysryplt(seqidno:45)>73c5vk39_15l-cdr3qqysryplt(seqidno:45)h-cdr1氨基酸序列>81b4vh33_49h-cdr1gysftsswih(seqidno:53)>81b4vh33_85th-cdr1gysftsswih(seqidno:53)>81b4vh33_90h-cdr1gysftsswih(seqidno:53)>81b4vh33_93h-cdr1gysftsswih(seqidno:53)>81b4vh50_22h-cdr1gysftsswih(seqidno:53)>81b4vh50_30h-cdr1gysftsswih(seqidno:53)>81b4vh51_13h-cdr1gysftsswih(seqidno:53)>81b4vh51_15h-cdr1gysftsswih(seqidno:53)>81b4vh52_83h-cdr1gysftsswih(seqidno:53)>73c5vh46_4h-cdr1gfsltdyavh(seqidno:107)>73c5vh46_19h-cdr1gfsltdyavh(seqidno:107)>73c5vh46_40h-cdr1gfsltdyavh(seqidno:107)>73c5vh47_65h-cdr1gfsltdyavh(seqidno:107)>73c5vh47_77h-cdr1gfsltdyavh(seqidno:107)>73c5vh58_91h-cdr1gfsltdyavh(seqidno:107)________________________________h-cdr2氨基酸序列>81b4vh33_49h-cdr2einpgnvrtnynenf(seqidno:62)>81b4vh33_85th-cdr2einpgnvrtnynenf(seqidno:62)>81b4vh33_90h-cdr2einpgnvrtnynenf(seqidno:62)>81b4vh33_93h-cdr2einpgnvrtnynenf(seqidno:62)>81b4vh50_22h-cdr2eilpgvvrtnynenf(seqidno:108)>81b4vh50_30h-cdr2einpgavrtnynenf(seqidno:109)>81b4vh51_13h-cdr2einpglvrtnynenf(seqidno:110)>81b4vh51_15h-cdr2einpgavrtnynenf(seqidno:109)>81b4vh52_83h-cdr2einpgsvrtnynenf(seqidno:111)>73c5vh46_4h-cdr2viwsdgstdynapfks(seqidno:64)>73c5vh46_19h-cdr2viwsdgstdynapfks(seqidno:64)>73c5vh46_40h-cdr2viwsdgstdynapfks(seqidno:64)>73c5vh47_65h-cdr2viwsdgstdynapfks(seqidno:64)>73c5vh47_77h-cdr2viwsdgstdfnapfks(seqidno:63)>73c5vh58_91h-cdr2viwsdgstdynapfks(seqidno:64)______________________________h-cdr3氨基酸序列>81b4vh33_49h-cdr3vfygepyfpy(seqidno:72)>81b4vh33_85th-cdr3vfygepyfpy(seqidno:72)>81b4vh33_90h-cdr3vfygepyfpy(seqidno:72)>81b4vh33_93h-cdr3vfygepyfpy(seqidno:72)>81b4vh50_22h-cdr3vfygepyfpy(seqidno:72)>81b4vh50_30h-cdr3vfygepyfpy(seqidno:72)>81b4vh51_13h-cdr3vfygepyfpy(seqidno:72)>81b4vh51_15h-cdr3vfygepyfpy(seqidno:72)>81b4vh52_83h-cdr3vfygepyfpy(seqidno:72)>73c5vh46_4h-cdr3kggysgswfay(seqidno:73)>73c5vh46_19h-cdr3kggysgswfay(seqidno:73)>73c5vh46_40h-cdr3kggysgswfay(seqidno:73)>73c5vh47_65h-cdr3kggysgswfay(seqidno:73)>73c5vh47_77h-cdr3kggysgswfay(seqidno:73)>73c5vh58_91h-cdr3kggysgswfay(seqidno:73)在一方面中,本发明的可变区与恒定区连接。例如,本发明的可变区与下文所示恒定区连接,从而形成抗体的重链或轻链。本发明的代表性轻链及重链序列是显示于下文中(源自抗体81b4及73c5的人类化可变区与恒定区连接)。轻链氨基酸序列重链氨基酸序列上文所列示的cdr是使用chothia编号系统(al-lazikani等人,(1997)jmb273,927-948)来界定。在一方面中,本发明抗体包含3个轻链cdr及3个重链cdr,例如上文所述。在一方面中,本发明抗体包含上文所述的轻链及重链可变区。在一方面中,本发明的轻链可变区与轻链恒定区(例如κ或λ恒定区)融合。在一方面中,本发明的重链可变区与重链恒定区(例如iga、igd、ige、igg或igm、具体而言igg1、igg2、igg3或igg4)融合。本发明提供包含以下的抗il-36r抗体(抗体b1):包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:125的重链。本发明提供包含以下的抗il-36r抗体(抗体b2):包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:126的重链。本发明提供包含以下的抗il-36r抗体(抗体b3):包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:127的重链。本发明提供包含以下的抗il-36r抗体(抗体b4):包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:125的重链。本发明提供包含以下的抗il-36r抗体(抗体b5):包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:126的重链。本发明提供包含以下的抗il-36r抗体(抗体b6):包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:127的重链。本发明提供包含以下的抗il-36r抗体(抗体c3):包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:138的重链。本发明提供包含以下的抗il-36r抗体(抗体c2):包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:139的重链。本发明提供包含以下的抗il-36r抗体(抗体c1):包含氨基酸序列seqidno:124的轻链;及包含氨基酸序列seqidno:138的重链。本发明的代表性抗体是显示于下文中。表a.表b本发明抗体可用于治疗人类中的各种疾病或病症(例如免疫学疾病、发炎性疾病、自体免疫疾病及呼吸疾病)的方法。例如,本发明抗体可用于治疗牛皮癣、类风湿性关节炎、发炎性肠疾病或牛皮癣性关节炎的方法。例如,本发明抗体可用于治疗慢性阻塞性肺病(copd)或气喘的方法。例如,本发明抗体可用于治疗硬皮病、掌跖脓疱病、泛发性脓疱型牛皮癣、糖尿病肾病、狼疮肾炎、硬皮病、关节粘连性脊椎炎、il-36受体拮抗剂缺陷自体免疫疾病(ditra)、il-1受体拮抗剂缺陷自体免疫疾病(dira)或cryopyrin相关周期性症候群(caps)的方法。在一些方面中,人源化抗体展示阻断活性,藉此其使il-36配体与il-36受体的结合降低至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。抗体阻断il-36配体与il-36受体结合的能力可使用业内已知的竞争性结合分析来量测。或者,抗体的阻断活性可藉由评价il-36的生物学效应(例如il-8、il-6及gm-csf的产生)以确定由il-36受体介导的信号传导是否受到抑制来量测。在又一方面中,本发明提供具有有利生物物理性质的人类化抗il-36r抗体。在一方面中,本发明的人类化抗il-36r抗体以至少90%单体形式或以至少92%单体形式或以至少95%单体形式存于缓冲液中。在又一方面中,本发明的人类化抗il-36r抗体以至少90%单体形式或以至少92%单体形式或以至少95%单体形式于缓冲液中保留1个月或4个月。在一方面中,本发明的人源化抗体是抗体b1、抗体b2、抗体b3、抗体b4、抗体b5、抗体b6、抗体c1、抗体c2或抗体c3。因此,在一实施方案中,本发明的人源化抗体包含轻链序列seqidno:115及重链序列seqidno:125(抗体b1)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:115及重链序列seqidno:126(抗体b2)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:115及重链序列seqidno:127(抗体b3)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:118及重链序列seqidno:125(抗体b4)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:118及重链序列seqidno:126(抗体b5)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:118及重链序列seqidno:127(抗体b6)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:124及重链序列seqidno:138(抗体c1)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:123及重链序列seqidno:139(抗体c2)。在另一实施方案中,本发明的人源化抗体包含轻链序列seqidno:123及重链序列seqidno:138(抗体c3)。在又一实施方案中,本发明的人源化抗体是由轻链序列seqidno:115及重链序列seqidno:125组成(抗体b1)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:115及重链序列seqidno:126组成(抗体b2)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:115及重链序列seqidno:127组成(抗体b3)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:118及重链序列seqidno:125组成(抗体b4)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:118及重链序列seqidno:126组成(抗体b5)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:118及重链序列seqidno:127组成(抗体b6)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:124及重链序列seqidno:138组成(抗体c1)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:123及重链序列seqidno:139组成(抗体c2)。在另一实施方案中,本发明的人源化抗体是由轻链序列seqidno:123及重链序列seqidno:138组成(抗体c3)。在一些实施方案中,包括其抗原结合片段(重链及轻链可变区)的人类化抗il-36r抗体包含源自抗体b1、抗体b2、抗体b3、抗体b4、抗体b5、抗体b6、抗体c1、抗体c2或抗体c3的残基的氨基酸序列。在又一实施方案中,本发明提供与本发明抗体(例如,本文所述的抗体b1、抗体b2、抗体b3、抗体b4、抗体b5、抗体b6、抗体c1、抗体c2或抗体c3)竞争性结合人类il-36r的抗il-36r抗体或其抗原结合片段。抗体或抗原结合片段与il-36r竞争性结合的能力可使用业内已知的竞争性结合分析来量测。人类化抗il-36r抗体视情况在共有或种系框架区中包括特异性氨基酸取代。在该等框架位置处的特异性氨基酸残基取代可相对于藉由将cdr或hvl“直接交换”至人类种是框架区中所形成的人源化抗体中所示者改良各方面抗体性能,包括结合亲和性及/或稳定性。在一些实施方案中,本发明阐述轻链可变区具有seqidno:1-10中的任一者中所述氨基酸序列的其它单克隆抗体。在一些实施方案中,本发明阐述重链可变区具有seqidno:11-20中的任一者中所述氨基酸序列的其它单克隆抗体。将cdr置于人类共有重链及轻链可变结构域的fr中可产生有用的本发明人源化抗体。具体而言,本发明提供具有seqidno:1/11、2/12、3/13、4/14、5/15、6/16、7/17、8/18、9/19、10/20的轻链可变区及重链可变区的组合的单克隆抗体。该等可变区可与人类恒定区组合。在一些实施方案中,本发明阐述轻链可变区序列具有seqidno:76-86中的任一者中所述氨基酸序列的其它人源化抗体。在一些实施方案中,本发明阐述可变区序列具有seqidno:87-101中的任一者中所述氨基酸序列的其它人源化抗体重链。具体而言,本发明提供具有seqidno:77/89、80/88、80/89、77/87、77/88、80/87、86/100、85/101、85/100的轻链可变区及重链可变区的组合的单克隆抗体。该等可变区可与人类恒定区组合。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:77的cdr及氨基酸序列与seqidno:77的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:89的cdr及氨基酸序列与seqidno:89的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于抗il-36r抗体或其抗原结合片段,其包含人类化轻链可变结构域,该域包含seqidno:80的cdrs及氨基酸序列与seqidno:80的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,及人类化重链可变结构域,该域包含seqidno:88的cdrs及氨基酸序列与seqidno:88的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一个实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含抗il-36r抗体或其抗原结合片段,其包含人类化轻链可变结构域,该域包含seqidno:80的cdrs及氨基酸序列与seqidno:80的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,及人类化重链可变结构域,该域包含seqidno:89的cdrs及氨基酸序列与seqidno:89的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一个实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于抗il-36r抗体或其抗原结合片段,其包含该人类化轻链可变结构域,该域包含seqidno:77的cdrs及氨基酸序列与seqidno:77的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,及人类化重链可变结构域,该域包含seqidno:87的cdrs及氨基酸序列与seqidno:87的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一个实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:77的cdr及氨基酸序列与seqidno:77的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:88的cdr及氨基酸序列与seqidno:88的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:80的cdr及氨基酸序列与seqidno:80的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:87的cdr及氨基酸序列与seqidno:87的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:86的cdr及氨基酸序列与seqidno:86的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:100的cdr及氨基酸序列与seqidno:100的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:85的cdr及氨基酸序列与seqidno:85的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:101的cdr及氨基酸序列与seqidno:101的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在又一实施方案中,本发明是关于包含人类化轻链可变结构域及人类化重链可变结构域的抗il-36r抗体或其抗原结合片段,该人类化轻链可变结构域包含seqidno:85的cdr及氨基酸序列与seqidno:85的可变结构域轻链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区,该人类化重链可变结构域包含seqidno:100的cdr及氨基酸序列与seqidno:100的可变结构域重链氨基酸序列的框架区的氨基酸序列具有至少90%一致性、至少93%一致性或至少95%一致性的框架区。在一实施方案中,该抗il-36r抗体是人类化单克隆抗体。在某些具体实施方案中,本文所揭示的人类化抗il-36r抗体至少包含具有上文所揭示鼠类单克隆抗体或人源化抗体的cdr或hvl的重链或轻链可变结构域及人类种系重链及轻链可变结构域的fr。在又一方面中,本发明提供抗il-36r抗体或其抗原结合片段,其包含seqidno:21-29中的任一者的轻链cdr1(l-cdr1)序列;seqidno:30-38中的任一者的轻链cdr2(l-cdr2)序列;seqidno:39-47中的任一者的轻链cdr3(l-cdr3)序列;seqidno:48-56中的任一者的重链cdr1(h-cdr1)序列;seqidno:57-66中的任一者的重链cdr2(h-cdr2)序列;及seqidno:67-75中的任一者的重链cdr3(h-cdr3)序列。在一方面中,该抗il-36r抗体或其抗原结合片段包含轻链可变区及重链可变区,该轻链可变区包含上文所列示l-cdr1、上文所列示l-cdr2及上文所列示l-cdr3,该重链可变区包含上文所列示h-cdr1、上文所列示h-cdr2及上文所列示h-cdr3。在又一方面中,本发明提供抗il-36r抗体或其抗原结合片段,其包含:a)分别seqidno:21、30、39、48、57及67的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或b)分别seqidno:22、31、40、49、58及68的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或c)分别seqidno:23、32、41、50、59及69的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或d)分别seqidno:24、33、42、51、60及70的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或e)分别seqidno:25、34、43、52、61及71的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或f)分别seqidno:26、35、44、53、62及72的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或g)分别seqidno:27、36、45、54、63及73的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或h)分别seqidno:27、36、45、54、64及74的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或i)分别seqidno:27、36、45、54、64及73的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或j)分别seqidno:28、37、46、55、65及74的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或k)分别seqidno:29、38、47、56、66及75的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列。在又一方面中,本发明提供抗il-36r抗体或其抗原结合片段,其包含:a)分别seqidno:26、103、44、53、62及72的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或b)分别seqidno:26、104、44、53、62及72的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或c)分别seqidno:27、36、45、107、63及73的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列;或d)分别seqidno:27、36、45、107、64或73的l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3序列。在一方面中,该抗il-36r抗体或其抗原结合片段包含轻链可变区及重链可变区,该轻链可变区包含上文所列示的l-cdr1、l-cdr2及l-cdr3组合,该重链可变区包含上文所列示的h-cdr1、h-cdr2及h-cdr3组合。在具体实施方案中,预期具有该等例示性免疫球蛋白之间的经交换cdr区(即(例如)将小鼠抗体或源自其的人源化抗体中的一者的一或两个cdr与来自另一小鼠抗体或源自其的人源化抗体的类似cdr交换)的嵌合抗体可产生有用抗体。在某些实施方案中,人类化抗il-36r抗体是抗体片段。上文已概述各种抗体片段且已研发出多种技术来产生抗体片段。可经由蛋白水解消化完整抗体来获得片段(例如,参见morimoto等人,1992,journalofbiochemicalandbiophysicalmethods24:107-117;及brennan等人,1985,science229:81)。或者,可在重组宿主细胞中直接产生片段。例如,可直接自大肠杆菌(e.coli)回收fab'-sh片段,并实施化学偶合以形成f(ab')2片段(例如,参见carter等人,1992,bio/technology10:163-167)。藉由另一方法,可直接自重组宿主细胞培养物中分离f(ab')2片段。本领域技术人员可了解产生抗体片段的其它技术。因此,在一方面中,本发明提供包含本文所述cdr、具体而言本文所述l-cdr1、l-cdr2、l-cdr3、h-cdr1、h-cdr2及h-cdr3的组合中的一者的抗体片段。在又一方面中,本发明提供包含本文所述可变区、例如本文所述轻链可变区及重链可变区的组合中的一者的抗体片段。某些实施方案包括人类化抗il-36r抗体的f(ab')2片段,该f(ab')2片段包含seqidno:115或118中的任一者的轻链序列与seqidno:125、126或127中的任一者的重链序列的组合。该等实施方案可包括包含此一f(ab')2的完整抗体。某些实施方案包括人类化抗il-36r抗体的f(ab')2片段,该f(ab')2片段包含seqidno:123或124中的任一者的轻链序列与seqidno:138或139中的任一者的重链序列的组合。该等实施方案可包括包含此一f(ab')2的完整抗体。在一些实施方案中,抗体或抗体片段包括介导效应子功能的恒定区。恒定区可提供针对表达il-36r的标靶细胞的抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)及/或补体依赖性细胞毒性(cdc)反应。效应子结构域可为(例如)ig分子的fc区。抗体的效应子结构域可来自任何适宜脊椎动物物种及同型。来自不同动物物种的同型介导效应子功能的能力不同。例如,人类免疫球蛋白介导cdc及adcc/adcp的能力通常分别具有以下次序:igm≈igg1≈igg3>igg2>igg4及igg1≈igg3>igg2/igm/igg4。鼠类免疫球蛋白通常分别以以下次序来介导cdc及adcc/adcp:鼠类igm≈igg3>>igg2b>igg2a>>igg1及igg2b>igg2a>igg1>>igg3。在另一实例中,鼠类igg2a介导adcc,而鼠类igg2a及igm二者介导cdc。抗体修饰人类化抗il-36r抗体及药剂可包括对人类化抗il-36r抗体或其抗原结合片段的修饰。例如,可期望在效应子功能方面修饰抗体,以增强抗体在治疗癌症中的效力。一该修饰是将半胱胺酸残基引入fc区中,由此使得在此区域中可形成链间二硫键。由此生成的同二聚抗体可具有经改良的内化能力及/或增强的补体介导细胞杀伤及/或抗体依赖性细胞毒性(adcc)。例如,参见caron等人,1992,j.expmed.176:1191-1195;及shopes,1992,j.immunol.148:2918-2922。亦可使用异双功能性交联剂来制备具有增强的抗肿瘤活性的同二聚抗体,如wolff等人,1993,cancerresearch53:2560-2565中所述。或者,抗体可经改造以含有双重fc区,从而增强抗体的补体溶解及adcc能力。参见stevenson等人,1989,anti-cancerdrugdesign3:219-230。已藉由修改抗体fc区的糖基化模式来生成支持adcc的能力经改良的抗体。此是可能的,此乃因抗体在ch2结构域中天冬酰胺残基n297处的糖基化参与adcc必需的igg与fcγ受体之间的相互作用。宿主细胞是已经改造以表达具有经改变糖基化(例如增加二等分型n-乙酰基葡糖胺或减少岩藻糖)的抗体。减少岩藻糖比增加二等分型n-乙酰基葡糖胺的存在更大程度地增强adcc活性。此外,低岩藻糖抗体的adcc增强与fcγriiiav/f多态性无关。修饰抗体fc区中的氨基酸序列是增强adcc的糖基化改造的替代方案。已藉由广泛突变分析来确定fcγ受体在人类igg1上的结合位点。此导致生成具有fc突变的人类化igg1抗体,该等突变提高对fcγriiia的结合亲和性并增强活体外adcc。另外,已获得结合特性具有多种不同变更的fc变体,例如与特异性fcγr受体的结合增强且与其它fcγr受体的结合不变或减小。另一方面包括免疫偶联物,其包含与细胞毒性剂偶联的人源化抗体或其片段,该细胞毒性剂是(例如)化学治疗剂、毒素(例如,细菌、真菌、植物或动物源的酶促活性毒素或其片段)或放射性同位素(即,放射性偶联物)。上文已阐述可用于产生该等免疫偶联物的化学治疗剂。可用于形成有用免疫偶联物的酶促活性毒素及其片段包括白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自绿脓杆菌(pseudomonasaeruginosa))、蓖麻毒素(ricin)a链、相思豆毒素(abrin)a链、蒴莲根毒素(modeccin)a链、α-八迭球素(alpha-sarcin)、光桐(aleuritesfordii)蛋白、石柱素(dianthin)蛋白、美洲商陆(phytolacaamericana)蛋白(papi、papii及pap-s)、苦瓜(momordicacharantia)抑制剂、麻风树毒素(curcin)、巴豆毒素(crotin)、皂质草(saponariaofficinalis)抑制剂、白树毒素(gelonin)、米托洁林(mitogellin)、局限曲菌素、酚霉素、依诺霉素(enomycin)、单端孢霉烯族毒素(tricothecene)及诸如此类。多种放射性核素可用于产生放射性偶联的人类化抗il-36r抗体。实例包括212bi、131i、131in、90y及186re。人类化抗il-36r抗体与细胞毒性剂或化学治疗剂的偶联物可藉由已知方法使用多种双功能蛋白质偶合剂制得,例如3-(2-吡啶基二巯基)丙酸n-琥珀酰亚胺酯(spdp)、亚胺基硫(it)、亚胺酸酯的双功能衍生物(例如己二酸二甲酯hcl)、活性酯(例如辛二酸二琥珀酰亚胺酯)、醛(例如戊二醛)、双迭氮基化合物(例如双(对-迭氮基苯甲酰基)已二胺)、双重氮衍生物(例如双(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(例如甲苯2,6-二异氰酸酯)及双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)。例如,蓖麻毒素免疫毒素可如vitetta等人,1987,science238:1098中所述来制备。经碳-14标记的1-异硫氰基苄基-3-甲基二伸乙基三胺基五乙酸(mx-dtpa)是偶联放射性核苷酸与抗体的实例性螯合剂。偶联物亦可使用可裂解连接体来形成。亦可将本文所揭示的人类化抗il-36r抗体调配为免疫脂质体。含有抗体的脂质体是藉由业内已知的方法来制备,例如以下文献中所阐述:epstein等人,1985,proc.natl.acad.sci.usa82:3688;hwang等人,1980,proc.natl.acad.sci.usa77:4030;及美国专利第4,485,045号及第4,544,545号。循环时间延长的脂质体是揭示于(例如)美国专利第5,013,556号中。尤其有用的脂质体可使用包含磷脂酰胆碱、胆固醇及peg衍生的磷脂酰乙醇胺(peg-pe)的脂质组合物藉由逆相蒸发法来生成。经由具有指定孔径的滤膜挤出脂质体以获得具有期望直径的脂质体。可经由二硫化物互换反应使本文所揭示抗体的fab'片段与脂质体偶联,如martin等人,1982,j.biol.chem.257:286-288中所述。化学治疗剂(例如多柔比星)视情况含于脂质体内。例如,参见gabizon等人,1989,j.nationalcancerinst.81(19):1484。本文所阐述并揭示的抗体亦可藉由使抗体与活化前药的酶偶联来用于adept(抗体导向酶前药疗法)程序,该酶将前药(例如,肽基化学治疗剂)转化为活性抗癌药物。例如,参见wo81/01145、wo88/07378及美国专利第4,975,278号。可用于adept的免疫偶联物中的酶组份是能作用于前药而将其转化为活性更强的细胞毒性形式的酶。可用于adept的具体酶包括(但不限于)碱性磷酸酶,其用于将含磷酸酯前药转化为游离药物;芳基硫酸酯酶,其用于将含硫酸酯前药转化为游离药物;胞嘧啶去胺酶,其用于将非毒性5-氟胞嘧啶转化为抗癌药物5-氟尿嘧啶;蛋白酶,例如沙雷氏菌(serratia)蛋白酶、嗜热菌蛋白酶、枯草杆菌蛋白酶、羧肽酶及组织蛋白酶(例如组织蛋白酶b及l),其用于将含肽前药转化为游离药物;d-内胺酰羧肽酶,其用于转化含有d-氨基酸取代基的前药;碳水化合物裂解酶,例如β-半乳糖苷酶及神经胺酸酶,其用于将糖基化前药转化为游离药物;β-内酰胺酶,其用于将经β-内酰胺衍生的药物转化为游离药物;及青霉素酰胺酶,例如青霉素v酰胺酶或青霉素g酰胺酶,其用于将胺氮处分别经苯氧基乙酰基或苯基乙酰基衍生的药物转化为游离药物。或者,可使用具有酶促活性的抗体(“抗体酶”)来将前药转化为游离活性药物(例如,参见massey,1987,nature328:457-458)。可藉由已知方法来制备抗体-抗体酶偶联物以供将抗体酶递送至肿瘤细胞群,例如,藉由使酶与上文所述人类化抗il-36r抗体/异双功能性交联试剂共价结合来制备。或者,可使用重组dna技术构造融合蛋白,其包含本文所揭示抗体的至少抗原结合区及与的相连的上文所述酶的至少功能活性部分(例如,参见neuberger等人,1984,nature312:604-608)。在某些实施方案中,可期望使用人类化抗il-36r抗体片段而非完整抗体以(例如)促进肿瘤渗透。可期望修饰抗体片段以延长其血清半衰期。此可藉由(例如)将补救受体结合表位纳入抗体片段中来达成。在一方法中,可改变(例如,突变)抗体片段中的适宜区域,或可藉由(例如)dna或肽合成将表位纳入肽标签中,然后使该标签在任一末端或在中部与抗体片段融合。例如,参见wo96/32478。在其它实施方案中,亦包括人类化抗il-36r抗体的共价修饰。共价修饰包括对以下基团的修饰:半胱胺酰基残基、组胺酰基残基、离胺酰基及胺基末端残基、精胺酰基残基、酪胺酰基残基、羧基侧基团(天冬胺酰基或麸胺酰基)、麸酰胺酰基及天冬酰胺酰基残基或丝胺酰基或苏胺酰基残基。另一共价修饰类型涉及使糖苷与抗体化学或酶促偶合。若适用,该等修饰可藉由化学合成或藉由抗体的酶促或化学裂解来制备。可藉由使抗体的靶向氨基酸残基与能与选定侧链或胺基-或羧基-末端残基反应的有机衍生剂反应来将抗体的其它共价修饰类型引入分子中。抗体上存在的任何碳水化合物部分的移除可以化学或酶促方式来完成。化学去糖基化是阐述于以下文献中:hakimuddin等人,1987,arch.biochem.biophys.259:52及edge等人,1981,anal.biochem.,118:131。抗体上碳水化合物部分的酶促裂解可藉由使用多种内切糖苷酶及外切糖苷酶来达成,如thotakura等人,1987,meth.enzymol138:350中所述。可用共价修饰的另一类型包含使抗体与多种非蛋白质性聚合物(例如聚乙二醇、聚丙二醇或聚氧化烯)中的一者以以下文献中的一或多者中所述的方式连接:美国专利第4,640,835号、美国专利第4,496,689号、美国专利第4,301,144号、美国专利第4,670,417号、美国专利第4,791,192号及美国专利第4,179,337号。人类化及氨基酸序列变体抗il-36r抗体的氨基酸序列变体可藉由将适宜核苷酸变化引入抗il-36r抗体dna中或藉由肽合成来制备。该等变体包括(例如)本文实例中抗il-36r抗体氨基酸序列内残基的缺失及/或插入及/或取代。实施缺失、插入及取代的任一组合以获得最终构造物,限制条件是最终构造物具有期望特征。氨基酸变化亦可改变人类化或变体抗il-36r抗体的转译后过程,例如改变糖基化位点的数目或位置。可用于识别抗il-36r抗体中是较佳诱变位置的某些残基或区域的方法是称作“丙胺酸扫描诱变”,如cunningham及wells(science,244:1081-1085(1989))中所述。此处,残基或标靶残基群(例如带电荷残基,例如arg、asp、his、lys及glu)已确定且经中性或带负电荷氨基酸(通常是丙胺酸)替代以影响氨基酸与il-36r抗原的相互作用。然后藉由在取代位点或针对取代位点引入另外或其它变体来改良那些显示对取代具有功能敏感性的氨基酸位置。因此,在预先确定引入氨基酸序列变异的位点时,无需预先确定突变本身的性质。例如,为分析给定位点处突变的性能,在标靶密码子或区域处实施丙胺酸扫描诱变或随机诱变并针对期望活性筛选所表达的抗il-36r抗体变体。氨基酸序列插入包括胺基-及/或羧基末端融合(长度在一个残基至含有上百或更多残基的多肽的范围内)以及单一或多个氨基酸残基的序列内插入。末端插入的实例包括与表位卷标融合的抗il-36r抗体。抗il-36r抗体分子的其它插入性变体包括可提高抗体血清半衰期的酶或多肽与抗il-36r抗体n-或c-末端的融合。另一变体类型是氨基酸取代变体。该等变体在抗il-36r抗体分子中移除至少一个氨基酸残基并在该位置处插入不同残基。用于取代诱变的最受关注的位点包括超变区,但亦涵盖fr改变。保守取代是显示于表5的“较佳取代”标题下。若该等取代引起生物活性改变,则可引入更重要的改变(命名为“实例性取代”,或如下文参照氨基酸类别所进一步阐述),并筛选产物。表c:在蛋白质化学中,通常公认抗体的生物学特性可藉由选择维持以下特性的效应显著不同的取代来达成:(a)取代区域中多肽骨架的结构,例如呈折迭或螺旋构象,(b)分子在标靶位点处的电荷或疏水性,或(c)侧链体积。基于常见侧链性质将天然存在的残基分为以下各类:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr;(3)酸性:asp、glu;(4)碱性:asn、gin、his、lys、arg;(5)影响链定向的残基:gly、pro;及(6)芳香族:trp、tyr、phe。非保守性取代可使得需要将该等类别中一者的成员交换为另一类别。亦可取代(通常用丝胺酸)维持人类化或变体抗il-36r抗体的适当构象时未涉及的任何半胱胺酸残基,从而提高分子的氧化稳定性,防止异常交联,或提供与细胞毒性或细胞抑制化合物的已确认偶联点。相反,可将半胱胺酸键添加至抗体以提高其稳定性(尤其在抗体是诸如fv片段等抗体片段时)。一类取代型变体涉及取代亲代抗体(例如人类化或人类抗体)中的一或多个超变区残基。通常,所选用于进一步研发的所得变体可相对于产生该等变体的亲代抗体具有经改良的生物性质。产生该等取代型变体的便捷方法是使用噬菌体展示实施的亲和性成熟。简言的,使若干超变区位点(例如6个至7个位点)突变以在每一位点产生所有可能的氨基酸取代。由此产生的抗体变体以单价方式以与每一颗粒内所封装的m13基因iii产物的融合形式自丝状噬菌体颗粒展示出来。然后针对生物学活性(例如结合亲和性)来筛选噬菌体展示的变体。为确定修饰的候选超变区位点,可实施丙胺酸扫描诱变以确定显著促进抗原结合的超变区残基。或者或另外,有利的是分析抗原-抗体复合物的晶体结构以确定抗体与人类il-36r之间的接触点。该等接触残基及附近残基是根据本文所述技术的候选取代残基。在产生该等变体后,立即如本文所述对变体组进行筛选,且可选择在一或多个相关分析中具有优越性质的抗体以供进一步研发。抗体的另一类氨基酸变体改变抗体的初始糖基化模式。“改变”意指缺失一或多个存于抗体中的碳水化合物部分及/或添加一或多个抗体中不存在的糖基化位点。在一些实施方案中,可期望修饰本发明抗体以添加糖基化位点。抗体的糖基化通常是n-连接或o-连接。n-连接是指碳水化合物部分附接至天冬酰胺残基侧链。三肽序列天冬酰胺-x-丝胺酸及天冬酰胺-x-苏胺酸(其中x是除脯胺酸外的任何氨基酸)是碳水化合物部分与天冬酰胺侧链酶促附接的识别序列。因此,多肽中存在该等三肽序列中的任一者均可产生潜在糖基化位点。o-连接糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一者附接至羟基氨基酸,最常见为丝胺酸或苏胺酸,但亦可使用5-羟基脯胺酸或5-羟基离胺酸。因此,为使给定蛋白(例如抗体)糖基化,改造蛋白质的氨基酸序列以使其含有上述三肽序列中的一或多者(对于n-连接糖基化位点)。亦可藉由在初始抗体序列中添加一或多个丝胺酸或苏胺酸残基或经一或多个丝胺酸或苏胺酸残基取代来达成改变(对于o-连接糖基化位点)。编码抗il-36r抗体氨基酸序列变体的核酸分子是藉由业内已知的多种方法来制备。该等方法包括(但不限于)自天然来源分离(在天然存在的氨基酸序列变体情形下)或藉由对抗il-36r抗体的预先制备的变体或非变体形式实施寡核苷酸介导(或定点)诱变、pcr诱变及盒式诱变来制备。多核苷酸、载体、宿主细胞及重组方法其它实施方案涵盖包含编码人类化抗il-36r抗体的序列的分离多核苷酸、包含该多核苷酸的载体及宿主细胞,以及产生人源化抗体的重组技术。分离多核苷酸可编码抗il-36r抗体的任何期望形式,包括(例如)全长单克隆抗体、fab、fab'、f(ab')2及fv片段、双链抗体、线性抗体、单链抗体分子及自抗体片段形成的多特异性抗体。一些实施方案包括分离多核苷酸,其包含编码抗体或抗体片段中具有seqidno:1-10中任一者的氨基酸序列的轻链可变区的序列。一些实施方案包括分离多核苷酸,其包含编码抗体或抗体片段中具有seqidno:11-20的氨基酸序列的重链可变区的序列。一些实施方案包括分离多核苷酸,其包含编码抗体或抗体片段中具有seqidno:76-86中任一者的氨基酸序列的轻链可变区的序列。一些实施方案包括分离多核苷酸,其包含编码抗体或抗体片段中具有seqidno:87-101的氨基酸序列的重链可变区的序列。一些实施方案包括分离多核苷酸,其包含编码抗体中具有seqidno:114-124中任一者的氨基酸序列的轻链的序列。一些实施方案包括分离多核苷酸,其包含编码抗体中具有seqidno:125-139的氨基酸序列的重链的序列。在一方面中,分离多核苷酸序列编码具有包含以下的氨基酸序列的轻链及重链可变区的抗体或抗体片段:分别seqidno:115及seqidno:127;分别seqidno:118及seqidno:126;分别seqidno:118及seqidno:127;分别seqidno:115及seqidno:125;分别seqidno:115及seqidno:126;分别seqidno:118及seqidno:125;分别seqidno:124及seqidno:138;分别seqidno:123及seqidno:139;分别seqidno:123及seqidno:138。包含编码人类化抗il-36r抗体或其片段或链的序列的多核苷酸可与一或多个业内已知的调节或控制序列融合,且可含于业内已知的适宜表达载体或宿主细胞中。编码重链或轻链可变结构域的每一多核苷酸分子均可独立地与编码恒定结构域(例如人类恒定结构域)的多核苷酸序列融合,从而使得能产生完整抗体。或者,可使多核苷酸或其部分融合在一起,从而提供产生单链抗体的模板。对于重组产生,将编码抗体的多核苷酸插入可复制载体中以供克隆(扩增dna)或表达。可使用多种适合表达重组抗体的载体。载体组份通常包括(但不限于)以下中的一或多者:信号序列、复制起点、一或多个标记基因、增强子组件、启动子及转录终止序列。人类化抗il-36r抗体亦可以融合多肽形式产生,其中抗体与异源多肽融合,例如信号序列或在成熟蛋白质或多肽的胺基末端具有特异性裂解位点的其它多肽。所选异源信号序列通常是宿主细胞可识别及加工(即,藉由信号肽酶裂解)者。对于不能识别并加工人类化抗il-36r抗体信号序列的原核宿主细胞而言,信号序列可经原核信号序列取代。信号序列可为(例如)碱性磷酸酶、青霉素酶、脂蛋白、耐热肠毒素ii前导序列及诸如此类。对于酵母菌分泌,可用(例如)以下信号来取代天然信号序列:得自酵母菌转化酶α-因子(包括酵母菌属(saccharomyces)及克鲁维酵母菌属(kluyveromyces)α-因子前导序列)的前导序列、酸性磷酸酶、人白色念珠菌(c.albicans)葡糖淀粉酶或wo90/13646中所述的信号。在哺乳动物细胞中,可使用哺乳动物信号序列以及病毒分泌前导序列(例如单纯疱疹病毒gd信号)。该前体区的dna在读码框中与编码人类化抗il-36r抗体的dna接合。表达及克隆载体含有使载体能在一或多个选定宿主细胞中复制的核酸序列。通常,在克隆载体中,此序列是使载体能独立于宿主染色体dna而复制者,且其包括复制起点或自主复制序列。用于多种细菌、酵母菌及病毒的该等序列为业内所熟知。来自质体pbr322的复制起点适用于大多数革兰氏(gram)阴性细菌,2-υ质体起点适用于酵母菌,且多种病毒起点(sv40、多瘤病毒、腺病毒、vsv及bpv)可用于在哺乳动物细胞中克隆载体。通常,哺乳动物表达载体不需要复制起点组份(通常可仅使用sv40起点,此乃因其含有早期启动子)。表达及克隆载体可含有编码可选择标记物的基因以有助于对表达的识别。典型可选择标记基因编码如下蛋白质:赋予对抗生素或其它毒素(例如,胺苄青霉素(ampicillin)、新霉素、甲胺蝶呤或四环素)的抗性;或者,是营养缺陷的补体;或在其它替代方案中供应复合培养基中不存在的特殊营养素,例如编码杆菌(bacilli)的d-丙胺酸消旋酶的基因。选择方案的一个实例利用药物来阻止宿主细胞的生长。那些经异源基因成功转化的细胞产生赋予抗药性的蛋白质,且因此可在该选择方案中存活。该显性选择的实例使用药物新霉素、霉酚酸及潮霉素。哺乳动物细胞的常用可选择标记物是那些使得能识别可吸收编码人类化抗il-36r抗体的核酸的胜任细胞者,例如dhfr(二氢叶酸还原酶)、胸苷激酶、金属硫蛋白-i及-ii(例如灵长类动物金属硫蛋白基因)、腺苷去胺酶、鸟胺酸去羧酶及诸如此类。首先藉由在含有甲胺蝶呤(mtx)(dhfr的竞争性拮抗剂)的培养基中培养所有转化体来鉴定经dhfr选择基因转化的细胞。在采用野生型dhfr时,适宜宿主细胞是dhfr活性缺陷的中国仓鼠卵巢(cho)细胞是(例如dg44)。或者,经编码抗il-36r抗体、野生型dhfr蛋白及另一可选择标记物(例如胺基糖苷3'-磷酸转移酶(aph))的dna序列转化或共转化的宿主细胞(尤其含有内源性dhfr的野生型宿主)可藉由在含有针对该等可选择标记物的选择剂(例如胺基糖苷抗生素,例如康霉素(kanamycin)、新霉素或g418)的培养基中使细胞生长来进行选择。例如,参见美国专利第4,965,199号。若使用酵母菌细胞作为宿主细胞来实施重组产生,则可使用存于酵母菌质体yrp7中的trp1基因(stinchcomb等人,1979,nature282:39)作为可选择标记物。trp1基因为缺少在色胺酸中生长的能力的酵母菌突变体菌株(例如,atcc第44076号或pep4-1)提供选择标记物(jones,1977,genetics85:12)。则酵母菌宿主细胞基因组中trp1损伤的存在可提供有效环境以藉由在不存在色胺酸时生长来检测转化。类似地,leu2p缺陷型酵母菌株(例如atcc20,622或38,626)是藉由具有leu2基因的已知质粒来补足。另外,可使用源自1.6μm环形质体pkd1的载体来转化克鲁维酵母菌。或者,已报导用于大规模产生重组牛凝乳酶的表达系统可用于乳酸克鲁维酵母菌(k.lactis.)(vandenberg,1990,bio/technology8:135)。亦已揭示藉由克鲁维酵母菌属的工业菌株分泌成熟重组人类血清白蛋白的稳定多拷贝表达载体(fleer等人,1991,bio/technology9:968-975)。表达及克隆载体通常含有宿主生物体可识别且与编码抗il-36r抗体或其多肽链的核酸分子可操作连接的启动子。适用于原核宿主的启动子包括phoa启动子、β-内酰胺酶及乳糖启动子系统、碱性磷酸酶、色胺酸(trp)启动子系统及杂合启动子(例如tac启动子)。其它已知细菌启动子亦适宜。用于细菌系统的启动子亦可含有与编码人类化抗il-36r抗体的dna可操作连接的shine-dalgarno(s.d.)序列。已知多种真核启动子序列。事实上,所有真核基因均具有富at区,其位于转录起始位点上游约25个至30个碱基处。在许多基因的转录起始点上游70个至80个碱基处发现的另一序列是cncaat区,其中n可为任一核苷酸。在大多数真核基因的3'端处为aataaa序列,其可能是向编码序列的3'端添加聚a尾的信号。所有该等序列均以适宜方式插入真核表达载体中。适用于酵母菌宿主的启动序列的实例包括以下酶的启动子:3-磷酸甘油酸酯激酶或其它糖解酶,例如烯醇酶、甘油醛-3-磷酸去氢酶、己糖激酶、丙酮酸去羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油酸变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶及葡糖激酶。诱导型启动子的另一优点是藉由生长条件来控制转录。该等启动子包括以下酶的酵母菌启动子区:醇去氢酶2、异细胞色素c、酸性磷酸酶、与氮代谢相关的衍生物酶、金属硫蛋白、甘油醛-3-磷酸去氢酶及负责麦芽糖及半乳糖利用的酶。用于酵母菌表达的适宜载体及启动子进一步阐述于ep73,657中。酵母菌增强子亦可有利地与酵母菌启动子一起使用。在哺乳动物宿主细胞中自载体转录人类化抗il-36r抗体受(例如)自以下获得的启动子控制:病毒基因组,例如多瘤病毒、禽痘病毒、腺病毒(例如腺病毒2)、牛乳头状瘤病毒、禽肉瘤病毒、细胞巨大病毒、反转录病毒、肝炎b病毒及猿猴病毒40(sv40);异源性哺乳动物启动子,例如肌动蛋白启动子或免疫球蛋白启动子;或热休克启动子,限制条件是该等启动子与宿主细胞系统兼容。sv40病毒的早期及晚期启动子是便捷地以sv40限制性片段形式获得,其亦含有sv40病毒复制起点。人类细胞巨大病毒的立即早期启动子是便捷地以hindiiie限制性片段形式获得。使用牛乳头状瘤病毒作为载体在哺乳动物宿主中表达dna的系统是揭示于美国专利第4,419,446号中。此系统的修改形式是阐述于美国专利第4,601,978号中。亦可参见reyes等人,1982,nature297:598-601,其揭示在来自单纯疱疹病毒的胸苷激酶启动子控制下在小鼠细胞中表达人类p-干扰素cdna。或者,可使用劳斯肉瘤病毒(roussarcomavirus)长末端重复序列作为启动子。可用于重组表达载体的另一有用组件是增强子序列,其用于提高高等真核生物中编码人类化抗il-36r抗体的dna的转录。现已知多种增强子序列来自哺乳动物基因(例如球蛋白、弹性蛋白酶、白蛋白、α-胎蛋白及胰岛素)。然而,通常使用来自真核细胞病毒的增强子。实例包括位于复制起点迟侧(lateside)上的sv40增强子(bp100-270)、细胞巨大病毒早期启动子增强子、位于复制起点迟侧上的多瘤病毒增强子及腺病毒增强子。关于活化真核启动子的增强组件的描述亦可参见yaniv,1982,nature297:17-18。可将增强子剪接至载体中人类化抗il-36r抗体编码序列的5'或3'位置处,但较佳位于启动子的5'位点。用于真核宿主细胞(酵母菌、真菌、昆虫、植物、动物、人类细胞或来自其它多细胞生物体的有核细胞)中的表达载体亦可含有终止转录及稳定mrna所需的序列。该等序列通常可自真核生物或病毒dna或cdna的5'及偶而3'非转译区获得。该等区域含有在编码抗il-36r抗体的mrna的非转译部分中转录为聚腺苷酸化片段的核苷酸区段。一种有用转录终止组份是牛生长激素聚腺苷酸化区。参见wo94/11026及其中所揭示的表达载体。在一些实施方案中,人类化抗il-36r抗体可使用chef系统来表达。(例如,参见美国专利第5,888,809号;其揭示内容以引用的方式并入本文中。)在本文载体中克隆或表达dna的适宜宿主细胞是上述原核细胞、酵母菌细胞或高等真核细胞。适用于此目的的原核生物包括真细菌,例如革兰氏阴性或革兰氏阳性生物体,例如肠杆菌科(enterobacteriaceae),例如艾氏菌属(escherichia)(例如大肠杆菌)、肠杆菌属(enterobacter)、伊文氏杆菌属(erwinia)、克雷白氏菌属(klebsiella)、变形杆菌属(proteus)、沙门氏菌属(salmonella)(例如鼠伤寒沙门氏菌(salmonellatyphimurium))、沙雷菌属(例如黏质沙雷氏菌(serratiamarcescans))及志贺杆菌属(shigella),以及杆菌属(例如枯草杆菌(b.subtilis)及地衣杆菌(b.licheniformis)(例如于1989年4月12日公开的dd266,710中所揭示的地衣芽孢杆菌41p))、假单胞菌属(pseudomonas)(例如绿脓杆菌)及链霉菌属(streptomyces)。一较佳大肠杆菌克隆宿主是大肠杆菌294(atcc31,446),但其它菌株(例如大肠杆菌b、大肠杆菌x1776(atcc31,537)及大肠杆菌w3110(atcc27,325))亦适合。该等实例是例示性而非限制性的。除原核生物外,诸如丝状真菌或酵母菌等真核微生物亦是人类化抗il-36r抗体编码载体的适宜克隆或表达宿主。酿酒酵母菌(saccharomycescerevisiae)或常见焙用酵母菌(baker'syeast)是最常用的低等真核宿主微生物。然而,通常可使用多种其它属、种及菌株且可用于本文中,例如粟酒裂殖酵母菌菌(schizosaccharomycespombe);克鲁维酵母菌属宿主,例如乳酸克鲁维酵母菌、松脆克鲁维酵母菌(k.fragilis)(atcc12,424)、保加利亚克鲁维酵母菌(k.bulgaricus)(atcc16,045)、威克海姆克鲁维酵母菌(k.wickeramii)(atcc24,178)、瓦尔提克鲁维酵母菌(k.waltii)(atcc56,500)、果蝇克鲁维酵母菌(k.drosophilarum)(atcc36,906)、耐热克鲁维酵母菌(k.thermotolerans)及马克斯克鲁维酵母菌(k.marxianus);子囊菌酵母菌属(yarrowia)(ep402,226);巴斯德毕赤酵母菌菌(pichiapastoris)(ep183,070);假丝酵母菌属(candida);里氏木霉菌(trichodermareesia)(ep244,234);粗糙链孢霉菌(neurosporacrassa);许旺酵母菌属(schwanniomyces),例如西方许旺酵母菌(schwanniomycesoccidentalis);及丝状真菌,例如链孢霉属(neurospora)、青霉属(penicillium)、弯颈霉属(tolypocladium)及曲霉菌属(aspergillus)宿主(例如构巢曲霉(a.nidulans)及黑曲霉(a.niger))。表达糖基化人类化抗il-36r抗体的适宜宿主细胞是源自多细胞生物体。无脊椎动物细胞的实例包括植物及昆虫细胞,包括(例如)多种杆状病毒株及变体及来自诸如以下等宿主的对应许可昆虫宿主细胞:草地贪夜蛾(spodopterafrugiperda)(毛虫)、埃及斑蚊(aedesaegypti)(蚊子)、白线斑蚊(aedesalbopictus)(蚊子)、黑腹果蝇(drosophilamelanogaster)(果蝇)及家蚕(bombyxmori)(蚕)。多种转染用病毒株可公开获得,例如加州苜蓿夜蛾(autographacalifornica)npv的l-1变体及家蚕npv的bm-5株,且该等病毒尤其可用于转染草地贪夜蛾细胞。亦可采用棉花、玉米、马铃薯、大豆、矮牵牛、西红柿及烟草的植物细胞培养物作为宿主。在另一方面中,人类化抗il-36r的表达是在脊椎动物细胞中实施。脊椎动物细胞在培养(组织培养)中的繁殖已成为常规程序且技术随处可得。有用哺乳动物宿主细胞是的实例是经sv40转化的猴子肾cv1细胞是(cos-7,atcccrl1651)、人类胚胎肾细胞是(经亚克隆以在悬浮培养中生长的293或293细胞,graham等人,1977,j.genvirol.36:59)、幼仓鼠肾细胞(bhk,atccccl10)、中国仓鼠卵巢细胞/-dhfr1(cho,urlaub等人,1980,proc.natl.acad.sci.usa77:4216;例如,dg44)、小鼠赛特利氏(sertoli)细胞(tm4,mather,1980,biol.reprod.23:243-251)、猴子肾细胞(cv1atccccl70)、非洲绿猴子肾细胞(vero-76,atcccrl-1587)、人类子宫颈癌细胞(hela,atccccl2)、犬肾细胞(mdck,atccccl34)、水牛大鼠肝细胞(brl3a,atcccrl1442)、人类肺细胞(w138,atccccl75)、人类肝细胞(hepg2,hb8065)、小鼠乳房肿瘤(mmt060562,atccccl51)、tr1细胞(mather等人,1982,annalsn.y.acad.sci.383:44-68)、mrc5细胞、fs4细胞及人类肝癌细胞是(hepg2)。用上述用于产生人类化抗il-36r抗体的表达或克隆载体来转化宿主细胞,并在常规营养培养基中培养,该等营养培养基经修改以适于诱导启动子、选择转化体或扩增编码期望序列的基因。可在多种培养基中培养用于产生本文所述人类化抗il-36r抗体的宿主细胞。市售培养基适用于培养宿主细胞,例如ham'sf10(sigma-aldrich公司,st.louis,mo.)、最小必需培养基((mem),sigma-aldrich公司)、rpmi-1640(sigma-aldrich公司)及杜贝克氏改良伊氏培养基(dulbecco'smodifiedeagle'smedium)((dmem),sigma-aldrich公司)。另外,可使用以下文献中的一或多者中所阐述的任一培养基来作为宿主细胞的培养基:ham等人,1979,meth.enz.58:44;barnes等人,1980,anal.biochem.102:255;美国专利第4,767,704号、美国专利第4,657,866号、美国专利第4,927,762号、美国专利第4,560,655号、美国专利第5,122,469号、wo90/103430及wo87/00195。该等培养基中的任一者可根据需要补加有激素及/或其它生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐(例如氯化钠、钙盐、镁盐及磷酸盐)、缓冲液(例如hepes)、核苷酸(例如腺苷及胸苷)、抗生素(例如正大霉素)、痕量元素(定义为通常以微莫耳范围的最终浓度存在的无机化合物)及葡萄糖或等效能源。亦可以本领域技术人员已知的适当浓度包括其它补加物。诸如温度、ph及诸如此类等培养条件是那些先前用于所选表达用宿主细胞者,且对本领域技术人员而言是显而易见的。在使用重组技术时,抗体可在细胞内、在壁膜间隙中产生,或直接分泌至培养基中。若在细胞内产生抗体,则作为第一步骤可使细胞破裂以释放蛋白质。可藉由(例如)离心或超滤移除微粒碎片,即宿主细胞或溶解片段。carter等人,1992,bio/technology10:163-167阐述分离分泌至大肠杆菌壁膜间隙中的抗体的程序。简言的,在乙酸钠(ph3.5)、edta及苯甲磺酰氟(pmsf)存在下经约30分钟使细胞糊剂解冻。可藉由离心移除细胞碎片。若抗体分泌至培养基中,则通常首先使用市售蛋白质浓缩滤器(例如amicon或milliporepellicon超滤单元)浓缩来自该等表达系统的上清液。在任一前述步骤中可包括诸如pmsf等蛋白酶抑制剂以抑制蛋白质水解,且可包括抗生素以防止外来污染物生长。可使用多种方法自宿主细胞分离抗体。可使用(例如)羟基磷灰石层析、凝胶电泳、透析及亲和层析来纯化自细胞制备的抗体组合物,其中亲和层析是典型纯化技术。蛋白质a作为亲和配体的适合性取决于存于抗体中的任一免疫球蛋白fc结构域的物种及同型。蛋白质a可用于纯化基于人类γ1、γ2或γ4重链的抗体(例如,参见lindmark等人,1983j.immunol.meth.62:1-13)。推荐蛋白质g用于所有小鼠同型及人类γ3(例如,参见guss等人,1986emboj.5:1567-1575)。亲和配体所附接的基质最经常为琼脂糖,但亦可使用其它基质。机械上稳定的基质(例如定孔玻璃或聚(苯乙烯二乙烯基)苯)使得可达成较使用琼脂糖更快的流速及更短的处理时间。若抗体包含ch3结构域,则bakerbondabxtm树脂(j.t.baker,phillipsburg,n.j.)可用于纯化。视欲回收抗体亦可使用其它蛋白质纯化技术,例如在离子交换管柱上分级分离、乙醇沉淀、逆相hplc、在二氧化硅上层析、在肝素sepharosetm上层析、在阴离子或阳离子交换树脂(例如聚天冬胺酸管柱)上层析、层析聚焦、sds-page及硫酸铵沉淀。在任何初步纯化步骤后,可使用ph介于约2.5至4.5之间的溶析缓冲液对包含目标抗体及污染物的混合物实施低ph疏水作用层析,通常是在低盐浓度(例如,约0m-0.25m盐)下实施。亦包括在低、中等及高严格度条件下与由编码本发明抗体或抗体片段的分离多核苷酸序列代表的核苷酸序列的全部或一部分(例如,编码可变区的部分)杂交的核酸。杂交核酸的杂交部分的长度通常是至少15个(例如,20个、25个、30个或50个)核苷酸。杂交核酸的杂交部分与编码抗il-36r多肽(例如,重链或轻链可变区)或其补体的核酸的一部分或全部的序列至少80%(例如至少90%、至少95%或至少98%)一致。本文所述类型的杂交核酸可用作(例如)克隆探针、引物(例如pcr引物)或诊断探针。非治疗性用途本文所述抗体可用作亲和纯化剂。在此方法中,使用业内熟知方法将抗体固定在诸如蛋白质a树脂等固相上。使经固定抗体与含有欲纯化il-36r蛋白(或其片段)的样品接触,且随后用适宜溶剂洗涤载体,从而可移除样品中除与经固定抗体结合的il-36r蛋白以外的实质上所有材料。最后,用另一适宜溶剂洗涤载体,从而可自抗体释放il-36r蛋白。抗il-36r抗体(例如人类化抗il-36r抗体)亦可用于检测及/或量化il-36r蛋白的诊断分析,例如,检测在具体细胞、组织或血清中的il-36r表达。抗il-36r抗体可以诊断方式用于(例如)监测疾病的发展或进展作为(例如)测定给定治疗及/或预防方案的效力的临床测试程序的一部分。可藉由偶合抗il-36r抗体来促进检测。可检测物质的实例包括各种酶、辅基、荧光材料、发光材料、生物发光材料、放射性材料、使用各种正电子发射断层摄影术的正电子发射金属及非放射性顺磁性金属粒子。例如,参见美国专利第4,741,900号,其是关于根据此发明可与抗体偶联用作诊断剂的金属离子。抗il-36r抗体可用于诊断il-36r相关病症(例如,特征在于il-36r的异常表现的病症)或确定个体是否具有患il-36r相关病症的增加的风险的方法。该等方法包括使来自个体的生物样品与il-36r抗体接触及检测抗体与il-36r的结合。“生物样品”意欲指自个体、细胞是、组织培养或可能表达il-36r的其它细胞源获得的任何生物样品。自哺乳动物获得组织活检及体液的方法为业内所熟知。在一些实施方案中,该方法可进一步包含将il-36r在患者样品中的含量与对照样品(例如,未患有il-36r相关病症的个体)相比较以确定患者是否患有il-36r相关病症或是否具有患il-36r相关病症的风险。在一些实施方案中,例如处于诊断性目的,可有利地用可检测部分标记抗体。可使用多种可检测标记,包括放射性同位素、荧光标记、酶受质标记及诸如此类。可使用多种已知技术使标记与抗体间接偶联。例如,可使抗体与生物素偶联,且可使上文所述三大类标记中的任一种与抗生物素蛋白偶联,或反的亦然。生物素选择性地与抗生物素蛋白结合,且标记由此可以此间接方式与抗体偶联。或者,为达成标记与抗体的间接偶联,可使抗体与较小半抗原(例如地高辛(digoxin))偶联且使一种不同类型的上述标记与抗半抗原抗体(例如,抗地高辛抗体)偶联。由此,可达成标记与抗体的间接偶联。实例性放射性同位素标记包括35s、14c、125i、3h及131i。可使用(例如)以下文献中所述的技术利用放射性同位素标记抗体:currentprotocolsinimmunology,第1卷及第2卷,1991,coligen等人编辑,wiley-interscience,newyork,n.y.,pubs。可藉由(例如)闪烁计数来量测放射性。实例性荧光标记包括源自以下的标记:稀土螯合物(铕螯合物)或荧光素及其衍生物、玫瑰红(rhodamine)及其衍生物、丹磺酰(dansyl)、丽丝胺(lissamine)、藻红素及得克萨斯红(texasred)。可经由已知技术使荧光标记与抗体偶联,例如currentprotocolsinimmunology中所揭示的那些。可使用荧光计来量化荧光。业内已知多种经充分表征的酶-受质标记(例如,综述参见美国专利第4,275,149号)。酶通常催化发色受质进行可使用各种技术量测的化学改变。例如,改变可是可以分光光度计法量测的受质颜色变化。或者,酶可改变受质的荧光或化学发光。量化荧光变化的技术如上文所述。化学发光受质可藉由化学反应经电子激发,且然后可发射可使用(例如)化学发光计量测的光或向荧光受体提供能量。酶标记的实例包括荧光素酶(例如萤火虫荧光素酶及细菌荧光素酶,美国专利第4,737,456号)、荧光素、2,3-二氢酞嗪二酮、苹果酸去氢酶、脲酶、过氧化酶(例如山葵过氧化酶(hrpo))、碱性磷酸酶、β-半乳糖苷酶、葡萄糖淀粉酶、溶菌酶、糖氧化酶(例如葡萄糖氧化酶、半乳糖氧化酶及葡萄糖-6-磷酸去氢酶)、杂环氧化酶(例如尿酸酶及黄嘌呤氧化酶)、乳过氧化酶、微过氧化酶及诸如此类。酶与抗体偶联的技术是阐述于(例如)o'sullivan等人,1981,methodsforthepreparationofenzyme-antibodyconjugatesforuseinenzymeimmunoassay,在methodsinenzym.(j.langone及h.vanvunakis编辑),academicpress,n.y.,73:147-166中。酶-受质组合的实例包括(例如):山葵过氧化酶(hrpo)与作为受质的过氧化氢酶,其中过氧化氢酶氧化染料前体(例如邻苯二胺(opd)或3,3',5,5'-四甲基联苯胺盐酸盐(tmb));碱性磷酸酶(ap)与作为发色受质的磷酸对硝基苯酯;及β-d-半乳糖苷酶(β-d-gal)与发色受质(例如对硝基苯基-β-d-半乳糖苷酶或荧光受质4-甲基伞形酮-β-d-半乳糖苷酶)。本领域技术人员可了解多种其它酶-受质组合。该等组合的一般综述参见美国专利第4,275,149号及美国专利第4,318,980号。在另一实施方案中,使用未经标记的人类化抗il-36r抗体且用结合该人类化抗il-36r抗体的经标记抗体来检测。本文所述抗体可用于任一已知分析方法中,例如竞争性结合分析、直接及间接夹心式分析及免疫沉淀分析。例如,参见zola,monoclonalantibodies:amanualoftechniques,第147页-第158页(crcpress有限公司,1987)。抗il-36r抗体或其抗原结合片段可用于抑制配体与il-36受体的结合。该等方法包含向细胞(例如,哺乳动物细胞)或细胞环境投与抗il-36r抗体或其抗原结合片段,其中藉由il-36受体介导的信号传导受到抑制。该等方法可在活体外或活体内实施。“细胞环境”意欲指组织、培养基或围绕细胞的细胞外基质。向细胞的细胞环境投与抗il-36r抗体或其抗原结合片段,以使抗体或片段能够与细胞外部且围绕细胞的il-36r分子结合,从而防止il-36配体与其受体结合。诊断套组抗il-36r抗体可用于诊断套组中,即预定量试剂与实施诊断分析的说明书的经包装组合。若用酶标记抗体,则套组可包括酶所需受质及辅因子(例如提供可检测发色团或荧光团的受质前体)。另外,可包括其它添加剂,例如稳定剂、缓冲液(例如封阻缓冲液或溶解缓冲液)及诸如此类。各种试剂的相对量可大幅变化以使该等试剂在溶液中的浓度可显著优化分析的灵敏度。试剂可以干粉形式(通常经冻干)提供,其包括在溶解后可使试剂溶液具有适宜浓度的赋形剂。治疗性用途在另一实施方案中,本文所揭示的人类化抗il-36r抗体可用于治疗如本文所述各种与il-36r的表达相关的病症。治疗il-36r相关病症的方法包含向需要其的个体投与治疗有效量的人类化抗il-36r抗体。人类化抗il-36r抗体或药剂是藉由任何适宜方式来投与,包括非经肠、皮下、腹膜内、肺内及鼻内,且若需要局部免疫阻抑治疗,则实施病灶内投与(包括灌注或以其它方式使移植物在移植前与抗体接触)。人类化抗il-36r抗体或药剂可以(例如)输注或快速浓注形式来投与。非经肠输注包括肌内、静脉内、动脉内、腹膜内或皮下投与。另外,人类化抗il-36r抗体是藉由脉冲输注适当投与,尤其是以抗体的递减剂量来投与。在一方面中,藉由注射来实施投药,最佳藉由静脉内或皮下注射来投药,此部分取决于投与是短期还是长期投与。在预防或治疗疾病时,抗体的适宜剂量可取决于多种因素,例如如上文所定义欲治疗疾病的类型、疾病的严重程度及病程、投与抗体的目的是预防性还是治疗性、先前治疗、患者临床史及对抗体的反应,以及主治医师的决定。抗体是一次性或经一是列治疗以适当方式投与患者。视疾病类型及严重程度而定,不论是(例如)藉由一或多次分开投与或藉由连续输注来投与,向患者投与的抗体初始候选剂量为约1μg/kg至20mg/kg(例如0.1mg/kg-15mg/kg)。视上文所提及的因素而定,典型日剂量可在约1μg/kg至100mg/kg或更高范围内。对于经数天或更长时间重复投与,视病状而定,持续治疗直至疾病症状出现期望阻抑为止。然而,可使用其它剂量方案。此疗法的进展可藉由常规技术及分析容易地监测。实例性剂量方案是揭示于wo94/04188中者。本文所用术语“阻抑”在与“改善”及“减轻”相同的上下文中意指减少疾病的一或多个特征。可以与良好医疗实践一致的方式对抗体组合物进行调配、投药及投与。在此上下文中需考虑的因素包括所治疗的特定病症、所治疗的特定哺乳动物、个体患者的临床病状、病因、药剂的递送位点、投与方法、投与时间安排及从业医师所知的其它因素。欲投与抗体的“治疗有效量”可由该等因素决定,且是预防、改善或治疗与il-36r表达相关的病症所需的最小量。抗体不需(但视情况)与一或多种当前用于预防或治疗所述病症的药剂一起调配。该等其它药剂的有效量取决于人类化抗il-36r23p19抗体存于调配物中的量、病症或治疗的类型及上述其它因素。该等其它药剂通常以与上文所用相同的剂量及投与途径来使用或是上文所用剂量的约1%至99%。医药组合物及其投与可向患有免疫病症、呼吸病症或癌症或具有罹患该等疾病的风险的个体投与包含il-36r结合剂(例如,抗il-36r抗体)的组合物。本发明进一步提供il-36r结合剂(例如,抗il-36r抗体)用于制造用以预防或治疗癌症、呼吸病症或免疫病症的医药的用途。本文所用术语“个体”意指可投与il-36r结合剂的任何哺乳动物患者,包括(例如)人类及非人类哺乳动物,例如灵长类动物、啮齿类动物及狗。明确意欲使用本文所述方法治疗的个体包括人类。在免疫病症、呼吸病症或癌症的预防或治疗中,抗体或药剂可单独或与其它组合物组合投与。可与抗体或药剂组合投与的该等组合物包括甲胺蝶呤(mtx)及免疫调节剂,例如抗体或小分子。用于该等医药组合物的抗体的实例是那些包含具有seqidno:1-10中任一者的轻链可变区氨基酸序列的抗体或抗体片段者。用于该等医药组合物的抗体的实例亦是那些包含具有seqidno:11-20中任一者的重链可变区氨基酸序列的人源化抗体或抗体片段者。用于该等医药组合物的抗体的其它实例亦是那些包含具有seqidno:76-86中任一者的轻链可变区氨基酸序列的人源化抗体或抗体片段者。用于该等医药组合物的较佳抗体亦是那些包含具有seqidno:87-101中任一者的重链可变区氨基酸序列的人源化抗体或抗体片段者。用于该等医药组合物的抗体的其它实例亦是那些包含具有以下任一者的轻链可变区及重链可变区的人源化抗体或抗体片段者:seqidno:77及89、seqidno:80及88、seqidno:80及89、seqidno:77及87、seqidno:77及88、seqidno:80及87、seqidno:86及100、seqidno:85及101或seqidno:85及10。用于该等医药组合物的抗体的其它实例亦是那些包含具有seqidno:115、118、123或124中任一者的轻链区氨基酸序列的人源化抗体者。用于该等医药组合物的较佳抗体亦是那些包含具有seqidno:125、126、127、138或139中任一者的重链可变区氨基酸序列的人源化抗体者。用于该等医药组合物的抗体的其它实例亦是那些包含抗体b1、抗体b2、抗体b3、抗体b4、抗体b5、抗体b6、抗体c1、抗体c2或抗体c3者。已知且可使用各种递送系统来投与il-36r结合剂。引入方法包括(但不限于)真皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外及经口途径。il-36r结合剂可藉由(例如)输注、快速浓注或注射来投与,且可与诸如化学治疗剂等其它生物活性剂一起投与。投与可为全身性或局部投与。在较佳实施方案中,藉由皮下注射来投与。可在(例如)预填充唧筒中制备用于该等注射的调配物,其可每隔一周投与一次。在具体实施方案中,il-36r结合剂组合物是藉由注射、藉助导管、藉助栓剂或藉助植入体来投与,该植入体是有孔、无孔或凝胶状材料,其包括诸如硅橡胶膜等膜或纤维。通常,在投与组合物时,使用抗il-36r抗体或药剂不吸附的材料。在其它实施方案中,抗il-36r抗体或药剂是以受控释放系统来递送。在一实施方案中,可使用帮浦(例如,参见langer,1990,science249:1527-1533;sefton,1989,crccrit.ref.biomed.eng.14:201;buchwald等人,1980,surgery88:507;saudek等人,1989,n.engl.j.med.321:574)。在另一实施方案中,可使用聚合材料。(例如,参见medicalapplicationsofcontrolledrelease(langer及wise编辑,crcpress,bocaraton,fla.,1974);controlleddrugbioavailability,drugproductdesignandperformance(smolen及ball编辑,wiley,newyork,1984);ranger及peppas,1983,macromol.sci.rev.macromol.chem.23:61。亦参见levy等人,1985,science228:190;during等人,1989,ann.neurol.25:351;howard等人,1989,j.neurosurg.71:105。)其它受控释放系统是论述于(例如)langer(参见上文)中。il-36r结合剂(例如,抗il-36r抗体)可以包含治疗有效量的结合剂及一或多种医药兼容成份的医药组合物形式来投与。在典型实施方案中,按照常规程序将医药组合物调配为适于向人类静脉内或皮下投与的医药组合物。通常,注射投与用组合物是存于无菌等渗水性缓冲液中的溶液。若需要,医药物亦可包括增溶剂及局部麻醉剂(例如利多卡因(lignocaine))以减轻注射位点的疼痛。通常,各成份是单独或混合在一起以单位剂型来供应,例如,作为冻干干粉或无水浓缩物存于诸如安瓿或药囊等标明活性剂的量的密封容器中。若医药物是藉由输注来投与,则可将其分配至含有无菌医药级水或盐水的输注瓶中。若医药物是藉由注射来投与,则可提供含有注射用无菌水或盐水的安瓿以使得可在投与之前混合各成份。此外,可以医药套组形式来提供医药组合物,该医药套组包含(a)含有呈冻干形式的il-36r结合剂(例如,抗il-36r抗体)的容器及(b)含有医药上可接受的注射用稀释剂(例如,无菌水)的第二容器。医药上可接受的稀释剂可用于重建或稀释冻干抗il-36r抗体或药剂。视情况,该(等)容器可附带有监管医药物或生物产品的制造、使用或销售的政府机构所规定形式的公告,该公告显示政府机构已批准用于人类投与的制造、使用或销售。il-36r结合剂(例如,抗il-36r抗体)在治疗或预防免疫病症或癌症中的有效量可藉由标准临床技术来确定。另外,可视情况采用活体外分析来帮助确定最佳剂量范围。调配物中所用的确切剂量亦可取决于投与途径及免疫病症或癌症的阶段,且应根据从业医师的判断及每一患者的情况来决定。可根据得自活体外或动物模型测试系统的剂量反应曲线来推断有效剂量。通常,向患有免疫病症或表达il-36r的癌症的患者所投与的抗il-36r抗体或il-36r结合剂的剂量通常为约0.1mg/kg个体体重至约100mg/kg。向个体所投与的剂量为约0.1mg/kg个体体重至约50mg/kg、约1mg/kg至约30mg/kg、约1mg/kg至约20mg/kg、约1mg/kg至约15mg/kg或约1mg/kg至约10mg/kg。实例性剂量包括(但不限于)1ng/kg至100mg/kg。在一些实施方案中,剂量为约0.5mg/kg、约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg或约16mg/kg。该剂量可以诸如以下等频率来投与:每日、每周一次(一周一次)、每周两次、每周三次、每周四次、每周五次、每周六次、每两周一次或每月一次、每两个月一次或每三个月一次。在具体实施方案中,剂量为约0.5mg/kg/周、约1mg/kg/周、约2mg/kg/周、约3mg/kg/周、约4mg/kg/周、约5mg/kg/周、约6mg/kg/周、约7mg/kg/周、约8mg/kg/周、约9mg/kg/周、约10mg/kg/周、约11mg/kg/周、约12mg/kg/周、约13mg/kg/周、约14mg/kg/周、约15mg/kg/周或约16mg/kg/周。在一些实施方案中,剂量是在约1mg/kg/周至约15mg/kg/周范围内。在一些实施方案中,包含il-36r结合剂的医药组合物可进一步包含与该结合剂偶联或未偶联的治疗剂。抗il-36r抗体或il-36r结合剂可与一或多种用于治疗或预防免疫病症或癌症的治疗剂组合共投与。该组合疗法投与可对疾病参数(例如,症状严重程度、症状数或复发频率)产生累加或协同效应。对于组合投与的治疗方案,在一具体实施方案中,将抗il-36r抗体或il-36r结合剂与治疗剂同时投与。在另一具体实施方案中,在投与抗il-36r抗体或il-36r结合剂之前或之后投与治疗剂,即在投与抗il-36r抗体或il-36r结合剂之前或之后至少1小时且最长数月、例如至少1小时、5小时、12小时、1天、1周、1个月或3个月投与治疗剂。制品在另一方面中,包括含有可用于治疗上述病症的材料的制品。该制品包含容器及标签。适宜容器包括(例如)瓶子、小瓶、唧筒及试管。容器可自诸如玻璃或塑料等各种材料形成。容器容纳可有效治疗病状的组合物且可具有无菌存取埠。例如,容器可为静脉内溶液袋或具有皮下注射针可刺入塞子的小瓶。组合物中的活性剂是人类化抗il-36r抗体。容器上或与容器相连的卷标指示,该组合物是用于治疗所选病状。制品可进一步包含第二容器,该第二容器包含医药上可接受的缓冲液,例如磷酸盐缓冲盐水、林格氏溶液(ringer'ssolution)及右旋糖溶液。其可进一步包括自商业及用户角度考虑所期望的其它材料,包括其它缓冲液、稀释剂、过滤器、针、唧筒及写有使用说明的包装插页。本发明进一步阐述于以下实例中,该等实例不欲限制本发明的范围。本发明抗体进一步阐述于以下实例中。实例实例1:抗人类il-36r抗体的识别利用以重组方式产生的人类il-36r(ecd-细胞外结构域:基因库登录号np_003845的氨基酸20-332)蛋白质对多个小鼠菌株实施免疫,且将那些产生强力价反应者纳入传统融合瘤产生。亚克隆并重新筛选引发与人类il-36r(ecd)的强结合而不与人类il-1r1(最相关的il-1r家族成员)结合的融合产物。识别产生结合il-36r并使自il-36r的信号传导无效的单克隆抗体的多个融合瘤(参见实例2、3及4)。使用标准pcr引物组自融合瘤克隆可变结构域。代表性单克隆抗体的可变结构域及特异性cdr是如上文所述。将所有小鼠抗体转化成由于人类恒定结构域(huigg1ko/κ)上的小鼠可变结构域组成的嵌合抗体。huigg1ko(剔除(knockout))具有两个替代突变(leu234ala及leu235ala),其藉由降低效应子功能(例如fcλr及补体结合)来消除adcc及cdc活性。小鼠与嵌合抗体的可变结构域是相同的。嵌合抗体经产生来证实抗体功能并确保已获得正确的可变结构域序列。实例2:经识别小鼠抗人类il-36r抗体的分子结合亲和力a)在单一管柱纯化后使用proteon(bio-rad,hercules,ca)并使用自融合瘤产生的材料量测抗il-36r抗体与重组人类il-36r结合的动力学及结合亲和力。据估计,所有小鼠前导序列与人类il-36r在单一il-36r表面层浓度下的结合亲和力<100pm。小鼠抗体与人类il-36r在7个不同表面密度下进行的结合亲和力(整体拟合)是显示于表1中。嵌合抗il36rigg的结合等效于各自小鼠前导序列。表1:小鼠抗人类il-36r抗体的结合亲和力。b)对小鼠il-36r及人类il-1r1的分子选择性亦以100nm的浓度将小鼠及嵌合抗il-36r抗体注射于小鼠il-36r或人类il-1r1表面上。使用fortebiooctet(fortebio,menlopark,ca)量测该等抗体与小鼠il-36r及人类il-1r1的结合信号为0,此表明该等抗体选择性地与人类il-36r结合。亦在50%人类血清存在下分析抗il-36r抗体与人类il-36r的结合,且观测到血清对结合缔合速率(on-rate)无显著效应。实例3:小鼠及嵌合抗人类il-36r抗体在人类及石蟹猕猴功能分析中的效能方案:人类nci/adr-res细胞pnfκb/细胞因子释放分析试剂:r&dsystems:截短rhil36βr&dsystems:截短rhil36γr&dsystems:截短rhil36α:ma6000phospho-nfκb(ser536)全细胞溶解产物套组mesoscalediagnostics,llcmsdelisa定制人类96孔4点滴(spot)分析mesoscalediagnostics,llc将nci/adr-res细胞以45000细胞/孔平铺于96孔板中含有0.25%血清的rpmi培养基上。一板用于分析pnfκb且另一板用于细胞因子释放。然后于37℃、5%co2下将该等板培育过夜。将配体(il36α、β或γ)及抗体以4×期望浓度于血清饥饿(ss)培养基中稀释。将拮抗剂(抗体)添加至细胞中,然后添加配体。对于pnfκb:于37℃、5%co2下,将nci细胞+/-配体及拮抗剂培育1小时。然后抽吸培养基,并在冰上将细胞于100μl/孔完全溶解缓冲液中溶解30min。然后使溶解产物在4℃下以2500rpm离心20min,并转移至msdelisa板,并根据制造商的方案分析pnfκb。对于细胞因子释放:刺激后18小时-24小时,将上清液转移至msdelisa板,并根据制造商的方案分析细胞因子。方案:baf/3石蟹猕猴il-36r细胞的pnfκb(s536)msdelisa将baf/3石蟹猕猴il-36r细胞以90,000细胞/孔平铺于96孔板中的ss培养基上。将100μl培养基添加至对照孔中。以4×期望浓度稀释拮抗剂(抗体),且将50μl添加至每一孔中。将配体(il36α、β或γ)以4×期望浓度于ss培养基中稀释,且将50μl添加至每一孔中(最终体积为200μl)。于37℃、5%co2下将各板培育15min。对板进行短暂离心,抽吸培养基,并将细胞溶解于100μl/孔完全溶解缓冲液中(参见msdpnfκb方案)并在冰上培育30min。然后使溶解产物在4℃下以2500rpm离心20min,并转移至msdelisa板。然后使用如上文所述的msd套组评估溶解产物的pnfκb活性。结果:小鼠抗人类il-36r抗体在人类功能分析(pnfκb及细胞因子释放)及石蟹猕猴功能分析(pnfkb)中对于人类il-36配体的ic90结果是显示于表2中。嵌合抗人类il-36r抗体在人类功能分析(pnfκb及细胞因子释放)及石蟹猕猴功能分析(pnfκb)中对于人类il-36配体的ic90结果是显示于表3中。表2:小鼠抗体在功能细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)表3:嵌合抗体在功能细胞分析中的效能(同型对照展示在针对样品所测试的浓度下对活性无抑制)实例4:小鼠抗人类il-36r抗体与人类il-36r表达细胞的结合藉由流式细胞术的抗体结合方案使经全长人类il-36r转染的hek293细胞或nci/adr-res细胞传代24小时,然后染色。藉由用10ml存于pbs中的5mmedta冲洗来自烧瓶移除细胞,且然后在37℃下利用另外10ml的5mmedta及2.5ml的accumax培育10min,以去凝块(declump)/分散细胞。然后于pbs+2%bsa中将抗体稀释至指定浓度,并在室温下将细胞培育20min。然后藉由添加200μl的pbs来洗涤过量抗体,且然后离心。然后以50μl/孔添加第二试剂,且在室温下将细胞培育15min,且然后如上进行洗涤。将细胞重新悬浮于200μlpbs中,并藉由流式细胞术进行分析。小鼠抗人类il-36r抗体与人类il-36rhek转染子结合的结合ec50是示于表4中。表4纯系与hek-il-36r细胞结合的ec50(m)33d104.748e-01067e75.321e-01073f67.456e-01076e104.257e-01078c85.289e-01081a12.795e-01081b43.016e-01089a126.089e-010实例5:人类化il-36r抗体的产生为在人类中投与后降低潜在免疫原性,藉助设计及筛选过程使小鼠抗人类il-36r单克隆抗体81b4及73c5“人类化”。基于框架同源性、cdr结构、保守标准残基、保守接口封装残基及其它参数来选择小鼠前导序列的人类框架序列。在该等框架位置处的特异性氨基酸残基取代可相对于藉由将cdr或hvl“直接交换”至人类种是框架区中所形成的人源化抗体中所示者改良各方面抗体性能,包括结合亲和性及/或稳定性。选择与嵌合亲代fab相比显示较好或相等结合及经改良表达的fab用于进一步表征。抗体81b4及73c5的代表性人类化可变区是显示于说明书部分。以此方式,抗体b1至抗体b6是源自小鼠抗体81b4(克隆至人类igg1ko(ko=剔除)/κ骨架中)的人源化抗体。抗体b1至b6是显示于表a中。抗体c1至抗体c3是源自小鼠抗体73c5(克隆至人类igg1-ko(ko=剔除)/κ骨架中)的人源化抗体。抗体c1至c3是显示于表c中。实例6:人类化il-36r抗体的结合使用proteon(bio-rad,hercules,ca)量测人类化抗il-36r抗体与重组人类il-36r结合的动力学及结合亲和力。以5个不同表面密度使人类il-36r固定化,且使用整体拟合分析结果(参见显示三个实验的结果的表5)。经由流式细胞术使用实例4中所述方案量测人源化抗体与nci/adr-res细胞的结合(ec90值参见表5)。表5–人类化抗人类il-36r抗体的分子及细胞结合亲和力。抗体(lc+hc)kd±标准偏差(pm)ec90(nm)b1-32_138+33_4927±2.52.0b2-32_138+33_8532±5.42.3b3-32_138+33_9020±2.21.4b4-32_105+33_8535±3.71.5b5-32_105+33_9024±7.61.7b6-32_105+33_4941±4.91.7实例7:人类化抗人类il-36r抗体在人类功能分析中的效能如实例3中所述测试来自人类nci/adr-res细胞的人类化il-36r变体对信号传导的功能阻断。人类化抗人类il-36r抗体在人类功能分析(pnfκb及细胞因子释放)中对人类il-36配体的ic90结果是显示于表6中。表6:人源化抗体在人类功能nci/adr-res细胞分析中的效能[ic90(nm)](结果等于至少2个实验的平均值。同型对照展示在针对样品所测试的最高浓度下对活性无抑制)实例8:抗il-36r抗体在人类原代角化细胞功能分析中的效能方案:人类原代表皮角化细胞pnfkb/细胞因子释放分析将细胞以30,000细胞/孔平铺于96孔板中的培养基中,并在37℃、5%co2下培育过夜。然后如实例3中所述实施分析。结果:小鼠、嵌合及人类化抗il-36r抗体在人类原代角化细胞分析(pnfkb及il-8释放)中经人类il-36配体刺激的ic90结果分别显示于中表7、表8及表9中。表7(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)nhk33d1073c573f678c881a181b4pnfκbtrun-il-36aic90(nm)1.810.78.211.6nd1.3trun-il-36bic90(nm)2.314.45.214.2nd1.1trun-il-36gic90(nm)0.81.71.310.6nd0.5il-8trun-il-36aic90(nm)1.520.817.819.3nd0.7trun-il-36bic90(nm)3.0462634nd1.2trun-il-36gic90(nm)0.82.42.13.6nd0.5表8:嵌合抗il-36r抗体在原代人类角化细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)nhkc73c5c81a1c81b4pnfκbtrun-il-36aic90(nm)20.5nd1.4trun-il-36bic90(nm)8.37.11.8trun-il-36gic90(nm)1.4nd0.5il-8trun-il-36aic90(nm)29.723.41.2trun-il-36bic90(nm)49.38711.1trun-il-36gic90(nm)3.61.20.3表9:人类化抗il-36r抗体在原代人类角化细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)nhkbi1bi2bi3pnfκbtrun-il-36aic90(nm)2.92.12.2trun-il-36bic90(nm)3.62.91.9trun-il-36gic90(nm)1.01.30.7il-8trun-il-36aic90(nm)2.32.81.8trun-il-36bic90(nm)3.94.13.5trun-il-36gic90(nm)0.80.80.8实例9抗il-36r抗体在人类原代肠上皮细胞功能分析中的效能方案:人类原代肠上皮细胞pnfkb/细胞因子释放分析将细胞以30,000细胞/孔平铺于96孔板中的培养基中,并在37℃、5%co2下培育过夜。然后如实例3中所述实施分析。结果:小鼠抗il-36r抗体在经人类il-36配体刺激的人类原代肠上皮细胞分析(pnfkb及il-8释放)中的ic90结果是显示于表10中。表10:小鼠抗il-36r抗体在原代人类肠上皮细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)hie73c581b4pnfκbtrun-il-36aic90(nm)211.3trun-il-36bic90(nm)207.4trun-il-36gic90(nm)329.5il-8trun-il-36aic90(nm)1235.8trun-il-36bic90(nm)1549.8trun-il-36gic90(nm)nd16实例10:抗il-36r抗体在人类原代肠成肌纤维细胞功能分析中的效能方案:人类原代肠成肌纤维细胞pnfκb/细胞因子释放分析将细胞以30,000细胞/孔平铺于96孔板中的培养基中,并在37℃、5%co2下培育。然后如实例3中所述实施分析。结果:抗il-36r抗体在经人类il-36配体刺激的人类原代肠成肌纤维细胞分析(pnfkb及il-8释放)中的ic90结果是显示于表11及表12中。表11:小鼠及嵌合抗il-36r抗体在原代人类肠成肌纤维细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)him81b4c81b4pnfκbtrun-il-36aic90(nm)76.2trun-il-36bic90(nm)42.3trun-il-36gic90(nm)3.60.9il-8trun-il-36aic90(nm)22.3trun-il-36bic90(nm)2.31.4trun-il-36gic90(nm)2.92表12:人类化抗il-36r抗体在原代人类肠成肌纤维细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)实例11:抗il-36r抗体在人类原代真皮成纤维细胞功能分析中的效能方案:人类原代真皮成纤维细胞pnfκb/细胞因子释放分析将细胞以30,000细胞/孔平铺于96孔板中的培养基中,并在37℃、5%co2下培育过夜。然后如实例3中所述实施分析。结果:抗il-36r抗体在经人类il-36配体刺激的人类原代真皮成纤维细胞分析(pnfkb及il-8释放)中的ic90结果是显示于表13及表14中。表13:小鼠及嵌合抗il-36r抗体在原代人类真皮成纤维细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)hdf81b4c81b4pnfκbtrun-il-36aic90(nm)1.91.8trun-il-36bic90(nm)4.93.4trun-il-36gic90(nm)3.97.4il-8trun-il-36aic90(nm)0.90.6trun-il-36bic90(nm)0.40.5trun-il-36gic90(nm)0.40.3表14:人类化抗il-36r抗体在原代人类真皮成纤维细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)hdfb3b5b6pnfκbtrun-il-36aic90(nm)6.410.23.8trun-il-36bic90(nm)13.59.99trun-il-36gic90(nm)108.616.8il-8trun-il-36aic90(nm)2.11.51.4trun-il-36bic90(nm)1.31.21trun-il-36gic90(nm)1.11.10.7实例12:小鼠抗il-36r抗体在人类原代近端肾小管细胞功能分析中的效能方案:人类原代近端肾小管细胞pnfkb/细胞因子释放分析将细胞以5,000细胞/孔平铺于96孔板中的培养基中,并在37℃、5%co2下培育过夜。如实例3中所述实施分析。结果:小鼠、嵌合及人类化抗il-36r抗体在经人类il-36配体刺激的人类原代近端肾小管细胞分析(il-8释放)中的ic90结果是显示于表15中。表15:小鼠及人类抗il-36r抗体在原代人类近端肾小管细胞分析中的效能(同型对照展示在针对样品所测试的最高浓度下对活性无抑制)hpt81b4b3b5b6il-8trun-il-36aic90(nm).04nd5ndtrun-il-36bic90(nm).01nd5ndtrun-il-36gic90(nm).04nd3nd实例13:对自经il-36γ刺激的经重构人类表皮产生il-8的抑制方案:经重构表皮将抗il-36r抗体(1.5μg/ml)与经重构人类表皮一起预培育并利用人类重组il-36γ(20ng/ml)进行刺激。使用重组人类il-1β(20ng/ml;r&dsystems)作为阳性对照。培养24小时的后,收集细胞上清液并分析il-8(对il-8的分析是如实例3中所述)。以一式三份测试样品,且平均pg/ml±标准误差是显示于下表中(表16)。表16实例14:对经重构人类表皮中经il-36配体诱导的s100a7及s100a12基因表达的抑制用激动性il-36配体刺激重构人类表皮诱导s100a7及s100a12基因表达。s100a7及s100a12是位于表皮分化复合体内的基因。方案:将经重构人类表皮与抗il-36r抗体(1.5μg/ml)一起培育并利用人类重组il-36γ(20ng/ml)进行刺激。使用重组人类il-1β(20ng/ml;r&dsystems)作为阳性对照。在5%co2及37℃下培养24小时后,自经重构人类表皮分离rna并藉由实时逆转录酶-聚合酶链反应分析基因表达。使用2-δδct方法计算相对表达。以一式三份测试样品,且平均表达±标准误差是显示于下表中(表17)。表17实例15:抗il-36r抗体在牛皮癣的异种移植模型中的效力方案:24个由皮肤科医生临床诊断的牛皮癣患者获得血液及非损伤皮肤活检。将皮肤活检移植于免疫缺陷型nih-iii小鼠上并使其植入4周至5周的时间。在活检时自收集自每一捐献者的血液分离外周单核细胞(pbmc),以供真皮内注射至植入皮肤中。在注射的前,利用1μg/ml葡萄球菌肠毒素b(toxintechnologies,florida,usa)及80u/ml人类重组il-2(peprotech有限公司,oosterhout,thenetherlands)刺激pbmc。将自体pbmc与存于pbs中的7.5×10^5细胞一起经真皮内注射,以使对皮肤发炎及牛皮癣表现型的诱导同时发生。注射细胞后三周,自小鼠取回活检并藉由组织学进行分析。对所有群组的冷冻保藏皮肤组织实施组织学染色。如图4中所述制备覆盖所有皮肤层的对角线剖面(8μm)。为评估表皮厚度,自活检中心随机选择两个非连续切片并利用苏木精-曙红染色。随后,在100倍放大率下评估切片。在活检的整个长度中,在两个切片中使用olympusdp71相机及cell^d成像软件(v2.7,munster,germany)量测脊长度。脊长度是定义为:介于颗粒层的上边缘与脊的底部之间的距离。随机且在不知情的情况下对活检评分。每一治疗群组的平均表皮厚度及最大表皮厚度的结果是显示于表18中。每一治疗群组表皮厚度的净变化的结果是显示于表19中。表18表19实例16:野生型及白介素-1受体样2纯合剔除小鼠中3周香烟烟雾暴露后的亚慢性肺发炎方案:使野生型或白介素-1受体样2小鼠暴露于香烟烟雾中3周以诱导肺窘迫。第1周及第2周是由5个连续暴露日组成,而在第3周期间使小鼠连续暴露4天。每天使小鼠暴露于5支香烟中,其中香烟暴露(16分钟)与新鲜空气(8分钟)的间隔为24分钟。最后一次暴露的后18小时,用2×0.8ml的汉克氏盐溶液(hank'ssaltsolution,0.6mmedta)灌洗小鼠。离心10分钟后,自支气管肺泡灌洗液收集上清液及细胞沉淀。每一暴露群组的支气管肺泡灌洗液中总的巨噬细胞及嗜中性细胞计数是显示于表20中。表20综上所述,本申请包括但不限于以下技术项:1.一种抗il-36r抗体或其抗原结合片段,其以等于或<0.1nm之kd与人类il-36r结合。2.如技术项1的抗il-36r抗体或其抗原结合片段,其中该抗体或抗原结合片段是单克隆抗体或其抗原结合片段。3.如技术项1和/或2的抗il-36r抗体或其抗原结合片段,其中该抗体或抗原结合片段是人源化抗体或其抗原结合片段。4.如技术项1至3任一项的抗il-36r抗体或其抗原结合片段,其以等于或<50pm的kd与人类il-36r结合。5.如技术项1至4任一项的抗il-36r抗体或其抗原结合片段,其不与人类il-1r1结合。6.如技术项1至5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:35、102、103、104、105、106或140(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。7.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:102(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。8.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:103(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。9.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:104(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。10.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:105(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。11.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:106(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。12.如技术项6的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:140(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62、108、109、110或111(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。13.如技术项1至5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含seqidno:76、77、78、79、80、81、82或83中任一者的氨基酸序列的轻链可变区;及包含seqidno:87、88、89、90、91、92、93、94或95中任一者的氨基酸序列的重链可变区。14.如技术项13的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:87的重链可变区;或包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:88的重链可变区;或包含氨基酸序列seqidno:77的轻链可变区;及包含氨基酸序列seqidno:89的重链可变区。15.如技术项13的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:87的重链可变区;或包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:88的重链可变区;或包含氨基酸序列seqidno:80的轻链可变区;及包含氨基酸序列seqidno:89的重链可变区。16.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:63或64(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。17.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含seqidno:84、85或86中任一者的氨基酸序列的轻链可变区;及包含seqidno:96、97、98、99、100或101中任一者的氨基酸序列的重链可变区。18.如技术项17的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含该氨基酸序列seqidno:85的轻链可变区;及包含该氨基酸序列seqidno:100的重链可变区;或包含氨基酸序列seqidno:85的轻链可变区;及包含氨基酸序列seqidno:101的重链可变区。19.如技术项17的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:86的轻链可变区;及包含氨基酸序列seqidno:100的重链可变区;或包含氨基酸序列seqidno:86的轻链可变区;及包含氨基酸序列seqidno:101的重链可变区。20.如技术项1-5任一项的抗il-36r抗体,其中该抗体包含:包含seqidno:114、115、116、117、118、119、120或121中任一者的氨基酸序列的轻链;及包含seqidno:125、126、127、128、129、130、131、132或133中任一者的氨基酸序列的重链。21.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:125的重链。22.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:126的重链。23.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:115的轻链;及包含氨基酸序列seqidno:127的重链。24.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:125的重链。25.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:126的重链。26.如技术项20的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:127的重链。27.如技术项1-5任一项的抗il-36r抗体,其中该抗体包含:包含seqidno:122、123或124中任一者的氨基酸序列的轻链;及包含seqidno:134、135、136、137、138或139中任一者的氨基酸序列的重链。28.如技术项27的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:138的重链。29.如技术项27的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:123的轻链;及包含氨基酸序列seqidno:139的重链。30.如技术项27的抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:124的轻链;及包含氨基酸序列seqidno:138的重链。31.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:103(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。32.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:104(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3)。33.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。34.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:a)轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及b)重链可变区,其包含氨基酸序列seqidno:107(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3)。35.如技术项1-5的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:轻链可变区,其包含氨基酸序列seqidno:21(l-cdr1);氨基酸序列seqidno:30(l-cdr2);氨基酸序列seqidno:39(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:48(h-cdr1);氨基酸序列seqidno:57(h-cdr2);氨基酸序列seqidno:67(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:22(l-cdr1);氨基酸序列seqidno:31(l-cdr2);氨基酸序列seqidno:40(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:49(h-cdr1);氨基酸序列seqidno:58(h-cdr2);氨基酸序列seqidno:68(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:23(l-cdr1);氨基酸序列seqidno:32(l-cdr2);氨基酸序列seqidno:41(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:50(h-cdr1);氨基酸序列seqidno:59(h-cdr2);氨基酸序列seqidno:69(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:24(l-cdr1);氨基酸序列seqidno:33(l-cdr2);氨基酸序列seqidno:42(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:51(h-cdr1);氨基酸序列seqidno:60(h-cdr2);氨基酸序列seqidno:70(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:25(l-cdr1);氨基酸序列seqidno:34(l-cdr2);氨基酸序列seqidno:43(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:52(h-cdr1);氨基酸序列seqidno:61(h-cdr2);氨基酸序列seqidno:71(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:26(l-cdr1);氨基酸序列seqidno:35(l-cdr2);氨基酸序列seqidno:44(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:53(h-cdr1);氨基酸序列seqidno:62(h-cdr2);氨基酸序列seqidno:72(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:63(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:27(l-cdr1);氨基酸序列seqidno:36(l-cdr2);氨基酸序列seqidno:45(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:54(h-cdr1);氨基酸序列seqidno:64(h-cdr2);氨基酸序列seqidno:73(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:28(l-cdr1);氨基酸序列seqidno:37(l-cdr2);氨基酸序列seqidno:46(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:55(h-cdr1);氨基酸序列seqidno:65(h-cdr2);氨基酸序列seqidno:74(h-cdr3);或轻链可变区,其包含氨基酸序列seqidno:29(l-cdr1);氨基酸序列seqidno:38(l-cdr2);氨基酸序列seqidno:47(l-cdr3);及重链可变区,其包含氨基酸序列seqidno:56(h-cdr1);氨基酸序列seqidno:66(h-cdr2);氨基酸序列seqidno:75(h-cdr3)。36.如技术项1-5任一项的抗il-36r抗体或其抗原结合片段,其中该抗体或其抗原结合片段包含:包含氨基酸序列seqidno:1的轻链蛋白质;及包含氨基酸序列seqidno:11的重链蛋白质;或包含氨基酸序列seqidno:2的轻链蛋白质;及包含氨基酸序列seqidno:12的重链蛋白质;或包含氨基酸序列seqidno:3的轻链蛋白质;及包含氨基酸序列seqidno:13的重链蛋白质;或包含氨基酸序列seqidno:4的轻链蛋白质;及包含氨基酸序列seqidno:14的重链蛋白质;或包含氨基酸序列seqidno:5的轻链蛋白质;及包含氨基酸序列seqidno:15的重链蛋白质;或包含氨基酸序列seqidno:6的轻链蛋白质;及包含氨基酸序列seqidno:16的重链蛋白质;或包含氨基酸序列seqidno:7的轻链蛋白质;及包含氨基酸序列seqidno:17的重链蛋白质;或包含氨基酸序列seqidno:8的轻链蛋白质;及包含氨基酸序列seqidno:18的重链蛋白质;或包含氨基酸序列seqidno:9的轻链蛋白质;及包含氨基酸序列seqidno:19的重链蛋白质;或包含氨基酸序列seqidno:10的轻链蛋白质;及包含氨基酸序列seqidno:20的重链蛋白质。37.一种药物组合物,包含技术项1-36任一项的抗体或其抗原结合片段,以及药学可接受的载体。38.技术项1-36任一项的抗体或其抗原可结合片段,或技术项37的药物组合物,用于医学中。39.技术项38的抗体或其抗原可结合片段或药物组合物,其中该于医学中的用途是在治疗炎症疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性或癌症的方法中的用途。40.如技术项38或39的抗体或其抗原结合片段或药物组合物,其中该于医学中的用途是在治疗牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘或关节粘连性脊椎炎的方法中的用途。41.如技术项38-40任一项的抗体或其抗原结合片段或药物组合物,其中该于医学中的用途是在治疗发炎性肠疾病的方法中的用途。42.如技术项38-41任一项的抗体或其抗原结合片段或药物组合物,其中该于医学中的用途是在治疗克隆氏病(crohn'sdisease)的方法中的用途。43.一种治疗疾病的方法,包括给药有此需要的患者技术项1-36任一项的抗体或其抗原结合片段或技术项38的药物组合物,其中所述疾病选自:炎症疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性和癌症。44.如技术项43的方法,其中所述疾病选自:牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘和关节粘连性脊椎炎。45.如技术项43和/或44的方法,其中所述疾病是克隆氏病。46.一种分离的多核苷酸,其包含编码如技术项1至36中任一技术项的抗il-36r抗体或其抗原结合片段的序列,较佳为dna或rna序列。47.如技术项46的分离的多核苷酸,其编码如seqidno.1至140中的一或多者所定义的序列。48.一种载体,其包含如技术项46和/或47的多核苷酸,较佳为表达载体,更佳为包含本发明的多核苷酸与表达控制序列功能联结的载体。49.一种宿主细胞,其包含如技术项46和/或47的多核苷酸和/或如技术项48的载体。50.一种制造如技术项1至36中任一技术项或多技术项的抗il-36r抗体或其抗原结合片段的方法,较佳为重组制造方法,包含使用如技术项46和/或47的多核苷酸、和/或如技术项48的载体和/或如技术项49的宿主细胞。51.如技术项50的方法,其包含以下步骤:(a)该宿主细胞在允许表现该抗il-36r抗体或抗原结合片段的条件下培养,及(b)回收该抗il-36r抗体或抗原结合片段。52.一种诊断套组或诊断方法,包含如技术项1至36中任一技术项的抗il-36r抗体或其抗原结合片段,或使用如技术项1至36中任一技术项的抗il-36r抗体或其抗原结合片段。53.如技术项52的诊断套组或诊断方法,其用于诊断炎症疾病、自体免疫疾病、呼吸疾病、代谢病症、上皮介导的发炎病症、纤维变性、癌症、牛皮癣、发炎性肠疾病、牛皮癣性关节炎、多发性硬化症、类风湿性关节炎、copd、慢性气喘、关节粘连性脊椎炎或克隆氏病。54.一种抗il-36r抗体,其中该抗体包含:包含氨基酸序列seqidno:118的轻链;及包含氨基酸序列seqidno:127的重链。55.一种药物组合物,包含技术项54的抗体,以及药学可接受的载体。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1