抗‑CD19类美登素免疫缀合物抗体在治疗B‑细胞恶性肿瘤症状中的用途的制作方法
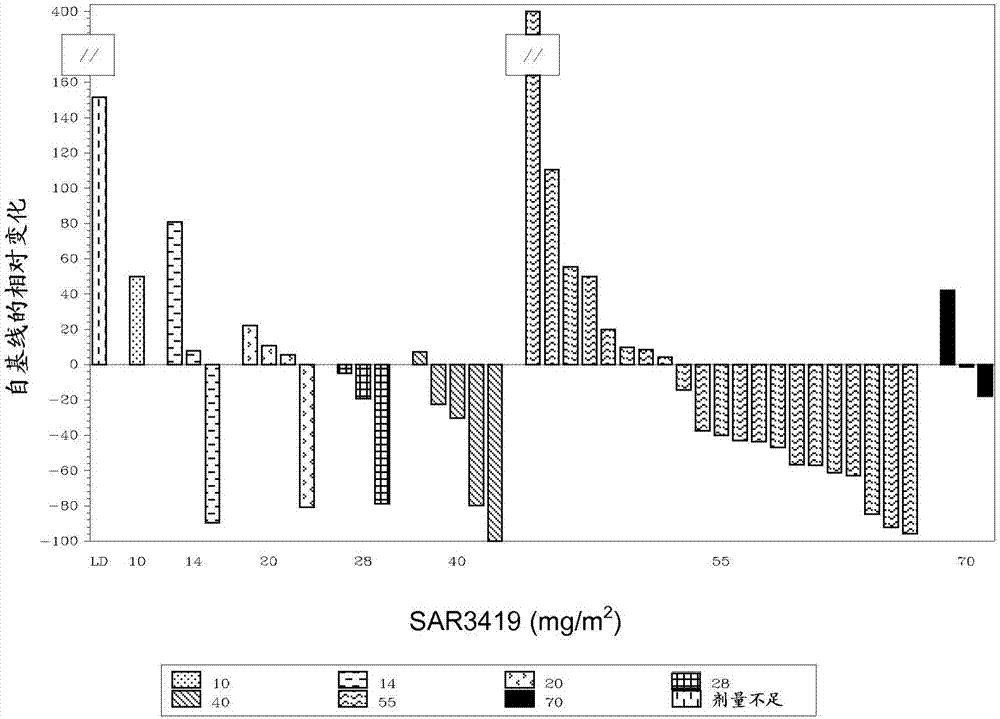
本申请是申请日为2012年5月16日、中国申请号为201280023918.7、发明名称为“抗-cd19类美登素免疫缀合物抗体在治疗b-细胞恶性肿瘤症状中的用途”的发明申请的分案申请。发明领域本发明涉及抗-cd19类美登素(maytansinoid)免疫缀合物在治疗b-细胞恶性肿瘤症状中的用途。发明背景b细胞表达的细胞表面分子及其恶性对应物(counterpart)是免疫疗法的重要靶标。cd19是b淋巴细胞谱系最早的分化抗原,其在大多数b细胞中表达,但在浆细胞、干细胞中或在正常骨髓谱系中未检测到。因此,cd19在来自所有b细胞来源的瘤(b细胞非何杰金氏淋巴瘤、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病)的肿瘤细胞中表达,除了骨髓瘤。b-细胞非何杰金氏淋巴瘤(b-nhl)是美国第五大最常见的恶性肿瘤,而且发病率持续增长,尤其在老年患者中。尽管患有血液恶性肿瘤的患者在过去十年期间已从使用常规药物疗法的治疗优化中受益,但大部分患者仍死于他们的疾病,并且药物疗法仍有高毒性。因此,未来对开发新的疗法以提高淋巴瘤患者的存活率和生活质量的努力必须包括特异性靶向癌细胞并且显示改进的安全性和功效的策略。hub4-dm4是由特异性靶向cd19抗原的人源化igg1单克隆抗体hub4构成的抗体药物缀合物,hub4通过二硫键与类美登素衍生物dm4(一种有效的微管蛋白抑制剂)缀合。hub4-dm4缀合物sar3419的结构在图1中公开,而且抗体的重链和轻链的序列在所附的序列表中列出,所述轻链具有seqidno.7所示的序列,所述重链具有seqidno.8所示的序列。在与cd19抗原结合后,hub4-dm4缀合物经过内化和细胞内释放dm4。在首次用于人体的研究ted6828中,测试了7个剂量水平(10mg/m2-270mg/m2)的hub4-dm4缀合物sar3419,将该缀合物每3周一次持续6个周期(n=39)iv给予具有难治性/复发性cd19+nhl的患者。最大耐受剂量(mtd)是每3周160mg/m2。剂量限制性毒性是可逆的角膜毒性。最常见的药物相关毒性是眼睛的(所有等级),其在43.5%的患者中观察到,其中15.4%是3级/4级。主要由与角膜上皮上的微囊沉积有关的视力模糊组成的毒性(角膜毒性)在所有病例中是可逆的。该试验的初步结果已发表在ash2009(younes等人ashannualmeetingabstracts,2009,114(22):585)的摘要中。目前已发现,有可能减轻毒性、特别是眼睛毒性,其由通过使用另一剂量方案给予hub4-dm4缀合物的hub4-dm4缀合物治疗引起。此外还显示,缀合物sar3419允许治疗具有b-细胞非何杰金氏淋巴瘤、特别是扩散性大b-细胞淋巴瘤(dlbcl)的患者。技术实现要素:本发明涉及本文公开的方法、组合物和制品(article)。一方面,本发明提供在需要治疗的患者中治疗cd19+b-细胞恶性肿瘤症状的方法,所述方法包括给予所述患者治疗有效量的抗-cd19类美登素免疫缀合物。在一个具体的实施方案中,所述方法包括用减轻由治疗引起的眼睛毒性的剂量方案,给予所述患者治疗有效量的抗-cd19类美登素免疫缀合物。在一个实施方案中,该毒性由用hub4-dm4缀合物的治疗引起。在该方法另一具体的实施方案中,与眼睛相关的不良事件(所有等级)的发生率低于40%。在该方法另一具体的实施方案中,3或4级与眼睛相关的不良事件的发生率低于13%。该方法是安全和有效的。尽管本发明主要涉及在需要治疗的患者中治疗cd19+b-细胞恶性肿瘤症状,但无论细胞内cd19表达水平如何,亦可治疗b-细胞恶性肿瘤症状。因此,另一方面本发明提供在需要治疗的患者中治疗b-细胞恶性肿瘤症状的方法,所述方法包括给予所述患者治疗有效量的抗-cd19类美登素免疫缀合物。这些治疗的方法可包括给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物的步骤,以及给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物的步骤,其中后续剂量在时间上彼此分开约1周。在本方法的一个具体实施方案中,给予初始剂量后,接着给予至少6次在时间上彼此分开约1周的剂量。在另一实施方案中,初始剂量后,接着给予至少7次或8次在时间上彼此分开约1周的剂量。在本方法另一具体的实施方案中,给予初始剂量,接着给予6-14次在时间上彼此分开约1周的剂量。在另一实施方案中,给予初始剂量后,接着给予7-13次剂量或8-12次剂量。因此,在该具体的实施方案中,所述方法包括以下步骤:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;和给予患者至少6次约55mg/m2后续剂量的抗-cd19美登素免疫缀合物,所述后续剂量在时间上彼此分开约1周。该治疗方法可包括以下进一步的步骤:给予约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,其中所述剂量在时间上彼此分开约2周。在本方法该具体的实施方案中,给予初始剂量后,接着给予至少3次在时间上彼此分开约1周的剂量,然后给予至少3次在时间上彼此分开约2周的剂量。在本申请中,该实施方案通常称为每周1次/每两周1次(2weekly)或qw/q2w,或者甚至称为最佳计划(optimizedschedule)。因此,在该具体的实施方案中,所述方法包括以下步骤:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;给予患者至少3次在时间上彼此分开约1周的约55mg/m2后继剂量的抗-cd19类美登素免疫缀合物;和给予患者至少3次在时间上彼此分开约2周的约55mg/m2后继剂量的抗-cd19类美登素免疫缀合物。cd19+b-细胞恶性肿瘤定义为表达cd19细胞表面抗原的任何恶性肿瘤。所述cd19+b-细胞恶性肿瘤症状可以是白血病症状例如急性成淋巴细胞性白血病(all)症状或淋巴瘤症状例如非何杰金氏淋巴瘤(nhl)症状。非何杰金氏淋巴瘤症状可以是扩散性大b-细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)、套细胞淋巴瘤(mcl)、边缘区淋巴瘤(mzl)、小淋巴细胞性淋巴瘤(sll)或沃尔登斯特伦巨球蛋白血症(macroglobulinemia,wm)。在本方法的一个具体的实施方案中,所述非何杰金氏淋巴瘤症状是复发性或难治性b-细胞非何杰金氏淋巴瘤。在本方法的另一具体的实施方案中,所述非何杰金氏淋巴瘤症状是表达cd19的b-细胞非何杰金氏淋巴瘤。在本方法的另一具体的实施方案中,已针对非何杰金氏淋巴瘤症状治疗所述患者。特别是所述患者可能经过失败的疗法,特别是化学疗法或利妥昔单抗疗法。在本方法的另一具体的实施方案中,所述非何杰金氏淋巴瘤症状是利妥昔单抗抗性疾病。在本方法的另一具体的实施方案中,所述患者接受过自体或同种异体干细胞移植。在本方法的一个具体的实施方案中,所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体与dm4缀合。与cd19抗原特异性结合的抗体可通过可裂解的接头(特别是4-(2-吡啶基二硫)丁酸n-琥珀酰亚胺酯(spdb)接头)与dm4缀合。在本方法的一个具体的实施方案中,抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体通过spdb与dm4缀合,其中约3.5个dm4分子通过spdb接头与每个hub4分子结合。在一个具体的实施方案中,抗-cd19类美登素免疫缀合物具有下式:在一个实施方案中,所述抗体包含6个互补决定区(cdr),所述cdr具有seqidno1-6所示的序列。在另一实施方案中,抗体包含轻链,其中所述轻链的序列与seqidno.7所示序列具有至少60%、至少75%、至少85%、至少95%或至少99%的同一性。在又一实施方案中,抗体包含重链,其中所述重链的序列与seqidno.8所示序列具有至少60%、至少75%、至少85%、至少95%或至少99%的同一性。在另一实施方案中,本发明的抗体是roguska等人(proc.natl.acad.sci.usa,91:969-973,1994)所述的人源化抗体hub4。本发明的抗体hub4包含轻链和重链,所述轻链具有seqidno.7所示的序列,并且所述重链具有seqidno.8所示的序列。在一个具体的实施方案中,所述缀合物是hub4-dm4缀合物。一方面,本发明提供抗-cd19类美登素免疫缀合物,其用于使用包括以下步骤的方法来治疗诊断为具有cd19+b-细胞恶性肿瘤症状的人类患者:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;和给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,其中所述后续剂量在时间上彼此分开1周。一方面,本发明提供抗-cd19类美登素免疫缀合物,其用于使用包括以下步骤的方法来治疗诊断为具有cd19+b-细胞恶性肿瘤症状的人类患者:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;然后给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开1周;并且在进一步的步骤中给予多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开2周。另一方面,本发明提供制品,其包含:包装材料;抗-cd19类美登素免疫缀合物;和包含在所述包装材料内的标签或包装说明书(packageinsert),其指示将所述抗-cd19类美登素免疫缀合物按以下给予患者:约55mg/m2的初始剂量,和多次约55mg/m2的量的后续剂量,所述后续剂量在时间上彼此分开1周。另一方面,本发明提供制品,其包含:包装材料;抗-cd19类美登素免疫缀合物;和包含在所述包装材料内的标签或包装说明书,其指示将所述抗-cd19类美登素免疫缀合物按以下给予患者:约55mg/m2的初始剂量,然后多次约55mg/m2的量的后续剂量(所述后续剂量在时间上彼此分开1周),然后多次约55mg/m2的量的后续剂量(所述后续剂量在时间上彼此分开2周)。一方面,本发明提供制品,其包含:包装材料;抗-cd19类美登素免疫缀合物;和包含在所述包装材料内的标签或包装说明书,其指示将所述抗-cd19类美登素免疫缀合物以约55mg/m2的剂量给予患者,以使毒性(例如晚期毒性和累积毒性)风险、特别是眼睛毒性风险最小。这样的包装材料指示将所述抗-cd19类美登素免疫缀合物以约55mg/m2的剂量(4次在时间上彼此分开1周的剂量,然后4次在时间上彼此分开2周的后续剂量)给予患者以限制药物蓄积,所述蓄积被认为(至少部分认为)是毒性(例如角膜毒性、末梢感觉神经病和感觉异常)累积或所述毒性的严重性增加的原因。在一个具体的实施方案中,包含在所述包装材料中的标签或包装说明书指示,眼睛相关不良事件(所有级别)的发生率低于40%、30%或25%。在一个具体的实施方案中,包含在所述包装材料中的标签或包装说明书指示,眼睛相关不良事件(3级/4级)的发生率低于13%、10%或5%。眼睛毒性的特征在于患者中所观察到的眼睛病症。眼睛病症在由u.s.departmentofhealthandhumanservices于2009年5月28日出版的题目为“不良事件的通用技术标准(ctcae)”的文献(3.0版)中定义,本领域技术人员可参考该文献。按照该文献,眼睛病症根据不良事件(ae)进行分类,所述ae根据它们的严重性分级。基于该通用准则,ctcae显示1级至5级,对每个ae的严重性具有独特临床描述:1级轻微;无症状或轻微症状;仅临床或诊断观察;无需干预。2级中等;需要最小限度、局部或非入侵干预;限制性合适年龄的工具性日常生活活动(adl)。3级严重或医学上明显但不立即威胁生命;需要住院或延长住院;丧失能力;限制性自身护理adl。4级威胁生命的后果;需要紧急干预。5级与ae相关的死亡。抗-cd19类美登素免疫缀合物可在药物组合物中给予,所述药物组合物包含:有效量的抗-cd19类美登素免疫缀合物;和药学上可接受的载体,其可以是惰性的或具有生理学活性。本文所用的“药学上可接受的载体”包括任何以及所有的溶剂、分散介质、包衣、抗细菌和抗真菌剂等等,它们是生理学上相容的。合适的载体、稀释液和/或赋形剂的实例包括以下的一种或多种:水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等及其组合。在许多情况下,优选在组合物中包含等渗剂,例如糖、多元醇或氯化钠。具体而言,合适载体的相关实例包括:(1)dulbecco磷酸盐缓冲盐水,ph~7.4,包含或不包含约1mg/ml至25mg/ml人血清白蛋白;(2)0.9%盐水(0.9%w/v氯化钠(nacl));和(3)5%(w/v)葡萄糖;并且还可包含抗氧化剂例如色胺和稳定剂例如tween20。在另一实施方案中,抗-cd19类美登素免疫缀合物经静脉内给予。然而可使用其他胃肠外给予方式:即,肌内、腹膜内或皮下。当抗-cd19类美登素免疫缀合物经静脉内给予时,其可以推注给予或在一段时间内持续输注给予,所述时间通常包括在10分钟和4小时之间。在另一实施方案中,它们通过肌内、皮下、关节内、滑膜内、瘤内、瘤周围、病灶内或病灶周围途径注射,以产生局部和全身治疗效果。它们还可通过喷雾给予。抗-cd19类美登素免疫缀合物可以多种形式给予。这些形式包括例如液体、半固体和固体剂型,但所述形式依赖于预期的给药方式和治疗应用。典型的组合物为可注射或输注的溶液形式。用于胃肠外给予的无菌组合物可通过以下制备:将所需量的抗-cd19类美登素免疫缀合物掺入到合适的溶剂中,然后通过微量过滤进行灭菌。作为溶剂或溶媒,可使用水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等以及其组合。在许多情况下,在组合物中优选包含等渗剂例如糖、多元醇或氯化钠。这些组合物还可包含辅剂,特别是湿润剂、等渗剂、乳化剂、分散剂和稳定剂。用于胃肠外给予的无菌组合物还可制备成无菌固体组合物的形式,其可在使用时溶解于无菌水或任何其他可注射的无菌介质。抗-cd19类美登素免疫缀合物可与所治疗的具体病症必需的另外治疗剂例如化学治疗剂一起给予。优选地,抗-cd19类美登素免疫缀合物和补充的活性剂具有互补的活性,其并没有不利的互相影响。这样的化学治疗剂可同时、半同时、单独或隔开一段时间给予,以获得共给予的最大功效;对于每次给予,有可能改变其持续时间,从快速给予变成持续灌注。本领域技术人员可具体参考ep1651162以实施本发明。本申请涉及下述实施方案。1.一种在需要治疗的患者中治疗cd19+b-细胞恶性肿瘤症状的方法,所述方法包括给予所述患者治疗有效量的抗-cd19类美登素免疫缀合物。2.实施方案1的方法,其中所述免疫缀合物用减轻由治疗所引起的毒性的剂量方案给予。3.实施方案1和2中任一项的方法,其中所述毒性为导致眼睛相关不良事件的眼睛毒性。4.实施方案3的方法,其中所有级别的眼睛相关不良事件的发生率低于40%。5.实施方案3的方法,其中3级或4级眼睛相关不良事件的发生率低于13%。6.一种在需要治疗的患者中治疗cd19+b-细胞恶性肿瘤症状的方法,所述方法包括以下步骤:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;和给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,其中所述后续剂量在时间上彼此分开约1周。7.实施方案6的方法,其中给予初始剂量后,接着给予至少6次在时间上彼此分开约1周的剂量。8.实施方案6和7中任一项的方法,其中给予初始剂量后,接着给予6-14次在时间上彼此分开约1周的剂量。9.实施方案6和7中任一项的方法,其中所述方法包括以下步骤:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;和给予患者至少6次约55mg/m2后续剂量的抗-cd19,所述后续剂量在时间上彼此分开约1周。10.实施方案6的方法,其中所述方法包括以下进一步的步骤:给予约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,其中所述剂量在时间上彼此分开约2周。11.实施方案6和10中任一项的方法,其中所述方法包括以下步骤:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;给予患者至少3次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开约1周;和给予患者至少3次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开约2周。12.实施方案1-11中任一项的方法,其中所述cd19+b-细胞恶性肿瘤症状为白血病症状或淋巴瘤症状。13.实施方案12的方法,其中所述白血病症状为非何杰金氏淋巴瘤(nhl)症状。14.实施方案12的方法,其中所述淋巴瘤症状是急性成淋巴细胞性白血病(all)症状。15.实施方案13的方法,其中所述非何杰金氏淋巴瘤症状是扩散性大b-细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)、套细胞淋巴瘤(mcl)、边缘区淋巴瘤(mzl)、小淋巴细胞性淋巴瘤(sll)或沃尔登斯特伦巨球蛋白血症(wm)。16.实施方案13的方法,其中所述非何杰金氏淋巴瘤症状为复发性或难治性b-细胞非何杰金氏淋巴瘤。17.实施方案13的方法,其中所述非何杰金氏淋巴瘤症状为表达cd19的b-细胞非何杰金氏淋巴瘤。18.实施方案13的方法,其中已针对非何杰金氏淋巴瘤症状治疗所述患者。19.实施方案13的方法,其中所述患者的利妥昔单抗疗法失败。20.实施方案13的方法,其中所述非何杰金氏淋巴瘤症状为利妥昔单抗抗性疾病。21.实施方案13的方法,其中所述患者已接受自体或同种异体干细胞移植。22.实施方案1-21中任一项的方法,其中所述抗-cd19类美登素免疫缀合物经静脉内给予。23.实施方案1-22中任一项的方法,所述方法是安全和有效的。24.实施方案1-23中任一项的方法,所述方法还包括同时或贯序给予有效量的化学治疗剂。25.实施方案1-24中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体与类美登素家族的细胞毒素缀合。26.实施方案1-25中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体与dm4缀合。27.实施方案1-26中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体通过可裂解的接头与dm4缀合。28.实施方案1-27中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体通过spdb与dm4缀合。29.实施方案1-28中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含与cd19抗原特异性结合的抗体,所述抗体通过spdb与dm4缀合,其中约3.5个分子的dm4通过spdb接头与每个hub4分子结合。30.实施方案1-29中任一项的方法,其中所述抗-cd19类美登素免疫缀合物具有下式:31.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含抗体,并且所述抗体包含6个互补决定区(cdr),所述cdr具有seqidno1-6所示的序列。32.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含抗体,并且所述抗体包含轻链,其中所述轻链的序列与seqidno.7所示序列具有至少60%的同一性。33.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含抗体,并且所述抗体包含重链,其中所述重链的序列与seqidno.8所示序列具有至少60%的同一性。34.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含抗体,并且所述抗体包含轻链和重链,所述轻链具有seqidno.7所示的序列,和所述重链具有seqidno.8所示的序列。35.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物包含hub4抗体。36.实施方案1-30中任一项的方法,其中所述抗-cd19类美登素免疫缀合物是hub4-dm4缀合物。37.实施方案2-30中任一项的方法,其中所述剂量方案减轻由hub4-dm4缀合物治疗所引起的毒性。38.抗-cd19类美登素免疫缀合物,其用于用包括以下步骤的方法治疗诊断为具有cd19+细胞恶性肿瘤症状的人类患者:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;和给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,其中所述后续剂量在时间上彼此分开约1周。39.抗-cd19类美登素免疫缀合物,其用于用包括以下步骤的方法治疗诊断为具有cd19+细胞恶性肿瘤症状的人类患者:给予患者约55mg/m2初始剂量的抗-cd19类美登素免疫缀合物;然后给予患者多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开约1周;和在进一步的步骤中给予多次约55mg/m2后续剂量的抗-cd19类美登素免疫缀合物,所述后续剂量在时间上彼此分开约2周。40.一种制品,其包含:a)包装材料;b)抗-cd19类美登素免疫缀合物;和c)包含在所述包装材料内的标签或包装说明书,其指示将所述抗-cd19类美登素免疫缀合物以约55mg/m2初始剂量和多次约55mg/m2的量的后续剂量给予患者,所述后续剂量在时间上彼此分开约1周。41.一种制品,其包含:a)包装材料;b)抗-cd19类美登素免疫缀合物;和c)包含在所述包装材料内的标签或包装说明书,其指示将所述抗-cd19类美登素免疫缀合物按以下给予患者:以约55mg/m2初始剂量,然后以多次在时间上彼此分开约1周的约55mg/m2的量的后续剂量,然后以多次在时间上彼此分开约2周的约55mg/m2的量的后续剂量。42.一种制品,其包含:a)包装材料;b)抗-cd19类美登素免疫缀合物;和c)包含在所述包装材料内的标签或包装说明书,其指示将所述抗-cd19类美登素免疫缀合物以约55mg/m2的剂量给予患者,以使毒性风险最小。43.实施方案42的制品,其中眼睛相关不良事件(所有等级)的发生率低于40%。44.实施方案42的制品,其中眼睛相关不良事件(3级/4级)的发生率低于13%。附图简述图1:hub4-dm4缀合物sar3419的结构。图2:根据剂量水平的治疗应答。图3:根据组织学的治疗应答。图4:在mtd下随时间的肿瘤缩小。实施例下文的实施例阐明按本发明的组合。实施例1:在具有复发性/难治性cd19-阳性b-细胞非何杰金氏淋巴瘤的患者中每周一次给予的hub4-dm4缀合物(研究ted6829)研究目的主要:当作为单一剂每周一次iv给予具有复发性或难治性b-细胞nhl的患者时,根据所观察到的剂量限制毒性(dlt),确定sar3419的最大耐受剂量(mtd)。次要:表征sar3419的整体安全性概况评估sar3419的药代动力学(pk)概况进行药效学(pd)评估评估sar3419的潜在免疫原性评估抗淋巴瘤活性的初步证据。方法研究设计招募具有表达cd19抗原的难治性或复发性b-细胞nhl的成年患者。剂量递增(escalation)基于3+3设计中的安全性。通过初始3周治疗期间预确定的dlt的发生率指导剂量递增。治疗期间的后期或累积毒性也可考虑用于确定推荐的剂量。关于在30ml透明玻璃小瓶中供应的活性实体,sar3419药物产品可作为溶液得到,用于以25mg/25ml(1mg/ml)输注。sar3419作为单一剂每周1次经iv给予8次剂量。可对患者具有临床益处的任何另外的治疗可在研究员和赞助者(sponsor)之间讨论并同意。每次输注前需要用苯海拉明50mgiv和扑热息痛650mg经口进行前驱给药。评估在研究开始时、8次剂量后以及最终治疗(eot)后42-49天,进行计算机断层摄影术(ct)和/或正电子发射断层摄影术(pet)扫描。在直至1年的时间内,每3个月跟踪应答者(responder)。使用在基线、在治疗期间的特定时间点和在eot采集的血液样品,进行pk和免疫原性评估。结果结果总结于下表1-7中。表1:基线人口统计学和疾病特征*在研究开始时6例缺少组织学。表2:剂量递增*1名患者在2次剂量后具有dlt:3级中性粒细胞减少症,导致2周的剂量延迟。以70mg/m2治疗的2名患者具有晚期(>5次剂量)2级明显的毒性:与角膜沉积有关的视力模糊和左束支传导阻滞,考虑其是由于剂量递增所致。**研究确定55mg/m2作为mtd/rd(建议剂量)。***一个研究场所错误地在每次研究药物输注时没有冲洗iv线。对应于18mg研究药物的18ml死体积的制剂未被给予。在该场所招募的8名患者回溯再指定至他们的实际剂量水平。基于实际剂量水平提供研究结果。表3:非血液学相关的teae3-4级*按照用于不良事件的国立癌症研究所通用技术标准(nationalcancerinstitutecommonterminologycriteriaforadverseevents)(第三版)对不良事件分级。**总共报告5例相关的sae,其中4例为3-4级。***在mtd下,增加组(expansioncohort)的两名患者在6-8次每周一次剂量之后具有可逆的3级毒性:视神经病和感觉异常。这些晚期和累积的毒性被考虑用于修改2010年7月的研究方案和修改给药计划。表4:血液学毒性3-4级表5:相关的眼睛毒性*包括视力模糊(5)、干眼(3)、结膜炎(1)、复视(2)、眼刺激(1)、角膜沉积(1)、角膜炎(1)、角膜结膜炎(1)、暗点(1)**视神经病(具有关联的3-4级症状视力模糊和眼刺激)是研究中报告的唯一>2级的眼睛毒性。表6:抗-淋巴瘤活性*在研究截止日时3名患者仍在应答表7:在每周一次的计划中重复给予sar3419(8-12次剂量)后观察到的中值(cv%或最小-最大)sar3419血浆药代动力学参数结论使用用于8-12次剂量的sar3419每周一次计划,最大耐受剂量为55mg/m2/周。sar3419证明了在无痛的和侵略性nhl两者中鼓舞人心的活性,其在mtd时具有33%的orr。在25名患者(58%)中观察到肿瘤缩小。总体而言,sar3419被很好地耐受,其中总体上每名患者的剂量中值数为8,并且在mtd时中值相对剂量强度为0.96。值得注意的是缺少明显的骨髓抑制,这使sar3419成为与常规化学疗法组合的有吸引力的adc。在每周一次的计划中,眼睛毒性(所有级别)为22%(2%的3级/4级),而在3周的给药方案中,眼睛毒性(所有级别)为43.5%,其中3级/4级为15.4%。成对的治疗前和治疗后活组织检查允许显示肿瘤中dm4积聚、cd19蛋白表达水平的减少和有丝分裂阻断,这证实了药物的作用机制。基于两种迟发型3级毒性(视神经病和感觉异常)的临床证据(由每周一次给药后显示药物蓄积的pk数据支持),修改方案以评估最佳计划,其由4次55mg/m2的每周一次剂量和随后的4次每2周一次给予的另外剂量组成。实施例2:在具有复发性/难治性cd19-阳性b-细胞非何杰金氏淋巴瘤的患者中每周一次和其后每两周一次给予(qw/q2w计划)的hub4-dm4缀合物(修改的研究ted6829临床试验)基于两种迟发型晚期毒性的临床证据(由显示治疗3-4周后达到稳定状态的pk数据支持),修改实施例1中所述的方案以评估最佳计划,其由4次55mg/m2的每周一次剂量和随后的4次每2周一次给予的另外剂量组成(正进行中)。研究目的和方法与实施例1相同,除了sar3419作为单一剂在以下计划下经iv给予:所述计划由rd下的4次每周一次剂量和随后的4次每2周一次剂量组成。此外,关于在30ml透明玻璃小瓶中供应的活性实体,sar3419药物产品可作为浓缩液得到,用于以125mg/25ml(即5mg/ml)输注。实施例1的研究扩大至使用最佳计划治疗25名患者。结果结果总结于下表8-12中。表8:基线人口学统计学和疾病特征*4名患者错误地用药不足,接受了40mg/m2;21名患者实际上的确接受了计划的剂量55mg/m2**难治性状态=在治疗下或在治疗结束后6个月内是进行性的表9:每个患者的临床ae(>10%),无论与研究药物的关系如何(n=25)*可逆的1级视力模糊和1级感觉异常各自在1名患者中报告。**研究中报告的其他3-4级(各自1个事件):葡萄膜炎、肾盂肾炎、心肌梗塞、淋巴管性水肿。表10:血液学毒性(n=25)实验室原始数据所有级别3级4级白血球减少症182(1)*1中性粒细胞减少症123(2)*3(2)*贫血症231-血小板减少症163(2)*1(0)**2名患者接受了另外的抗癌疗法而没有检查血液学报告。1名患者在研究开始时异常,并包括有3级中性粒细胞减少症/白血球减少症。表11:qw/q2w计划的抗-淋巴瘤活性orr(cr/pr)7/25(28%)包括3个cru*dlbcl亚型中的orr3/9(33%)肿瘤缩小64%应答持续时间(周)[8;35+]**有待更新*在对最终方案具有难治性的患者中1个cru**x个患者在研究截止日时仍在应答表12:在第一次和最后一次sar3419剂量后平均(cv%)sar3419pk参数结论所接受的剂量的中值数按计划为8,在rd下具有1.0[0.8-1.0]的中值相对剂量强度。最常见的相关teae是5名(23.8%)患者中的虚弱(1个3级事件)和7名(33%)患者中的胃肠道病症。可逆的1级视力模糊/角膜事件在1名患者中发生。3-4级血液学毒性是最小的。在16名(64%)患者中观察到肿瘤缩小。7名(28%)患者达到目标应答(objectiveresponse),包括1个cr和3个完整应答(cru)。应答率基本上保持在侵略性疾病中(3/9dlbcl患者)。总之,由4次每周一次剂量和随后的4次每两周一次剂量的计划与先前测试的计划相比,显示改进的安全性概况,具有基本上保持在侵略性淋巴瘤中的临床功效。总体结论在该研究期间,确定sar3419mtd/rd为55mg/m2(最大耐受剂量),而最大给药剂量(mad)为70mg/m2。最佳给药计划(55mg/m2每周一次/每两周一次)与先前测试的计划相比,显示改进的安全性概况,对adc(角膜的)/dm4(神经的、消化的和血液学的)相关毒性的发生率和严重性具有明显的临床控制。在两个给药计划中都观察到抗淋巴瘤活性,在55mg/m2mtd/rd下约30%的患者,尤其是以每周一次/每两周一次的建议给药计划的剂量在具有侵略性组织学(dlbcl)的患者中。序列表<110>赛诺菲(sanofi)<120>抗-cd19类美登素免疫缀合物抗体在治疗b-细胞恶性肿瘤症状中的用途<130>fr2011/031pct<160>8<170>patentinversion3.3<210>1<211>10<212>prt<213>小鼠<220><221>其他特征<223>cdrl1<400>1seralaserserglyvalasntyrmethis1510<210>2<211>7<212>prt<213>小鼠<220><221>其他特征<223>cdrl2序列<400>2aspthrserlysleualaser15<210>3<211>7<212>prt<213>小鼠<220><221>其他特征<223>cdrl3序列<400>3hisglnargglysertyrthr15<210>4<211>5<212>prt<213>小鼠<220><221>其他特征<223>cdrh1序列<400>4serasntrpmethis15<210>5<211>10<212>prt<213>小鼠<220><221>其他特征<223>cdrh2序列<400>5gluileaspproseraspsertyrthrasn1510<210>6<211>11<212>prt<213>小鼠<220><221>其他特征<223>cdrh3序列<400>6glyserasnprotyrtyrtyralametasptyr1510<210>7<211>211<212>prt<213>合成的<220><223>hub4轻链序列<400>7gluilevalleuthrglnserproalailemetseralaserprogly151015gluargvalthrmetthrcysseralaserserglyvalasntyrmet202530histrptyrglnglnlysproglythrserproargargtrpiletyr354045aspthrserlysleualaserglyvalproalaargpheserglyser505560glyserglythrasptyrserleuthrilesersermetgluproglu65707580aspalaalathrtyrtyrcyshisglnargglysertyrthrphegly859095glyglythrlysleugluilelysargthrvalalaalaproserval100105110pheilepheproproseraspgluglnleulysserglythralaser115120125valvalcysleuleuasnasnphetyrproargglualalysvalgln130135140trplysvalaspasnalaleuglnserglyasnserglngluserval145150155160thrgluglnaspserlysaspserthrtyrserleuserserthrleu165170175thrleuserlysalaasptyrglulyshislysvaltyralacysglu180185190valthrhisglnglyleuserserprovalthrlysserpheasnarg195200205glyglucys210<210>8<211>450<212>prt<213>合成的<220><223>hub4重链序列<400>8glnvalglnleuvalglnproglyalagluvalvallysproglyala151015servallysleusercyslysthrserglytyrthrphethrserasn202530trpmethistrpvallysglnalaproglyglnglyleuglutrpile354045glygluileaspproseraspsertyrthrasntyrasnglnasnphe505560glnglylysalalysleuthrvalasplysserthrserthralatyr65707580metgluvalserserleuargseraspaspthralavaltyrtyrcys859095alaargglyserasnprotyrtyrtyralametasptyrtrpglygln100105110glythrservalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaprogluleuleuglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuproalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvaltyr340345350thrleuproproserargaspgluleuthrlysasnglnvalserleu355360365thrcysleuvallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleutyrserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnhistyrthrglnlysserleuserleuserpro435440445glylys450当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1