无患子果皮活性提取物的制备方法及其抗真菌的应用与流程
本发明属于天然产物有效成分的提取工艺技术领域,具体涉及一种无患子果皮活性提取物的制备方法及其抗真菌的应用。
背景技术:
由于各种抗生素的广泛应用、器官移植等技术的发展,真菌感染的患病率和致死率在全球呈上升趋势。根据侵犯人体部位的不同,可以将真菌感染性疾病分为浅表真菌感染,皮肤真菌感染,皮下组织真菌感染和系统性真菌感染。其中,浅表真菌感染和皮肤真菌感染统称为浅部真菌感染,皮下组织真菌感染和系统性真菌感染统称为侵袭性真菌感染。浅部真菌感染是致病真菌侵犯皮肤的角质层、毛发和甲板所导致的感染,主要致病菌为皮肤癣菌,其他常见致病菌还有马拉色菌和念珠菌等,直接接触是其主要传播方式。皮肤癣菌等主要致病菌来源于3个属,即小孢子菌属、毛癣菌属和表皮癣菌属,霉菌性阴道炎主要致病菌为念珠菌属。深部真菌感染主要由条件致病性真菌,如念珠菌属、曲霉属和隐球菌属所致,占造血干细胞移植、器官移植和其他免疫缺陷患者真菌感染的80%以上。
由于各种高效广谱抗菌药物的广泛使用,病原微生物产生了多种耐药机制以保持物种的延续,而形成生物被膜就是一种重要的耐药机制。生物被膜是指大量微生物黏附于某些物体的表面形成的一种膜样聚集,具有复杂的三维结构和功能,目前认为人体80%微生物感染与病原微生物的生物被膜相关。生物被膜相关性感染会影响患者预后,临床研究表明由产生生物被膜念珠菌造成的念珠菌血流感染其致死率是由不产生生物被膜念珠菌造成的血流感染的1.77倍,生物被膜产生也是念珠菌血流感染患者死亡的独立危险因素。动物实验也表明,从生物被膜扩散的游离念珠菌较非生物被膜游离念珠菌具有更强的毒力,从而其感染可造成更差的结局。生物被膜相关性感染很难控制,因为其具有更强的耐药性,普通抗真菌药物治疗很难完全清除生物被膜。目前临床对念珠菌生物被膜尚无理想对策,如何防治和克服生物被膜耐药问题,已成为临床上极具挑战性的课题。
无患子(sapindusmukorossigaertn.),又名油患子、木患子、洗手果、肥皂树等,属于无患子科无患子属落叶小乔木,广泛分布于我国淮河以南和东南亚地区,在我国主产于广东、广西。无患子始记载于《本草纲目》,具有清热祛痰、消积杀虫等作用。现代药理研究发现,无患子具有多种生理活性,主要包括抗细菌、抗真菌、抗肿瘤、灭螺活性、杀虫活性、抗炎症、抗溃疡、保护心肌缺血、防血栓、杀精、保肝等。
无患子果皮的主要化学成分为无患子活性部位,主要为常春藤皂苷元型三萜皂苷,具有很强的非离子表面活性作用,是优良的天然洗涤剂,所以目前关于无患子的大量研究主要集中在其清洁去污能力上。无患子在洗化用品上应用较多,其抗菌活性部位的提取方法主要包括水提法或有机溶剂提取法。虽然研究者们对无患子的分离提取做了不少工作,但总的来说都还处于初步研究阶段,要实现规模化生产还存在纯度低,如水提法,水提法的提取率较高,但是往往会将一些单糖、寡糖、氨基酸、蛋白质、黏液质等也被提取出来,从而导致提取物中的皂苷纯度降低,或是成本高、可操作性差等缺点。目前还有超滤法分离、微波提取等无患子活性部位提取工艺,但存在清洗苦难、溶剂损失大,纯度不高等缺点,因此很有必要对无患子活性部位提取工艺进行更深入的研究,以获得低成本、高纯度、操作简便、绿色环保的提取工艺,实现或完善无患子活性部位的工业化生产。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种无患子果皮活性提取物的制备方法,制备的无患子果皮活性提取物纯度达到95%以上,具有操作简便、适合工业化生产、纯度高、活性好、机制明确、无毒副作用的特点;本发明还提供一种将提取物应用于抗真菌药物中应用。
本发明所述的一种无患子果皮活性提取物的制备方法,将无患子果皮粉碎,用溶剂处理,合并处理得到的提取液,浓缩,将浓缩液通过d392型弱碱性阴离子交换树脂柱,依次用水和不同浓度的乙醇水溶液洗脱,收集乙醇水溶液的洗脱液,将收集的洗脱液进行浓缩、干燥,即得产品。
其中:
优选地,依次用水和不同浓度的乙醇水溶液洗脱,收集乙醇水溶液的洗脱液为:依次用水、50±2%乙醇、75±2%乙醇、95%±2乙醇洗脱,收集50±2%乙醇、75±2%乙醇和95±2%乙醇洗脱液。其中50±2%乙醇代表浓度为48-52%的乙醇水溶液,其他类推。
溶剂为水、乙醇水溶液、甲醇水溶液或丙酮水溶液。
用溶剂处理为用溶剂超声处理或添加溶剂加热回流处理。
用溶剂处理次数为至少3次,每次处理时溶剂添加重量是无患子果皮的8-12倍,每次处理时间为1.8-2.2小时。
无患子果皮重量与树脂柱体积比为1:2,无患子果皮重量以g计,树脂柱体积以ml计;树脂柱的径高比为1:10。
洗脱液流速为1个柱体积/小时。
将无患子果皮粉碎为将无患子果皮烘干后粉碎,对粉碎后的粒径没有特别要求。
由本发明所述的制备方法制备的无患子果皮活性提取物在抗真菌中的应用,无患子果皮活性提取物用于制备治疗真菌感染所致疾病、念珠菌感染所致疾病、白色念珠菌感染所致疾病、被膜念珠菌感染所致疾病、红色毛癣菌感染所致疾病、霉菌性阴道炎或体癣的药物。
药物剂型为软膏剂、乳剂、洗剂或栓剂,药物中无患子果皮活性提取物的添加重量为1%~20%。
一、对样品1-12抗真菌活性测试:
最小抑菌浓度(mic)测定方法:所用菌株为:白色念珠菌sc5314(野生型)、红色毛癣菌atcc28188、黑曲霉菌atcc16404。将菌株混悬于含20%甘油的生理盐水中,于-80℃长期保存。实验前,将菌株划线转接至ypd固体平板,30℃静置培养24h,将长出的单菌落转接至ypd液体培养基,30℃,200rpm过夜培养,将过夜培养的菌液以约1:100比例接种于新鲜的ypd培养基中,30℃振荡培养4h,此时白色念珠菌处于对数生长期,可用来进行后续实验。
mic值的确定是按照美国临床和实验标准协会(clsi)所制定的真菌敏感性检测方法(m27-a3),采用微量稀释的方法进行测定。具体实验步骤为:用rpmll640培养基将待测菌株菌浓度调整至0.5~2.5×103cells/ml:在96孔板第一个孔中加入200μl含有最高浓度待测药物的菌液,其余每孔各加入100μl不含药物的空白菌液;采用二倍梯度稀释的方法将菌液稀释至一系列浓度梯度;将孔板在35℃恒温静置培养24h。用酶标仪检测各浓度梯度在570nm处的吸光度(od值),扣除空白培养基吸光度后,以各孔od值除以对照组od值的比率为其生长率,以抑制率(1-生长率)大于80%的最小浓度为其最小抑菌浓度即mic值。
样品的制备:
1、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50±2%乙醇、75±2%乙醇、95%±2乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品1。
2、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d101型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品2。
3、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过ads-2型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品3。
4、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过ab-8型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品4。
5、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过hp-20型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品5。
6、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d152型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品6。
7、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过dm130型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品7。
8、分别取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过hz-101型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,流速为1个柱体积/小时,收集乙醇洗脱液,减压浓缩,真空干燥,即得产品,为样品8。
9、取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量,真空干燥,即得产品,为样品9。
10、取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用50%±2%乙醇加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量,真空干燥,即得产品,为样品10。
11、取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用50%甲醇加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量,真空干燥,即得产品,为样品11。
12、取无患子果皮100g,捡除杂质,将原料烘干,粉碎成粗粉;用20%丙酮加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量,真空干燥,即得产品,为样品12。
纯度检测:精密称取常春藤皂苷元对照品10mg,置于烧杯中,用甲醇溶解并定容至100ml的容量瓶中,摇匀,制成每1ml含0.1mg的对照品溶液,冷藏备用。
标准曲线的制备:精密吸取对照品溶液20μl、40μl、80μl、120μl、160μl、200μl,分别置于具塞试管中,低温挥去溶剂,加入5%香草醛-冰醋酸溶液0.2ml,置60℃恒温水浴上充分混匀后加热15分钟,立即用冰水冷却2分钟,加入冰醋酸5ml,摇匀;以相应试剂作空白,照紫外-可见分光光度法,在539nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标绘制标准曲线,得回归方程为y=20.421x-0.0266,r2=0.9999,见图1。
测定方法:取本发明所述的活性部位约50mg,精密称定,置25ml量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,精密量取50μl,照标准曲线制备项下的方法测定吸光度,然后代入回归议程计算样品溶液中总皂苷的质量浓度,最后根据公式计算样品中总皂苷的含量。从标准曲线上读出供试品溶液中常春藤皂苷元的量。
纯度及抗真菌结果见表1。
表1不同制备方法抗真菌活性部位结果
由实验结果可知,将无患子提取采用d392型大孔树脂纯化得到的有效部位,纯度及抗白色念珠菌、红色毛癣菌、黑曲霉菌活性明显优于溶剂提取及d101、ads-2、ab-8、hp-20、d152、dm130、hz-101型大孔树脂纯化所得部位。
二、本发明中所述活性部位对被膜念珠菌的作用
白色念珠菌sc5314菌株混悬于含20%甘油的生理盐水中,于-80℃长期保存。实验前,将菌株划线转接至ypd固体平板,30℃静置培养24h,将长出的单菌落转接至ypd液体培养基,30℃,200rpm过夜培养,将过夜培养的菌液以约1:100比例接种于新鲜的ypd培养基中,30℃振荡培养4h,此时白色念珠菌处于对数生长期,可用来进行后续实验。
按照美国临床和实验标准协会(clsi)所制定的真菌敏感性检测方法(m27-a3),采用微量稀释的方法进行测定。
具体实验步骤为:
(1)用rpmⅱ640培养基将待测菌株菌浓度调整至l×106cells/ml;
(2)将稀释好的菌液以100μl每孔加入96孔板中,在37℃下静置培养24h,此时在孔板底部已形成成熟被膜;
(3)弃上清,用无菌pbs缓冲液洗涤两遍,加入含有化合物的rpmⅱ640培养基,培养基加入200μl含有最高浓度待测药物的菌液,其余每孔各加入100μl不含药物的空白菌液;
(4)采用二倍梯度稀释的方法将菌液稀释至一系列浓度梯度;
(5)将孔板在35℃恒温静置培养24h;
取样,稀释,点板计数,设置三个重复组,将ypd平板于300c静置培养24h以上,根据长出的菌落数,计算原菌液的活菌数,与0时间点菌液中活菌数相比,计算白色念珠菌的存活率。
菌落计数得到的白色念珠菌存活率低于10%的药物浓度作为活性部位对被膜念珠菌的最低作用浓度。结果见表2。
表2样品1-12活性部位对被膜真菌的抑制作用
由实验结果可知,将无患子提取采用d392型大孔树脂纯化得到的有效部位对被膜念珠菌活性明显优于d101、ads-2、ab-8、hp-20、d152、dm130、hz-101型大孔树脂纯化及溶剂提取所得的有效部位。
三、本发明中所述活性部位的抗真菌作用机制研究
检测细胞膜通透性:我们用荧光染料pi来检测化合物对细胞膜通透性的影。具体实验步骤为:
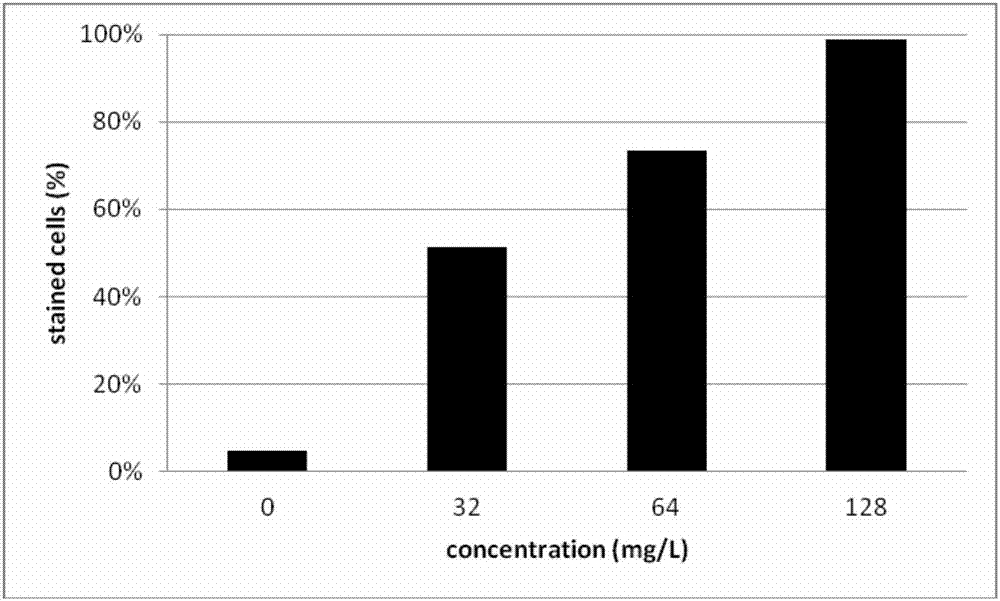
(1)在稀释好的sc5314菌液中加入终浓度为0、32、64、128μg/ml的活性部位,30℃孵育3h;
(2)加入终浓度为5μg/ml的pi染料,黑暗孵育30min;
(3)pbs缓冲液洗涤后,交由流式细胞仪检测被染色细胞比率。流式细胞仪参数调整方法:将未染色的正常白色念珠菌调至101以内,保持参数不变检测其余样品,以荧光强度超过101的细胞为被染色细胞,结果见图2。
pi为膜选择透过性染料,其只能透过收到损伤而通透性增加的细胞膜。实验结果表明本发明所述的活性部位的加入能够导致被pi染色的细胞数量增多,此结果表明越高剂量的本发明所述的活性部位越容易导致细胞膜的损坏。以上实验结果表明,本发明所述的活性部位能够干扰细胞膜结构导致其通透性增加破坏细胞膜的完整性。
综上所述,由于本发明所述活性部位的抗真菌机制是增加细胞膜的通透性,从而破坏细胞膜的完整性,因此适用于多种真菌感染。尤其适用于对目前市场上的主流药物产生耐药性及由被膜念珠菌引起的感染,如由白色念珠菌感染引起的阴道炎及由红色毛癣菌感染引起的体癣等由真菌引起的疾病。
四、本发明中所述活性部位对正常细胞的毒性
1.材料
细胞株:huvec人脐静脉内皮细胞系。
1.2试剂及培养基
1.2.1试剂及来源
见表3。
表3对正常细胞毒性实验试剂
化合物精确称量溶解于dmso,amb精确称量溶解于无菌去离子水,母液浓度为10mg/ml,储存于-20℃备用。
1.2.2仪器设备
见表4。
表4对正常细胞毒性实验仪器与设备
2.方法
细胞系培养在含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素的dmem培养基中,5%co2,37℃恒温恒湿静置培养。
采用mtt的方法来检测化合物对人细胞株huvec细胞增殖的影响。具体实验步骤为:
(1)将细胞稀释至1×104cells/ml,接种于96孔板中,37℃,5%co2培养24h;
(2)加入各个浓度梯度的本发明所述化合物和amb(阳性对照),每个梯度设置3个重复孔,同样条件培养24h;
(3)每孔加入10μl终浓度为0.5mg/ml的mtt溶液,继续37℃避光孵育4h,此时孔底出现蓝紫色结晶;
(4)在每孔加入100μldmso将结晶完全溶解,酶标仪检测570nm波长下每孔吸光度;
(5)根据各孔药物浓度和吸光度计算ic50值。
3、观察指标
见表5。
表5对正常细胞毒性
由实验结果可知,本发明实施例1活性部位对正常细胞的毒性小于d101、ads-2、ab-8、hp-20、d152、dm130、hz-101型大孔树脂纯化的活性部位,远小于两性霉素,临床使用更安全。
综上所述,针对目前临床常用的抗真菌药物普遍产生抗药性问题,本发明所述的无患子活性部位的抗真菌机制明确,明显优于溶剂提取、d101、ads-2、ab-8、hp-20、d152、dm130、hz-101型大孔树脂纯化纯化所得的有效部位;对正常细胞的毒性小于d101、ads-2、ab-8、hp-20、d152、dm130、hz-101型大孔树脂纯化所得的有效部位,明显小于两性霉素。具有机制明确,疗效确切,易于工业生产的优点,尤其适用于对目前市场上的主流药物产生耐药性及由被膜念珠菌引起的感染。
与现有技术相比,本发明具有以下优点:
(1)采用本发明所述方法提取纯化所得的无患子果皮活性提取物纯度达到95%以上,具有纯度高、活性好、机制明确、无毒副作用的特点。
(2)针对现有技术无患子提取纯化方法复杂,效率低,成本高等实际应用问题,本发明提供一种低成本、高纯度、操作简便、适合工业化生产、绿色环保的无患子活性部位提取纯化的新方法,针对目前临床常用的抗真菌药物普遍产生抗药性问题,本发明提供了一种抗真菌药物的新来源。
(3)由本发明所述的制备方法制备的无患子果皮活性提取物,应用于抗真菌药物中,尤其适用于制备白色念珠菌、红色毛癣菌、被膜念珠菌感染所致疾病的药物。
附图说明
图1为常春藤皂苷元的标准曲线图;
图2为活性部位细胞膜通透性图。
具体实施方式
下面结合实施例对本发明做进一步说明。
实施例1
取无患子果皮10kg,捡除杂质,将原料烘干,粉碎成粗粉;用水超声提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,收集50%±2%乙醇、75%±2%乙醇洗脱液,将收集的洗脱液进行减压浓缩,真空干燥,即得。
实施例2
取无患子果皮10kg,捡除杂质,将原料烘干,粉碎成粗粉;用水煎煮3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,收集75%±2%乙醇、95%±2%乙醇洗脱液,将收集的洗脱液进行减压浓缩,真空干燥,即得。
实施例3
取无患子果皮10kg,捡除杂质,将原料烘干,粉碎成粗粉;用50%±2%乙醇加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,收集50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱液,将收集的洗脱液进行减压浓缩,真空干燥,即得。
实施例4
取无患子果皮10kg,捡除杂质,将原料烘干,粉碎成粗粉;用50%甲醇加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,收集50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱液,将收集的洗脱液进行减压浓缩,真空干燥,即得。
实施例5
取无患子果皮10kg,捡除杂质,将原料烘干,粉碎成粗粉;用20%丙酮加热回流提取3次,每次加10倍量溶剂,提取时间为2小时,合并提取液,浓缩至适量;将浓缩液通过d392型树脂,无患子药材重量与树脂体积比为1:2,树脂柱的径高比为1:10,依次用水、50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱,收集50%±2%乙醇、75%±2%乙醇、95%±2%乙醇洗脱液,将收集的洗脱液进行减压浓缩,真空干燥,即得。
实施例6
无患子软膏剂制备
取凡士林940g及羊毛脂50g,加热,滤过,放冷至约50℃,加入无患子活性提取物10g,搅匀至半凝固状,制成1000g,即得。
实施例7
无患子软膏剂制备
取凡士林750g及羊毛脂50g,加热,滤过,放冷至约50℃,加入无患子活性提取物200g,搅匀至半凝固状,制成1000g,即得。
实施例8
无患子乳剂制备
取甘油80g、硬脂酸镁120g、三乙醇胺30g、液状石蜡180g、石蜡80g、羟苯乙酯1.5g、蒸馏水加至1000g,置于一容器中,加热至85~90℃,待完全溶化,停止加热,搅拌至冷凝,即得乳剂型基质。取无患子活性提取物200g,加入乳剂型基质800g,搅拌均匀,制成1000g,即得。
- 还没有人留言评论。精彩留言会获得点赞!