二维的肺静脉显示的制作方法
本发明整体涉及医疗消融规程,并且具体地涉及对医疗消融规程的显示。
背景技术:
导管消融为用于从容易发生心率失常的患者的心脏的部分移除或终止出故障的电通路的微创规程。
美国专利申请2013/0123598描述了包括具有相对的远端部分和近端部分的细长柔性轴的MRI-兼容导管。柄部附接到近端部分并且包括与轴远端部分连通的致动器,该致动器被配置成铰接该轴远端部分。轴的远端部分可包括消融顶端并包括与电连接到MRI扫描器的消融顶端相邻定位的至少一个RF跟踪线圈。该至少一个RF跟踪线圈电连接到在至少一个RF跟踪线圈暴露至MRI环境时减小耦合的电路。每个RF跟踪线圈为1至10线匝螺线管线圈并具有沿导管的纵向的介于约0.25mm和约4mm之间的长度。
美国专利申请2012/0189178描述了用于从3D医疗图像自动生成最佳2维(2D)医疗图像的方法和设备,从用于以3D方式示出患者的身体的一部分的3D体积图像数据生成穿过3D体积的至少一个虚拟平面,通过将3D体积图像数据应用到虚拟平面来生成表示患者的身体的一部分的横截面的至少一个2D图像,并且输出至少一个2D图像间的适于对患者进行诊断的具有最类似于目标特征的特征的2D图像。
美国专利8,135,185描述了相对于受检者的脉管系统的三维血管照影图像而找到血管的堵塞部分堵塞部分的位置的方法,该方法包括:在基本上横向于血管的堵塞部分的方向的平面中在得自三维图像数据的一系列所显示的二维图像中的每个所显示的二维图像上识别血管的堵塞部分的位置。然后血管的堵塞部分中的所识别的位置可用于确定血管的堵塞部分的路径。
美国专利7,961,924描述了用于响应于用户或计算机确定的输入使用单平面成像系统、使用医疗装置的计算模型和描述本地装置形状和取向的医疗装置的传递函数来确定医疗装置远侧端部的三维位置和取向的方法和系统。该方法允许使用单投射成像系统来将介入性医疗系统引导至患者体内的一组目标点。
技术实现要素:
下文所述的本发明的实施方案提供了一种用于观察患者的内腔的方法。
因此,根据本发明的实施方案提供了一种用于数据显示的方法,该方法包括:获取受检者的身体内的内腔的三维(3D)图;通过将3D图投射到环带上来将内腔的3D图转换成二维(2D)图像;以及在显示屏上呈现2D图像。
在本发明所公开的实施方案中,呈现2D图像包括呈现静止2D图像。
在一些实施方案中,3D图的3D图像以及静止2D图像被同时呈现在显示屏的相邻部分上。除此之外或另选地,在操纵3D图像时,该2D图像可保持静止。
在本发明所公开的实施方案中,获取3D图包括获取经历消融规程的内腔的3D图,其中该消融规程可包括消融心脏的肺静脉。除此之外或另选地,该方法包括针对肺静脉上的给定起始点计算消融规程的路径,以及在3D图的3D图像以及2D图像上显示路径的图像。
在一些实施方案中,经计算的位置和消融病灶的程度被显示在3D图的3D图像以及2D图像上。除此之外或另选地,基于经计算的位置和消融病灶的程度中的至少一者来计算另外的消融的所推荐的起始点,该方法包括将作为标记的所推荐的起始点显示在3D图像和2D图像上。
在另外的实施方案中,响应于在2D图像上呈现连续的闭合病灶的图像来确定消融规程的完成。
根据本发明的实施方案还提供了用于显示数据的设备,该设备包括显示屏和处理器,该处理器被配置成:获取受检者的身体内的内腔的3D图;通过将3D图投射到环带上来将内腔的3D图转换成2D图像;以及在显示屏上呈现2D图像。
在另一个实施方案中,该2D图像为静止的。
在另一个实施方案中,该处理器被配置成将3D图的3D图像以及2D图像同时呈现在显示屏的相邻部分上。除此之外或另选地,该处理器被配置成在操纵3D图像时保持2D图像静止。
在其他实施方案中,该3D图包括经历消融规程的内腔的3D图,并且该消融规程可包括消融心脏的肺静脉。除此之外或另选地,该处理器被配置成针对肺静脉上的给定起始点来计算消融规程的路径,以及在3D图的3D图像以及2D图像上显示路径的图像。
在另一个实施方案中,该处理器被配置成将经计算的位置和消融病灶的程度显示在3D图的3D图像以及2D图像上。除此之外或另选地,该处理器被配置成基于经计算的位置和消融病灶的程度中的至少一者来计算另外的消融的所推荐的起始点,并且将作为标记的所推荐的起始点显示在3D图像和2D图像上。
在实施方案中,该处理器被配置成响应于在2D图像上呈现连续的闭合病灶的图像来确定消融规程的完成。
从结合附图的本发明的实施方案的以下详细说明将更全面地理解本发明,在附图中:
附图说明
图1为根据本发明的实施方案的肺静脉的消融规程的示意图;以及
图2至图8示出了由外科医生在根据本发明的实施方案的受检者的肺静脉的消融规程期间所看见的显示屏。
具体实施方式
概述
导管消融规程诸如肺静脉的消融期间的问题中的一个问题为规程的可视化。通常,该肺静脉被呈现为三维(3D)图像,并且在外科医生执行消融时,其重新定位和/或旋转和/或改变图像的放大率,以观察规程的进程。使用该跟踪规程的方法的外科医生已发现在消融时使用和操纵3D图像通常既复杂又难以有效地执行。
本发明的实施方案通过获取受检者的体内的内腔诸如肺静脉的3D图来解决该问题。通过将3D图投射到环带上来将3D图转换成二维(2D)图像,并且在显示屏上将2D图像呈现给外科医生。
使用这种方法,在同时被呈现以该区域的静止二维(2D)图像时,外科医生能够观察和操纵消融区域的3D图像,如上所述。
在一个实施方案中,在消融的肺静脉的过程中,该消融区域包括柱状体结构。获取3D图像的处理器将该柱状体结构转换成2D环带,其中该柱状体结构的两个边缘被转换成环带的内圆周和外圆周,并且该柱状体结构的面积被转换成环带的面积。外科医生在消融规程期间所观察的显示屏被分成两个区域:该消融区域的可操纵3D图像连同心脏的其他部分被显示在显示屏的一个区域中,而静止2D环带被显示在另一区域中。
在另一个实施方案中,一旦外科医生已确定消融的起始点,处理器就基于该起始点和肺静脉的已知几何结构计算消融规程的推荐路径。该路径被标记在3D图像和2D环带两者中,以便引导外科医生。所推荐的路径为围绕肺静脉的路径,使得在已完成消融规程时,心跳激活波将被阻断。
在另一个实施方案中,当消融病灶在规程期间生长时,该处理器计算外科医生应开始接下来的消融病灶的位置,以便确保消除消融病灶之间的任何间隙。通常将存在两个此类位置,在现有消融病灶的任一侧上各有一个位置。这些位置被标记在3D图像和2D环带两者上,并且随着消融病灶生长,它们被重新计算和移动。
在本发明所公开的实施方案中,通过处理器使用由导管顶端施加的力的测量而从导管得顶端发射的射频功率和病灶的实耗时间来计算任何给定消融病灶的尺寸。在成功的消融规程中,外科医生看见围绕肺静脉生长的消融病灶的连续的经计算的图像链,直到已形成消融病灶的完整环。由于可立刻看见整个消融区域,因此通过对2D环带的显示大大便于消融病灶的经计算的图像的环的进程和完成两者的可视化。
系统描述
图1为根据本发明的实施方案的使用设备12的侵入式医疗规程的示意图。该规程由外科医生14执行,并且以举例的方式,假设下文描述中的规程包括消融人类患者18的心脏46的肺静脉16的一部分。然而,应当理解,本发明的实施方案并非仅适用于该特定规程,并且还可包括对生物组织的基本上任何规程。
为了执行消融,外科医生14将探头20(通常为导管)插入患者的内腔中,使得探头的远侧端部22进入患者的肺静脉16。远侧端部22包括被安装在远侧端部的外侧上的电极24,该电极接触肺静脉16的相应位置。探头20的近侧端部28耦接到设备12的控制台32。
设备12由位于控制台32中的处理器30来控制。控制台32包括由外科医生14使用以与处理器30进行通信的控件34。在规程期间,处理器30通常使用本领域中已知的任何方法来跟踪探头的远侧端部22的位置和取向。例如,该处理器30可使用磁跟踪方法,其中患者18外部的磁发射器在被定位在远侧端部22中的线圈中生成信号。由加利福尼亚州钻石吧市的韦伯斯特生物传感公司(Biosense Webster,of Diamond Bar,CA)生产的系统使用此类跟踪方法。
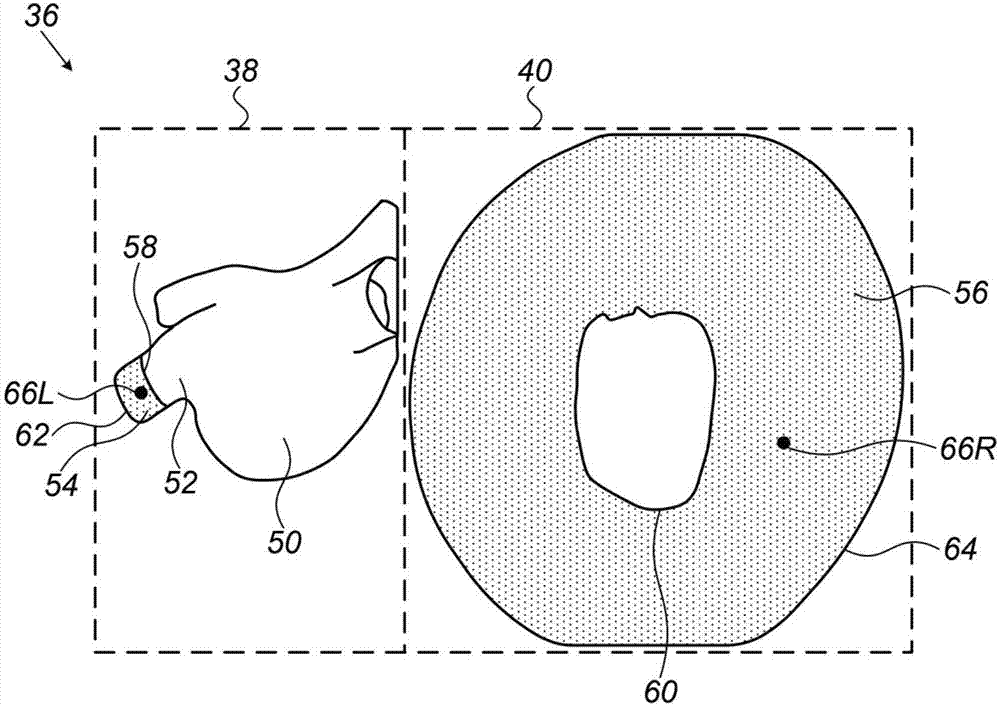
可将用于处理器30的软件通过例如网络以电子形式下载到处理器。另选地或除此之外,该软件可通过非临时性有形介质诸如光学介质、磁性介质或电子存储介质提供。处理器30耦接到被分成左显示器38和右显示器40的显示屏36,如下所述。虽然为了简单起见本文的描述假设屏幕被分成左显示器和右显示器,但是应当理解,本发明的范围包括用于屏幕分割和图像显示(诸如上部显示器和下部显示器,或第一屏幕和单独的第二屏幕)的任何其他便捷的方法。
为了操作设备12,处理器30与电子器件42进行通信,该电子器件42具有由处理器使用以操作设备的多个模块。因此,电子器件42包括模块,诸如消融模块43、用于测量远侧端部22上的力的力模块45、以及用于操作由处理器30使用的跟踪方法的跟踪模块47。该模块还包括硬件元件以及软件元件。探头20的耦接到控制台32的近侧端部28还耦接到电子器件42的模块。
处理器30使用来自模块的测量结果诸如由远侧端部22的顶端44施加的力、从顶端发射的射频功率、所消融的实耗时间、以及顶端的位置来计算并以图表形式显示该显示屏36上的消融规程的进程,如下所述。
图2至图8(参考图1)示出了由外科医生14在根据本发明的实施方案的患者18的肺静脉16的消融规程期间所看见的显示屏36。左显示器38示出了患者18的肺静脉16和心脏46的3D图像,并且右显示器40示出了肺静脉16的所选择得部分的2D图像。如下所述,左显示器38中的3D图像通常为可操纵的,而右显示器40中的2D图像通常为静止的。左显示器38和右显示器40中的对应的项目利用相同的数字来标记,其中字母“L”和“R”分别指示左显示器和右显示器。显示屏36可显示涉及消融规程的附加信息,例如实耗时间以及执行消融的电极所耗散的功率。为简单起见,此类附加信息未被呈现在图中。
图2在左显示器38中示出了心脏46的3D图像50和心脏46的肺静脉16的3D图像52。图像52的柱状体区域54对应于其中外科医生14实施消融规程的肺静脉16的区域。在规程期间,处理器30将柱状体区域54投射到右显示器40中的2D环带56,其中在图像50近侧的柱状体区域54的边缘58被投射到环带56的内圆周60,并且在图像50远侧的边缘62被投射到环带56的外圆周64。外科医生14已利用在左显示器38中由基准66L并且在右显示器40中由基准66R所指示的位置来将探头20的顶端44定位成接触肺静脉16。基准66L和66R以及下文所引用的其他基准通常作为与顶端44对应的图标而被呈现在屏幕36上。
图3示出了在外科医生14已选择顶端44的起始点以开始消融之后但在启动消融之前的显示屏36。基准68L和68R分别指示在左显示器38和右显示器40中的所选择的消融起始点。一旦选择起始点,处理器30便基于起始点和肺静脉16的已知3D尺寸来计算所推荐的闭合消融路径。基于由外科医生14选择的标准来计算所推荐的闭合路径,其中标准为例如闭合路径为围绕肺静脉的最短路径,或者闭合路径距肺静脉的基部固定的距离。所推荐的闭合路径作为区域70L和70R而被分别显示在左显示器38和右显示器40上。区域70L为图像54内的与围绕肺静脉16的所推荐的路径对应的带,并且区域70R为环带56内的环。在区域70L和70R中的每个区域内标记较的窄环71L和71R,该较窄的环71L和71R还有助于外科医生14指导消融规程。环71L和71R为用于消融的最佳路径,并且通常由外科医生14基于其想要偏离环71L和71R的最大距离来设定区域70L和70R的宽度。所推荐的消融路径为围绕肺静脉16的闭合路径,使得在已完成消融规程时,心跳激活波被阻断。
图4示出了在消融开始时的显示屏36。左显示器38和右显示器40分别示出了从起始点基准68L和68R开始的第一消融生长的经计算的消融病灶图像72L和72R(参考图3)。在屏幕36上,不同元件的图像通常通过不同的颜色来区分。在本专利申请的附图中,不同元件的图像通过不同的着色类型来区分。因此,完整的消融病灶区域在屏幕36上可被成像为红色,并且在附图中被示出为具有交叉影线。
由处理器30使用由顶端44施加的力的测量、从顶端发射的射频功率、以及实耗消融时间来计算病灶图像72L和72R的尺寸。此外,处理器30计算区域70L和70R中的两个接下来的所推荐的消融位置,并且在左显示器38上以标记74L和76L示出它们,并且在右显示器40上以标记74R和76R示出它们。接下来的所推荐的消融位置向外科医生提供随后消融的两个可选的起始位置。在本发明所公开的实施方案中,这些位置被计算成为距最外侧消融的边缘固定距离。固定距离可由外科医生14来选择。虽然在一个实施方案中固定距离默认值为3mm,但该距离可小于或大于该值。
接下来的所推荐的位置取决于消融病灶的位置和尺寸。外科医生14可沿肺静脉滑动顶端44,并同时使用顶端进行消融。另选地或除此之外,该外科医生可在消融时使顶端保持静止。在任一种情况下,随着消融病灶生长,重新计算并“推出”接下来的所推荐的位置。实时生成被呈现在屏幕36上的图像,并且通过两个显示器上的病灶图像72L和72R的实时呈现来协助外科医生14。外科医生14基于其判断和屏幕36上的图像来终止消融,但不迟于屏幕36上的消融病灶图像到达区域70L和70R的边缘的时刻。在消融规程中连续施加消融病灶的实时可视化和接下来的消融位置的指示两者。
重新参见图2和图3,在左显示器38中明显的是在进行消融规程时外科医生14已使用控件34来旋转3D图像。然而,在该旋转期间,处理器30确保右显示器40中的环带56保持静止,因此协助外科医生14容易并快速地观察消融规程的进程。对外科医生14很有帮助的是能够旋转或以其他方式随意操纵左显示器38中的3D图像,同时观察右显示器40中的完全静止2D图像。
图5示出了在完成第一消融病灶(被显示为病灶图像72L和72R)以及开始第二消融病灶(被示为病灶图像78L和78R)时的显示屏36。在图4中分别被示为标记76L和76R的“上部”的所推荐的接下来的位置处实施第二消融。因为消融规程为连续的,所以处理器30计算新的所推荐的接下来的位置。因此,处理器30计算新的、偏移的上部的所推荐的接下来的位置以反映第二消融病灶的存在,并将其显示为标记80L和80R。不改变“下部”所推荐的接下来的位置74L,74R。
图6示出了在第一消融病灶(被示为病灶图像72L和72R)和第二消融病灶(被示为病灶图像78L和78R)已达到其最终尺寸从而彼此融合并且第三消融病灶(被示为病灶图像82L和82R)已开始形成之后的显示屏36。在这种情况下,处理器30将下部的所推荐的位置的位置改变为新的位置83L,83R,同时不改变上部的所推荐的位置80L,80R的位置。
图7示出了在肺静脉16的超过一半的圆周已被连续的消融病灶(分别被示为病灶图像84L和84R)覆盖时显示屏36上的消融规程的进程。与在左显示器38上显示3D图像相比,在右显示器40上显示2D图像以用于快速和容易地评估消融规程的进程的优点为显而易见的。如附图所示,2D图像病灶84R显示完整的邻接病灶、位置83R和另一个所推荐的消融位置85R,而在3D图像84L中仅病灶的一部分以及所推荐的病灶位置85L中的一个所推荐的病灶位置为可见的。
图8示出了被示为病灶图像86L和86R的完整的消融病灶。两个图像均作为与在图3中示出的围绕肺静脉的闭合的所推荐的路径对应的闭合路径来显示。然而,在右显示器40的2D图像中,病灶的邻接为立即可见的和可验证的,而左显示器38的3D图像需要操纵以便验证病灶邻接。
应当理解,上述实施方案以举例的方式被引用,并且本发明不限于上文具体示出和描述的内容。相反,本发明的范围包括上文描述的各种特征的组合和子组合两者,以及本领域技术人员在阅读前述说明时将会想到的并且未在现有技术中公开的本发明的变型和修改。
- 还没有人留言评论。精彩留言会获得点赞!