基因递送的改进方法与流程
本申请要求2016年4月15日提交的美国临时专利申请no.62/323,476,以及2016年10月1日提交的美国临时专利申请no.62/403,110的优先权,其内容在此以引用的方式整体并入本文。
通过引用的方式并入
仅用于那些允许通过引入的方式并入的行政辖区,本申请中引用的所有参考文献(包括但不限于出版物,专利申请,专利和其他参考文献),其全文以引用的方式整体并入本文。此外,本文引用或提及的任何产品的任何制造商说明书或目录都通过引用并入本文。在美国专利no.8,465,732中提供的许多教导可以与本发明结合使用,或可适用于本发明。因此,美国专利no.8,465,732的全部内容通过引用明确并入本申请。通过引用并入本文中的文件,或其中的任何教导,可用于本发明的实践中。
背景技术:
腺病毒早期4(e4)区包含至少6个开放阅读框(orf)。已报道整个e4区可以调节血管生成和促进内皮细胞存活(zhangetal.(2004),j.biol.chem.279(12):11760-66)。在整个e4区内,e4orf1序列负责内皮细胞中的这些生物学效应(美国专利no.8,465,732;和seandeletal.(2008),pnas,105(49):19288-93)。已经发现,被工程化为表达e4orf1的内皮细胞在多种共培养方法中是特别有用的,其中它们可用于支持各种不同细胞类型的扩增,否则这些细胞类型难以在培养物中维持或扩增,如各种干细胞,包括造血干细胞(美国专利no.8,465,732;和seandeletal.(2008),pnas,105(49):19288-93)。
基因治疗,例如采用基因编辑技术,为对抗大量的遗传障碍和疾病提供一种有前景的潜在解决方案。然而,本领域克服的主要障碍是高效地遗传修饰足够数量的用于移植的自体细胞,以及修饰最有可能是治疗有效的细胞类型的能力。在用于血液紊乱的基因治疗中,这种细胞类型包括造血干细胞(hsc)和组织特异性的再填充干细胞(tissue-specificrepopulatingstem)和祖细胞。采用针对该关键造血细胞群的基因修正和其它基因治疗技术,可以更有效地治疗几种血液紊乱。不幸的是,到目前为止已经证明在这些和其它细胞中的基因修正的尝试大部分是无效率的。
几种细胞转导和转染技术(如电穿孔)可引起显著的细胞应激和细胞损伤,这经常会导致细胞死亡。因此,通常只有部分细胞被成功转导或转染。这是基因递送至干细胞中的特殊问题,并且在需要大量健康的,有活力的,转导的或转染的细胞的应用中也是一个特定的问题。
技术实现要素:
本发明部分地基于在本专利公开的“实施例”这一部分中进一步描述的某些新发现和过程。
例如,现已发现,当基因递送与内皮细胞共培养(例如与已被优化为能在体外(exvivo)培养的内皮细胞(如表达e4orf1基因(e4orf1+ec)的内皮细胞)共培养)相结合进行时,可以显著提高基因递送至“靶细胞”的效率,和/或成功转染的或转导的靶细胞(包括干细胞)的产量。
据申请人所知,没有关于内皮细胞,更具体地为e4orf1+ecs在基因递送至其它“靶”细胞类型(例如,与e4orf1+ec共培养的细胞)的效率上,和/或在成功转染的或转导的靶细胞的产量上,和/或在基因递送过程中“拯救”损伤的细胞的能力上的影响的报道。此外,当基因递送过程在内皮细胞,特别是在e4orf1+ec存在下进行时,基因递送效率和/或成功转导的或转染的细胞的产量不会受到不利影响,甚至可以被提高,这一发现似乎是反直觉的——因为人们可能期望内皮细胞(例如e4orf1+ec)摄取原本可由靶细胞摄取的遗传物质,从而显著降低基因递送至靶细胞的整体效率和/或显著降低成功转导的或转染的细胞的产量。然而,在此呈现的结果证明情况并不是这样的。相反,本文呈现的结果证明,与仅包含靶细胞的培养物相比,在含有内皮细胞(尤其是e4orf1+ec)的培养物中,基因递送至靶细胞的效率,和/或成功转导的或转染的细胞的产量,要远远大于所期望的——即使递送至培养物的遗传物质的总量相同以及培养物中的靶细胞的相对比例降低。基于这些发现,本发明提供了用于基因递送的特定的新的和改进的方法,以及可用于这些方法的各种组合物。
因此,在一个实施例中,本发明提供了一种基因递送至靶细胞的方法,所述方法包括:(a)将靶细胞与内皮细胞(如e4orf1+内皮细胞)共培养,(b)将所述靶细胞与用于基因递送/基因编辑的一种或多种外源核酸分子和/或其它分子接触;其中将靶细胞与内皮细胞(如e4orf1+内皮细胞)共培养的步骤,在以下任一情况下进行:(i)在将靶细胞与一种或多种外源核酸分子和/或其它分子接触之前进行,(ii)与将靶细胞与一种或多种外源核酸分子和/或其它分子接触的同时进行,(iii)在将靶细胞与一种或多种外源核酸分子和/或其它分子接触之后进行,或(iv)上述任意组合。
在一些这样的实施例中,所述基因递送是基因编辑过程的一部分,并且还可包括将所述靶细胞与用于基因编辑的一种或多种分子接触。
在一些这样的实施例中,靶细胞与内皮细胞(例如e4orf1+内皮细胞)共培养(例如,它们与靶细胞存在于相同容器中,和/或与靶细胞相接触),与此同时,靶细胞与一种或多种外源核酸分子和/或其它分子接触。
在一些这样的实施例中,在将靶细胞与一种或多种外源核酸分子和/或其它分子接触之前,将靶细胞与内皮细胞(例如e4orf1+内皮细胞)共培养至少12小时,或至少24小时(1天),或至少36小时,或至少48小时(2天)或至少60小时,或至少72小时(3天),或至少84小时,或至少96小时(4天)。
在一些这样的实施例中,靶细胞与内皮细胞(例如e4orf1+内皮细胞)的共培养在将靶细胞与在基因递送/基因编辑中有用的一种或多种外源核酸分子或其它分子接触后立即开始——以便及时使靶细胞免受基因递送过程中的任何损伤。在本文中,术语“立即”是指在完成“接触”步骤的30分钟内。在一些实施例中,靶细胞与内皮细胞(例如e4orf1+内皮细胞)的共培养在完成所述“接触”步骤的15分钟内,或10分钟内,或5分钟内,或3分钟内,或2分钟内,或1分钟内开始。根据所采用的基因递送方法不同,所述“接触”步骤的完成时间也不同。例如,当通过电穿孔实现基因递送时,当电脉冲结束时,即完成“接触”步骤,且在电脉冲结束后,靶细胞应与内皮细胞共培养。类似地,当通过将靶细胞与脂质转染药剂接触来实现基因递送时,当脂质转染药剂被去除时(例如通过介质置换),即完成“接触”步骤,且在脂质转染药剂去除后,靶细胞应与内皮细胞共培养。在一些这样的实施例中,在接触步骤完成后,靶细胞继续与内皮细胞(例如e4orf1+内皮细胞)共培养至少2小时,至少6小时,至少12小时,至少24小时(1天),或至少48小时(2天),或至少72小时(3天),或至少96小时(4天),或至少120小时(5天),或至少144小时(6天),或至少168小时(7天),或至少192小时(8天),或至少240小时(10天),或至少288小时(12天)。
在一些实施例中,在共培养过程中,靶细胞与内皮细胞(例如e4orf1+内皮细胞)的比例约为1∶1。在一些实施例中,在共培养过程中,靶细胞与内皮细胞的比例为约2∶1至约1∶2。在一些实施例中,靶细胞与内皮细胞比例为约10∶1,或约9∶1,或约8∶1,或约7∶1,或约6∶1,或约5∶1,或约4∶1,或约3∶1,或约2∶1,或约1∶2,或约1∶3,或约1∶4,或约1∶5,或约1∶6,或约1∶7,或约1∶8,或约1∶9,或约1∶10。在一些这样的实施例中,这些是靶细胞与内皮细胞的比例,并且是共培养开始的时间。在一些这样的实施例中,这些是靶细胞与内皮细胞的比例,并且是靶细胞与一种或多种外源核酸分子和/或其它分子接触的时间。
在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约10%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约20%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约30%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约40%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约50%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约60%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约65%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约70%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约75%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约80%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约85%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约90%。在一些实施例中,本文提供的方法导致靶细胞转导或转染效率大于约95%。
在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染的效率更高。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约10%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约20%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约30%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约40%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约50%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约60%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约70%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约80%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约90%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约100%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约150%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约200%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约250%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致靶细胞转导或转染效率高约300%。
在一些实施例中,由于例如提供给与内皮细胞共培养的靶细胞以及未与内皮细胞共培养的靶细胞的外源核酸分子的量相同(或大致相同),和/或由于因共培养内皮细胞的存在而导致的可用于转染或转导靶细胞的外源核酸分子的量降低,本文提供的方法甚至在转染或转导效率被预期降低的情况下,导致靶细胞转导或转染效率类似于不存在内皮细胞共培养的情况。
在一些实施例中,由于例如提供给与内皮细胞共培养的靶细胞以及未与内皮细胞共培养的靶细胞的外源核酸分子的量相同(或大致相同),和/或由于因共培养内皮细胞的存在而导致的可用于转染或转导靶细胞的外源核酸分子的量显著降低,与不存在内皮细胞共培养的情况相比,本文提供的方法甚至在转染或转导效率被预期降低很多的情况下,导致靶细胞转导或转染效率仅降低约10%,或约20%,或约30%,或约40%,或约50%。
在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量更高。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约10%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约20%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约30%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约40%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约50%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约60%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约70%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约80%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约90%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约100%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约150%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约200%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约250%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约300%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约400%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约500%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高约600%。在一些实施例中,与不存在内皮细胞共培养相比,本文提供的方法导致成功转染的或转导的靶细胞的产量高大于600%。
在一些实施例中,这种基因递送方法的共培养步骤在大气氧条件下进行。在一些实施例中,这种基因递送方法的共培养步骤在常氧条件(normoxicconditions)下进行。在一些实施例中,这种基因递送方法的共培养步骤在低氧条件(hypoxicconditions)下进行。在一些实施例中,这种基因递送方法的共培养步骤在严重低氧条件下进行。在一些实施例中,这种基因递送方法的共培养步骤在氧含量为18%至0.1%的氧气水平下进行。
本发明改进的基因递送方法预期对执行靶细胞“基因编辑”可能特别有用——例如采用位点特异性核酸酶向靶细胞基因组内的特异性位点递送“基因修正的”核酸序列。因此,在一些实施例中,上述描述的方法还包括使靶细胞与一种或多种外源核酸酶(如序列特异性核酸酶)接触。这种核酸酶包括但不限于,归巢核酸内切酶(meganucleases),锌指核酸酶,转录激活样效应因子核酸酶(talens)和crispr-cas系统核酸酶。
本发明的基因传递方法可用于递送外源核酸,和/或遗传修饰,至任何所需的靶细胞类型。在一些实施例中,靶细胞是分化的细胞,例如但不限于,例如淋巴细胞,t细胞,b细胞,nk细胞,骨髓细胞,内分泌细胞,间充质细胞或表皮细胞。在一些实施例中,靶细胞是干细胞或祖细胞,包括但不限于是多能干细胞——如胚胎干细胞(es细胞)或诱导多能干细胞(ips细胞)。在一些实施例中,干细胞是组织或器官受限的干/祖细胞——即致力于特定细胞或组织谱系的干/祖细胞。例如,在一些优选实施例中,靶细胞为造血干细胞(hsc)或造血干/祖细胞(hspc)。在一些这样的实施例中,hsc或hspc是cd34-阳性的(cd34+)。在一些实施例中,hsc或hspc来源于骨髓,外周血,脐带血,羊水或其它干细胞源。
在一些实施例中,任何合适类型的内皮细胞可用于本文上述和其他地方所描述的基因递送方法中。在优选的实施例中,内皮细胞和靶细胞来源于相同的组织或器官。典型地,内皮细胞是血管内皮细胞,例如初级血管内皮细胞,例如脐静脉内皮细胞或uvec细胞,其为造血器官系统的一部分。优选地,内皮细胞是人内皮细胞,例如人脐静脉内皮细胞或“huvecs”。优选地,靶细胞为造血干细胞和/或祖细胞。
使靶细胞与用于基因编辑的一种或多种外源核酸分子或其它分子接触的步骤可以采用本领域已知的任何合适的方法来实施。在一些实施例中,该步骤通过转染的方法来执行,例如采用诸如脂质体介导的转染,聚凝胺介导的转染,deae葡聚糖介导的转染,电穿孔,磷酸钙沉淀,显微注射,或微粒子轰击等方法。在其它实施例中,该步骤通过采用病毒转导的方法来执行,例如采用慢病毒介导的转导,腺病毒介导的转导,逆转录病毒介导的转导,腺相关病毒介导的转导或疱疹病毒介导的转导。
采用本文所述方法递送至靶细胞的核酸分子可以是所需的任何核酸分子。例如,核酸分子可以但不限于编码治疗有用的蛋白,或标记蛋白,或任何其它所需的蛋白。类似地,所递送的核酸分子可以不编码蛋白。例如,它可以编码蛋白质的片段,例如靶细胞基因组中存在的如用于修正靶细胞遗传缺陷的核苷酸序列的“基因修正”片段。在一些这样的方法中,例如使用一种或多种基因编辑/基因修正技术,包括但不限于归巢核酸内切酶(meganucleases),锌指核酸酶,talen和crispr-cas更多基因编辑/基因修正技术,所述“基因修正”序列可用于替代靶细胞基因组中的突变序列。
本专利公开中在上文和其他地方所描述的各种方法,能够产生“遗传修饰靶细胞”。可以根据需要使用这些遗传修饰靶细胞。例如,在一些实施例中,遗传修饰靶细胞可以被给予有需要的个体,如人或非人个体。在一些这样的实施例中,所述个体可以是患有影响靶细胞的疾病或紊乱,例如,遗传疾病或紊乱,和/或导致靶细胞群体缺陷的疾病或紊乱。在一些优选的实施例中,遗传修饰靶细胞是hsc或hspc,并且被给予患有影响造血系统的细胞的疾病或紊乱的个体。例如,在一些实施例中,这样的个体可以具有由清髓性治疗(myeloablativetreatment)引起的造血不足。在其它实施例中,所述个体可以具有血液疾病,感染性免疫缺陷,影响t细胞的感染性疾病,遗传免疫缺陷,重症综合性免疫缺陷,影响红细胞的遗传疾病,和/或贫血症——例如镰状细胞性贫血,fanconi贫血,或地中海贫血。在一些这样的实施例中,靶细胞可以是相对于个体来说是同种异体的。在其它实施例中,靶细胞可以是相对于个体来说是自体的。
本发明还提供使用本文所述方法生产的遗传修饰靶细胞,和/或包含所述遗传修饰靶细胞的组合物,例如治疗性组合物。
在本专利公开的其它部分对本发明的这些和其它实施例作进一步描述。此外,对于本领域技术人员来说显而易见的是,本文描述的各种实施例的某些修改和组合均落在本发明的保护范围内。
附图说明
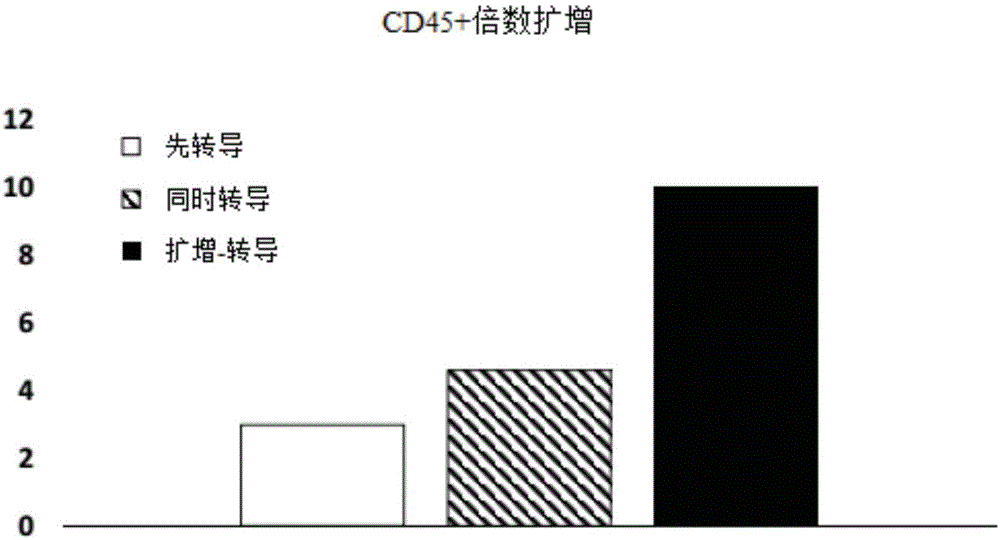
图1a-b为在开始转导过程前,在e4orf1+人脐静脉内皮细胞(uvec细胞)上扩增cd34+细胞,导致总造血细胞和cd34+细胞的倍数扩增(foldexpansion)。图1a-8天后cd45+(总)造血细胞的倍数扩增。图1b-8天后cd34+造血细胞的倍数扩增(“先转导(pre-transduced)”样品-白色柱;“同时转导(concurrent-transduced)”样品-灰色柱;“扩增-转导(expanded-transduced)”样品-黑色柱)。此处未明确的条件在实施例(examples)中进行详细说明。
图2a-b为在开始转导过程前,cd34+细胞在e4orf1+uvec细胞上的扩增导致细胞群转导效率的提高。图2a-8天后红色荧光蛋白(rfp)-标记的细胞的百分比%(白色柱-占总细胞群的百分比%;黑色柱-占cd34+细胞群的百分比%)。图2b-8天后总cd34+细胞和总rfp+/cd34+细胞。此处未明确的条件在实施例中进行详细说明。
图3a-b显示提高细胞因子的量,cd34+细胞在e4orf1+uvec细胞上的扩增得到改善。图3a-7天后cd45+(总)造血细胞的倍数扩增。图3b-7天后cd34+造血细胞的倍数扩增。“共转导(co-transduced)”样品-白色柱;“分离的转导(separated-transduced)”样品-黑色柱)。此处未明确的条件在实施例中进行详细说明。
图4a-b显示当与e4orf1+uvec共培养相配合(inconcertwith)进行转导时,cd34+细胞的转导效率得到提高。图4a-7天后的bfp-标记的细胞占总细胞群的百分比%。图4b-7天后的bfp-标记的细胞占cd34+/cd45+细胞群的百分比%(“共转导”样品-白色柱;“分离的转导”样品-黑色柱)。此处未明确的条件在实施例中进行详细说明。
图5显示提高细胞因子的量与cd34+细胞的转导相结合,同时与e4orf1+uvec细胞共培养,可以提高转导的cd34+细胞群的转导效率和总体细胞产量。此处未明确的条件在实施例中进行详细说明。
图6显示在采用e4orf1+uvec细胞的电穿孔过程中,总造血细胞产量提高。分离自动员后的外周血(mobilizedperipheralblood,mpb)的500,000个cd34+细胞被转染。通过电穿孔,所述转染递送表达绿色荧光蛋白(gfp)的质粒。在刺激,转染,复原(recovery)/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。用于鉴定造血细胞上的cd45的荧光抗体用于确定培养物的造血含量(hematopoieticcontent),并与血细胞计数相结合,产量如图所示(轴表示细胞数以百万计)。此处未明确的条件在实施例中进行详细说明。
图7a-b显示在采用e4orf1+uvec细胞的电穿孔期间,总cd45+cd34+hspc细胞产量增加。分离自动员后的外周血的500,000个cd34+细胞被转染。通过电穿孔方法,所述转染递送表达gfp的质粒。在刺激,转染,复原/扩增阶段期间,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。采用流式细胞仪对细胞数进行定量。用于鉴定造血干细胞和祖细胞上的cd34和cd45的荧光抗体用于确定培养物的hspc的含量。gfp的表达表示成功转染细胞。通过流式细胞仪进行定量和使用血细胞计数器进行细胞计数,总的cd45+cd34+hspc的产量如图7a柱状图所示(轴表示细胞数以百万计),成功转染的cd45+cd34+hspc的产量如图7b柱状图所示(轴表示细胞数以百万计)。此处未明确的条件在实施例中进行详细说明。
图8a-d显示在电穿孔过程中,当hspc与e4orf1+uvec细胞共培养时,提高了集落形成单位(cfu)。在刺激,转染,复原/扩增阶段期间,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e),如实施例所述。集落形成单位(cfu)试验中,1000个总细胞(单独hspc或与e4orf1+uvec细胞共培养的hspc)被铺到6孔板的两个孔中,每个孔在甲基纤维素中处理两周。采用stemvision仪量化并区分每1000个铺板的细胞集落的频率。图8a是示出所有类型集落的量的柱状图(轴表示集落总数)。图8b是表示红系爆式集落形成单位(bfu-e)的柱状图(轴表示bfu-e集落数)。图8c是粒-巨噬细胞集落形成单位(cfu-gm)的定量柱状图(轴表示cfu-gm集落数)。图8d是粒细胞红细胞巨噬细胞巨核细胞集落形成单位-(cfu-gemm)的定量柱状图(轴表示cfu-gemm集落数)。此处未明确的条件在实施例中进行详细说明。
图9显示在电穿孔过程中,当hspc与e4orf1+uvec细胞共培养时,集落形成单位(cfu)得到提高。在刺激,转染,复原/扩增阶段期间,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e),如实施例所述。集落形成单位(cfu)试验中,1000个总细胞(单独hspc或与e4orf1+uvec细胞共培养的hspcs)被铺到6孔板的两个孔中,每个孔在甲基纤维素中处理两周。使用stemvision仪量化并区分每1000个铺板的细胞集落的频率。为了量化粒细胞红细胞巨噬细胞巨核细胞集落形成单位(cfu-gemm)的比率,考虑不能形成集落的e4orf1+uvec细胞的存在,对数据进行归一化。柱状图表示cfu-gemm在整个扩增产物中比率。此处未明确的条件在实施例中进行详细说明。
图10表示在使用e4orf1+uvec细胞的慢病毒转导过程中,总的造血细胞的量得到增加。分离自动员后的外周血的450,000个cd34+细胞被转导,感染复数(moi)为25。所述转导递送表达绿色荧光蛋白(gfp)的转基因。在刺激,转导,复原/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转导阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。用于鉴定造血细胞上的cd45的荧光抗体用于确定培养物中的造血含量(hematopoieticcontent),并与血细胞计数器计数相结合,产量如图所示(轴表示细胞数以百万计)。此处未明确的条件在实施例中进行详细说明。
图11a-b显示在采用e4orf1+uvec细胞的慢病毒转导过程中,总cd45+cd34+hspc细胞产量增加。分离自动员后外周血的450,000cd34+细胞被转导,感染复数(moi)为25。所述转导递送表达绿色荧光蛋白(gfp)的转基因。在刺激,转导,复原/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转导阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。采用流式细胞仪对细胞进行定量。荧光抗体用于鉴定培养物中造血干细胞和祖细胞上的cd34和cd45,并确定hspc的含量。gfp的表达表示成功转导细胞。通过流式细胞仪进行定量和使用血细胞计数器计数后,总的cd45+cd34+hspc的产量如图11a柱状图所示,成功转染的cd45+cd34+hspc的产量如图11b柱状图所示。轴表示细胞数以百万计。此处未明确的条件在实施例中进行详细说明。
图12a-b显示在采用e4orf1+uvec细胞的慢病毒转导过程中,总的cd45+cd34+cd38-cd45ra-cd49f+干细胞的量得到提高。分离自动员后的外周血的450,000个cd34+细胞被转导,感染复数(moi)为25。所述转导递送表达gfp的转基因。在刺激,转导,复原/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转导阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。采用流式细胞仪对细胞进行定量。用于鉴定造血干细胞上的cd38,cd45ra,cd49f,cd34和cd45的荧光抗体用于确定培养物中的干细胞含量。gfp的表达表示成功转导细胞。通过流式细胞仪进行定量和使用血细胞计数器计数后,总的干细胞的产量如图12a柱状图所示(轴表示细胞数以百万计),成功转导的干细胞的产量如图12b柱状图所示(轴表示细胞数)。此处未明确的条件在实施例中进行详细说明。
图13表示在采用e4orf1+uvec细胞的慢病毒转导过程中,总的造血细胞的产量得到提高。分离自动员后的外周血的300,000个cd34+细胞被转导,感染复数(moi)为50。所述转导递送表达gfp的转基因。在刺激,转导,复原/扩增阶段,cd34+细胞在刺激和转导阶段暴露于细胞因子(scf,tpo,flt3-l)中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);以及所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。用于鉴定造血细胞上的cd45的荧光抗体用于确定培养物的造血含量,结合血细胞计数器进行计数,以确定细胞的产量,如柱状图所示(轴表示细胞数以百万计)。此处未明确的条件在实施例中进行详细说明。
图14a-b表示在采用e4orf1+uvec细胞的慢病毒转导过程中,总的cd45+cd34+hspc细胞的量增加。分离自动员后的外周血的300,000个cd34+细胞被转导,感染复数(moi)为50。所述转导递送表达gfp的转基因。在刺激,转导,和复原/扩增阶段,cd34+细胞在刺激和转导阶段暴露于细胞因子(scf,tpo,flt3-l)中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);以及所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。采用流式细胞仪对细胞进行定量。用于鉴定造血干细胞和祖细胞上的cd34和cd45的荧光抗体用于确定培养物中的hspc含量。gfp的表达表示成功转导细胞。通过流式细胞仪进行定量和使用血细胞计数器进行计数,总的cd45+cd34+hspc的产量如图14a柱状图所示,成功转染的cd45+cd34+hspc的产量如图14b柱状图所示(轴表示细胞数以百万计)。此处未明确的条件在实施例中进行详细说明。
图15a-b表示在采用e4orf1+uvec细胞的慢病毒转导过程中,总的cd45+cd34+cd38-cd45ra-cd49f+干细胞的量得到提高。分离自动员后的外周血的300,000个cd34+细胞被转导,感染复数(moi)为50。所述转导递送表达绿色荧光蛋白(gfp)的转基因。在刺激,转导,复原/扩增阶段,cd34+细胞在刺激和转导阶段暴露于细胞因子(scf,tpo,flt3-l)中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);以及所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。采用流式细胞仪对细胞进行定量。用于鉴定造血干细胞上的cd38,cd45ra,cd49f,cd34和cd45的荧光抗体用于确定培养物中的干细胞含量。gfp的表达表示成功转导细胞。通过流式细胞仪进行定量和使用血细胞计数器计数后,总的干细胞的产量如图15a柱状图所示,成功转导的干细胞的产量如图15b柱状图所示(轴表示细胞数)。此处未明确的条件在实施例中进行详细说明。
详细说明
本专利公开的“发明内容”,“附图”,“附图说明”,“实施例”和“权利要求书”部分描述了本发明的一些主要实施方式。该“详细说明”部分提供了与本发明的组合物和方法相关的某些进一步的描述,并且旨在与本专利公开的所有其它部分相结合地进行理解。此外,对于本领域技术人员来说显而易见的是,本专利公开中通篇所描述的不同实施例可以是,并且旨在以各种不同的方式组合使用。本文描述的特定实施方式的不同组合旨在落入本发明的范围内。
下面提供了某些定义。在本专利公开其他部分定义的其它术语,具有从使用它们、或根据本领域通常含义使用它们的上下文得出的清楚的含义。
如本文中所使用的,术语“约”和“大约”当与数值一起使用时,是指在所述数值的+/-20%以内。
本文所使用的术语“培养”是指在各种类型的介质上或介质中进行的细胞扩增。“共培养”是指两种或多种不同类型的细胞在各种类型的介质上或介质中的扩增,例如,在一些实施方式中,可以将e4orf1+ec和造血干/祖细胞(hspcs)共培养。
术语“工程化”当用于本文中的细胞时,是指已被人工改造以产生所述表型(如e4orf1+),或表达所述核酸分子或多肽的细胞。术语“工程化细胞”不包括自然产生的细胞,而旨在包括,例如包含重组核酸分子的细胞,或被人为改变(例如,通过遗传修饰)的细胞,例如因此它们表达原本不表达的多肽,或因此它们表达比非工程化内皮细胞中所观察到的水平大体上更高水平的多肽。
在细胞或细胞培养的上下文中,术语“扩增(expansion)”或“扩增(expanding)”是指初始细胞群的特定类型(例如“靶细胞”,如hspc)的细胞数量的增加。用于扩增的初始细胞不必与扩增生成的细胞相同。例如,扩增的细胞可以通过初始细胞群的生长和/或分化而产生。
“遗传修饰”或“基因修饰”是指任何对细胞的正常核苷酸序列的添加,缺失或破坏,包括但不限于“基因编辑”。典型地,基因修饰采用“基因递送”方法进行。
“基因递送”是指将任何外源核酸分子递送至细胞中。本发明涵盖的基因递送方法包括但不限于,“转导”法(即,病毒介导的核酸至靶细胞的导入)和“转染”法(即,非病毒介导的核酸至靶细胞的导入)。
术语“造血干细胞”或“hsc”是指能最终分化为造血系统的所有细胞类型的克隆形成的(clonogenic),自我更新的多能细胞,包括b细胞,t细胞,nk细胞,淋巴树突状细胞,髓样树突细胞,粒细胞,巨噬细胞,巨核细胞和红系细胞。与造血系统的其它细胞一样,hsc典型地由细胞标记物的特征集的存在来确定。
如本文所用的术语“造血干/祖细胞”或“hspc”包括如上所定义的hsc,以及能够最终分化为造血系统的所有细胞类型的多能非自我更新祖细胞(multipotentnon-self-renewingprogenitorcells),和能分化为造血系统的特定细胞类型的低聚能(oligopotent)和单能性(unipotent)祖细胞。hspcs包括cmps,mps,meps和gmps,其中的每一个在本文其他部分进行定义。
本文所使用的术语“分离的”是指一种产物(如细胞)或组合物,其从与之自然发生状态(无论是天然的还是人工合成的)相关的至少一种其它产物或组合物中分离得到。
本文中所使用的术语“重组”是指由人工(包括通过机器)采用分子生物学和基因工程(如分子克隆)方法产生的核酸分子,它包括天然不存在的核苷酸序列。因此,重组核酸分子与天然存在的核酸分子(例如在生物体基因组中存在的)不同。包括mrna序列的互补dna或“cdna”的拷贝,而没有任何中间的内含子序列(如在相应的基因组dna序列中发现的)的核酸分子,因此被认为是重组核酸分子。作为实例,重组e4orf1核酸分子可以包括可操作地连接到启动子和/或其他基因组件的e4orf1编码序列,所述编码序列与启动子和/或其他基因组件不同寻常地关联在天然存在的腺病毒基因组中。
术语“自我更新”是指细胞进行分裂以生成与母细胞具有相同特征(例如自我更新)至少一子细胞的能力。第二子细胞可以定向于特定的分化途径。例如,自我更新造血干细胞分裂并形成一子干细胞,和另一定向于骨髓或淋巴途径的子细胞。定向祖细胞通常失去自我更新能力,并且在细胞分裂时产生显示出更具分化(即,受限的)表型的两个子细胞。
术语“个体”和“患者”可在本文中互换使用,除非另有说明,其是指哺乳动物,诸如人,非人灵长类动物,以及兔,大鼠,小鼠,山羊,猪和其它哺乳动物物种。
在本文中与细胞群相关使用的短语“大体上纯的”时,是指实施方式中特定类型(例如,通过表达一种或多种特定的细胞标记物,形态特征或功能特征来确定的),或特定的多个类型(复数)的细胞群,其中两个或多个不同的细胞类型一起使用,即至少约50%,优选至少约75-80%,更优选至少约85-90%,最优选至少约95%的细胞组成总细胞群。因此,“大体上纯的细胞群”是指包含少于约50%,优选少于约20-25%,更优选少于约10-15%,最优选少于约5%的细胞不是特定类型或特定的多个类型。
本文所述的本发明的几个实施方式涉及内皮细胞,例如,表达腺病毒e4orf1多肽的工程化内皮细胞-即e4orf1+内皮细胞(e4orf1+ec)。这些细胞包括编码e4orf1的核酸分子。e4orf1多肽和/或编码e4orf1的核酸分子可以具有本文所定义的或本领域已知的氨基酸序列或核苷酸序列,或可以具有这些氨基酸或核苷酸序列的变体,衍生物,突变体,或片段的氨基酸序列或核苷酸序列——假设这些变体,衍生物,突变体或片段具有或编码具有本文所述的一种或多种功能特性的多肽,其包括但不限于,能够支持内皮细胞在培养物中的维持或扩增的能力,和/或支持另一靶细胞类型(例如hspc)在培养物中的扩增,和/或提高基因导入至另一靶细胞类型(例如hspc)的效率。
在涉及腺病毒e4orf1多肽的那些实施方式中,所用的多肽序列可以来自任何合适的腺病毒类型或菌株,如人腺病毒2,3,5,7,9,11,12,14,34,35,46,50,或52型,在一些优选的实施方式中,所用的多肽序列来自人腺病毒5型。这些腺病毒多肽的氨基酸序列,以及编码这些多肽的核酸序列在本领域中是公知的,并且在众所周知的公开可用的数据库(例如genbank数据库)中是可获得的。例如,合适的序列包括如下:人腺病毒9(genbank登录号cai05991),人腺病毒7(genbank登录号aar89977),人腺病毒46(genbank登录号aax70946),人腺病毒52(genbank登录号abk35065),人腺病毒34(genbank登录号aaw33508),人腺病毒14(genbank登录号aaw33146),人腺病毒50(genbank登录号aaw33554),人腺病毒2(genbank登录号ap.sub.--000196),人腺病毒12(genbank登录号ap.sub.--000141),人腺病毒35(genbank登录号ap.sub.--000607),人腺病毒7(genbank登录号ap.sub.--000570),人腺病毒1(genbank登录号ap.sub.--000533),人腺病毒11(genbank登录号ap.sub.--000474号),人腺病毒3(genbank登录号abb17792)和人腺病毒类型5型(genbank登录号d12587)。
在一些实施方式中,本文所述的内皮细胞包括e4orf1核酸或氨基酸序列,而没有来自腺病毒e4区的其它序列——例如,在某些实施方式中,内皮细胞包括e4orf1序列,但不包括整个e4区,或来自整个e4区的其它开放阅读框(orfs)——例如e4orf2,e4orf3,e4orf4,和/或e4orf5。然而,在其它实施方式中,本文所述的内皮细胞可以包括e4orf1序列,以及来自e4区的一种或多种其它核酸或氨基酸序列,如e4orf2,e4orf3,e4orf4,e4orf5,或e4orf6序列,或其变体,突变体或片段。
在本文所述的所有涉及多肽和/或核酸分子的实施方式中,在一些实施例中,这些多肽和/或核酸分子具有与本文特别定义的或本领域已知的(例如,在诸如genbank数据库的公共序列数据库中)多肽和/或核酸分子相同的氨基酸或核苷酸序列。在一些实施方式中,本发明的多肽和核酸分子可以具有这些序列的变体,衍生物,突变体,或片段的氨基酸或核苷酸序列,例如与这些序列具有大于85%序列同一性的变体,衍生物,突变体,或片段。在一些实施方式中,变体,衍生物,突变体或片段具有已知序列约85%的序列同一性,或具有已知序列约88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%的序列同一性。在一些实施方式中,已知核苷酸序列的变体,衍生物,突变体,或片段,在长度上约50个核苷酸,或约45个核苷酸,或约40个核苷酸,或约35个核苷酸,或约30个核苷酸,或约28个核苷酸,26个核苷酸,24个核苷酸,22个核苷酸,20个核苷酸,18个核苷酸,16个核苷酸,14个核苷酸,12个核苷酸,10个核苷酸,9个核苷酸,8个核苷酸,7个核苷酸,6个核苷酸,5个核苷酸,4个核苷酸,3个核苷酸,2个核苷酸,或1个核苷酸不同于所述已知核苷酸序列。在一些实施方式中,已知氨基酸序列的变体,衍生物,突变体,或片段,在长度上约50个氨基酸,或约45个氨基酸,或约40个氨基酸,或约35个氨基酸,或约30个氨基酸,或约28个氨基酸,26个氨基酸,24个氨基酸,22个氨基酸,20个氨基酸,18个氨基酸,16个氨基酸,14个氨基酸,12个氨基酸,10个氨基酸,9个氨基酸,8个氨基酸,7个氨基酸,6个氨基酸,5个氨基酸,4个氨基酸,3个氨基酸,2个氨基酸,或1个氨基酸不同于所述已知氨基酸序列。
根据所需的用途,例如抗生素抗性基因,报告基因或表达标签(如编码gfp的核苷酸序列),用于同源重组的序列,或任何其它可能需要的核苷酸序列或基因,本文所述的核酸分子可用于含有各种其它核酸序列,基因或编码区的构建体中。本文所述的多肽可以单独表达或作为融合蛋白的一部分来表达。
在一些实施方式中,本文所述的核酸分子可以在允许表达的一种或多种启动子的控制下。可以使用任何能够在所需细胞类型中驱动核酸序列表达的启动子。合适的启动子的实例包括但不限于cmv,sv40,rsv,hiv-ltr和mml启动子。所述启动子也可以是来自腺病毒基因组的启动子或其变体。
在一些实施方式中,本文所述的核酸分子可以位于诱导型启动子的控制下,使得核酸序列的表达可以根据需要开启或关闭。可以使用任何合适的诱导型表达系统,例如,比如四环素诱导型表达系统或激素诱导型表达系统。例如,本发明的核酸分子可以在需要时表达,并在达到所需结果时关闭。开启或关闭表达的能力对于体内应用是特别有用的,例如用于采用本文所述方法所产生的遗传修饰的靶细胞在体内的应用中。
本文所述的核酸分子可以包括天然存在的核苷酸,合成的核苷酸,或其组合。例如,在一些实施方式中,核酸分子可以包括rna,例如在细胞内是稳定的且可用于细胞内直接的蛋白质表达/生产的合成修饰的rna。在其它实施方式中,核酸分子可以包括dna。在使用dna的实施方式中,dna序列可与一种或多种合适的启动子和/或调控元件可操作地连接,以允许(和/或促进,增强或调节)在细胞内的表达,并且可以存在于一种或多种合适的载体或构建体中。
本发明多肽和核酸分子的处理,操纵和表达可利用分子生物学和细胞生物学的常规技术进行。这些技术在本领域中是公知的。例如,人们可以参考sambrook,fritsch和maniatis编辑,“molecularcloningalaboratorymanual,2nded.,coldspringsharborlaboratorypress,1989;以及methodsofenzymology(academicpress,inc.)系列丛书或任何其它标准文章的教导,用于指导使用合适的技术来处理,操纵和表达核苷酸和/或氨基酸序列。在美国专利no.8,465,732中描述了与e4orf1序列的处理或表达相关的其它方面,其内容在此以参考的方式引入。
本发明提供了用于将基因递送至靶细胞的改进方法。在一些实施方式中,可以使用本领域已知的任何合适的基因递送系统,如任何合适的转染系统或任何合适的转导系统。
依照本发明可使用的转染方法包括但不限于脂质体介导的转染,聚凝胺介导的转染,deae葡聚糖介导的转染,电穿孔,核转染(nucleofection),磷酸钙沉淀,微注射,微粒子轰击。
可使用的转导方法包括但不限于慢病毒介导的转导,腺病毒介导的转导,逆转录病毒介导的转导,腺相关病毒介导的转导和疱疹病毒介导的转导。
在一些实施方式中,靶细胞可以是遗传修饰的,这样使得它们包括已知的参与或被怀疑参与影响靶细胞类型的疾病或紊乱的修正版基因,或任何其它基因,例如治疗有效的基因,可以期望将其提供在靶细胞中或使用靶细胞来进行施用或递送。在一些实施方式中,本发明的方法可用于基因组编辑技术或与基因组编辑技术联合使用,例如,利用工程化核酸酶在靶细胞基因组中插入,删除,或替换期望的核苷酸序列的基因组编辑技术。典型地,这些核酸酶在基因组中产生位点特异性的双链断裂,并采用非同源末端连接或同源重组来将其修复。目前用于基因编辑技术的这些核酸酶主要分为四个家族——即,归巢核酸内切酶,锌指核酸酶(zfn),转录激活样效应因子核酸酶或“talens”,以及crispr-cas系统核酸酶(如cas9)。
本发明的方法包括内皮细胞(ec)的使用,例如,被改造成表达e4orf1的内皮细胞-即e4orf1+ec。这种内皮细胞可以来源于本领域已知的任何合适的内皮细胞。例如,在一些实施方式中,内皮细胞是血管内皮细胞。在一些实施方式中,内皮细胞为原代内皮细胞。在一些实施方式中,工程化内皮细胞是哺乳动物细胞,例如人或非人灵长类动物细胞,或兔,大鼠,小鼠,山羊,猪或其它哺乳动物细胞。在一些实施方式中,内皮细胞是原代人内皮细胞。在一些实施方式中,内皮细胞是脐静脉内皮细胞(uvec),例如人脐静脉内皮细胞(huvec)。其它合适的可以使用的内皮细胞包括之前在美国专利no.8,465,732中所描述的那些适于表达e4orf1的内皮细胞,其内容在此以参考的方式引入。
本发明的工程化内皮细胞可以以各种形式存在或提供。例如,在一些实施方式中,工程化内皮细胞可以包括细胞群,例如分离的细胞群。在一些实施方式中,工程化内皮细胞可以包括离体的细胞群。在一些实施方式中,工程化内皮细胞可以包括大体上纯的细胞群。例如,在一些实施方式中,本发明构成总细胞群的至少约50%,优选至少约75-80%,更优选至少约85-90%,最优选至少约95%的细胞工程化内皮细胞。在一些实施方式中,工程化内皮细胞可以以包含工程化细胞和一种或多种附加成分的组合物的形式提供。例如,在一些实施方式中,本发明可以提供一种组合物,其包括本文所述的工程化内皮细胞群以及载体溶液,如生理盐水,细胞悬浮介质,细胞培养介质等等。在一些实施方式中,所述组合物可以是治疗性组合物——包含工程化内皮细胞群和适于施用于个体(如人体)中的载体溶液。如果需要,可以包括其它治疗可接受的药剂。本领域技术人员可以根据预期用途容易地选择包含在治疗性组合物中的合适药剂。
培养细胞的方法是本领域公知的,并且可以使用任何合适的细胞培养方法。例如,可以使用已知用于培养其它内皮细胞的方法,或已知用于培养表达e4orf1的内皮细胞的方法来培养e4orf1+细胞,例如,如美国专利no.8,465,732中所描述的,其内容在此以引用的方式并入。在一些实施方式中,本发明的工程化内皮细胞可以在没有血清的情况下,或在没有外源生长因子的情况下,或在没有血清和外源生长因子的情况下进行培养。本发明工程化内皮细胞也可以冷冻保存(cryopreserved)。用于细胞培养和细胞冷冻保存的各种方法是本领域技术人员公知的,如cultureofanimalcells:amanualofbasictechnique,4thedition(2000)(作者r.ianfreshney(″freshney″))中所描述的方法,其内容在此以参考的方式并入。
在一些实施方式中,本发明涉及原代内皮细胞,内皮祖细胞或e4orf1+ec饲养层细胞的使用,以支持在共培养方法中其它细胞(如靶细胞)的存活、扩增和或遗传修饰。例如,在一个实施方式中,e4orf1+ec细胞群可以用作饲养层细胞以支持干/祖细胞(例如hspcs和hspcs)的生长、扩增或遗传修饰。
在一些实施方式中,本发明提供了用于培养e4orf1+ec细胞群和靶细胞群的共培养方法。这种共培养方法可以包括在同一培养容器中一起培养e4orf1+ec细胞群和靶细胞群。在一些这样的实施方式中,e4orf1+ec可以在培养容器的表面上形成饲养细胞层,所述靶细胞可以位于饲养细胞层上。在另一实施方式中,本发明提供了一种培养靶细胞的方法,包括:将靶细胞与从e4orf1+细胞的培养物中获得的条件培养基接触。
本发明还提供了用于实施本文所述的各种方法的试剂盒。这种试剂盒可以包含本文所述的任何组分,包括但不限于核苷酸序列,载体,内皮细胞,e4orf1+内皮细胞,对照非工程化内皮细胞,靶细胞(如hspc),用于维持或扩增e4orf1+ec或靶细胞的介质或组合物,或它们的任意组合。所有这些试剂盒可任选地包括使用说明,容器,培养瓶等等。试剂盒可包括标签,其可以包含任何书写的或记录的材料,可以是电子的或计算机可读形式(例如,磁盘、光盘、存储芯片或磁带),以提供用于使用所述试剂盒的说明或其它信息。
本发明的某些方面可以在以下非限制性的实施例中进一步描述。应注意的是,实施例中的描述,以及本发明特定实施方式的上述描述均是为说明和描述的目的而呈现。它们并不旨在穷举或将本发明局限于所公开的具体形式中。根据本专利申请的教导,可以对本文所描述的特定实施方式做出诸多修改和变化。本发明选择和描述的实施方式是为了更好地解释本发明的原理及其实际应用,从而使本领域技术人员能够更好地利用本发明和适于预期特定用途的具有各种修改的各种实施方式。
具体实施方式
在以下实施例中产生的一些数据被提供在附图中。此外,本专利公开的附图说明部分包含关于这些实施例的某些附加信息,包括关于所进行的实验和所产生的数据的更多细节。本发明的实施例旨在结合附图和附图说明来理解。
实施例1
e4orf1+共培养对hspc的扩增&病毒转导的影响
进行实验以评估e4orf1+内皮细胞对扩增和转导cd34+/cd45+hspc的能力的影响。按如下三种不同方案,采用红色荧光蛋白(rfp)对cd34+细胞(lonza)进行转导,并在6孔板中的e4orf1+脐静脉内皮细胞(uvec)培养物上进行扩增,如下所示:
在方案1中,在开始hspc-e4orf1+uvec共培养之前24小时,开始转导(“先转导”)。
在方案2中,与hspc-e4orf1+uvec共培养的同时进行转导(同时转导)。
在方案3中,hspc与e4orf1+uvec共培养48小时,之后将悬浮的(floating)hspc转移到空的孔中进行转导(24小时),转导后,接着将hspc与e4orf1+uvec共培养(“扩增-转导”)。
在上述每一种方案中,细胞培养在低氧条件下进行。同样,在每一种方案中,大约100,000个造血细胞(通过流式细胞仪确定其中95,000个造血细胞为cd34+)要么被铺到空的孔中(方案1),要么被铺到已预先用e4orf1+uvec细胞接种形成融合层(confluency)的孔中(方案2和3)。在6孔板的一个孔的融合层存在的e4orf1+uvec细胞的数量为约300,000个。培养基由stemmacshsc扩增培养基(生产商为miltenyibiotec)和100ng/ml的scf,flt3,和tpo细胞因子组成。所述转导过程由将所述细胞与工程化为rfp和聚凝胺的慢病毒孵育的24小时期间组成。然后将转导的细胞收集,离心,悬浮在含有细胞因子的新鲜培养基中,再涂布至融合的e4orf1+uvec培养物上。此后每两天更换培养基(包括细胞因子)。在所有三种方案中,细胞扩增总共为8天,然后对细胞进行收集,计数,并用cd34和cd45抗体染色以用于facs分析。
总造血细胞和cd34+亚群(即hspc)均证明,与仅对cd34+细胞进行转导相比,当转导过程在与e-celuvec细胞共培养的情况下发生时,表现出更高倍数的扩增(图1)。此外,在启动转导过程之前进行48小时的共培养期,这些细胞的扩增潜能被进一步提升。类似地,证明的最有效的转导过程是,在开始转导过程之前,将造血细胞和e4orf1+uvec细胞共培养48小时(图2)。重要的是,这些结果既指示了尤其cd34+亚群被最有效地转导(图2a),也显示出所述转导的细胞群的最大扩增(图2b)。综上,这些数据表明使cd34+造血细胞适应于与e4orf1+uvec细胞共培养,能显著提高转导的效率和转导的细胞群的整体细胞产量。
实施例2
悬浮部分&细胞因子对病毒转导效率的影响
进行实验以确定去除cd34+造血细胞的“悬浮部分”(floatingfraction')对转导效率的影响,并确定细胞因子浓度是否对转导效率有影响。
按如下四种不同方案采用蓝色荧光蛋白(bfp)对cd34+细胞(lonza)进行转导,并在6孔板的e4orf1+uvec培养物上进行扩增,如下所示:
在方案1和3中,hspc在e4orf1+uvec培养物上扩增96小时,随后通过将hspcs与工程化为表达bfp的慢病毒孵育24小时来进行转导,其中hspc仍在e4orf1+ec饲养层上。然后,hspc在e4orf1+ec培养物再扩增两天。采用这些方案获得的结果在图中被称为“共转导”结果。
在方案2和4中,hspc在e4orf1+uvec培养物上扩增96小时,随后悬浮部分被转移到空的孔中,并通过将hspc与工程化为表达bfp的慢病毒孵育24小时来进行转导。在转导期后,hspc在e4orf1+uvec培养物上再培养两天。采用这些方案获得的结果在图中被称为“分离的转导(separatedtransduction)”结果。
在方案1和2中,使用的细胞培养基由stemmacshsc扩增培养基(生产商为miltenyibiotec)以及细胞因子scf,flt3,和tpo各100ng/ml组成——在图中被称为“标准细胞因子剂量”。在方案3和4中使用的细胞培养基由stemmacshsc扩增培养基(生产商为miltenyibiotec)以及scf和flt3各300ng/ml,tpo和il-6各100ng/ml,以及20ngml的il-3组成-在图中被称为“高细胞因子剂量”。
在上述各方案中,所有细胞培养在低氧条件下进行。同样,在这4种方案中的每一种方案中,将100,000个造血细胞(包含95,000个cd34+细胞-由流式细胞仪确定)铺到e4orf1+uvec细胞的融合层上。存在于6孔板的一个孔的融合层上的e4orf1+uvec细胞的数量约为300,000个。在造血细胞/e4orf1+ec共培养96小时期后,启动转导过程,所述转导过程由将样品与工程化为表达bfp和聚凝胺的慢病毒孵育的24小时期组成。然后收集转导的样品,离心,重悬在新鲜培养基中(具有细胞因子-如所述的),并铺到e4orf1+uvec培养物上。此后每两天更换培养基(具有细胞因子)。所有样品的扩增持续总共7天,之后收集细胞,计数,并用抗体对cd34和cd45染色以进行facs分析。
如所期望的,在使用较高剂量的细胞因子时,总造血细胞群和cd34+造血细胞亚群均表现出更高倍数的扩增(图3)。与不存在e4orf1+ec的情况下进行的转导相比,在e4orf1+uvec培养物存在的情况下进行转导的造血细胞群的倍数扩增似乎与之只有很小差异。然而,令人惊奇地,在转导过程中,在e4orf1+uvec细胞存在下对造血细胞进行转导的效率,高于对从e4orf1uvec培养物中临时分离的造血细胞的转导效率(图4)。因此,尽管在可潜在地具有吸收/隔离(sequestered)病毒的转导步骤中存在第二细胞类型(即,e4orf1+uvec),当在e4orf1+uvec细胞的存在下进行转导时,造血细胞-特别是cd34+/hspc细胞级分-仍证明了较高的病毒摄取能力。而给予细胞因子的量对转导效率有很小的影响(图4),使用较高剂量的细胞因子会导致更大数量的转导的cd34+细胞总量—这可能归因于细胞扩增的提高和/或转导的cd34+cd45+细胞数量的增加(图5)。综上,这些结果表明,在e4orf1+uvec培养物存在的情况下转导hspc可以改善病毒转导效率,并且通过增加在扩增过程中使用的细胞因子的剂量,可以进一步提高转导的细胞的数量。
实施例1和2中所示的数据证明,某些靶细胞(如hspc)与e4orf1+ec的共培养可以显著提高基因导入的效率。具体而言,本文所呈现的结果证明了病毒转导hspc-基因编辑领域的一个主要障碍-可以利用e4orf1+ec共培养体系得到显著改善。e4orf1+uvec细胞的存在可以提高cd34+/cd45+hspc的总产量,以及在该重要干细胞群中的转导效率。e4orf1+ec共培养的双重益处是可以代表用于提高各种基因导入方法的效率的新方法-例如用于基因编辑和/或基因治疗的目的。
实施例3
通过随后的ec共培养拯救转染的细胞
转染的或转导的细胞,例如通过电穿孔转染的细胞,可以在转染或转导之后与ec一起培养。这种后续的共培养可以“拯救(rescue)”在转染或转导过程中被破坏的细胞—减少转染的或转导的细胞的死亡和损失。这种共培养应在转染或转导步骤开始后“立即”开始(如在本专利说明书中所定义的那样),并且应当持续足够的时间以允许靶细胞的复原。不希望受理论的束缚,人们认为这样的“拯救”可以是两个细胞群(即转导/转染的细胞和ec)之间的细胞-细胞接触的结果,和/或可以是将转导/转染的细胞暴露于由ec分泌的可溶性因子的结果,如血管生成因子和细胞因子。这两个细胞群的共培养也可以促进和/或提高转导的或转染的细胞的扩增。
所用的ec可以是任何期望的ec。可以使用器官特异性的ec(即,ec与转导的/转染的细胞来源于同一器官)。也可以使用e4orf1+ec。
实施例4
e4orf1+共培养对hspc的扩增&通过电穿孔进行转染的影响
目的:为了测定在与e4orf1+内皮细胞共培养的情况下,电穿孔系统(lonza4d-核转染系统)对质粒gfp转染至人动员后的外周血(mpb)cd34+细胞的影响。
实验设计:除非另有说明,在5%氧气和37℃条件下进行细胞培养。在刺激,转染,复原/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段-即,刺激阶段,转染阶段,复原阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。在第0天,1,500,000人mpbcd34+细胞(来自allcells)被铺到低吸附(low-bindingattachment)6孔板(每孔500k)的两个孔中,以及预处理(pre-conditioned)e4orf1+uvec的6孔板的1个孔中(500k),所有均在含有细胞因子(100ng/mlscf,flt3,和tpo)的stemmacshsc扩增介质(生产商miltenyibiotec)中。第1天(24小时后),收集所有样品,离心,并计数。将细胞重悬在核转染溶液(nucleofectorsolution)和maxgfp质粒(来自lonza)中。对样品进行电穿孔处理,并按如下方式铺板:#1:第一低吸附孔被转移到新的低吸附孔(c/c/c)。#2:第二低吸附孔被转移到e4orf1+uvec孔(c/c/e)。#3:e4orf1+uvec孔被转移到第二e-cele4orf1+uvec孔(e/e/e)。所有样品继续在含有细胞因子(100ng/mlscf,flt3,和tpo)的stemmacshsc扩增介质(生产商miltenyibiotec)中进行培养。然后将板置于37℃,5%氧气培养箱中96小时(在转染后48小时再加入新鲜的培养基和细胞因子),在此时间,通过细胞计数,流式细胞计数和cfu分析进行分析。在使用e4orf1+ec的每种情况下,每孔中大约有300,000个这种细胞-即,共培养和转染/转导在e4orf1+ec融合单层的存在下进行(在6孔板的一个孔的融合层的ec的数量约为300,000)。
结果:整个试验在ec上扩增的总造血细胞(图6)特别是cd34+细胞(图7a)显示出最大的总扩增(提高6.4倍),随后为在转染过程后在ec上扩增的cd34+细胞(提高2.7倍)。在没有ec存在的情况下转染和扩增cd34+细胞,完全显示出最差的扩增(提高0.7倍)。值得注意的是,由于ec的存在,cd34+细胞群的转染效率不会受到不利影响(相对于在c/c/c和c/c/e样品中分别为73%cd34+细胞和76%cd34+细胞被转染,在e/e/e样品中为78%cd34+细胞被转染,暴露于e4orf1+uvec细胞更多则具有显著更高的转染的cd34+的总量-(图7b)。虽然cfu分析中所有样品的总集落形成是阳性的(图8a),仅在ec存在下扩增的cd34+细胞显示gemm的形成(图8d和图9),其指示在这些扩增群中存在多能祖细胞(mmp)。
结论:与在转染和扩增过程中ec细胞群延迟介入或完全不参与相比较,在ece4orf1+uvec细胞存在下对cd34+细胞进行转染和随后的扩增导致总细胞和转染的细胞的最大产量。此外,在转染过程中,转染效率出人意料地不受存在的ec细胞群的不利影响。最后,在cfu分析中,与ec共培养的样品上存在的gemm集落形成,证明在扩增过程中ec对cd34+细胞的mpp群的维持起着重要的作用。这些结果表明,当使用这些转染造血细胞时,与不引入e4orf1+uvec细胞相比,引入这些细胞可以改善进行的基因递送。
实施例5
利用e4orf1+uvec平台使用lenti-gfp转导猴非人灵长类动物mpbcd34+
目的:为了评估在e4orf1+uvec共培养情况下进行的非人灵长类动物mpbcd34+的转导效率和扩增
实验设计:在5%氧气下进行扩增试验。在刺激,转染,复原/扩增阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均在e4orf1+uvec细胞存在的情况下进行(e/e/e)。450,000个非人灵长类动物mpbcd34+细胞分别按如下方式铺到:#1)纤维连接蛋白包被的孔(6孔式);#2)纤维连接蛋白包被的孔(6孔式);#3)e4orf1+uvec细胞融合的孔(6孔式)。在第0天,所有三种样品均在含有100ngml的scf,flt3,和tpo的stemmacshsc扩增培养基(生产商miltenyibiotec)中进行初始cd34+铺板。第1天(24小时后),将所有样品重新加入新鲜的培养基和细胞因子;另外,向所有三种样品中加入感染复数为25的gfp慢病毒。第2天(转导后24小时),将样品#1传代至一个新的纤维连接蛋白包被的孔中。将样品#2和#3传代到新的预先接种e4orf1+uvec细胞的孔中。向所有样品中重新加入新鲜的培养基和细胞因子。第4天(转导后72小时),向所有样品中重新加入新鲜的培养基和细胞因子。第6天(转导后120小时),将细胞传代到含有新鲜培养基和细胞因子的纤维连接蛋白包被的孔中(样品#1)或e4orf1+uvec细胞孔中(样品#2和#3)。第8天(转染后168小时),向所有样品中重新加入新鲜的培养基和细胞因子。在第10天(转染后192小时),收集所有样品进行细胞计数和染色(用于facs分析)。在每个使用e4orf1+ec的情况下,在每个孔中存在大约300,000个这种细胞,即,共培养和转染/转导在e4orf1+ec融合单层的存在下进行(6孔板的一个孔的融合层中ec的数量约为300,000个)。
结果:与采用gfp进行转导刚结束后即在ec上扩增cd34+细胞(提高48倍)相比,整个试验在ec上扩增的总造血细胞(图10)特别是cd34+细胞(图11左)显示出更大的总扩增(提高62倍)。cd34+细胞在没有ec存在的情况下采用gfp转导和扩增,完全显示出最差的扩增(提高7倍)。在ec的存在下,cd34+群的转导效率(图11)稍微下降(相对于在c/c/c样品中转染的cd34+为60%,在e/e/e样品中转染的cd34+细胞为42%)。有趣的是,在不存在ec的情况下转导cd34+细胞,然后随后在ec上共培养,转导效率也轻微下降(在c/c/e样品中转导的cd34+为51%)。然而,当与e4orf1+uvec细胞共培养时,转染的cd34+细胞的总产量更高(图1ib)。表型干细胞群的转导效率也显示出类似的趋势(由cd45+cd34+cd38-cd45ra-cd49f+细胞测定):e/e/e样品-21%;c/c/e样品-24%;c/c/c样品-38%,图12)。值得注意的是,转导的干细胞的数量显著增加,e/e/e样品(~900,000细胞)和c/c/e样品(~850,000细胞),相对于c/c/c样品(~300,000)(图12b)。
结论:在转导过程中存在ec时,虽然猴cd34+细胞,更具体地是cd34+干细胞的转导效率稍小,但是当ec是所述过程的一部分时,所述转导的略微降低可以通过扩增产物中这些细胞数量的显著增加而抵消。因此,通过改变转导过程的条件,例如通过提高感染复数,可以使转导效率获得提高,同时仍然保持e4orf1+uvec细胞平台提供的细胞总产量的显著增加。
实施例6
利用e4orf1+uvec细胞平台,采用lenti-gfp转导人mpbcd34+
目的:确定在e-e4orf1+uvec细胞存在下采用lemigfp转导人mpbcd34+对转导效率和/或扩增潜能的影响。
实验设计:在5%氧气下进行扩增试验。在刺激,转染,复原/扩增阶段阶段,cd34+细胞仅暴露于细胞因子(scf,tpo,flt3-l)中(表示为c/c/c);在刺激和转染阶段暴露于细胞因子中,随后复原阶段与e4orf1+uvec细胞直接共培养(c/c/e);或所有3阶段均存在e4orf1+uvec细胞存在的情况下进行。300,000个人mpbcd34+细胞(来自allcells)按如下方式铺到:#1)纤维连接蛋白包被的孔(6孔式);#2)融合e4orf1+uvec细胞的孔(6孔式)。在第0天,在含有100ngml的scf,flt3,和tpo的stemmacshsc扩增培养基(生产商miltenyibiotec)中,对样品#1和#2中进行初始cd34+铺板。在第1天(24小时后),向两种样品中重新加入新鲜的培养基和细胞因子;另外,向所有样品#1和#2中加入moi为50的gfp病毒。在第2天(转导后24小时),每种样品被传代到在新鲜培养基和细胞因子中的新鲜的e4orf1+uvec细胞上。第4天(转导后72小时),细胞被重新给予新鲜的培养基和细胞因子。在第6天(转导后120小时),收集细胞,进行计数和染色(facs)。在使用e4orf1+ec的每种情况下,每个孔中存在大约300,000个这种细胞,即,共培养和转染/转导在e4orf1+ecs的融合单层的存在下进行(在6孔板的一个孔的融合处ec的数量约为300,000)。
结果:与cd34+细胞在用gfp转导过程刚结束后即在ec上扩增(提高7.9倍)相比来说,整个试验在ec上扩增的总造血细胞(图13)特别是cd34+细胞(图14a)显示出更大的总扩增(提高21.5倍)。由于ec的存在,cd34+群的转导效率略微下降(在e/e/e样品中61%cd34+细胞被转染,vs.在c/c/c样品中81%cd34+被转染-图14b)。相似地,表型干细胞群(由cd45+cd34+cd38-cd45ra-cd49f+细胞测定)在e/e/e样品(74%)中的转导效率相比于c/c/e样品(92%)也是稍微更低(图15)。值得注意的是,相对于c/c/c样品,在e/e/e样品中,转导的干细胞的数量有3倍增加(图15b)。
结论:尽管在转导过程中存在ec时,cd34+干细胞的lenti-介导的转导效率略微更低(e/e/e样品为74%,c/c/e样品为92%),这种适度降低可以通过在扩增过程结束时产生的成功转导的干细胞的大量增加相抵消(e/e/e样品为~100,000个转导的干细胞,c/c/e样品为~36,000个转导的干细胞)。另外,虽然高转导效率(例如>70%)和细胞的高产量是该平台的最终目标,对转导条件的进一步处理有助于进一步提高转导效率(例如>90%))而不会抑制重要细胞群的后续扩增。
***
通过权利要求书对本发明作进一步描述。
- 还没有人留言评论。精彩留言会获得点赞!