包含羟基酪醇和乳香酸的组合物的制作方法
本发明提供了包括向哺乳动物或禽类受试者施用:(i)3-o-乙酰基-11-酮基-β-乳香酸(akba)和(ii)羟基酪醇的方法。本发明还提供了包含akba和羟基酪醇的可口服施用组合物。
背景技术:
结缔组织是连接关节中软骨、骨、滑膜、韧带、半月板和肌腱的结构构架组织。结缔组织的组分由居留细胞产生,然后分泌以形成组织的细胞外基质(ecm)特征。除了用作结构构架组织以外,ecm还在细胞通讯和功能中起到关键作用。在关节软骨中,软骨细胞在ii型胶原ecm构架组织内以独特的模式进行排列。形成骨的成骨细胞和骨细胞以及骨再吸收破骨细胞在矿化的i型胶原ecm中进行组织。滑膜中的少数成纤维细胞样和巨噬细胞样细胞也由ecm保持在适当的位置。类似地,肌腱细胞和韧带细胞在ecm内装配在一起。结缔组织ecm的合成和分解由调节分子网络控制,这些调节分子也是由居留组织细胞产生的。该网络包括生长因子和被称为促炎介质的各种分子。
它们包括细胞因子、趋化因子、前列腺素和一氧化氮。这些分子显示出许多生物活性。它们可以诱导细胞增殖或细胞死亡。这些物质还可以诱导产生ecm的合成代谢途径或诱导可分解ecm的分解代谢酶。在细胞存活或死亡的生理条件下,结缔组织ecm的产生或分解受到严格控制以维持平衡的体内稳态。调节分子的产生和功能由许多因素调节,包括机械力、诸如温度和ph的生理因素、化学品、微生物及其产物。在一定条件下,这些因素可导致产生过多的和不适时的调节分子,造成不可弥补的组织损伤、功能丧失和死亡。
组织通过炎症反应对机械性、物理性、化学性损害和感染作出反应。已知炎症过程导致康复、治愈、防御感染并且通常维持生命。人和动物的炎症反应由两个阶段组成。初期阶段以局部合成促炎介质(如前列腺素和白三烯)为特征。它们由花生四烯酸通过环氧合酶和脂氧合酶的作用衍生得到。这些促炎介质增加局部血流量并提高内皮细胞的通透性以允许白细胞募集和积累。随后产生的其他促炎介质包括细胞因子(白细胞介素1β(il-1β)、肿瘤坏死因子α(tnf-α))、趋化因子(il-8)和一氧化氮。在第二阶段消退期中,在初期阶段生成的前列腺素激活酶途径,沿着该途径,花生四烯酸转化为具有抗炎性质的化学介质。据报道前列腺素e2(pge2)激活15-脂氧合酶的表达,15-脂氧合酶由花生四烯酸生成抗炎脂氧素。因此,炎症的消退由促炎反应驱动。这些研究表明炎症过程的开始、进行和终止受到严格控制。长时间的、夸大的炎症与许多病症相关,包括骨关节炎(oa)、类风湿性关节炎(ra)、阿尔茨海默氏病和心血管疾病。
在关节组织中,软骨细胞、滑膜细胞、成骨细胞、破骨细胞、韧带细胞和肌腱细胞产生大量的促炎介质。其中的一种是pge2,已知其通过诱导产生其他介质(包括细胞因子、一氧化氮和结缔组织降解金属蛋白酶(mmp))而发挥调节作用。由于其具有诱导金属蛋白酶(mmp)的能力,pge2有助于软骨ecm的分解。此外,pge2促进骨吸收和骨赘形成。pge2敏化外周神经末梢上的伤害感受器,因此有助于炎性疼痛的发展。pge2水平由环氧合酶-2(cox-2)局部调节。在诸如骨关节炎的病理条件下,cox-2的表达上调,伴随着pge2产生的增加。
tnf-α是炎症的主要介质,并且在炎症期间在组织再生/扩张和破坏中起重要作用。在正常状态下,炎症受这些因素的良好调节。也就是说,在这些因子引起炎症同时诱导免疫应答之后,它们的水平降低至正常状态。然而,失调的tnf-α产生引起慢性炎症,其与多种疾病如关节炎直接相关。
虽然炎症是解决组织损伤或感染所必需的关键免疫过程,但促炎介质如il-1β和tnf-α的长期释放可继续诱导产生另外的炎症介质。如果水平没有恢复到正常状态,则tnf-α的产生失调可潜在地导致有害的病理生理过程,包括骨关节炎(oa)。
tnf-α在炎症过程的启动中起关键作用。tnf-α由关节中的多种细胞(即软骨细胞、成骨细胞、滑膜中的细胞和关节中的居留免疫细胞)或在炎症反应期间浸润关节的那些细胞产生。在骨关节炎患者的滑液、滑膜、软骨和软骨下骨中检测到升高的tnf-α水平。
tnf-α与il-1β一起能够诱导核因子-κb(nf-κb),其是炎症反应的主调节因子。tnf-α通过增加其合成中涉及的关键酶(包括cox-2、微粒体pge合酶(mpges-1)和可溶性磷脂酶a2(spla2))的产生来诱导pge2的产生。另外,tnf-α诱导诱导型一氧化氮合酶(inos)的产生,导致一氧化氮(no)水平升高。其他细胞因子(包括il-6、il-17和il-18)和趋化因子il-8的产生受tnf-α的正调节。结合起来,这些促炎介质(前列腺素、no、细胞因子和趋化因子)的产生最终导致与骨关节炎相关的软骨分解。
tnf-α能够抑制细胞外基质的两种关键组分—聚集蛋白聚糖和ii型胶原的产生。此外,tnf-α诱导聚集蛋白聚糖酶adamts4和adamts-5(降解聚集蛋白聚糖的酶)的表达。这两种作用相结合,破坏了关节中软骨基质合成和退化之间的正常生化平衡,最终导致软骨退化。还表明tnf-α在线粒体功能障碍、atp产生减少和细胞凋亡中起作用,进一步促进软骨破坏。虽然tnf-α在启动对损伤和感染的基本免疫应答中起核心作用,但是其在失调时引发的有害作用使tnf-α成为开发炎症管理产物的靶标。
炎症过程中其他组织的作用也被充分确立。现在认识到滑膜炎症在骨关节炎的软骨退化中起关键作用,特别是在疾病的早期。滑膜炎的特征为激活滑膜中的居留巨噬细胞样细胞和成纤维细胞样细胞,导致产生过量的促炎介质(包括tnf-α、il-1β和pge2)。最近的证据表明滑膜巨噬细胞是骨关节炎最早期中的细胞因子的主要来源,而且它们是骨关节炎整个疾病过程中软骨损伤的重要贡献者。细胞因子还诱导pge2和活性金属蛋白酶(mmp)的产生。现在被普遍接受的是这些介质控制ecm破坏和修复之间的平衡,使得这些分子成为治疗性干预的优选靶标。关节中的其他组织如软骨下骨也产生调节关节健康的促炎介质。
除了如细胞因子和前列腺素的促炎介质以外,在骨关节炎中观察到的关节退化中还牵涉到活性氧物质(ros)。已表明ros(如一氧化氮和过氧化氢)诱导的氧化应激造成软骨细胞凋亡和软骨ecm分解。而且,已报道ros激活信号转导途径,导致促炎介质(包括细胞因子和前列腺素)的产生增加。体外研究已证实了产生ros和促炎介质所涉及的途径之间的关联。这些研究支持这样的观念:能同时抑制氧化应激和炎症途径的物质将特别可用于炎症的调节。
选择性cox-2抑制剂和各种非选择性非甾体类抗炎药(nsaid)在骨关节炎的治疗中的广泛使用反映了cox-2和pge2在骨关节炎病理生理学中的核心作用。但是,长期施用这些药物具有不良副作用,包括胃肠病变和软骨蛋白聚糖代谢的破坏。在人和动物模型中的研究已证实使用cox抑制剂损伤骨愈合和修复。因此,需要管理炎症的替代疗法,该方法不集中于使用nsaid来抑制pge2和其他促炎介质的产生。
迄今为止针对靶向tnf-α开发的药物包括英夫利昔单抗(一种抗人tnf的嵌合单克隆抗体)、阿达木单抗(一种完全人单克隆抗体)、依那西普(一种与人igg的fc部分连接的二聚tnfrii(p75)融合蛋白)、伐利木单抗、cdp571和沙利度胺。但是,除了抑制tnf-α的积极功能外,这些药物还可能引发不想要的结果,包括淋巴瘤的发展和感染。因此,需要一种治疗剂,其调节由tnf-α诱导的过量活性氧物质的产生和细胞死亡,而不阻断tnf-α的积极生理功能。
技术实现要素:
根据本文描述的目的和益处,在本发明的一个方面,提供了包含羟基酪醇和3-o-乙酰基-11-酮-β-乳香酸的协同组合的组合物。在实施方案中,羟基酪醇来源于橄榄提取物,而3-o-乙酰基-11-酮-β-乳香酸来源于齿叶乳香树(boswelliaserrata)提取物。该组合物可以配制用于口服施用于哺乳动物受试者,其可以选自人、狗、猫、马、骆驼或牛。在其他实施方案中,组合物可以配制用于口服施用于禽类受试者。
在实施方案中,配制用于口服施用于人受试者的组合物可以包含量为约0.67至约2.70mg/kg体重的3-o-乙酰基-11-酮-β-乳香酸和量为约0.15至约2.50mg/kg体重的羟基酪醇。在实施方案中,配制用于口服施用于狗受试者的组合物可以包含量为约1.24至约4.98mg/kg体重的3-o-乙酰基-11-酮-β-乳香酸和量为约0.28至约4.60mg/kg体重的羟基酪醇。
在另一方面,本发明提供一种治疗、修复或减少由一种或多种炎症介质引起的结缔组织损伤的方法,其包括向有此需要的哺乳动物或禽类受试者施用如上所述的包含羟基酪醇和3-o-乙酰基-11-酮-β-乳香酸的协同组合的可口服施用组合物。
在又一方面,本发明提供一种降低结缔组织中一种或多种炎症介质水平的方法,其包括向有此需要的哺乳动物或禽类受试者施用如上所述的包含羟基酪醇和3-o-乙酰基-11-酮-β-乳香酸的协同组合的可口服施用组合物。
在以下描述中,显示和描述了所公开的组合物和方法的实施方案。应该认识到,所描述的组合物和方法能够具有其他不同的实施方案,并且在各种、明显的方面其若干细节能够进行修改,所有这些都不脱离下面的权利要求中阐述和描述的主题。因此,附图和说明书在本质上应被视为说明性的而非限制性的。
附图简要说明
并入本文并形成说明书一部分的附图说明了所公开组合物的若干方面,并与说明一起用于解释其某些原理。在附图中:
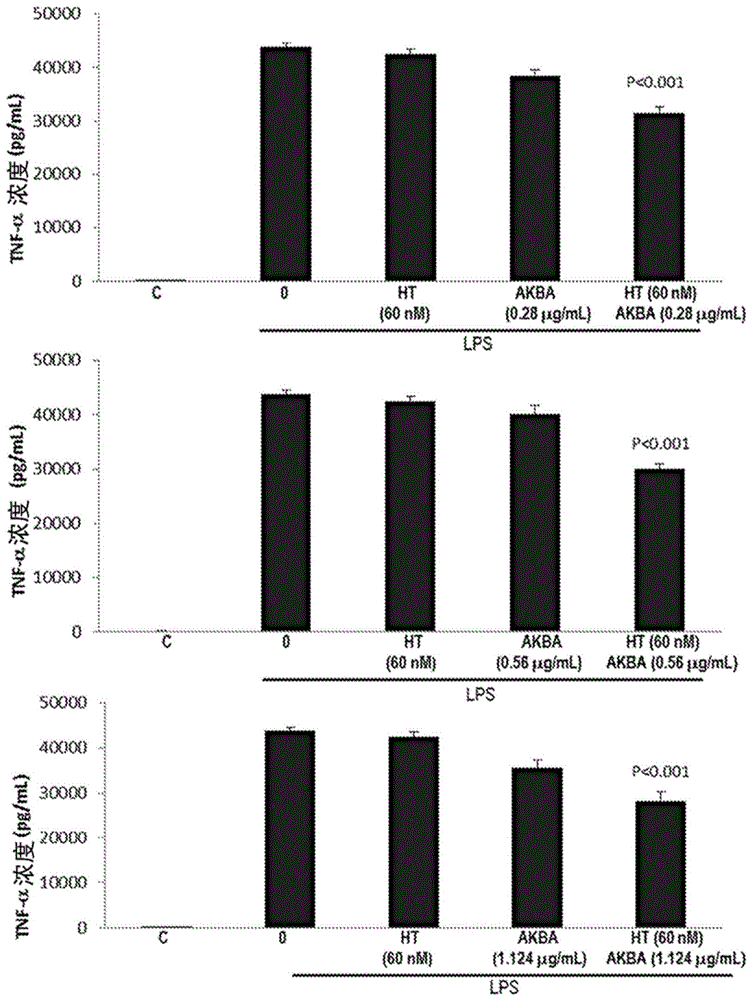
图1说明了羟基酪醇和akba在某些浓度下对脂多糖刺激的raw264.7小鼠巨噬细胞中tnf-α产生的影响;
图2说明了羟基酪醇和akba在某些浓度下对脂多糖刺激的raw264.7小鼠巨噬细胞中tnf-α产生的影响;和
图3说明了羟基酪醇和akba在某些浓度下对脂多糖刺激的raw264.7小鼠巨噬细胞中tnf-α产生的影响。
现在将详细参考所公开的组合物和相关方法的实施方案,其实例在附图中说明。
发明详述
本发明提供了包括向哺乳动物或禽类受试者施用(i)3-o-乙酰基-11-酮-β-乳香酸(akba)和(ii)羟基酪醇的方法。akba和羟基酪醇可以以一种组合物或剂型一起施用,或者它们可以分开施用。在某些实施方案中,akba和羟基酪醇在其治疗效能重叠的周期内以一种组合物或剂型一起施用或分开施用。在实施方案中,组合物在1小时内分开施用。在其他实施方案中,组合物在30分钟内分开施用。在其他实施方案中,组合物在5分钟内分开施用。
术语“哺乳动物受试者”是任何哺乳动物,包括但不限于人、狗、猫、马、牛以及骆驼。术语“禽类受试者”是指鸟。
羟基酪醇是一种在橄榄树的部位中发现的酚类植物化学物质类型。羟基酪醇的iupac名称为4-(2-羟基乙基)-1,2-苯二酚,并且是指具有以下结构的化合物:
如本文所用,羟基酪醇可以是合成来源的或可以通过提取和/或纯化从天然来源(如从来源于橄榄树的产品和副产品)获得。此外,羟基酪醇可以以可以含羟基酪醇的提取物的形式施用,该提取物获得自橄榄树的产品或副产品。橄榄树的产品和副产品包括橄榄、橄榄树叶、橄榄果肉、橄榄油、橄榄来源的植物水和橄榄油渣,但不限于此。基于提取程序,本领域技术人员可以容易地调节羟基酪醇的量和各自的比例。在实施方案中,羟基酪醇来源于橄榄,其可以从常规的和可商购的来源如种植者处获得。
本文使用的羟基酪醇可通过本领域已知的许多方法制备。可以通过任何合适的手段处理橄榄以获得所述组合物。例如,可以压榨橄榄和/或橄榄叶以获得包括橄榄油、植物水和固体副产物的混合物。羟基酪醇可以直接从该混合物中获得,或者可以将该混合物分离和/或纯化以获得羟基酪醇。可以通过本领域技术人员已知的许多方法分离和/或纯化组合物。分离方法的实例包括用有机溶剂分配、色谱法、高压液相色谱法(hplc)或使用超临界流体。
涉及从橄榄叶中提取羟基酪醇的参考文献的实例是wo02/18310a1、us2002/0198415a1、wo2004/005228a1、美国专利号6,416,808和us2002/0058078a1,其公开了一种酸性水解橄榄植物水2至12个月直至至少90%的存在的橄榄苦苷被转化的方法。从橄榄、橄榄果肉、橄榄油和榨油工厂废水中提取羟基酪醇的方法描述于美国专利号6,361,803和wo01/45514a1和us2002/0004077a1中。ep1582512a1描述了从橄榄叶中提取羟基酪醇。从去核橄榄的植物水中获得羟基酪醇的方法公开于us2004/0039066a1的第[0080]-[0091]段中。类似地,可商购的含羟基酪醇的橄榄提取物适用于本发明。
在文献中已经报道了人受试者中单个2.5mg/kg剂量的羟基酪醇的口服生物利用度,观察到的峰值血浆浓度为1.11±0.20μmol/l。gonzález-santiago等人,pharmacologicalresearch,61.4(2010):364-370。通过评价体重、表面积和物种差异,本领域技术人员可以确定剂量计算。类似地,本领域技术人员可以使用常规剂量转换方法计算跨物种外推剂量。
羟基酪醇的典型剂量比为约0.001mg/kg至约2.0mg/kg。在一些实施方案中,对于人和非人受试者,典型的日剂量为至少0.1mg且至多300mg。日剂量是指在24小时周期内施用的总剂量。
根据一些示例性实施方案,羟基酪醇可以以0.15至2.50mg/kg人受试者体重的剂量(即对于60kg人受试者以9-250mg)施用。
根据一些示例性实施方案,羟基酪醇可以以0.28至4.60mg/kg狗受试者体重的剂量(即对于10kg狗受试者以2.8-46mg)施用。
羟基酪醇可以以每周一次至每天五次的频率施用。在实施方案中,羟基酪醇每两天一次至每天三次施用。在替代实施方案中,羟基酪醇每天施用一至两次。在其他实施方案中,羟基酪醇每天一次施用。羟基酪醇可以在施用食物或不施用食物的情况下服用。
据报道,从齿叶乳香树中提取的植物化学成分在治疗许多病痛和疾病方面具有活性。齿叶乳香树的树胶脂长期以来一直被印度医学体系中的阿育吠陀医学的从业者用于治疗类风湿性关节炎和痛风。树胶脂的各种提取物已在实验室动物中显示出有效的抗炎和抗动脉粥样硬化活性。提取物的生物活性与乳香酸部分的组分有关。3-o-乙酰基-11-酮-β-乳香酸(akba)已被鉴定为齿叶乳香树提取物中最具活性的化合物。据报道,含有akba的齿叶乳香树提取物在体外抑制5-脂氧合酶和基质金属蛋白酶-3(mmp-3),如wo2010/029578a2中所述。wo2010/029578a2类似地报道了包含选择性富含akba至30%的齿叶乳香树提取物的组合物在体内的抗炎效力,包括血清生物标志物tnf-α和il-1β的显著减少。
在文献中已经报道了在大鼠血清中单剂量施用100mg/kg剂量的标准化至30%akba的齿叶乳香树提取物的生物利用度,观察到的峰值血清浓度为2.0μg/ml。sengupta等人,molecularandcellularbiochemistry,354.1-2(2011):189-197。剂量计算可由本领域技术人员通过评价体重、表面积和物种差异来确定。类似地,本领域技术人员使用常规剂量转换方法可计算跨物种外推剂量。
akba的典型剂量率为约0.01mg/kg至约10.0mg/kg。在一些实施方案中,对于人和非人受试者,典型的日剂量为至少1mg且至多约1g。日剂量是指在24小时内施用的总剂量。
根据一些示例性实施方案,akba可以以0.67至2.70mg/kg人受试者体重的剂量(即,对于60kg人受试者以40-162mg)施用。
根据一些示例性实施方案,akba可以以1.24至4.98mg/kg狗受试者体重的剂量(即对于10kg狗受试者以12.4-49.8mg)施用。
akba可以以每周一次至每天五次的频率施用。在某些实施方案中,akba以每两天一次至每天三次的频率施用。在替代实施方案中,akba每天施用一至两次。在其他实施方案的实施方案中,akba每天施用一次。akba可以在施用或不施用食物的情况下服用。
在一些实施方案中,(i)羟基酪醇和(ii)akba的组合显示出协同作用。协同作用是指两种或更多种组分的组合提供的结果是其效益大于各物质单独使用时产生的效应之和。在某些实施方案中,结果具有统计学上显著性并且大于加和效应。在一些实施方案中,羟基酪醇和akba的组合比每种组分单用具有统计学显著的、更大的效应。在某些实施方案中,羟基酪醇和akba的组合在以下一种或多种方面中显示出协同作用:预防、治疗、修复或减少对结缔组织损伤;减轻与禽类或哺乳动物受试者的结缔组织损伤相关的症状;以及降低结缔组织中一种或多种炎症介质的水平。
本发明提供了在禽类或哺乳动物受试者中预防、治疗、修复、减少结缔组织损伤或控制结缔组织炎症、保护软骨或减轻与结缔组织损伤相关的症状的方法,该方法包括向受试者施用:(i)羟基酪醇和(ii)akba。术语“结缔组织”包括但不限于软骨、骨、滑膜、韧带、半月板和肌腱。在一些实施方案中,施用(i)羟基酪醇和(ii)akba可以预防、治疗、修复或减少结缔组织损伤。结缔组织损伤可以是物理性伤害的结果,或者可以表示由不断使用、体重和年龄(例如由骨关节炎)导致的“磨损”。结缔组织损伤也可以由如类风湿性关节炎、滑膜病症、感染有关的风湿性疾病和炎性结缔组织病症的疾病引起。在一些实施方案中,(i)羟基酪醇和(ii)akba的施用可以在禽类或哺乳动物受试者中减轻与结缔组织损伤相关的症状。与结缔组织损伤相关的症状包括但不限于:疼痛、不适、压力、炎症、僵直和/或肿胀。
本发明还提供降低结缔组织中一种或多种炎症介质水平的方法,包括向禽类或哺乳动物受试者施用:(i)羟基酪醇和(ii)akba。炎症介质包括但不限于肿瘤坏死因子-α(tnf-α)、前列腺素如前列腺素e2(pge2)、细胞因子如白细胞介素-1β(il-1β)和趋化因子、白三烯、一氧化氮和活性氧物质。
羟基酪醇和akba的施用也可以用于治疗、预防和减少与影响心血管系统、神经系统、肌肉骨系统和胃肠系统的状况相关的损伤或减轻与影响心血管系统、神经系统、肌肉骨系统和胃肠系统的状况相关的症状。在一个方面,本发明提供了用于预防和/或减少受试者的炎症反应和/或炎症的组合物和方法。在一个方面,本发明提供了用于管理炎性病症或总体减少人或非人动物的炎症负荷的组合物和方法。因此,在一个实施方案中,本发明提供预防和/或减少一种或多种组织中的炎症反应和/或炎症的方法,该方法包括向该一种或多种组织递送本发明的组合物。
本发明还提供可口服施用组合物,其包含:(i)羟基酪醇和(ii)akba。可口服施用组合物是如本领域中已知的任何可口服施用的剂型,例如但不限于:胶囊;片剂;可分散于饮品中的粉末;糊剂;丸状形式;液体,如溶液、混悬剂或乳剂;软凝胶/咀嚼胶囊;咀嚼棒或其他方便的剂型,如胶囊中的口服液体。
可口服施用组合物可以含有一种或多种非活性药物成分(在本文中通常也被称为“赋形剂”)。非活性成分例如用于使活性成分溶解、悬浮、增稠、稀释、乳化、稳定、防腐、受到保护、着色、调味和改变形状,做成适用的和有效的制剂,该制剂在使用时是安全的、便利的、以及在其他方面可接受的。赋形剂可以是药学上可接受的赋形剂。药学上可接受的赋形剂的种类的实例包括润滑剂、缓冲剂、稳定剂、发泡剂、色素、着色剂、调味剂、填充剂、增容剂(bulkingagent)、芳香剂、释放调节剂、佐剂、增塑剂、流动促进剂、脱模剂、多元醇、成粒剂、稀释剂、粘合剂、缓冲剂、吸附剂、助流剂、粘附剂、抗粘着剂、酸化剂、软化剂、树脂、缓和剂、溶剂、表面活性剂、乳化剂、弹性体及其混合物。
可口服施用组合物可以进一步包含一种或多种活性成分。例如,组合物可以进一步包含一种或多种药物或营养补充剂。在一些实施方案中,组合物可以进一步包含有益于结缔组织的化合物。实例包括但不限于糖胺聚糖,如软骨素;氨基糖,如葡萄糖胺、甲磺酰基甲烷(msm)、胶原(包括ii型胶原)、绿茶提取物、黄芩提取物、刺槐提取物、姜黄提取物、姜黄素、鲸蜡基肉豆蔻酸酯复合物(cetylmyristoleatecomplex,cmo)以及蛋壳膜。
本文所引用的所有参考文献通过引用以其全部内容并入。
实施例
实施例1:羟基酪醇和akba在脂多糖(lps)刺激的raw264.7小鼠巨噬细胞中对tnf-α产生的影响。
将raw264.7小鼠巨噬细胞用60nm、160nm或1μμ羟基酪醇(ht)(纯度98%,sigma-aldrich,st.louis,mo)单独地预处理24小时;0.28μg/ml、0.56μg/ml或1.124μg/mlakba(以5-
与单用任一种物质的降低相比,当三种浓度的ht中的每一种与akba组合时,观察到统计学显著更大的tnf-α水平降低。60nmht与0.28μg/ml、0.56μg/ml或1.124μg/mlakba的组合均导致tnf-α产生的减少大于单用ht(p<0.001)或akba(p<0.001)(图1)。与单用ht(p<0.001)或akba(p=0.001)相比,用160nmht与0.56μg/mlakba组合处理的细胞中tnf-α的减少达到统计学显著性(图2)。用1μmht和0.28μg/ml、0.56μg/ml或1.124μg/mlakba处理细胞与单用ht(分别为p<0.001、p=0.002和p<0.001)和单用akba(分别为p<0.001、p=0.02和p=0.004)相比也导致统计学显著的减少(图3)。
- 还没有人留言评论。精彩留言会获得点赞!