PR-957用于制备治疗脑缺血再灌注损伤药物的应用的制作方法
本发明涉及医药技术领域,进一步涉及物质的新的医药用途,具体涉及PR-957用于制备治疗脑缺血再灌注损伤药物的应用。
背景技术:
缺血性脑卒中是指由脑供血动脉狭窄或闭塞引起脑供血不足、进而导致脑组织坏死的总称。在缺血性脑卒中发病过程中,所造成的损伤呈多环节级联效应,由多种损伤机制共同参与,除了由缺血本身所造成的组织梗死、炎症反应之外,缺血后再灌注对组织细胞的进一步损害也是缺血性脑卒中发病的必然阶段。
缺血后的再灌注对脑部组织具有严重损失,脑缺血时脑细胞生物电发生改变,出现病理性慢波,缺血一定时间后再灌注,慢波持续并加重。颞叶组织内神经递质性氨基酸代谢发生明显变化,即兴奋性氨基酸随缺血再灌注时间延长而逐渐降低,抑制性氨基酸在缺血再灌注早期明显升高。缺血再灌注损伤时间越长,兴奋性递质含量越低,脑组织超微结构改变越明显:线粒体肿胀,有钙盐沉积,并可见线粒体嵴断裂、核染色质凝集、内质网高度肿胀,结构明显破坏、星型细胞肿胀,Nissl体完整性破坏、胶质细胞、血管内皮细胞肿胀,周围间隙增大并有淡红色水肿液、白质纤维间隙疏松,血管内由微血栓、髓鞘分层变性,呈现不可逆损伤。
PR-957(又称为ONX 0914),是免疫蛋白酶体亚基低分子量多肽7(LMP7)的特异性抑制剂,已被证明在调节中枢神经系统多种疾病的病理生理和炎症反应中起关键作用,目前主要用于实验性类风湿性关节炎、炎症性肠病的治疗。目前,现有技术中未见其用于治疗的脑缺血再灌注损失的报道。有研究者报道,在心肌缺血/再灌注过程中,抑制免疫蛋白酶体亚基β5i(LMP7)活性可加重缺血/再灌注引起的心肌损伤(徐多娇等,2017)。
技术实现要素:
本发明旨在针对现有技术的技术缺陷,提供PR-957用于制备治疗脑缺血再灌注损伤药物的应用,以拓展脑缺血再灌注损伤治疗药物的可选范围。
本发明要解决的另一技术问题是现有技术中PR-957的适应症范围较为局限。
本发明要解决的再一技术问题是如何实现对脑缺血再灌注患者神经功能损伤、炎症性损伤等具体病理症状的治疗。
本发明要解决的又一技术问题是揭示PR-957对脑缺血再灌注损伤的治疗机理。
本发明提供了PR-957用于制备治疗脑缺血再灌注损伤药物的应用。
作为优选,所述治疗是通过减小脑组织梗死体积实现的。
作为优选,所述治疗是通过抑制CD4+T细胞向Th17分化实现的。
作为优选,所述治疗是通过降低脑组织中pSTAT3蛋白水平和RORγtmRNA水平实现的。
作为优选,所述治疗是通过抑制脑组织内促炎性细胞因子的表达实现的。
作为优选,所述促炎性细胞因子包括IL-1β、IL-6、IL-12、IL-17A、IFN-γ或TNF-α。
作为优选,所述脑缺血再灌注损伤是由缺血性脑卒中导致的。
作为优选,所述脑缺血再灌注损伤是由脑缺血再灌注所导致的神经功能损伤。
作为优选,所述缺血再灌注损伤是由脑缺血再灌注所导致的炎症性损伤。
作为优选,所述药物的剂型为注射剂;所述注射剂是含有10%(w/v)磺丁基醚-β-环糊精、10mM柠檬酸钠、PR-957的水溶液。
作为优选,所述水溶液的pH值为3.5。
作为优选,所述药物的有效剂量为20mg/kg。
本发明提供了免疫蛋白酶体亚基低分子量多肽7(LMP7)的特异性抑制剂PR-957用于制备治疗脑缺血再灌注损伤药物的应用。该技术方案以MCAO动物模型为实验对象,利用PR-957考察了免疫蛋白酶体在缺血性脑卒中中的作用。实验结果表明,PR-957治疗可以通过降低STAT3的磷酸化水平,进而导致RORγt和IL-17的转录水平降低,从而抑制Th17分化,减轻脑内炎症反应,减小脑梗死体积,减轻神经功能缺陷。因此,PR-957在调节小鼠缺血性脑卒中后辅助性T细胞的炎症状态中起关键作用,可以作为缓解缺血性脑卒中后脑损伤的治疗手段。
具体来看,本发明分析了PR-957在大脑中动脉阻塞(MCAO)引起的小鼠实验性卒中模型中的神经保护作用。首先,通过神经行为学评分评估了PR-957对小鼠神经功能的改善情况,并对小鼠脑梗死体积进行了测量。同时,利用免疫荧光染色对梗死灶周围Th17细胞的分布进行了检测。然后,本发明通过酶联免疫吸附测定(ELISA)、实时荧光定量聚合酶链反应(qRT-PCR)分析和流式细胞术对梗死侧脑组织中免疫细胞及细胞因子进行了分析。此外,本发明利用蛋白印迹法追踪磷酸化信号转导和转录激活因子p-STAT3的表达。实验结果显示,PR-957能够减小小鼠脑组织梗死体积,改善神经功能缺陷。本发明的结果还表明,PR-957能够减少MCAO小鼠中的T淋巴细胞浸润,抑制Th17细胞分化。与对照组相比,PR-957治疗组中表达的p-STAT3水平也显着降低,而STAT3磷酸化水平下降可以直接抑制Th17细胞分化。因此,PR-957具有抗炎作用,对缺血性脑卒中具有神经保护作用,对该疾病的治疗具有潜在应用价值。
附图说明
图1是本发明具体实施方式中,MCAO小鼠单次腹腔注射5、10、20、30mg/kg剂量的PR-957后,神经功能及梗死灶体积变化情况。
图2是本发明具体实施方式中,PR-957对MCAO小鼠脑组织淋巴细胞亚群的影响。
图3是本发明具体实施方式中,PR-957对MCAO小鼠脑组织Th17细胞水平的影响。
图4是本发明具体实施方式中,PR-957对MCAO小鼠脑组织pSTAT3蛋白水平和RORγtmRNA水平的影响。
图5是本发明具体实施方式中,PR-957对MCAO小鼠脑组织促炎性细胞因子水平的影响。
图6是PR-957的抗炎作用原理图。
具体实施方式
以下将对本发明的具体实施方式进行详细描述。为了避免过多不必要的细节,在以下实施例中对属于公知的结构或功能将不进行详细描述。
以下实施例中所使用的近似性语言可用于定量表述,表明在不改变基本功能的情况下可允许数量有一定的变动。因此,用“大约”、“左右”等语言所修正的数值不限于该准确数值本身。在一些实施例中,“大约”表示允许其修正的数值在正负百分之十(10%)的范围内变化,比如,“大约100”表示的可以是90到110之间的任何数值。此外,在“大约第一数值到第二数值”的表述中,大约同时修正第一和第二数值两个数值。在某些情况下,近似性语言可能与测量仪器的精度有关。
除有定义外,以下实施例中所用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
1材料与方法
1.1实验动物
C57BL/6成年雄性小鼠(6-8周,18-20g)购自北京维通利华实验动物技术有限公司(中国北京)。所有小鼠在12小时光照-12小时黑暗循环条件下,置于温度和湿度可控的房间中饲养。在实验期间,给小鼠提供适量的水和食物,并使其适应上述实验条件一周。所有动物实验操作均符合国家规定,并经天津医科大学动物实验伦理委员会批准。
实验中,将278只雄性小鼠随机分为3组:假手术组(Sham),PR-957治疗组(MCAO+PR-957)和溶剂对照组(MCAO+溶剂)。MCAO小鼠死亡率约为4%,假手术组无死亡。
1.2MCAO造模
在本实验中,本发明根据Longa等报道的实验方法,通过大脑中动脉闭塞的方法诱导短暂性脑缺血(Longa等,1989),制作缺血性脑卒中小鼠模型。手术前,使用10%水合氯醛(30mg/kg)通过腹膜内(i.p.)注射麻醉小鼠。本发明首先在解剖显微镜下进行颈部正中切口,然后将左颈总动脉(CCA),颈内动脉(ICA)和颈外动脉(ECA)暴露并分离。然后结扎CCA和ECA。将直径0.16mm的线拴(尖端直径0.20mm;中国北京西农)插入CCA,最后到达ICA,轻轻推进7-8mm,以阻断大脑中动脉(MCA)的血流。在血液阻塞60分钟后,撤回线栓,使ICA血液再灌注。应用激光多普勒血流计(PF5010)检测局部脑血流量(rCBF)。对假手术组小鼠进行同样的实验操作,但不插入线栓。在实验过程中,使用恒温电热毯维持小鼠体温(37-38℃)。术后第12小时腹腔注射一次丁丙诺啡(0.03mg/kg)止痛。
1.3PR-957给药
PR-957购自Selleckchem(S7172,中国上海),溶解于10%(w/v)磺丁基醚-β-环糊精和10mM柠檬酸钠(pH 3.5)的水溶液(溶剂)中。为了确定最佳剂量,将PR-957按照5mg/kg、10mg/kg、20mg/kg或30mg/kg的浓度梯度经腹腔注射随机给药。经过3天行为学测试以及对24小时后小鼠脑梗塞体积测量,选定最佳给药剂量为20mg/kg。实验中将小鼠随机分为三组:假手术组(Sham);MCAO组(MCAO+溶剂);PR-957治疗组(MCAO+PR-957)。在PR-957治疗组中,小鼠给药剂量为20mg/kg;假手术组和MCAO组给予相同体积的溶剂。缺血/再灌注(I/R)开始时,向各组小鼠腹腔注射相应药物。
1.4神经功能损伤评分
造模后24、48和72小时分别对三组小鼠进行神经行为学测试(n=10),包括改良神经损伤严重程度评分(mNSS)(陈等人,2001)、粘纸实验、足错步实验和斜坡测试。在神经行为学测试中,观察者并不知道实验分组情况。mNSS是一种复合评估方法,包括运动、感觉、反射和平衡测试,评分为分,评分越高反映缺陷越严重。
粘纸实验(Bouet等人,2009;Freret等人,2009;Zhang等人,2011)评估小鼠体感和运动能力的缺陷。小鼠在造模前连续3天接受训练。在熟悉测试环境之后,轻轻地将两个粘性纸片连接到小鼠每个前肢末端。然后记录每只小鼠从前肢撕下纸片的时间,共记录3次,每次试验间隔5分钟。经过3天的训练后,所有小鼠均能够从其前肢撕下纸片,记录所需时间进行统计分析。
在足错步实验中(Zhou等人,2010),使用水平网格地板测试每组中的小鼠错步情况2分钟。当小鼠的前肢或后肢落入其中一个网格开口处时,即发生足错步。统计分析记录的足错步数量。
在斜坡测试(Pajoohesh-Ganji等人,2010)中,将小鼠头朝下放置在带凹槽的1毫米厚的橡胶表面上。然后平台的角度逐渐增大,直到老鼠从原来的位置滑下来。记录小鼠持续5秒不动的最后一个角度。
1.5梗死体积测量
在造模后24小时和72小时,使用水合氯醛(30mg/kg,腹腔注射)麻醉小鼠,通过左心室用20毫升预冷PBS(pH7.4,4℃)灌注,如前所述(Li等,2016)快速取出脑组织以测量梗死体积。将大脑从前端沿冠状位切分成5片,每片厚度为2毫米。然后将脑切片用2%2,3,5-三烯基四唑氯化物(TTC;Sigma,St.Louis,MO,USA)在37℃染色20分钟,然后在4%多聚甲醛中于4℃下固定1小时。TTC染色后,未损伤组织变为深红色,梗塞组织保持白色。使用Image-Pro Plus,v.6.0图像分析软件(Media Cybernetics,Washington,DC,USA)进行梗塞体积分析。
1.6免疫荧光染色和分析
用水合氯醛(30mg/kg,腹腔注射)麻醉小鼠,然后用PBS(pH 7.4,4℃)心室内灌注。如上所述迅速摘取脑组织,在4℃下将脑组织浸入含有4%多聚甲醛中过夜,然后在30%蔗糖中进行组织脱水,后将脑组织冻结在液氮中进行OCT包埋。使用标准低温恒温器(Leica Microsystems LM3050S)将脑组织行冠状切片(8μm),将其储存于-80℃冰箱中。染色时,在室温复温30分钟后,用冰丙酮对组织切片进行固定,后于37℃在3%牛血清白蛋白(BSA)中封闭半小时;随即将这些切片于4℃予以一抗孵育过夜。实验中使用的一抗包括兔抗小鼠IL17抗体(1:200,Abcam,Cambridge,Cambs,UK)和小鼠抗小鼠CD4抗体(1:200,Santa Cruz Biotechnology,Dallas,TX,USA)。接下来将切片在冷PBS中洗涤三次,并在室温下予以二抗孵育1小时。实验中使用二抗包括594偶联驴抗兔IgG(H+L)(1:1000,赛默飞世尔科技公司(Thermo Fisher Scientific),沃尔瑟姆(Waltham),MA,USA)和Alexa Fluor 488偶联驴抗小鼠IgG(H+L)(1:1000,赛默飞世尔科技)。在预冷PBS中洗涤5次(每次10分钟)后,用DAPI(Abcam)覆盖脑组织以使细胞核复染。待干片后使用荧光显微镜(Nikon,Sendai,Ishinomaki,日本)对切片进行成像。从三个随机选择的显微镜视野(200×放大倍数),在同侧区域的半暗带中,每平方毫米测定阳性细胞数量。
1.7流式细胞术(FACS)
MCAO后72小时,各组分别取6个小鼠脑组织分离收集单细胞悬液,进行流式细胞术分析NK细胞(CD3-NK1.1+)和淋巴细胞亚群(CD3+CD4+T细胞,CD3+CD8+T细胞和CD3-CD19+B细胞)。将脑组织通过40μm尼龙细胞过滤器(Becton Dickinson,USA),在预冷PBS中机械匀浆,然后收集细胞匀浆并以400xg离心10分钟。将沉淀悬浮于5ml 30%Percoll(GE Healthcare Bio Science AB,Uppsala,瑞典)中,再加入5ml 60%Percoll。然后以500×g离心20分钟;从斜坡边界回收细胞并用PBS洗涤。
在进行流式细胞术染色之前,将1×106个脑细胞首先悬浮于100μl含有1%BSA的PBS中。再使用抗小鼠PE-Cy7偶联的抗CD3抗体(1:100)和FITC偶联的抗CD4抗体(1:200)作为染色检测CD4+T细胞;对于CD8+T细胞,使用PE-Cy7偶联的抗CD3抗体(1:100)和FITC偶联的抗CD8抗体(1:200)进行染色检测;对于B细胞,使用PE-Cy7偶联的抗CD3抗体(1:100)和FITC偶联的抗CD19抗体(1:100)进行染色检测;对于NK细胞,使用偶联PE-Cy7的抗CD3抗体(1:100)和PerCP偶联的抗NK1.1抗体(1:100)染色检测。
为了评估CD4+CD25+Tregs,用PerCP偶联的抗CD4抗体(1:200)和FITC偶联的抗CD25(1:100)抗体在室温下染色30分钟以进行表面染色。然后将细胞用固定缓冲液固定,用透膜缓冲液(eBioscience,San Diego,CA,USA)洗涤两次,并在透化缓冲液中在室温下用偶联PE的抗Foxp3(1:100)抗体染色30分钟。
对于Th1、Th2和Th17细胞分析,在24孔板(1×10 6个细胞/孔)中加入样品并用2μL细胞活化混合物(具有布雷菲德菌素A)(Biolegend,San Diego,CA,USA,含有40.5μM佛波醇-12-肉豆蔻酸酯13-乙酸酯,669.3μM伊屋诺霉素和2.5mg/ml Brefeldin A的DMSO溶液)的混合物进行刺激,在37℃下处理4小时。收集到15ml离心管中并用PBS洗涤2次后,将刺激的细胞转移到流式细胞仪管中,然后沉淀并用含有1%BSA的PBS溶液重悬,并用PerCP偶联的抗CD4(1:200)抗体在室温下30分钟。洗涤并固定后,用透膜缓冲液洗涤细胞两次,然后用FITC偶联的抗IFN-γ(1:100)抗体对Th1细胞染色,用PE偶联的抗IL-17(1:100)抗体对Th17细胞染色,用于透膜缓冲液中的FITC偶联的抗IL-4(1:100)抗体对Th2细胞染色,抗体孵育30分钟。用于流式细胞术染色研究中使用的所有抗体购自Biolegend。用同型对照抗体染色的细胞用于消除背景染色并设定象限,然后计算阳性细胞的百分比。流式细胞术结果通过FACS Aria III流式细胞仪(BD Biosciences,Franklin Lakes,New Jersey,USA)获得并用FlowJo软件7.6.1版(flowjo.com)分析。
1.8蛋白免疫印迹
用Trizol(Ambion,Waltham,MA,USA)从脑组织提取总蛋白,然后使用蛋白质浓度测定试剂盒(Beyotime,杭州,中国)测量蛋白质浓度。根据样品浓度与上样缓冲液混合,加热变性后,取适量样品加入12%SDS-PAGE凝胶上样孔,分离条件为80V至120V电压,然后转移至PVDF膜(Millipore,Billerica,MA,USA)(4℃条件下,80V电转1.5小时)。将PVDF膜置于5%BSA溶液中室温封闭1小时,然后在4℃下与一抗孵育过夜;第二天使用TBST洗涤三次(各10分钟),用辣根过氧化物酶偶联的二抗孵育1小时,然后使用TBST洗涤三次(每次10分钟)。实验中的所有孵育均在含有0.1%Tween-20的TBS缓冲液中进行。实验中使用一抗如下:p-STAT3(Tyr705)兔mAb(1:2000,Cell Signaling Technology,Danvers,MA,USA),STAT3小鼠mAb(1:1,000Cell Signaling Technology)和抗GAPDH抗体(1:5,000,Abcam)。二抗如下:辣根过氧化物酶偶联的山羊抗兔IgG,山羊抗小鼠IgG(Transgen Biotech,Peking,China)。加入显色底物显色后,由Bio-Rad 721BR08844Gel Doc Image(Bio-Rad,Hercules,CA,USA)观测并分析。
1.9细胞因子谱的酶联免疫吸附测定(ELISA)
从缺血部位取脑组织,对IL-1α、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12、IL-17A、IFN-γ、TNF-α、G-CSF等12种细胞因子的同时定量并使用ELISArray试剂盒(Qiagen,杜塞尔多夫,德国),根据制造商的方案完成测定。每个样品进行三次重复检测(每组6只小鼠),结果以平均OD±SEM表示。
1.10实时荧光定量聚合酶链式反应(qRT-PCR)
按照说明,使用Trizol试剂(Ambion)从缺血半球提取总RNA。用紫外分光光度法在260/280nm定量RNA浓度。然后用TransScript First-Strand cDNA Synthesis SuperMix(Transgen Biotech)从5μgRNA转录cDNA。将表1中列出的引物分别与cDNA模板和SYBR试剂混合(Roche,Basel,Switzerland),在Opticon 2实时PCR检测系统(Bio-Rad)上进行PCR反应。样品在95℃热变性10分钟,然后进行40个循环扩增cDNA,最后在60℃进行1分钟延伸。用ABI Stepone Plus仪器进行自动分析后,使用2-ΔΔCt方法计算结果。以相对于对照(n=6)的倍数变化报告mRNA的表达水平。
1.11统计分析
所有数据均以平均值±SEM表示。使用Student's t检验对两组数值进行统计学分析;对于三组以上的数据进行单因素方差分析(ANOVA),随后进行用于多组比较的Bonferroni posthoc检验(GraphPad Prism 5.0)。P<0.05被认为有显著性差异。
2、实验结果
2.1PR-957减轻了神经功能损伤并减小了脑组织梗死体积
如图1所示,MCAO小鼠单次腹腔注射5、10、20或30mg/kg剂量的PR-957。结果显示,20mg/kg的剂量在实验中产生最显著的改善(P<0.01)(图1A,B),并且不超过PR-957的最大耐受剂量(Muchamuel等,2009),所以选用20mg/kg的PR-957在后续实验中对MCAO小鼠进行腹腔注射给药。在缺血再灌注后24、48和72小时评估神经功能损伤。如图1C,D,E,F所示,MCAO后72小时在PR-957治疗组中,神经功能评分比对照组中得到了改善。mNSS测试的结果显示了这种改变(图1C;48小时P<0.05;72小时P<0.01)。本发明还通过进一步神经功能评估——足错步实验(图1D;48小时P<0.05;72小时P<0.01),粘纸实验(图1E;48小时P<0.05;72小时P<0.01)和斜坡试验(图1F;48和72小时P<0.01)),发现PR-957治疗对MCAO小鼠神经功能有显著改善。表1列出了各组不同时间点临床评分的平均值±SEM。
为了评估PR-957对小鼠局灶性缺血和再灌注后脑损伤的保护作用,本发明测量了MCAO后24小时和72小时的梗死体积。TTC染色能够清楚地看到大脑的梗塞区域。如图所示,在缺血性损伤后用PR-957治疗显著降低了MCAO后24小时的梗塞面积(图1G;PR-957治疗组中的35.93±3.50mm 3与MCAO组中的53.90±6.21mm 3,P<0.05,每组n=6只小鼠)。在72小时,PR-957治疗组产生了相同的结果(图1G;MCAO组中的31.15±2.45mm 3相对于54.60±6.87mm3,P<0.01,每组n=6只小鼠)。这些结果表明PR-957处理有效地减轻了脑缺血引起的神经损伤的严重程度,因此在MCAO小鼠中具有神经保护作用。
表1表1PR-957治疗组和MCAO组的神经功能评分
各组及各时间点的结果用平均值±SEM表示。
2.2PR-957抑制MCAO小鼠脑中的CD4+T细胞和Th17分化
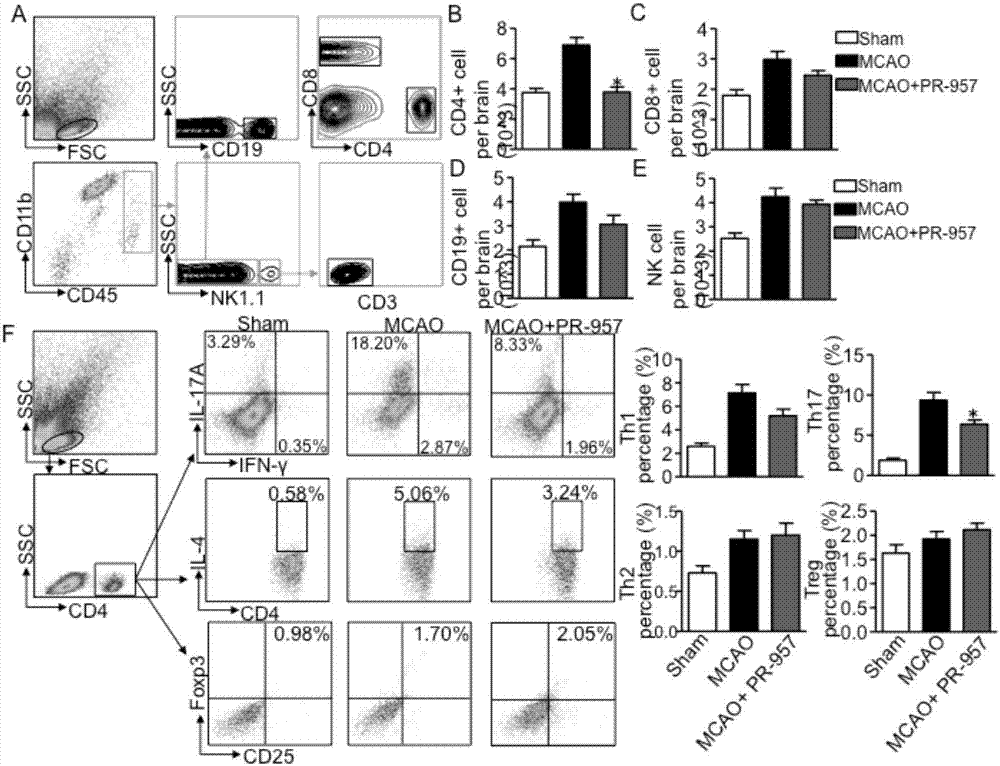
如图2所示,本发明通过实验试图了解PR-957在缺血再灌注后减轻脑损伤的机制。首先,进行用PR-957或溶剂处理的MCAO小鼠的脑内免疫细胞亚群的流式细胞术分析,淋巴细胞的设门策略见图2A。然后,对假手术组,MCAO组和MCAO+PR-957组各组小鼠造模后72小时脑中CD4+T细胞(CD3+CD4+),CD8+T细胞(CD3+CD8+),NK细胞(CD3-NK1.1+)和B细胞(CD3-CD19+)进行计数和分析(图2B-E)。在PR-957治疗组中存在较少的CD4+T细胞(图2B,P<0.01)。CD8+T细胞数量没有明显变化(图2C)。此外,在MCAO后3天未发现对B细胞(图2D)或NK细胞(图2E)的计数的影响。
然后本发明研究了PR-957如何在MCAO后72小时影响脑中的CD4+T细胞亚群。使用Th细胞标记物CD4和INF-γ,IL-4,IL-17或Foxp3,本发明对MCAO小鼠脑内淋巴细胞亚群进行流式细胞分析。值得注意的是,PR-957处理使MCAO后72小时的Th17(CD4+IL-17+)细胞比例下降(图2F,P<0.05),但Th1、Th2或Treg细胞的表达变化不明显(图2F)。
如图3所示,与对照组比较,免疫荧光染色结果显示PR-957治疗组MCAO小鼠脑内Th17细胞数量减少(图3A-C,P<0.01)。总之,PR-957抑制缺血性脑卒中后的CD4+T细胞浸润和Th17分化。
2.3PR-957降低MCAO小鼠大脑中的pSTAT3蛋白水平和RORγtmRNA水平
如图4所示,对MCAO 72小时后,提取梗死侧脑组织蛋白与mRNA,对Th17细胞分化的重要转录调节因子STAT3和RORγt表达进行免疫组织化学分析。本发明使用蛋白质印迹(图4A-C)和qRT-PCR(图4D)分别检测MCAO后72小时小鼠脑中的p-STAT3(Tyr705)蛋白水平和RORγtmRNA水平。免疫印迹结果显示PR-957处理组中p-STAT3(Tyr705)的表达较对照组减少(图4B;P<0.05);然而,这些组中STAT3总蛋白水平没有显着差异(图4C;P>0.05)。此外,PR-957处理组小鼠脑中RORγtmRNA的表达明显低于对照组(图4D,P<0.05)。总体而言,PR-957在蛋白质水平降低了STAT3的磷酸化,导致在转录水平RORγt降低。
2.5PR-957改善缺血后脑组织中的炎症环境
PR-957组小鼠中枢神经中的mRNA相对于对照组的变化,数据如下:用平均数±SEM表示
表2 PR-957治疗组和MCAO组小鼠脑中的炎性细胞因子mRNA水平
如图5所示,用ELISA和qRT-PCR方法对小鼠脑组织内细胞因子的表达水平进行检测,检测的因子包括IL-1α、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12、IL-17A、IFN-γ、TNF-α、G-CSF和GM-CSF在内。结果显示,PR-957治疗组中促炎性细胞因子IL-1β,IL-6,IL-12,IL-17A,IFN-γ和TNF-α的水平比MCAO组中显著降低(图5A)。而对照组与PR-957治疗组IL-1α、IL-2、IL-4、IL-10、G-CSF或GM-CSF蛋白水平无明显差异。
本发明还通过qRT-PCR研究了脑组织中的细胞因子表达水平。结果显示与对照组相比,PR-957处理组中的IL-1β、IL-6、IL-12、IL-17、IL-23和TNF-α的mRNA水平显著降低(图5B-G;表2)。这表明PR-957可以缓解缺血性脑卒中后的炎症状态。
因此,这些结果表明PR-957介导了缺血再灌注后的抗炎作用。PR-957可以通过抑制STAT3/RORγt途径调节MCAO小鼠中促炎性和抑炎性辅助性T细胞之间的平衡,从而改善MCAO小鼠脑内炎症微环境,如图6所示。
3、结论
本研究证实,免疫蛋白酶体亚单位的新型选择性抑制剂PR-957对缺血再灌注小鼠脑组织具有神经保护作用。通过经典的缺血再灌注损伤小鼠模型的实验表明,PR-957能够显著减少缺血性脑卒中后小鼠脑组织的梗塞体积,改善相关的神经功能损伤,并减轻炎症反应。PR-957的神经保护作用是通过减少CD4+T细胞浸润,抑制Th17细胞分化,并减少促炎性细胞子的分泌来实现的。PR-957通过降低RORγtmRNA表达水平来抑制STAT3信号通路,抑制Th17细胞的分化。此外,通过用PR-957处理,MCAO小鼠脑组织中的关键细胞转录因子的磷酸化水平及其下游信号分子的mRNA水平显著下调。
T淋巴细胞介导的炎症反应在缺血性脑损伤中具有重要作用,T淋巴细胞通过急性缺血性脑卒中的脑血液屏障被激活并积聚在缺血性核心区。有研究表明,T淋巴细胞在缺血性脑卒中后24小时开始浸润缺血性脑组织,并在发病后第3天达到峰值。缺血性脑卒中后发生炎性级联反应,其中T细胞及其亚群参与炎症介导的脑损伤。先前的研究认为对于脑组织损伤IL-17比IFN-γ更关键。IL-17是由Th17细胞和γδT细胞产生的促炎因子。γδT细胞在缺血性脑卒中后早期即进入梗死边界区,然后释放IL-17。缺血性脑卒中几天后,Th17细胞是IL-17的主要来源。另外,Th17细胞分泌的IL-17可能加重缺血性中风后的脑损伤。巨噬细胞释放的IL-23可刺激IL-17的产生。另外,TNF-α和IL-1水平的升高也能刺激IL-17分泌。在本发明的研究中,与对照组相比,用PR-957治疗组MCAO小鼠的神经功能的改善与其脑中的Th17显著减少相关。PR-957还能降低MCAO小鼠脑内IL-1β、IL-6、TNF-α、IL-12、IL-17和IL-23的mRNA表达。对MCAO小鼠的脑组织上清液的ELISA检测中观察到相同的减少趋势。这些结果表明,PR-957调节改善炎症环境是神经保护作用的基础。尽管有相当多的证据表明,CD4+CD25+Foxp3+T细胞通过抗炎细胞因子在中枢神经系统的生理和病理状态下调节免疫反应中发挥关键作用;但本研究中,缺血再灌注72小时后,PR-957治疗组与对照组相比,脑组织中Treg细胞数量没有显著差异。流式细胞术结果显示,与对照组相比,PR-957治疗组的MCAO脑组织中的Th17细胞数量显著减少。类似地,与对照组相比,免疫荧光染色也显示治疗组中MCAO脑组织中的IL17表达减少。
本发明证明了PR-957作为选择性免疫蛋白酶体抑制剂在MCAO小鼠模型中的应用。结果显示,LMP7选择性抑制剂对MCAO后的小鼠脑组织具有神经保护作用。然而,与既往有关缺血性卒中的研究发现NF-κB活化的调节不同,本发明提供了新证据:即PR-957通过抑制STAT3通路,在MCAO小鼠中调节促炎和抗炎的辅助性T细胞平衡。
综上所述,PR-957抑制了幼稚CD4+T细胞向Th17分化,减少脑组织中促炎性细胞因子的产生,在缺血性脑卒中具有神经保护作用。PR-957能够减轻MCAO模型小鼠脑组织的炎症反应,为临床上应用干预免疫策略治疗缺血性脑卒中提供了新的思路。
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,并不用以限制本发明。凡在本发明的申请范围内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!