一种膀胱修复材料及其用途和制备方法与流程
本发明涉及医学组织工程领域,尤其是膀胱组织修复领域。
技术背景
膀胱损伤是各种暴力引起的膀胱组织结构的挫伤、裂创及挫裂创;膀胱切除,是在必要的时候(如膀胱癌等)对膀胱病变组织进行切除。目前,临床上修复膀胱组织常利用胃肠道替代,但存在着诸多并发症,如,黏液分泌、长期菌尿、结石形成、吻合口漏尿、电解质紊乱等,且可能造成新的损伤。
组织工程技术的出现为解决这一问题提供了新的思路。目前,采用组织工程支架复合种子细胞的办法来进行膀胱修复的报道较多,该方法在促进膀胱组织再生,防止瘢痕的形成方面较有优势。
膀胱组织工程研究进程中,多种材料已被用于支架构建,如:乙烯聚合物海绵、聚乙烯的膀胱模型、橡胶网、硅橡胶补片、凝胶海绵、胶原等,这些材料移植到体内会产生较强的免疫排斥反应,且难以在体内降解,易引起组织感染、钙化等副作用。生物源的脱细胞基质去除了可能引发免疫反应的细胞成分,保留了器官组织的胞外基质结构,是绝佳的细胞粘附、生长、增殖和分化的场所。其中,小肠黏膜下层具有良好的生物相容性和机械强度,又包含大量生长因子,是一种理想的支架材料。
干细胞因具有多向分化潜能是为理想的种子细胞来源。有报道表明胚胎干细胞、成体干细胞、间充质干细胞、羊水来源的干细胞已用于膀胱组织工程重建。salemi等证实小鼠脂肪干细胞可分化为平滑肌细胞用于膀胱组织工程重建。
但是现有文献中,采用组织工程支架复合种子细胞修复膀胱均存在问题,即通常只能促进上皮再生,而难以促进肌肉再生,使得膀胱的排尿功能仍然难以有效恢复。
尿源性干细胞,从尿液中分离出的细胞群,具有干细胞的生物学特性和分化潜能的干细胞。尿源性干细胞是近年来才发现的一类新的干细胞,但是采用其作为种子细胞仍然存在难以有效促进肌肉再生的问题,如,liuyang等人的研究(stemcellresearch&therapy,2017,8(1):63),以兔子为实验对象,其术后四周,新生的平滑肌细胞仍然非常少。
需要对现有组织修复材料进行改进,解决上述问题。
技术实现要素:
为了解决上述问题,本发明提供了一种新的膀胱修复材料及其制备方法。
首先,本发明提供了一种修复材料,它是复合了抗体的小肠黏膜下层膜,所述抗体为cd29、cd44、cd73和cd90中的一种或者多种。
小肠黏膜下层膜:是指小肠经过去除浆膜层、肌层,再经脱脂、脱细胞、去垢、冻干制得的膜材料。
优选地,所述抗体为cd29。
其中,所述修复材料中,每平方厘米可以含有0.3-3微克抗体。
优选地,所述修复材料中,每平方厘米含有0.366~0.470微克抗体;进一步优选为每平方厘米含有0.463~0.470微克抗体。
优选地,所述抗体与小肠黏膜下层膜通过如下方式复合:
取抗体,活化氨基,与小肠黏膜下层膜共反应,洗涤;优选地,所述共反应是在室温下共反应1~3h,优选2h;
或者按照如下方法制备:取小肠黏膜下层膜,巯基化处理;取抗体,制成溶液,活化氨基,与巯基化的小肠黏膜下层膜共反应,洗涤;优选地,所述共反应是在室温下共反应1~3h,优选2h。
进一步优选地,所述活化氨基的方式是:0.25~1.0mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐溶液与抗体溶液反应,反应时间为0.5~2h,优选为1h;所述4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐溶液的浓度优选为0.5mg/ml;述4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐与抗体的重量比例为(3~7):1,优选为5:1。
所述巯基化处理的方法是:取小肠黏膜下层膜,置于浓度为1.25~10mg/ml的traut’s溶液中,室温反应1~2h,洗涤;反应时间优选1.5h。
traut’s溶液:2-亚氨基硫烷盐酸盐溶液。
所述小肠黏膜下层膜按照如下方法制备:取小肠,去除浆膜层和肌层,脱脂,脱细胞,去垢,冻干。
优选地,所述脱脂是用体积比为1:1的甲醇和氯仿的混合溶液浸泡6-24小时,去离子水冲洗;
和/或,所述脱细胞采用酶消化,在4~37℃环境中,于胰蛋白酶溶液中孵育6-24小时,生理盐水冲洗去除胰酶;优选地,所述混合溶液中,胰蛋白酶的浓度均为0.01~10%w/v,进一步优选为0.25%w/v;
所述去垢是在十二烷基硫酸钠溶液中处理3~5分钟,所述含十二烷基硫酸钠溶液的浓度为0.01%-1%w/v,优选浓度为0.3%w/v。
本发明还提供了一种制备前述修复材料的方法,方法如下:取抗体,活化氨基,与小肠黏膜下层膜共反应,洗涤;优选地,所述共反应是在室温下共反应1~3h,优选2h;
或者方法如下:取小肠黏膜下层膜,巯基化处理;取抗体,制成溶液,活化氨基,与巯基化的小肠黏膜下层膜共反应,洗涤;优选地,所述共反应是在室温下共反应1~3h,优选2h。
优选地,所述活化氨基的方式是:0.25~1.0mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐溶液与抗体溶液反应,反应时间为0.5~2h,优选为1h;所述4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐溶液的浓度优选为0.5mg/ml;述4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐与抗体的重量比例为(3~7):1,优选为5:1。
本发明还提供了前述修复材料在制备膀胱修复材料中的用途。
上述述膀胱修复材料,指的是膀胱切除手术后或膀胱损伤后对膀胱修复的材料。
本发明以小肠黏膜下层为组织工程支架,结合抗体形成的修复材料,可以募集尿源性干细胞,对膀胱修复性能优良,术后两周生成大量新生平滑肌细胞,myosin高表达,较为分散。术后四周平滑肌细胞趋于成熟,myosin、α-sma均有高表达,并且形成一定排列秩序。术后八周α-sma表达量显著提升,平滑肌细胞排列有序,更为致密,趋于正常,显著优于现有文献报道的小肠黏膜下层直接复合尿源性干细胞的方式。本发明采用小肠黏膜下层复合抗体募集尿源性干细胞的方式,相比小肠黏膜下层直接复合尿源性干细胞的方式,可以更好地促进平滑肌细胞新生,平滑肌再生,对膀胱组织功能修复有更好的恢复作用。
组织工程支架复合抗体在心肌修复研究中较为常见,用于解决采集自体细胞会对患者造成伤害的问题。而本发明中的小肠黏膜下层膜片复合抗体技术,解决的是提高膀胱修复的问题。血液中可供利用的种子细胞比尿液中要多得多,且流经心脏的血液每分钟可高达约5l,心脏处种子细胞的补充速率要远远高于膀胱;然而仍能以组织工程支架复合抗体的方法实现尿液中的种子细胞高效富集,达到优秀的膀胱修复效果(2cmx2cm缺损面积,8周基本完成修复;现有技术对心脏的修复是2mmx2.5mm缺损面积,4周基本完成修复),这是意想不到的。
本发明提供的修复材料,能大大降低细胞体外培养带来的污染风险,减少体外培养的时间成本,还能无损地利用手术对象自身的尿源干细胞,实现膀胱损伤区域的快速上皮化,并快速恢复其肌肉功能。本发明提供的修复材料在膀胱修复应用上具有方便、高效的特征,前景广阔。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其他多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
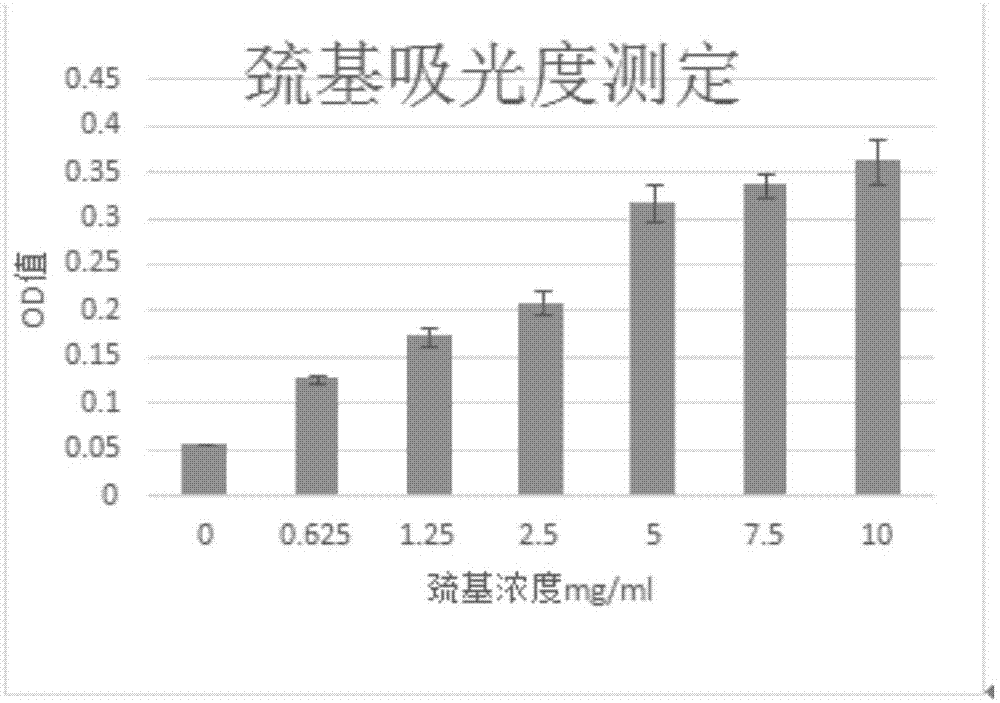
图1为sis膜与不同浓度traut’s反应后的巯基吸光度值;
图2为elisa测量液体残余抗体;
图3为混合细胞捕捉实验;
图4为凋亡实验,sis组;
图5为凋亡实验,ac-sis组;
图6为细胞增殖活力的测定;
图7为兔膀胱术后大体观察;
图8为上皮修复免疫荧光观察:1w,1周;2w,2周;4w,4周;8w,8周。
图9为平滑肌修复免疫荧光观察:左上,1周;右上,2周;左下,4周;右下,8周。
具体实施方式
traut’s:2-亚氨基硫烷盐酸盐
sulfo-smcc:4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐
ellman′s:5,5′-二硫双(2-硝基苯甲酸)
实施例1一种新的组织修复材料的制备
1.sis的制备
(1)清洁肠段:取新鲜猪小肠一副,清除肠段内多余食糜后,将小肠内外翻转,并用生理盐水反复将内表面清洗干净,接着用剪刀将小肠纵向剖开,最后剪成长15cm左右的肠段。
(2)物理刮除:使用压舌板刮除肠段上的浆膜层和肌肉层,得到初步的sis。该过程需反复用力刮除,直至分离出乳白色半透明状薄膜,并用生理盐水清洗2-3次。
(3)脱脂:用去离子水反复冲洗干净后,用纱布包裹sis膜,挤出部分水分,并用滤纸沾除多余水分。将氯仿-甲醇混合液,1:1v/v混合后,于通风橱内浸泡上述干燥后的sis膜共6h,每60min搅拌一次,使sis膜与液体充分接触。
(4)胰酶脱细胞:流水冲洗脱脂后的sis膜直至无任何异味,然后浸泡于浓度为0.25%(g/ml)的胰蛋白酶溶液中,置于4℃环境中过夜。
(5)sds去垢:去离子水反复清洗,除去胰酶后,于0.3%(g/ml)的sds中浸泡4h后,多次反复洗涤,除去sds。
(6)冻干:清洗平铺后,于–40℃冰柜中预冷冻后,于真空冷冻干燥机中冻干24h,于塑封袋中保存,
(7)环氧乙烷灭菌。
2.sis膜片的巯基化
(1)将sis材料裁剪成d=15.6mm(24孔板大小)的圆片,将10片sis圆片置于d=60mm的玻璃皿中;
(2)用pbs配制2.5mg/ml,的traut’s溶液(2-亚氨基硫烷盐酸盐溶液)2ml;
(3)将步骤(1)中材料(10片/皿)完全浸润于traut’s溶液,于室温反应1.5小时。反应结束后,用pbs清洗2-3次。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1小时,活化氨基,然后使用zebadesaltspincolumn(piercebiotechnology)除去有机试剂,纯化抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.02μg,本发明膜片上面复合的抗体的量为8.98μg,本发明膜片的面积为1.91cm2,一共有10片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.98μg/10/1.91=0.470微克。
实施例2一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
(1)将sis材料裁剪成d=15.6mm(24孔板大小)的圆片,将10片sis圆片置于d=60mm的玻璃皿中;
(2)用pbs配制5mg/ml,的traut’s溶液2ml;
(3)将步骤(1)中材料(10片/皿)完全浸润于traut’s溶液,于室温反应1.5小时。反应结束后,用pbs清洗2-3次。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制浓度为0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1小时,活化氨基,然后使用zebadesaltspincolumn(piercebiotechnology)除去有机试剂,纯化抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.148μg,本发明膜片上面复合的抗体的量为8.852μg,本发明膜片的每一片的面积为1.91cm2,一共有10片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.852μg/10/1.91=0.463微克。
实施例3一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
(1)将sis材料裁剪成d=15.6mm(24孔板大小)的圆片,将10片sis圆片置于d=60mm的玻璃皿中;
(2)用pbs配制10mg/ml,的traut’s溶液2ml;
(3)将步骤(1)中材料(10片/皿)完全浸润于traut’s溶液,于室温反应1.5小时。反应结束后,用pbs清洗2-3次。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.136μg,本发明膜片上面复合的抗体的量为8.864μg,本发明膜片的面积为1.91cm2,一共有10片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.864μg/10/1.91=0.464微克。
实施例4一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
(1)将sis材料裁剪成d=22.1mm(12孔板大小)的圆片,将5片sis圆片置于d=60mm的玻璃皿中;
(2)用pbs配制5mg/ml,的traut’s溶液2ml;
(3)将步骤(1)中材料(5片/皿)完全浸润于traut’s溶液,于室温反应1.5小时。反应结束后,用pbs清洗2-3次。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.148μg,本发明膜片上面复合的抗体的量为8.852μg,本发明膜片的面积为3.84cm2,一共有5片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.852μg/5/3.84=0.461微克。
实施例5一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
(1)将sis裁剪成2.2cm*2.2cm正方形膜片,将5片sis圆片置于d=60mm的玻璃皿中;
(2)用pbs配制5mg/ml,的traut’s溶液2ml;
(3)将步骤(1)中材料(5片/皿)完全浸润于traut’s溶液,于室温反应1.5小时。反应结束后,用pbs清洗2-3次。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.148μg,本发明膜片上面复合的抗体的量为8.852μg,本发明膜片的面积为4.84cm2,一共有5片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.852μg/5/4.84=0.366微克。
实施例6一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
同实施例2步骤2。
3.抗体与sis膜片的耦联
本实施例以抗体cd44/cd73/cd90为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与10μl(1mg/ml)的cd44/cd73/cd90抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
采用测小鼠igg的elisa试剂盒测算液体中残余的抗体浓度,反算得出复合在sis膜片上面的抗体量。
经过检测得到,溶液中抗体量为1.148μg,本发明膜片上面复合的抗体的量为8.852μg,本发明膜片的每一片的面积为1.91cm2,一共有10片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:8.852μg/10/1.91=0.463微克。
实施例7一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
同实施例2步骤2。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与5μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
实施例8一种组织修复材料的制备
1.sis的制备
同实施例1步骤1。
2.sis膜片的巯基化
同实施例2步骤2。
3.抗体与sis膜片的耦联
本实施例以抗体cd29为例,说明抗体与sis膜片的耦联过程。用100μl,pbs配制的0.5mg/ml的4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc;sigma)与20μl(1mg/ml)的cd29抗体在玻璃皿内,于室温反应1.5小时,然后使用zebadesaltspincolumn(piercebiotechnology)提纯抗体。将活化的抗体加入与步骤2处理后的sis膜片中,室温下共反应2小时,反应结束后,吸走液体,用pbs清洗2-3次。
以下通过实验例的方式来说明本发明的有益效果:
实验例1sis膜巯基接枝量的检测
1.方法
用pbs配制不同浓度(0,0.625,1.25,2.5,5,10mg/ml)的traut’s试剂(含edta2mg/ml)溶液各2ml,以实施例1中方法制备sis膜片。用nahco3配制浓度为0.4mmellman’s试剂,检测上述sis膜巯基接枝量。将上述sis膜片加入上述ellman‘s试剂孵育20min后,在波长为410nm处,测得吸光度。
2.结果
巯基接枝量和巯基浓度成正相关关系,如图1所示,traut’s试剂浓度在10mg/ml时,巯基接枝量最大。
实验例2抗体的接枝效率
1.方法
用pbs配制不同浓度(0,0.625,1.25,2.5,5,10mg/ml)的traut’s试剂(含edta2mg/ml)溶液各2ml,以实施例1中方法制备sis膜片。
采用测小鼠igg的elisa试剂盒,测算液体中的残余的抗体浓度,反算得出抗体耦联效率。
2.结果
标准曲线如图2(横坐标:抗体浓度纵坐标:od值,采用elisacalc软件进行四参数logistic曲线拟合回归方程:回归方程:y=2.78011/[1+(x/49.35570)^-1.55073]+0.07210)
检测的结果如下表1所述:
表1不同traut’s试剂与抗体直接效率的关系
由上表可以看出,当不添加traut’s试剂时,可以复合大量的抗体,但是其结合不牢固;当添加traut’s试剂时,traut’s试剂的浓度为2.5~5mg/ml时较高,在浓度为2.5mg/ml时最高。
采用前述方法制备的本发明复合材料,每平方厘米含有的抗体为0387~0.470微克。
计算方法为:本发明膜片的每一片的面积为1.91cm2,一共有10片,因此本发明制备得到的修复材料中,每平方厘米含有的抗体为:(7.628~8.98)μg/10/1.91微克。
实验例3耦联抗体sis对细胞的捕捉
1.方法
本实验用物理耦联抗体(未使用耦联剂,单纯物理吸附)的sis作为对照,以实施例2材料为实验组,设置爬片作为阳性对照。用绿色荧光染料cfse标记第三代人源uscs,红色荧光染料pkh26标记3t3(cd29阴性表达细胞),按1:1混合制备细胞密度为2x10^4/ml的细胞悬液。将环氧乙烷灭菌的24孔板大小sis圆片(实验组+对照组)、细胞爬片平铺在24孔板内,每孔接种混合细胞悬液2ml,放置于37℃,5%co2细胞培养箱内孵育30min后,用无菌pbs清洗2-3次(冲洗掉未被抗体特异捕捉的uscs)。培养24h后,荧光显微镜下采图,对比两组细胞捕捉情况。
2.结果
实验组出现了绿色荧光点状信号,而无红色信号,表明抗体耦联的sis材料确实可以特异性地捕捉尿源干细胞,结果如图3所示。
实验例4凋亡实验
本实验用未耦联抗体的sis作为阴性对照,以实施例2材料为例。
1.方法
选用生长状态良好的p3代uscs,tne(胰蛋白酶溶液)常规消化后计数,将细胞悬液稀释成2x10^4/ml。将ac-sis平铺于24孔板内,每孔加入1ml细胞悬液,于细胞培养箱孵育30min后,吸走细胞悬液,并以无菌pbs每孔洗涤2-3次,再将膜片转移至新孔板,每三天换一次液,生长至第七天细胞总量可满足流式检测时,对细胞进行消化处理。每孔加入1mltne,将细胞版轻晃30s,加入1ml培养基终止消化后轻轻吹打,将孔板内液体全部吸至15ml离心管后,每孔重复上述消化步骤一遍。将两次收集好的细胞悬液离心,计数,细胞密度调整至1×106/ml,用pbs洗涤两次,每次吹打重悬时动作轻柔。吸取200μl细胞悬液于流式管中,离心后弃上清,加入凋亡试剂盒bindingbuffer200μl,用枪尖轻轻吹打或用手指弹流式管底部,让细胞重新悬浮且无团集,加入双染试剂annexinv/pi各2μl。4℃孵育5min,即可上机检测。
2.结果
图4、图5分别为sis,ac-sis细胞凋亡流式结果,细胞存活率分别为94.4%,95.0%,无统计学差异,说明改性后的材料无明显细胞毒性,细胞存活状态良好。
实验例5细胞活力检测
1.方法
本实验用未耦联抗体的sis作为阴性对照,以实施例2材料为例。选用生长状态良好的p3代人源uscs,tne常规消化后计数,将细胞悬液稀释成2x10^4/ml。将sis与ac-sis分别置于24孔板内,实验检测第一天,三天,五天,共3个时间点,每个时间点设置3个复孔,每孔加入1ml细胞悬液。细胞版置于细胞培养箱孵育30min后,吸走细胞悬液,并以无菌pbs每孔洗涤2-3次,即是将未被抗体特异性捕捉的uscs洗脱,再将膜片转移至新孔板,孵箱培养24h,进行第一次cck-8检测。首先弃掉孔内液体,加入含cck-8培养基,每孔为300μ培养基加30μcck-8,于细胞培养箱孵育2h后,吸取100μl待检测液至96孔板,使用酶标仪于波长450nm下检测。
2.结果
由图6所示,耦联抗体的实验组,细胞活力测定远高于对照组,证明抗体耦联材料可对uscs实现捕捉,且无明显细胞毒性,不影响细胞增殖及活力。
实验例6兔膀胱修复实验
本实验以兔膀胱缺损修复实验说明材料的修复能力,共设置自体修复(control),sis修复,ac-sis(antibody-crosslinkedsis,指抗体耦联的sis,采用实施例5得到的材料)修复三组,以1,2,4,8周为4个观察点取材。
1.方法
1.1手术操作
本实验通过手术器械,在兔膀胱后壁造一个2cm×2cm的方形全层缺损模型。自体修复组将膀胱顶的缺角与对角对齐,采用5-0可吸收带针缝线缝针固定,打结后留线,剩余两角均缝针留线,此时从一个端角开始采用连续锁边的方式全层对缝。材料修复组均为将膜片4个角与缺损4个角缝合固定后留线,牵拉,再从一个角开始连续锁边缝合,防止尿液渗漏。缺损区域缝合后,用不可吸收线在四个角处(自体修复组为两端)进行标记,并逐步关闭腹腔。实验完成后,将兔放回笼中饲养,待取材。
1.2取样观察
分别在第1周、第2周、第4周和第八周分批处死实验对象,取出膀胱观察。
1.3免疫荧光切片检测
将术后取材的组织进行固定、石蜡包埋、切片。对切片按常规方法脱蜡复水,再于柠檬酸酸钠缓冲溶液(ph=6.0)微波加热进行抗原修复,血清封闭后,孵育一抗、二抗(ae1/ae3、α-sma和myosin为一抗;山羊抗小鼠为二抗,1:200稀释后使用)。用一抗稀释液将ae1/ae3按1:200,α-sma按1:400,myosin按1:500稀释,滴加稀释一抗后,4℃条件下孵育过夜,pbs洗涤3次后。二抗以1:200的比例稀释后于孵育37℃条件下孵育1h,pbs洗涤3次。将制作好的免疫荧光切片在荧光显微镜下观察拍照。
2.结果
2.1膀胱组织外观
如图7所示,sis组与ac-sis组材料均在2w时可观察到材料的降解,4周时少量材料未降解完成,8周均降解完全。ac-sis组组织平均厚度高于自体修复组、sis组,初步说明其平滑肌修复效果更为理想。
2.2上皮修复和平滑肌修复的免疫荧光切片
术后一周修复区域明显未上皮化,少量红色荧光信号显示,该区域或有少量上皮细胞新生。术后两组,损伤区域附近有大量的新生上皮组织形成,并逐步往损伤区域迁移,实现修复。术后四周,修复基本完成,形成连续上皮,术后八周上皮完整连续,完成修复,具体如图8所示。平滑肌免疫荧光观察中,因血细胞大量吸附绿色荧光,因而术后一周可观察到修复区域有大量血管生成,术后两周生成大量新生平滑肌细胞,肌球蛋白高表达,较为分散。术后四周平滑肌细胞趋于成熟,肌球蛋白、α-sma均有高表达,并且形成一定排列秩序。术后八周α-sma表达量显著提升,平滑肌细胞排列有序,更为致密,趋于正常,如图9所示。实验结果表明,ac-sis在缺损修复过程中,实现了缺损区域上皮化、平滑肌的新生,加速了膀胱的修复。
本发明提供的修复材料,膀胱修复效果非常优良,快速上皮化,并快速恢复其肌肉功能,应用前景优良。
- 还没有人留言评论。精彩留言会获得点赞!