个性化癌症疫苗的制备方法与流程
本发明属于生物医药技术领域,具体地,涉及个性化癌症疫苗的制备方法,具体地,涉及从患癌对象的体液中收集筛选含肿瘤特异性体细胞突变的抗原片段,从而制备个性化癌症疫苗的方法。
背景技术:
癌症的发生,是因为病人体内的某些细胞产生了基因突变,出现不受控制地增殖分化,最终发展成为恶性肿瘤。癌细胞表面存在许多由突变基因编码的新生抗原蛋白,正常情况下应能被人体免疫系统及时识别,并引发免疫反应将这些癌细胞清除。然而在病理情况下,肿瘤细胞发展分化迅速,且不断发生新的突变,使得机体免疫系统不能及时识别。再加上肿瘤微环境中形成的免疫抑制,可能使免疫系统完全丧失反应能力。虽然目前比较先进的免疫治疗疗法,如car-t技术等,能够在体外改造t细胞,增强其肿瘤细胞免疫识别和反应能力,并在体外放大后在回注到病人身上,但是注射后病人自身还是不能复制这些细胞。当然,输入体内的免疫细胞中一部分可能会长期潜伏下来,成为“记忆细胞”,这样将来可能“复苏”。但这些细胞经过了基因改造,长期潜伏在人体内会造成什么问题?短期内没有答案。同时,过度降低免疫应答门槛,可能会导致过度的免疫反应及各种炎症。而最先进的个性化car-t技术目前也只对个别癌症的部分病人有效,并且最近也有异体car-t药物造成患者死亡的事件发生。
癌症的免疫治疗,需另辟蹊径。癌细胞表面存在的由突变基因编码的新生抗原蛋白,之所以无法引起免疫应答,可能是这些异常蛋白表达量不高,不足以引发机体免疫识别和免疫反应。而肿瘤基因组测序的开展,及癌症免疫治疗的进展,使得应用这些异常的肿瘤新生抗原蛋白来制作癌症疫苗成为可能(ottpanat2017;547:217-221,epub2017jul5;sahinuetal.nat2017;547:222-226,epub2017jul5)。所谓个性化癌症疫苗,即根据患癌对象各自肿瘤细胞有关的突变情况定制设计的抗癌疫苗,是个性化医疗(精准医疗)发展的高级阶段。然而,如何高效地从组织中获取关键抗原,并安全地施用于所需要的对象从而有效地抑制肿瘤,至今仍面对着不少癌症疫苗挑战。例如疫苗制备时间较长,需6-8周;样本的获得必须进行手术切除晚期病人癌变组织,才能发现和证实肿瘤体细胞突变。癌症疫苗长周期和有创性的获得途径都难以满足患癌对象巨大的临床治疗需求。
技术实现要素:
本发明的第一方面,提供了一种制备个性化癌症疫苗的方法,包括以下步骤:
(a)提供对应于所述对象的第一样本测序数据集a1和第一对照测序数据集r1;和/或提供对应于所述对象的第二样本测序数据集a2和第二对照测序数据集r2,
其中,所述的第一样本数据集a1和第一对照测序数据集r1通过包括以下步骤的方法获得:
t1).提供第一样本,所述第一样本为含ctc细胞和正常体液细胞的样本;
t2)对所述第一样本进行ctc细胞富集处理,从而获得经富集的第一样本,其中在所述的经富集的第一样本中,ctc细胞丰度c1≥5%并且正常体液细胞丰度c2≤95%,按所述经富集的样本中所有细胞的总数量计,并且ctc细胞丰度c1与正常体液细胞丰度c2之比记为b1(即b1=c1/c2);
t3)从所述经富集的第一样本中抽提dna和/或rna,从而获得第一核酸样本,其中所述第一核酸样本包括来自ctc细胞的核酸样本以及来自正常体液细胞的核酸样本;和
t4)对所述第一核酸样本进行测序,其中,将所述第一核酸样本中来自正常体液细胞的核酸样本作为来自ctc细胞的核酸样本的对照,从而获得第一样本测序数据集a1和第一对照测序数据集r1,其中第一样本测序数据集a1对应于ctc细胞的测序数据集,而第一对照测序数据集r1对应于正常体液细胞的测序数据集;
其中,所述的第二样本数据集a2和第二对照测序数据集r2通过包括以下步骤的方法获得:
w1).提供第二样本,所述第二样本为含循环肿瘤dna(ctdna)和循环肿瘤rna(ctrna)及其他游离dna(cfdna)和游离rna(cfrna)的样本;
w2).对所述第二样本进行富集处理,从而获得经富集的第二核酸样本;其中,所述的经富集的第二核酸样本包括来自ctc细胞的ctdna和ctrna以及来自正常体液细胞的cfdna和cfrna,其中按所有核酸的总重量计算,ctdna和ctrna含量l1≥5%,而来自正常细胞cfdna和cfrna的含量l2≤95%,并且所述含量l1与l2之比记为b2(即b2=l1/l2);
w3).对所述第二核酸样本进行测序,其中,将所述第二核酸样本中的样本中来自正常细胞的cfdna和cfrna作为来自ctc细胞的ctdna和ctrna的对照,从而获得第二样本测序数据集a2和第二对照测序数据集r2,其中第二样本测序数据集a2对应于ctc细胞的测序数据集,而第二对照测序数据集r2对应于正常体液细胞的测序数据集;
(b).将所述第一样本测序数据集a1与第一对照测序数据集r1,或第二样本测序数据集a2与第二对照测序数据集r2,分别进行序列比对处理,从而获得第一候选数据集s1或第二候选数据集s2;其中,所述第一候选数据集s1中的任一序列元素是存在于所述a1但不存在于所述r1的元素;而所述第二候选数据集s2中的任一序列元素是存在于所述a2但不存在于所述r2的元素;
(c).对于所述第一候选数据集s1和/或第二候选数据集s2中的任一序列元素,进行hla类型i或ii受体亲和力预测分析,从而获得一级选定的序列元素,所述一级选定的序列元素为与hla类型i或ii受体结合紧密(ic50≤500nm,较佳地,100nm)的序列元素;
(d).基于所述一级选定的序列元素,合成对应于所述一级选定的(primarilyselected)序列元素的dna、rna、短肽链;
(e).用所述合成的dna、rna、短肽链,进行离体t-细胞受体(tcr)结合试验和cd8+t细胞和/或cd4+t辅助细胞活化试验,从而获得10-30种二级选定的(secondarilyselected)序列元素,其中所述的二级选定的序列元素能够与tcr结合且使cd8+t细胞和/或cd4+t辅助细胞活化;
(f).基于所述二级选定的序列元素,合成对应于所述二级选定的序列元素的dna、rna、肽链;
(g).将上一步骤中合成的所述的dna、rna、肽链与药学上可接受的载体混合,从而制得药物组合物,即为个性化癌症疫苗。
在另一优选例中,在经富集的第一样本中,ctc细胞丰度为5%至95%(较佳地10-90%)而正常体液细胞丰度为95%至5%(较佳地90-10%),且ctc细胞丰度和正常体液细胞丰度相加之后为100%。
在另一优选例中,在经富集的第二样本中,来自于ctc细胞的ctdna和ctrna含量为5%至95%(较佳地10-90%)而来自于正常细胞cfdna和cfrna的含量为95%至5%(较佳地90-10%),且ctc细胞的ctdna和ctrna含量和正常细胞cfdna和cfrna含量相加之后为100%。
在另一优选例中,所述第一核酸样本中,来自ctc细胞的核酸样本与来自正常体液细胞的核酸样本的重量比b2等于或基本上等于b1。
在另一优选例中,第一对照测序数据集r1对应于正常的pbmc细胞的测序数据集。
在另一优选例中,第二对照测序数据集r2对应于正常的pbmc细胞的测序数据集。
在另一优选例中,在步骤(t4),“将来自正常体液细胞的核酸样本作为来自ctc细胞的核酸样本的对照”指在对测序数据,参考ctc细胞丰度c1与正常体液细胞丰度c2之比b1进行分类和/或分析。
在另一优选例中,在步骤(w3),“将来自正常细胞的cfdna和cfrna作为来自ctc细胞的ctdna和ctrna的对照”指在对测序数据,参考ctc细胞的ctdna和ctrna含量l1与来自正常细胞cfdna和cfrna含量l2之比b2进行分类和/或分析。
在另一优选例中,在所述分类和/或分析中,对于同一位点或位置的两类测序数据d1和d2,如果符合下式q1,则将测序数据d1归类为ctc测序数据,并将测序数据d2归类为正常体液细胞的测序数据
rd1/(rd1+rd2)≈c1/(c1+c2)(q1)
式中,
rd1为测序数据d1(如读序或其相关序列)的出现频率(或丰度,如读序深度)
rd2为测序数据d2(如读序或其相关序列)的出现频率(或丰度,如读序深度)
c1为经富集的第一样本中的ctc细胞丰度;
c2为经富集的第一样本中的正常体液细胞丰度。
在另一优选例中,在所述分类和/或分析中,对于同一位点或位置的两类测序数据e1和e2,如果符合下式q2,则将测序数据e1归类为ctc细胞的ctdna和ctrna测序数据,并将测序数据e2归类为正常细胞ctdna和ctrna的测序数据
re1/(re1+re2)≈l1/(l1+l2)(q2)
式中,
re1为测序数据e1(如读序或其相关序列)的出现频率(或丰度,如读序深度)
re2为测序数据e2(如读序或其相关序列)的出现频率(或丰度,如读序深度)
l1为经富集的第二样本中的ctc细胞ctdna和ctrna含量;
l2为经富集的第二样本中的正常细胞ctdna和ctrna含量。
在另一优选例中,在步骤(w2)中,所述富集包括用选自下组的一种或多种方法进行:通过基于细胞尺寸的捕获(过滤方法)或基于肿瘤表面标志物的阳性捕获(免疫学方法)。
在另一优选例中,在步骤(t2)中,所述富集包括用选自下组的一种或多种方法进行:分子筛、甲基化分离、过滤离心或其组合。
在另一优选例中,所述的测序包括用选自下组的一种或多种方法进行:初筛ultralowpass-wgs、wes或rna-seq。
在另一优选例中,所述的序列元素为下组:dna序列元素、rna序列元素、和/或肽链序列元素。
在另一优选例中,所述的dna序列元素包含2-5个dna变异体,每个dna变异体包含至少5个短肽链编码序列;和/或
所述的rna序列元素包含2-5个rna变异体,每个rna变异体包含至少5个短肽链编码序列;和/或
所述肽链序列元素含有5-100个氨基酸。
在另一优选例中,所述肽链序列元素优选为10-80个氨基酸,更优选为15-50个,如20、30、40个氨基酸。
在另一优选例中,所述的“与hla类型i或ii受体结合的序列元素”指所述序列元素所对应的肽序列(即肽链序列元素本身,或rna序列元素/dna序列元素所编码的肽序列)能够与hla类型i或ii受体结合。
在另一优选例中,所述的正常体液细胞包括白细胞、单核细胞、淋巴细胞等。
在另一优选例中,所述方法还用于癌症的早期诊断。
在另一优选例中,所述方法在4-6周内完成,以利于个性化癌症疫苗及时应用于激发患癌对象的免疫反应。
在另一优选例中,所述体液包括血液、尿液、唾液、淋巴液或精液。
在另一优选例中,所述体液包括胸水、腹水、脑脊液。
在另一优选例中,所述方法还包括步骤(h1):基于步骤(f)中合成的所述的dna、rna、肽链,筛选出与所述二级选定的序列元素特异性结合的单链抗体(scfv),并构建和/或扩增表达嵌合抗原受体(car)的t细胞(car-t),其中,所述car含有所述scfv作为胞外抗原结合域。
在另一优选例中,所述的单链抗体是通过单链抗体噬菌体展示技术获得。
在另一优选例中,在步骤(h1)中,针对一种或多种(如2-5种)所述二级选定的序列元素,分别筛选出具有特异性的单链抗体(scfv),并构建相应的所述表达嵌合抗原受体(car)的t细胞(car-t)。
在另一优选例中,所述的表达嵌合抗原受体(car-)的t细胞用于回输给所述对象。
在另一优选例中,所述的回输还包括额外地施用针对通用肿瘤抗原的car-t细胞、tcr-t细胞和/或共刺激因子。
在另一优选例中,所述方法还包括步骤(h2):基于步骤(f)中合成的所述的dna、rna、肽链,筛选出与所述二级选定的序列元素特异性结合的t细胞受体(tcr),并构建和/或扩增表达所述tcr的t细胞(tcr-t)。
在另一优选例中,在步骤(h2)中,针对一种或多种(如2-5种)所述二级选定的序列元素,分别筛选出特异性的tcr,并构建和/或扩增相应的表达所述tcr的t细胞。
在另一优选例中,所述的表达所述tcr-的t细胞用于回输给所述对象。
在另一优选例中,所述的回输还包括额外地施用针对通用肿瘤抗原的car-t细胞、tcr-t细胞和/或共刺激因子。
在另一优选例中,所述方法还包括步骤(h3):基于步骤(f)中合成的所述的dna、rna、肽链,在体外对所述对象的树突状细胞(dc)进行致敏(priming)处理,从而获得经致敏的(primed)树突状细胞。
在另一优选例中,在步骤(h3)中,用多种(如2-5或5-10或10-20种)所述二级选定的序列元素,进行致敏处理。
在另一优选例中,在步骤(h3)中,还包括:在体外,将所述经致敏的树突状细胞与所述对象的t细胞进行共培养,从而制得dc-ctl细胞。
在另一优选例中,所述的经致敏的(primed)树突状细胞和/或dc-ctl细胞用于回输给所述对象。
在另一优选例中,步骤(h1)、(h2)和(h3)是各自独立的,并可任意互相组合。
在另一优选例中,在所述方法中,用步骤(h1)、(h2)和/或(h3)替换步骤(g)。
在另一优选例中,步骤(g)、(h1)、(h2)和(h3)是各自独立的,并可任意互相组合。
在另一优选例中,所述的正常体液细胞选自下组:外周血单个核细胞(pbmc)。
本发明第二方面,提供了一种个性化癌症疫苗,所述的疫苗是由本发明第一方面中任一所述方法制成的。
在另一优选例中,所述的疫苗还任选地含有佐剂。
在另一优选例中,所述佐剂包括:poly-iclc,tlr,1018iss,铝盐,amplivax,as15,bcg,cp-870、893,cpg7909,cyaa,dslim,gm-csf,ic30,ic31,咪喹莫特,imufactimp321,ispatch,iss,iscomatrix,juvlmmune,lipovac,mf59,单磷酰脂质a,蒙塔尼德ims1312,蒙塔尼德isa206,蒙塔尼德isa50v,蒙塔尼德isa-51,ok-432,om-174,om-197-mp-ec,ontak,plga微颗粒,瑞喹莫德,srl172,病毒微体和其他病毒样颗粒,yf-17d,vegf陷阱,r848,β-葡聚糖,pam3cys,阿奎拉qs21刺激子,vadimezan或asa404(dmxaa)。
本发明第三方面,提供了一种用于免疫治疗的细胞产品,所述的细胞产品是用本发明第一方面中所述的方法制备的,所述细胞产品包括:个性化car-t细胞、个性化tcr-t细胞、个性化经致敏的dc细胞和个性化dc-ctl细胞。
本发明第四方面,提供了一种在患癌对象诱导肿瘤特异免疫反应的方法,包括向需要的对象施用如本发明第二方面所述的个性化癌症疫苗。
在另一优选例中,所述个性化癌症疫苗还可用于制备一种联合施用治疗癌症的药物组合物。
在另一优选例中,所述个性化癌症疫苗和佐剂还可与其他药物和/或疗法联合用药。
在另一优选例中,所述的其它药物或疗法包括抗免疫抑制药物、化疗、放疗、或其他靶向药物。
在另一优选例中,所述抗免疫抑制药物包括抗ctla-4抗体,抗pd1抗体,抗pd-l1抗体,抗cd25抗体,抗cd47抗体或ido抑制剂。
在另一优选例中,所述的治疗癌症的药物组合物包括抗体药物、细胞免疫治疗药物(如car-t细胞、tcr-t细胞、dc-ctl细胞等)、或其组合。
本发明第五方面,提供了一种对患癌对象进行个性化治疗的方法,包括向需要的对象施用如本发明第三方面所述的免疫治疗的细胞产品。
附图说明
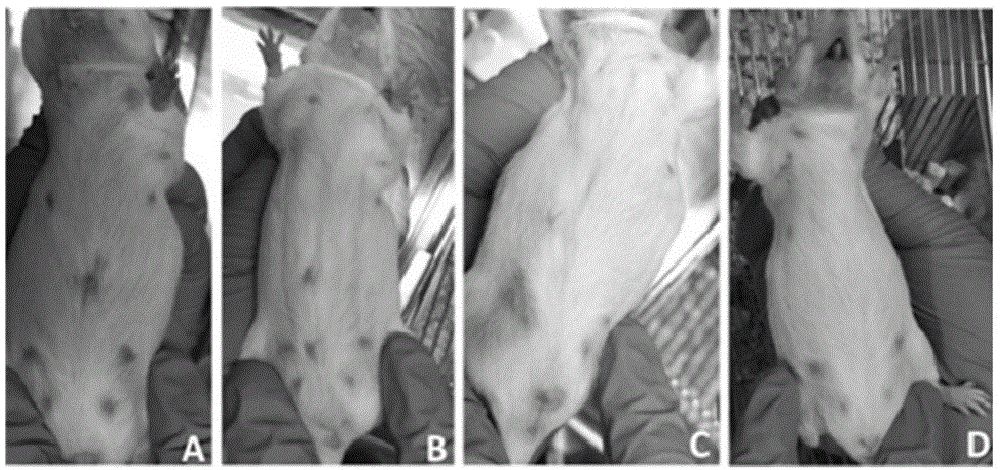
图1显示了小鼠肺癌动物模型身体状态观察图。部份实验组小鼠(a,b,c)4周注射完成后出现腹部皮毛脱落现象,而对照组小鼠(d)表现正常。
图2显示了单个ctc示意图。从结肠癌病人(a)和患癌小鼠(b)血浆中分离的ctc(如箭头所指)。利用celsee系统富集的ctc经染色显示dapi阳性(蓝色),panck阳性(绿色)及cd45阴性。并进行ctc细胞回收及富集,从该结肠癌病人分选的最终ctc细胞数经过二代测序(ngs)验证和sequenza软件分析,细胞总数为10,其中ctc细胞丰度(cellularity)占比30-40%,染色体倍数(ploidy)为混合多倍体;背景颜色表示分析对数后验概率(logposteriorprobability,lpp)的可能性(蓝色=最有可能,白色=最不可能)(c)。
图3显示了ctc单细胞外显子组测序和转录组测序(g&t-seq)核酸扩增示意图。从患癌小鼠血浆ctc富集样本先分离mrna,经反转录成cdna(a,b),同时提取剩余的基因组dna并扩增(c),以供外显子组测序和转录组测序使用。
图4显示了对应于图3ab的cdna文库的一个ctc突变的测序结果。
图5显示了小鼠个性化癌症疫苗制备示意图。已筛选并制作8-12种多肽疫苗,与佐剂混合,注射至患癌小鼠皮下,观察疗效。注射了个性化癌症疫苗的患癌小鼠,仍然存活,而没有注射疫苗的患癌小鼠,则陆续死亡。
图6显示了病人ctdna片段大小示意图。利用安捷伦2100分析仪,上图(rubicon提供)箭头显示有两个片段,左边为主要的170bp片段,右边为一些大分子片段;下图为一病人ctdna样本,除主要170bp片段外,大分子片段已被专有的富集手段清除。
图7显示了癌症病人肿瘤新生抗原预测结果。应用hlahd软件对病人hla分子分型,应用sentieontnscope等软件,以病人外周血单个核细胞dna外显子组测序序列作为对照,从病人ctcdna外显子组测序序列中分离肿瘤新生抗原,并应用相关分析软件预测短肽链肿瘤新生抗原及其相对应的野生型短肽链与病人mhc分子的亲和力。红框显示病人个性化癌症疫苗筛出的最佳候选成份,该短肽链肿瘤新生抗原与mhci类分子的亲和力(7.16nm)比其相对应的野生型短肽链(25394.2nm)要高出约3550倍。
图8显示了癌症病人癌症驱动基因突变示意图。两个癌症病人(结肠癌和皮肤癌)外显子组测序结果显示muc16基因突变有5个相同的位点(箭头所指)。
图9显示了肿瘤新生抗原筛查流程。利用专有的筛查方法,从癌症病人血浆ctc筛选80-100种肿瘤新生抗原候选成份,组成串联短基因(tmg)库,进行体外转录(ivt),rna分子转染至从病人血浆分离分化的dc细胞;然后抽取病人外周血,分离cd8+t细胞、cd4+t辅助细胞,分别进行exvivoelispot实验,筛选出能活化cd8+t细胞或cd4+t辅助细胞的肿瘤新生抗原,制备个性化癌症疫苗。
图10显示了卵巢癌病人无创血浆和有创胸腹水分离制备ctc肿瘤新生抗原疫苗实验流程。
具体实施方式
本发明人经过广泛而深入的研究,首次在患癌对象体液中通过收集体液并分离富集一定比例的循环肿瘤细胞(ctc)及其dna和rna或循环肿瘤dna(ctdna)和循环肿瘤rna(ctrna)混合物,利用新一代测序技术(包括ulp-wgs、wes及rna-seq等测序方法),分别以患癌对象其他正常体液细胞dna和rna样本作为ctc及其dna和rna的对照样本,或患癌对象体液内来自于其他正常细胞的游离dna(cfdna)和游离rna(cfrna)样本作为ctdna和ctrna的对照样本,在提取和富集的ctcdna及rna和/或ctdna及ctrna片段中,分离和证实10-30种能引起蛋白序列变化并能与人体hla类型i或ii受体及t-细胞受体(tcr)紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的dna,rna或短肽链,即肿瘤新生抗原,有助于癌症的早期诊断;并且,在4-6周内,制成个性化癌症疫苗,从而开发快速、高效个性化实体肿瘤免疫治疗方案。在此基础上,完成了本发明。
具体地,本发明人采用富集(1)循环肿瘤细胞(ctc)及其dna和rna或(2)循环肿瘤dna(ctdna)和循环肿瘤rna(ctrna),按照特定比例,利用测序技术(ngs)包括ultralowpass全基因组测序(ulp-wgs)、全外显子组测序(wes)及rna-seq,分别以从患癌对象ctc和其他正常体液细胞dna和rna混合抽提液中占比≤95%的其他正常体液细胞dna和rna样本作为占比≥5%的ctc及其dna和rna样本的对照样本,或患癌对象体液内占比≤95%的来自于其他正常细胞的游离dna(cfdna)和游离rna(cfrna)样本作为占比≥5%的ctdna和ctrna样本的对照样本,在提取和富集的ctcdna及rna和/或ctdna及ctrna片段中,分离和证实10-30种能引起蛋白序列变化并能与人体hla类型i或ii受体及t-细胞受体(tcr)紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的dna,rna或短肽链,即肿瘤新生抗原,有助于癌症的早期诊断;并且,在4-6周内,制成个性化癌症疫苗,及时用于激发患癌对象的免疫反应。
定义
“体液(bodilyfluid)”是指人体自然存在或分泌的液体,包括并不限于血液、尿液、唾液、淋巴液、精液、胸水、腹水、脑脊液等。
循环肿瘤细胞(circulatingtumorcell,ctc)是存在于血液循环系统中的各类肿瘤细胞的统称,因自发或诊疗操作从实体肿瘤病灶包括原发灶和转移灶等脱落,大部分ctc在进入外周血后发生凋亡或被吞噬,少数能够逃逸并发展成为转移灶,增加癌症患者死亡风险。
“cfdna和cfrna”是指人体体液系统,尤其是血液循环系统中,含有不断流动的来自病人肿瘤基因组的dna和细胞rna片段。正常细胞和肿瘤细胞都会破裂,细胞破裂之后,细胞中的dna就会被释放到体液当中,其中进入血液的这部分dna和rna,就被称为血浆游离dna(cfdna)或cfrna。
“ctdna和ctrna”是指人体体液系统,尤其是血液循环系统中,含有不断流动的来自病人肿瘤基因组的dna和细胞rna片段。以上cfdna和cfrna里来源于肿瘤细胞的那部分dna和rna,携带肿瘤特异突变,叫ctdna或ctrna。
“肿瘤新生抗原(neoantigen)”是指仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原,故又称独特肿瘤抗原。此类抗原可存在于不同个体同一组织类型的肿瘤中,如人恶性黑色素瘤基因编码的黑色素瘤特异性抗原可存在于不同个体的黑色素瘤细胞,但正常黑色素细胞不表达。这类抗原也可为不同组织学类型的肿瘤所共有,如突变的ras癌基因产物可见于消化道、肺癌等,但由于其氨基酸顺序与正常原癌基因ras表达产物存在差异,可被机体的免疫系统所识别,激发机体的免疫系统攻击并消除肿瘤细胞。肿瘤新生抗原主要诱导t细胞免疫应答。
“wgs”是在获得一定的遗传及物理图谱信息的基础上,将基因组dna分解成2kb左右的小片段进行随机测序,辅以一定数量的10kb的克隆和bac克隆的末端测序,利用超级计算机进行整合进行序列组装。
“ulp-wgs”则是一种超低通量的快速、相对廉价的全基因组测序方法,测序深度仅为0.01-0.1x,已应用于无创产前筛查以检测大规模染色体异常。可用于癌症病人早期ctc和ctdna的筛查,筛查阳性的ctc和ctdna样本可进一步开展wes和rna-seq分析。
“wes”:外显子组(exome)是指真核生物基因组中全部外显子区域的总和,包含了蛋白质合成最直接的信息。wes是利用设计好的探针试剂盒将坐标已知的全基因组外显子区域的dna捕捉并富集后,进行高通量测序的基因组分析方法。对于人类基因组来说,外显子区域大概占到基因组的1%,大约30m。
“rna-seq”:转录组是指在相同生理条件下的在一个细胞、或一群细胞中所能转录出的所有rna的总和,包括mrna、rrna、trna及非编码rna。rna-seq是将提取所要研究的特定类型的rna,将其反转录成cdna,利用高通量测序技术获得某一物种特定组织或器官在某一状态下的几乎所有转录本序列信息。
“mhc”是所有生物相容复合体抗原的一种统称,表示由mhc基因家族(mhcclassⅰ,classⅱ,classⅲ)编码而成的分子,位于细胞表面,主要功能是绑定由病原体衍生的肽链,在细胞表面显示出病原体,以便于t-细胞的识别并执行一系列免疫功能。mhcclassi位于一般细胞表面上,可提供一般细胞内的一些状况,比如该细胞遭受病毒感染,则相关病毒外膜碎片的短肽链透过mhc提示在细胞外侧,可以供cd8+t细胞等辨识,以进行扑杀。mhcclassⅱ只位于抗原提呈细胞(apc)上,如巨噬细胞、cd4+t辅助细胞等。这类提供则是细胞外部的情况,像是组织中有细菌侵入,则巨噬细胞进行吞食后,把细菌碎片利用mhc提示给辅助t细胞,启动免疫反应。mhcclassⅲ主要编码补体成分,肿瘤坏死因子(tnf)等。人类的mhc通常被称为hla(humanleucocyteantigen),即人类体液细胞抗原。mhc基因,定位于人类第六号染色体短臂,呈高度多态性。
“cd8+t细胞”通常指在细胞表面表达cd8的t细胞。而cd8(clusterofdifferentiation8)是一种跨膜糖蛋白,用作tcr的co-receptor。类似于tcr,cd8与mhcclassi分子结合,以供cd8+t细胞等辨识扑杀。
“cd4+t辅助细胞”通常指在细胞表面表达cd4的t辅助细胞,属于一种体液细胞。而cd4(clusterofdifferentiation4)是一种糖蛋白,用作tcr的co-receptor并辅助tcr识别apc。cd4与mhcclassii分子结合,以供cd8+t细胞等辨识扑杀。
“ic50”是指被测量的拮抗剂或抑制剂的最大半抑制浓度。它能指示某一药物或者物质(抑制剂)在抑制某些生物程序(或包含在此程序中的某些物质,比如酶,细胞受体或是微生物)的半量。
“免疫佐剂”,又称非特异性免疫增生剂。本身不具抗原性,但同抗原一起或预先注射到机体内能增强免疫原性或改变免疫反应类型。
术语“dna、rna、肽链”指dna、rna、和/或肽链。
“car-t”,全称是嵌合抗原受体t细胞免疫疗法,是目前较为有效的恶性肿瘤免疫治疗方法之一。嵌合抗原受体(car)是car-t的核心部件,赋予t细胞hla非依赖的方式识别肿瘤抗原的能力,这使得经过car改造的t细胞相较于天然t细胞表面受体tcr能够识别更广泛的目标。在急性白血病和非霍奇金淋巴瘤的治疗上有较好的疗效。
“tcr-t”,全称是t细胞受体(tcr)嵌合型t细胞(tcr-t),是通过部分基因改造的方法来提高这些tcr对相应的肿瘤新生抗原的“亲和力”来消灭肿瘤细胞。基因改造的tcr技术也被称为亲和力增强的tcr技术。与上述car-t作为当前过继性细胞回输治疗act技术两大最新的免疫细胞技术,因其能够表达特异性受体靶向识别特异性的细胞如肿瘤细胞,受到广泛的关注和研究。
“dc-ctl”,dc细胞受自体或同一种类肿瘤细胞裂解物的冲击,能特异递呈某一类肿瘤抗原,从而诱导具有针对某一特定肿瘤细胞的细胞毒性淋巴细胞(ctl),提高了抗肿瘤效应。国内外大量的临床资料显示dc-ctl免疫治疗综合了dc和ctl的所有优点,对众多的肿瘤均有明显疗效,且对控制肿瘤的复发与转移,提高患者机体的免疫力,提高生存质量均有积极作用。dc-ctl已成为当前生物治疗的主要治疗方法之一,也是未来根治肿瘤中最具发展前景的肿瘤治疗手段之一。
ctc富集及ctcdna和rna的提取
ctc的类型、数量及变化在肿瘤早筛、肿瘤用药、疗效评估和复发监测等方面有着重要的临床指导意义。但在早期肿瘤病人10ml血液里面大概仅含1-10个左右的ctc,所以在血液样本中收集罕见的ctc比较困难。目前ctc富集原理主要包括基于细胞尺寸的捕获(过滤)和基于肿瘤表面标志物的阳性捕获(免疫学)两种方法。过滤方法由于不依赖于特定的标志物而且能高效富集或分离所有类型的ctc,应用更广泛。在现有使用过滤方法富集ctc的产品中,celseeprep100和prep400系统是无需预先去除红细胞、高度自动化、高效率富集,并将细胞富集系统与细胞鉴定和分析系统整合到一起的ctc产品(www.celsee.com)。细胞无需离心、细胞裂解、不添加任何标签;样本需求量少;分选速度快;使用微流控芯片分选技术,分选效率高达80%以上;自动化多通道设置,一次可同时处理4个样本。可对ctc进行原位免疫组化,dna-fish,rna-fish,细胞培养,pcr和ngs分析等。另外,ctc富集过程中,其细胞悬液不可避免地含有其他背景体液细胞如白细胞和淋巴细胞等(gogoipetal.methodsmolbiol2017;1634:55-64),我们在此首次巧妙地提出以该细胞悬液中其他背景体液细胞如白细胞和淋巴细胞dna和rna样本作为对照,对ctc的dna和rna进行ngs包括ulp-wgs,wes及rna-seq等分析,从而发现肿瘤特异体细胞突变。
在一优选例中,对于总数仅10个细胞的细胞样本(其中,ctc为1-4个,即ctc占比10-40%),本发明方法仍可高灵敏地检测出肿瘤特异体细胞突变。
ctdna和ctrna的提取及富集
ctdna大小约166bp,相当于围绕核糖体及其连接体的长度。这些dna片段来源于四个部分:1、坏死的肿瘤细胞;2、凋亡的肿瘤细胞;3、循环肿瘤细胞;4、肿瘤细胞分泌的外排体。自1977年人类发现ctdna以来,一直对其研究。1994年,研究人员首次鉴定了来源于肿瘤的含有癌症标志性突变的dna。加上ctdna的无创性和易获得性,在其中发现的肿瘤标志物,被认为可以用于检测肿瘤早期诊断、进展过程、预后判断及个性化用药指导。虽说早在1987年wieczorek等发现患癌对象血浆中存在ctrna,直到1999年,特异基因mrna才不断在不同患癌对象血浆中得到证实(gonzález-masiájaetal.oncotargets&therapy2013;6:819-832)。但由于ctdna和ctrna在人体血液内含量极低,只有循环dna的1%,甚至万分之一,其检测存在较大的挑战。本发明人从患癌对象体液样本分离去除细胞,并从去除细胞的样本中通过分子筛、甲基化分离、过滤离心等方法提取cfdna和cfrna,从中富集ctdna和ctrna片段达10-100%,有利于下游的wgs,wes和rna-seq。另外,ctdna和ctrna富集过程中,其核酸悬液不可避免地含有来自于体液内其他正常细胞的cfdna和cfrna,本发明在此首次巧妙地提出以该核酸悬液中来自于体液内其他正常细胞的cfdna和cfrna样本作为对照,对ctdna和ctrna进行ngs包括ulp-wgs,wes及rna-seq等分析,从而发现肿瘤特异体细胞突变。
肿瘤新生抗原分离和证实
本发明的主要目的是在患癌对象体液中分离富集ctc及其dna和rna或ctdna和ctrna,利用ngs包括ulp-wgs、wes及rna-seq,分离和证实能引起蛋白序列变化并能与人体hla类型i或ii受体及tcr紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的dna,rna或短肽链,即肿瘤新生抗原。尤其重要的是,这些变异的新生抗原只存在于病人的肿瘤细胞,而不存在于病人的正常组织和细胞,有助于癌症的早期诊断。有意义的突变包括:(1)非同义突变导致氨基酸序列变化;(2)通读突变导致终止密码子发生变化或消失,而在蛋白序列c端形成较长的肿瘤特异蛋白序列;(3)剪切位点突变导致在mrna序列内出现包含內显子的肿瘤特异蛋白序列;(4)染色体重组导致形成一个嵌合蛋白,结合位点含肿瘤特异蛋白序列(基因融合);(5)mrna移码突变或缺失,产生一个含肿瘤特异蛋白序列的新的蛋白开放阅读框(orf)。
wes是对定向富集的基因组dna进行高通量测序,它能够以相对低廉的成本对人类外显子组进行测序。2009年,外显子组捕获工具的出现,让wes技术迅速火热,目前市场上的技术平台相对成熟。经过wes分离出能引起蛋白序列变化的含肿瘤特异体细胞突变的dna,rna或短肽链后,这些突变还得需要rna-seq来证实这些突变蛋白或变异体编码dna、rna的表达。前述体液样品提取ctrna后,去除rrna,保留带polya和不带polya的转录本,用六碱基随机引物(randomhexamers)合成cdna第一链,并加入缓冲液、dntps、rnaseh和dnapolymerasei合成cdna第二链,经过pcr试剂盒纯化并加eb缓冲液洗脱经末端修复,加测序接头,并进行pcr扩增,从而完成整个文库制备工作,构建好的文库进行ngs。
除了采用传统的wes和rna-seq技术来筛查肿瘤新抗原,还可利用现代的新型生物信息学建立mhc(hla类型i或ii受体)结合文库,从中筛查能与mhc结合的多肽链或rna变异体,缩小wes尤其是rna-seq范围,加快ngs实验进程。
肿瘤新生抗原与hla类型i或ii受体及tcr结合
领域里已有各种离体预测hla结合实验方法,如iedb综合性预测方法,可用来预测分离和证实的潜在肿瘤新生抗原与hla亲和力,即ic50≤100nm或至少≤150nm。基于正常人体对前述完全新颖的蛋白序列不存在耐受性及其肿瘤特异性,只要它们与hla类型i或ii受体预测亲和力≤500nm,可被作为最优先考虑的短肽链以制作个性化疫苗。如果非同义突变短肽链与hla类型i或ii受体预测亲和力≤150nm,同时与之相对应的天然肽链与hla类型i或ii受体预测亲和力≥1000nm,该短肽链可被作为次优先考虑来制作个性化疫苗。如果非同义突变短肽链和与之相对应的天然肽链与hla类型i或ii受体预测亲和力分别≤150nm,该短肽链可被作为第三优先考虑来制作个性化疫苗。
但仅与hla结合不是一个优化的免疫原性预测,而增加tcr结合度可以提高预测精度。而本发明提出从患癌对象体液中提取t-细胞,将筛选出的短肽链或变异体编码rna进行离体tcr结合试验和cd8+t细胞或cd4+t辅助细胞活化试验,这样能将tcr绑定到传统的工作流中,以便更好地预测绑定到tcr的新表位的准确性。
与hla类型i或ii受体及tcr结合的肿瘤新生抗原cd8+t细胞或cd4+t辅助细胞活化试验
从患癌对象分离的cd8+t细胞和cd4+t辅助细胞能通过与hla类型i或ii受体及tcr结合的病人肿瘤新生抗原多肽链共同离体培养被活化,从而分泌针对这些肿瘤新生抗原多肽链的ifn-γ(ifn-γelispotassay)。
制作患癌对象个性化癌症疫苗
采用标准固相法合成化学结合反相高效液相色谱(rp-hplc),通过gmp制作能引起蛋白序列变化,并能与人体hla类型i或ii受体及tcr紧密结合,还能活化抗肿瘤cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的dna,rna或短肽链个性化癌症疫苗。
加快个性化癌症疫苗治疗进程
目前,个性化癌症疫苗研发及制作得从病人癌变组织切除开始,耗时约需6-8周,且费用昂贵,这尤其对于转移性癌症患者而言,过程漫长。本发明人国际上首次通过收集体液分离富集ctc及其dna和rna或循环肿瘤dna(ctdna)和循环肿瘤rna(ctrna),利用ngs包括ulp-wgs、wes及rna-seq,分别以患癌对象其他正常体液细胞dna和rna样本作为ctc及其dna和rna的对照样本,或患癌对象体液内来自于其他正常细胞的游离dna(cfdna)和游离rna(cfrna)样本作为ctdna和ctrna的对照样本,在提取和富集的ctcdna及rna和/或ctdna及ctrna片段中,分离和证实10-30种能引起蛋白序列变化并能与人体hla类型i或ii受体及t-细胞受体(tcr)紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的dna,rna或短肽链,即肿瘤新生抗原;在4-6周内,制成个性化癌症疫苗,为开发快速、高效个性化实体肿瘤,尤其是转移性癌症免疫治疗方案提供可行性参考,以部分满足患癌对象巨大的临床治疗需求。
佐剂的使用
免疫佐剂本身不具抗原性,但同抗原一起或预先注射到机体内能增强免疫原性或改变免疫反应类型。例如,在以往的研究中,poly-iclc显示出了与黄热病疫苗相似的佐剂功能,因此,其也是目前认为最好的toll样受体3激动剂。
用于免疫治疗的细胞产品
本发明还提供了用于个性化免疫治疗的细胞产品,代表性的所述细胞产品包括(但并不限于):car-t细胞、tcr-t细胞、经致敏的dc细胞和dc-ctl细胞。
在一实例中,本发明方法包括:快速筛选2-5种与所述的二级选定的序列元素(即肿瘤新生抗原)具特异性和高亲和力的单链抗体(scfv);然后收集所述对象(即患癌对象)外周血中的t细胞,通过体外重组dna技术,使其表达含有所述scfv作为胞外抗原结合域的car,从而制得针对所述肿瘤新生抗原的个性化的car-t细胞。
本发明的一种或多种(如2-5种)个性化的car-t细胞可以回输给所述对象,从而激发患癌对象产生针对实体癌症和/或血液癌症的免疫反应。
在一实例中,本发明方法包括:快速筛选2-5种与所述的二级选定的序列元素(即肿瘤新生抗原)具特异性和高亲和力的tcr;然后制备含相应tcr的t细胞,针对所述肿瘤新生抗原的个性化的tcr-t细胞。
本发明的一种或多种(如2-5种)个性化的tcr-t细胞可以回输给所述对象,从而激发患癌对象产生针对实体癌症和/或血液癌症的免疫反应。
在一实例中,本发明方法包括:用多种(如2-5或5-10或10-20种)所述二级选定的序列元素,对dc细胞进行致敏处理,从而获得经致敏的dc细胞。进一步地制备相应的dc-ctl细胞。
本发明的经致敏的(primed)树突状细胞和/或dc-ctl细胞可以回输给所述对象,从而激发患癌对象产生针对实体癌症和/或血液癌症的免疫反应。
个性化癌症疫苗与其他药物和疗法的联合用药
《自然》在线发表的两组黑色素瘤病人中都有在个性化癌症疫苗免疫治疗后复发的情况,比如cwu团队中有两名四期患者(肺部转移)在接受免疫治疗后仍旧产生癌症复发。但是这些病人在接受了pd-1抗体联合治疗后,病情得到控制。这在很大程度上应该与个性化癌症疫苗治疗后患者免疫库的变化有关。美德两队的研究人员都发现,在经过特异性疫苗治疗后,病人大多都产生了对肿瘤新生抗原具有特异结合能力的t细胞,而这些t细胞在没有免疫之前在血液中检测不到,即个性化癌症疫苗从病人免疫库中找到了那些沉眠中的t细胞,或经过特异性抗原诱导产生原来不存在的t细胞,并把它们招募加入免疫系统,从而产生了抗癌效果(ottpanat2017;547:217-221,epub2017jul5;sahinuetal.nat2017;547:222-226,epub2017jul5)。更重要的是,这些新加入的t细胞大多为pd-1阳性,可用pd-1抗体和其他抗免疫抑制药物包括抗ctla-4抗体,抗pd-l1抗体,抗cd25抗体,抗cd47抗体或ido抑制剂等联合治疗。因此,针对肿瘤新生抗原的个性化癌症疫苗可以通过“免疫招募”,“免疫诱导”等手段扩增病人已有的免疫库,给癌症免疫治疗带来了新的希望。同时,个性化癌症疫苗还可与其他药物和疗法联合用药,包括疫苗+化疗、疫苗+放疗、疫苗+其他靶向药物等。
本发明所有部分引用了各种参考文献。这些参考文献及其引用的参考文献通过引用纳入本发明,予以披露,以便更全面地描述涉及本发明领域内的工作现状。
应理解的是,上述涉及本发明的优选实施例和许多变动的披露,不脱离本发明适用范围。本发明进一步用下面的实施例说明,不能以任何方式解释为限制本发明适用范围。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
如无特别说明,实施例中所用的材料或试剂均为市售产品。
实施例1.建立小鼠早期肺腺癌模型并用个性化癌症疫苗治疗
已有报道,应用甲基硝基亚硝基胍(1-methyl-3-nitro-1-nitroso-guanidine,mnng,一种强诱癌试剂)皮下注射小鼠可诱导肺癌的发生,以建立早期肺癌动物模型(xiaosmetal.2015;actalabanimscisin23:227-32)。我们根据此方法建立小鼠早期肺腺癌模型,并用个性化癌症疫苗治疗。
采用浓度为2.0mg/ml的亚硝基胍溶液0.2ml每周皮下注射至20只km母鼠(25-30g),连续注射四周(图1)。注射后4周左右,从鼠尾取全血200ul,分离富集ctc(图2a)及其dna和rna或ctdna和ctrna。图3显示了ctc单细胞外显子组测序和转录组测序(g&t-seq)核酸扩增示意图。从患癌小鼠血浆ctc富集样本先分离mrna,经反转录成cdna(图3,a,b),同时提取剩余的基因组dna并扩增(图3,c),以供外显子组测序和转录组测序使用。图4显示了对应于图3ab的cdna文库的一个ctc突变的测序结果。
以病鼠外周血单个核细胞dna样本作为对照,在提取和富集的ctcdna和rna片段中,进行wes和rna-seq,分离和证实能引起蛋白序列变化并含肿瘤特异体细胞突变的短肽链。由于小鼠mhc分子编码基因与人类相似,利用生物信息学软件,筛选出8-12种能引起蛋白序列变化并能与mhci或ii类分子及鼠tcr紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的短肽链,即肿瘤新生抗原。
对于小鼠肿瘤新生抗原进行了分析,方法如下:应用小鼠h-2分型软件对小鼠h-2分子分型,应用sentieontnscope等软件,以患癌小鼠外周血单个核细胞dna外显子组测序序列作为对照,从患癌小鼠ctcdna外显子组测序序列中分离肿瘤新生抗原,并应用相关分析软件预测短肽链肿瘤新生抗原及其相对应的野生型短肽链与该小鼠mhc分子的亲和力。病鼠个性化癌症疫苗筛出的一个优选的肿瘤新生抗原肽(kairnvlii),该短肽链肿瘤新生抗原与mhci类分子的亲和力(9.19nm)比其相对应的野生型短肽链(5105.43nm)要高出约556倍;同时,iedb预测与小鼠tcr亲和力(mhci免疫原性)得分较高(0.20254)。
将该上述优选的肿瘤新生抗原肽制成个性化癌症疫苗,与佐剂混合,注射至患癌小鼠皮下,观察疗效(图5)。注射了个性化癌症疫苗的患癌小鼠,仍然存活,而没有注射疫苗的患癌小鼠,则陆续死亡。
实施例2.在患癌对象血浆中分离富集ctc及其dna和ctdna,利用wes和rna-seq,分离和证实肿瘤新生抗原
在3个患癌对象(肺癌、结直肠癌和膀胱癌)外周血中分别采集两管,一管10ml,另一管5ml全血,置于edta采血管中,上下混匀数次。10ml管利用celsee系统进行ctc富集和计数(图2b)。
ctc富集过程中,其细胞悬液不可避免地含有其他血液细胞如白细胞和淋巴细胞等。我们在此首次利用该细胞悬液中其他血液细胞如白细胞和淋巴细胞dna和rna样本作为对照,对ctc的dna和rna进行ngs包括ulp-wgs,wes及rna-seq等分析,从而发现肿瘤特异体细胞突变。分选的最终细胞数经过ngs验证,对于总数仅10个细胞的细胞样本,ctc细胞丰度(cellularity)占比30-40%,染色体倍数(ploidy)为混合多倍体;背景颜色表示分析对数后验概率(logposteriorprobability,lpp)的可能性(蓝色=最有可能,白色=最不可能)(图2c)。。
而另一管5ml全血,在1900xg(3000rpm)和4℃条件下,离心血液样本10分钟。仔细吸取上清液,不干扰下层吸浆。从5ml全血样品,可获取约3ml血浆。上清液分别转移至2个1.5mlep管中,在16000xg和4℃条件下,离心10分钟。小心吸取上清液,不干扰高速离心形成的少量沉淀物,存放于-80℃冰箱。第2天后,取3ml血浆样品用qiaamp游离核酸提取试剂盒(qiagen55114)提取cfdna,加入离心、过滤步骤,富集ctdna。同时,利用rubicon的thruplexplasma-seq试剂盒,在ngs分析之前扩增含量较少的ctdna(图6)。
另外,ctdna富集过程中,其核酸悬液不可避免地含有来自于体液内其他正常细胞的cfdna,我们在此首次利用该核酸悬液中来自于体液内其他正常细胞的cfdna样本作为对照,对ctdna进行ngs包括ulp-wgs,wes及rna-seq等分析,从而发现肿瘤特异体细胞突变。
上述样本直接进行核酸提取、扩增,然后进行二代测序包括外显子组测序,利用sentieon的相关软件流程包括tnscope等进行分析,基于比较肿瘤外显子组和转录组数据与正常细胞对照数据,同时检测多种突变产生的变异多肽,结合先进的新生抗原预测算法和软件,快速高效筛选出高质量的肿瘤新生抗原短肽序列(图7)。
两个癌症病人(结肠癌和皮肤癌)外显子组测序结果显示癌症驱动基因muc16基因突变有5个相同的位点(图8)。
从癌症病人血浆ctc筛选80-100种肿瘤新生抗原候选成份,组成串联短基因(tmg)库,进行体外转录(ivt),rna分子转染至从病人血浆分离分化的dc细胞;然后抽取病人外周血,分离cd8+t细胞、cd4+t辅助细胞,分别进行exvivoelispot实验,筛选出能活化cd8+t细胞或cd4+t辅助细胞的肿瘤新生抗原,制作个性化癌症疫苗(图9)。
利用常规基于亲和力的方法筛选肿瘤新生抗原,其命中率(hitrate)只有3%,而采用本发明的基于hla全方位(hla-agnostic)方法筛选肿瘤新生抗原,其命中率(hitrate)可提高到35%。
实施例3.卵巢癌病人无创血浆和有创胸腹水分离制备ctc肿瘤新生抗原疫苗
本实施例的主要内容是开展以下临床前动物实验(实验流程见图10):
1.分离富集ctc。从晚期伴腹水卵巢癌病人无创血浆(10ml)和有创腹水进行ctc分离和富集。
2.腹水ctc体外培养,建立卵巢癌病人腹水ctc裸鼠pdx模型。
3.血浆和腹水ctcrna和dna提取和二代测序。利用二代测序技术(ngs)包括全外显子测序(wes)和rnaseq,从血浆和腹水ctc中分离和证实10-30种能引起蛋白序列变化并能与病人mhc分子及tcr紧密结合,还能活化cd8+t细胞或cd4+t辅助细胞的含肿瘤特异体细胞突变的短肽链,即肿瘤新生抗原。
4.invivo证实肿瘤新生抗原疫苗的有效性。腹水和血浆ctc经过二代测序和后续的生信学分析而筛选出的肿瘤新生抗原多肽或mrna疫苗,与从该病人血浆中分离的dc离体结合(priming),并经exvivoelispot验证实验,筛选合适数量肿瘤新生抗原疫苗成分,与从该病人血浆中分离的pbmc结合,一起注射至pdx裸鼠的尾部静脉。
5.每日观察部份人源化pdx小鼠状况,每两天测量pdx小鼠皮下肿瘤的大小。以此评估个性化癌症疫苗的安全性和有效性及进一步探索药效学特征。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!