一种脱细胞神经基质及其制备方法与流程
本发明涉及组织工程材料技术领域,具体涉及一种脱细胞神经基质及其制备方法。
背景技术:
神经系统是机体内对生理功能活动的调节起到主导作用的系统,主要由神经组织组成,分为中枢神经系统和周围神经系统两大部分,中枢神经系统又包括脑和脊髓,周围神经系统包括脑神经和脊神经。周围神经系统的主要功能是允许针对外部或内部刺激进行运动,感觉和行为改变。当周围神经断裂后,虽然近端神经有较好的再生能力,但由于原有通路的破坏,再生的神经纤维往往支配错误的靶器官,当运动神经纤维错误的支配肌肉会导致运动功能失调,再生的错误感觉神经纤维会导致异位感,自主神经的错接会导致植物神经功能紊乱。一般而言,在相对较短距离(小于5毫米)的外周神经损伤,轴突可以自发再生,但仍然很难达到功能完全恢复,在大于3cm的缺损中,神经修复过程中会发生神经错配。周围神经损伤是使人功能受损的常见创伤方式,影响约2.8%的创伤患者。目前,由于各种原因导致的周围神经损伤患者数量逐年增加,在中国,每年约有50余万人因创伤导致周围神经损伤,周围神经损伤常引起支配区域的感觉和运动功能障碍,而长时间的感觉或运动的缺失将引起肌肉萎缩、关节挛缩畸形等,影响患者生活质量,治疗费用较昂贵,但疗效不佳,给患者和社会带来了巨大的经济负担。周围神经缺损的修复治疗是临床工作中的一大难题,特别是>3cm的较长神经缺损。多年来临床医务工作者和科研人员对周围神经缺损的修复治疗进行了大量临床和实验研究,为周围神经损伤的修复提供了理论和实践基础。
脱细胞技术是脱除免疫原性的组织细胞保留细胞外基质的方法,相对于自体神经修复具有缺点,如可供神经移植的自体神经来源极其有限,会对患者造成二次损伤,供体部位发病率增加、供体部位发病率增加,疼痛,瘢痕形成,神经瘤形成和供体区域的感觉丧失等,利用脱细胞技术制备的异种脱细胞神经基质具有以下优点:(1)来源广泛,价格低廉。(2)保留了天然神经内存在的三维网络结构,细胞迁移和神经纤维伸长细胞外基质成分来引导,为轴突再生提供物理指导。(3)保留细胞外基质组分(胶原蛋白、纤连蛋白、层粘连蛋白)等保留完整,纤连蛋白可以促进轴突生长和存活,也可做为细胞表面受体的配体,从而启动影响细胞行为和生存的信号,如细胞黏附、增殖、迁移、分化等。层粘连蛋白促进施万细胞生长,在周围神经修复中发挥作用。(4)经脱细胞处理后的异种神经基质除去了硫酸神经素蛋白多糖(cspg),研究表明,cspg可以抑制轴突生长,因此从神经移植材料中去除cspg可以促进神经修复,因此,脱细胞技术已成为神经组织修复中非常重要的研究方向和研究内容。
目前国内外常用到的脱细胞方法主要有机械法、酶消化法、化学去垢剂法等,然而在单独使用或者联合使用这些方法脱细胞的过程中容易出现细胞抗原性去除不彻底,细胞外基质的三维结构遭到破坏的问题,使得细胞营养供应以及代谢废物排出困难,影响神经修复效果,甚至导致神经修复失败。现有技术中,为了彻底地脱除神经细胞,主要采用先将神经粉粹或者研磨成微粒的方法,这就造成在后续处理中需要多次离心以及多次清洗,不仅加重了对细胞外基质的三维结构的破坏,导致脱细胞神经基质材料力学性能变差、机械强度降低。
例如,中国专利文献cn102218160a公开了一种神经组织基质源性组织工程支架材料的制备及其应用。以神经组织为原料,通过药物膨胀、机械粉碎、酶解处理、透析收集等手段提取出利于神经再生的基质成分(包括纳米级胶原微丝、纤粘蛋白微丝和层粘蛋白微丝),去除了不利于神经再生的免疫原性成分(包括雪旺细胞、磷脂和轴突)。所制备出的神经组织基质源性材料单独或配以其他高分子材料可进一步通过定向结晶、冷冻干燥和交联制备成三维多孔取向支架,或者利用电纺丝技术制备纳米级别薄膜,再缠绕形成神经再生导管。本发明方法制备的组织工程用支架或导管有利于种子细胞粘附、增殖、迁移,促进神经再生,可用于神经缺损修复。上述脱细胞神经基质的制备方法中,虽然通过物理和化学交联能够在很大程度上提高脱细胞神经基质的力学强度,使其更加稳定,然而,因外加交联剂本身具有毒性及其残留的问题,植入体内一段时间后易出现免疫反应。
技术实现要素:
因此,本发明要解决的技术问题在于克服现有技术中的脱细胞神经基质机械性能差,免疫原性和毒性高,质量不稳定的缺陷,从而提供一种脱细胞神经基质及其制备方法。
本发明提供了一种脱细胞神经基质的制备方法,将神经组织依次通过低渗处理、胰蛋白酶处理、去污剂处理和核酸酶处理,制得神经基质。
在低渗处理中,将神经组织加入低渗溶液中孵育,孵育温度为2-6℃,孵育时间为15-30h;
优选地,所述低渗溶液为超纯水。
在胰蛋白酶处理中,将神经组织加入胰蛋白酶溶液中,在37℃下水浴加热0.5-3h;
优选地,所述胰蛋白酶溶液为含0.1-0.5%(m/v)胰蛋白酶和0.01-0.05%(m/v)edta的pbs溶液。
在去污剂处理中,将神经组织加入去污剂溶液中,在温度为15-25℃下振荡处理15-30h;
优选地,所述去污剂溶液为含0.05-0.3%sds和0.05-0.3%(m/v)edta的的pbs溶液为去污剂溶液或含0.2-0.3%triton-x100(v/v)和0.05-0.3%(m/v)edta的的pbs溶液为去污剂溶液。
所述去污剂处理为使用两种去污剂溶液分两次处理,第一次处理中,采用含0.05-0.3%sds和0.05-0.3%(m/v)edta的pbs溶液为去污剂溶液,第二次处理中,采用含0.2-3%triton-x100(v/v)和0.05-0.3%(m/v)edta的pbs溶液为去污剂溶液;
优选地,在所述去污剂处理之后还包括α-1,3-半乳糖苷酶溶液处理,在α-1,3-半乳糖苷酶溶液处理中,将神经组织加入含10-40μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在25-37℃浸泡1-6小时。
在核酸酶处理中,将神经组织加入缓冲细胞液中,然后加入30-60u/ml的dna酶和0.5-4u/ml的rna酶,在35-40℃下水浴加热1-6h。
所述缓冲细胞液为含5-30mm氯化镁的tris-hcl溶液,所述tris-hcl溶液的浓度为30-60mm,ph为7-8。
在核酸酶处理之后还包括灭菌处理;
优选地,在灭菌处理中,将神经组织加入消毒液中浸泡1-6h,所述消毒液为含有0.05-0.4vt%乙酸和0.05-0.4wt%次氯酸钠的pbs溶液,或
含有0.05-0.4vt%乙酸和0.05-0.4vt%84消毒液的pbs溶液。
神经组织在低渗处理之前还包括前清洗处理;在低渗处理、胰蛋白酶处理、去污剂处理和核酸酶处理之后还包括中间清洗处理;在核酸酶处理之后还包括后清洗处理;
优选地,在前清洗处理中,将神经组织加入生理盐水中浸泡,然后加入超纯水中超声清洗,再用超纯水持续冲洗;
优选地,在中间清洗处理中,将神经组织加入超纯水中超声清洗,再用超纯水持续冲洗;
优选地,在后清洗处理中,将神经组织加入无菌pbs中浸泡。
本发明提供了一种所述的制备方法制得的脱细胞神经基质。
本发明技术方案,具有如下优点:
1.本发明提供的脱细胞神经基质的制备方法,清洗后的神经组织依次经过低渗处理,胰蛋白酶处理和去污剂处理,最后经过核酸酶处理,制得脱细胞神经基质。其中,通过低渗溶液的渗透作用使水分不断透过细胞膜,使细胞膜膨胀破裂,促进胰蛋白酶处理和去污剂处理中的脱细胞溶液透过细胞膜进入细胞,从而能够提高胰蛋白酶处理和去污剂处理的脱细胞效果,具体地,神经组织经过胰蛋白酶消化细胞膜表面和细胞内的免疫蛋白,有效降低免疫原性,保留胶原和糖胺多糖,然后经过去污剂去除神经组织中的细胞成分,破坏细胞膜磷脂和脂膜,彻底清除抗原和免疫复合物,最后通过核酸酶处理可以去除细胞核中的dna和rna;本发明不仅利用在先的低渗溶液处理来增强胰蛋白酶处理和去污剂处理的脱细胞效果,而且通过胰蛋白酶处理和去污剂的联合处理也能够提高脱细胞效果,降低去污剂的用量,有效改善因去污剂残留或者去污剂处理过度而导致的脱细胞神经基质的细胞毒性或者免疫原性增强,同时也能够改善胰蛋白酶处理过度而造成对胶原蛋白和弹性蛋白的过度消化导致脱细胞神经基质基质的三维结构紊乱和机械强度降低的情况发生。因而,本发明制备的脱细胞神经基质能够最大限度地保留神经细胞基质本身的三维结构,具有良好的机械性能,而且不需要外加交联剂进行物理或者化学交联,免疫原性低、毒性低,而且制备方法简单,稳定可靠,成本较低,适宜产业化生产。
2.本发明提供的脱细胞神经基质的制备方法,将神经组织置于低渗溶液中孵育,孵育温度为2-6℃,孵育时间为15-30h,使低渗溶液中的水分在温和条件下缓慢进入神经细胞,避免低渗溶液破坏神经细胞外基质的结构的完整性,提高机械性能的稳定性,减小批次间机械性能的差异,进一步的,采用超纯水为低渗溶液,能够进一步改善低渗溶液处理过程对脱细胞神经基质结构的完整性的影响,提高脱细胞神经基质机械性能,降低毒性。
3.本发明提供的脱细胞神经基质的制备方法,将神经组织加入胰蛋白酶溶液中,在37℃下水浴加热0.5-3h,能够进一步提高神经细胞基质的结构的完整性,提高脱细胞神经基质机械性能和稳定性,减小批次间机械性能的差异。而且本发明采用将神经组织加入去污剂溶液中,在温度为15-25℃下振荡处理15-30h,分别以含0.05-0.3%sds和0.05-0.3%(m/v)edta的的pbs溶液为去污剂溶液或含0.2-3%triton-x100(v/v)和0.05-0.3%(m/v)edta的的pbs溶液为去污剂溶液,既保证了良好的去污和脱细胞效果,又能够保留完整的神经基质结构。
4.本发明提供的脱细胞神经基质的制备方法,通过先将神经组织加入缓冲细胞液中,然后加入30-60u/ml的dna酶和0.5-4u/ml的rna酶,高浓度的核酸酶在缓冲溶液中逐渐分散,彻底消化掉神经组织中的核酸,有效降低脱细胞神经基质的免疫原性,减少批次之间毒性的差异,提高产品质量的稳定性,且采用水浴加热的方式,使核酸酶在温和条件下进入神经组织,消化dna和rna,减少对脱细胞神经基质的破坏,提高脱细胞神经基质机械性能和稳定性。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
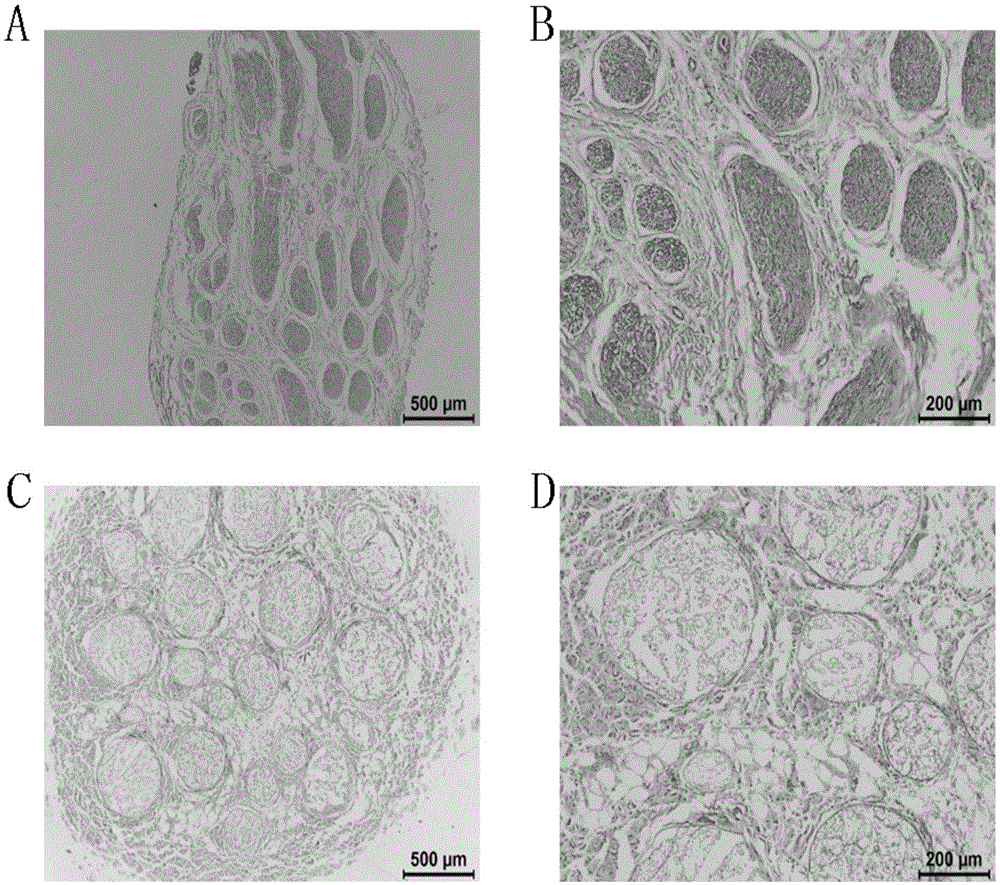
图1是实验例4中显微镜下的脱细胞神经基质和未经脱细胞处理的神经组织的he染色图,其中a为神经组织(500μm),b为神经组织(200μm),c为脱细胞神经基质(500μm),d为为脱细胞神经基质(200μm);a与b中有大量蓝染,c与d中无蓝染;
图2是实验例5中显微镜下的脱细胞神经基质和未经脱细胞处理的神经组织的dapi染色图,其中a为神经组织,b为脱细胞神经基质;a中有较强蓝色荧光,b中无蓝色荧光;
图3是实验例6中显微镜下的脱细胞神经基质和未经脱细胞处理的神经组织的ɑ-gal免疫组织化学染色图,其中a为神经组织,b为脱细胞神经基质;a中有较强红色荧光,b中无红色荧光;
图4是实验例7中显微镜下的脱细胞神经基质和未经脱细胞处理的神经组织的天狼星红染色染图,其中a为神经组织,b为脱细胞神经基质;a中有较强红色和蓝色,其中红色为胶原纤维,蓝色为细胞核;b中只有红色。
具体实施方式
提供下述实施例是为了更好地理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
下述新鲜的神经组织均取自成年健康猪坐骨神经,将坐骨神经清洗后轻柔剥除外层的疏松结缔组织,制得神经组织。
实施例1
本实施例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入生理盐水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在4℃下孵育20h。
(3)胰蛋白酶处理:将低渗处理后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热1h。其中,胰蛋白酶溶液为含0.1%(m/v)胰蛋白酶和0.03%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)α-1,3-半乳糖苷酶溶液处理,将神经组织加入含25μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在37℃下浸泡3小时。
(6)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(7)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸和0.2vt%的84消毒液的pbs中,在室温下浸泡3h,进行灭菌处理。
(8)后清洗处理:加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(7)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
实施例2
本实施例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取100g新鲜的神经组织加入生理盐水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在5℃下孵育30h。
(3)胰蛋白酶处理:将低渗处理后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热0.5h。其中,胰蛋白酶溶液为含0.10%(m/v)胰蛋白酶和0.05%edta(m/v)的pbs溶液,胰蛋白酶溶液的体积为1l。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.2%(v/v)triton-x100和0.3%(m/v)edta的pbs溶液中,室温下振荡处理15h,然后再将神经组织放入1l含0.05%(m/v)sds和0.3%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)核酸酶处理:将神经组织放入1l的含有5mm氯化镁且ph为8的60mm的tris-hcl溶液中,加入60u/ml的dna酶和0.5u/ml的rna酶,在40℃下水浴加热1h。
(6)灭菌处理:将核酸酶处理后的神经组织加入含有0.4vt%乙酸和0.05vt%的84消毒液的pbs中,在室温下浸泡4h,进行灭菌处理。
(7)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(6)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
实施例3
本实施例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取50g新鲜的神经组织加入生理盐水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在2℃下孵育20h。
(3)胰蛋白酶处理:将低渗处理后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热0.5h。其中,胰蛋白酶溶液为含0.5%(m/v)胰蛋白酶和0.01%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含1%(v/v)triton-x100和0.05%(m/v)edta的pbs溶液中,室温下振荡处理30h,然后再将神经组织放入1l含0.3%(m/v)sds和0.05%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)核酸酶处理:将神经组织放入含有30mm氯化镁且ph为7.0的5mm的tris-hcl溶液中,加入30u/ml的dna酶和4u/ml的rna酶,在35℃下水浴加热6h。其中,tris-hcl溶液的体积为1l。
(6)灭菌处理:将核酸酶处理后的神经组织加入含有0.05vt%乙酸和0.4vt%的84消毒液的pbs中,在室温下浸泡2h,进行灭菌处理。
(7)后清洗处理:然后加入无菌pbs中浸泡,浸泡时间为36h,每6h换液一次,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(8)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
实施例4
本实施例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入生理盐水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在4℃下、转速200rpm/min的条件下振荡20h。
(3)胰蛋白酶处理:将低渗处理后的神经组织放入胰蛋白酶溶液中,在37℃下、转速200rpm/min的条件下振荡1h。其中,胰蛋白酶溶液为含0.1%(m/v)胰蛋白酶和0.03%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)α-1,3-半乳糖苷酶溶液处理,将神经组织加入含25μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在37℃下浸泡3小时。
(6)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(7)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸和0.2vt%的84消毒液的pbs中,在室温下浸泡3h,进行灭菌处理。
(8)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(7)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
实施例5
本实施例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入超纯水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在4℃下孵育20h。
(3)胰蛋白酶处理:将低渗处理后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热1h。其中,胰蛋白酶溶液为含0.1%(m/v)胰蛋白酶和0.03%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(6)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸的pbs中,在室温下浸泡3h,进行灭菌处理。
(7)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(6)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
对比例1
本对比例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入超纯水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在4℃下孵育20h。
(3)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(4)α-1,3-半乳糖苷酶溶液处理,将神经组织加入含25μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在37℃下浸泡3小时。
(5)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(6)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸和0.2vt%的84消毒液的pbs中,在室温下浸泡3h,进行灭菌处理。
(7)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(6)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
对比例2
本对比例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入超纯水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)低渗处理:将神经组织加入到已灭菌的1l超纯水中,在4℃下孵育20h。
(3)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(4)α-1,3-半乳糖苷酶溶液处理,将神经组织加入含25μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在37℃下浸泡3小时。
(5)胰蛋白酶处理:将去污剂处理后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热1h。其中,胰蛋白酶溶液为含0.1%(m/v)胰蛋白酶和0.03%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(6)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(7)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸和0.2vt%的84消毒液的pbs中,在室温下浸泡3h,进行灭菌处理。
(8)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(7)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
对比例3
本对比例中脱细胞神经基质的制备方法,包括如下步骤:
(1)前清洗处理:取80g新鲜的神经组织加入超纯水中,浸泡,然后将神经组织取出加入超纯水中,经超声波清洗仪超声清洗,再用超纯水持续冲洗。
(2)胰蛋白酶处理:将反复冻融后的神经组织放入胰蛋白酶溶液中,在37℃下水浴加热1h。其中,胰蛋白酶溶液为含0.1%(m/v)胰蛋白酶和0.03%(m/v)edta的pbs溶液,胰蛋白酶溶液的体积为1l。
(3)低渗处理:将胰蛋白酶处理后的神经组织加入到已灭菌的1l超纯水中,在4℃下孵育20h。
(4)去污剂处理:将胰蛋白酶处理后的神经组织放入1l含0.5%(v/v)triton-x100和0.1%(m/v)edta的pbs溶液中,室温下振荡处理24h,然后再将神经组织放入1l含0.05%(m/v)sds和0.2%(m/v)edta的pbs溶液中,室温下振荡处理24h。
(5)α-1,3-半乳糖苷酶溶液处理,将神经组织加入含25μg/mlα-1,3-半乳糖苷酶的pbs溶液中,在37℃下浸泡3小时。
(6)核酸酶处理:将神经组织放入含有10mm氯化镁且ph为7.5的50mm的tris-hcl溶液中,加入45u/ml的dna酶和2u/ml的rna酶,在37℃下水浴加热3h。其中,tris-hcl溶液的体积为1l。
(7)灭菌处理:将核酸酶处理后的神经组织加入含有0.2vt%乙酸和0.2vt%的84消毒液的pbs中,在室温下浸泡3h,进行灭菌处理。
(8)后清洗处理:然后加入无菌pbs中浸泡,封装,储存于-20℃的冰箱中保存待用。
其中步骤(2)-(7)中,每步结束后还包括中间清洗处理,中间清洗处理为使用超纯水将神经组织清洗,然后置于超声波清洗仪中。
采用该制备方法重复进行5轮次,制备得到5个不同批次的脱细胞神经基质。
实验例1
脱细胞神经基质的dna残留量能够反映其的脱细胞效果,通过降低dna残留量也能够降低脱细胞神经基质的免疫原性。
分别取实施例1-5和对比例1-3中制得的脱细胞神经基质以及未脱细胞的神经组织25mg,分别作为试验组、对照组和空白对照组,分别切成小块,按照《中国药典》2015版第三部3407外源性dna残留量测定法中的荧光染色法测定不同批次的脱细胞神经基质中dna残留量,结果见下表所示。
表1实施例1-5和对比例1-3中不同批次的脱细胞神经基质中dna残留量结果
实验例2
取实施例1-5和对比例1-3中制得的脱细胞神经基质以及未脱细胞的神经组织,分别作为试验组、对照组和空白对照组,采用mtt法分别测定各组神经组织或神经基质的细胞毒性,采用无血清dmem培养基作为浸提介质,按照gb/t1688.12-2008标准制备得12组脱细胞神经基质浸提液,按照gb/t14233.2标准,取1周龄新西兰大白兔股骨骨髓,采用密度离心法体外分离培养bmscs细胞培养,然后于96孔板中接种处于对数生长期的细胞,细胞接种浓度为7×104个/ml。设置空白组,剩余每孔加入100μl细胞悬液。在37℃,含5%co2的培养箱中培养过夜后,测试组分别加入100μl的浸提液,对照组加入100μl培养液,每组设8个平行孔。培养48h后,加入20μlmtt(5mg/mlpbs)溶液,放入培养箱中继续培养4h后,小心吸出上层清夜,加入150μl二甲亚砜,震荡10min至孔底紫色结晶完全溶解。用酶联免疫酶标仪测定每个孔吸光度od值,计算各组脱细胞神经基质处理后的bmscs细胞的相对增殖率。
表2实施例1-5和对比例1-3中不同批次的脱细胞神经基质细胞毒性结果
实验例3
将实施例1-5和对比例1-3制得的脱细胞神经基质以及未脱细胞的神经组织,分别作为试验组、对照组和空白对照组,分别制成板状,采用拉伸强度测定仪测定各组脱细胞神经基质的拉伸强度,记录下拉断时的最大拉力,最大拉力处于神经基质的截面积,即为拉伸强度,见表3所示。
表3实施例1-5和对比例1-3中不同批次的脱细胞神经基质的拉伸强度结
果
从表1-3中可知,与对比例1-3相比,实施例1-5中的脱细胞神经基质的拉伸强度、细胞相对增殖率明显增加,dna残留量、dna残留量的变异系数、细胞相对增殖率的变异系数和拉伸强度的变异系数均有显著降低,其中脱细胞神经基质的dna残留量为36.33-88.21ng/ml,细胞相对增殖率为53.09-92.26%,细胞毒性等级不大于2级,拉伸强度为6.34-10.49mpa,说明本发明的脱细胞神经基质细胞脱除效果可靠,免疫原性低、毒性低,神经细胞基质本身的三维结构保留完整性高;而且本发明的脱细胞神经基质的dna残留量的批间变异系数不大于6.40%,细胞相对增殖率的批间变异系数不大于6.48%,拉伸强度的批间变异系数不大于5.09%,较对比例1-3均有明显降低,说明本发明的脱细胞神经基质质量更加稳定可靠,均一性明显提高;而且,与实施例4和5相比,实施例1-3中制得的脱细胞神经基质的dna残留量、拉伸强度的变异系有显著降低,细胞相对增殖率和拉伸强度有明显提升,表明通过对低渗、胰蛋白酶处理条件,核酸酶浓度以及消毒液的优化,有利于进一步提高制得的脱细胞神经基质质量的稳定性。
实验例4he染色
将实施例1制得的脱细胞神经基质以及实施例1中未经脱细胞处理的天然神经组织分别进行苏木精-伊红染色(he染色),具体实验方法如下:取实施例1制得的脱细胞神经基质和未经脱细胞处理的神经组织,分别为实验组和对照组,各组均采用4%的多聚甲醛固定24h,梯度酒精脱水,二甲苯透明、浸蜡、包、切片,切片厚度为5μm,得到石蜡切片。然后将石蜡切片于二甲苯中脱蜡各10min,依次入无水乙醇,95%乙醇,85%乙醇各5min,自来水冲洗1-2min。然后用苏木素染液染3-5min,自来水冲洗1-2min。1%盐酸酒精分化数秒。1%氨水溶液返蓝数秒,然后水洗1-2min。入伊红染液染1-3min。然后无水乙醇脱水两次各1min,二甲苯透明数分钟。中性树胶封片,镜检,结果如图1所示。
结果显示,实施例1制得的脱细胞神经基质无细胞成分存在,细胞脱除干净,细胞外基质的结构与天然神经组织一致,说明制得的脱细胞神经基质的细胞外基质结构保持完整。
实验例5dapi染色
采用dapi染剂对实施例1制得的脱细胞神经基质以及实施例1中未经脱细胞处理的神经组织中的dna进行染色,具体实验方法如下:取实施例1制得的脱细胞神经基质和未经脱细胞处理的神经组织,分别为实验组和对照组,各组均采用4%的多聚甲醛固定24h,梯度酒精脱水,二甲苯透明、浸蜡、包、切片,切片厚度为5μm,得到石蜡切片。将石蜡切片于二甲苯中脱蜡,依次入无水乙醇,95%乙醇,85%乙醇各5min,自来水冲洗1-2min。加dapi工作液,室温避光孵育10min,pbs漂洗三次,每次5min。封片后荧光显微镜下观察,结果如图2所示。
结果显示,天然的神经组织中有较强的荧光,说明未经脱细胞处理的神经组织有细胞核成分,而脱细胞神经基质中无荧光,说明制得的脱细胞神经基质无细胞核成分。
实验例6抗原ɑ-gal检测
对实施例1制得的脱细胞神经基质以及实施例1中未经脱细胞处理的神经组织进行抗原ɑ-gal检测,具体实验方法如下:取实施例1制得的脱细胞神经基质和未经脱细胞处理的神经组织,分别为实验组和对照组,各组均采用4%的多聚甲醛固定24h,梯度酒精脱水,二甲苯透明、浸蜡、包、切片,切片厚度为5μm。
将切片置于65℃烤箱中,烤1-2h。然后将切片于二甲苯中脱蜡,依次入无水乙醇,95%乙醇,85%乙醇各1min,80%乙醇各1min,70%乙醇各1min,pbs冲洗3min,3次。然后置于预先配置好的柠檬酸钠抗原修复液,在高压修复锅中,加入工作液加热至沸腾,放入切片,盖紧后继续加热至限压阀喷气转动开始计时2.5min。离开热源,自然冷却5min,自来水冲洗,冷却至室温后取出切片,pbs冲洗3min,3次。用3%双氧水封闭10分钟,pbs冲洗3min,3次,擦干组织周围的pbst,用中杉金桥正常羊血清封闭1h,倾去血清,勿洗。加入一抗,过夜(ɑ-gal抗体,自带荧光,货号(i21412)1:2000)。pbst,3分钟,3遍,封片,荧光显微镜下观察切片,结果如图3所示。
结果显示,未经脱细胞处理的神经组织中有荧光,说明有ɑ-gal抗原表达,而脱细胞后的脱细胞神经基质中没有荧光,说明无ɑ-gal抗原表达。
实验例7天狼星红染色
对实施例1制得的脱细胞神经基质以及实施例1中未经脱细胞处理的神经组织进行天狼星红染色,具体实验方法如下:取实施例1制得的脱细胞神经基质和未经脱细胞处理的神经组织,分别为实验组和对照组,各组均采用4%的多聚甲醛固定24h,梯度酒精脱水,二甲苯透明、浸蜡、包、切片,切片厚度为5μm,得到石蜡切片。将石蜡切片于二甲苯中脱蜡,依次入无水乙醇,95%乙醇,85%乙醇各5min,自来水冲洗1-2min。苏木素染液染10-20min,酸性分化液分化数秒,自来水洗5-10min,蒸馏水洗一次,天狼星红染液染1h。流水稍冲洗,无水乙醇脱水1min,两次,二甲苯透明数分钟,两次,中性树胶封片,镜检,结果如图4所示
结果显示,未经脱细胞处理的神经组织有细胞核成分和纤维结构,而经脱细胞处理制得的脱细胞神经基质,纤维结构保存完整,无细胞核成分。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!