负载金属卟啉的脂质体纳米颗粒及其制备方法和应用与流程
本发明涉及纳米药物技术领域,尤其是涉及一种负载金属卟啉的脂质体纳米颗粒及其制备方法和应用。
背景技术:
声动力疗法(sdt)通过超声激发声敏剂,在声致发光引起的声裂解过程中,通过将能量传递给氧气分子或者水分子产生高活性的单线态氧和自由基等活性氧簇(ros)来杀伤肿瘤细胞,而达到治疗肿瘤目的。声动力疗法利用超声波产生活性氧来治疗癌症,因具有穿透深,非侵入和时空可控等优势而成为近年来肿瘤治疗领域的研究热点。
目前关于声敏剂的研究还主要集中在卟啉类等有机声敏剂的方向上。传统有机声敏剂如卟啉及其衍生物由于在肿瘤部位积蓄量少,声动力效果不显著。近年来,各种金属中心的卟啉金属配合物应用于抗菌、抗肿瘤的研究被大量报道。金属有机配合物作为一种金属离子与有机化合物以配位键络合的物质,优化了有机原材料的结构同时发挥金属离子在生物体内的生理功能,往往表现出特异的生理活性。
虽然金属卟啉在声敏剂系统中一定程度上提高了声动力治疗敏化作用,但是这种配合物生物利用度差,靶向性差,限制了其临床应用。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的之一在于提供一种负载金属卟啉的脂质体纳米颗粒,以缓解现有金属卟啉生物利用度差和靶向性差,限制了其临床应用的技术问题。
本发明提供的负载金属卟啉的脂质体纳米颗粒,包括金属卟啉和脂质体,所述金属卟啉包载于所述脂质体中。
进一步的,所述金属卟啉中的金属离子选自金、铂、铁、钴、镍、锰、铜或锌中的至少一种,优选为锰卟啉。
进一步的,所述脂质体为叶酸脂质体,所述叶酸脂质体包括脂质体和叶酸,所述叶酸通过化学键与所述脂质体连接。
进一步的,所述负载金属卟啉的脂质体纳米颗粒的粒径为50-500nm,优选为100-200nm。
本发明的目的之二在于提供所述负载金属卟啉的脂质体纳米颗粒的制备方法,包括如下步骤:
将金属卟啉溶液和脂质体溶液混合均匀,超声,得到负载金属卟啉的脂质体纳米颗粒。
优选地,所述负载金属卟啉的脂质体纳米颗粒的制备方法,包括如下步骤:
(a)将金属卟啉溶液、卵磷脂溶液和磷脂化peg类物质溶液混合均匀,去除溶剂,得到负载金属卟啉的脂质体薄膜;
(b)将负载金属卟啉的脂质薄膜分散在水溶液中,得到负载金属卟啉的脂质体悬液;
(c)对负载金属卟啉的脂质体悬液进行超声,得到负载金属卟啉的脂质体纳米颗粒。
进一步的,步骤(a)中,金属卟啉和脂质体的质量比为1:(10-25),优选为1:(15-20)。
进一步的,步骤(a)中,所述磷脂化peg类物质包括dspe-peg及其衍生物;
优选地,所述dspe-peg衍生物选自dspe-peg-folate、dspe-peg-nh2、dspe-peg-cooh或dspe-peg-nhs中的至少一种,优选为dspe-peg-folate。
优选地,所述金属卟啉、卵磷脂和所述dspe-peg-folate的质量比为1:(5-15):(1-2),优选为1:(8-12):(1-2)。
进一步的,步骤(a)中,采用减压旋蒸法去除有机溶剂;
和/或,步骤(b)中,通过超声水化将负载金属卟啉的脂质体薄膜分散在水溶液中;
和/或,步骤(c)中,采用超声波细胞破碎仪进行超声。
优选地,步骤(b)中,超声水化的时间为2-15min,优选为5-10min;
优选地,步骤(c)中,超声的时间为3-10min,优选为4-6min。
本发明的目的之三在于提供负载金属卟啉的脂质体纳米颗粒在制备治疗肿瘤药物中的应用。
本发明的目的之四在于提供一种治疗肿瘤的药物,包括本发明提供的负载金属卟啉的脂质体纳米颗粒。
本发明提供的负载金属卟啉的脂质体纳米颗粒通过脂质体包载金属卟啉,不仅提高了金属卟啉的稳定性和生物相容性,而且提高了金属卟啉的生物膜穿透性和靶向性,同时还能够在超声激发下触发声动力疗效,从而使得负载金属卟啉的脂质体纳米颗粒更易于聚集在肿瘤细胞处,提高药物利用率,达到选择性治疗肿瘤的效果。
本发明提供的负载金属卟啉的脂质体纳米颗粒的制备方法通过超声将金属卟啉包载于脂质体中,工艺简单,操作方便,能够有效降低制备成本。
附图说明
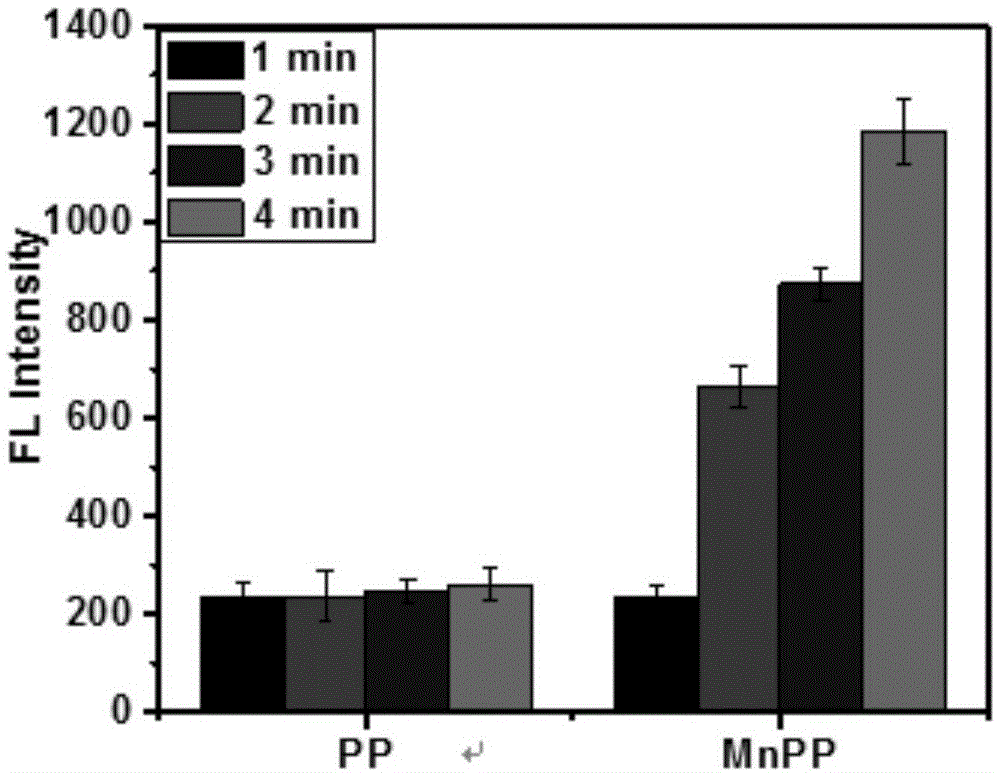
图1为实施例3提供的负载mnpp的叶酸脂质体纳米颗粒及对比例1提供的负载pp的叶酸脂质体纳米颗粒在不同超声时间荧光强度的柱状图;
图2为实施例3提供的负载mnpp的叶酸脂质体纳米颗粒、对比例1提供的负载pp的叶酸脂质体纳米颗粒及空白对照组与细胞作用后的细胞存活率柱状图;
图3为实施例3提供的负载mnpp的叶酸脂质体纳米颗粒、对比例1提供的负载pp的叶酸脂质体纳米颗粒及空白对照组与细胞作用后的细胞存活率柱状图;
图4为实施例3提供的负载mnpp的叶酸脂质体纳米颗粒、对比例1提供的负载pp的叶酸脂质体纳米颗粒及空白对照组产生的ros图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是:
本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。
本发明中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。
本发明中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。
本发明中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“6~22”表示本文中已经全部列出了“6~22”之间的全部实数,“6~22”只是这些数值组合的缩略表示。
本发明所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
本发明中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
金属卟啉中的金属离子对卟啉大π键的吸引作用,从而提高卟啉环上π电子的跃迁性能使金属卟啉在超声激发的条件下具有杀伤肿瘤的作用,因此开发了金属卟啉的新功能——超声激发下的抗肿瘤功能。但是由于其生物相容性比较差,严重影响了其在生物学研究上的应用。
根据本发明的一个方面,本发明提供了一种负载金属卟啉的脂质体纳米颗粒,包括金属卟啉和脂质体,所述金属卟啉包载于所述脂质体中。
在本发明中,金属卟啉为金属卟啉配合物。
本发明提供的负载金属卟啉的脂质体纳米颗粒通过脂质体包载金属卟啉,不仅提高了金属卟啉的稳定性和生物相容性,而且提高了金属卟啉的生物膜穿透性和靶向性,同时还能够在超声激发下触发声动力疗效,从而使得负载金属卟啉的脂质体纳米颗粒更易于聚集在肿瘤细胞处,提高药物利用利用率,达到选择性治疗肿瘤的效果。
在本发明的一种优选实施方式中,金属卟啉中的金属离子选自金、铂、铁、钴、镍、锰、铜或锌中的一种或几种,优选为锰卟啉。
当金属卟啉为锰卟啉时,其具有核磁成像和抗肿瘤的双重作用,能够实现在肿瘤治疗上的声动力和核磁成像的多功能诊疗一体化。
在本发明的一种优选实施方式中,脂质体为叶酸脂质体,叶酸脂质体包括脂质体和叶酸,叶酸通过化学键与脂质体连接。叶酸作为一种水溶性药物,能够参与人体多种代谢活动,而叶酸受体是人体各类肿瘤细胞上过量表达的高亲和力叶酸结合蛋白,其在卵巢癌、子宫内膜癌、肾癌、乳腺癌、肺癌、结肠癌、肺癌、结肠癌和鼻烟癌中叶酸受体均高度表达。因此,将叶酸与脂质体通过化学键连接后,更易于实现负载金属卟啉的脂质体纳米颗粒的对肿瘤细胞的精准靶向。
在本发明的一种优选实施方式中,化学键包括离子键、共价键和金属键,优选地,叶酸和脂质体通过共价键连接,以提高叶酸和脂质体连接的稳定性。
在本发明的一种优选实施方式中,负载金属卟啉的脂质体纳米颗粒的粒径为50-500nm。通过控制负载金属卟啉的脂质体纳米颗粒的粒径,以便于其穿透细胞膜,提高其对肿瘤细胞的靶向性,尤其是当粒径为100-200nm时,其更有利于穿透细胞膜,提高对肿瘤细胞的靶向性,增强肿瘤细胞对金属卟啉的摄取,增强声动力疗效。
典型但非限制性负载金属卟啉的脂质体纳米颗粒的粒径如为50、100、150、200、250、300、350、400、450或500nm。
根据本发明的第二个方面,本发明提供了上述负载金属卟啉的脂质体纳米颗粒的制备方法,包括如下步骤:
将金属卟啉溶液和脂质体溶液混合均匀,超声,得到负载金属卟啉的脂质体纳米颗粒。
在本发明的一种优选实施方式中,金属卟啉和脂质体的质量比为1:(10-25)。通过控制金属卟啉和脂质体的质量比,以提高负载金属卟啉的脂质体纳米颗粒中金属卟啉的包载率,提高治疗效果,尤其是当金属卟啉和脂质体的质量比为1:(15-20)时,负载金属卟啉的脂质体纳米颗粒中金属卟啉的包载率更高,对肿瘤细胞的治疗效果更好。
典型但非限制性的,金属卟啉和脂质体的质量比如为1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19、1:20、1:21、1:22、1:23、1:24或1:25。在本发明的一种优选实施方式中,负载金属卟啉的脂质体纳米颗粒的制备方法,包括如下步骤:
(a)将金属卟啉溶液、卵磷脂溶液和磷脂化peg类物质溶液混合均匀,去除溶剂,得到负载金属卟啉的脂质体薄膜;
(b)将负载金属卟啉的脂质薄膜分散在水溶液中,得到负载金属卟啉的脂质体悬液;
(c)对负载金属卟啉的脂质体悬液进行超声,得到负载金属卟啉的脂质体纳米颗粒。
在上述优选的实施方案中,步骤(a)中将金属卟啉溶液、卵磷脂溶液和磷脂化peg类物质溶液混合均匀后,去除溶液,以将金属卟啉负载于卵磷脂和磷酯化peg类物质生成的脂质体薄膜上,得到负载金属卟啉的脂质体薄膜;在步骤(b)中,将负载金属卟啉的脂质体薄膜分散在水中,得到负载金属卟啉的脂质体悬浮液以有利于在步骤(c)中,通过超声,使得金属卟啉包载与脂质体中。
在本发明的优选实施方式中,通过将金属卟啉溶液和脂质体的原料混合均匀后,再去除溶液,更有利于金属卟啉在脂质体薄膜中分散的更加均匀。
在本发明的一种优选实施方式中,步骤(a)中,磷脂化peg类物质包括dspe-peg及其衍生物。
在本发明的优选实施方式中,磷脂化peg类物质包括dspe-peg及其衍生物,dspe-peg衍生物选自dspe-peg-folate、dspe-peg-nh2、dspe-peg-cooh或dspe-peg-nhs中的至少一种。当磷酯化peg类物质为dspe-peg-folate时,其与卵磷脂相同协同,制成的脂质体为叶酸脂质体,从而使得制成的负载金属卟啉的脂质体纳米颗粒具有更强的靶向性能,更易于在肿瘤细胞处富集,提高治疗效果。
在本发明的一种优选实施方式中,卵磷脂为大豆卵磷脂。
在本发明的一种优选实施方式中,所述金属卟啉、卵磷脂和所述dspe-peg-folate的质量比为1:(5-15):(1-2),优选为1:(8-12):(1-2)。通过控制金属卟啉、卵磷脂和dspe-peg-folate的质量比,以利于提供负载金属卟啉的脂质体纳米颗粒中金属卟啉的包载率,,尤其是当三者的质量比为1:(8-12):(1-2),制备得到的负载金属卟啉的脂质体纳米颗粒金属卟啉的包载率更高。
典型但非限制性的,卵磷脂和dspe-peg-folate的质量比如为5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1或15:1。
在本发明的一种优选实施方式中,步骤(a)中,采用减压旋蒸法去除有机溶剂。通过采用减压旋蒸法去除有机溶剂工艺更简单,更方便快捷。
在本发明的一种优选实施方式中,步骤(b)中,通过超声水化,将负载金属卟啉的脂质薄膜分散在水溶液中,使得到的负载金属卟啉的脂质体在水中分散的更均一更稳定,从而更有利于后续将金属卟啉包载于脂质体中。
在发明的一种优选实施方式中,超声水化的时间为2-15min,优选为5-10min。
通过控制超声水化的时间,以利于将负载金属卟啉的脂质薄膜在水中分散均匀,得到分散均一稳定的负载金属卟啉的脂质体。
在本发明的一种优选方式中,步骤(c)中,采用超声波细胞破碎仪进行超声,以有利于生成粒径均一稳定的负载金属卟啉的脂质体纳米颗粒。
在本发明的一种优选实施方式中,采用超声波细胞破碎仪超声的时间为3-10min,优选为4-6min。通过控制超声波细胞破碎仪超声的时间,以利于金属卟啉包载于脂质体中,尤其是当超声时间为4-6min,更有利于在保证包载率的基础上减少能源浪费。
典型但非限制性的,采用超声波细胞破碎仪超声的时间如为3、4、5、6、7、8、9或10min。
根据本发明的第三个方面,本发明提供了上述负载金属卟啉的脂质体纳米颗粒在制备治疗肿瘤药物中的应用。
上述肿瘤包括但不限于卵巢癌、子宫内膜癌、肾癌、乳腺癌、肺癌、结肠癌和鼻咽癌。
下面结合实施例和对比例对本发明提供的技术方案做进一步的描述。
实施例1
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其按照如下步骤制备得到:
(1)取mnpp1mg溶解在100ul分析纯的二甲基亚砜(dmso)中,得到浓度为10mg/ml的mnpp溶液;
(2)取大豆卵磷脂10mg的质量比溶于分析纯的氯仿中,轻摇至全溶,得到大豆卵磷脂溶液;
(3)称取dspe-peg-folate1mg于分析纯的氯仿中,轻摇至全溶,得到dspe-peg-folate溶液;
(4)将mnpp溶液、大豆卵磷脂溶液和dspe-peg-folate溶液混合均匀,利用减压旋蒸除去氯仿,得均匀负载mnpp的叶酸脂质体薄膜,真空干燥24h;
(5)将负载mnpp的叶酸脂质体薄膜加入一定体积的pbs超声清洗波中超声水化2-15分钟,得负载mnpp的叶酸脂质体悬液;
(6)使用超声波细胞破碎仪对负载mnpp的叶酸脂质体悬液进行间歇式超声5分钟,然后用0.22μm的过滤膜过滤整粒,得负载mnpp卟啉的叶酸脂质体纳米颗粒。
实施例2
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,步骤(3)中dspe-peg-folate的用量为2mg。
实施例3
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,步骤(3)中dspe-peg-folate的用量为1.5mg。
实施例4
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例3的不同之处在于,步骤(2)中大豆卵磷脂的用量为15mg。
实施例5
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例3的不同之处在于,步骤(2)中大豆卵磷脂的用量为8mg。
实施例6
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,步骤(2)中大豆卵磷脂的用量为12mg。
实施例7
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,步骤(2)中大豆卵磷脂的用量为3mg。
实施例8
本实施例提供了一种负载锰卟啉(mnpp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,步骤(3)中dspe-peg-folate的用量为0.5mg。
对比例1
本对比例提供了一种负载卟啉(pp)的叶酸脂质体纳米颗粒,其制备方法与实施例1的不同之处在于,采用pp代替mnpp。试验例1
分别取实施例1-8提供的负载mnpp的叶酸脂质体纳米颗粒溶液5ml,分别置于100kd的超滤管内,并分别在5000rpm下离心5min,弃滤液并补加去离子水至5ml,重复3次,分别收集浓缩液。分别精密量取上述8组浓缩液适量,用二甲基亚砜(dmso)稀释到适当的浓度用紫外分光光度计分析,计算药物含量;同时分别精密量取实施例1-8提供的负载mnpp的叶酸脂质体纳米颗粒溶液5ml,冻干,分别称量并记录纳米颗粒的重量,计算载药率。另外,分别将实施例1-8提供的负载mnpp的叶酸脂质体纳米颗粒溶液稀释至适当浓度,于马尔文激光粒度仪中检测粒径。结果见表1。
表1负载mnpp的叶酸脂质体纳米颗粒数据表
从表1中,实施例1-6和实施例7-8的对比可以看出,实施例1-6提供的负载mnpp的叶酸脂质体纳米颗粒的粒径均小于100nm,且粒径分布更均匀,药物包载率不低于7.5%,更易于在肿瘤部位聚集。
试验例2
分别将实施例3提供的负载mnpp的叶酸脂质体纳米颗粒溶液和对比例1提供的负载pp的叶酸脂质体纳米颗粒溶液分别配置成能浓度为50μg/ml的水分散液,然后将实施例3提供的负载mnpp的叶酸脂质体纳米颗粒水分散液和对比例1提供的负载pp的叶酸脂质体纳米颗粒分别与10μmol/l的2′,7′-二氯荧光素二乙酸盐(dcfh-da)荧光探针混合后,进行超声,并在不同时间取样。分别将超声后的2组溶液稀释相同倍数后,用多功能酶标仪检测活性氧的荧光强度,记录超声4min后的荧光强度,绘制柱形图。
图1为实施例3提供的负载mnpp的叶酸脂质体纳米颗粒在不同超声时间荧光强度的柱状图,其中,pp代表对比例1提供的负载pp的叶酸脂质体纳米颗粒的水分散液,mnpp代表实施例3提供的负载mnpp的叶酸脂质体纳米颗粒的水分散液,flintensity代表荧光强度。如图1所示,随着超声时间的延长,分散在水里的实施例3提供的负载mnpp的叶酸脂质体纳米颗粒产生的荧光强度明显增强,而对比例1提供的负载pp的叶酸脂质体纳米颗粒随着超声时间的延长,其荧光强度稍有少许增强,这说明实施例3提供的负载mnpp的叶酸脂质体纳米颗粒将mnpp包载于叶酸脂质体中,产生活性氧簇(ros)的数量显著高于仅包载pp的叶酸脂质体纳米颗粒,能够实现更高效的声动力治疗。
试验例3
将处于对数生长期的乳腺癌细胞4t1,以5×103个/孔接种于96孔板中,每孔加入0.2ml细胞悬液,于37℃培养箱中(含5%co2)孵育24小时后,将实施例3提供的负载mnpp的叶酸脂质体纳米颗粒及卟啉及对比例1提供的负载pp的叶酸脂质纳米颗粒分别用培养基稀释到5μg/ml、10μg/ml、20μg/ml浓度后,分别加入到细胞中,同时将培养基作为空白对照组也加入细胞中,继续孵育24小时后,加入cck8,1小时后在多功能酶标仪检测od(450)值,进而计算纳米颗粒的体外安全性。结果如图2所示,其中,control代表培养基空白对照组,pp-lp-fa代表对比例1提供的负载pp的叶酸脂质体纳米颗粒;mnpp-lp-fa代表负载mnpp的叶酸脂质体纳米颗粒,celllivability代表细胞存活率。
从图2中可以看出,实施例3提供的负载mnpp的叶酸脂质体纳米颗粒对细胞没有明显杀伤性,这说明实施例3提供的负载mnpp的叶酸脂质体纳米颗粒具有良好的安全性,不会对细胞造成损伤。
试验例3
将处于对数生长期的乳腺癌细胞4t1,以5×103个/孔接种于96孔板中,每孔加入0.2ml细胞悬液,于37℃培养箱中(含5%co2)孵育24小时后,将实施例3提供的负载mnpp的叶酸脂质体纳米颗粒及对比例1提供的负载pp的叶酸脂质体纳米颗粒分别用培养基稀释到10μg/ml浓度后,加入到细胞中,同时将培养基作为空白对照组也加入细胞中,继续孵育3小时。然后将96孔板中需要超声处理的孔置于平面超声探头下,超声激发(2mhz,2w)3min后,继续孵育24小时后,加入cck8,1小时后在多功能酶标仪检测od(450)值,进而计算纳米颗粒的超声杀伤率,结果如图3所示,其中,contronl代表空白对照组且不进行超声处理,control+us代表空白对照组且进行超声,pp-lp-fa+us代表对比例1提供负载pp的叶酸脂质体纳米颗粒且进行超声处理;mnpp-lp-fa+us代表实施例3提供的负载mnpp的叶酸脂质体纳米颗粒且进行超声处理,cellviability代表细胞存活率。
从图3中可以看出,实施例3提供的负载mnpp的叶酸脂质体纳米颗粒在超声作用下,对肿瘤细胞的杀伤性显著高于同样在超声情况下的对比例1提供的负载pp的叶酸脂质体纳米颗粒,这说明实施例3提供的负载mnpp的叶酸脂质体纳米颗粒对乳腺肿瘤细胞4t1具有显著的声动力疗效。
试验例4
将乳腺癌细胞4t1分别与培养基、实施例3提供的负载mnpp的叶酸脂质体纳米颗粒及对比例1提供的负载pp的叶酸脂质体纳米颗粒共孵育,培育3h后,然后加以超声处理,检测超声后的细胞存活率。结果如图4所示,其中,control+us代表培养基空白对照组加超声处理,pp-lp-fa+us代表对比例1提供的负载pp的叶酸脂质体纳米颗粒加超声处理;mnpp-lp-fa代表实施例3提供的负载mnpp的叶酸脂质体纳米颗粒加超声处理,dapi代表4',6-二脒基-2-苯基吲哚,ros代表自由基等活性氧簇,merge代表两者叠加。结果显示,在声动力(sdt)条件下实施例3提供的负载mnpp的叶酸脂质体纳米颗粒在细胞内产生ros的量明显增多,说明实施例3提供的负载mnpp的叶酸脂质体纳米颗粒具有声敏性,能够作为声敏剂用于肿瘤治疗的声动力学治疗中的声敏剂。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!