调释烟酰胺的制作方法
本发明涉及包括调释烟酰胺的药物制剂,以及其在预防和/或治疗血清磷酸盐水平升高(高磷血症)和/或血脂异常的方法中的应用,其中血清磷酸盐水平升高(高磷血症)和血脂异常特别是由肾衰竭引起的。
背景技术:
高磷血症(hyperphosphatemia)定义为磷酸盐的超生理水平,被认为是慢性肾脏疾病(ckd)或慢性肾衰竭(crf)患者的独立危险因素,而充分治疗仍然是一个挑战,约50%至70%的ckd患者未能达到根据doppsiii[young2004(1),tentori2008(2)]所建议的目标磷酸盐水平[kdigoguideline2009(8);k/doqiclinicalpracticeguidelines2003(7)]。
肾衰竭是高磷血症的主要原因。慢性肾衰竭(crf)是一种进行性肾脏疾病。当肾脏丧失了从大量液体、电解质、代谢物质中清除血液的全部能力时,患者将无法生存,必须求助于透析。这样的最终病症被定义为终末期肾病(esrd)。最关键的电解质之一是磷酸盐。
ckd破坏系统性钙和磷的体内稳态,并且影响骨骼、肠道和甲状旁腺。这种情况的发生是由于磷酸盐的肾排泄减少,以及25-羟基维生素d经肾脏羟基化转化为骨化三醇(1,25二羟基维生素d)的过程减弱[levin,2007(3)]。进行性肾功能异常导致高磷血症和骨化三醇缺乏。这些最终可导致低钙血症。这些异常通过感知作为对pth释放的有力刺激的钙敏感受体(casr),而直接增加了pth水平。因此,高磷血症也是甲状旁腺功能亢进的重要因素。尽管细胞外磷酸盐传感器因子的身份尚未确定,但新的利磷因子(phosphaturicfactor)fgf23可能受到磷酸盐和维生素d的调节。这可能在终末期肾病(esrd)中,调节甲状旁腺功能中发挥作用[saito,2005(4)]。
高磷血症还降低离子钙的水平,干扰1,25-二羟基维生素d的产生,从而导致pth水平升高。血清磷酸盐和钙水平异常的高磷血症和继发性甲状旁腺功能亢进,与发病率、肾性骨营养不良和死亡率相关。许多报告描述了,矿物质代谢紊乱患者的全死因和心血管死亡的风险增加。尽管并非在所有研究中均发现,但与生存率降低的关联主要涉及升高的磷酸盐、钙、钙x磷酸盐产物和/或甲状旁腺激素水平。这些反过来又与加速性动脉粥样硬化、动脉钙化,和不良心血管预后和死亡的风险增加有关[block,1998(5);london,2003(6)]。
血磷超过5.5mg/dl和磷酸钙产物超过52mg2/dl2,都与透析患者的死亡风险增加相关[block,1998(5)]。
这些发现导致了最近的kdoqi(肾脏病预后质量倡议)建议,将血清磷更有效地控制在2.5和5.5mg/dl之间,同时将磷酸钙产物保持在小于55mg2/dl2[k/doqiclinicalpracticeguidelines,2003(7)]。
因为人们越来越多地关注心血管疾病、血管钙化与骨骼和矿物质代谢异常之间的关系,经过证据审查和专家审议的谨慎过程,得出了2003k/doqi骨代谢指南[k/doqiclinicalpracticeguidelines,2003(7)]。
基于此观点,以下是对经受维持性透析的患者的一些一般性建议的概述[k/doqiclinicalpracticeguidelines,2003(7);kdigoguidelines2009(8)]。
·可以通过含钙或不含钙的磷酸盐结合剂,例如钙或非金属盐基磷酸盐结合剂,来起始对难以通过透析和饮食治愈的高磷酸盐水平(大于5.5mg/dl[>1.8mmol/l])的治疗。
·鼓励使用口服磷酸盐结合剂鸡尾酒,限制使用1.5克钙盐(连同饮食中的钙摄入,每天最多摄入2克钙元素)。
·持续不变的pth水平<150pg/ml或血浆钙水平>9.5mg/dl(>2.37mmol/l)的患者应避免摄入钙盐。钙水平大于9.5mg/dl(>2.37mmol/l)的患者也应避免或终止摄入维生素d化合物。
·血管或软组织钙化严重的患者优选非钙基磷酸盐结合剂。
·血浆钙水平应保持在正常范围的下限(8.4至9.5mg/dl[2.1至2.35mmol/l])。
·首先通过专注于控制血浆磷酸盐,将磷酸钙产物保持在小于55mg2/ml2(<4.4mmol2/l2)。
下表1总结了根据kdigo指南2009(kdigoguidelines2009)(8)提出的一些建议。
表1:根据kdigoguidelines2009的建议。gfr=估计的肾小球滤过率,对肾功能进行分类的参数(kdigo,2009(8))。
高磷血症的主要后果是心血管并发症,这是慢性肾衰竭患者的主要死因。在局部水平上,这些并发症表现为内皮改变、脂质积累、凝块形成和管腔闭塞。
如果要实现主要的磷酸盐控制目标,需要遵循这些准则,要求许多患者使用多种不同的降磷酸盐试剂。
可以通过施用具有降低磷酸盐活性的产品(降磷酸盐试剂)来治疗高磷血症:
-钙基结合剂,即乙酸钙、碳酸钙、钙镁盐,
-铝基结合剂,即氯化铝和盐酸铝,
-碳酸镧,
-含铁的磷酸盐结合剂(柠檬酸铁、氢氧化蔗糖铁(sucroferricoxyhydroxide)),它们全都通过饮食摄入的药剂和磷酸盐的物理化学沉淀而起作用,并且沉淀在胃肠道中(即归类为磷酸盐结合剂)。
此外,
-碳酸司维拉姆或盐酸司维拉姆(聚合物)
是降磷酸盐试剂,通过饮食摄取的磷酸盐的物理化学吸收而起作用,并且在通过胃肠道期间被聚合物吸收。
此外,在生理作用方式下,可以减少主动和被动的磷酸盐吸收:
-利用替那帕诺(tenapanor)或其他物质阻断钠氢交换因子(nh3交换因子),来减少被动的磷酸盐吸收(block,2017(76))
-利用烟酰胺阻断位于肠道中的napi2b受体,来减少主动的磷酸盐吸收。
术语“降磷酸盐试剂”和“磷酸盐结合剂”在本文中可互换地使用。
由于作用方式,随餐服用药物是必要的,需要高剂量,并且患者依从性是前提条件,但由于高片剂负担(每餐3至6片或胶囊),这些往往不足。因此,尽管使用上述降磷酸盐试剂治疗,高达70%的ckd患者仍处于高磷血症[navaneethan,2009(9)],并且未达到上述kdigo和kdoqi所推荐的磷酸盐水平[k/doqiclinicalpracticeguidelines,2003(7);kdigoguideline,2009(8)]。
烟酰胺通过下调主要在小肠中表达的napi2b协同转运蛋白,而发挥药理、药理生理作用。
通过调节肠内磷酸盐的吸收,以及通过调节磷酸盐经由肾脏的排泄,实现细胞外磷酸盐的体内稳态。此外,磷酸盐的体内稳态受到涉及肾脏、骨骼和肠道的整合内源性交流(crosstalk)的调节(ketteler,2011(58))。通过调节肠内磷酸盐的吸收,以及通过调节磷酸盐经肾脏的排泄,来实现细胞外磷酸盐的体内稳态。现有知识表明,三种不同的钠依赖性磷酸盐协同转运蛋白(napi2a、napi2c和napi2b)以及两种3型协同转运蛋白(pit1和pit2)负责肠和肾脏的磷酸盐调节(marks,2010(10),suyama,2012(11))。napi2b协同转运蛋白对于主动摄取磷酸盐至关重要,其中磷酸盐有助于约50%的磷酸盐吸收到血清中(katai,1999(12))。肾脏表达四种不同的磷酸盐协同转运蛋白。其中三种(napi2a、napi2c、pit2)位于肾小管器官的近端部分,位于肾上皮细胞的顶面(forster,2013(56))。它们的生理作用是从原尿中重新吸收过滤掉的磷酸盐。最近,在大鼠的肾脏中也检测到了磷酸盐协同转运蛋白napi2b(suyama,2012(11))。与上述协同转运蛋白相比,napi2b表达在泌尿道周围的上皮细胞的基底外侧,表明其生理作用是升高肾脏中的基础磷酸盐排泄水平。根据这一假设,在高磷饮食下,肾脏的napi2b表达会大大升高(suyama,2012(11))。此外,在腺嘌呤诱导的ckd小鼠模型中,napi2b的肾脏表达也显著升高,同时napi2a和napi2c的表达降低(pulskens,2015(57))。下表2中提供了转运机制的简要概述。
表2:肾脏和肠道中的主动磷酸盐协同转运蛋白。根据(giral,2009(13);marks,2010(10);sabbagh,2011(14),suyama,2012(11))。
bbm=刷状缘膜,mepe=基质细胞外磷酸糖蛋白,fgf23=成纤维细胞生长因子23,mg2+=镁,napi=磷酸钠协同转运蛋白,pfa=膦甲酸、pit=钠依赖性磷酸盐协同转运蛋白,po4=磷酸盐,s=片段,vdr=维生素d受体,pth=甲状旁腺素
已示出,在患有实验性诱发ckd的动物中(eto,2005(18)),和在患有终末期肾病并在透析的人中,烟酰胺可以有效降低磷酸盐水平升高(takahashi,2004(19),medice,2015(36))。
在双敲除小鼠(marks,2010(10))中或通过fgf23(gattineni,2009(15))来抑制肾脏napi2a和napi2c的蛋白表达,通过阻断肾脏中的肾小管磷酸盐再吸收,来诱导严重的低磷血症。
钠依赖性磷酸盐协同转运蛋白napi2b被证明,负责约50%的胃肠道磷酸盐吸收(katai,1999(12))。在这种跨细胞转运机制下,被动的磷酸盐扩散在肠道磷酸盐吸收中也很重要。
富含磷酸盐的饮食会阻断肠道napi2b的表达(hattenhauer,1999(16))。低磷酸盐饮食(giral,2009(13);hattenhauer,1999(16))或血清骨化三醇的增加(xu,2002(17)),会提高该协同转运蛋白的表达。fgf23被证明,通过抑制肾脏1α-羟化酶活性,从而降低骨化三醇的水平,来发挥对肠道napi2b表达的间接抑制作用(marks,2010(10))。
由于抑制磷酸盐协同转运蛋白napi2b,而使小肠吸收磷酸盐减少被认为是降低磷酸盐浓度的新作用机理。腹膜内施用烟酰胺阻断napi2b的表达(eto,2005(18)),并且抑制磷酸盐的胃肠道吸收(katai,1999(12))。尚未确定功能性协同转运蛋白是否也被直接抑制。
已显示烟酰胺可以有效降低动物(eto,2005(18))和人类中升高的磷酸盐水平,其概述见表3。
表3:烟酰胺在ckd患者中的研究概述
但是,还未研究和系统评估过调释烟酰胺(mr-na)的生物利用度、临床疗效和安全性。
此外,磷酸盐的体内稳态受到涉及肾脏、骨骼和肠道的整合内源性交流的调节(ketteler,2011(58))。肾功能下降导致一系列病理生理事件,从而导致矿物质和骨代谢紊乱(mbd)。mbd的特征是继发性甲状旁腺功能亢进、动脉钙化、动脉功能改变和骨代谢异常。这些变化导致肾功能进一步丧失,骨骼脱矿质,骨折,以及高心血管性发病率和死亡率(kdigo,2009(8))。
在早期慢性肾病(ckd)中,由于过滤肾元丢失而导致的不明显的磷酸盐潴留在ckd-mbd发展中起着关键作用(block,2013(61))。磷酸盐潴留向磷酸性激素(phosphaturichormones)甲状旁腺激素(pth)和成纤维细胞生长因子23(fgf23)传递信号,两者均导致通过肾脏使部分的磷酸盐排泄增加(gutierrez,2005(62))。此外,磷酸盐潴留会抑制1,25二羟基维生素d(1,25(oh)2d)的肾脏合成,从而导致肠道对磷酸盐的吸收减少(marks,2006(63))。结果,磷酸性激素和1,25(oh)2d在早期肾脏疾病中表现出特征性变化,而血液中的磷酸盐水平保持在正常范围内,直到ckd的第3~4阶段,在晚期尤其是ckd的第4/5阶段呈强指数增长。
ckd与心血管疾病(cvd)的风险大大增加有关(go,2004(64)),因此,ckd(kestenbaum,2005(65))和终末期肾病患者的心血管疾病的发病率和死亡率大大增加(block,2004(66))。在德国,血液透析患者的5年生存率仅为38%(frei,2008(67))。在经年龄、性别和种族调整后的心血管死亡率中,增加了30到100倍,从而导致了这种极高的死亡率(foley,1998(68))。矿物质代谢改变与血磷水平升高(高磷血症)是ckd患者全因和心血管疾病死亡率的最强的独立预测因子和风险因素(kestenbaum,2005(65))。在高磷血症之下,ckd患者表现出其它心血管疾病的风险因素。血脂异常是ckd患者非常常见的合并症。通常ckd患者的甘油三酸酯水平较高,尤其是患有肾病综合征的患者表现出低密度脂蛋白(ldl)的显著增加(mikolasevic,2017(23))。已证明,降低ldl可以降低ckd患者(baigent,2011(24))以及接受血液透析的糖尿病患者的心血管死亡率(
相比之下,高血清磷酸盐直接导致血管中层平滑肌层发生营养不良性钙化。此外,高血液磷酸盐水平导致因脂质沉积而产生的内膜斑继发钙化(moe,2004(69))。因此,高磷血症和血脂异常协同影响血管内膜的动脉粥样硬化性钙化的严重程度。此外,与年龄相匹配的普通群体相比,继发性动脉粥样硬化性钙化在ckd患者中的严重性和频率更为频繁,并且在以血脂异常和高磷血症为特征的ckd患者中可以被认为是合并症的特殊并发症(amann,2008(26))。
在ldl胆固醇改变的情况下,ckd患者血脂异常的特征还在于脂蛋白(a)(lp(a))的血液水平升高。这是一种ldl样脂蛋白,包括共价结合的载脂蛋白(a)(apo(a)),这样将其与ldl区别开。由于它与血浆蛋白酶酶基因纤溶酶原具有很高的同源性,apo(a)与纤溶酶原纤溶酶原受体,纤维蛋白原和纤维蛋白竞争。这些作用导致由于纤维蛋白溶解受到抑制,而促进血栓形成(mikolasevic,2017(23))。ckd患者的lp(a)浓度显著升高(haffner,1992(27)),apo(a)浓度也升高(trenkwalder,1997(28))。在ckd患者中,高血清水平的lp(a)与全因死亡和急性冠状动脉综合征呈负相关,表明lp(a)是心血管事件的独立风险因素(konishi,2016(70))。此外,一项前瞻性队列研究显示,在10年的中位随访期内,lp(a)水平高的患者发生ckd的风险显著增加(yun,2016(71))。因此,目前的证据表明,高水平的lp(a)会触发ckd的发生和发展,以及使晚期ckd患者的心血管发病率和死亡率升高。
lp(a)是与apo(a)复合的低密度脂蛋白。apo(a)几乎仅在肝脏中产生,而lp(a)的血浆水平与apo(a)的产生高度相关(kostner,2013(72))。迄今为止,降低lp(a)的药理干预措施非常有限。用pcsk9抑制剂治疗可使lp(a)降低约35%(kotani,2017(29))。此外,烟酸还显示最多使lp(a)降低35%(carlson,1989(30))。
烟酸可能是由于抑制了肝脏的apo(a)基因表达,而降低lp(a)的血浆水平(chennamsetty,2012(31))。另外,这种药理作用可能与烟酸与g蛋白偶联受体gpr109a的结合有关(digby,2012(32))。烟酰胺是否也有降低lp(a)血浆水平的潜能尚不清楚。
因此,仍然需要进一步开发改进的方法,以预防和/或治疗升高的血清磷酸盐水平(高磷酸血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高,升高的血清磷酸盐水平(高磷酸血症)和/或血脂异常两者特别是由于肾衰竭引起的。
技术实现要素:
本发明解决了由慢性肾衰竭(ckd)引起的高磷血症和/或血脂异常的问题。本发明提供了包括药学上有效量的调释烟酰胺,其用于预防和/或治疗特别是由慢性肾衰竭(ckd)引起的高磷酸血症和/或血脂异常,以及用于治疗和预防终末期肾病(esrd)。药物制剂优选通过口服途径或肠胃外途径施用。本发明进一步解决了,在降低特别是ckd3-5期患者的血磷酸盐水平方面,可用的治疗选择功效有限的问题,因为改变饮食中磷酸盐摄入以及使用磷酸盐结合剂的治疗不能有效地减少中度ckd的磷酸盐负担(sprague,2009(59),oliveira,2010(60))。本发明还提供了包括药学上有效量的调释烟酰胺的药物制剂,用于预防和/或治疗特别是由于ckd第3~5阶段引起的高磷血症。
发明人还特别发现,由于双重作用方式,而在慢性肾病患者中有效降低了升高的血清磷酸盐水平。降低升高的血清磷酸盐水平已知药理基础,与烟酰胺诱导肠道中磷酸盐协同转运蛋白napi2b的降低有关,从而减少从食品中吸收磷酸盐。本发明表明,烟酰胺还降低了具有残余肾功能的个体中协同转运蛋白napi2b在肾脏中的表达,导致磷酸盐经肾脏排泄增加。与使用仅通过结合肠道中摄入食物的磷酸盐来发挥作用的常规磷酸盐结合剂进行治疗相比,这种双重作用方式更强有力地降低了升高的磷酸盐水平。
本发明涉及以调释制剂的形式,施用药学上有效量的烟酰胺。
在第一方面,本发明涉及包括药学上有效量的调释烟酰胺的药物制剂,其用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中,其中升高的血清磷酸盐水平(高磷血症)和/或血脂异常两者特别是由肾衰竭引起的,其中在ph约0.5至约1.5,在约2个小时的时间内,约25~55重量%的烟酰胺从所述药物制剂中释放出来。
在第二方面,本发明涉及包括调释烟酰胺的药物制剂,其中在ph约0.5至约1.5,在约2小时的时间内,约25~55重量%的烟酰胺从所述药物制剂中释放出来。
还公开了一种试剂盒,其包括第二方面的药物制剂和至少一种磷酸盐结合剂。
本发明的其他实施方式和优点可以从下面的描述、附图、实施例以及从附权利要求书中获得,但并不限于此。
附图说明
附图应示出本发明的实施方式并传达对其进一步的理解。结合描述,它们用作对本发明的概念和原理的解释。其他实施方式和许多所述的优点可以参考附图得出。附图的元素不必彼此成比例。除非另有说明,否则在附图中以相同的附图标记表示相同、功能上等效且作用相同的特征和部件。
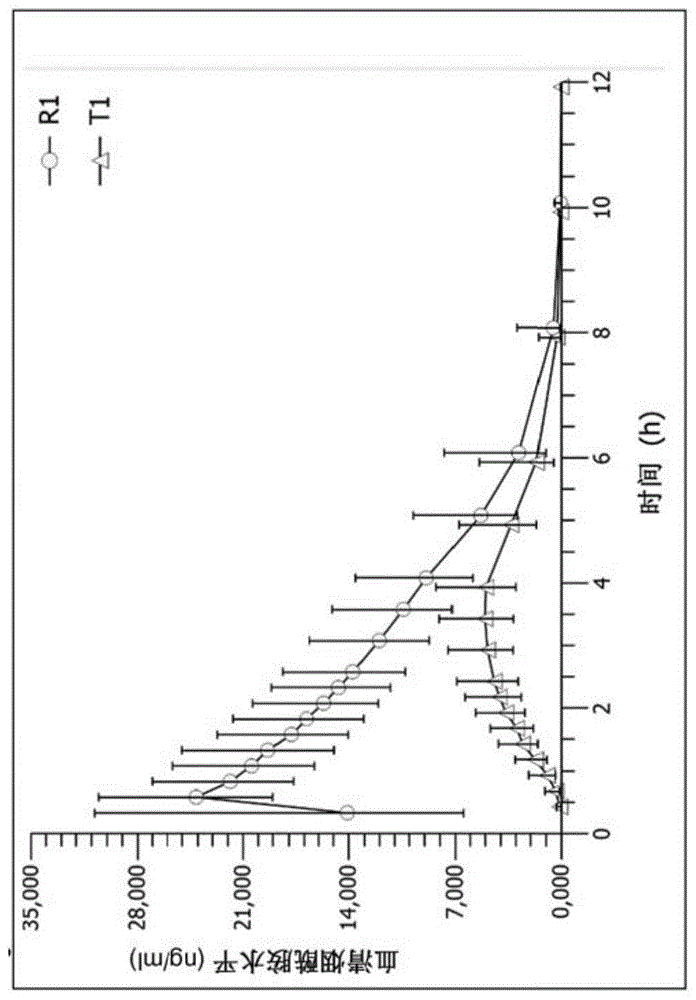
图1显示了在24名健康受试者中速释烟酰胺和调释烟酰胺的生物利用度之间的比较,其中,烟酰胺的剂量为1000mg,受试者在空腹和饱腹状态下接受随机、开放性、单剂量、2疗程4期、交叉研究。
图2显示了每天1000mg速释烟酰胺(每天以三种剂量(250mg-500mg-250mgp.o.))(ir-na)与每天1000mg调释烟酰胺(0mg-1000mg-0mgp.o;mr-na)之间的血清磷酸盐水平的比较。
图3显示了六种不同的烟酰胺缓释丸剂的释放动力学比较。
图4a显示了在慢性肾病的小鼠模型中napi2b蛋白表达的定量。在野生型小鼠(wt)中,腺嘌呤诱导的ckd导致napi2b磷酸盐协同转运蛋白的微弱减少,而利用磷酸盐结合剂司维拉姆处理则导致napi2b蛋白表达强烈上调。
图4b代表了在实验性诱导ckd的两种不同小鼠品系中的血清磷酸盐水平。在野生型小鼠(wt)中,腺嘌呤诱导的ckd导致磷酸盐水平显著升高。利用磷酸盐结合剂司维拉姆治疗不能降低血清磷酸盐的升高。相比之下,在napi2b敲除小鼠(napi-ko)中,进行司维拉姆治疗使升高的磷酸盐水平正常化,表明野生型动物中缺乏磷酸盐减少取决于磷酸盐协同转运蛋白napi2b的表达增强。
图5显示了在本实施例3中获得的结果。在手术诱导性ckd的小鼠模型中,利用磷酸盐结合剂碳酸镁(mg)处理导致napi2b蛋白表达的强烈增强。在使用烟酰胺(na)和磷酸盐结合剂联合治疗的情况下,完全消除了这种上调。
图6描绘了实施例3中获得的进一步结果。在相同的手术诱导性ckd小鼠模型中,烟酰胺治疗导致肾脏中napi2b蛋白表达的强烈增加。烟酰胺和磷酸盐结合剂碳酸镁的联合治疗进一步增强了肾脏的napi2b。单独使用碳酸镁治疗对肾脏的napi2b表达没有显著影响。
图7显示了烟酸在降低lp(a)中的假定作用方式的示意图。烟酸与烟酸受体grp109a特异性结合(tunaru2005(33))。配体结合后,g蛋白偶联受体抑制细胞内的腺苷酸环化酶,其中腺苷酸环化酶催化三磷酸腺苷(atp)生成环状单磷酸腺苷(camp)。载脂蛋白a基因的翻译受到抑制,因为该基因的启动子区域包括c-amp应答元件(camp-re)(gouni-berthold,2013(34))。
图8是在本实施例5中获得的结果,并且显示了用1%烟酸(a)或烟酰胺(b)治疗的转基因apo(a)小鼠中lp(a)血浆水平的降低。治疗1周后,仅烟酰胺显著降低了lp(a)水平。治疗2周后,lp(a)血浆水平比烟酸低50%以上,与基线水平相比低200%以上。
图9显示了与实施例7中筛查的itt群体相比,血清lp(a)浓度的差异。
图10描绘了在完成研究的患者中,在实施例8的试验期间血清磷酸盐浓度的进程。
图11显示了在接受血液透析的ckd患者中,响应于常规磷酸盐结合剂或替那帕诺与烟酰胺(na)组合(以mg配量、口服、每天一次)随时间(周)变化的磷酸盐水平(mmol/l)。
具体实施方式
定义
除非另有定义,否则本文使用的技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。本文提供的数值数据(如烟酰胺的单位剂量)必须理解为也涵盖“约”值。
本发明的磷酸盐结合剂也称为降磷酸盐试剂,并且本身是本领域已知的。根据本发明,在本发明的范围内也可以使用其它用于降低磷酸盐含量的磷酸盐结合剂。在本发明的范围内,术语“降磷酸盐试剂”和“磷酸盐结合剂”在本文中可互换使用。
包括调释烟酰胺的药物制剂是包括烟酰胺的药物制剂,其中药物制剂中包括的烟酰胺的全部剂量在服用药物制剂时不直接释放,而是在一定时间和/或一定时间后释放,即是延长释放制剂/缓释制剂的形式。它表明,烟酰胺的释放比通过相同途径施用的常规释放剂型(即,速释制剂)的释放慢。
药学上有效量的烟酰胺,例如调释烟酰胺,可以是药物制剂中一定量的烟酰胺,其可以在服用该药物制剂的部分受试者中达到治疗反应或所需效果。
关于本发明,升高的磷酸盐水平是超过医学指南所推荐的磷酸盐水平,例如超过约5.5mg/dl的血清磷酸盐水平,和/或约≥1.78mmol/l的血清磷酸盐水平。
在本发明中,血脂异常表示为患者中,特别是血液中,异常量的脂质(例如甘油三酸酯、胆固醇、脂肪磷脂)或其衍生物(例如脂蛋白)。根据某些实施方案,它是指脂质代谢的失调,特别是血清脂蛋白(a)(lp(a))水平的升高。
在第一方面,本发明涉及包括药学上有效量的调释烟酰胺的药物制剂,其用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调、特别是血清脂蛋白(a)(lp(a))水平升高的方法中,其中升高的血清磷酸盐水平(高磷血症)和/或血脂异常两者特别是由肾衰竭引起的;其中,在约2小时的时间内,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0,约25~55重量%,优选约27~约45重量%的烟酰胺从药物制剂中释放出来。根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2下溶解约2小时,然后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下溶解约4小时,至少约60重量%,优选至少约65重量%,进一步优选至少约70重量%的烟酰胺从药物制剂中释放出来。因此,对于释放至少约60重量%,优选至少约70重量%的烟酰胺,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0,然后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下的总处理时间约6小时。特别地,在体外,进一步特别地在常压(101325pa)和约20至约25℃,例如约22至约23℃,例如约22℃的室温下,烟酰胺在ph约0.5至约1.5下释放,并且任选地,随后进一步在ph约6.5至约7.5下释放。根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下溶解约2小时,随后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下溶解后,约15至约40重量%,优选17.5至37.5重量%的烟酰胺在约1.5小时中从药物制剂中释放出来;和/或,约40至约70重量%,优选约42.5至约67.5重量%,进一步优选约45至约65重量%的烟酰胺在约3小时中从药物制剂中释放出来;和/或,约65至约95重量%,优选约67.5至约92.5重量%,进一步优选约70至约90重量%的烟酰胺在约7小时中从药物制剂中释放出来。因此,根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下,约15至约40重量%,优选17.5至37.5重量%的烟酰胺在约1.5小时中从药物制剂中释放出来。根据某些实施方案,在体外,通过在线监测来测量烟酰胺的释放。根据某些实施方案,将药物制剂放入包括ph约1.0的0.1nhcl的第一容器中保持约2小时,约2小时后取出,然后立即置于包括ph约6.8的0.05n磷酸二氢钾缓冲液的第二容器中,用于测量烟酰胺的释放。根据某些实施方案,第一容器仅包括0.1n的hcl和/或第二容器仅包括0.05n的磷酸二氢钾缓冲液。替代0.1n的hcl和/或0.05n的磷酸二氢钾缓冲液,也可以使用其他合适的酸和/或缓冲液来提供约0.5至约1.5,例如约1.0至约1.2,例如约1.0的ph,和/或约6.5至约7.5,例如约6.7至约7.0,例如约6.8的ph。根据某些实施方案,烟酰胺在体外试验中释放,其中将片剂在相应容器中搅拌或不搅拌。根据某些实施方案,根据欧洲药典ph.eur.2.9.3,通过在100rpm下的篮子试验(baskettest),在体外测量烟酰胺的释放。
根据某些实施方案,用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中的、包括药学上有效量的调释烟酰胺的药物制剂,用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和血脂异常的方法中,两者特别是由肾衰竭引起的。根据某些实施方案,包括药学上有效量的调释烟酰胺的药物制剂用于预防和/或治疗血清磷酸盐水平升高(高磷血症)的方法中,其中所述药物制剂用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中,升高的血清磷酸盐水平(高磷血症)和血脂异常两者特别是由肾衰竭引起的。根据某些实施方案,包括药学上有效量的调释烟酰胺的药物制剂用于预防和/或治疗血脂异常的方法中,其中该药物制剂用于预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中,升高的血清磷酸盐水平(高磷血症)和血脂异常两者特别是由肾衰竭引起的。
本发明的第四方面还涉及预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法,其中升高的血清磷酸盐水平(高磷血症)和血脂异常两者特别是由肾衰竭引起的,所述方法使用包括药学上有效量的调释烟酰胺的药物制剂,其中在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下,在约2小时的时间,约25~55重量%,优选约27至约45重量%的烟酰胺从所述药物制剂中释放出来。该方法的实施方式对应于本发明的第一方面的实施方式。特别地,在ph约0.5至约1.5,并且任选随后在体外ph约6.5至约7.5,进一步特别地在常压和室温约20至约25℃,例如约22至约23℃,例如约22℃下,释放烟酰胺。根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下溶解约2小时,随后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下溶解后,在约1.5小时的时间,约15至约40重量%,优选约17.5至37.5重量%的烟酰胺在约1.5小时的时间内从药物制剂中释放出来;和/或,在约3小时的时间,约40至约70重量%,优选约42.5至约67.5重量%,进一步优选约45至约65重量%的烟酰胺从药物制剂中释放出来;和/或,在约7小时的时间,约65至约95重量%,优选约67.5至约92.5重量%,进一步优选约70至约90重量%的烟酰胺从药物制剂中释放出来。因此,根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下,在约1.5小时的时间,约15至约40重量%,优选17.5至37.5重量%的烟酰胺从药物制剂中释放出来。根据某些实施方案,在体外,通过在线监测测量烟酰胺的释放。根据某些实施方案,将药物制剂放入包括ph约1.0的0.1nhcl的第一容器中保持约2小时,约2小时后取出,然后立即置于包括ph约为6.8的0.05n磷酸二氢钾的第二容器中,用于测量烟酰胺的释放。根据某些实施方案,第一容器仅包括0.1nhcl,和/或第二容器仅包括0.05n的磷酸二氢钾缓冲液。除了0.1nhcl和/或0.05n磷酸二氢钾缓冲液之外,也可以使用其他合适的酸和/或缓冲液来提供约0.5至约1.5,例如约1.0至约1.2,例如约1.0的ph,和/或约6.5至约7.5,例如约6.7至约7.0,例如约6.8的ph。根据某些实施方案,烟酰胺在体外试验中释放,其中将片剂在相应容器中搅拌或不搅拌。根据某些实施方案,根据欧洲药典ph.eur.2.9.3,以100rpm的篮子试验在体外测量烟酰胺的释放。
根据某些实施方案,使用包括药学上有效量的调释烟酰胺的药物制剂来预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高(两者特别是由肾衰竭引起的)的方法,是预防和/或治疗升高的血清磷酸盐水平(高磷血症)和血脂异常的方法。根据某些实施方案,该方法是预防和/或治疗升高的血清磷酸盐水平(高磷血症)的方法。根据某些实施方案,该方法是预防和/或治疗血脂异常的方法。
除烟酰胺外,包括药学上有效量的调释烟酰胺的药物制剂,以及第四方面中使用的药物制剂可以包括不受特别限制的其他成分,例如至少一种药学上可接受的载体,至少一种调释剂和/或其他赋形剂,如抗粘剂、结合剂、包衣、色素、崩解剂、调味剂、填充剂、稀释剂、助流剂、润滑剂、防腐剂、吸附剂、甜味剂和/或没有特别限制的溶媒(vehicle);其中该药物制剂用于预防和/或治疗升高的血清磷酸盐水平和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中。根据某些实施方案,用于预防和/或治疗升高的血清磷酸盐水平的方法中的、包括药学上有效量的调释烟酰胺的药物制剂,以及用于第二方面的相应方法的药物制剂,包括至少一种调释剂。
根据某些实施方案,用于预防和/或治疗升高的血清磷酸盐水平和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中的药物制剂,以及在第四方面使用的药物制剂,包括经调释包衣覆盖的烟酰胺的配制物。根据某些实施方案,包括烟酰胺的配制物为丸剂的形式,即包括一个或多个丸粒,例如多个丸粒。然后可以将丸粒包括在合适的剂型中,如一个胶囊。调释包衣没有特别限制,并且可以由技术人员基于烟酰胺的释放值适当地设定。
根据某些实施方案,所述调释包衣包括至少一种结合剂和至少一种调释剂,优选其中所述调释剂包括乙基纤维素和/或羟丙基甲基纤维素,优选乙基纤维素和羟丙基甲基纤维素。根据某些实施方案,调释包衣包括重量比为约10:至约20:1,优选约12:1至约16:1,例如约14:1的乙基纤维素和羟丙基甲基纤维素。
根据某些实施方案,所述药物制剂为片剂、胶囊剂、口服制剂、粉剂、颗粒剂、锭剂、可重构粉剂、糖浆剂、溶液剂或混悬剂的形式。
根据某些实施方案,所述药物制剂为包括调释烟酰胺丸粒的胶囊的形式。胶囊的材料没有特别限制。根据某些实施方案,胶囊的材料不导致调释烟酰胺丸粒的延长释放,并且优选在ph约3或以下,例如约2或以下,或约1.5或以下立即溶解。根据某些实施方案,胶囊溶解与ph无关。
根据某些实施方案,高磷血症和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高,是由于慢性肾衰竭、终末期肾病和/或血液透析引起的。
根据某些实施方案,本发明药物制剂的受试者是哺乳动物,特别是人类,其中所述药物制剂包括药学上有效量的调释烟酰胺,用于预防和/或治疗升高的血清磷酸盐水平和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中,以及用于预防和/或治疗升高的血清磷酸盐水平和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp)(a))水平升高的相应方法中。
根据某些实施方案,所述药物制剂经肠胃外或口服施用,优选口服施用。
根据某些实施方案,烟酰胺以每天至多约2000mg的单位剂量,优选以每天约250至约2000mg,进一步优选每天约400至约1700mg,甚至进一步优选每天约500至约1500mg的单位剂量施用。
根据某些实施方案,烟酰胺将在餐前、餐中和/或餐后,例如在餐后1小时或30分钟内施用,和/或在睡前,例如在睡前1小时内或30分钟内施用,这与食物摄入以及血液透析或腹膜透析治疗前和/或后无关。根据某些实施方案,与食物摄入无关,包括药学上有效量的调释烟酰胺的药物制剂每天施用一次或两次,优选每天一次,进一步优选在睡前施用。特别是在睡前施用一次的情况下,可以避免同时服用磷酸盐结合剂,否则可能不利地影响烟酰胺作为辅助物的摄取。
根据某些实施方案,进一步施用至少一种磷酸盐结合剂。在这方面,对至少一种磷酸盐结合剂没有特别限制。
在这方面,对磷酸盐结合剂没有特别的限制,可以使用通常用于治疗高磷血症和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的那些磷酸盐结合剂。根据某些实施方案,磷酸盐结合剂是选自包括以下物质的组中的至少一种:
-钙基结合剂,例如乙酸钙、碳酸钙、钙镁盐,
-铝基结合剂,例如氯化铝和盐酸铝、氯化铝氢氧化物络合物,
-碳酸镧,
-碳酸镁,
-含铁的磷酸盐结合剂,例如柠檬酸铁、氢氧化蔗糖铁,和/或
-司维拉姆,碳酸司维拉姆或盐酸司维拉姆(聚合物),
-替那帕诺,或其他钠氢交换阻断剂,
-它们的组合。
根据某些实施方案,所述至少一种磷酸盐结合剂是选自包括以下物质的组中的至少一种:乙酸钙、钙镁盐、替那帕诺、司维拉姆、碳酸司维拉姆、碳酸钙、碳酸镁、碳酸镧、氯化铝氢氧化物络合物和其混合物。这些磷酸盐结合剂的络合物和/或加合物也是可能的,例如,与水的络合物和/或加合物。根据某些实施方案,所述磷酸盐结合剂包括碳酸镁或为碳酸镁。根据某些实施方案,所述磷酸盐结合剂包括钙镁盐或为钙镁盐。根据某些实施方案,所述磷酸盐结合剂包括或为替那帕诺。
根据某些实施方案,所述磷酸盐结合剂选自表14或表15中给出的磷酸盐结合剂。
通常的单位剂量可因所施用的磷酸盐结合剂而异,但至少对于某些患者而言,建议的每日剂量(kdigo2009、dimdi和whoatc定义的每日剂量)可以如下:
-钙基结合剂,例如乙酸钙(约5600~6300mg/d,例如约6000mg/d)、碳酸钙(约4000mg/d)、钙镁盐(约4000~4500mg/d,例如约4226mg/d),不超过建议的每日单位剂量的每天约1500mg基本钙;
-铝基结合剂,例如氯化铝,al9cl8(oh)19(约900~1800mg/d)和盐酸铝(约1800~12000mg/d),每日剂量为约1800mg/d;
-碳酸镧,每日剂量例如约3708mg/d,和/或平均日剂量是例如约2250mg/d;
-含铁的磷酸盐结合剂,例如柠檬酸铁、氢氧化蔗糖铁,每日剂量为约7200~7500mg/d;
-碳酸司维拉姆或盐酸司维拉姆(聚合物),每日剂量为约5600~6400mg/d;
-替那帕诺,每日剂量为约1~100mg/d。
上述剂量可以如上所述进行改变,并且可以由技术人员针对疾病和要治疗的个体患者,以及与所使用的烟酰胺的量和所选择的磷酸盐结合剂的种类的关系进行调整。
关于剂型中至少一种磷酸盐结合剂和/或烟酰胺的剂量,也可以参考人和兽医学中已建立的药理学原理。关于即用型药物的配制物,可参考“remington,《thescienceandpracticeofpharmacy(药学科学与实践)》”,第22版,2013,pp.777-1070。其内容通过引用并入本文中。
根据某些实施方案,包括药学上有效量的调释烟酰胺的药物制剂的施用时间与至少一种磷酸盐结合剂的施用时间不同,时间上相隔优选至少一小时,进一步优选至少两小时、甚至更优选至少三个小时。已发现磷酸盐结合剂(例如司维拉姆)可能会对烟酰胺的肠道吸收产生不利影响,这大概是通过与其复合导致的。因此,优选在不同时间施用磷酸盐结合剂和包括药学上有效量的调释烟酰胺的药物制剂。优选地,在服用包括药学上有效量的调释烟酰胺的药物制剂之后,与接着服用磷酸盐结合剂的时间相隔至少两个小时,优选至少三个小时,特别优选至少四个小时,以便烟酰胺可以在没有磷酸盐结合剂干扰的情况下长时间释放。优选地,在睡前服用包括药学上有效量的调释烟酰胺的药物制剂,以使与接着服用磷酸盐结合剂(其通常餐中服用)的时间差最大化。然而,服用包括药学上有效量的调释烟酰胺的药物制剂与服用磷酸盐结合剂的时间有足够差异的其他时间也是合适的。也不排除如果磷酸盐结合剂基本上不对烟酰胺的吸收产生负面影响,则将包括药学上有效量的调释烟酰胺的药物制剂与磷酸盐结合剂一起服用。
根据某些实施方案,特别是在与包括药学上有效量的调释烟酰胺的药物制剂同时施用时,所述至少一种磷酸盐结合剂不是司维拉姆和/或其衍生物,例如盐酸司维拉姆和/或碳酸司维拉姆。根据某些实施方案,所述至少一种磷酸盐结合剂是钙镁盐、替那帕诺、乙酸钙、碳酸镁、碳酸钙,和/或碳酸镧,和/或含铝的磷酸盐结合剂,和/或含铁的磷酸盐结合剂,例如是乙酸钙、碳酸钙,和/或碳酸镧,和/或含铝的磷酸盐结合剂,和/或含铁的磷酸盐结合剂,例如,如上面所给出的。
在第二方面,本发明涉及包括调释烟酰胺,特别是药学上有效量的调释烟酰胺的药物制剂,其中在ph约0.5至约1.5,在约2小时的时间,约25~55重量%的烟酰胺从药物制剂中释放出来。根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下溶解约2小时,然后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下溶解约4小时之后,至少约60重量%,优选至少约70重量%的烟酰胺从药物制剂中释放出来。因此,在ph约0.5至约1.5,约1.0至约1.2,例如约1.0,然后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8,释放至少约60重量%,优选至少约70重量%的烟酰胺的总处理时间为约6小时。根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0下溶解2小时,然后在ph约6.5至约7.5,例如约6.7至约7.0,例如约6.8下溶解之后,在约1.5小时的时间,约15至约40重量%,优选17.5至37.5重量%的烟酰胺从药物制剂中释放出来;和/或,在约3小时的时间,约40至约70重量%,优选约42.5至约67.5重量%,进一步优选约45至约65重量%的烟酰胺从药物制剂中释放出来;和/或,在约7小时的时间,约65至约95重量%,约67.5至约92.5重量%,进一步优选约70至约90重量%的烟酰胺从药物制剂中释放出来。因此,根据某些实施方案,在ph约0.5至约1.5,例如约1.0至约1.2,例如约1.0,在约1.5小时的时间,约15至约40重量%,优选17.5至37.5重量%的烟酰胺从药物制剂中释放出来。根据某些实施方案,通过在线监测,在体外测量烟酰胺的释放。根据某些实施方案,将药物制剂放入包括ph约1.0的0.1nhcl的第一容器中约2小时,约2小时后取出,然后立即置于包括ph约6.8的0.05n磷酸二氢钾的第二容器中,用于测量烟酰胺的释放。根据某些实施方案,第一容器仅包括0.1nhcl和/或第二容器仅包括0.05n的磷酸二氢钾缓冲液。除了0.1nhcl和/或0.05n磷酸二氢钾缓冲液之外,也可以使用其他合适的酸和/或缓冲液来提供约0.5至约1.5,例如约0.5至1.5,例如约1.0至约1.2,例如约1.0的ph,和/或约6.5至约7.5,例如约6.7至约7.0,例如约6.8的ph。根据某些实施方案,烟酰胺在体外试验中释放,其中将片剂在相应容器中搅拌或不搅拌。根据某些实施方案,根据欧洲药典ph.eur.2.9.3,以100rpm的篮子试验在体外测量烟酰胺的释放。
第二方面的药物制剂可以用作包括药学上有效量的调释烟酰胺的药物制剂,用于第一方面所述的预防和/或治疗升高的血清磷酸盐水平和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法中,或用于相应的方法中。
根据某些实施方案,所述药物制剂为片剂、胶囊剂、口服制剂、粉剂、颗粒剂、锭剂、可重构粉剂、糖浆剂、溶液剂或混悬剂的形式。
所述药物制剂的其他成分,例如至少一种药学上可接受的载体和/或其他赋形剂,不受特别限制。所述药物制剂可以包括药学上可接受的赋形剂,例如抗粘剂;结合剂;涂料;网络形成赋形剂;着色剂;崩解剂;香味剂;填充剂;稀释剂;助流剂,例如气相二氧化硅、滑石粉、硬脂酸镁和/或碳酸镁;润滑剂,例如滑石,二氧化硅和/或脂肪;防腐剂,例如抗氧化剂,例如维生素a,维生素e,维生素c等,氨基酸半胱氨酸和甲硫氨酸,柠檬酸及其盐,例如柠檬酸钠和/或合成防腐剂;吸附剂,例如干燥剂;甜味剂;水稳定剂;抗真菌剂和/或溶媒,其优选不与烟酰胺和/或至少一种磷酸盐结合剂相互作用。
这些赋形剂对于技术人员是众所周知的,例如。参见remington,《药物科学与实践》,第22版,2012年,第1卷:“药物科学(thescienceofpharmacy)”,第1049-1070页,关于药物赋形剂的内容通过引用并入本文。
根据某些实施方案,所述药物制剂包括配制物,该配制物包括被调释包衣覆盖的烟酰胺。根据某些实施方案,包括烟酰胺的配制物为丸剂形式。
调释包衣没有特别限制,可以由技术人员基于烟酰胺的释放值适当地设定。关于这种调释包衣的配方,可以参考例如,remington,《药物科学与实践》,第22版,2013年,第981、982、989-998页。其内容通过引用并入本文。
根据某些实施方案,所述调释包衣包括至少一种结合剂和至少一种调释剂,优选其中所述调释剂包括(甲基)丙烯酸酯共聚物,例如甲基丙烯酸铵共聚物和甲基丙烯酸甲酯共聚物;丙烯酸酯衍生物,例如丙烯酸乙酯;和/或纤维素衍生物,例如乙基纤维素和羟丙基甲基纤维素,例如乙基纤维素和羟丙基甲基纤维素。根据某些实施方案,所述调释包衣包括乙基纤维素和羟丙基甲基纤维素,其重量比为约10∶1至约20∶1,优选约12∶1至约16∶1,例如约14:1。
除烟酰胺外,上述丸剂可以包括一种或多种结合剂,例如糖类及其衍生物,例如:二糖,如蔗糖、乳糖;多糖及其衍生物,如淀粉、纤维素或改性纤维素,如微晶纤维素和纤维素醚,如羟丙基纤维素;糖醇,如木糖醇、山梨糖醇和麦芽糖醇;蛋白质,如明胶;或,合成聚合物,如聚乙烯吡咯烷酮或聚乙二醇等,例如微晶纤维素。覆盖有调释包衣的丸剂可以进一步包括:软化剂,例如癸二酸二丁酯、柠檬酸三丁酯、柠檬酸三乙酯,柠檬酸乙酰基三乙酯等,例如癸二酸二丁酯;和/或,分离剂和/或助流剂,如单硬脂酸甘油酯、滑石粉和/或胶态无水硅土。根据某些实施方案,所述丸剂包括微晶纤维素、乙基纤维素、癸二酸二丁酯、羟丙基甲基纤维素、单硬脂酸甘油酯、滑石粉和胶态无水硅土。
根据某些实施方案,所述药物制剂为包括调释烟酰胺丸粒的胶囊的形式。胶囊的材料不受特别限制。根据某些实施方案,胶囊的材料不导致调释烟酰胺丸粒延长释放,并且优选在ph约3或更低,例如约2或更低,或约1.5或更低下立即溶解。根据某些实施方案,胶囊溶解与ph无关。
胶囊可以是硬胶囊或软胶囊,例如硬胶囊,例如由胶囊帽和胶囊主体形成的硬胶囊,两者均不受特别限制,并且可以例如由包括以上列出关于药物制剂的药学上可接受的赋形剂。例如,胶囊帽可以包括如下材料:明胶;着色剂,例如二氧化钛、靛蓝胭脂红、黑色氧化铁和/或赤藓红;月桂基硫酸钠;和/或纯净水,和/或胶囊主体可以包括以下材料:明胶;二氧化钛;月桂基硫酸钠;和/或纯净水。
根据某些实施方案,所述药物制剂包括约100mg至约1500mg,优选约100mg至约500mg,例如约250mg的烟酰胺。
本发明的第三方面还涉及一种试剂盒,其包括第二方面的药物制剂和至少一种磷酸盐结合剂。在这样的试剂盒中,一种剂型可以例如包括调释烟酰胺,另一种可以包括至少一种磷酸盐结合剂。然后,该试剂盒中的两种或更多种剂型可以各自包括至少一种可以相同或不同的药学上可接受的载体。
在这方面,对所述磷酸盐结合剂没有特别的限制,可以使用通常用于治疗高磷血症和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的那些。磷酸盐结合剂也可以包括至少一种载体和/或药学上可接受的赋形剂,例如抗粘剂、结合剂、包衣、着色剂、崩解剂、调味剂、填充剂、稀释剂、助流剂、润滑剂、防腐剂、吸附剂、甜味剂、水稳定剂,抗真菌剂和/或溶媒,其优选不与烟酰胺和/或至少一种磷酸盐结合剂相互作用。
根据某些实施方案,所述磷酸盐结合剂是选自包括以下物质的组中的至少一种:
-钙基结合剂,例如乙酸钙、碳酸钙、钙镁盐,
-铝基结合剂,例如氯化铝和盐酸铝、氯化铝氢氧化物络合物,
-碳酸镁,
-碳酸镧,
-含铁的磷酸盐结合剂,例如柠檬酸铁、氢氧化蔗糖铁,和/或
-司维拉姆,碳酸司维拉姆或盐酸司维拉姆(聚合物),
-替那帕诺或其他钠氢交换阻断剂,
-它们的组合。
根据某些实施方案,所述至少一种磷酸盐结合剂是选自包括以下物质的组中的至少一种:乙酸钙、钙镁盐、替那帕诺、司维拉姆、碳酸司维拉姆、碳酸钙、碳酸镁、碳酸镧、氯化铝氢氧化物络合物,和它们的混合物。这些磷酸盐结合剂的络合物和/或加合物也是可能的,例如与水的络合物和/或加合物。根据某些实施方案,所述磷酸盐结合剂包括碳酸镁或为碳酸镁。根据某些实施方案,所述磷酸盐结合剂包括钙镁盐或为钙镁盐。根据某些实施方案,磷酸盐结合剂包括替那帕诺或为替那帕诺。
根据某些实施方案,所述磷酸盐结合剂选自表14或表15中给出的磷酸盐结合剂。
一般的单位剂量可能会因所施用的磷酸盐结合剂而异,而至少对于某些患者而言,建议的每日剂量(kdigo2009、dimdi和whoatc定义的每日剂量)可以如下:
-钙基结合剂,例如乙酸钙(约5600~6300mg/d,例如约6000mg/d)、碳酸钙(约4000mg/d)、钙镁盐(约4000~4500mg/d,例如约4226mg/d),不超过建议的每日单位剂量的每天约1500mg基本钙;
-铝基粘合剂,例如氯化铝,al9cl8(oh)19(约900~1800mg/d)和盐酸铝(约1800~12000mg/d),每日剂量例如为约1800mg/d;
-碳酸镧,每日剂量为例如约3708mg/d,和/或平均每日剂量为例如约2250mg/d;
-含铁的磷酸盐结合剂,例如柠檬酸铁、氢氧化蔗糖铁,每日剂量为约7200~7500mg/d;
-碳酸司维拉姆或盐酸司维拉姆(聚合物),每日剂量为约5600~6400mg/d;
-替那帕诺,每日剂量为约1~100mg/d。
上述剂量可以如上所述进行改变,可以由技术人员针对疾病和要治疗的个体患者,以及与所使用的烟酰胺的量和所选择的磷酸盐结合剂的种类的关系进行调整。
关于剂型中至少一种磷酸盐结合剂和/或烟酰胺的剂量,也可以参考人和兽医学中已建立的药理学原理。关于即用型药物的配制物,可参考“remington,《药物科学与实践》”,第22版,2013年,第777页-1070页。其内容通过引用并入本文。
根据某些实施方案,特别是在与包括药学上有效量的调释烟酰胺的药物制剂同时施用时,在所述试剂盒中的至少一种磷酸盐结合剂不是司维拉姆和/或其衍生物,例如,盐酸司维拉姆和/或碳酸司维拉姆。根据某些实施方案,所述试剂盒中的至少一种磷酸盐结合剂是乙酸钙、钙镁盐、替那帕诺、碳酸镁、碳酸钙和/或碳酸镧和/或含铝的磷酸盐结合剂和/或含铁的磷酸盐结合剂,例如乙酸钙、碳酸钙和/或碳酸镧和/或包括铝的磷酸盐结合剂和/或包括铁的磷酸盐结合剂,例如,上面所给出的。
所述试剂盒可用于治疗血清磷酸盐水平升高(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高,两者特别是由肾衰竭引起的,特别是其中所述高磷血症和/或血脂异常,特别是脂质代谢异常,特别是血清脂蛋白(a)(lp(a))水平升高是由慢性肾衰竭引起、终末期肾病和/或血液透析引起的。它可以肠胃外和/或口服施用,例如,在试剂盒的情况中,一种剂型可以肠胃外施用,而另一种可以口服施用。
在第五方面,进一步公开了一种药物制剂,该药物制剂包括药学上有效量的调释烟酰胺,如上文关于第一方面所定义的,用于预防和/或治疗处于慢性肾病4期和/或5期的患者(但排除正在接受透析治疗的患者)的升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的方法,其中升高的血清磷酸盐水平(高磷血症)和血脂异常两者特别是由肾衰竭引起的。根据某些实施方案,患者的肾小球滤过率为30ml/min/1.73m2或更小,10ml/min/1.73m2或更高,优选小于30ml/min/1.73m2且大于10ml/min/1.73m2,和/或不进行透析治疗。
在第六方面,还公开了一种方法,该方法使用包括药学上有效量的调释烟酰胺的药物制剂,例如如以上关于第二方面所定义的,来预防和/或治疗升高的血清磷酸盐水平(高磷血症)和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高,其中其中升高的血清磷酸盐水平(高磷血症)和血脂异常两者特别是由肾衰竭引起的。根据某些实施方案,所述方法被应用于肾小球滤过率为30ml/min/1.73m2或更低,10ml/min/1.73m2或更高,优选小于30ml/min/1.73m2且大于10ml/min/1.73m2的患者。
根据某些实施方案,第五方面和/或第六方面的药物制剂经肠胃外或口服,优选口服施用。
除了烟酰胺之外,用于第五方面的方法的包括药学上有效量的烟酰胺的药物制剂,以及在第六方面中使用的药物制剂,可以包括不受特别限制的其他成分,例如,至少一种药学上可接受的载体和/或赋形剂,例如抗粘剂;结合剂,例如糖及其衍生物,例如二糖,如蔗糖、乳糖;多糖及其衍生物,例如淀粉,纤维素或改性纤维素,例如微晶纤维素和纤维素醚,例如羟丙基纤维素;糖醇,如木糖醇,山梨糖醇和麦芽糖醇;蛋白质,如明胶;或合成聚合物,例如聚乙烯吡咯烷酮或聚乙二醇等,例如微晶纤维素;软化剂,如癸二酸二丁酯、柠檬酸三丁酯、柠檬酸三乙酯、柠檬酸乙酰基三乙酯等,例如癸二酸二丁酯,和/或分离剂和/或助流剂,如单硬脂酸甘油酯、滑石粉和/或胶态无水硅土;包衣;网络形成赋形剂;着色剂;崩解剂;风味剂;填料;稀释剂;助流剂,如气相硅土(silica)、滑石粉、硬脂酸镁和/或碳酸镁;润滑剂,如滑石、硅土和/或脂肪;防腐剂,例如抗氧化剂,例如维生素a、维生素e、维生素c等,氨基酸半胱氨酸和甲硫氨酸,柠檬酸及其盐,例如柠檬酸钠和/或合成防腐剂;吸附剂,如干燥剂;甜味剂;水稳定剂;抗真菌剂和/或溶媒,其优选不与烟酰胺和/或至少一种磷酸盐结合剂相互作用。
这些赋形剂对于技术人员是众所周知的,例如。参见remington,《药物科学与实践》,第22版,2012年,第1卷:“药物科学”,第1049-1070页,关于药物赋形剂的内容通过引用并入本文。
根据某些实施方案,第五方面和/或第六方面使用的药物制剂为片剂、胶囊剂、口服制剂,粉剂、颗粒剂、锭剂、可重构粉剂、糖浆剂、溶液剂或混悬剂的形式。根据某些实施方案,所述药物制剂包括含烟酰胺的配制物,烟酰胺可以为丸剂的形式,即包括一个或多个丸粒,例如大量丸粒。
根据某些实施方案,所述药物制剂为含烟酰胺丸剂的胶囊形式。胶囊的材料没有特别限制。根据某些实施方案,胶囊的材料不导致烟酰胺丸剂的延长释放,并且优选在ph约3或更低,例如约2或更低,或约1.5或更低下立即溶解。根据某些实施方案,胶囊的溶解与ph无关。
胶囊可以是硬胶囊或软胶囊,例如硬胶囊,例如由胶囊帽和胶囊主体形成的硬胶囊,两者均不受特别限制,并且可以例如包括以上关于药物制剂列出的药学上可接受的赋形剂。例如,胶囊帽可以包括以下材料:明胶;着色剂,例如二氧化钛、靛蓝胭脂红、黑色氧化铁和/或赤藓红;月桂基硫酸钠;和/或纯净水,和/或胶囊主体可以包括以下物质:明胶;二氧化钛;月桂基硫酸钠;和/或纯净水。
根据第五方面和/或第六方面的药物制剂的某些实施方案,所述受试者是哺乳动物,特别是人。
根据第五方面和/或第六方面的药物制剂的某些实施方案,烟酰胺以每天至多约2000mg的单位剂量施用,优选以每天约250至约2000mg的单位剂量施用,进一步优选以每天约400至约1700mg的单位剂量,甚至更优选以每天约500至约1500mg的单位剂量施用。
根据第五方面和/或第六方面的药物制剂的某些实施方案,烟酰胺要在餐前、餐中和/餐后施用,例如在餐后1小时或30分钟内施用,和/或在睡前施用,例如在睡前1小时内或30分钟内施用,这与食物摄入,以及血液透析或腹膜透析治疗前和/或后无关。
据第五方面和/或第六方面的药物制剂的某些实施例,独立于食物摄入,包括药学上有效量的烟酰胺的药物制剂每天施用一次或两次,优选每天施用一次,更优选在睡前施用。特别对于睡前施用一次的情况,可以避免同时服用磷酸盐结合剂,否则可能会对烟酰胺作为辅助物的服用产生负面影响。
根据第五方面和/或第六方面的药物制剂的某些实施例,进一步施用至少一种磷酸盐结合剂。
在这方面,对磷酸盐结合剂没有特别限制,可以使用通常用于治疗高磷血症和/或血脂异常,特别是脂质代谢失调,特别是血清脂蛋白(a)(lp(a))水平升高的那些磷酸盐结合剂。根据某些实施方式,所述磷酸盐结合剂选自包括以下物质的组中的至少一种:
-钙基结合剂,例如乙酸钙、碳酸钙、钙镁盐,
-铝基结合剂,例如氯化铝和盐酸铝、氯化铝氢氧化物络合物,
-碳酸镁,
-碳酸镧,
-含铁的磷酸盐结合剂,例如柠檬酸铁、氢氧化蔗糖铁,和/或
-司维拉姆、碳酸司维拉姆或盐酸司维拉姆(聚合物),
-替那帕诺,或其他钠氢交换阻断剂,
-它们的组合。
根据某些实施方案,所述至少一种磷酸盐结合剂是选自包括以下物质的组中的至少一种:乙酸钙、钙镁盐、替那帕诺、司维拉姆、碳酸司维拉姆、碳酸钙、碳酸镁、碳酸镧、氯化铝氢氧化物络合物,和它们的混合物。这些磷酸盐结合剂的络合物和/或加合物也是可能的,例如与水的络合物和/或加合物。根据某些实施方案,所述磷酸盐结合剂包括碳酸镁或为碳酸镁。根据某些实施方案,所述磷酸盐结合剂包括钙镁盐或为钙镁盐。根据某些实施方案,所述磷酸盐结合剂包括替那帕诺或为替那帕诺。
根据某些实施方案,所述磷酸盐结合剂选自表14或表15中给出的磷酸盐结合剂。
一般的单位剂量可根据使用的磷酸盐结合剂而变化,但至少对于某些患者,建议的每日剂量(kdigo2009,dimdi和whoatc规定的每日剂量)可以如下所示,
-钙基结合剂,例如乙酸钙(约5600~6300mg/d,约6000mg/d)、碳酸钙(约4000mg/d)、钙镁盐(约4000~4500mg/d,约4226mg/d),不超过每天约1500mg基本钙的推荐单位剂量;
-铝基结合剂,例如氯化铝、al9cl8(oh)19(约900~1800mg/d)和盐酸铝(约1800~12000mg/d),每日剂量为例如约1800mg/d;
-碳酸镧,每日剂量为例如约3708mg/d,和/或平均每日剂量为例如约2250mg/d;
-含铁的磷酸盐结合剂,如柠檬酸铁、氢氧化蔗糖铁,每日剂量约为7200~7500mg/d;
-碳酸司维拉姆或盐酸司维拉姆(聚合物),每日剂量约为5600~6400mg/d;
-替那帕诺,钠氢交换阻断剂,每日剂量约为1~100mg/d。
上述剂量可以如上所述进行改变,并且可以由技术人员针对疾病和要治疗的个体患者,以及与所使用的烟酰胺的量和所选择的磷酸盐结合剂的种类的联系来进行调整。
关于剂型中至少一种磷酸盐结合剂和/或烟酰胺的剂量,也可以参考人和兽医学中已建立的药理学原理。关于即用型药物的制剂,可参考“remington,《药学科学与实践》”,第22版,2013,pp.777-1070。其内容通过引用并入本文。
根据第五方面和/或第六方面的药物制剂的某些实施方案,包括药学有效量的烟酰胺的药物制剂在与至少一种磷酸盐结合剂施用不同的时间施用,特别是如果至少一种磷酸盐结合剂对烟酰胺的吸收有负面影响,则优选相隔至少一小时,进一步优选至少两小时,甚至进一步优选至少三小时。已发现磷酸盐结合剂(例如司维拉姆)可能会对烟酰胺的肠道吸收产生不利影响,这大概是与烟酰胺复合导致的。因此,根据某些实施方案,特别是如果至少一种磷酸盐结合剂对烟酰胺吸收有负面影响,则在不同的时间给予磷酸盐结合剂和包括药学上有效量的烟酰胺的药物制剂。优选地,在服用包括药学上有效量的烟酰胺的药物制剂之后,与接着服用磷酸盐结合剂的时间相隔至少一小时,优选为至少两小时,特别优选为至少三小时,以便烟酰胺可以在不受磷酸盐结合剂干扰的情况下进行释放。根据某些实施方案,例如当烟酰胺不立即从药物制剂中释放时,在睡前服用包含药学上有效量的烟酰胺的药物制剂,从而使接着服用磷酸盐结合剂(其通常在餐中服用)的时间差最大化。然而,服用包括药学上有效量的烟酰胺的药物制剂与服用磷酸盐结合剂的时间有足够差异的其他时间也是合适的。如果磷酸盐结合剂基本上不对烟酰胺的吸收产生负面影响,则不排除包括药学上有效量的烟酰胺的药物制剂与磷酸盐结合剂一起服用。
根据某些实施方案,特别是与包括药物上有效量的烟酰胺的药物制剂同时施用时,所述至少一种磷酸盐结合剂不是司维拉姆和/或其衍生物,例如,不是盐酸司维拉姆和/或碳酸司维拉姆。根据某些实施方案,所述至少一种磷酸盐结合剂是乙酸钙、钙镁盐、替那帕诺、碳酸镁、碳酸钙和/或碳酸镧和/或含铝的磷酸盐结合剂和/或含铁的磷酸盐粘合剂,例如乙酸钙、碳酸钙和/或碳酸镧和/或含铝的磷酸盐粘合剂和/或含铁的磷酸盐粘合剂,例如上面所给出的。
如果合适,上述实施方式可以任意组合。本发明的其他可能的实施方案和实施方式还包括在前面或下面关于本发明的实施例未明确提及的特征的组合。特别地,本领域技术人员还将增加各个方面,作为对本发明的各基本形式的改进或增加。
实施例
现在将参考本发明的几个实施例详细描述本发明。但是,这些实施例仅是说明性的,并不限制本发明的范围。
实施例1-1:速释烟酰胺与调释烟酰胺的生物利用度
本发明是值得注意的,因为人们期望用速释烟酰胺(ir-na)的治疗足以抑制磷酸盐协同转运蛋白napi2b。然而,发明人已经表明,速释烟酰胺的生物利用度、功效和安全性与调释烟酰胺(mr-na)的不同,从而在人体内产生不同的药代动力学特征和临床生理作用。
使用以下成分(每粒胶囊的近似质量),来制备包括调释烟酰胺丸粒的调释(mr)烟酰胺硬明胶胶囊:
-作为活性药物成分,烟酰胺的使用量为250mg。此外,在调释丸粒中使用了以下赋形剂:微晶纤维素(107.143mg;粘合剂),乙基纤维素(17.857mg;调释剂),癸二酸二丁酯(1.786mg;软化剂),羟丙基甲基纤维素(1.276mg;调释剂),单硬脂酸甘油酯(0.918mg;分离剂),微粉化滑石粉(0.204mg;分离剂),胶态无水硅土(0.204mg;分离剂,助流剂)。
-胶囊由胶囊盖和胶囊主体组成。胶囊盖由以下成分组成:明胶(31.992mg)、二氧化钛(0.384mg)、靛蓝胭脂红(0.200mg)、黑色氧化铁(0.157mg)、赤藓红(0.023mg)、月桂基硫酸钠(0.077mg)、纯净水(5.568mg),胶囊盖的总质量为38.4mg。胶囊主体由以下成分组成:明胶(47.981mg)、二氧化钛(1.152mg)、月桂基硫酸钠(0.115mg)、纯净水(8.352mg),胶囊主体的总质量为57.600mg。胶囊根据用于生产胶囊的常规程序来生产。
为了生产丸粒,将烟酰胺、微晶纤维素和纯净水(在干燥过程中除去)称重,混合并造粒,挤出以形成粒棒,以潮湿形式切割,滚圆,干燥并分级。对于调释包衣,将乙基纤维素、癸二酸二丁酯、羟丙基甲基纤维素和单硬脂酸甘油酯,与乙醇混合(在干燥过程中除去)并悬浮。该悬浮液用于包敷丸粒。干燥后,将微粉化滑石粉和二氧化硅(胶体无水硅土)的1:1(w/w)混合物分散到干燥的经包敷的丸剂上。之后,将丸粒过筛并封装。例如,生产包括105.000kg烟酰胺、45.000kg微晶纤维素、7.500kg乙基纤维素、0.750kg癸二酸二丁酯、0.536kg羟丙基甲基纤维素,0.386kg单硬脂酸甘油酯和0.170kg滑石粉与胶体无水硅土的1:1混合物的一个批次,要使用37.500kg纯净水和60.000kg乙醇。
作为比较例,使用了可商购的速释(ir)烟酰胺片剂(烟酰胺5×200mg
首先,测试mr丸剂的烟酰胺释放。图3中显示了单电荷(singlecharges)的示例性释放谱线。显示了在六种不同的溶出制剂(容器)中,在类似于肠道的ph条件下,六种不同电荷的调释(mr)烟酰胺的体外溶出谱线。根据欧洲药典,ph.eur.2.9.3,以100rpm的篮子试验在体外测量烟酰胺的释放。mr配制物可以在8小时内连续释放烟酰胺。
然后,在处于空腹和饱腹状态,接受随机、非盲、单剂量、2疗程4期、交叉研究的24名健康受试者中,以1000mg的剂量对mr胶囊和ir丸剂进行测试(35)。在这项研究中,与速释配制物相比,调释胶囊显示出显著更低的生物利用度,和较少出现突发性不良事件。
图1显示了速释烟酰胺(r1,圆圈)与调释烟酰胺(t1,三角形)的生物利用度研究结果。图1显示了摄入单次量1000mg速释烟酰胺(r1)和1000mg调释烟酰胺(t1)后,烟酰胺血清水平的浓度时间曲线。与ir配制物(空腹状态)相比,调释(t1)烟酰胺配制物显示烟酰胺的生物利用度显著较低,调释配制物的auc(曲线下面积)为28%;与ir配制物(空腹状态)相比,调释配制物的c最大为20%;调释配制物的t最大为3.75小时,而ir配制物(r1)的t最大为0.50小时。
进一步的研究结果见表4。
表4:在24名健康受试者中,1000mg剂量的速释烟酰胺(对照)和调释烟酰胺(试验)的安全性结果概述(35);不良事件以及认为与研究药物合理相关的事件的总数,速释配制物是调释配制物的两倍。
与速释配制物相比,调释配制物的较低auc,以及在c最大、t最大和其他药代动力学参数上观察到的差异本身并不是意外的发现,可以在许多调释配制物中看到。然而,这些药代动力学上的差异通常会导致不同的临床表现。然而,使用目前的250mg调释胶囊,在降低血清磷酸盐水平方面显示出可比的甚至更好的临床疗效。
实施例1-2和1-3:其他包括调释烟酰胺的药物制剂的制备
除非另有说明,使用以下成分(每胶囊给予近似质量),用与实施例1.1相同的方式,来制备包括调释烟酰胺丸粒的调释(mr)烟酰胺胶囊。
实施例1-2
实施例1-2的丸剂以与实施例1-1相同的方式来制备(除了使用滑石粉代替单硬脂酸甘油之外),其具有以下量的各组分:烟酰胺(250.00mg)、微晶纤维素(107.14mg)、乙基纤维素(18.00mg)、癸二酸二丁酯(1.29mg)、羟丙基甲基纤维素(1.29mg)、滑石粉(5.14mg)、滑石粉(0.89mg)、胶体无水硅土(0.89mg)。
如用相对于图3所描述的篮子试验所测量的,实施例1-3中获得的药物制剂显示,在ph约1.0,在2小时的时间段内,约25~55重量%的烟酰胺从药物制剂中释放出来,在ph约1.0下溶解约2小时的时间,随后在ph约6.8下溶解约4小时后,70重量%的烟酰胺从药物制剂中释放出来。
实施例1-3:
与实施例1-1的两种类型的丸剂(速释和调释,例如缓释)相比,丸剂被组合在一个胶囊中。与实施例1-1类似地生产未经包敷的ir丸剂,但使用水性包敷方法包敷缓释丸剂。
使用了以下组分:
烟酰胺(190.000mg)、微晶纤维素(81.43mg)、乙基纤维素(14.18mg)、氢氧化铵(0.93mg),癸二酸二丁酯(3.02mg)、油酸(1.66mg)、胶体无水硅土(1.51mg),滑石粉(0.37mg)、胶体无水硅土(0.37mg)。
如用相对于图3所描述的篮子试验所测量的,实施例1-3中获得的药物制剂显示,在ph约为1.0,在2小时的时间段内,约25~55重量%的烟酰胺从药物制剂中释放出来,在ph约1.0下溶解约2小时的时间,随后在ph约6.8下溶解约4小时后,至少约70重量%的烟酰胺从药物制剂中释放。
实施例2:ii期剂量发现和概念验证研究(36)
作为250mg剂量的调释烟酰胺胶囊,将在实施例1-1中生产的调释烟酰胺胶囊用于实施例2中。对于更高的剂量,则应用多个胶囊,即500mg、750mg和1000mg的剂量使用两个、三个或四个胶囊。
作为本研究的比较例,对于150kg批次的ir丸剂,以105.0kg烟酰胺、45.0kg微晶纤维素、37.5kg纯净水的量,与微晶纤维素(70wt.%烟酰胺和30wt.%微晶纤维素)和纯净水混合,然后制粒、挤出、滚圆、干燥和分级,来生产含250mg烟酰胺的速释(ir)丸剂。
在这项随机研究中,研究了252名接受血液透析的患者,其接受长达8周的烟酰胺治疗。在双盲设置下,以每日剂量250mg、500mg、750mg和1000mg给予调释烟酰胺(mr)。另外,研究了实施例2中生产的1000mg速释烟酰胺(ir)的安全性和功效。每天给予一次1000mg烟酰胺调释胶囊,而每天以三剂量(250mg-500mg-250mgp.o.)给予速释片剂。
该试验的主要问题是,基于随机给药后4周的血清磷酸盐浓度值,烟酰胺调释胶囊是否存在剂量反应依赖性。次要结果标准包括,利用几种安全性和有效性的措施,比较两种不同的烟酰胺盖仑制剂。
验证性分析显示,在磷酸盐水平降低上,具有显著(p<0.0001)二次剂量响应形状。相对于独立基线组(使用1000mgir的值,称为比较组),为了达到0.22603mmol/l磷酸盐水平降低的效果,需要450mg烟酰胺的最小有效剂量。
关于次要终点,对于所有磷酸盐相关的功效指标(efficiencymeasure),均观察到了显著的治疗效果。关于两种不同盖仑制剂的比较,该实施例揭示了关于预定功效终点的异质结果。如图2所示,次要结果指标显示,在持续治疗的8周,调释和速释配制物对于血清磷酸盐水平的平均降低,具有相似的临床疗效。
本文中的图2显示了每天给予1000mg(ir-na=速释烟酰胺,实线),每天以三种剂量(250mg-500mg-250mgp.o.)给予的示例性速释烟酰胺,与每天给予1000mg(0mg-1000mg-0mg,p.o.;mr-na=调释烟酰胺,虚线)的调释烟酰胺,并且在持续8周的治疗期内,显示出血清磷酸盐水平平均降低的相似功效。
其他次要结果指标总结在下表5中。
表5:在治疗结束时,实施例的预定次要结果指标。关于两个1000mg剂量组,调释制剂(mr)显示出与速释制剂(ir)相当或甚至更好的结果。突出了小组差异大于15%的次要结果指标。
虽然平均血清磷酸盐水平显示出速释配制物和调释配制物之间没有差异,但与基线血清磷酸盐水平的差异,以及符合响应者标准的患者比例(血清磷酸盐水平<1.78mmol/l和<1.52mmol/l)显示出组均大于15%的差异,调释制剂具有优势。
临床安全性和耐受性。
由于不良事件随着患者的每日烟酰胺摄入量从16.7%(250mg/dmr)增至24.5%(1.000mg/dmr))而增加,导致试验中止。经速释配制物治疗后,观察到与不良事件相关的试验中止的次数最高(n=17(33.3%)),参见表6。
表6:不同donato(36)治疗组的研究中止和不良事件总结。在接受ir烟酰胺治疗的情况下,更多的患者因不良事件而中止治疗,更多的不良事件被评估为与药物相关。
在研究性治疗下,252例患者中有182例报告了485件不良事件(占72%)。对于调释制剂,被评估为与研究药物可能(possible)相关,很可能(probably)相关或相关的不良事件在26.7%至38.7%的范围内。在治疗组1000mgir中这个数字更高(44.1%)。对两个1000mg治疗组的直接比较显示,与mr配制物相比,ir烟酰胺治疗下与治疗相关的ae增加了近40%。因此,与1000mgmr治疗组相比,ir配制物因ae导致的研究中止要高31%(17对13例患者,参见表6)。
总之,本实施例揭示了,与速释配制物相比,调释配制物具有至少相当,对于几个预定次级终点而言甚至更好的功效。尽管功效更好,在调释治疗下,更少的患者经历与药物相关的副作用,并且更少的患者因不良事件而中止治疗。
在本实施例中,还测量了在透析患者的稳态条件下的烟酰胺的血浆水平。如表7所示,与药代动力学试验类似,mr配制物的生物利用度比ir配制物低得多。这与两次试验中观察到的调释配制物具有更好的安全性相符。相比之下,mr配制物在降低升高的血浆磷酸盐水平方面具有相当或甚至更好的功效,确实是出乎意料的。
药效学作用的出乎意料的差异对应于两种配制物的代谢差异。在母体药物下,还测量了烟酰胺腺嘌呤二核苷酸(nad)和n-甲基烟酰胺的血浆水平。nad是烟酰胺大多数生理作用必不可少的代谢产物(参见yang,2004(37)),与烟酰胺相比,n-甲基烟酰胺也与特定的生理功能有关(参见mogielnicki,2007(38))。尽管在使用mr配制物治疗时,母体药物具有相当低的生物利用度,但两种代谢物的血浆水平仍比使用ir配制物治疗高45~50%(请参见表8和9)。因此,两种配制物的风险-收益率差异可能基于代谢的差异,从而导致配制物代谢物生物利用度的特定模式。
表7:在基线和在治疗8周后的血浆烟酰胺水平。在每天1000mg调释烟酰胺(mr)的治疗下,血浆水平比1000mg速释配制物(ir)低三倍。
表8:在基线和在治疗8周后的烟酰胺代谢产物烟酰胺腺嘌呤二核苷酸(nad)的血浆水平。在每天1000mg调释烟酰胺(mr)的治疗下,血浆水平比1000mg速释配制物(ir)高45%。
表9:在基线和在治疗8周后,烟酰胺代谢产物n-甲基烟酰胺的血浆水平。在每天1000mg调释烟酰胺(mr)的治疗下,血浆水平比1000mg速释配制物(ir)高49%。
实施例3:
组合疗法在高磷血症的治疗中特别有前景,因为烟酰胺的药理学靶点,协同转运蛋白napi2b在磷酸盐结合剂的治疗下被上调。在这方面,还应再次指出,因为磷酸盐结合剂会对烟酰胺的吸收产生负面影响,例如如司维拉姆和/或其衍生物,因此调释烟酰胺可以减轻此类磷酸盐结合剂同时给药时的这些负面影响。
肠道磷酸盐的吸收有两种不同的机制。在正常饮食中磷可利用的条件下,被动细胞旁路扩散占磷吸收的大部分。在饮食磷酸盐限制的情况中,或用防止肠道磷酸盐吸收的磷酸盐结合剂处理下,提高主动协同转运蛋白驱动的吸收过程,从而提高食品中磷酸盐的生物利用度。为了研究napi2b协同转运蛋白对肾脏疾病中肠道磷酸盐吸收的贡献,在野生型(wt)或条件性napi2b基因敲除小鼠(napi-ko)中,通过腺嘌呤处理来诱导了肾脏损伤(schiavi2012(39))。图4a和图4b显示了此研究的结果。图4a,b来自schiavi2012(39),显示了相比于β-肌动蛋白,磷酸钠协同转运蛋白2b(napi2b)表达的相对量,并且证明与对照(食物(chow))相比,在ckd(腺嘌呤)中降低,而在磷酸盐结合剂处理下(腺嘌呤+司维拉姆)在ckd动物中显著增加。在napi2b敲除小鼠(napi-ko)中未观察到napi2b的表达。与腺嘌呤相比,#p<0.05。图4b,改编自:schiavi2012(39),显示了在野生型(wt)和napi2b基因敲除小鼠(napi-ko)中的血清磷酸盐(pi)平衡。在尿毒症(腺嘌呤)野生型小鼠中,pi显著升高。这种作用在尿毒症的napi-ko小鼠中减弱了。磷酸盐结合剂处理(腺嘌呤+司维拉姆)使napi-ko小鼠体内的pi正常化,而wt小鼠中pi水平的升高仍然不受影响,这表明磷酸盐结合剂处理被napi2b协同转运蛋白的补偿性调节所抵消。
在野生型小鼠中,腺嘌呤处理使肠道napi2b蛋白表达降低了50%,而这些动物在磷酸盐结合剂治疗下,协同转运蛋白增加了6倍(图4a),而在napi-ko小鼠中则未检测到协同转运蛋白。尽管野生型小鼠的磷酸盐水平显著高于napi-ko小鼠,但腺嘌呤处理通常导致高磷血症(图4b)。在野生型小鼠中,磷酸盐结合剂处理不影响高磷血症,而napi-ko小鼠在结合剂处理下是正常磷血(图4b),这表明在野生型小鼠中,napi2b的上调完全抵消了由于结合剂处理而降低的磷酸盐可利用性。在与烟酰胺联合治疗下,完全消除了磷酸盐结合剂引发的napi2b上调。
另外,研究了烟酰胺处理对小鼠模型(dba/2小鼠)中肠道napi2b蛋白表达的影响。
为此,使用5/6肾切除的dba/2小鼠作为血管钙化的模型。小鼠使用饮用水中浓度为600μg/ml的烟酰胺(na)进行处理。
在高磷酸盐饮食(磷含量1.03%(w/w);基本食品组成[%(w/w)]:干物质:87.7;粗蛋白(nx6.25)19;粗脂肪3.3;粗纤维4.9;粗灰分6.4;无氮提取物54.1;淀粉36.5;糖4.7;钙0.9;磷酸盐1.03;镁0.22)的健康dba/2小鼠中,该处理仅导致s-磷酸盐减少。na,磷酸盐结合剂镁(mg)和na+mg联合治疗,导致部分磷酸盐清除率降低和fgf23降低。na显示对小肠的napi2b-rna和相应的协同转运蛋白含量没有任何影响。mg导致napi2b-协同转运蛋白明显增加,而na+mg再次导致减少。
在该模型中,肾病的诱导导致napi2b表达减少超过50%,而利用磷酸盐结合剂碳酸镁处理7周导致协同转运蛋白表达增加10倍(图5)。磷酸盐结合剂和烟酰胺的联合处理完全恢复了协同转运蛋白的上调,这表明napi2b抑制在磷酸盐结合剂处理下是特别有用的。
图5显示了慢性肾病(ckd)小鼠模型中napi2b的免疫荧光。利用磷酸盐结合剂碳酸镁处理可以大大增强肠道napi2b的蛋白密度(ckdmg),而烟酰胺和磷酸盐结合剂(ckdnamg)的联合处理则可以完全防止napi2b的过表达。在图5中,显示了napi2b蛋白的肠道(回肠)表达的量化。给出了在经烟酰胺(ctrl+na)处理的对照dba/2小鼠、5/6肾切除小鼠(ckd)、经烟酰胺处理的ckd小鼠(ckd+na)、经烟酰胺和磷酸盐结合剂(碳酸镁)处理的ckd小鼠(ckd+na+mg)和经磷酸盐结合剂处理ckd小鼠(ckd+mg)中,napi2b蛋白免疫荧光的量和标准偏差。ckd导致了napi2b(ckd)的表达略有降低,而用磷酸盐结合剂处理ckd小鼠则大大增加了napi2b蛋白(ckd+mg)。在烟酰胺(ckd+na+mg)的附加处理下,这种上调被完全消除。条柱之间的棒(bar)表示组间的显著差异(采用图基事后检验法(tukeyposttest)的anova,p<0.05)。
因此,新的研究强烈表明,通过以下方式,降低磷酸盐负担的烟酰胺处理,在与旨于限制肠道磷酸盐可利用性的治疗方法(即饮食磷酸盐限制以及口服磷酸盐结合剂)的联合治疗中特别有效:
(1)解决肠道磷酸盐可利用性的生理补偿上调,其限制了现有高磷血症治疗方案的治疗效果。
(2)在其药理学靶标napi2b协同转运蛋白被上调的情况下,增强烟酰胺治疗的治疗效果。
烟酰胺通过提高ckd1~5期和残余肾功能患者中的磷酸钠协同转运蛋白napi2b的肾脏表达来预防高磷血症。
新观察到的磷酸盐结合剂和烟酰胺联合处理对肠道磷酸盐协同转运蛋白表达的生理学相互作用表明,这种新的干预措施应该可用作药物干预措施,以治疗ckd患者和肾病终末期患者的高磷血症。在ckd的dba/2小鼠模型中进行的烟酰胺作用临床前研究也首次揭示了一种新的二次作用模式,该二次作用模式可以减轻磷酸盐的负担,特别是在具有残余肾脏功能的中度肾病患者中减轻磷酸盐的负担。
根据表2,肾脏表达三种不同的磷酸盐协同转运蛋白(napi2a、napi2c、pit2)。它们位于肾小管器官的近端部分,位于肾上皮细胞的顶面(forster,2013(56))。它们的生理作用是从原尿中重新吸收过滤掉的磷酸盐。最近,在大鼠的肾脏中发现了磷酸盐协同转运蛋白napi2b(suyama,2012(11))。与上述协同转运蛋白相比,napi2b在泌尿道周围的上皮细胞的基底外侧表达,表明其生理作用是增强肾脏中的基础磷酸盐的排泄水平。与这一假设相符,在高磷饮食下,肾脏napi2b的表达会大大增强(suyama,2012(11))。此外,在腺嘌呤诱导的ckd小鼠模型中,napi2b的肾脏表达也显著升高,而napi2a和napi2c的表达降低(pulskens,2015,(57))。
本发明人探索了烟酰胺处理,对5/6肾切除的dba/2小鼠中肾脏napi2b协同转运蛋白表达的影响。如前所述(pulskens,2015(57)),ckd诱导了肾脏napi2brna以及肾脏蛋白表达的增强。相比之下,如图6所示,烟酰胺处理导致肾脏napi2b表达强烈且显著的增强。
图6在其中显示了napi2b蛋白的肾脏表达的量化。显示了在经烟酰胺处理的对照dba/2小鼠(ctrl+na)、5/6肾切除的小鼠(ckd)、经烟酰胺处理的ckd小鼠(ckd+na)、经磷酸盐粘合剂碳酸镁处理的小鼠(ckd+mg)和经烟酰胺和磷酸盐结合剂处理的动物(ckd+na+mg)中,napi2b蛋白免疫荧光的量和标准偏差。ckd导致napi2b在其余肾脏组织中的表达略有增强。用烟酰胺处理ckd小鼠,大大增加了napi2b蛋白信号。此外,在与磷酸盐结合剂的联合处理下,napi2b协同转运蛋白进一步增加,而仅使用磷酸盐结合剂处理与基线相比没有显著差异。条柱之间的棒表示组间的显著差异(采用tukeyposttest的anova,p<0.05)。
因此,在这种中度ckd的动物模型中,首次可以证明烟酰胺激发了双重作用模式,减少肠道中napi2b的表达(图5)以及增强肾脏中napi2b的表达。肠道napi2b表达降低会降低肠道磷酸盐的摄取,而肾脏napi2b表达增强会增强肾脏部分磷酸盐的排泄率。因此,两种药理作用协同地降低了ckd中的全身磷酸盐负荷。当前的实验数据表明,烟酰胺对中度肾病的高磷血症的预防和治疗特别有效。
实施例4:
为了进一步测试经调释烟酰胺处理的不良反应,进行了有关速释烟酰胺的副作用,特别是潮红(flush)和血小板减少症的文献检索。
表10显示了所考虑的文献。
从文献综述中,在总共368例患者中,5.4%表现出血小板减少症,2.7%出现潮红。相比之下,这些副作用在实施例中使用的本发明的调释烟酰胺中未观察到。
发明人得出的结论是,以每天高达1500mg的剂量,一天摄入一次调释烟酰胺能有效降低升高的血磷水平。与每日三次摄入的速释烟酰胺相比,调释烟酰胺更加有效,并且引起更少的药物不良反应。更好的风险收益率与调释和速释烟酰胺在人类体内的代谢的特定差异有关。如表7至表9所示,donato试验(36)显示,与速释配制物相比,在调释配制物治疗下的母体药物的血夜水平较低,而几种药理活性代谢物的血液水平增加了。
对于缓释烟酸,还描述了在血液透析患者的高磷血症治疗中具有更好的风险收益率(sampathkumar,2006(50))。但是,因为两种药物被明确区分为不同的化学实体,因此这一发现不能预测调释烟酰胺具有可比的作用。尽管两种药物在传统上都命名为维生素b3,但两种化学物质之间的转化受到酶促控制,烟酰胺在人体内不转化为烟酸(参见例如gillmor,1999(51);petley,1995(52))。两种药物在药理作用上有很大不同(参见例如niacinamidemonograph,2002(53))。此外,这两种药物的安全性在本质上是不同的,烟酸的最高容许摄入量为10mg/天,烟酰胺的最高容许摄入量为900mg/天(参见例如scientificcommitteeonfood,2002(54))。
实施例5
此外,大多数磷酸盐结合剂不仅与磷酸盐特异性反应,而且还与肠道中的其他极性小分子结合,从而可能抑制它们的肠道吸收(参见例如neradova,2016(55))。实际上,烟酰胺与磷酸盐结合剂司维拉姆联合给予时,对高磷血症的治疗是无效的(参见olivero,2006(43)),司维拉姆因其广泛的肠道相互作用潜力而闻名。碳酸司维拉姆
实施例6:烟酰胺用于双重改善ckd患者的血清磷酸盐和lp(a)水平。
为了研究烟酰胺对降低lp(a)血清水平升高的可能作用,本发明人在转基因小鼠模型中进行了临床前研究。lp(a)仅在人类和旧大陆猴(oldworldmonkeys)中进行生物合成,这使得使用动物模型来直接研究lp(a)的代谢变得复杂(kostner,2013(72))。lp(a)由与apo(a)共价结合的ldl组成。lp(a)的血浆水平与人体内apo(a)的合成高度相关。由于lp(a)的合成仅限于灵长类动物,因此使用了转基因小鼠模型,其中将包括启动子区域在内的整个apo(a)基因引入了小鼠基因组中(chennamsetty,2012(31))。在转基因apo(a)小鼠(tg-apo(a))中,apo(a)主要在雌性小鼠中表达。响应于经食物中的1%烟酸口服处理后,这些雌性小鼠表现出血浆apo(a)蛋白降低43%,肝细胞apo(a)mrna转录物降低65%(chennamsetty,2012(31))。
由此,制备了烟酸在lp(a)降低中假定作用方式的模型,如图7所示。烟酸(尼克酸)与特定的烟酸受体gpr109a结合。gpr109a抑制负责将三磷酸腺苷(atp)合成为环单磷酸腺苷(camp)的腺苷环化酶。较低浓度的camp会降低核camp响应元件(camp-re)的激活,从而减少apo(a)基因(apoa)的转录。
为了研究烟酰胺对血浆apo(a)水平的影响,杂合子tg-apo(a)雌性小鼠在交叉设计中口服了1%烟酰胺或1%烟酸作为食物补充品,为期两周。通过elisa测定apo(a)的水平,并表示为lp(a)(mg/dl),因为每个分子apo(a)结合一个ldl分子形成lp(a)。如图8所示,与基线水平相比,烟酰胺处理后1周,lp(a)降低67%,两周后降低77%(p<0.0001;t-检验和wilcox)。图8显示了用标准食物处理的转基因apo(a)雌性小鼠的血清水平lp(a)的降低,其中标准食物(维持饮食,altrominspezialfuttergmbh&co.kg,德国:粗蛋白191970.400[mg/kg];粗脂肪40803.010[mg/kg];粗纤维60518.480[mg/kg];粗灰分69364.890[mg/kg];水分112946.890[mg/kg];二糖49464.050[mg/kg];多糖358852.330[mg/kg];代谢能3188.487[kcal/kg];赖氨酸8026.060[mg/kg];甲硫氨酸2738.230[mg/kg];半胱氨酸3171.100[mg/kg];苏氨酸6611.330[mg/kg];色氨酸2458.450[mg/kg];精氨酸11503.050[mg/kg];组氨酸4465.100[mg/kg];异亮氨酸7560.450[mg/kg];亮氨酸13416.500[mg/kg];苯丙氨酸8326.500[mg/kg];缬氨酸8858.100[mg/kg];丙氨酸8557.750[mg/kg];天冬氨酸15905.350[mg/kg];谷氨酸38495.600[mg/kg];甘氨酸8345.100[mg/kg];脯氨酸12427.300[mg/kg];丝氨酸9127.550[mg/kg];酪氨酸5962.050[mg/kg];维生素a15000.000[i.e./kg];维生素d3600.000[i.e./kg];维生素e110.350[mg/kg];维生素k3为甲萘醌3.000[mg/kg];维生素b118.000[mg/kg];维生素b212.000[mg/kg];维生素b69.000[mg/kg];维生素b120.024[mg/kg];烟酸36.000[mg/kg];泛酸21.000[mg/kg];叶酸2.33500[mg/kg];生物素0.250[mg/kg];氯化胆碱699.000[mg/kg];维生素c36.000[mg/kg];钙7114.940[mg/kg];磷5090.560[mg/kg];消化磷1537.500[mg/kg];镁2436.930[mg/kg];钠2156.565[mg/kg];钾9214.900[mg/kg];硫1198.200[mg/kg];氯3541.000[mg/kg];铁198.037[mg/kg];锰97.686[mg/kg];锌94.876[mg/kg];铜13.582[mg/kg];碘1.623[mg/kg];钼1.129[mg/kg];氟2.192[mg/kg];硒0.265[mg/kg];钴0.351[mg/kg];棕榈酸c-16:03581.475[mg/kg];硬脂酸c-18:01094.300[mg/kg];油酸c-18:16292.225[mg/kg];亚油酸c-18:22038.700[mg/kg];亚油酸c-18:32038.700[mg/kg];花生酸c-20:040.000[mg/kg];二十烷酸
烟酸治疗也导致lp(a)下降(第1周:37%,p=0.011;第2周:50%,p<0.001;见图8),但这种下降没有烟酰胺的明显。apo(a)和lp(a)的下降在与先前针对tg-apo(a)小鼠所述的相同范围内(chennamsetty,2012(31))。相比之下,烟酰胺降低lp(a)的作用是出乎意料的,因为该物质不结合或以其它方式影响介导烟酸药理学作用的gpr109a受体(tunaru,2005(33))。此外,烟酰胺甚至更强的降脂作用也指向了一种新的药理作用模式,与gpr109a的结合无关。
如上所述,高水平的lp(a)触发ckd的发生和发展,以及晚期ckd患者的心血管发病率和死亡率升高。由于一方面血脂异常和高磷血症协同触发心血管钙化的发展(见上文),另一方面ckd的进展是高磷血症的发生率和严重程度的独立危险因素,因此降低升高的lp(a)水平可能在降低高磷血症时期的风险和频率,以及降低与高磷酸盐血症有关的心血管结果的风险方面,是有利于ckd患者的。因此,烟酰胺通过对抑制肠道napi-2b协同转运蛋白的双重作用(kettler,2011(58)),以及通过降低血清lp(a)的水平,而降低了ckd患者的高磷血症的风险和强度。此外,由于lp(a)和高磷血症均促进心血管钙化,因此两种作用都可能有助于改善临床结果。
实施例7:
在实施例6中,基于血脂异常动物模型,证明了烟酰胺的口服治疗导致脂蛋白a(lp(a))的显著减少。
另外,发明人研究了在血液透析的终末期肾病患者中,每天一次使用调释(mr)烟酰胺治疗,对血清lp(a)水平以及血清磷酸盐浓度的影响。这项随机、双盲、平行组试验比较了mr烟酰胺和安慰剂,作为经批准的磷酸盐结合剂的附加疗法,在血液透析患者中长期降低升高的磷酸盐浓度以及包括lp(a)在内的各种脂质参数。在整个研究过程中,应尽可能保持伴随的磷酸盐结合剂治疗的稳定。在研究的前12周内,不应该使其变化以及使其他相关伴随药物变化。血清磷酸盐和脂质水平的分析基于意向性治疗(itt)人群,该意向性治疗人群包括722位患者,539位接受至少一次mr烟酰胺和磷酸盐结合剂治疗的患者,以及183位接受安慰剂和磷酸盐结合剂治疗的患者(3:1随机)。患者接受了长达52周的治疗。提前中止研究药物摄入的患者被要求留在研究中以备进一步随访。566位患者完成了试验,其中358位患者(63%)在试验结束时处于研究治疗中,因此代表“较完整人群”。研究开始时的平均血清磷酸盐浓度为6.0mg/dl。在整个研究期间,该参数在试验期间降低了0.68至0.39mg/dl。这种降低对于itt人群来说在治疗12周和24周后是显著的,并且对于使用研究药物的患者来说在整个试验中保持显著性(完成者;请参见表11)。这项研究是针对高磷血症患者进行的,尽管他们长期使用一种或两种磷酸盐结合剂进行治疗,但应该指出,较完整人群中有36%至49%的患者达到了其各自的血清磷酸盐目标范围,这表明烟酰胺与磷酸盐结合剂联用的这种联合疗法具有很高的降低磷酸盐的功效。
在降低血清磷酸盐水平的同时,该试验还显示,使用mr烟酰胺治疗12周和24周后,血清lp(a)浓度降低。在比较第12周和第24周的mr烟酰胺和安慰剂治疗组之间的lp(a)水平时,这种降低具有统计学显著性,并且经52周烟酰胺治疗后还倾向于更低(参见表12和图9)。
血清中高浓度的磷酸盐(blocketal.2004(66))和lp(a)(konishietal.2016(70))是心血管疾病发病率和死亡率的独立危险因素。因此,在对终末期肾病患者的长期治疗中,两种心血管危险因素的同时改善会协同地改善心血管的疗效。
表11:血清磷酸盐浓度(mg/dl):在itt人群中的筛查相比的绝对值差异
*kruskal-wallis-检验,
n=患者数量,pb=各磷酸盐结合剂,sem=平均数的标准误差,w=治疗周,itt=意向性治疗人群
表12:血清lp(a)浓度(mg/dl):在itt人群中筛查时相比的绝对值差异
*用药组的kruskal-wallis-检验的p值,
lp(a)=脂质蛋白a,n=患者数量,pb=各磷酸盐结合剂,sem=平均数的标准误差,w=治疗周
图9显示了血清lp(a)浓度与试验的itt人群中筛查时相比的差异。在该图中适用以下情况:用药组在kruskal-wallis检验中的p值<0.05;lp(a)=脂蛋白a,pb=各磷酸盐结合剂,w=治疗周
实施例8
磷酸盐协同转运蛋白napi2b已显示出负责约50%的胃肠道磷酸盐吸收(kataietal.1999(12))。在动物模型中已经显示出,烟酰胺降低了napi2b的肠道表达和磷酸盐的肠道吸收(etoetal.2005(18))。在作透析的终末期肾病的人中,烟酰胺显著降低升高的血清磷酸盐浓度(takahashietal.2004,(19),未示出更多数据)。用于治疗升高的血清磷酸盐水平的标准方法(如低磷酸盐饮食)可以增加协同转运蛋白napi2b的表达(giraletal,2009(13),hattenhaueretal,1999(16))。此外,还显示了使用磷酸盐结合剂处理可以增强napi2b的肠道表达(schiavietal.2012(39))。因此,经由napi2b适应性上调肠道磷酸盐吸收降低了常规方式治疗高磷血症的功效,且可能导致这些治疗方式的目标达成不良。如上所述,例如在实施例1中,发明人进行了一项临床试验,以研究磷酸盐结合剂与调释(mr)烟酰胺的联合治疗,以降低使用一种或两种磷酸盐结合剂治疗的高磷血症患者的血清磷酸盐水平。
该试验显示,与接受磷酸盐结合剂和安慰剂治疗的患者相比,在持续52周的研究期内,血清磷酸盐浓度显著降低(图10)。图10显示了完成研究的患者中,血清磷酸盐浓度在试验过程中的变化进程(pb=磷酸盐结合剂)。
此外,在mr烟酰胺治疗下,在基线的高磷血症患者中有36%至49%在研究进行期间达到了各自的目标范围(表13)。
因此,该试验显示,烟酰胺和磷酸盐结合剂的联合治疗明显改善了血清磷酸盐水平,因此与磷酸盐结合剂一起协同作用。
该试验包括在所有磷酸盐结合剂稳定治疗下的患者,其中磷酸盐结合剂在德国、波兰和奥地利经批准用于高磷血症的治疗。表14列出了试验过程中最常用的10种磷酸盐结合剂。此外,接受两种不同磷酸盐结合剂联合治疗的患者可以参加试验。表15列出了用于10种最常见的磷酸盐结合剂联合疗法的患者人数。该试验显示所有患者的磷酸盐水平均显著降低,表明联合疗法在所有使用的联合疗法中均具有协同作用。对3组磷酸盐结合剂的亚组分析还显示,在mr烟酰胺与1)含钙的磷酸盐结合剂,2)碳酸镧和铝盐,和3)其余的磷酸盐结合剂(主要为碳酸司维拉姆和盐酸司维拉姆),和4)替那帕诺(一种钠氢交换阻断剂)的联合治疗中,血清磷酸盐显著降低,其中替那帕诺阻断肠道中磷酸盐的被动摄取,并且与通过阻断肠中napi2b受体肠而阻断磷酸盐主动摄取的烟酰胺结合,从而转化为协同作用,因此非常有效地降低了磷酸盐血清水平。图11示出了,使用烟酰胺和替那帕诺的组合的这种增强效果,和使用烟酰胺和钙镁盐(镁钙)的组合的较小程度的增强效果。
因此,该试验表明,烟酰胺联合疗法独立于磷酸盐结合剂的不同成分,成功地降低了血清磷酸盐水平。
表13:试验的响应者分析:达到其预定的个体血清磷酸盐目标范围的患者比例。
*kruskal-wallis检验,n=患者人数,pb=磷酸盐结合剂,w=治疗周,较完整人群=每次访问时接受治疗的患者,ci=置信区间
表14:在试验过程中,与mr烟碱酰胺或安慰剂组合的10种最常见的磷酸盐结合剂
表15:在试验过程中,与mr烟碱胺或安慰剂组合的两种磷酸盐结合剂的10种最常见组合
参考文献
1.youngew,akibat,albertjm,mccarthyjt,kerrpg,mendelssohndc,etal.magnitudeandimpactofabnormalmineralmetabolisminhemodialysispatientsinthedialysisoutcomesandpracticepatternsstudy(dopps).amjkidneydis.2004;44(5suppl2):34-8.
2.tentorif,blayneymj,albertjm,gillespiebw,kerrpg,bommerj,etal.mortalityriskfordialysispatientswithdifferentlevelsofserumcalcium,phosphorus,andpth:thedialysisoutcomesandpracticepattemsstudy(dopps).amjkidneydis.2008;52(3):519-30.
3.levina,bakrisgl,molitchm,smuldersm,tianj,williamsla,etal.prevalenceofabnormalserumvitamind,pth,calcium,andphosphorusinpatientswithchronickidneydisease:resultsofthestudytoevaluateearlykidneydisease.kidneylnt.2007;71(1):31-8.
4.saitoh,maedaa,ohtomos,hiratam,kusanok,katos,etal.circulatingfgf-23isregulatedby1alpha,25-dihydroxyvitamind3andphosphorusinvivo.jbiolchem.2005;280(4):2543-9.
5.blockga,hulbert-shearonte,levinnw,portfk.associationofserumphosphorusandcalciumxphosphateproductwithmortalityriskinchronichemodialysispatients:anationalstudy.amjkidneydis.1998;31(4):607-17.
6.londongm,guerinap,marchaissj,metivierf,pannierb,addah.arterialmediacalcificationinend-stagerenaldisease:impactonall-causeandcardiovascularmortality.nephroldialtransplant.2003;18(9):1731-40.
7.k/doqi.clinicalpracticeguidelinesforbonemetabolismanddiseaseinchronickidneydisease(k/doqiclinicalpractiseguideline).ameficanjournalofkidneydiseases.2003;42(4):s7-s201.
8.kdigo.clinicalpracticeguidelineforthediagnosis,evaluation,prevention,andtreatmentofchronickidneydisease-mineralandbonedisorder(ckd-mbd).kidneyint2009;76(supplement113):s1-s130.
9.navaneethansd,palmersc,craigjc,eldergj,strippoligf.benefitsandharmsofphosphatebindersinckd:asystematicreviewofrandomizedcontrolledtrials.amjkidneydis.2009;54(4):619-37.
10.marksj,debnames,unwinrj.phosphatehomeostasisandtherenal-gastrointestinalaxis.americanjournalofphysiology-renalphysiology.2010;299(2):f285-f96.
11.suyamat,okadas,lshijimat,lidak,abek,nakaiy.highphosphorusdiet-inducedchangesinnapi-llbphosphatetransporterexpressionintheratkidney:dnamicroarrayanalysis.plosone.2012;7(1):e29483.
12.kataik,tanakah,tatsumis,fukunagay,genjidak,moritak,etal.nicotinamideinhibitssodium-dependentphosphatecotranspodactivityinratsmallintestine.nephroldialtransplant.1999;14(5):1195-201.
13.giralh,caldasy,sutherlande,wilsonp,breusegems,barryn,etal.regulationofratintestinalna-dependentphosphatetransportersbydietaryphosphate.amjphysiolrenalphysiol.2009;297(5):f1466-f75.
14.sabbaghy,giralh,caldasy,levim,schiavisc.intestinalphosphatetransport.advchronickidneydis.2011;18(2):85-90.
15.gattinenij,batesc,twombleyk,dwarakanathv,robinsonml,goetzr,etal.fgf23decreasesrenalnapi-2aandnapi-2cexpressionandinduceshypophosphatemiainvivopredominantlyviafgfreceptor1.amjphysiolrenalphysiol.2009;297(2):f282-f91.
16.hattenhauero,traebertm,murerh,biberj.regulationofsmallintestinalna-p(i)typellbcotransporterbydietaryphosphateintake.amjphysiol.1999;277(4pt1):g756-g62.
17.xuh,bail,collinsjf,ghishanfk.age-dependentregulationofratintestinaltypellbsodium-phosphatecotransporterby1,25-(oh)2vitamind3.ajp-cellphysiology.2002;282(3):c487-c93.
18.eton,miyatay,ohnoh,yamashitat.nicotinamidepreventsthedevelopmentofhyperphosphataemiabysuppressingintestinalsodium-dependentphosphatetransporterinratswithadenine-inducedrenalfailure.nephroldialtransplant.2005;20(7):1378-84.
19.takahashiy,tanakaa,nakamurat,fukuwatarit,shibatak,shimadan,etal.nicotinamidesuppresseshyperphosphatemiainhemodialysispatients.kidneyint.2004;65(3):1099-104.
20.rahmounik,araarb,harbouchel,shahapunil,esperne,fourniera.useofnicotinamideasphosphatebindercouldreducebyhalfthecostofhyperphosphatemiacontrolbysevelamerindialysispatients.the38thannualmeetingoftheamericansocietyofnephrology.2005:sp240.
21.chengsc,youngdo,huangy,delmezja,coynedw.arandomized,double-blind,placebo-controlledtrialofniacinamideforreductionofphosphorusinhemodialysispatients.clinjamsocnephrol.2008;3(4):1131-8.
22.youngdo,chengsc,delmezja,coynedw.theeffectoforalniacinamideonplasmaphosphoruslevelsinperitonealdialysispatients.peritdialint.2009;29(5):562-7.
23.mikolasevicl,zutelijam,mavrinacv,orlicl.dyslipidemiainpatientswithchronickidneydisease:etiologyandmanagement.intjnephrolrenovascdis.2017;10:35-45.
24.baigentc,landraymj,reithc,embersonj,wheelerdc,tomsonc,etal.theeffectsofloweringldlcholesterolwithsimvastatinplusezetimibeinpatientswithchronickidneydisease(studyofheartandrenalprotection):arandomisedplacebo-controlledtrial.lancet.2011;377(9784):2181-92.
25.
26.amannk.mediacalcificationandintimacalcificationaredistinctentitiesinchronickidneydisease.clinjamsocnephrol.2008;3(6):1599-605.
27.haffnersm,gruberkk,aldreteg,jr.,moralespa,sternmp,tunlekr.increasedlipoprotein(a)concentrationsinchronicrenalfailure.jamsocnephrol.1992;3(5):1156-62.
28.trenkwaldere,grubsra,konigp,dieplingerh,kronenbergf.lncreasedplasmaconcentrationsofldl-unboundapo(a)inpatientswithend-stagerenaldisease.kidneyint.1997;52(6):1685-92.
29.kotanik,banachm.lipoprotein(a)andinhibitorsofproproteinconvertasesubtilisin/kexintype9.jthoracdis.2017;9(1):e78-e82.
30.carlsonla,hamstena,asplunda.pronouncedloweringofserumlevelsoflipoproteinlp(a)inhyperlipidaemicsubjectstreatedwithnicotinicacid.jlnternmed.1989;226(4):271-6.
31.chennamsettyl,kostnerkm,claudelt,vinodm,franks,weissts,etal.nicotinicacidinhibitshepaticapoageneexpression:studiesinhumansandintransgenicmice.jlipidres.2012;53(11):2405-12.
32.digbyje,ruparelian,choudhuryrp.niacinincardiovasculardisease:recentpreclinicalandclinicaldevelopments.arteriosclerthrombvascbiol.2012;32(3):582-8.
33.tunarus,lattigj,keroj,krauseg,offermannss.charactsrizationofdeterminantsofligandbindingtothenicotinicacidreceptorgpr109a(hm74a/puma-g).molpharmacol.2005;68(5):1271-80.
34.gouni-bertholdi,bertholdhk.theroleofniacininlipid-loweringtreatmsnt:areweaimingtoohigh?currpharmdes.2013;19(17):3094-106.
35.medicearzneimittelpüttergmbh&co.kg.asingle-center,randomized,open-label,single-dose,2treatment,4period,two-stage,cross-overbioavailabilitystudywithnicotinamide250mgmodifiedreleasecapsulesversusareferenceformulation(
36.medicearzneimittelpüttergmbh&co.kg.dose-findingtrialofnicotinamideindialysis-dependentpatientswithhyperphosphataemia,thedonatotrlal.2012medicestudyno.6520-9961-03.eudractno.2009-015821-34.
37.yangj,adamsjd.nicotinamideanditspharmacologicalpropertiesforclinicaltherapy.drugdesignreviewsonline.2004;1:4.
38.mogielnickia,kramkowskik,pietrzakl,buczkow.n-methylnicotinamideinhibitsarterialthrombosisinhypertensiverats.jphysiolpharmacol.2007;58(3):515-27.
39.schiavisc,tangw,brackenc,o′briensp,songw,boulangerj,etal.npt2bdeletionattenuateshyperphosphatemiaassociatedwithckd.jamsocnephrol.2012;23:11691-700.
40.galeanoc,navarrop,terueljl,ortunoj.[treatmentofhyperphosphatemiaindialyzedpatientswithnicotinamide].nefrologia.2005;25(6):725-6.
41.rottembourgjb,launay-vacherv,massardj.thrombocytopeniainducedbynicotinamideinhemodialysispatients.kidneylnt.2005;68(6):2911-2.
42.delahayep,weekersl,krzesinskijm.diarrheainducedbyhighdosesofnicotinamideindialysispatients.kidneylnt.2006;69(10):1914.
43.oliveroj,garneyp,armentroutb,maysl,hollandr.nicotinamideusedforthetreatmentofhyperhosphatemiainhemodialysispatients.the39thannualmeetingoftheamericansocietyofnephrology,november14-19,2006:f-po104.
44.delcarmenreinosos,grinblatn,santosjc,al.e.nicotinamide:analternativeforhyperphosphatemiaindialysispatients.worldcongressofnephrology.2009:su570.
45.shahbazianh,zafarma,ghorbania,abbaspourmr,belladimusaviss,hayatif,etal.oralnicotinamidereducesserumphosphorus,increaseshdl,andinducesthrombocytopeniainhemodialysispatients:adouble-blindrandomizedclinicaltrial.nefrologia.2011;31(1):58-65.
46.vasanthaj,soundararajanp,vanitharanin,kannang,thennarasup,neenug,etal.safetyandefficacyofnicotinamideinthemanagementofhyperphosphatemiainpatientsonhemodialysis.indianjnephrol.2011;21(4):245-9.
47.allams,ei-hamamsym,eisharkawy.theeffectofcoadminstrationofnicotinamideandcalcium-basedphosphatebinderonhyperphophatemiainpatientsundergoinghemodialysis.advancesinnaturalscience.2012;5(1):1-9.
48.lengleta,liabeufs,elen,brissets,mansourj,lemaire-hurtelas,etal.efficacyandsafetyofnicotinamideinhaemodialysispatients:thenicorenstudy.nephroldialtransplant.2016,pubmedid27190329(2016may4).
49.eiborolossyr,eiwakeellm,eihakiml,sabrin.efficacyandsafetyofnicotinamideinthemanagementofhyperphosphatemiainpediatricpatientsonregularhemodialysis.pediatrnephrol.2016;31(2):289-96.
50.sampathkumark,selvamm,soorajys,gowthamans,ajeshkumarrn.extendedreleasenicotinicacid-anoveloralagentforphosphatecontrol..inturolnephrol.2006;38(1):171-4.
51.gillmotha,boltonch,hoptonm,moorewp,perrettd,bingleypj,etal.measurementofnicotinamideandn-methyl-2-pyridone-5-carboxamideinplasmabyhighperformanceliquidchromatography.biomedchromatogr.1999;13(5):360-2.
52.petleya,macklinb,renwickag,wilkintj.thepharmacokineticsofnicotinamideinhumansandrodents.diabetes.1995;44(2):152-5.
53.n.n.niacinamide.monograph.alternmedrev.2002;7(6):525-9.
54.europeancommission,health&consumerprotectiondirectorate-general.opinionofthescientificcommitteeonfoodonthetolerableupperintakelevelofnicotinicacidandnicotinamide(niacin).scf/cs/nut/upplev/39finalreport,6thmay2002.
55.neradovaa,schumachers,luxp,etal.phosphatebindersandvitaminkabsorption.53rdera-edtacongress,vienna2016;postermp377
56.forsteric,hemandon,biberj,murerh.phosphatetransportersoftheslc20andslc34families.molaspectsmed.2013;34(2-3):386-95.
57.pulskenswp,verkaikm,sheedfarf,vanloonep,vandesluisb,vervloetmg,etal.deregulatedrenalcalciumandphosphatetransportduringexperimentalkidneyfailure.plosone.2015;10(11):e0142510.
58.kettelerm.phosphatemetabolisminckdstages3-5:dietaryandpharmacologicalcontrol.intjnephrol.2011:2011:970245.
59.spraguesm,abboudh,qiup,dauphinm,zhangp,finnw.lanthanumcarbonatereducesphosphorusburdeninpatientswithckdstages3and4:arandomizedtrial.clinjamsocnephrol.2009;4(1):178-85.
60.oliveirarb,cancelaal,graciollifg,dosreislm,draibesa,cupparil,etal.earlycontrolofpthandfgf23innormophosphatemicckdpatients:anewtargetinckd-mbdtherapy?clinjamsocnephrol.2010;5(2):286-91.
61.blockga,ixjh,kettelerm,martinkj,thadhanirl,tonellim,etal.phosphatehomeostasisinckd:reportofascientificsymposiumsponsoredbythenationalkidneyfoundation.amjkidreydis.2013;62(3):457-73.
62.gutierrezo,lsakovat,rheee,shaha,holmesj,collerroneg,etal.fibroblastgrowthfactor-23mitigateshyperphosphatemiabutaccentuatescalcitrioldeficiencyinchronickidneydisease.jamsocnephrol.2005;16(7):2205-15.
63.marksj,sraisk,biberj,murerh,unwinrj,debnames.intestinalphosphateabsorptionandtheeffectofvitamind:acomparisonofratswithmice.expphysiol.2006;91(3):531-7.
64.goas,chertowgm,fand,mccullochce,hsucy.chronickidneydiseaseandtherisksofdeath,cardiovascularevents,andhospitalization.nengljmed.2004;351(13):1296-305.
65.kestenbaumb,sampsonjn,rudserkd,pattersondj,seligersl,youngb,etal.serumphosphatelevelsandmortalityriskamongpeoplewithchronickidneydisease.jamsocnephrol.2005;16(2):520-8.
66.blockga,klassenps,lazarusjm,ofsthunn,lowrieeg,chertowgm.mineralmetabolism,mortality,andmorbidityinmaintenancehemodialysis.jamsocnephrol.2004;15(8):2208-18.
67.freiu,schober-halstenbergh-j.(2008).nierenersatztherapieindeutschlandberichtüberdialysebehandlungundnierentransplantationindeutschland2006-2007.berlin:quasi-nieregmbh
68.foleyrn,parfreyps,samakmj.clinicalepidemiologyofcardiovasculardiseaseinchronicrenaldisease.amjkidneydis.1998;32(5suppl3):s112-s9.
69.moesm,chennx.pathophysiologyofvascularcalcificationinchronickidneydisease.circres.2004;95(6):560-7.
70.konishih,miyauchik,tsubois,ogitam,naitor,dohit,etal.plasmalipoprotein(a)predictsmajorcardiovasculareventsinpatientswithchronickidneydiseasewhoundergopercutaneouscoronaryintervention.lntjcardiol.2016;205:50-3.
71.yunjs,ahnyb,songkh,yookd,parkym,kimhw,etal.lipoprotein(a)predictsanewonsetofchronickidneydiseaseinpeoplewithtype2diabetesmellitus.diabetmed.2016;33(5):639-43.
72.kostnerkm,marzw,kostnergm.whenshouldwemeasurelipoprotein(a)?eurheartj.2013;34(42):3268-76.
73.remington,thescienceandpracticeofpharmacy″,22ndedition,2013,pp.777-1070
74.remington,thescienceandpracticeofpharmacy,22ndedition,2012,volume1:″thescienceofpharmacy″,pages1049-1070
75.remington,thescienceandpracticeofpharmacy″,22ndedition,2013,pp.981,982,989-998
76.blockgaetal.effectoftenapanoronserumphoephateinpatientsreceivinghemodialysis.jamsocnephrol.february2017:28(2):221-30.
- 还没有人留言评论。精彩留言会获得点赞!