包含血管破坏剂及免疫检查点抑制剂的用于预防或治疗癌症的组合物的制作方法
本公开涉及一种用于预防或治疗癌症的组合物,其包含血管破坏剂(vda)及免疫检查点抑制剂。
背景技术:
随着免疫学领域中的最新进展使人们进一步理解人体免疫系统,免疫疗法已发展为一种新颖肿瘤疗法,其中该疗法具有的优势是患者可使用其自身免疫系统,从而以较小副作用获得长时间段的抗肿瘤免疫。
免疫疗法的目标是生成肿瘤特异性细胞毒性t淋巴细胞(ctl),其能够识别肿瘤细胞或肿瘤抗原,从而消除肿瘤细胞。换言之,肿瘤抗原肽加载于主要组织相容性复合体(mhc)上,随后通过肿瘤细胞自身或抗原呈递细胞呈递至t淋巴细胞,从而激活t淋巴细胞且诱导其分化为ctl且使ctl增加。
然而,人体中多数肿瘤往往避开个体的免疫监视,因此其难以治疗。该难点的原因如下:1)肿瘤抗原是自体抗原的部分,其多数在胎儿期期间表达或表达于正常细胞中,或因诱导免疫的程度极低而无法识别为抗原,2)肿瘤细胞的mhc表达差或肿瘤抗原在肿瘤细胞中加工不完全,因此完全无法呈递,3)多数肿瘤细胞可能不表达抗原呈递所必要的共刺激分子,及4)这样的肿瘤细胞可通过由肿瘤分泌的抑制性细胞因子而避开免疫监视。
同时,血管破坏剂(vda)将目标定为选择性地破坏血管内皮细胞的细胞骨架微管,从而快速且选择性地破坏形成于该处的肿瘤血管,其中vda亦可诱发位于肿瘤中心的细胞的缺血性坏死。然而,若单独治疗,则多数vda的问题是肿瘤可自活性边缘迅速再生,因此降低这些药物的治疗效用。
现有技术参考文献
专利文件
wo2009/119980
wo2016/130839
wo2016/197204
非专利文件
cancerimmunologyimmunotherapy2014;63:925-938
技术实现要素:
技术问题
本发明人尝试了各种研究以提供用于预防或治疗癌症的新颖组合物及其治疗方法,其可充分利用使用免疫疗法的免疫治疗剂的优势,同时解决单独使用vda的问题。
解决问题
本公开的目标是提供一种用于预防或治疗癌症的组合物,其包含血管破坏剂(vda)及免疫检查点抑制剂。
本公开的目标是提供一种用于治疗癌症的方法,其包括给有需要的个体施用vda及免疫检查点抑制剂。
本公开的目标是提供vda及免疫检查点抑制剂的用途,其用于制备用于癌症治疗的药物。
本公开的目标是提供一种包含vda及免疫检查点抑制剂的组合物,其用于治疗癌症。
发明的有利效果
本公开的组合物实现了预防或治疗癌症的极佳活性,且具有肿瘤复发的可能性较低的优点。因此,本公开的组合物可用于预防、减少或治疗癌症。
附图简单说明
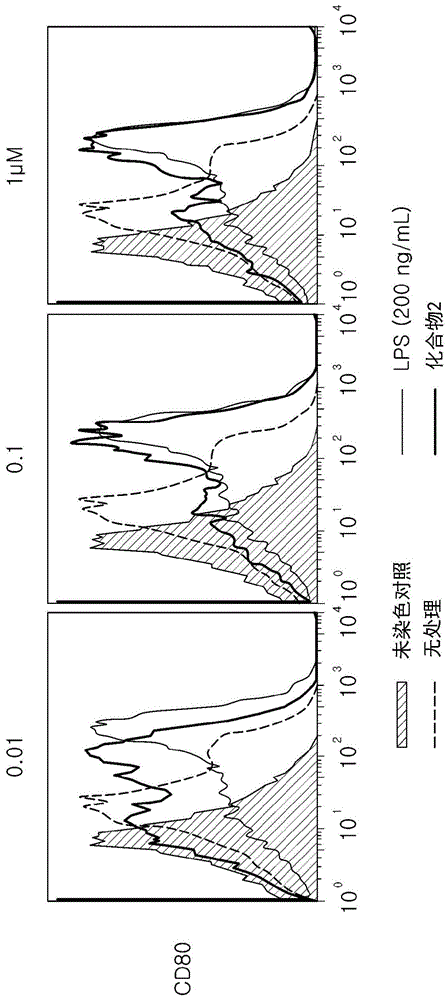
图1显示成熟树状细胞标记cd80的表达随使用式2的化合物的处理而增加。
图2显示成熟树状细胞标记cd86的表达随使用式2的化合物的处理而增加。
图3显示成熟树状细胞标记mhcⅱ的表达随使用式2的化合物的处理而增加。
图4显示il-1b、il-6及il-12的分泌量随使用式2的化合物的处理而增加。
图5显示树状细胞的吞噬作用随使用式2的化合物的处理而增加。
图6显示癌症动物模型中根据单一或组合施用血管破坏剂与免疫检查点抑制剂(pd-1、ctla-4或其二者)的癌症治疗效果。
图7显示癌症动物模型中根据单一或组合施用vda与免疫检查点抑制剂(pd-l1)的癌症治疗效果。
实施本发明的最佳模式
努力达成上文目标的结果是,本发明人已完成一种用于预防或治疗癌症的药物组合物,其包含血管破坏剂(vda)及免疫检查点抑制剂。
vda将目标定为选择性地破坏血管内皮细胞的细胞骨架微管,从而快速且选择性地破坏形成于该处的肿瘤血管。再者,vda可诱发位于肿瘤中心的细胞的缺血性坏死。
在本公开中,用作所述vda的化合物是由以下式1表示的(s)-n-(4-(3-(1h-1,2,4-三唑-1-基)-4-(3,4,5-三甲氧基苯甲酰基)苯基)噻唑-2-基)-2-氨基-3-甲基丁酰胺或其药学上可接受的盐。
[式1]
在本公开中,上文式1的化合物可通过例如国际专利申请wo2009-119980中所公开的制备方法而制备,但不限于该方法。
在本公开中,药学上可接受的盐是指制药工业中常规使用的盐,其中所述盐是例如从钙、钾、钠、镁等制备的无机离子盐;从盐酸、硝酸、磷酸、溴酸、碘酸、过氯酸、硫酸等制备的无机酸盐;从乙酸、三氟乙酸、柠檬酸、顺丁烯二酸、丁二酸、草酸、苯甲酸、酒石酸、反丁烯二酸、杏仁酸、丙酸、乳酸、乙醇酸、葡萄糖酸、半乳糖醛酸、谷氨酸、戊二酸、葡萄糖醛酸、天冬氨酸、抗坏血酸、碳酸、香草酸等制备的有机酸盐;从甲磺酸、乙磺酸、苯磺酸、对甲苯磺酸、萘磺酸等制备的磺酸盐;从甘氨酸、精氨酸、赖氨酸等制备的氨基酸盐;从三甲胺、三乙胺、氨、吡啶、甲吡啶等制备的胺盐等,但本公开中所表示的盐的类型不限于上文所列的盐。
具体地,(s)-n-(4-(3-(1h-1,2,4-三唑-1-基)-4-(3,4,5-三甲氧基苯甲酰基)苯基)噻唑-2-基)-2-氨基-3-甲基丁酰胺的盐可以是盐酸盐。
在本公开中,上文式1的化合物的活性代谢物可以是由以下式2表示的(4-(2-氨基噻唑-4-基)-2-(1h-1,2,4-三唑-1-基)苯基)(3,4,5-三甲氧基苯基)甲酮。上文术语“活性代谢物”是在身体中同化或异化分解过程期间产生的物质中,在治疗对象中实际显示药理学活性的物质。
[式2]
在本公开中,根据个体中的代谢过程,该包含式1的化合物用于预防或治疗癌症的药物组合物以上文式2的化合物存在,从而实现预防、减少或治疗癌症的效果。
根据本公开的式1的化合物快速且选择性地破坏肿瘤血管,因而不仅导致位于肿瘤中心的细胞的缺血性坏死,而且激活树状细胞。
根据本公开的一个实施方案,上文式2的化合物促进树状细胞(dc)的成熟,提升吞噬作用且提高外来抗原呈递能力(图1至图5)。
树状细胞是能够诱发抗肿瘤免疫的那些细胞,其中所述细胞通过吞噬作用等获得抗原,且通过将抗原肽负载于mhc上表达抗原,因而强烈诱导具有抗原特异性t细胞受体的t淋巴细胞的活性。再者,在激活时,树状细胞表达il-12以防止t淋巴细胞的细胞凋亡,诱导t淋巴细胞的分化及ctl的活性,且提高自然杀伤细胞的活性,因而这些细胞获得提高抗肿瘤免疫性的特点。
因此,在本发明用于预防或治疗癌症的药物组合物中,式1的化合物及其活性代谢物的式2的化合物不仅实现作为血管破坏剂的效应,而且实现激活树状细胞及提升吞噬作用及外来抗原呈递能力的作用效果。
在本公开中,免疫检查点抑制剂藉由破坏免疫检查点(其以高免疫抑制能力阻止癌症中免疫反应的发展)而抑制癌症逃避免疫,因此其可治疗癌症。
免疫检查点抑制剂是新的肿瘤治疗剂,其是由于免疫学领域的发展而对人体免疫系统获得更多理解所研发的,其中这些抑制剂已广泛用于抗癌策略中。使用所述抑制剂从而实现抗癌效果的例示性机制是t淋巴细胞抑制性机制,其通过ctla-4和pd-1/pd-l1机制抑制已激活的t淋巴细胞。然而,有报导,单独使用免疫检查点抑制剂的治疗具有局限性,诸如治疗效率低、效果不显著等。
然而,本发明用于预防或治疗癌症的组合物因协同效应及互补效应而可通过免疫疗法帮助预防及治疗癌症,方法是将式1的化合物(vda)与免疫检查点抑制剂互相组合的方式施用,其是具有不同治疗机制的抗癌药物。
免疫检查点抑制剂可为抗体、融合蛋白、适体或其免疫检查点蛋白结合片段。举例而言,免疫检查点抑制剂是抗免疫检查点蛋白抗体或其抗原结合片段。
在某一实例中,所述免疫检查点抑制剂选自抗ctla4抗体、其衍生物或其抗原结合片段;抗pd-l1抗体、其衍生物或其抗原结合片段;抗lag-3抗体、其衍生物或其抗原结合片段;抗ox40抗体、其衍生物或其抗原结合片段;抗tim3抗体、其衍生物或其抗原结合片段;抗pd-1抗体、其衍生物或其抗原结合片段。
举例而言,所述免疫检查点抑制剂可选自伊匹单抗(ipilimumab)、其衍生物或其抗原结合片段;替西木单抗(tremelimumab)、其衍生物或其抗原结合片段;纳武单抗(nivolumab)、其衍生物或其抗原结合片段;帕博利珠单抗(pembrolizumab)、其衍生物或其抗原结合片段;pidilizumab、其衍生物或其抗原结合片段;阿特珠单抗(atezolizumab)、其衍生物或其抗原结合片段;度伐单抗(durvalumab)、其衍生物或其抗原结合片段;阿维鲁单抗(avelumab)、其衍生物或其抗原结合片段;bms-936559、其衍生物或其抗原结合片段;bms-986016、其衍生物或其抗原结合片段;gsk3174998、其衍生物或其抗原结合片段;tsr-022、其衍生物或其抗原结合片段;mbg453、其衍生物或其抗原结合片段;ly3321367、其衍生物或其抗原结合片段;及imp321重组体融合蛋白。任何免疫检查点抑制剂可不受限制地加以使用,只要其是可用作免疫检查点抑制剂的抗体或其其他形式即可。
具体地,优选选自抗ctla4抗体、抗pd-1抗体、抗lag-3抗体、抗ox40抗体、抗tim3抗体及抗pd-l1抗体的至少一种。举例而言,可以以下方式使用抗体,从常规抗体制造商等购买或根据用于制备抗体的已知方法制备。
免疫检查点抑制剂可以是小分子化合物,其具有如上文所述的免疫检查点抑制剂的效果或参与其抑制性机制。举例而言,这些小分子化合物可能是与免疫检查点蛋白质结合或参与抑制免疫检查点相关的机制的小分子化合物。
具体地,所述小分子化合物可能系bms-202(来源:bms)、bms-8(来源:bms)、ca170(来源:curis/aurigene)、ca327(来源:curis/aurigene)、epacadostat、gdc-0919、bms-986205等。
可不受限制地使用任何免疫检查点抑制剂,只要其是可用作免疫检查点抑制剂或具有相关效用的小分子化合物即可。
本公开的组合物与式1的化合物(vda)及免疫检查点抑制剂组合施用,因此出于根据该组合用途的协同及互补效应而实现预防及治疗癌症的显著活性。
作为治疗机制的一个实例,本公开的组合物可对预防及治疗癌症具有如下显著效应,但并不限于此。式1的化合物激活树状细胞,从而t淋巴细胞的激活可相继发生。在t淋巴细胞激活的阶段中,或在激活的t淋巴细胞识别癌症细胞以对其杀伤的阶段中,免疫检查点可破坏这些阶段,从而抑制t淋巴细胞的活化。然而,与式1的化合物组合施用的免疫检查点抑制剂可破坏抑制t淋巴细胞活化的阶段,从而维持t淋巴细胞的活性。因此,可能通过不同机制的组合实现针对预防或治疗癌症的活性的协同效应:其一是由式1的化合物激活t淋巴细胞,且另一机制是由免疫检查点抑制剂破坏癌症细胞对t淋巴细胞活化的抑制。
在本公开的一个实施方案中,经鉴定,相较于单一施用,式1的化合物与抗pd-1抗体、抗ctla-4抗体或其二者组合施用实现提升的癌症治疗效果(图6)。
在本公开的一个实施方案中,经鉴定,相较于单一施用,式1的化合物与抗pd-l1抗体组合施用实现提升的癌症治疗效果(图7)。
因此,组合物包含式1的化合物及选自抗ctla4抗体、抗pd-1抗体及抗pd-l1抗体的至少一种。特定而言,组合物包含式1的化合物及抗ctla4抗体。特定而言,组合物包含式1的化合物及抗pd-1抗体。特定而言,组合物包含式1的化合物及抗pd-l1抗体。特定而言,组合物包含式1的化合物、抗ctla4抗体及抗pd-1抗体。
在本公开中,本公开的组合物可有益地用于预防或治疗癌症。癌症可为人体中各种类型的癌症,妇科肿瘤、内分泌系统癌症、中枢神经系统肿瘤、输尿管癌症等,具体包括肺癌、胃癌、肝癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤黑色素瘤、子宫癌、卵巢癌、结肠直肠癌、乳癌、子宫肉瘤、输卵管癌、内子宫内膜癌、子宫颈癌、阴道癌、阴门癌、食道癌、喉癌、小肠肿瘤(smallbowelneoplasm)、甲状腺癌、副甲状腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、多发性骨髓癌、慢性或急性白血病、儿童期实体瘤、淋巴瘤(如分化淋巴瘤、第一中枢神经系统淋巴瘤)、膀胱癌、肾癌、肾细胞癌、肾盂癌、脊髓轴肿瘤、脑干神经胶质瘤、梅克尔细胞癌(merkelcellcarcinoma)、尿路肿瘤(urinarytractneoplasm)或脑下垂体腺瘤,但不限于此。更特定而言,本公开的药物组合物可用于预防或治疗选自由结肠直肠癌、皮肤黑色素瘤、肺癌、胃癌、淋巴瘤、梅克尔细胞癌、尿路肿瘤及多发性骨髓瘤的癌症。
本公开的药物组合物可根据本公开所述领域的技术人员可以容易地实施的方法使用药学上可接受的载体而调配成制剂,使得该组合物可以单剂量形式制备或插入到多剂量容器中而制备。
药学上可接受的载体是常规用于调配制剂的载体,其中该载体包括(但不限于)乳糖、右旋糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、海藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁、矿物油等。除所述组分外,本公开的药物组合物可进一步包含润滑剂、保湿剂、增甜剂、调味剂、乳化剂、悬浮剂、防腐剂等。合适的药学上可接受的载体及制剂详细描述于remington'spharmaceuticalsciences(第19版,1995)中。
本公开的组合物可包含两种类型的不同制剂且还可由一种制剂构成。
根据目标方法,本公开的组合物可口服施用或胃肠外施用(例如,静脉内、皮下、腹膜内或局部施用)。
在本公开中,(s)-n-(4-(3-(1h-1,2,4-三唑-1-基)-4-(3,4,5-三甲氧基苯甲酰基)苯基)噻唑-2-基)-2-氨基-3-甲基丁酰胺或其药学上可接受的盐可口服施用或胃肠外施用,且优选口服施用。
再者,所述免疫检查点抑制剂可口服施用或胃肠外施用。
举例而言,作为免疫检查点抑制剂的抗体、融合蛋白、适体或其免疫检查点蛋白结合片段可胃肠外施用。
举例而言,作为免疫检查点抑制剂的小分子化合物可口服施用或胃肠外施用。
在本公开的组合物中,上文的有效组分的合适剂量范围根据患者体重、年龄、性别、健康状况、饮食、施用时间、施用方法、排泄率、疾病严重性等而改变。(s)-n-(4-(3-(1h-1,2,4-三唑-1-基)-4-(3,4,5-三甲氧基苯甲酰基)苯基)噻唑-2-基)-2-氨基-3-甲基丁酰胺或其药学上可接受的盐的日常剂量是约1至20mg/m2,优选5至15mg/m2。再者,作为本公开的免疫检查点抑制剂的抗体、融合蛋白、适体或其免疫检查点蛋白结合片段的日常剂量是约0.1至50mg/kg,优选1至30mg/kg。作为本公开的免疫检查点抑制剂的小分子化合物的日常剂量是约1至1500mg,优选200至800mg。
此外,在本公开的组合物中,施用上文有效组分的合适间隔可取决于该剂量。(s)-n-(4-(3-(1h-1,2,4-三唑-1-基)-4-(3,4,5-三甲氧基苯甲酰基)苯基)噻唑-2-基)-2-氨基-3-甲基丁酰胺或其药学上可接受的盐的施用可为一日一次或每三周一次,尤其一周两次,但不限于此。此外,本公开的免疫检查点抑制剂的施用可为一日一次或每三周一次,但不限于此。
本公开提供一种用于治疗癌症的方法,其包括将本发明的vda及免疫检查点抑制剂施用至有需要的个体中。在本公开中,术语“个体”包含哺乳动物,尤其人类。治疗方法包括治施用疗有效量,其中术语“治疗有效量”是指对癌症治疗有效的本发明vda及免疫检查点抑制剂的量。上文的vda及免疫检查点抑制剂可以任何顺序相继施用或同时施用。
本公开提供vda及免疫检查点抑制剂用于制备用于癌症治疗的药物的用途。用于制备药物的包含本发明的vda及免疫检查点抑制剂的组合物可与可接受的载体等混合,且可进一步包含其他药物。
本公开提供用于治疗癌症的组合物,其包含vda及免疫检查点抑制剂。
除非互相矛盾,否则本公开的用途、组合物、治疗方法中提及的物质(matter)同等适用。
本发明的模式
此后,将通过实施例更详细地描述本公开的配置及作用。然而,以下实施例仅出于阐释本公开的目的而提供,因此本发明的范畴不限于此。
实施例1、式2的化合物对提升树状细胞活性的作用
1.实验方法
制备小鼠骨髓衍生的树状细胞(bm-dc)
小鼠骨髓衍生的树状细胞(bm-dc)获自balb/c或c57bl/6小鼠的股骨。使用含有40ng/ml的rmgm-csf(jwcreagene,sungnam,korea)及20ng/ml的rmil-4(jwcreagene)且含有10%热失活的fbs(hyclone)、100u/ml的青霉素、100μg/ml的链霉素(hyclone)及50μm的2-巯基乙醇(sigma-aldrich,inc.,st.louis,mo,usa)的杜氏改良依格尔培养基(dulbecco'smodifiedeaglemedium,dmem)保存细胞。
制备活性化合物
将式1的化合物的活性代谢物式2的化合物(化合物2)溶解于dmso中,且用小鼠骨髓衍生的树状细胞培养基稀释以制备活性化合物。
鉴定树状细胞的表型
为了鉴定树状细胞的表型,使用式2的化合物处理小鼠骨髓衍生的树状细胞24小时,随后用针对小鼠骨髓衍生的树状细胞的细胞表面标记的抗体(针对抗小鼠cd80、抗小鼠cd86或抗小鼠mhcii的抗体)以及同型对照抗体染色。使用facscantoii流式细胞计量器(bectondickinson)进行流式细胞分析。
测量由树状细胞产生的细胞因子
为了鉴定细胞因子分泌的改变,使用式2的化合物处理小鼠骨髓衍生的树状细胞24小时,随后使用细胞培养基测量细胞因子。免疫分析试剂盒(r&d系统)用于测量细胞因子,且由此测量il-1β、il-6及il-12。
测量树状细胞的吞噬作用
为了鉴定树状细胞的吞噬作用,使用100nm式2的化合物处理小鼠骨髓衍生的树状细胞(2×106/孔)18小时,且随后添加含有用荧光素异硫氰酸酯(fitc)标记的卵白蛋白的ova-微球,由此培养2小时。用pbs洗涤完全培养的细胞,且随后收集细胞,以多聚甲醛固定,且用流式细胞计量器分析。
统计学分析
使用学生t检验验证对照组与处理组之间的统计显著性。
2.实验结果
树状细胞的成熟
用式2的化合物处理小鼠骨髓衍生的树状细胞的结果显示于图1至图3中。图1、图2及图3显示分别使用cd80、cd86及mhcii作为细胞标记鉴定表型的结果。如上文图1及图2中所见,发现cd80及cd86在所有以0.01、0.1及1μm的浓度施用的组中有所增加。图3显示100nm的浓度时的结果,其中发现mhcⅱ作为成熟树状细胞的表型增加。根据上文结果,经鉴定,式2的化合物使树状细胞成熟。
细胞因子的产生增加
因使用式2的化合物处理而改变细胞因子的结果显示于图4中。作为使用式2的化合物处理小鼠骨髓衍生的树状细胞的结果,经鉴定,在所有施用式2的化合物的组中,il-1*?*、il-6及il-12增加。根据上文结果,经鉴定,式2的化合物使树状细胞成熟。
树状细胞的吞噬作用提升
测量树状细胞的吞噬作用的结果显示于图5中。作为使用流式细胞计量器分析荧光强度的结果,经鉴定,式2的化合物提升树状细胞的吞噬作用,且因此鉴定树状细胞对外来抗原的吞噬作用会提升。
实施例2、式1的化合物及免疫检查点抑制剂在癌症治疗中的协同效应(1)
1.实验方法
将小鼠结肠直肠癌细胞系mc38(8×104个细胞)皮下移植至c57bl/6小鼠。当癌症尺寸到达40-60mm3时,将载剂(vehicle)或5mg/kg式1的化合物腹膜内注射至小鼠中,一周两次。再者,在施用载剂或式1的化合物后的一日内,将1ug/ul(200微克/200微升/小鼠)抗pd-1抗体、抗ctla-4抗体或其二者(购自bioxcell)腹膜内注射至小鼠中,一周两次。测量癌症尺寸及重量,一周两次。
2.实验结果
上文实验结果显示于图6中。
在上文癌症动物模型中,式1的化合物及抗pd-1抗体及抗ctla-4抗体显著抑制了癌症生长。具体地,当分别与抗pd-1抗体或抗ctla-4抗体组合施用时,式1的化合物获得具有协同效应的极高治疗潜能。此外,抗癌效果在式1的化合物与抗pd-1抗体及抗ctla-4抗体的第三组合施用的实验组中得到最多提升,从而经鉴定,在十只实验动物的两只中,癌症完全消除。自上文结果发现组合施用式1的化合物与免疫检查点抑制剂获得显著极佳抗癌症效果,同时对癌症治疗具有协同效应。
实施例3、式1的化合物及免疫检查点抑制剂在癌症治疗中的协同效应(2)
1.实验方法
将小鼠结肠直肠癌细胞系mc38(8×104个细胞)皮下移植至c57bl/6小鼠。当癌症尺寸到达40-60mm3时,将载剂或5mg/kg式1的化合物腹膜内注射至小鼠中,一周两次。再者,在施用载剂或式1的化合物后的一日内,将1ug/ul(200微克/200微升/小鼠)抗pd-l1抗体经腹膜内注射至小鼠中,一周两次。测量癌症尺寸及重量,一周两次。
2.实验结果
上文实验结果显示于图7中。
在上文癌症动物模型中,式1的化合物及抗pd-l1抗体显著抑制了癌症生长。具体地,当与抗pd-l1抗体组合施用时,式1的化合物获得具有协同效应的非常高的治疗潜能。根据上文结果,经鉴定,组合施用式1的化合物与免疫检查点抑制剂获得显著极佳抗癌症效应,同时对癌症治疗具有协同效应。
- 还没有人留言评论。精彩留言会获得点赞!