新结晶形式的制作方法
相关申请的参考本申请要求2017年5月19日提交的美国临时申请no.62/508,830的权益,所述申请的全部内容以引用方式并入本文。发明领域本发明涉及5-(4-{[(2-氟苯基)甲基]氧基}苯基)-脯氨酰胺盐酸盐的新结晶形式、所述结晶形式在治疗由电压门控钠通道的调节所介导的疾病和疾患中的用途、含有所述结晶形式的组合物以及所述结晶形式的制备工艺。
背景技术:
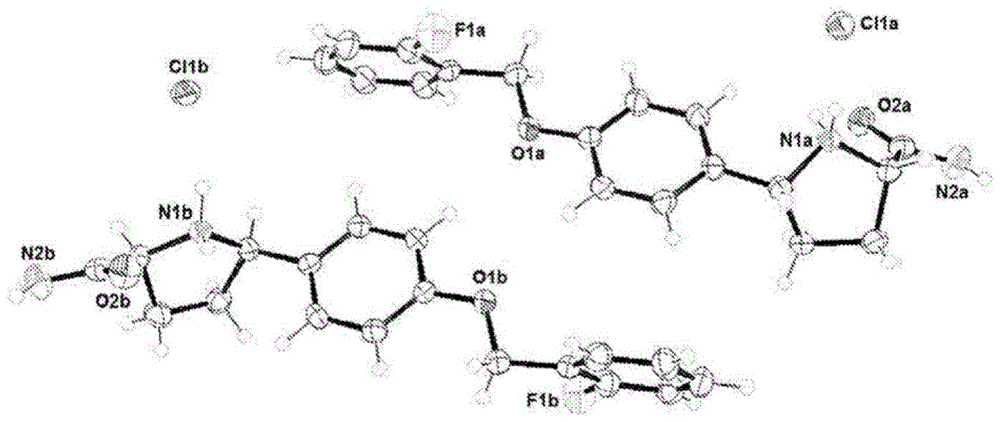
:在本文中称为式(i)化合物的(2s,5r)-5-(4-((2-氟苄基)氧基)苯基)吡咯烷-2-羧酰胺的盐酸盐:在wo2007/042239中被描述为在治疗由使用依赖性电压门控钠通道的调节所介导的疾病和疾患中具有实用性。在wo2007/042239和wo2011/029762中均描述了(2s,5r)-5-(4-((2-氟苄基)氧基)苯基)吡咯烷-2-羧酰胺盐酸盐的合成制剂。然而,需要开发具有期望的药剂学性质的此类α-羧酰胺吡咯烷衍生物的结晶形式。技术实现要素:根据本发明的第一实施方案,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的结晶形式,其特征在于所述结晶形式是无水形式或溶剂化形式。根据本发明的进一步实施方案,提供了一种药物组合物,所述药物组合物包含如本文所限定的结晶形式和一种或多种药学上可接受的载体、稀释剂和/或赋形剂。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式,其用于疗法。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式,其用于治疗由电压门控钠通道的调节所介导的疾病或疾患。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式在制造用于治疗由电压门控钠通道的调节所介导的疾病或疾患的药物中的用途。根据本发明的进一步实施方案,提供了一种治疗由电压门控钠通道的调节所介导的疾病或疾患的方法,所述方法包括向有需要的受试者施用治疗有效量的如本文所限定的结晶形式。附图说明图1:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式1(无水a)的ortep表示。图2:式(i)化合物·h+cl-形式1(无水a)的pxrd图。图3:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式2(乙醇)的ortep表示。图4:式(i)化合物·h+cl-形式2(乙醇)的pxrd图。图5:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式3(甲醇)的ortep表示。注意,一个甲醇分子显示具有0.5的部分占有率,并且每个式(i)化合物存在1.5个甲醇分子。图6:式(i)化合物·h+cl-形式3(甲醇)的pxrd图。图7:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式4(1-丙醇)的ortep表示。图8:式(i)化合物·h+cl-形式4(1-丙醇)的pxrd图。图9:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式5(1-丁醇)的ortep表示。图10:式(i)化合物·h+cl-形式5(1-丁醇)的pxrd图。图11:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式6(2-甲氧基乙醇)的ortep表示。图12:式(i)化合物·h+cl-形式6(2-甲氧基乙醇)的pxrd图。图13:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式7(乙二醇)的ortep表示。注意,为清楚起见,乙二醇分子无序地占据了部分位点。还应注意,该图示出了据信为多种无序溶剂的物质的单一表示。图14:式(i)化合物·h+cl-形式7(乙二醇)的pxrd图。图15:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式8(丙二醇)的ortep表示。注意,为清楚起见,丙二醇分子和含f1的环无序地占据了部分位点。图16:式(i)化合物·h+cl-形式8(丙二醇)的pxrd图。图17:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式9(无水b)的ortep表示。图18:式(i)化合物·h+cl-形式9(无水b)的pxrd图。图19:以50%的概率示出的具有热椭球体的式(i)化合物·h+cl-形式10(无水c)的ortep表示。图20:式(i)化合物·h+cl-形式10(无水c)的pxrd图。图21:根据针对无水路线d、e和f所述的程序制备的固体形式的粉末堆积密度分析。图22:根据针对无水路线d、e和f所述的程序制备的固体形式的粉末流动函数分析。图23:根据针对无水路线d、e和f所述的程序制备的固体形式的粉末时间固结行为分析。具体实施方式根据本发明的第一实施方案,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的结晶形式,其特征在于所述结晶形式是无水形式或溶剂化形式。在一个实施方案中,所述结晶形式是无水形式。本文中提及的“无水形式”是指不含结晶晶格水的固体形式。在进一步实施方案中,所述无水形式选自无水形式a(形式1)、无水形式b(形式9)或无水形式c(形式10)。在一个实施方案中,所述结晶形式是无水形式a(形式1)。无水形式a(形式1)是迄今为止确定的最稳定的结晶形式,并且有利地展现出适合于临床开发和商业用途的特性。无水形式a(形式1)在本文实施例2中加以描述,并在图1中示出。根据本发明的进一步实施方案,提供了一种制备无水形式a(形式1)的工艺,所述工艺包括实施例2中所述的方法。在一个实施方案中,无水形式a(形式1)的特征在于表1中的任何一个或多个或所有参数。在进一步实施方案中,无水形式a(形式1)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:9.56、11.48、12.71、14.30、16.23、17.49、17.87、19.23、19.74、19.87、20.40、21.09、21.47、22.47、23.06、23.87、24.10、26.61、26.79、27.37、28.09、31.89、32.66、33.25和34.20。这些峰与从图2的x射线衍射图外推出的峰有关。在进一步实施方案中,无水形式a(形式1)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:9.56、12.71、19.23、20.40、21.09、21.47和27.37。这些峰与从图2的x射线衍射图外推出的最强峰有关。在进一步实施方案中,无水形式a(形式1)的特征在于图2的x射线衍射图。在一个实施方案中,所述结晶形式是无水形式b(形式9)。无水形式b(形式9)不如无水形式a(形式1)稳定,但可能具有溶解度比无水形式a(形式1)高的优点。无水形式b(形式9)在本文实施例10中加以描述,并在图17中示出。根据本发明的进一步实施方案,提供了一种制备无水形式b(形式9)的工艺,所述工艺包括实施例10中所述的方法。在一个实施方案中,无水形式b(形式9)的特征在于表17中的任何一个或多个或所有参数。在进一步实施方案中,无水形式b(形式9)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:6.52、12.95、16.33、19.44、19.85、21.86、22.23、23.56、25.27、26.51、27.21和27.86。这些峰与从图18的x射线衍射图外推出的峰有关。在进一步实施方案中,无水形式b(形式9)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:16.33和21.86。这些峰与从图18的x射线衍射图外推出的最强峰有关。在进一步实施方案中,无水形式b(形式9)的特征在于在6.52处具有2θ衍射(°)峰的x射线衍射图。该峰与图18的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,无水形式b(形式9)的特征在于图18的x射线衍射图。在一个实施方案中,所述结晶形式是无水形式c(形式10)。无水形式c(形式10)不如无水形式a(形式1)稳定,但可能具有溶解度比无水形式a(形式1)高的优点。无水形式c(形式10)在本文实施例11中加以描述,并在图19中示出。根据本发明的进一步实施方案,提供了一种制备无水形式c(形式10)的工艺,所述工艺包括实施例11中所述的方法。在一个实施方案中,无水形式c(形式10)的特征在于表19中的任何一个或多个或所有参数。在一个实施方案中,无水形式c(形式10)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:4.51、8.99、12.97、17.48、18.03、19.45、20.19、21.39、21.76、23.50、25.34、26.37、27.19、31.84、33.14和36.57。这些峰与从图20的x射线衍射图外推出的峰有关。在进一步实施方案中,无水形式c(形式10)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:17.48、20.19、21.76、23.50和26.37。这些峰与从图20的x射线衍射图外推出的最强峰有关。在进一步实施方案中,无水形式c(形式10)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:4.51、8.99和18.03。这些峰与图20的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,无水形式c(形式10)的特征在于图20的x射线衍射图。在一个实施方案中,所述结晶形式是溶剂化形式。术语“溶剂化形式”是指其中溶剂结合到晶格中的固体形式。这种物理缔合可能涉及不同程度的离子键合和共价键合,包括氢键合。术语“溶剂化物”旨在涵盖溶液相和分离的溶剂化物。在进一步实施方案中,所述结晶形式是用乙醇、甲醇、1-丙醇、1-丁醇、2-甲氧基乙醇、乙二醇或丙二醇溶剂化的形式。在进一步实施方案中,所述结晶形式是乙醇溶剂化物(形式2)。据信,乙醇溶剂化物(形式2)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了乙醇溶剂化物(形式2)作为中间体在制备无水形式a(形式1)中的用途。乙醇溶剂化物(形式2)在本文实施例3中加以描述,并在图3中示出。根据本发明的进一步实施方案,提供了一种制备乙醇溶剂化物(形式2)的工艺,所述工艺包括实施例3中所述的方法。在一个实施方案中,乙醇溶剂化物(形式2)的特征在于表3中的任何一个或多个或所有参数。在一个实施方案中,乙醇溶剂化物(形式2)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:4.16、8.31、11.29、12.45、13.36、15.43、15.69、16.24、18.67、18.92、20.03、20.49、21.04、21.45、22.05、22.61、23.07、23.57、24.48、26.30、27.16和28.57。这些峰与从图4的x射线衍射图外推出的峰有关。在进一步实施方案中,乙醇溶剂化物(形式2)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:8.31、11.29、18.67、21.45和27.16。这些峰与从图4的x射线衍射图外推出的最强峰有关。在进一步实施方案中,乙醇溶剂化物(形式2)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:4.16、8.31、13.36和15.43。这些峰与图4的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,乙醇溶剂化物(形式2)的特征在于在8.31处具有2θ衍射(°)峰的x射线衍射图。该峰与从图4的x射线衍射图外推出的最强峰有关,该图还提供了图4的x射线衍射图与图2中的无水形式a(形式1)的x射线衍射图之间的区分峰。在进一步实施方案中,乙醇溶剂化物(形式2)的特征在于图4的x射线衍射图。在进一步实施方案中,所述结晶形式是甲醇溶剂化物(形式3)。据信,甲醇溶剂化物(形式3)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了甲醇溶剂化物(形式3)作为中间体在制备无水形式a(形式1)中的用途。甲醇溶剂化物(形式3)在本文实施例4中加以描述,并在图5中示出。根据本发明的进一步实施方案,提供了一种制备甲醇溶剂化物(形式3)的工艺,所述工艺包括实施例4中所述的方法。在一个实施方案中,甲醇溶剂化物(形式3)的特征在于表5中的任何一个或多个或所有参数。在一个实施方案中,甲醇溶剂化物(形式3)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.55、9.53、14.98、16.05、17.70、18.85、19.30、21.94、22.45、22.79、23.30、24.18、25.23、26.07、26.60、27.61、28.76、29.62、31.00、32.20和32.91。这些峰与从图6的x射线衍射图外推出的峰有关。在进一步实施方案中,甲醇溶剂化物(形式3)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.55、18.85、19.30、22.45和23.30。这些峰与从图6的x射线衍射图外推出的最强峰有关。在进一步实施方案中,甲醇溶剂化物(形式3)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.55、14.98和29.62。这些峰与图6的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,甲醇溶剂化物(形式3)的特征在于在7.55处具有2θ衍射(°)峰的x射线衍射图。该峰与从图6的x射线衍射图外推出的最强峰有关,该图还提供了图6的x射线衍射图与图2中的无水形式a(形式1)的x射线衍射图之间的区分峰。在进一步实施方案中,甲醇溶剂化物(形式3)的特征在于图6的x射线衍射图。在进一步实施方案中,所述结晶形式是1-丙醇溶剂化物(形式4)。据信,1-丙醇溶剂化物(形式4)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了1-丙醇溶剂化物(形式4)作为中间体在制备无水形式a(形式1)中的用途。1-丙醇溶剂化物(形式4)在本文实施例5中加以描述,并在图7中示出。根据本发明的进一步实施方案,提供了一种制备1-丙醇溶剂化物(形式4)的工艺,所述工艺包括实施例5中所述的方法。在一个实施方案中,1-丙醇溶剂化物(形式4)的特征在于表7中的任何一个或多个或所有参数。在一个实施方案中,1-丙醇溶剂化物(形式4)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.92、7.85、11.37、11.78、15.82、16.94、18.92、20.91、21.72、22.97、23.77、24.13、24.47、25.46、26.17、28.15、31.66和34.84。这些峰与从图8的x射线衍射图外推出的峰有关。在进一步实施方案中,1-丙醇溶剂化物(形式4)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.85、11.37、18.92、21.72和22.97。这些峰与从图8的x射线衍射图外推出的最强峰有关。在进一步实施方案中,1-丙醇溶剂化物(形式4)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.92和7.85。这些峰与图8的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,1-丙醇溶剂化物(形式4)的特征在于在7.85处具有2θ衍射(°)峰的x射线衍射图。该峰与从图8的x射线衍射图外推出的最强峰有关,该图还提供了图8的x射线衍射图与图2中的无水形式a(形式1)的x射线衍射图之间的区分峰。在进一步实施方案中,1-丙醇溶剂化物(形式4)的特征在于图8的x射线衍射图。在进一步实施方案中,所述结晶形式是1-丁醇溶剂化物(形式5)。据信,1-丁醇溶剂化物(形式5)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了1-丁醇溶剂化物(形式5)作为中间体在制备无水形式a(形式1)中的用途。1-丁醇溶剂化物(形式5)在本文实施例6中加以描述,并在图9中示出。根据本发明的进一步实施方案,提供了一种制备1-丁醇溶剂化物(形式5)的工艺,所述工艺包括实施例6中所述的方法。在一个实施方案中,1-丁醇溶剂化物(形式5)的特征在于表9中的任何一个或多个或所有参数。在一个实施方案中,1-丁醇溶剂化物(形式5)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.92、7.78、11.45、15.57、15.72、16.56、18.95、19.74、21.24、21.53、21.88、23.14、24.43、25.54、26.35、27.20、28.32、31.74、33.37和34.66。这些峰与从图10的x射线衍射图外推出的峰有关。在进一步实施方案中,1-丁醇溶剂化物(形式5)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:11.45、18.95和23.14。这些峰与从图10的x射线衍射图外推出的最强峰有关。在进一步实施方案中,1-丁醇溶剂化物(形式5)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.92和7.78。这些峰与图10的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,1-丁醇溶剂化物(形式5)的特征在于图10的x射线衍射图。在进一步实施方案中,所述结晶形式是2-甲氧基乙醇溶剂化物(形式6)。据信,2-甲氧基乙醇溶剂化物(形式6)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了2-甲氧基乙醇溶剂化物(形式6)作为中间体在制备无水形式a(形式1)中的用途。2-甲氧基乙醇溶剂化物(形式6)在本文实施例7中加以描述,并在图11中示出。根据本发明的进一步实施方案,提供了一种制备2-甲氧基乙醇溶剂化物(形式6)的工艺,所述工艺包括实施例7中所述的方法。在一个实施方案中,2-甲氧基乙醇溶剂化物(形式6)的特征在于表11中的任何一个或多个或所有参数。在一个实施方案中,2-甲氧基乙醇溶剂化物(形式6)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.86、7.70、11.54、15.38、19.05、19.30、19.96、21.56、21.90、23.17、24.51、25.53和31.79。这些峰与从图12的x射线衍射图外推出的峰有关。在进一步实施方案中,2-甲氧基乙醇溶剂化物(形式6)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:11.54、19.05和23.17。这些峰与从图12的x射线衍射图外推出的最强峰有关。在进一步实施方案中,2-甲氧基乙醇溶剂化物(形式6)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:3.86和7.70。这些峰与图12的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,2-甲氧基乙醇溶剂化物(形式6)的特征在于图12的x射线衍射图。在进一步实施方案中,所述结晶形式是乙二醇溶剂化物(形式7)。据信,乙二醇溶剂化物(形式7)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了乙二醇溶剂化物(形式7)作为中间体在制备无水形式a(形式1)中的用途。乙二醇溶剂化物(形式7)在本文实施例8中加以描述,并在图13中示出。根据本发明的进一步实施方案,提供了一种制备乙二醇溶剂化物(形式7)的工艺,所述工艺包括实施例8中所述的方法。在一个实施方案中,乙二醇溶剂化物(形式7)的特征在于表13中的任何一个或多个或所有参数。在一个实施方案中,乙二醇溶剂化物(形式7)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:8.38、11.29、12.69、13.40、15.54、15.89、16.40、18.74、18.95、19.79、20.12、20.73、21.24、21.90、22.43、23.26、23.78、24.43、26.35、26.02、27.06、27.71、28.50、29.47、29.68、30.51、30.66、32.96、33.57、33.89、35.75和37.86。这些峰与从图14的x射线衍射图外推出的峰有关。在进一步实施方案中,乙二醇溶剂化物(形式7)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:11.29、18.74、18.95、20.73、21.24、24.43、26.35和27.06。这些峰与从图14的x射线衍射图外推出的最强峰有关。在进一步实施方案中,乙二醇溶剂化物(形式7)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:8.38、13.40、18.74、18.95和29.68。这些峰与图14的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,乙二醇溶剂化物(形式7)的特征在于在18.74处具有2θ衍射(°)峰的x射线衍射图。该峰与从图14的x射线衍射图外推出的最强峰有关,该图还提供了图14的x射线衍射图与图2中的无水形式a(形式1)的x射线衍射图之间的区分峰。在进一步实施方案中,乙二醇溶剂化物(形式7)的特征在于图14的x射线衍射图。在进一步实施方案中,所述结晶形式是丙二醇溶剂化物(形式8)。据信,丙二醇溶剂化物(形式8)可用作潜在的加工中间体,因此代表了用于分离无水形式a(形式1)的替代合成路线。因此,根据本发明的进一步实施方案,提供了丙二醇溶剂化物(形式8)作为中间体在制备无水形式a(形式1)中的用途。丙二醇溶剂化物(形式8)在本文实施例9中加以描述,并在图15中示出。根据本发明的进一步实施方案,提供了一种制备丙二醇溶剂化物(形式8)的工艺,所述工艺包括实施例9中所述的方法。在一个实施方案中,丙二醇溶剂化物(形式8)的特征在于表15中的任何一个或多个或所有参数。在一个实施方案中,丙二醇溶剂化物(形式8)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.47、10.86、11.21、11.85、13.80、14.95、16.42、16.86、17.59、18.71、21.80、22.48、25.22、25.46和27.06。这些峰与从图16的x射线衍射图外推出的峰有关。在进一步实施方案中,丙二醇溶剂化物(形式8)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:11.85、16.86和21.80。这些峰与从图16的x射线衍射图外推出的最强峰有关。在进一步实施方案中,丙二醇溶剂化物(形式8)的特征在于在以下位置处具有2θ衍射(°)峰的x射线衍射图:7.47、11.85和14.95。这些峰与图16的x射线衍射图和图2中的无水形式a(形式1)的x射线衍射图之间的区分峰有关。在进一步实施方案中,丙二醇溶剂化物(形式8)的特征在于在11.85处具有2θ衍射(°)峰的x射线衍射图。该峰与从图16的x射线衍射图外推出的最强峰有关,该图还提供了图16的x射线衍射图与图2中的无水形式a(形式1)的x射线衍射图之间的区分峰。在进一步实施方案中,丙二醇溶剂化物(形式8)的特征在于图16的x射线衍射图。在一个实施方案中,如本文所限定的结晶形式是选自实施例12-14的固体形式中的任一种的无水形式。数据在本文的表21和图21-23中给出,这些数据证明了路线e和f的固体形式和无水路线d的固体形式作为活性药物成分的有益性质。在进一步实施方案中,如本文所限定的结晶形式是选自实施例13-14的固体形式中的任一种的无水形式。数据在本文的表21和图21-23中给出,这些数据证明了这些路线(即路线e和f)的产物相较于实施例12中描述的无水路线d的产物作为活性药物成分的优越的有益性质,特别是在粉末堆积密度(参见图21)和粉末流动函数(参见图22)方面的有益性质。在进一步实施方案中,如本文所限定的结晶形式是实施例13的无水形式。数据在本文的表21和图21-23中给出,这些数据证明了此路线(即路线e)的产物相较于路线f的产物(实施例14)和无水路线d的产物作为活性药物成分的优越的有益性质,特别是在粉末堆积密度(参见图21)、粉末流动函数(参见图22)和粉末时间固结行为(参见图23)方面的有益性质。根据本发明的进一步实施方案,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的无水结晶形式,其特征在于如本文所限定的那样进行测试,所述无水结晶形式具有至少0.4g/cm3,诸如至少0.5g/cm3的初始堆积密度。根据本发明的进一步实施方案,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的无水结晶形式,其特征在于根据本文的粉末流动函数分析进行测试,所述无水结晶形式在500pa的大主应力值下具有小于200pa的无约束屈服强度。如上文所讨论的,据信本发明的结晶形式(在本文中也称为本发明的化合物),特别地无水形式a(形式1)、无水形式b(形式9)和无水形式c(形式10)可用于治疗由电压门控钠通道的调节所介导的疾病和疾患。在一个实施方案中,所述化合物将为状态依赖性钠通道抑制剂。在另一个实施方案中,所述化合物将为亚型nav1.7钠通道状态依赖性抑制剂。在另一个实施方案中,所述化合物将为状态依赖性钠通道抑制剂,其具有关于口服施用,例如就暴露量(cmax)和/或生物利用度而言的适宜的可开发性特性。在一个实施方案中,所述化合物将为钠通道抑制剂。在另一个实施方案中,所述化合物将为亚型nav1.7钠通道抑制剂。在另一个实施方案中,所述化合物将为钠通道抑制剂,其具有关于口服施用,例如就暴露量(cmax)和/或生物利用度而言的适宜的可开发性特性。根据本发明的进一步实施方案,提供了本发明的化合物,其用作药物,优选地用作人类药物。根据进一步实施方案,本发明提供了本发明的化合物在制造用于治疗或预防由电压门控钠通道的调节所介导的疾病或疾患的药物中的用途。在一个特定实施方案中,本发明的化合物可用作镇痛药。例如,它们可用于治疗慢性炎性疼痛(例如与类风湿性关节炎、骨关节炎、类风湿性脊柱炎、痛风性关节炎和幼年型关节炎相关的疼痛);肌肉骨骼疼痛;下背部和颈部疼痛;扭伤和拉伤;神经性疼痛;交感神经维持性疼痛;肌炎;与癌症和纤维肌痛相关的疼痛;与偏头痛相关的疼痛;与流感或其他病毒感染(诸如普通感冒)相关的疼痛;风湿热;与功能性肠病症(诸如非溃疡性消化不良、非心脏性胸痛和肠易激综合症)相关的疼痛;与心肌缺血相关的疼痛;术后疼痛;头痛;牙痛;和痛经。本发明的化合物可用于治疗神经性疼痛。神经性疼痛综合征可在神经元损伤后发生,且即使在原始损伤已经治愈后,所产生的疼痛也可能持续数月或数年。神经元损伤可发生在周围神经、背根、脊髓或大脑的某些区域。神经性疼痛综合征通常根据造成它们的疾病或事件来分类。神经性疼痛综合征包括:糖尿病性神经病变;坐骨神经痛;非特异性下背部疼痛;多发性硬化症疼痛;纤维肌痛;hiv相关性神经病变;疱疹后神经痛;三叉神经痛;以及由身体创伤、截肢、癌症、毒素或慢性炎性疾患引起的疼痛。这些疾病是难以治疗的,尽管已知若干种药物具有有限的功效,但完全地控制疼痛是几乎不能实现的。神经性疼痛的症状是明显不同的,并且其经常被描述为自发的射击性和刀刺性痛,或持续性灼痛。此外,还存在与正常非疼痛感觉相关的疼痛,诸如“发麻”(感觉异常和感觉迟钝)、触摸敏感性增加(感觉过敏)、无害刺激后的疼痛感觉(动态、静态、热异常性疼痛)、对有害刺激敏感性增加(热、冷、机械痛觉过敏)、除去刺激后持续的痛觉(痛觉过敏)或选择性感觉传导通路的缺少或缺乏(痛觉减退)。本发明的化合物还可用于改善炎性病症,例如用于治疗皮肤疾患(例如晒伤、烧伤、湿疹、皮炎、牛皮癣);眼科疾病;肺部病症(例如哮喘、支气管炎、肺气肿、变应性鼻炎、非变应性鼻炎、咳嗽、呼吸窘迫综合征、好鸽者病(pigeonfancier’sdisease)、农民肺、慢性阻塞性肺病(copd);胃肠道病症(例如克罗恩病、溃疡性结肠炎、腹部疾病、节段性回肠炎、肠易激综合征、炎性肠病、胃食管返流疾病);具有发炎组分的其他疾患诸如偏头痛、多发性硬化症、心肌缺血。在一个实施方案中,本发明的化合物可用于治疗如本文所述的神经性疼痛或炎性疼痛。不希望被理论所束缚,可由电压门控钠通道的调节所介导的其他疾病或疾患选自由以下所组成的列表[以下所列疾病括号中的数字指的是由americanpsychiatricassociation(dsm-iv)出版的diagnosticandstatisticalmanualofmentaldisorders,第4版和/或internationalclassificationofdiseases,第10版(icd-10)中的分类代码]:i)抑郁和心境障碍,包括严重抑郁发作、躁狂发作、混合型发作和轻躁狂发作;抑郁症,包括严重抑郁症、轻郁症(300.4)、未另行指明的抑郁症(311);双相性精神障碍,包括i型双相性精神障碍、ii型双相性精神障碍(伴随轻躁狂发作的再发性严重抑郁发作)(296.89)、循环情感性精神障碍(301.13)和未另行指明双相性精神障碍(296.80);其他心境障碍,包括一般身体疾患(generalmedicalcondition)所致心境障碍(293.83)(包括下述亚型:伴随抑郁特征、伴随严重抑郁样发作、伴随狂躁特征和伴随混和特征)、物质引起的心境障碍(包括下述亚型:伴随抑郁特征、伴随狂躁特征和伴随混和特征)和未另行指明的心境障碍(296.90):ii)精神分裂症,包括下述亚型:偏执型精神分裂症(295.30)、瓦解型精神分裂症(295.10)、紧张型精神分裂症(295.20)、未分化型精神分裂症(295.90)和残余型精神分裂症(295.60);精神分裂症样精神障碍(295.40);情感分裂性精神障碍(295.70),包括下述亚型:双相型和抑郁型;妄想性精神障碍(297.1),包括下述亚型:情爱妄想型、夸大妄想型、嫉妒妄想型、被迫害妄想型、躯体妄想型、混合妄想型和未指明妄想型;短期性精神失常(298.8);共有型精神障碍(297.3);一般身体疾患所致精神障碍,包括下述亚型:伴随妄想(withdelusion)和伴随幻觉(withhallucination);物质引起的精神障碍,包括下述亚型:伴随妄想(293.81)和伴随幻觉(293.82);和未另行指明的精神障碍(298.9)。iii)焦虑障碍,包括惊恐发作;惊恐性障碍,包括无广场恐怖症的惊恐性障碍(300.01)和有广场恐怖症的惊恐性障碍(300.21);广场恐怖症;无惊恐性障碍病史的广场恐怖症(300.22);特殊恐怖症(300.29,以前称单纯恐怖症)(包括下述亚型:动物型、自然环境型、血液注射损伤型、情境型和其他类型)、社会恐怖症(社交焦虑障碍,300.23)、强迫性神经失调(300.3)、创伤后应激障碍(309.81)、急性应激障碍(308.3)、广泛性焦虑障碍(300.02)、一般身体疾患所致焦虑障碍(293.84)、物质引起的焦虑障碍、分离焦虑障碍(309.21)、适应障碍合并焦虑(309.24)和未另行指明的焦虑障碍(300.00):iv)物质相关性病症,包括物质使用病症,诸如物质依赖、物质渴求和物质滥用;物质引起的病症,诸如物质中毒、物质戒断、物质引起的谵妄、物质引起的持续性痴呆、物质引起的持续性遗忘症、物质引起的精神障碍、物质引起的心境障碍、物质引起的焦虑障碍、物质引起的性功能障碍、物质引起的睡眠障碍和致幻剂引起的持久性知觉障碍(幻觉重现);酒精相关性病症,诸如酒精依赖(303.90)、酒精滥用(305.00)、酒精中毒(303.00)、酒精戒断(291.81)、酒精中毒性谵妄、酒精戒断性谵妄、酒精引起的持续性痴呆、酒精引起的持续性遗忘症、酒精引起的精神障碍、酒精引起的心境障碍、酒精引起的焦虑障碍、酒精引起的性功能障碍、酒精引起的睡眠障碍和未另行指明的酒精相关性病症(291.9);安非他明(或安非他明类)相关性病症,诸如安非他明依赖(304.40)、安非他明滥用(305.70)、安非他明中毒(292.89)、安非他明戒断(292.0)、安非他明中毒性谵妄、安非他明引起的精神障碍、安非他明引起的心境障碍、安非他明引起的焦虑障碍、安非他明引起的性功能障碍、安非他明引起的睡眠障碍和未另行指明的安非他明相关性病症(292.9);咖啡因相关性病症,诸如咖啡因中毒(305.90)、咖啡因引起的焦虑障碍、咖啡因引起的睡眠障碍和未另行指明的咖啡因相关性病症(292.9);大麻相关性病症,诸如大麻依赖(304.30)、大麻滥用(305.20)、大麻中毒(292.89)、大麻中毒性谵妄、大麻引起的精神障碍、大麻引起的焦虑障碍和未另行指明的大麻相关性病症(292.9);可卡因相关性病症,诸如可卡因依赖(304.20)、可卡因滥用(305.60)、可卡因中毒(292.89)、可卡因戒断(292.0)、可卡因中毒性谵妄、可卡因引起的精神障碍、可卡因引起的心境障碍、可卡因引起的焦虑障碍、可卡因引起的性功能障碍、可卡因引起的睡眠障碍和未另行指明的可卡因相关性病症(292.9);致幻剂相关性病症,诸如致幻剂依赖(304.50)、致幻剂滥用(305.30)、致幻剂中毒(292.89)、致幻剂持续性知觉障碍(幻觉重现)(292.89)、致幻剂中毒性谵妄、致幻剂引起的精神障碍、致幻剂引起的心境障碍、致幻剂引起的焦虑障碍和未另行指明的致幻剂相关性病症(292.9);吸入剂相关性病症,诸如吸入剂依赖(304.60)、吸入剂滥用(305.90)、吸入剂中毒(292.89)、吸入剂中毒性谵妄、吸入剂引起的持续性痴呆、吸入剂引起的精神障碍、吸入剂引起的心境障碍、吸入剂引起的焦虑障碍和未另行指明的吸入剂相关性病症(292.9);尼古丁相关性病症,诸如尼古丁依赖(305.1)、尼古丁戒断(292.0)和未另行指明的尼古丁相关性病症(292.9);阿片样物质相关性病症,诸如阿片样物质依赖(304.00)、阿片样物质滥用(305.50)、阿片样物质中毒(292.89)、阿片样物质戒断(292.0)、阿片样物质中毒性谵妄、阿片样物质引起的精神障碍、阿片样物质引起的心境障碍、阿片样物质引起的性功能障碍、阿片样物质引起的睡眠障碍和未另行指明的阿片样物质相关性病症(292.9);苯环利定(或苯环利定类)相关性病症,诸如苯环利定依赖(304.60)、苯环利定滥用(305.90)、苯环利定中毒(292.89)、苯环利定中毒性谵妄、苯环利定引起的精神障碍、苯环利定引起的心境障碍、苯环利定引起的焦虑障碍和未另行指明的苯环利定相关性病症(292.9);镇静剂、催眠剂或抗焦虑剂相关性病症,诸如镇静剂、催眠剂或抗焦虑剂依赖(304.10)、镇静剂、催眠剂或抗焦虑剂滥用(305.40)、镇静剂、催眠剂或抗焦虑剂中毒(292.89)、镇静剂、催眠剂或抗焦虑剂戒断(292.0)、镇静剂、催眠剂或抗焦虑剂中毒性谵妄、镇静剂、催眠剂或抗焦虑剂戒断性谵妄、镇静剂、催眠剂或抗焦虑剂持续性痴呆、镇静剂、催眠剂或抗焦虑剂持续性遗忘症、镇静剂、催眠剂或抗焦虑剂引起的精神障碍、镇静剂、催眠剂或抗焦虑剂引起的心境障碍、镇静剂、催眠剂或抗焦虑剂引起的焦虑障碍、镇静剂、催眠剂或抗焦虑剂引起的性功能障碍、镇静剂、催眠剂或抗焦虑剂引起的睡眠障碍和未另行指明的镇静剂、催眠剂或抗焦虑剂相关性病症(292.9);多种物质相关性病症,诸如多种物质依赖(304.80);以及其他(或未知)物质相关性病症,诸如促同化激素类、硝酸酯吸入剂和氧化亚氮:v)认知增强,包括治疗其他疾病中的认知损害,所述其他疾病诸如精神分裂症、双相性精神障碍、抑郁、其他精神障碍和与认知损害相关联的精神疾患,例如阿尔茨海默病:vi)睡眠障碍,包括原发性睡眠障碍,诸如睡眠失调,诸如原发性失眠(307.42)、原发性睡眠过度(307.44)、发作性睡病(347)、呼吸相关性睡眠障碍(780.59)、昼夜节律睡眠障碍(307.45)和未另行指明的睡眠失调(307.47);原发性睡眠障碍,诸如异态睡眠,诸如恶梦障碍(307.47)、夜惊症(307.46)、梦游症(307.46)和未另行指明的异态睡眠(307.47);与其他心里障碍相关的睡眠障碍,诸如与其他心理障碍相关的失眠(307.42)和与其他心理障碍相关的睡眠过度(307.44);一般身体疾患所致的睡眠障碍,特别是与诸如神经障碍、神经性疼痛、下肢不宁综合征、心和肺疾病的疾病相关联的睡眠紊乱;和物质引起的睡眠障碍,包括下述亚型:失眠型、睡眠过度型、异态睡眠型和混合型:睡眠呼吸暂停和时差综合征:vi)进食障碍,诸如神经性厌食症(307.1),包括下述亚型:斋戒型和狂吃/催泻型;神经性贪食症(307.51),包括下述亚型:催泻型和非催泻型;肥胖症;强迫进食障碍;暴食症;和未另行指明的进食障碍(307.50):vii)孤独症谱系障碍,包括孤独性障碍(299.00)、亚斯伯格症(asperger’sdisorder)(299.80)、蕾特氏症(rett’sdisorder)(299.80)、儿童崩解症(299.10)和未另行指明的普遍性病症(299.80,包括不典型孤独症)。viii)注意力缺陷/多动症,包括下述亚型:注意力缺陷/多动症混合型(314.01)、注意力缺陷/多动症注意缺陷为主型(314.00)、注意力缺陷/多动症活动过度冲动型(314.01)和未另行指明的注意力缺陷/多动症(314.9);过动症;破坏性行为障碍,诸如品行障碍,包括下述亚型:儿童发作型(321.81)、青少年发作型(312.82)和未指明发作型(312.89)、对立违抗性障碍(313.81)和未另行指明的破坏性行为障碍;和抽动障碍,诸如图雷特氏症(tourette’sdisorder)(307.23):ix)人格障碍,包括下述亚型:偏执型人格障碍(301.0)、分裂样人格障碍(301.20)、分裂型人格障碍(301,22)、反社会型人格障碍(301.7)、边缘型人格障碍(301,83)、表演型人格障碍(301.50)、自恋型人格障碍(301,81)、回避型人格障碍(301.82)、依赖型人格障碍(301.6)、强迫型人格障碍(301.4)和未另行指明的人格障碍(301.9):以及x)性功能障碍,包括性欲障碍,诸如机能减退的性欲障碍(302.71)和性厌恶障碍(302.79);性唤起障碍,诸如女性性唤起障碍(302.72)和男性勃起障碍(302.72);性高潮障碍,诸如女性性高潮障碍(302.73)、男性性高潮障碍(302.74)和早泄(302.75);性交痛障碍,诸如性交困难(302.76)和阴道痉挛(306.51);未另行指明的性功能障碍(302.70);性欲倒错,诸如露阴癖(302.4)、恋物癖(302.81)、摩擦癖(302.89)、恋童癖(302.2)、性受虐狂(302.83)、性施虐狂(302.84)、易装癖(302.3)、窥阴癖(302.82)和未另行指明的性欲倒错(302.9);性身份障碍,诸如儿童性身份障碍(302.6)和青少年或成人性身份障碍(302.85);和未另行指明的性功能障碍(302.9)。xi)冲动控制障碍”,包括:间歇性暴发性障碍(312.34)、偷窃狂(312.32)、病理性赌博(312.31)、纵火狂(312.33)、拔毛狂(312.39)、未另行指明的冲动控制障碍(312.3)、暴食症、强迫购买、强迫性行为和强迫囤积症。在另一个实施方案中,可由电压门控钠通道的调节所介导的疾病或疾患为抑郁或心境障碍。在另一个实施方案中,可由电压门控钠通道的调节所介导的疾病或疾患为物质相关性病症。在进一步实施方案中,可由电压门控钠通道的调节所介导的疾病或疾患为双相性精神障碍(包括i型双相性精神障碍、ii型双相性精神障碍(即,伴随轻躁狂发作的再发性严重抑郁发作)(296.89)、循环情感性精神障碍(301.13)或未另行指明的双相性精神障碍(296.80))。在另一进一步实施方案中,可由电压门控钠通道的调节所介导的疾病或疾患为尼古丁相关性病症,诸如尼古丁依赖(305.1)、尼古丁戒断(292.0)和未另行指明的尼古丁相关性病症(292.9)。本发明的化合物还可用于治疗和/或预防使用抗惊厥药可治疗或可预防的病症,诸如包括创伤后癫痫的癫痫、强迫症(ocd)、睡眠障碍(包括昼夜节律障碍、失眠和发作性睡病)、抽搐症(例如抽动秽语综合征(gilesdelatourette'ssyndrome))、共济失调、肌肉僵直(痉挛状态),和颞下颌关节功能障碍。本发明的化合物还可用于治疗膀胱炎症后膀胱反射亢进(hyperrelexia)。本发明的化合物还可用于治疗神经退行性疾病和神经变性,诸如痴呆,特别是退行性痴呆(包括老年痴呆、阿尔茨海默病、皮克病、亨廷顿舞蹈病、帕金森病和克-雅二氏病、运动神经元病);所述化合物还可用于治疗肌萎缩性脊髓侧索硬化症(als)和神经炎症。本发明的化合物还可用于神经保护以及用于治疗中风、心脏停搏、肺旁路、创伤性脑损伤、脊髓损伤等后的神经变性。本发明的化合物还可用于治疗耳鸣,并且其可作为局部麻醉剂。本发明的化合物还可以与其他治疗剂组合使用。因此,在进一步实施方案中,本发明提供了包含如本文所限定的结晶形式与另外的治疗剂的组合,其用于治疗由电压门控钠通道的调节所介导的疾病和疾患,诸如疼痛。本发明的化合物可以与表明可用于治疗或预防疼痛的其他药物(即镇痛药)组合使用。这样的治疗剂包括例如cox-2(环氧合酶-2)抑制剂,诸如塞来昔布、德拉昔布、罗非考昔、伐地昔布、帕瑞昔布、cox-189或2-(4-乙氧基-苯基)-3-(4-甲磺酰基-苯基)-吡唑并[1,5-b]哒嗪(wo99/012930);5-脂氧合酶抑制剂;nsaid(非甾体类抗炎药),诸如双氯芬酸、消炎痛、萘丁美酮或布洛芬;双膦酸盐、白三烯受体拮抗剂;dmard(抗风湿病药物),诸如甲氨蝶呤;腺苷a1受体激动剂;钠通道阻断剂,诸如拉莫三嗪;nmda(n-甲基-d-天冬氨酸盐)受体调节剂,诸如甘氨酸受体拮抗剂或美金刚;电压门控钙通道的α2δ亚基的配体,诸如加巴喷丁、普瑞巴林和solzira;三环抗抑郁药,诸如阿米替林;神经元稳定的抗癫痫药;胆碱酯酶抑制剂,诸如加兰他敏;单胺能摄取抑制剂,诸如文拉法辛;阿片样物质镇痛药;局部麻醉剂;5ht1激动剂,诸如曲普坦,例如舒马曲坦、那拉曲普坦、佐米曲普坦、依来曲普坦、夫罗曲普坦、阿莫曲普坦或利扎曲普坦;烟碱乙酰胆碱(nach)受体调节剂;谷氨酸受体调节剂,例如nr2b亚型的调节剂;ep4受体配体;ep2受体配体;ep3受体配体;ep4激动剂和ep2激动剂;ep4拮抗剂;ep2拮抗剂和ep3拮抗剂;大麻素受体配体;缓激肽受体配体;辣椒素受体或瞬时受体电位(trp)配体;以及嘌呤能受体配体,包括在p2x3、p2x2/3、p2x4、p2x7或p2x4/7的拮抗剂;kcnq/kv7频道打开剂,诸如瑞替加滨;在美国专利no5,474,995、us5,633,272、us5,466,823、us6,310,099和us6,291,523;和在wo96/25405、wo97/38986、wo98/03484、wo97/14691、wo99/12930、wo00/26216、wo00/52008、wo00/38311、wo01/58881和wo02/18374中公开的另外的cox-2抑制剂。在一个实施方案中,本发明涉及共同疗法、辅助疗法或联合疗法,所述疗法包括施用本发明的化合物和一种或多种镇痛药(例如曲马多或阿米替林)、抗惊厥药(例如加巴喷丁、镇顽癫(neurontin)或普瑞巴林(即lyrica))或抗抑郁药(例如度洛西汀(即cymbalta)或文拉法辛)。在该实施方案中,治疗有效量应是指各种剂组合在一起,以使组合效应引发所需的生物学或医学反应的量。例如,包括施用本发明的化合物和至少一种适宜的镇痛药、抗惊厥药或抗抑郁药的共同疗法的治疗有效量将是合起来或相继具有治疗有效的联合效应的本发明的化合物的量和所述适宜的镇痛药、抗惊厥药或抗抑郁药的量。此外,本领域技术人员将认识到,就具有治疗有效量的共同疗法而言,本发明的化合物的量和/或所述适宜的镇痛药、抗惊厥药或抗抑郁药的量单独地可能是治疗有效或无效的。如本文所用,术语“共同疗法”、“辅助疗法”和“联合疗法”应是指通过施用一种或多种镇痛剂、抗惊厥剂或抗抑郁剂和本发明的化合物对有需要的受试者进行的治疗,其中本发明的化合物和所述一种或多种镇痛剂、抗惊厥剂或抗抑郁剂通过任何适宜的手段同时、相继地、单独地或以单一药物制剂形式施用。当相继施用时,可以首先施用本发明的化合物或第二治疗剂。当同时施用时,可以以相同或不同的药物组合物形式施用该组合。当在相同制剂中组合时,应当理解两种化合物必须是稳定的,并且必须与彼此以及制剂的其他组分相容。当单独地配制时,它们可以方便地以本领域中对于此类化合物已知的方式,以任何方便的制剂形式提供。当本发明的化合物和所述一种或多种镇痛剂、抗惊厥剂或抗抑郁剂以单独的剂型施用时,每种化合物每天施用的剂量数可以相同或不同。本发明的化合物和所述一种或多种镇痛剂、抗惊厥剂或抗抑郁剂可以通过相同或不同的施用途径来施用。适宜的施用方法的实例包括但不限于口服、静脉内(iv)、肌内(im)、皮下(sc)、鼻内、透皮和直肠。化合物还可以直接施用至神经系统,包括但不限于脑内、心室内、脑室内、鞘内、脑池内、脊髓内和/或脊髓周围施用途径,经由颅内或椎骨内针头和/或带有或不带有泵装置的导管进行递送。本发明的化合物和所述一种或多种镇痛剂、抗惊厥剂或抗抑郁剂可以根据同时或交替方案在疗法过程中的相同或不同时间以分开形式或单个形式同时施用。有利地,本发明的化合物可以以单日剂量施用,或者可以以每日两次、三次或四次的分剂量施用总日剂量。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式,其用于疗法。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式,其用于治疗由电压门控钠通道的调节所介导的疾病或疾患。根据本发明的进一步实施方案,提供了如本文所限定的结晶形式在制造用于治疗由电压门控钠通道的调节所介导的疾病或疾患的药物中的用途。根据本发明的进一步实施方案,提供了一种治疗由电压门控钠通道的调节所介导的疾病或疾患的方法,所述方法包括向有需要的受试者施用治疗有效量的如本文所限定的结晶形式。如本文所用,术语“受试者”是指已经成为治疗、观察或实验的对象的动物,优选为哺乳动物,最优选为人类成人、儿童或婴儿。应当理解,本文中对“治疗”的提及延伸到预防、防止复发和抑制或改善症状(无论是轻度、中度还是重度的)以及治疗确定的疾患。如本文所用,术语“治疗有效量”是指研究人员、兽医、医师或其他临床医生所寻求的在组织系统、动物或人体中引起生物学或医学反应的活性化合物或药剂的量,所述生物学或医学反应包括缓解所治疗疾病或病症的一种或多种症状;和/或减轻所治疗疾病或病症的一种或多种症状的严重程度。本发明的化合物可以作为原料化学品施用,但是活性成分优选作为药物组合物呈现。因此,根据本发明的进一步实施方案,提供了一种药物组合物,所述药物组合物包含如本文所限定的结晶形式和一种或多种药学上可接受的载体、稀释剂和/或赋形剂。如本文所用,术语“组合物”旨在涵盖包含指定量的指定成分的产物,以及直接或间接地由指定量的指定成分的组合产生的任何产物。由于本文所述的化合物旨在用于药物组合物中,因此容易理解,它们各自优选以基本上纯的形式提供,例如至少60%纯、更合适地至少75%纯、优选地至少85%纯、特别地至少98%纯(%以重量基位的重量给出)。化合物的不纯制剂可用于制备在药物组合物中使用的更纯的形式。根据本发明的进一步实施方案,提供了一种包含本发明的化合物的药物组合物,其用于治疗由电压门控钠通道的调节所介导的疾病或疾患。在一个实施方案中,所述药物组合物包含一种或多种药学上可接受的载体、稀释剂和/或赋形剂。所述载体、稀释剂和/或赋形剂必须是“可接受的”,其含义为与组合物的其他成分相容并且不会对其接受者有害。包含本发明的化合物作为活性成分的药物组合物可以根据常规药物配混技术,通过将化合物与药物载体充分混合来制备。这些程序可包括适当地混合、粒化和压缩或溶解成分,成为所需的制备物。本发明的化合物可采用根据本领域公知的常规程序,通过将本发明的化合物与标准药物载体或稀释剂组合制备的常规剂型来施用。这些程序可包括适当地混合、粒化和压缩或溶解成分,成为所需的制备物。化合物或其药学上可接受的盐可以通过任何方便的方法施用,例如通过口服、肠胃外、经颊、舌下、经鼻、直肠或透皮施用,并且对药物组合物相应地调整以向包括人在内的哺乳动物施用。在口服施用时具有活性的化合物或其药学上可接受的盐可以配制成液体或固体,例如配制成糖浆剂、混悬剂、乳剂、片剂、胶囊剂或锭剂。本发明的局部制剂可作为例如软膏、膏霜或洗剂、眼用软膏和眼滴剂或耳滴剂、浸渍的敷料和气溶胶呈现,并且可含有适当的常规的添加剂(诸如防腐剂)、辅助药物渗透的溶剂和在软膏和膏霜中的软化剂。制剂还可含有相容的常规载体,诸如膏霜或软膏基料和用于洗剂的乙醇或油醇。这样的载体可作为制剂的约1%至约98%存在。更通常地,它们形成制剂的最多约80%。液体制剂通常将由活性成分在一种或多种适宜的液体载体中的悬浮液或溶液组成,所述液体载体例如有水性溶剂诸如水、乙醇或甘油,或非水性溶剂诸如聚乙二醇或油。制剂还可以含有悬浮剂、防腐剂、调味剂和/或着色剂。用于口服施用的片剂和胶囊剂可为单位剂量呈现形式,并且可含义常规的赋形剂,诸如结合剂,例如糖浆、阿拉伯胶、明胶、山梨糖醇、黄蓍胶或聚乙烯基吡咯烷酮;填料,例如乳糖、糖、玉米淀粉、磷酸钙、山梨糖醇或甘氨酸;压片润滑剂,例如硬脂酸镁、滑石、聚乙二醇或二氧化硅;崩解剂,例如马铃薯淀粉;或可接受的湿润剂,诸如十二烷基硫酸钠。可以根据正常的药物实践中公知的方法将片剂包衣。口服液体制备物可为例如水性或油性混悬剂、溶液剂、乳剂、糖浆剂或酏剂形式,或者可作为干产物呈现,在使用前使用水或其他适宜的媒介物再组成。这样的液体制备物可含有常规的添加剂,诸如悬浮剂(例如山梨糖醇、甲基纤维素、葡萄糖糖浆、明胶、羟乙基纤维素、羧甲基纤维素、硬脂酸铝凝胶或氢化可食用脂肪)、乳化剂(例如卵磷脂、脱水山梨糖醇单油酸酯或阿拉伯胶);非水性媒介物(其可包括可食用油),例如杏仁油、油性酯,诸如甘油、丙二醇或乙醇;防腐剂,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸,以及如果需要的话常规的调味剂或着色剂。典型的肠胃外组合物由活性成分在无菌媒介物中的溶液或悬浮液组成,所述无菌媒介物优选为水,或肠胃外可接受的油,例如聚乙二醇、聚乙烯吡咯烷酮、卵磷脂、花生油或芝麻油。或者,可将溶液冻干,然后在施用前用适宜的溶剂再组成。取决于所使用的媒介物和浓度,化合物可以悬浮或溶解于媒介物中。在制备溶液剂时,化合物可溶解于注射用水中,经无菌过滤,随后填充至适宜的小瓶或安瓿,密封。有利地,剂(诸如局部麻醉剂、防腐剂和缓冲剂)可溶解于媒介物中。为了增强稳定性,在填充至小瓶中之后,可将组合物冷冻,并在真空下除去水。之后将干燥的冻干粉末密封在小瓶中,可供应注射用水的伴随小瓶,用于在使用前再组成液体。肠胃外混悬剂采用基本上相同的方式制备,不同之处在于,化合物悬浮于媒介物中而不是溶解,并且不能通过过滤实现灭菌。通过暴露于环氧乙烷,可将化合物灭菌,随后悬浮于无菌媒介物中。有利地,表面活性剂或湿润剂包括在组合物中,以促进化合物的均匀分布。经鼻施用的组合物可以方便地配制成气溶胶、滴剂、凝胶剂和散剂。气溶胶制剂通常包含活性成分在药学上可接受的水性或非水性溶剂中的溶液或精细悬浮液,并且通常以无菌形式以单剂量或多剂量形式存在于密封容器中,所述密封容器可以采取药筒或替换物的形式用于与雾化装置一起使用。或者,密封容器可以是一次性分配装置,诸如单剂量鼻吸入器或装有计量阀的气溶胶分配器。当剂型包含气溶胶分配器时,它将包含推进剂,所述推进剂可以是压缩气体例如压缩空气,或有机推进剂诸如氟氯烃或氢氟烃。气溶胶剂型还可以采取泵雾化器的形式。适于经颊或舌下施用的组合物包括片剂、锭剂和软锭剂,其中活性成分与载体诸如糖和阿拉伯胶、黄蓍胶或明胶和甘油一起配制。用于直肠施用的组合物方便地为含有常规栓剂基料诸如可可脂的栓剂形式。适于透皮施用的组合物包括软膏、凝胶和贴剂。在一个实施方案中,组合物是诸如片剂、胶囊剂或安瓿的单位剂型。用于治疗上述病症或疾病的化合物或其药学上可接受的盐的剂量将以通常的方式随所治疗的特定病症或疾病、受试者的体重和其他类似因素而变化。然而,一般而言,取决于施用方法,适宜的单位剂量可含有0.1重量%至100重量%,例如10重量%至60重量%的活性材料。取决于施用方法,组合物可含有0重量%至99重量%,例如40重量%至90重量%的载体。取决于施用方法,组合物可含有0.05mg至1000mg,例如1.0mg至500mg的活性材料。取决于施用方法,组合物可含有50mg至1000mg,例如100mg至400mg的载体。用于治疗上述病症的化合物的剂量将以通常的方式随病症的严重性、患者的体重和其他类似因素而变化。然而,一般而言,适宜的单位剂量可以在50mg至1500mg/天的范围内,例如120mg至1000mg/天。这种疗法可能会持续数周或数月。本领域技术人员认识到,本发明的化合物的单个剂量的优化量和间隔将由所治疗疾患的性质和程度、施用的形式、路线和部位以及所治疗的具体哺乳动物来确定,并且所述优化量可通过常规的技术来确定。另外,与所治疗的具体患者相关的因素,包括患者的年龄、体重、饮食和施用时间,将导致需要调整剂量。本领域技术人员还认识到,优化的治疗过程,即,对于限定的天数每天给予的本发明的化合物的剂量的数量可由本领域技术人员使用常规的治疗测定测试过程来确定。在整个说明书以及随后的权利要求书中,除非上下文另有要求,否则词语“包括”以及诸如“包含”和“含有”的变型将被理解为意指包括所述整体或步骤或者整体的组,但不排除任何其他整体或步骤或者整体或步骤的组。在本说明书中所引用的所有出版物,包括但不限于专利和专利申请,均以引用方式并入本文,如同具体且单独地指示每个单独的出版物以引用的方式与完全阐述一样并入本文。实施例通过以下实施例来说明本发明:方法使用brukerapex-iiccd衍射仪(173k)或brukerd8quest衍射仪(293k)进行单晶分析。用帕拉通油(paratoneoil)将样品固定在尼龙环上,使用mokα辐射源进行数据收集。使用以下三种方法之一获得所有pxrd光谱:方法1方法2方法3制造商brukerbrukerpanalytical型号d8advanced8advanceempyrean检测器psdlynxpsdlynxx’celerator辐射源cucucu发电机电压(kv)404045发电机电流(ma)404040起始2θ角(°)3.03.03.0终止2θ角(°)39.888338.968140.0步长大小(°)0.01640.01640.0167扫描步进时间(s)0.10.517.8形式2、31、4-89、10本文提供的峰的所有值均旨在表示具有选自以下的误差界限的2θ衍射(°)的值:±0.5,诸如±0.25,具体地±0.15,特别地±0.1,更特别是±0.05,最特别地±0.01。使用olex2(dolomanov等人(2009)j.appl.cryst.42,339-341),采用直接法求解方法,利用shelxs(sheldrick(2008)actacrystallogra,64(1),112-122)结构求解程序求解结构。该模型使用最小二乘最小化对2014/6版xl(sheldrick,2008)进行了精化。实施例1:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐(e1)实施例1的化合物可以如wo2007/042239的实施例2的程序1-5中所述制备。实施例2:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式1(无水a)(e2)将25.0mg实施例1添加至3ml闪烁小瓶中。添加thf(2.00ml),并将所得悬浮液搅拌10分钟。将悬浮液通过0.45μmptfe过滤器过滤,并将滤液小瓶置于20ml闪烁小瓶中。将己烷(2ml)放入外部小瓶中,密封整个系统,在室温下储存3天,在这之后在3ml小瓶中出现一批无色晶体。选择这些晶体之一进行单晶x射线衍射实验。完整的表征结果显示在图1和图2以及下面的表1和表2中。表1:形式1的单晶结构信息和精化参数.表2:从图2外推出的形式1的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰)。实施例3:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式2(乙醇)(e3)将25.0mg实施例1添加至3ml闪烁小瓶中。添加etoh(1.00ml),并将所得悬浮液搅拌10分钟。将悬浮液通过0.45μmptfe过滤器过滤,并将己烷(0.8ml)添加至滤液中。将小瓶关闭并静置2天,在此期间获得了一批无色晶体。分离出这些晶体之一,并通过单晶x射线衍射进行分析。完整的表征结果显示在图3和图4以及下面的表3和表4中。表3:形式2的单晶结构信息和精化参数.表4:从图4外推出的形式2的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例4:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式3(甲醇)(e4)将100.1mg实施例1添加至3ml闪烁小瓶中。添加meoh(1.00ml),并将所得悬浮液搅拌10分钟。将悬浮液通过0.45μmptfe过滤器过滤,将滤液小瓶关闭并静置10分钟,在这之后在小瓶底部出现一批无色晶体。通过单晶x射线衍射分析该批次的单晶体以进行结构解析。完整的表征结果显示在图5和图6以及下面的表5和表6中。表5:形式3的单晶结构信息和精化参数.表6:从图6外推出的形式3的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例5:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式4(1-丙醇)(e5)将25.0mg实施例1添加至3ml闪烁小瓶中。添加1-丙醇(7.00ml),并将所得悬浮液搅拌10分钟。将悬浮液通过中等玻璃料过滤以产生饱和的1-丙醇溶液。将1ml的该溶液添加至20ml闪烁小瓶中,并将己烷(9ml)添加至该小瓶中。将小瓶关闭并静置2天,在此期间获得了一批无色晶体。通过单晶x射线衍射分析这些晶体之一。完整的表征结果显示在图7和图8以及下面的表7和表8中。表7:形式4的单晶结构信息和精化参数.表8:从图8外推出的形式4的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例6:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式5(1-丁醇)(e6)将50.8mg实施例1添加至20ml闪烁小瓶中。添加1-丁醇(4.00ml),并将所得悬浮液搅拌10分钟。将悬浮液加热至100℃并继续搅拌10分钟,此时获得澄清溶液。将实施例1以小增量添加到搅拌的溶液中直至获得悬浮液。此时,添加500μl的1-丁醇,并将所得澄清溶液搅拌5分钟。通过预热的0.45μmptfe过滤器和注射器将溶液热过滤。封闭小瓶,将温度降低至70℃,并使小瓶静置过夜。第二天,可见大批量无色晶体。在室温下通过在1ml的1-丁醇中搅拌5.5mg实施例1来制备实施例1在在1-丁醇中的饱和悬浮液。将悬浮液通过0.45μmptfe过滤器过滤。倾析出含晶体的溶液(仍在70℃下),并添加实施例1在1-丁醇中的室温饱和溶液。在使整个系统在室温下冷却至平衡后,选择一些晶体并将其与母液一起转移至3ml小瓶中。将该样品送去进行单晶分析,获得1-丁醇溶剂化物的结构。完整的表征结果显示在图9和图10以及下面的表9和表10中。表9:形式5的单晶结构信息和精化参数.表10:从图10外推出的形式5的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例7:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式6(2-甲氧基乙醇)(e7)将24.3mg实施例1添加至3ml小瓶中,并悬浮于3ml2-甲氧基乙醇中。将悬浮液在室温下搅拌15分钟,随后通过中等玻璃料过滤,得到2-甲氧基乙醇饱和溶液。将1ml饱和溶液添加至3ml小瓶中,添加500μl己烷,将该小瓶密封并在环境条件下储存2天。获得了小批量的晶体,将这些晶体送去进行单晶xrd分析。完整的表征结果显示在图11和图12以及表11和表12中。表11:形式6的单晶结构信息和精化参数.表12:从图12外推出的形式6的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例8:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式7(乙二醇)(e8)将48.9mg实施例1添加至20ml闪烁小瓶中。添加4ml乙二醇,对悬浮液进行加热直至完全溶解(70℃)。将溶液缓慢冷却(约5℃/30min),得到一批单晶体。分离出单晶体并将其于母液中送去进行分析,分析确定了其为标题化合物的溶剂化物。完整的表征结果显示在图13和图14以及下面的表13和表14中。表13:形式7的单晶结构信息和精化参数.表14:从图14外推出的形式7的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例9:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式8(丙二醇)(e9)将74.1mg实施例1悬浮于1ml丙二醇中,搅拌10分钟,并通过中等玻璃料过滤以产生饱和溶液。将100μl饱和溶液添加至3ml小瓶中。添加900μl乙酸乙酯,将小瓶密封并在环境条件下储存过夜。第二天,可见一批晶体。将这些晶体于母液中送去进行单晶分析,并用于确定其是否为标题化合物的溶剂化物。完整的表征结果显示在图15和图16以及下面的表15和表16中。表15:形式8的单晶结构信息和精化参数.表16:从图16外推出的形式8的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例10:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式9(无水b)(e10)将10mg的实施例1溶解在1.5ml玻璃小瓶中的0.5-1.5ml乙腈中,在50℃下平衡1小时。将视觉上澄清的溶液使用尼龙膜(孔径为0.45μm)过滤,然后使用带一些针孔的将小瓶密封,之后在50℃下蒸发。分离出所获得的固体进行单晶分析。完整的表征结果显示在图17和图18以及下面的表17和表18中。表17:形式9的单晶结构信息和精化参数.表18:从图18外推出的形式9的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例11:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐形式10(无水c)(e11)制备实施例1在甲醇中的饱和溶液并离心。将100μl所得溶液添加至含有2ml去离子水的3ml小瓶中。将所得的澄清溶液在室温下蒸发,得到适于进行x射线衍射的一批晶体。完整的表征结果显示在图19和图20以及下面的表19和表20中。表19:形式10的单晶结构信息和精化参数.表20:从图20外推出的形式10的pxrd衍射峰的列表.粗体峰表示基于计算模式的最强衍射峰,带下划线的峰指示相对于形式1的不同衍射峰,而粗体和带下划线的峰指示这两者)。实施例12:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐(无水;路线d)(e12)将9.0kg(2s,5r)-5-(4-((2-氟苄基)氧基)苯基)吡咯烷-2-羧酰胺(其可根据wo2016/102967的描述6中所述的路线来制备)在127kg乙醇中的溶液加热至最大50℃,以完全溶解。在30分钟内添加31kg的1.25mhcl的乙醇溶液。同时将温度保持在20℃-25℃之内。将反应器内容物的温度保持在25℃-35℃,搅拌大约2小时,冷却至0℃-5℃,搅拌大约2小时。将浆液过滤并将湿滤饼用2x14.0kg冷(0℃-5℃)乙醇洗涤。将产物湿滤饼在真空下于40℃-70℃的温度下干燥,直至剩余水分不少于0.4%,得到9.6kg干燥产物(e12)。实施例13:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐(无水;路线e)(e13)将在288kg异丙醇中含有60kg(2s,5r)-5-(4-((2-氟苄基)氧基)苯基)吡咯烷-2-羧酰胺(其可根据wo2016/102967的描述6中所述的程序来制备)的溶液用34.8kg的20%盐酸水溶液处理,同时将温度保持在61℃-67℃之间。在大约4小时内将混合物冷却至0℃-5℃,并搅拌大约2小时。将浆液过滤并将产物滤饼用71kg异丙醇洗涤。将湿滤饼在真空下于40℃-70℃的温度下干燥,直至剩余水分不多于0.4%,得到64kg干燥产物(e13)。实施例14:(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐(无水;路线f)(e14)将118.4kg(2s,5r)-5-(4-((2-氟苄基)氧基)苯基)吡咯烷-2-羧酰胺(其可根据wo2016/102967的描述6中所述的程序来制备)在600.4kg异丙醇、36kg水中的溶液在20-40分钟添加时间内用6n盐酸溶液处理,同时将温度保持在73℃-77℃之内。将混合物在3至4小时内冷却至3℃-7℃,并通过ikadr2000/10高剪切混合器循环。直至根据产物粒度的过程中测量确定粒度减小完全完成时,停止通过磨机进行再循环。将再循环管线用90kg异丙醇冲洗。将合并的异丙醇和研磨的浆液混合物在3小时内加热至58℃-62℃,在58℃-62℃下保持2小时,在3小时内冷却至-2℃至2℃,然后在(-2)-2℃下保持1-2小时。将浆液过滤并将产物滤饼用92kg异丙醇洗涤。将湿产物在真空下在45℃-80℃下干燥,直至最终干燥产物(e14;133.3kg)中存在不多于0.1%的异丙醇和不多于0.1%的水。粉末堆积密度分析对根据路线d、e和f所述的程序制备的固体形式(分别为实施例12-14)按照以下程序进行粉末堆积密度分析。使用具有rstcontrol95软件的环剪切力测试仪(rst-xs.s,dietmarschulze,wolfenbüttel,germany)进行体积密度分析。对于此分析,使用刮刀将低应力剪切盒(xs-lr0)底环过度填充少部分的粉末。通过用刮刀轻轻刮去粉末直至粉末与环的顶部齐平来除去多余的粉末。称量底环并输入总质量。出现提示时,将剪切盒盖附接到加载杆上,并将装满的底环放在驱动轴上以进行测试。初始堆积密度是由控制软件从用盒体积归一化的粉末质量计算得来的。在剪切测试期间,对粉末施加5个预剪切法向应力,即0.1、0.2、0.3、0.4和0.5kpa,随后进行剪切直至达到稳态。在每个预剪切法向应力下,在0与预剪切法向应力之间的5个增大的法向应力下将粉末剪切至破坏,从而生成对应的破坏时剪切应力。通过对剪切应力与法向应力的函数图进行线性回归来生成屈服轨迹。大主应力(x轴)是当通过预剪切法向应力并相切于屈服轨迹绘制莫尔圆时获得的最大值。由盖子的高度变化确定每个稳态下的粉末体积,并与初始粉末质量一起用于计算粉末堆积密度(y轴)。此分析的初始密度结果显示在表21中。图21示出了与制造目的相关的不同应力下密度的变化。表21:实施例12-14的初始密度产物初始密度(g/cm3)路线d;e120.254路线e;e130.565路线f;e140.512表21中描述的初始密度对应于图21中的x=0。通常,密度越高,产物的初始堆积状态越理想。从表21和图21中生成的结果可以看出,路线e的产物(e13)和路线f的产物(e14)表现出的密度结果远远优于路线d的产物(e12),因此路线e和f的产物可能更适合用作活性药物成分。在一个实施方案中,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的无水结晶形式,其初始堆积密度为至少约0.4g/cm3。在另一个实施方案中,所述无水结晶形式的初始堆积密度为至少约0.5g/cm3。在另一个实施方案中,所述无水结晶形式的初始堆积密度为至少约0.6g/cm3。在另一个实施方案中,所述无水结晶形式的初始堆积密度为约0.4g/cm3至约0.6g/cm3。在另一个实施方案中,所述无水结晶形式的初始堆积密度为约0.4g/cm3至约0.5g/cm3。在另一个实施方案中,所述无水结晶形式的初始堆积密度为约0.5g/cm3至约0.6g/cm3。粉末流动函数分析对根据路线d、e和f所述的程序制备的固体形式(分别为实施例12-14)按照以下程序进行粉末流动函数分析。使用具有rstcontrol95软件的环剪切力测试仪(rst-xs.s,dietmarschulze,wolfenbüttel,germany)进行流动函数分析。对于此分析,使用刮刀将低应力剪切盒(xs-lr0)底环过度填充少部分的粉末。通过用刮刀轻轻刮去粉末直至粉末与环的顶部齐平来除去多余的粉末。称量底环并输入总质量。出现提示时,将剪切盒盖附接到加载杆上,并将装满的底环放在驱动轴上以进行测试。为了获得流动函数,使用控制软件中的“stresswalk”函数确定5个屈服轨迹。在剪切测试期间,对粉末施加5个预剪切法向应力,即0.1、0.2、0.3、0.4和0.5kpa,以产生5个屈服轨迹。在每个预剪切法向应力下,在0与预剪切法向应力之间的5个等距的法向应力下将粉末剪切至破坏,从而生成对应的破坏时剪切应力。通过对剪切应力与法向应力的函数图进行线性回归来导出每个屈服轨迹。大主应力是当通过预剪切法向应力并相切于屈服轨迹绘制莫尔圆时获得的最大法向应力。无约束屈服强度是当相切于相同的屈服轨迹但穿过原点绘制第二个莫尔圆时获得的最大法向应力。无约束屈服强度与大主应力的函数图是流动函数。该分析的结果显示在图22中,该图展示了流动函数曲线。通常,较低的流动函数曲线表明粉末流动性良好。图22证明,路线e和f的产物(分别为e13和e14)的流动性比路线d的产物(e12)更好(即,它们具有较低的流动函数曲线)。对于较小的粒度,路线f产物(e14)的流动性可能低于路线e产物(e13)的流动性。应当指出的是,使产物承受大主应力的目的是为了模拟药物制造过程。在一个实施方案中,提供了(5r)-5-(4-{[(2-氟苯基)甲基]氧基}苯基)-l-脯氨酰胺盐酸盐的无水结晶形式,其特征在于根据本文的粉末流动函数分析进行测试,所述无水结晶形式在500pa的大主应力值下具有小于约200pa的无约束屈服强度。在另一个实施方案中,所述无水结晶形式在500pa的大主应力值下具有小于约100pa的无约束屈服强度。在另一个实施方案中,所述无水结晶形式在500pa的大主应力值下具有约50pa至约200pa的无约束屈服强度。在另一个实施方案中,所述无水结晶形式在500pa的大主应力值下具有约100pa至约200pa的无约束屈服强度。粉末时间固结行为分析对根据路线e和f所述的程序制备的固体形式(分别为实施例13和14)按照以下程序进行粉末时间固结分析。使用具有rstcontrol95软件的环剪切力测试仪(rst-xs.s,dietmarschulze,wolfenbüttel,germany)进行流动函数分析。对于此分析,使用刮刀将低应力剪切盒(xs-lr0)底环过度填充少部分的粉末。通过用刮刀轻轻刮去粉末直至粉末与环的顶部齐平来除去多余的粉末。称量底环并输入总质量。出现提示时,将剪切盒盖附接到加载杆上,并将装满的底环放在驱动轴上以进行测试。对于时间固结测试,首先通过对粉末施加0.1kpa的预剪切应力和在0与所述预剪切应力之间的5个等距的法向应力并确定对应的剪切应力来获得屈服轨迹。再次制备新鲜的粉末样品,并调节至与刚刚获得的屈服轨迹的稳态相似的稳态。将粉末在1000pa的法向应力下保持稳定,并在指定的12个小时持续时间内保持恒定。再次将粉末剪切至破坏,并平行于先前的屈服轨迹但穿过新的剪切点绘制新的屈服轨迹。通过相切于屈服轨迹并穿过原点绘制莫尔圆,从该屈服轨迹获得新的无约束屈服强度。确定在这种新的调节状态之后获得的剪切应力的变化,这种变化代表粉末的时间固结行为。此分析的结果显示在图23中。众所周知,粉末在储存时会发生固结。在图23的图表上x=250pa时,较低的点表示初始时间(0小时)下的无约束屈服强度(uys),较高的点表示存储后(12小时)的值。粉末由于储存而获得的强度是在特定应力下的时间固结强度。实际上,活性药物成分在制造环境(混合器、料斗、储存箱等)中会经历相似的保存时间,了解时间固结行为对于预测流动问题很重要。储存后的uys(y轴)值越高,影响就越大,流动问题就越有可能发生。或者,无约束屈服强度越低,固结趋势越小(越好)。从图23中的结果可以看出,路线f的产物(e14)未表现出如路线e的产物(e13)那么多的固结效应。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1