一种人源的脱细胞真皮基质的制备方法与流程
本发明涉及医疗材料技术领域,更具体的说是涉及一种人源的脱细胞真皮基质的制备方法。
背景技术:
真皮替代物在创面愈合过程中具有重要作用,能够在创面底部提供真皮支架,提高培养表皮膜片的成活率,减小创面收缩和瘢痕形成。对于大面积烧伤或者创伤的病人来说,皮肤移植是最好的治疗方法。脱细胞真皮基质(adm)具有与皮肤真皮近似的内在结构,作为真皮替代物在国内外实验、临床中均得到应用。
目前脱细胞真皮基质主要分为两类:异体脱细胞真皮基质和异种的脱细胞真皮基质。相比异种的脱细胞真皮基质,实践和临床的使用证实,来源于人的尸体皮制作的同种异体脱细胞真皮作为真皮替代物最为理想,其机械性能与正常皮肤接近,组织相容性较好,免疫排斥反应较小,更适合皮肤缺损的修复。
脱细胞真皮基质制备的目的是尽可能的去除皮肤组织中的细胞成分(包括表皮细胞、毛囊、皮脂腺、汗腺及真皮中的血管内皮细胞、成纤维细胞等),尽可能保留细胞外基质成分以及真皮组织完整的三维结构。这样能提供引导组织再生的生物支架,达到最大限度修复组织缺损的目的。虽然目前脱细胞真皮基质制备方法很多,但都或多或少存在一定问题:目前脱细胞真皮基质的制备方法均十分繁杂,需要酶消化,碱液处理等,步骤繁复,工艺复杂,大大增加了生产成本;目前脱细胞真皮基质的制备方法中大部分均使用了化学固定剂,如戊二醛等,这大大改变了脱细胞真皮基质的天然结构,并阻碍了脱细胞真皮基质在生物体内的降解;同时戊二醛残留造成了脱细胞产品较大的细胞和遗传毒性,极大地影响临床使用;目前也有很多的脱细胞真皮基质制备方法引入了碱溶液及有机溶剂处理,这不仅影响脱细胞真皮基质的结构,同时也加大了环境污染的可能性,废液的处理也增加了成本;如反复冻融法,此方法属于利用物理方法进行脱细胞处理,时间久、周期长,现在基本己经不用。
因此,提供一种人源的脱细胞真皮基质的制备方法是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种人源的脱细胞真皮基质的制备方法,保证获得的脱细胞真皮基质细胞毒性低、遗传毒性低,生物相容性高,获得的脱细胞真皮基质主要用于皮肤及黏膜缺损的修复。
为了实现上述目的,本发明采用如下技术方案:
一种人源的脱细胞真皮基质的制备方法,具体步骤如下:
(1)取储存的人源皮肤;
(2)清除皮下附带脂肪成分;
(3)将步骤(2)清除皮下附带脂肪成分的皮肤,用碘伏及酒精清洗消毒,后用低渗溶液反复浸泡清洗皮肤;
(4)将步骤(3)清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;
(5)弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
(6)将步骤(5)获得的真皮用含有ca2+的高渗盐溶液处理12-24h;
(7)弃去高渗盐溶液后,用生理盐水清洗;
(8)将步骤(7)清洗后的真皮置于配制好的“脱细胞液”中,在“透析装置”中处理2h-6h,获得脱细胞真皮基质;
(9)将步骤(8)获得的脱细胞真皮基质用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质。
进一步,步骤(3),将步骤(2)清除皮下附带脂肪成分的皮肤,用2%碘伏清洗消毒,用75%酒精脱碘,再用无菌蒸馏水反复浸泡清洗皮肤。
进一步,步骤(6),将步骤(5)获得的真皮用0.5-3mol/l含有ca2+的高渗盐溶液处理12-24h,ca2+的终浓度为1-10mm/l。
进一步,所述高渗盐溶液为0.5-3mol/l含有ca2+的氯化钠溶液,ca2+的终浓度为1-10mm/l。
进一步,步骤(8)所述的“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.5mol/l,ca2+1-10mmol/l;ca2+来自ca(no3)2,no3-2-20mmol/l。
进一步,步骤(8)所述的“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.6mol/l,ca2+1-10mmol/l;ca2+来自cacl2。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种人源的脱细胞真皮基质的制备方法,本发明的脱细胞真皮基质来源于人体皮肤,具有与皮肤真皮近似的内在结构,作为真皮替代物在国内外实验、临床中均得到应用;人体皮肤经脱细胞处理后免疫排斥反应极小,机械性能与正常皮肤接近,能获得满意的修复效果,在医学领域具有较高的实际应用价值;
本发明利用新型的“脱细胞液”,包含有ca2+、去污剂、nacl等成分,在脱去细胞的同时最大程度保持真皮结构不变化;ca2+作为一种细胞培养必须离子,在合适浓度下不仅能够稳定脱细胞真皮基质的结构,还能在脱细胞处理过程中增强材料的机械、理化性能、生物相容性、止血性能等作用;同时创新性的引入“透析装置”,在脱细胞的同时将有害的脱细胞试剂去除,保证产品的低细胞毒性、低遗传毒性,高生物相容性;
本发明采用的试剂价廉易得,无毒无害,在杀灭细菌、病毒等病原体的同时最大程度地脱去细胞,保留细胞基质成分,获得的产品免疫免疫排斥反应极小;
本发明制备方法简便,生产工艺简单可靠,提高生产效率,节约生产成本,采用本发明提供的方法可以最大程度减轻环境污染,同时获得的脱细胞真皮基质保留了皮肤基底膜,更利于细胞黏附增殖,同时脱细胞真皮含有丰富的生长因子,具有良好的生物相容性,更有利于支持细胞的生长。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
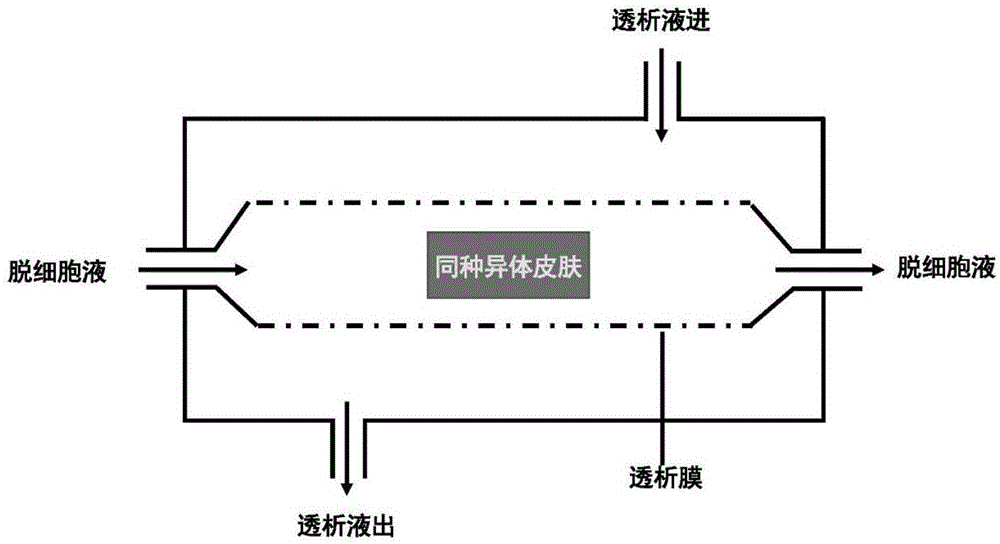
图1附图为本发明的透析装置示意图;
图2附图为本发明获得的脱细胞真皮基质的照片;
图3附图为本发明脱细胞真皮基质内部结构的电镜照片;
图4附图为本发明正常皮肤组织he染色结果;
图5附图为本发明脱细胞真皮基质he染色结果;
图6附图为本发明未使用脱细胞液、未采用透析装置制备的脱细胞真皮基质he染色图;
图7附图为本发明细胞增殖试验结果。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种人源的脱细胞真皮基质的制备方法,具体步骤如下:
(1)取储存的人源皮肤;
(2)清除皮下附带脂肪成分;
(3)将步骤(2)清除皮下附带脂肪成分的皮肤,用2%碘伏清洗消毒,用75%酒精脱碘,再用无菌蒸馏水反复浸泡清洗皮肤;
(4)将步骤(3)清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;
(5)弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
(6)将步骤(5)获得的真皮用2mol/l含有ca2+的氯化钠溶液处理18h,ca2+的终浓度为5mm/l;
(7)弃去2mol/l氯化钠溶液后,用生理盐水清洗;
(8)将步骤(7)清洗后的真皮置于配制好的“脱细胞液”中,“脱细胞液”包含以下组分:0.1%-0.5wt%胰酶,0.5-5mmedta,0.1%-0.5wt%tritonx-100,na+0.1-0.5mol/l,cl-0.1-0.5mol/l,ca2+1-10mmol/l;ca2+来自ca(no3)2,no3-2-20mmol/l;在“透析装置”中处理4h,获得脱细胞真皮基质;透析装置示意图如图1所示;
(9)将步骤8获得的脱细胞真皮基质用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质,如图2所示。
透析装置:将同种异体皮肤置于透析袋中,脱细胞液从一端进入,从装置另一端流出,在脱细胞的同时将脱细胞液中“有害”离子透析除去,在保证脱细胞效果的同时最大程度降低脱细胞真皮基质的细胞毒性和遗传毒性,有效地提高生物相容性。
实施例2脱细胞真皮基质的内部结构
(1)将上述获得的脱细胞真皮基质剪切为1cm×1cm大小,粘贴在金属托盘上;断面脱细胞真皮基质采用液氮骤冷的方法使其变硬变脆,再折断;断面朝上粘帖在金属托盘上。
(2)电镜样品准备间喷金后上机,扫描电镜观察并照相,结果如图3所示。
结果可见组织内无细胞残留,且胶原结构完整,与正常皮肤相似。
实施例3脱细胞真皮基质he染色
(1)分别将正常皮肤组织和脱细胞真皮基质分别置于4%的多聚甲醛固定液中固定24h;
(2)酒精脱水、二甲苯透明;
(3)浸蜡30min,包埋,制作5μm厚矢状位石蜡切片;
(4)梯度酒精进行脱蜡,脱水,he染色;
(5)透明,封片,光镜观察,正常皮肤组织he染色结果如图4所示,脱细胞真皮基质he染色结果如图5所示。
结果可见皮肤组织内无细胞残留。
实施例4
一种人源的脱细胞真皮基质的制备方法,具体步骤如下:
(1)取储存的人源皮肤;
(2)清除皮下附带脂肪成分;
(3)将步骤(2)清除皮下附带脂肪成分的皮肤,用2%碘伏清洗消毒,用75%酒精脱碘,再用无菌蒸馏水反复浸泡清洗皮肤;
(4)将步骤(3)清洗后的皮肤用2.5mg/mldispaseii溶液处理过夜;
(5)弃去dispaseii溶液,去除表皮,后用生理盐水清洗,获得真皮;
(6)将步骤(5)获得的真皮用2mol/l含有ca2+的氯化钠溶液处理18h,ca2+的终浓度为5mm/l;
(7)弃去氯化钠溶液后,用生理盐水清洗3次,每次15min,得到人源的脱细胞真皮基质,如图6所示。
实施例5细胞增殖试验(mtt)
(1)收集对数期hacat细胞,每孔加入100ul,铺板使待测细胞调密度至1000-10000个/孔;adm组:预先将与孔大小一致的无菌adm铺至孔底;wg-adm组:预先将与孔大小一致的无菌wg-adm铺至孔底;
(2)5%co2,37℃孵育,分别在12h,1d,2d,3d进行mtt检测;
(3)每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt),继续培养2h;
(4)终止培养,小心吸去孔内培养液;
(5)每孔加入150ul二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解,在酶联免疫检测仪od490nm处测量各孔的吸光值。
结果如图7所示,adm组:脱细胞真皮基质组;b组:空白组;c组:对照组(无adm,其他实验条件同adm组);wg-adm组:未添加ca2+、未采用透析装置制备的脱细胞真皮基质组。
从mtt实验可以看出,利用本发明方法制备得到的adm无细胞毒性,与其他组相比能够有效促进细胞增殖,有利于细胞增殖。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!