抗肿瘤药物及其制备方法与流程
本发明涉及一种抗癌药物,具体涉及一种光热光动力治疗抗癌药物及其制备方法。
背景技术:
肿瘤治疗技术主要包括手术切除、化疗、放射性治疗及光学治疗等。其中,光学治疗主要有光热治疗和光动力治疗。光热治疗是利用具有光热转换的材料,在外部光源的激发下能用产生的热能来杀死癌细胞的方法。而光动力治疗是在外部光源的作用下激发光敏剂产生活性氧进而导致细胞损伤及坏死的治疗方法。虽然光热治疗与光动力治疗得到了广泛的研究与报道,但是肿瘤具有很强异质性及其复杂的微环境,一般的光热治疗及光动力学治疗很难将其完全消除。
光热与光动力学联合治疗方法能有效克服肿瘤细胞的异质性,已被科学家们证实。但是,现今的联合光学治疗大多都是用较短波长光激发或多种波长激发光源,降低了治疗的效果以及操作性。而光热与光动力治疗的核心就是光敏剂。现今的光敏剂只能用于光动力治疗,而无法兼具光热与光动力治疗两方面。
因此,设计一种光热与光动力抗肿瘤药物具有非常重要的研究意义与应用价值。
技术实现要素:
本发明的目的是提供一种抗癌药物及其制备方法,以解决现有抗癌药物的种类不够丰富以及抗癌新途径较为单一的技术问题。
为了解决上述问题本发明提供了一种抗肿瘤药物,包括一种光热光敏剂,所述光敏剂,包括载体和结合于所述载体上的光敏剂功能成分;
所述光敏剂载体为纳米级的核壳结构,所述核壳结构包括核体和包覆于所述核体的壳体,所述核体为聚多巴胺纳米颗粒,所述壳体包括gd离子化合物、yb离子化合物和er离子化合物。
优选地,所述gd元素、yb元素和er元素的摩尔比例为78%:20%:2%。
优选地,所述光敏剂载体的粒径为120-160nm;
所述核体粒径为50-70nm;
所述壳体的厚度为70-90nm。
优选地,所述上转换光敏剂功能成分包括光敏剂ce6分子。
优选地,所述光敏剂功能成分与载体比值10%-15%。
优选地,所述抗肿瘤药物的制备方法包括如下步骤:
在聚多巴胺纳米颗粒上包裹稀土碳酸氢氧物层;
将稀土碳酸氢氧物层转换成上转换发光层;
在所述的上转换发光层上修饰活性基团;
在修饰有活性基团的上转换发光层上装载光敏剂;
添加其他辅料。
优选地,所述活性基团包括羟基、羧基和氨基中的任意一种或多种。
优选地,所述抗癌药物的用量为.
优选地,所述抗癌药物还修饰有靶向癌细胞的物质。
优选地,所述靶向癌细胞的物质包括叶酸。
与现有技术相比,本发明的抗癌药物一方面采用光热材料,聚多巴胺纳米颗粒做核心起到光热治疗的作用;另一方面以稀土元素作为光动力治疗的上转换能量中间站,使得可以用低能量的近红外光,对生物体伤害小。经上转换成为波长较短能量较高的光,通过光敏剂激活单线态氧,达到治疗目的。两者联合使用,互相补充效果更佳。
本发明的抗癌药物的制备方法,步骤少,操作简单,每个步骤转化率高,且制备所得的药物性能优越,兼具两者治疗功能。
附图说明
图1本发明实施例所述光敏剂载体的合成步骤示意图;
图2为本发明实施例聚多巴胺纳米粒子和光敏剂载体的扫描电镜图;
图3本发明实施例提供的pda@ucnp的光热效果评价图;
图4是本发明实施例提供的pda@ucnp在980nm近红外光激发下的发射光谱及光敏分子的吸收光谱图。
图5为探针及不用对照组进行治疗的结果;
图6为纳米探针与pd-1免疫治疗结合用于肿瘤的治疗的效果图;
图7是纳米探针进行核磁共振成像的结果图(a为未注射探针,b为注射探针后)。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明实施例一方面提供了一种抗肿瘤药物,包括一种光热光敏剂,所述光敏剂,包括载体和结合于所述载体上的光敏剂功能成分;
所述光敏剂载体为纳米级的核壳结构,所述核壳结构包括核体和包覆于所述核体的壳体,所述核体为聚多巴胺纳米颗粒,所述壳体包括gd离子化合物、yb离子化合物和er离子化合物。本发明的光敏剂载体采用的是光热纳米材料,具有很强的光热性能,而不是像其他的光敏剂材料核体也是采用的上转换纳米材料。因此多具备一种光热性能。而采用的稀土元素的吸收波长是近红外区,并且通过上转化将两份长波长的近红外光转化为波长为一半的五百纳米以下的光,高能激发单线态氧,同时产生较强的光热效应。两者相互配合,达到消灭病灶的目的。
所述gd元素、yb元素和er元素的摩尔比例为78%:20%:2%。一方面多元素的掺杂可以使的吸收范围变广;二来由于各种元素的吸收强度发射强度都不尽相同,因此调整用量来平衡其总体强度。
所述光敏剂载体的粒径为120-160nm;
所述核体粒径为50-70nm;
所述壳体的厚度为70-90nm。
较小的粒径可以更充分的吸收能量传递能量,限于工艺条件,取条件所述的粒径范围。
所述上转换光敏剂功能成分包括光敏剂ce6分子。这几种光敏剂的吸收波长与稀土元素上转换后的发射波长重合度较高,因此选取这几种光敏剂。
所述光敏剂功能成分与载体比值10%-15%。需要足够的光敏剂载体才能让光敏剂功能发挥完全,过多的量则会造成浪费,因此选取此范围比例
所述抗肿瘤药物的制备方法包括如下步骤:
s01:在聚多巴胺纳米颗粒上包裹稀土碳酸氢氧物层;
s02:将稀土碳酸氢氧物层转换成上转换发光层。
s03:在所述的上转换发光层上修饰活性基团;
s04:在修饰有活性基团的上转换发光层上装载光敏剂;
s05:添加其他辅料。
在本发明实施例s01中,实现稀土碳酸氢氧物层的包裹是将包含稀土元素的盐溶解,加入聚多巴胺纳米颗粒并与碱性容易挥发的物质共热回流,得到稀土碳酸氢氧物层包裹的聚多巴胺颗粒。
在本发明实施例s02中,具体的所述稀土碳酸氢氧物层加入氟化物和氢氟酸,形成稀土元素的氟化物。
本发明实施例步骤s03和s04中所述活性基团包括羟基、羧基和氨基中的任意一种或多种。具体的选取带有两种活性基团的连接化合物,先选择性的连接上稀土元素,然后通过另一个基团与光敏剂连接完成装载。
本发明实施例步骤s05可以添加缓释剂,可以添加生物相容性高的物质,还可以添加一下基团改善溶解性等物理化学性能,根据具体的应用场景加以合理变化。
所述活性基团包括羟基、羧基和氨基中的任意一种或多种。具体的选取带有两种活性基团的连接化合物,先选择性的连接上稀土元素,然后通过另一个基团与光敏剂连接完成装载。
所述抗癌药物的用量为。这只是试验范围,根据不同的病情,不同的性质可以酌情改变用量来适应应用场景。
所述抗癌药物还修饰有靶向癌细胞的物质。
所述靶向癌细胞的物质包括叶酸。后续的研发中还可以加一些定位集团可以使本发明实施例所述的药物更具靶向性,这里的叶酸是优选的基团,根据实际需求可以选取别的基团。
与现有技术相比,本发明的抗癌药物一方面采用光热材料,聚多巴胺纳米颗粒做核心起到光热治疗的作用;另一方面以稀土元素作为光动力治疗的上转换能量中间站,使得可以用低能量的近红外光,对生物体伤害小。经上转换成为波长较短能量较高的光,通过光敏剂激活单线态氧,达到治疗目的。两者联合使用,互相补充效果更佳。
本发明的抗癌药物的制备方法,步骤少,操作简单,每个步骤转化率高,且制备所得的药物性能优越,兼具两者治疗功能。
实施例1
光敏剂的合成步骤如图1所示。
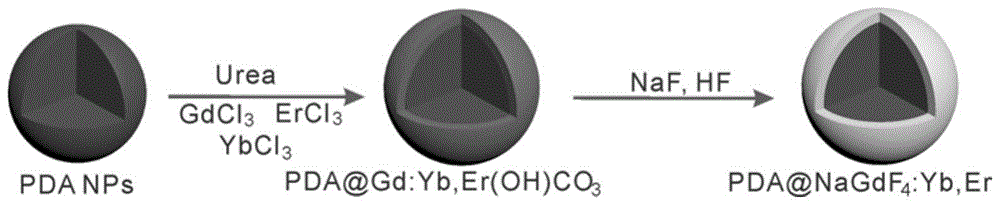
在20ml的乙醇-水(1:1)的混合溶液中,加入1ml稀土元素比例为78%:20%:2%(gdcl3:ybcl3:ercl3)的溶液,磁力搅拌10-30min形成透明溶液。加入步骤(1)中合成的3mg聚多巴胺纳米颗粒粉末,超声10-30min。随后将溶液在90℃下回流6h,即得到pda@gd,yb,er(oh)co3纳米颗粒。
将pda@gd,yb,er(oh)co3纳米颗粒分散于5ml水中,加入5ml乙二醇及20mgnaf,搅拌10min,转移至反应釜中,在180℃条件下处理8h。
将得到的纳米颗粒离心洗涤后分散于5-15ml乙醇-水溶液(1:1)中,加入0.1-0.5ml1mol/lnaf及0.1-0.5ml3mol/lhf溶液,搅拌10-30min,在100-180℃条件下处理4-12h,离心得到pda@ucnp纳米颗粒。
图2b所示为所得到的上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)的形貌图。图3为上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)在980nm近红外光以1w/cm2功率激发下的光热升温图。
将(2)中合成的pda@ucnp与多爪聚乙二醇(mpeg-pmhc18)按质量比1:1混合搅拌24h,洗涤,得到pda@ucnp-peg纳米颗粒。
加入光敏分子ce6乙醇溶液,搅拌12h,离心得到pda@ucnp-peg/ce6纳米探针。
图4为上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)在980nm近红外光激发下的发射光谱及光敏分子(ce6)的吸收光谱图。
实施例2
在20ml的乙醇-水(1:1)的混合溶液中,加入1ml稀土元素比例为60%:20%:20%(gdcl3:ybcl3:ercl3)的溶液,磁力搅拌10-30min形成透明溶液。加入步骤(1)中合成的3mg聚多巴胺纳米颗粒粉末,超声10-30min。随后将溶液在90℃下回流6h,即得到pda@gd,yb,er(oh)co3纳米颗粒。
将pda@gd,yb,er(oh)co3纳米颗粒分散于5ml水中,加入5ml乙二醇及20mgnaf,搅拌10min,转移至反应釜中,在180℃条件下处理8h。
将得到的纳米颗粒离心洗涤后分散于5-15ml乙醇-水溶液(1:1)中,加入0.1-0.5ml1mol/lnaf及0.1-0.5ml3mol/lhf溶液,搅拌10-30min,在100-180℃条件下处理4-12h,离心得到pda@ucnp纳米颗粒。
图2b所示为所得到的上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)的形貌图。图3为上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)在980nm近红外光以1w/cm2功率激发下的光热升温图。
将(2)中合成的pda@ucnp与多爪聚乙二醇(mpeg-pmhc18)按质量比1:1混合搅拌24h,洗涤,得到pda@ucnp-peg纳米颗粒。
加入光敏分子ce6乙醇溶液,搅拌12h,离心得到pda@ucnp-peg/ce6纳米探针。
实施例3
在20ml的乙醇-水(1:1)的混合溶液中,加入1ml稀土元素比例为78%:12%:10%(gdcl3:ybcl3:ercl3)的溶液,磁力搅拌10-30min形成透明溶液。加入步骤(1)中合成的3mg聚多巴胺纳米颗粒粉末,超声10-30min。随后将溶液在90℃下回流6h,即得到pda@gd,yb,er(oh)co3纳米颗粒。
将pda@gd,yb,er(oh)co3纳米颗粒分散于5ml水中,加入5ml乙二醇及20mgnaf,搅拌10min,转移至反应釜中,在180℃条件下处理8h。
将得到的纳米颗粒离心洗涤后分散于5-15ml乙醇-水溶液(1:1)中,加入0.1-0.5ml1mol/lnaf及0.1-0.5ml3mol/lhf溶液,搅拌10-30min,在100-180℃条件下处理4-12h,离心得到pda@ucnp纳米颗粒。
图2b所示为所得到的上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)的形貌图。图3为上转换发光层包覆的聚多巴胺纳米颗粒(pda@ucnp)在980nm近红外光以1w/cm2功率激发下的光热升温图。
将(2)中合成的pda@ucnp与多爪聚乙二醇(mpeg-pmhc18)按质量比1:1混合搅拌24h,洗涤,得到pda@ucnp-peg纳米颗粒。
加入光敏分子ce6乙醇溶液,搅拌12h,离心得到pda@ucnp-peg/ce6纳米探针。
实施例4
纳米探针(pda@ucnp-peg/ce6)用于皮下肿瘤治疗,其步骤是:
(1)小鼠肿瘤模型的制备:将5×105小鼠乳腺癌4t1细胞注射于balb/c小鼠后腿部,使肿瘤生长7-10天至100mm3左右待用。
(2)将2mg纳米探针(pda@ucnp-peg/ce6分散于100μlpbs磷酸缓冲液中)以瘤内注射的方式注射到小鼠肿瘤内部,然后对肿瘤部位进行光照(980nm,1w/cm2,5min)。分别设置探针对照组与光照对照组。
(3)每隔一天记录小鼠的肿瘤体积及体重。如图1所示,实验组的肿瘤基本消失,而其它组都有不同程度的生长,这一现象即说明了该纳米探针能有效地治疗肿瘤。
实施例5
纳米探针与pd-1免疫治疗结合用于肿瘤的治疗及肿瘤转移抑制,其步骤为:
(1)小鼠肿瘤模型的制备:将5×105小鼠乳腺癌4t1细胞注射于balb/c小鼠后腿部,使肿瘤生长7天后在小鼠的另一侧后腿部注射2×105小鼠乳腺癌4t1细胞,继续使肿瘤生长3天。
(2)将2mg纳米探针(pda@ucnp-peg/ce6分散于100μlpbs磷酸缓冲液中)以瘤内注射的方式注射到小鼠第一次接种的肿瘤内部,然后对该肿瘤部位进行光照(980nm,1w/cm2,5min),另一侧较小的肿瘤不做任何处理。分别设置探针对照组、光照对照组及pd-1抗体对照组。
(3)每隔一天记录小鼠的两测肿瘤体积。如图2所示,实验组中治疗的肿瘤基本消失,而且实验组另一侧的肿瘤生长都有不同程度的抑制。但是其它组两侧的肿瘤都有不同程度的生长,这一现象即说明了该纳米探针不仅能有效地治疗原发肿瘤也能抑制肿瘤的转移。
实施例6
体内核磁共振成像,其步骤为:
(1)小鼠肿瘤模型的制备:将5×105小鼠乳腺癌4t1细胞注射于balb/c小鼠后腿部,使肿瘤生长7-10天至100mm3左右待用。
(2)将纳米探针由静脉注射于小鼠体内,24h后在武汉物理与数学研究所进行核磁共振成像,仪器型号为bruker4.5t,german。并以未注射纳米探针的小鼠为空白试验。如图3所示,注射有纳米探针的小鼠肿瘤明显的信号增强,即说明了该探针能用于肿瘤的成像与监测。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗肿瘤药物奈拉滨化合物的制造方法与工艺
- 四苯基卟啉连二胺芳基钌化合物及其制备方法和用途与制造工艺
- 一种具抗肿瘤活性的不对称双1‑取代5‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双7‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双取代靛红席夫碱类化合物及其合成方法与制造工艺
- 一种抗肿瘤药物奈拉滨组合物的制造方法与工艺
- 含Micranthanone A用于抗肿瘤的药物的制造方法与工艺
- 一种小分子靶向药物脂质体制剂的制备方法与制造工艺
- 一种5?溴?1H?吡咯并[2,3?b]吡啶的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法