一种治疗脑胶质瘤的药物组合物的制作方法
1.本发明属于肿瘤治疗和生物医药技术领域,具体涉及一种治疗脑胶质瘤的药物组合物。
背景技术:
2.恶性肿瘤是严重危害人类生命健康的重大疾病,并已成为当今疾病致死亡的主要原因之一。我国肿瘤发病率和死亡率持续走高,形势严峻。目前脑胶质瘤的主要治疗手段有手术治疗、放疗和化疗等。由于手术后肿瘤的复发和转移仍需要化疗,故化疗仍然是目前应对肿瘤的主要手段。临床医生通过调节用药剂量可以优化得到最大的疗效和最小的毒性,帮助患者延长生存时间和提高预后生活质量。然而化疗药物普遍存在毒副作用过大问题,常常导致杀敌一千、自损八百,使病人体能和抵抗力急剧下降,生存期大幅缩短。造成这一结果的主要原因之一,就是绝大数化疗药物的药效选择性差,对肿瘤细胞的杀伤作用和与机体正常细胞的杀伤作用差别不大;另外一个原因,是抗肿瘤药物在体内的分布没有选择性,在肿瘤组织和机体正常组织中均广泛分布。因此,筛选对某种肿瘤细胞具有选择性杀伤作用的化疗药物,是提高肿瘤治疗效果的途径之一。
3.在各种肿瘤实体中,包括脑胶质瘤、急性骨髓性白血病(aml)、软骨肉瘤、胆管细胞癌、黑素瘤、前列腺癌、血管免疫母细胞的t细胞淋巴瘤等等,idh1 或idh2在独立的氨基酸位置发生突变(balss j.acta neuropathol.2008dec; 116(6):597-602,mardis er,n engl j med.2009sep 10;361(11):1058-66,amary mf,j pathol.2011jul;224(3):334-43,borger dr,oncologist.2012;17(1):72-9, shibata t,am j pathol.2011mar;178(3):1395-402,ghiam af,oncogene.2012aug 16;31(33):3826,cairns ra,blood.2012feb 23;119(8):1901-3)。这种突变始终是杂合的,并且互相排斥。已经在酶的催化域(负责2-酮戊二酸配位)的关键位置发现这些点突变的大部分,例如,idh1r100、idh1r132、idh1g97和idh2r140、 idh2r172(dang l.,nature,2009dec 10;462(7274):739-44)。在神经胶质瘤中,所有非原发性恶性胶质瘤的70%以上是idh1突变的,并且在92.7%的idh1突变的肿瘤当中,精氨酸被组氨酸替代(idh1r132h)(hartmann c,acta neuropathol. 2009oct;118(4):469-74)。
4.在那些催化残基上替代野生型氨基酸,会引起酶的新生活性,使α-酮戊二酸转化为r-2-羟基戊二酸(2-hg)。2-hg是代谢废物,但也是肿瘤代谢物 (oncometabolite),且被认为有助于肿瘤生成(dang l.,nature,2009dec 10;462(7274):739-44)。2-hg在正常细胞中仅以极低的水平生成,但隐藏idh突变的细胞产生高水平的2-hg。在具有idh突变的肿瘤中也发现了高数量的 2-hg。在具有高2-hg水平的其它病症的患者中也描述了idh突变,例如,在罕有的神经代谢病中,其特征在于超生理水平的2-hg(2-hg酸尿)(kranendijk m, science.2010oct 15;330(6002):336)。
5.由此,抑制idh突变和它的新生活性是胶质瘤及其它idh突变相关的病症的潜在治疗方案。
技术实现要素:
6.有鉴于背景技术中存在的问题,本发明的目的在于提供一种治疗脑胶质瘤的药物组合物。
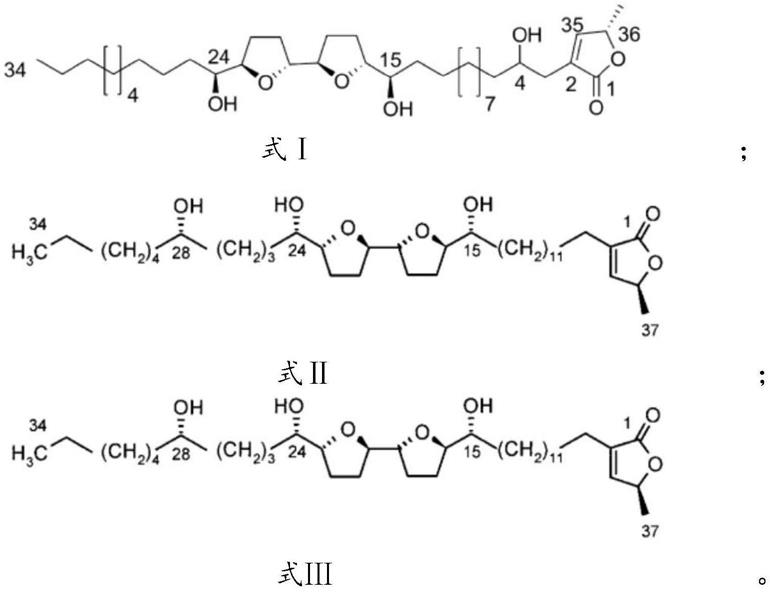
7.本发明提供的治疗脑胶质瘤的药物组合物包括式ⅰ、式ⅱ和式ⅲ中任意一项或多项所示化合物以及其它药物活性组分;
[0008][0009]
具体的,本发明提供了式ⅰ所示化合物在制备治疗脑胶质瘤或黑色素瘤的药物中的应用;
[0010]
优选的,所述治疗脑胶质瘤或黑色素瘤的药物中还包括式ⅱ和/或式ⅲ所示化合物。
[0011]
优选的,所述药物的剂型包括:片剂、胶囊、颗粒、微囊、注射液、冻干粉针、凝胶、外用制剂或腔道给药制剂。
[0012]
本发明提供了一种用于治疗脑胶质瘤或黑色素瘤的番荔枝种子提取物的制备方法,包括如下步骤:
[0013]
(1)将番荔枝种子粉碎,得到颗粒物;;
[0014]
(2)将颗粒物与脱脂溶剂混合,脱脂后固液分离,得到滤渣;
[0015]
(3)将滤渣与提取溶剂混合,提取后固液分离,得到液相;
[0016]
(4)去除液相中的溶剂,得到番荔枝种子提取物。
[0017]
优选的,步骤(1)所述颗粒物的粒径为2~25目。
[0018]
优选的,步骤(2)所述脱脂溶剂包括石油醚、正己烷和环己烷中的一种或多种;所述脱脂溶剂的使用量与颗粒物的质量比为200~10000ml:20~250g;所述脱脂的时间为3~8h。
[0019]
优选的,步骤(3)所述提取溶剂包括乙醇、甲醇、丙酮和乙酸乙酯中的一种或多种;所述提取溶剂的使用量与颗粒物的质量比为200~2000ml:20~250g。
[0020]
优选的,所述步骤(4)得到番荔枝种子提取物后,还包括有效部位的制备。
[0021]
优选的,所述有效部位的制备方法包括如下步骤:
[0022]
①
将所述番荔枝种子提取物与水混合,得到提取物的水悬浮液;
[0023]
②
将所述提取物的水悬浮液与乙酸乙酯混合,萃取,得到乙酸乙酯萃取液;
[0024]
③
去除乙酸乙酯萃取液中的溶剂,得到萃取物;
[0025]
④
将所述萃取物与硅胶混合拌样,上柱,依次用正己烷、体积比为5:95的丙酮-正己烷、体积比为15:85的丙酮-正己烷洗脱充分,收集体积比为15:85 的丙酮-正己烷洗脱液,减压回收溶剂,得到有效部位。
[0026]
本发明提供了上述制备方法制备得到的番荔枝种子提取物,所述番荔枝种子提取物中包括式ⅰ、式ⅱ和式ⅲ所示化合物。
[0027]
本发明还提供了上述制备方法制备得到的番荔枝种子提取物在制备治疗脑胶质瘤或黑色素瘤的药物中的应用。
[0028]
有益效果:本发明提供了式ⅰ、式ⅱ和式ⅲ中任意一项或多项所示化合物在制备治疗脑胶质瘤或黑色素瘤的药物中的应用。式ⅰ、式ⅱ和式ⅲ所示化合物分别为番荔枝总内酯提取物中的单体成分。本发明在番荔枝总内酯和单体成分的敏感细胞株筛选过程中,意外地发现,在对绝大多数肿瘤细胞的半数抑制浓度ic
50
值高达数μm至近百μm的情况下,式ⅰ、式ⅱ和式ⅲ所示化合物以及本发明所述制备方法制备得到的提取物(包括有效部位)对脑胶质瘤和黑色素瘤具有高效杀伤作用。本发明所述制备方法制备得到的提取物对u87-mg的 ic
50
值最高19.25ng/ml,最低2.167ng/ml;对黑色素瘤sk-mel-28的ic
50
值最高35.96ng/ml,最低3.593ng/ml。本发明所述制备方法制备得到的总内酯有效部位对u87-mg的ic
50
值1.645nm,对黑色素瘤sk-mel-5和sk-mel-28的ic
50
值分别为0.5797nm和2.635nm。尤其是式ⅰ所示化合物对脑胶质瘤u87-mg 的ic
50
值仅为0.4044nm,对黑色素瘤sk-mel-28的ic
50
值仅有0.5152nm。而对其他多数肿瘤的ic
50
往往在1um-100um之间,相差三个数量级以上,显示出对脑胶质瘤u87-mg和黑色素瘤sk-mel-28的选择性和高效杀伤作用。
[0029]
本发明还提供了一种番荔枝种子提取物的制备方法,该方法制备得到的番荔枝种子提取物(包括有效部位)对脑胶质瘤u87-mg或黑色素瘤sk-mel-28也表现出特异选择性和高效杀伤作用。本发明提供的方法无须精确筛选荔枝总内酯中的单体成分,在省略了繁杂的纯化步骤前提下,可以达到近似式ⅰ所示化合物对脑胶质瘤u87-mg或黑色素瘤sk-mel-28的抑制效果,相对更为经济,具有广阔的应用前景。
附图说明
[0030]
图1为番荔枝种子乙醇提取物的hplc图谱,其中,k20,k437,k19,k16 和k109这5个主化合物的总含量为8%;
[0031]
图2为番荔枝种子醇提物的乙酸乙酯部分的hplc图谱,其中,k20,k437, k19,k16和k109这5个主化合物的总含量为20%;
[0032]
图3为实施例6中番荔枝总内酯有效部位的hplc图谱,其中,k20,k437, k19,k16和k109这5个主化合物的总含量为62%,k19和k16合计约51%;
[0033]
图4为本发明实施例15所述番荔枝总内酯对人恶性脑胶质瘤u87-mg、人黑色素瘤sk-mel-5和sk-mel-28的体外生长抑制测试结果;
[0034]
图5为本发明实施例15所述番荔枝内酯单体化合物对人恶性脑胶质瘤u87-mg 细胞的体外生长抑制测试结果;
[0035]
图6为本发明实施例15所述番荔枝内酯单体化合物对人黑色素瘤sk-mel-28 细胞的体外生长抑制测试结果;
[0036]
图7为本发明实施例15所述番荔枝总内酯纳米粒对人恶性脑胶质瘤u87-mg的体外生长抑制测试结果;
[0037]
图8为本发明实施例15所述番荔枝总内酯纳米粒对人黑色素瘤sk-mel-28的体外生长抑制测试结果;
[0038]
图9为本发明实施例15所述番荔枝种子醇提物对人恶性脑胶质瘤u87-mg的体外生长抑制测试结果。
[0039]
图10为本发明实施例15所述番荔枝种子醇提物对人黑色素瘤sk-mel-28的体外生长抑制测试结果。
[0040]
图11为本发明实施例15所述番荔枝种子醇提物纳米粒对人恶性脑胶质瘤 u87-mg的体外生长抑制测试结果。
[0041]
图12为本发明实施例15所述番荔枝种子醇提物纳米粒对人黑色素瘤 sk-mel-28的体外生长抑制测试结果。
[0042]
图13为本发明实施例20所述温度对番荔素的影响,其中,图13-(1)的温度条件为60℃,图13-(2)的温度条件为100℃。
具体实施方式
[0043]
本发明提供了式ⅰ、式ⅱ和式ⅲ中任意一项或多项所示化合物在制备治疗脑胶质瘤或黑色素瘤的药物中的应用;
[0044][0045]
式ⅰ所示化合物为番荔枝总内酯提取物中的单体成分bullatacin(k16),其对脑胶
质瘤u87-mg的ic
50
值为0.4044nm,对人黑色素瘤sk-mel-28的ic
50
值为0.5152nm;式ⅱ所示化合物为番荔枝总内酯提取物中的单体成分 squamocin(k19),其对脑胶质瘤u87-mg的ic
50
值为1.058nm,对人黑色素瘤 sk-mel-28的ic
50
值为1.058nm;式ⅲ所示化合物为番荔枝总内酯提取物中的单体成分isoannonareticin(k109),其对脑胶质瘤u87-mg的ic
50
值为0.5102nm,对和人黑色素瘤sk-mel-28的ic50值为1.31nm。以上三个化合物单体成分对脑胶质瘤u87-mg或人黑色素瘤sk-mel-28均具有选择性和高效杀伤作用。
[0046]
在本发明中,所述药物的剂型优选包括:片剂、胶囊、颗粒、微囊、注射液、冻干粉针、凝胶、外用制剂或腔道给药制剂。本发明对上述各剂型的制备方法不作特别限定,本领域常规方法均可。
[0047]
本发明提供了一种番荔枝种子提取物的制备方法,包括如下步骤:
[0048]
(1)将番荔枝种子粉碎,得到颗粒物;
[0049]
(2)将颗粒物与脱脂溶剂混合,脱脂后固液分离,得到滤渣;
[0050]
(3)将滤渣与提取溶剂混合,提取后固液分离,得到液相;
[0051]
(4)回收液相中的溶剂,得到番荔枝种子提取物。
[0052]
本发明先将番荔枝种子粉碎,得到细颗粒。在本发明中,所述番荔枝种子的品种优选包括番荔枝、刺果番荔枝和/或圆滑番荔枝。所述颗粒物的粒径优选为 2~25目,更优选为10~18目。
[0053]
得到颗粒物后,本发明将颗粒物与脱脂溶剂混合,脱脂后固液分离,得到滤渣。在本发明中,所述脱脂溶剂优选包括石油醚、正己烷和环己烷中的一种或多种;更优选为正己烷。所述脱脂溶剂的体积与颗粒物的质量比优选为200~ 10000ml:20~250g;更优选为8000ml:200g。所述脱脂的时间优选为3~8h,更优选为5h。在本发明中,所述脱脂的次数优选为两次,第一次脱脂后分离脱脂溶剂得到的固体物质进行第二次脱脂,固液分离,得到滤渣。本发明对所述固液分离的方法不作特别限定,本领域常规方法如滤纸抽滤等均可。
[0054]
得到滤渣后,本发明将滤渣与提取溶剂混合,提取后固液分离,得到液相。在本发明中,所述提取溶剂优选包括乙醇、甲醇、丙酮和乙酸乙酯中的一种或多种,更优选为乙醇;所述乙醇的浓度优选≥95%。在本发明中,所述提取溶剂的使用量以上述粉碎后得到的细颗粒为标准,所述提取溶剂的体积与细颗粒的质量比优选为200~2000ml:20~250g;更优选为1500ml:200g。本发明对所述提取的方法不作特别限定,本领域常规提取方法比如超声提取、组织破碎搅拌提取、回流提取均可。当使用超声提取时,超声的功率优选为200~300w,更优选为250w;提取的温度优选为10~60℃,更优选为20~30℃,更优选为 25℃;提取的时间优选为0.5~12h,更优选为1~3h,更优选为2h。当使用组织破碎搅拌提取时,本发明优选使用北京金鼐科技发展有限公司或河南金鼐科技发展有限公司生产的闪式提取设备;提取的温度优选为10~60℃,更优选为 20~30℃,更优选为25℃;提取的时间优选为1~120min,更优选为10~30min,更优选为20min。当使用回流提取时,提取的温度优选为60~80℃,更优选为 70℃。本发明对所述固液分离的方法不作特别限定,本领域常规方法如滤纸抽滤等均可。
[0055]
得到液相后,本发明回收液相中的溶剂,剩余的固形物即为番荔枝种子提取物。本发明对所述溶剂的回收方法不作特别限定,本领域常规回收方法比如减压旋蒸、闪蒸浓缩、喷雾干燥、冷冻干燥等均可。在本发明中,所述溶剂在回收过程中的温度优选≤70℃,更优
选≤60℃,更优选≤50℃。如果采用闪蒸浓缩或喷雾干燥,所述溶剂的受热温度优选为60-150℃,受热时间优选≤2min,更优选≤1min,更优选≤30s。
[0056]
利用本发明所述的制备方法制备得到的提取物对u87-mg的ic
50
值最高为 19.25ng/ml,最低为2.167ng/ml;对黑色素瘤sk-mel-28的ic
50
值最高为 35.96ng/ml,最低为3.593ng/ml,显示出对脑胶质瘤u87-mg的特异选择性和高效杀伤作用。
[0057]
得到番荔枝种子提取物后,本发明优选对所述提取物进行精提纯化,制备得到有效部位。在本发明中,所述有效部位的制备方法优选包括如下步骤:
[0058]
①
将所述番荔枝种子提取物与水混合,得到提取物的水悬浮液;
[0059]
②
将所述提取物的水悬浮液与乙酸乙酯混合,萃取,得到乙酸乙酯萃取液;
[0060]
③
回收乙酸乙酯萃取液中的溶剂,得到萃取物;
[0061]
④
将所述萃取物与硅胶混合拌样,上柱,依次用正己烷、体积比为5:95的丙酮-正己烷、体积比为15:85的丙酮-正己烷洗脱充分,收集体积比为15:85 的丙酮-正己烷洗脱液,减压回收溶剂,得到有效部位。
[0062]
本发明先将所述番荔枝种子提取物与水混合,得到提取物的水悬浮液。然后将所述提取物的水悬浮液与乙酸乙酯混合,萃取,得到乙酸乙酯萃取液。在本发明中,所述水的体积(升)优选为番荔枝种子提取物重量(公斤)的2~6倍,更优选为3~4倍;所述乙酸乙酯的体积优选为提取物水悬浮液体积的1~3倍,更优选为2倍。本发明优选萃取3次,萃取后合并乙酸乙酯萃取液。
[0063]
得到乙酸乙酯萃取液后,本发明回收乙酸乙酯萃取液中的溶剂,得到萃取物。本发明对所述溶剂的回收方法不作特别限定,本领域常规回收方法比如减压旋蒸、闪蒸浓缩、喷雾干燥、冷冻干燥等均可。在本发明中,所述溶剂在回收过程中的温度优选≤70℃,更优选≤60℃,更优选≤50℃。如果采用闪蒸浓缩或喷雾干燥,所述溶剂的受热温度优选为60~150℃,受热时间优选≤2min,更优选≤1min,更优选≤30s。
[0064]
得到萃取物后,本发明将所述萃取物与硅胶混合拌样,上柱,依次用正己烷、体积比为5:95的丙酮-正己烷、体积比为15:85的丙酮-正己烷洗脱充分,收集体积比为15:85的丙酮-正己烷洗脱液,减压回收溶剂,得到有效部位。
[0065]
本发明上述制备方法制备得到的有效部位为番荔枝总内酯,所述番荔枝总内酯(有效部位)对人恶性胶质瘤u87-mg的ic
50
值1.645nm,对人黑色素瘤sk-mel-5和sk-mel-28的ic
50
值分别为0.5797nm和2.635nm,显示出对脑胶质瘤u87-mg、人黑色素瘤sk-mel的特异选择性和高效杀伤作用。
[0066]
本发明提供了上述制备方法制备得到的番荔枝种子提取物(或有效部位)。在本发明中,所述番荔枝种子提取物(或有效部位)中包括式ⅰ、式ⅱ和式ⅲ所示化合物,且在不对上述式ⅰ、式ⅱ和式ⅲ所示化合物进行纯化的情况下,可以达到近似式ⅰ所示化合物对脑胶质瘤u87-mg和人黑色素瘤sk-mel-28的抑制效果。本发明提供的上述方法省略了繁杂的纯化步骤,制备得到的产品相对更为经济,具有广阔的应用前景。
[0067]
本发明还提供了上述式ⅰ、式ⅱ和式ⅲ中的任意一种或多种所示化合物,以及上述制备方法制备得到的番荔枝种子提取物(或有效部位)在制备治疗脑胶质瘤或人黑色素瘤的药物中的应用。在本发明中,所述药物可以添加药学上可接受的辅料制备成各种便于临床给药的形式,如片剂、胶囊、颗粒、微囊、注射液、冻干粉针、凝胶、外用制剂或腔道给药制
剂等;药物在制剂中可以以分子状态、纳米颗粒、脂质体、包合物、微米颗粒等形式存在。
[0068]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0069]
实施例1
[0070]
圆滑番荔枝,乙醇超声提取(圆-乙醇超声提取物)
[0071]
取干燥的圆滑番荔枝种子20克,粉碎成15目的颗粒,加正己烷浸泡脱脂 2次(每次使用200ml正己烷,间歇振摇,时间5小时),滤纸抽滤,滤渣加入 200ml无水乙醇,25℃和250w超声提取两次,每次30min,滤纸抽滤,合并两次滤液,55℃减压加热旋转蒸发除去有机溶剂,真空干燥,得乙醇超声提取物。
[0072]
实施例2
[0073]
番荔枝,乙醇超声提取(土-乙醇超声提取物)
[0074]
取干燥的番荔枝(俗称土番荔枝)种子20克,粉碎成18目的颗粒,加正己烷浸泡脱脂2次(每次使用200ml正己烷,间歇振摇,时间5小时),滤纸抽滤,滤渣加入200ml无水乙醇,25℃和250w超声提取两次,每次30min,滤纸抽滤,合并两次滤液,60℃减压加热旋转蒸发除去有机溶剂,真空干燥,得乙醇超声提取物。
[0075]
实施例3
[0076]
刺果番荔枝,乙醇超声提取(刺-乙醇超声提取物)
[0077]
取干燥的刺果番荔枝种子20克,粉碎成10目的颗粒,加正己烷浸泡脱脂 2次(每次使用200ml正己烷,间歇振摇,时间5小时),滤纸抽滤,滤渣加入 200ml无水乙醇,25℃和250w超声提取两次,每次30min,滤纸抽滤,合并两次滤液,50℃减压加热旋转蒸发除去有机溶剂,真空干燥,得乙醇超声提取物。
[0078]
实施例4
[0079]
圆滑番荔枝,乙醇回流提取(圆-醇回流提取物)
[0080]
取干燥的圆滑番荔枝种子185克,粉碎成15目的颗粒,加正己烷脱脂2次(每次使用7升正己烷,间歇振摇,时间5小时),滤纸抽滤,滤渣加入1400ml 95%乙醇,70℃回流提取两次,每次30min,滤纸抽滤,合并两次滤液,60℃减压加热旋转蒸发除去有机溶剂,得95%醇回流提取物,-20度冰箱预冻12小时,
ꢀ-
40度和0.12pa冻干,得两部分样品,瓶底棕褐色浸膏,命名为“圆-醇回流提取物-固”;上层油状液体,命名为“圆-醇回流提取物-液”。
[0081]
实施例5
[0082]
圆滑番荔枝,组织破碎(闪式)动态提取
[0083]
取干燥的圆滑番荔枝种子200克,粉碎成15目的颗粒,放置在体积为2.5升的闪式提取器中,加1.5升正己烷脱脂3次(室温,转速5000rpm,时间15分钟,期间间歇3次),5000rpm离心10分钟,沉淀再加1升正己烷同法脱脂,共脱脂三次;弃上清,沉淀加入1.0升95%乙醇闪式提取3次(室温,转速5000rpm,每次时间15分钟,每提取5分钟间歇2分钟,5000rpm离心10分钟,沉淀用于下一次继续提取),合并三次提取液,60℃减压旋转蒸发除去有机溶剂,得95%醇闪式提取物。
[0084]
实施例6
[0085]
番荔枝总内酯acgs,有效部位
[0086]
将实施例5中的提取物,均匀分散在3倍重量的水中,得到水悬浮液,加入悬浮液2
倍体积的乙酸乙酯振摇混匀,静置萃取3次。合并乙酸乙酯萃取液,减压回收溶剂,得乙酸乙酯萃取物,用萃取物1.3倍重量的硅胶拌样,加载在1 倍重量(含样硅胶)的干净硅胶装填的柱子上,先用10倍柱床体积的正己烷洗脱(弃去洗脱液),再用10倍柱床体积的丙酮-正己烷(5:95,v/v)洗脱(弃去洗脱液),然后用40倍柱床体积的丙酮-正己烷(15:85,v/v)洗脱,收集这部分洗脱液,减压回收溶剂得总内酯有效部位(简称为acgs)。
[0087]
实施例7
[0088]
番荔枝种子提取物和有效部位的色谱分析和含量测定
[0089]
hplc色谱条件:waters高效液相色谱仪(waters 2695型泵,waters 2996检测器,empower工作站);色谱柱为diamonsil c18(2),5um,4.6*250mm;流动相为:a为乙腈,b为0.3%磷酸水溶液,梯度洗脱:0~10min 29%~29%b, 10~35min 27%~27%b,35~45min 25%~25%b,45~55min 15%~15%b, 55~70min 29%~29%b;流速:1.0ml/min;柱温:30℃;检测波长:210nm;进样量:20μl。
[0090]
精密称取k20(squamostatin-b)、k437(cherinolin),k19(squamocin), k16(bullatacin)、k109(isoannonareticin)对照品各1mg于5ml容量瓶中,用乙腈定容,从中依次取出0.2,0.4,0.6,0.8,1.0,1.2,0.5ml置1ml容量瓶中,以流动相稀释至刻度。得到质量浓度为1.6,4,8,20,40,60,100μg/ml的溶液,进样测定峰面积a,以番荔枝各指标成分浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到回归方程。
[0091]
将实施例5中的番荔枝种子提取物、实施例6中的乙酸乙酯萃取物和得到的总内酯有效部位配制成适当浓度的甲醇溶液,按照hplc色谱条件进样获得色谱图,并根据得到的5个对照品的色谱峰和回归方式测定实施例5中的番荔枝种子提取物、实施例6中的乙酸乙酯萃取物和得到的总内酯有效部位中5个指标性成分的总含量。
[0092]
结果如图1~3所示,图1~3表明:从醇提取物、乙酸乙酯萃取物到总内酯有效部位,杂质越来越低,内酯类成分得到了富集。有效部位中,5种指标性成分含量合计超过60%,两个主要成分k19和k16含量合计约50%。
[0093]
实施例8
[0094]
总内酯纳米粒,p188为载体(p188-acgs纳米粒)
[0095]
称取5mg番荔枝总内酯溶于0.5ml无水乙醇中,5mg泊洛沙姆p188溶于 5ml去离子水中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至溶有p188的去离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs纳米粒。动态光散射法测得平均粒径为169.8nm,多分散性指数(pdi)为0.108,电位值-17.8mv。
[0096]
实施例9
[0097]
总内酯纳米粒,tpgs为载体(tpgs-acgs纳米粒)
[0098]
称取5mg番荔枝总内酯、5mg维生素e聚乙二醇琥珀酸酯tpgs共溶于0.5ml 无水乙醇中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至去5ml离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs纳米粒。动态光散射法测得平均粒径为136.0nm,多分散性指数(pdi)为0.195,电位值-19.6mv。
[0099]
实施例10
[0100]
总内酯纳米粒,pcl2000-peg2000为载体(pcl-peg-acgs纳米粒)
[0101]
称取5mg番荔枝总内酯溶于0.5ml无水乙醇中,5mg聚乙二醇2000-聚己内酯
2000peg2k-pcl2k溶于0.2ml丙酮中,两者混匀,常温在250hz超声条件下将上述混合溶液缓慢滴注至5ml去离子水中。滴注完毕后,旋蒸除去有机溶剂,即得acgs纳米粒。动态光散射法测得平均粒径为133.9nm,多分散性指数(pdi)为0.175,电位值-16.2mv。
[0102]
实施例11
[0103]
圆滑番荔枝种子乙醇超声提取物-p188纳米粒(p188-圆-乙醇超声提取物)
[0104]
称取10mg圆滑番荔枝种子乙醇超声提取物溶于1ml无水乙醇中,10mg泊洛沙姆p188溶于10ml去离子水中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至溶有p188的去离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs 纳米粒。动态光散射法测得平均粒径为177.3nm,多分散性指数(pdi)为0.112,电位值-33.8mv。
[0105]
实施例12
[0106]
番荔枝(俗称土番荔枝)种子乙醇超声提取物-p188纳米粒(p188-土-乙醇超声提取物)
[0107]
称取5mg番荔枝种子乙醇超声提取物溶于0.5ml无水乙醇中,5mg泊洛沙姆p188溶于5ml去离子水中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至溶有p188的去离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs纳米粒。动态光散射法测得平均粒径为177.9nm,多分散性指数(pdi)为0.128,电位值-12.8mv。
[0108]
实施例13
[0109]“圆-醇回流提取物-固
”-
p188纳米粒(p188-圆-醇回流提取物-固)
[0110]
称取10mg圆-醇回流冻干-固溶于1ml无水乙醇中,10mg泊洛沙姆p188溶于 10ml去离子水中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至溶有 p188的去离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs纳米粒。动态光散射法测得平均粒径为197.3nm,多分散性指数(pdi)为0.286,电位值-24.6mv。
[0111]
实施例14
[0112]“圆-醇回流提取物-液
”-
p188纳米粒(p188-圆-醇回流提取物-液)
[0113]
称取10mg圆-醇回流冻干-液溶于1ml无水乙醇中,10mg泊洛沙姆p188溶于 10ml去离子水中,常温在250hz超声条件下将上述乙醇溶液缓慢滴注至溶有 p188的去离子水中。滴注完毕后,旋蒸除去乙醇,即得acgs纳米粒。动态光散射法测得平均粒径为279.6nm,多分散性指数(pdi)为0.370,电位值-19.6mv。
[0114]
实施例15
[0115]
对肿瘤细胞的直接杀伤测试
[0116]
(一)番荔枝总内酯对人恶性脑胶质瘤u87-mg、人黑色素瘤sk-mel-28和 sk-mel-5的体外生长抑制测试
[0117]
实验方法:
[0118]
1)调整人恶性脑胶质瘤u87-mg、人黑色素瘤sk-mel-28和sk-mel-5细胞生长状态,待细胞处于对数生长期时收获细胞,消化洗涤后进行台盼蓝染色,并计数;
[0119]
2)使用完全培养基将贴壁细胞密度调整为5.56
×
104个/ml;
[0120]
3)接种96孔细胞培养板,90μl/孔,保证贴壁细胞每孔细胞数量为5
×
103个;
[0121]
4)将接种好的细胞板置于37℃培养箱中孵育过夜;
[0122]
5)用dmso溶解番荔枝总内酯(实施例6制备得到的有效部位),配制100mm 储液(按
照分子量622折合),用培养基对待测物稀释得到50μm、15.8μm、5 μm、1.58μm、0.5μm、0.158μm、0.05μm、0.0158μm、0.005μm;
[0123]
6)取出细胞培养板,将以上浓度的药物工作液加入到细胞培养板中,10μl/孔,以空白培养基为对照,每个浓度做三个复孔;
[0124]
7)将细胞培养板置于培养箱中继续孵育72小时;
[0125]
8)72小时后,将celltiteraqueous one solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20μl/孔的celltiteraqueous one solution 试剂;
[0126]
9)将细胞培养板置于37℃培养箱中继续孵育3小时;
[0127]
10)使用酶标仪读取各孔490nm波长的吸光度(od值);
[0128]
11)数据处理及分析,分别得到待测物的ic
50
值。
[0129]
随后用培养基对待测物进一步稀释得到浓度为50nm、15.8nm、5nm、1.58nm、 0.5nm、0.158nm、0.05nm、0.0158nm、0.005nm的一系列工作液,重新实验。番荔枝总内酯有效部位和三个单体化合物对人恶性胶质瘤u87-mg、人黑色素瘤sk-mel-28和sk-mel-5细胞生长的半数抑制浓度(ic50值)见表1。
[0130]
表1番荔枝总内酯有效部位和三个单体化合物对人恶性胶质瘤u87-mg、人黑色素瘤sk-mel-28和sk-mel-5细胞生长的半数抑制浓度(ic50值)
[0131][0132]
结果如图4和表1所示,番荔枝总内酯有效部位对人恶性胶质瘤细胞 u87-mg、人黑色素瘤细胞sk-mel-28、sk-mel-5生长抑制的半数抑制浓度 ic
50
分别为1.645nm、2.635nm和0.5797nm,显示出对人恶性胶质瘤细胞和黑色素瘤的高效杀伤作用。
[0133]
(二)番荔枝内酯单体化合物对人恶性脑胶质瘤u87-mg细胞和人黑色素瘤细胞sk-mel-28的体外生长抑制测试
[0134]
实验方法:
[0135]
1)调整人恶性脑胶质瘤u87-mg细胞和人黑色素瘤细胞sk-mel-28的生长状态,待细胞处于对数生长期时收获细胞,消化洗涤后进行台盼蓝染色,并计数;
[0136]
2)使用完全培养基将贴壁细胞密度调整为5.56
×
104个/ml;
[0137]
3)接种96孔细胞培养板,90μl/孔,保证贴壁细胞每孔细胞数量为5
×
103个;
[0138]
4)将接种好的细胞板置于37℃培养箱中孵育过夜;
[0139]
5)用dmso分别溶解番荔枝总内酯单体化合物bullatacin(k16,式i)、 squamocin(k19,式ii)和isoannonareticin(k109,式iii),配制100mm储液,用培养基对待测物稀释得到50nm、15.8nm、5nm、1.58nm、0.5nm、0.158nm、 0.05nm、0.0158nm、0.005nm的一系列工作液;
[0140]
6)取出细胞培养板,将以上浓度的药物工作液加入到细胞培养板中,10μ l/孔,以空白培养基为对照,每个浓度做三个复孔;
[0141]
7)将细胞培养板置于培养箱中继续孵育72小时;
[0142]
8)72小时后,将celltiteraqueous one solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20μl/孔的celltiter aqueous one solution试剂;
[0143]
9)将细胞培养板置于37℃培养箱中继续孵育3小时;
[0144]
10)使用酶标仪读取各孔490nm波长的吸光度(od值);
[0145]
11)数据处理及分析,分别得到待测物的ic
50
值。
[0146]
结果如图5、图6和表1所示。图5和表1表明:番荔枝内酯单体化合物 k16、k19、k109对人恶性脑胶质瘤u87-mg生长抑制的半数抑制浓度ic
50
分别为0.4044、1.058、0.5102nm,均显示出对人恶性脑胶质瘤u87-mg的高效杀伤作用;图6和表1表明:番荔枝内酯单体化合物k16、k19、k109对人黑色素瘤sk-mel-28生长抑制的半数抑制浓度ic
50
分别为0.5152、1.571、1.31nm,均显示出对人黑色素瘤sk-mel-28的高效杀伤作用。
[0147]
(三)番荔枝总内酯纳米粒对人恶性脑胶质瘤u87-mg和人黑色素瘤 sk-mel-28的体外生长抑制测试
[0148]
实验方法:
[0149]
1)调整人恶性脑胶质瘤u87-mg和人黑色素瘤sk-mel-28细胞生长状态,待细胞处于对数生长期时收获细胞,消化洗涤后进行台盼蓝染色,计数;
[0150]
2)使用完全培养基将贴壁细胞密度调整为5.56
×
104个/ml;
[0151]
3)接种96孔细胞培养板,90μl/孔,保证贴壁细胞每孔细胞数量为5
×
103个;
[0152]
4)将接种好的细胞板置于37℃培养箱中孵育过夜;
[0153]
5)将实施例8、9、10中的三种总内酯纳米粒,分别配制100mm储液(总内酯分子量按照622折合),用培养基对待测物稀释得到释得到浓度为50nm、 15.8nm、5nm、1.58nm、0.5nm、0.158nm、0.05nm、0.0158nm、0.005nm的一系列工作液;
[0154]
6)取出细胞培养板,将以上浓度的药物工作液加入到细胞培养板中,10μ l/孔,以空白培养基为对照,每个浓度做三个复孔;
[0155]
7)将细胞培养板置于培养箱中继续孵育72小时;
[0156]
8)72小时后,将celltiteraqueous one solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20μl/孔的celltiter aqueous one solution试剂;
[0157]
9)将细胞培养板置于37℃培养箱中继续孵育3小时;
[0158]
10)使用酶标仪读取各孔490nm波长的吸光度(od值);
[0159]
11)数据处理及分析,分别得到待测物的ic
50
值。
[0160]
番荔枝总内酯纳米粒对人恶性胶质瘤u87-mg和人黑色素瘤sk-mel-28 细胞生长的半数抑制浓度(ic50值)见表2。
[0161]
表2番荔枝总内酯纳米粒对人恶性胶质瘤u87-mg和人黑色素瘤 sk-mel-28细胞生长的半数抑制浓度(ic50值)
[0162][0163]
结果如图7、图8和表2所示。图7和表2表明,以泊洛沙姆p188、tpgs、 pcl2000-mpeg2000为载体的番荔枝总内酯纳米粒对人恶性胶质瘤u87-mg细胞生长抑制的半数抑制浓度ic
50
分别为1.37、1.524、3.448nm;与表1中总内酯对u87-mg的ic50值(1.645nm)加以对比,可见纳米粒在解决总内酯难溶难以药问题的同时,完全保留了总内酯对人恶性胶质瘤细胞的高效杀伤作用。图8和表2表明,以泊洛沙姆p188、tpgs、pcl2000-mpeg2000为载体的番荔枝总内酯纳米粒对人黑色素瘤sk-mel-28细胞生长抑制的半数抑制浓度ic
50
分别为0.9717、1.289、2.059nm;与表1中总内酯对sk-mel-28的ic50值(2.635nm) 相对比,纳米粒在解决总内酯难溶难以药问题的同时,还略微提高了总内酯对人黑色素瘤细胞的高效杀伤作用。
[0164]
(四)番荔枝种子醇提物对人恶性脑胶质瘤u87-mg和人黑色素瘤 sk-mel-28的体外生长抑制测试
[0165]
实验方法:
[0166]
1)调整人恶性脑胶质瘤u87-mg细胞和人黑色素瘤sk-mel-28生长状态,待细胞处于对数生长期时收获细胞,消化洗涤后进行台盼蓝染色,计数;
[0167]
2)使用完全培养基将贴壁细胞密度调整为5.56
×
104个/ml;
[0168]
3)接种96孔细胞培养板,90μl/孔,保证贴壁细胞每孔细胞数量为5
×
103个;4)将接种好的细胞板置于37℃培养箱中孵育过夜;
[0169]
5)将实施例1、2、3中的三种乙醇提取物,分别配制100mm储液(总内酯分子量按622估算),用培养基对待测物稀释得到释得到浓度为50nm、15.8nm、 5nm、1.58nm、0.5nm、0.158nm、0.05nm、0.0158nm、0.005nm的一系列工作液;
[0170]
6)取出细胞培养板,将以上浓度的药物工作液加入到细胞培养板中,10μ l/孔,以空白培养基为对照,每个浓度做三个复孔;
[0171]
7)将细胞培养板置于培养箱中继续孵育72小时;
[0172]
8)72小时后,将celltiteraqueous one solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20μl/孔的celltiter aqueous one solution试剂;
[0173]
9)将细胞培养板置于37℃培养箱中继续孵育3小时;
[0174]
10)使用酶标仪读取各孔490nm波长的吸光度(od值);
[0175]
11)数据处理及分析,分别得到待测物的ic
50
值。
[0176]
随后用培养基对待测物进一步稀释得到浓度为50nm、15.8nm、5nm、1.58nm、0.5nm、0.158nm、0.05nm、0.0158nm、0.005nm的一系列工作液,重新实验。
[0177]
番荔枝种子乙醇提取物对人恶性胶质瘤u87-mg和人黑色素瘤sk-mel-28细胞生长的半数抑制浓度(ic50值)见表3。
[0178]
表3番荔枝种子乙醇提取物对人恶性胶质瘤u87-mg和人黑色素瘤 sk-mel-28细胞生长的半数抑制浓度(ic50值)
[0179][0180]
结果如图9、图10和表3所示。图9和表3表明:圆滑番荔枝和番荔枝种子乙醇超声提取物对人恶性脑胶质瘤u87-mg生长抑制的半数抑制浓度ic
50
分别为2.459ng/ml和2.167ng/ml;而圆滑番荔枝乙醇热回流的两个提取物对人恶性脑胶质瘤u87-mg生长抑制的半数抑制浓度ic
50
分别为3.325ng/ml和 19.25ng/ml。图10和表3表明:圆滑番荔枝和番荔枝种子乙醇超声提取物对人黑色素瘤sk-mel-28生长抑制的半数抑制浓度ic
50
分别为3.593ng/ml和 4.006ng/ml;而圆滑番荔枝乙醇热回流的两个提取物对人恶性脑胶质瘤 sk-mel-28生长抑制的半数抑制浓度ic
50
分别为7.814ng/ml和35.96ng/ml。
[0181]
这些数据显示种子经过脱脂后的乙醇提取物对人恶性脑胶质瘤u87-mg 和sk-mel-28也具有高效杀伤作用。由于提取物制备工艺简单,易于工业化制备,且省去了富集总内酯的繁琐步骤,成本低廉,商业化价值很高。
[0182]
(五)番荔枝种子醇提物纳米粒对人恶性脑胶质瘤u87-mg和人黑色素瘤 sk-mel-28的体外生长抑制测试
[0183]
实验方法:
[0184]
1)调整人恶性脑胶质瘤u87-mg细胞和人黑色素瘤sk-mel-28生长状态,待细胞处于对数生长期时收获细胞,消化洗涤后进行台盼蓝染色,计数;
[0185]
2)使用完全培养基将贴壁细胞密度调整为5.56
×
104个/ml;
[0186]
3)接种96孔细胞培养板,90μl/孔,保证贴壁细胞每孔细胞数量为5
×
103个;
[0187]
4)将接种好的细胞板置于37℃培养箱中孵育过夜;
[0188]
5)将实施例11、13、14中的三种乙醇提取物的纳米粒,分别配制100mm储液(按照提取物的浓度计算),用培养基对待测物稀释得到释得到浓度为50nm、15.8nm、5nm、1.58nm、0.5nm、0.158nm、0.05nm、0.0158nm、0.005nm的一系列工作液;
[0189]
6)取出细胞培养板,将以上浓度的药物工作液加入到细胞培养板中,10μ l/孔,以空白培养基为对照,每个浓度做三个复孔;
[0190]
7)将细胞培养板置于培养箱中继续孵育72小时;
[0191]
8)72小时后,将celltiteraqueous one solution试剂置于室温融化并平衡至室温,向细胞培养板中加入20μl/孔的celltiter aqueous one solution试剂;
[0192]
9)将细胞培养板置于37℃培养箱中继续孵育3小时;
[0193]
10)使用酶标仪读取各孔490nm波长的吸光度(od值);
[0194]
11)数据处理及分析,分别得到待测物的ic
50
值。
[0195]
番荔枝种子乙醇提取物纳米粒对人恶性胶质瘤u87-mg和人黑色素瘤 sk-mel-28细胞生长的半数抑制浓度(ic50值)见表4。
[0196]
表4番荔枝种子乙醇提取物纳米粒对人恶性胶质瘤u87-mg和人黑色素瘤 sk-mel-28细胞生长的半数抑制浓度ic50值
[0197][0198]
结果如图11、图12和表4所示。图11和表4表明:三种圆滑番荔枝提取物纳米粒对人恶性脑胶质瘤u87-mg细胞生长的半数抑制浓度ic
50
分别为 1.576ng/ml、3.175ng/ml和11.20ng/ml;对人黑色素瘤sk-mel-28细胞生长的半数抑制浓度ic
50
分别为5.261ng/ml、14.84ng/ml和36.79ng/ml。
[0199]
与表3中相应提取物对总u87-mg和sk-mel-28的ic50值加以对比,可见纳米粒在解决总内酯难溶难以药问题的同时,有效保留了提取物对人恶性胶质瘤和黑色素瘤细胞的高效杀伤作用。由于提取物制备工艺简单,易于工业化制备,且省去了富集总内酯的繁琐步骤,成本低廉,故提取物临床应用前景广阔,商业化价值很高。
[0200]
实施例16
[0201]
番荔枝总内酯纳米粒(p188为载体)口服急性毒性实验研究。
[0202]
纳米粒制备:参照实施例8中的方法,以p188为载体,分别制备药载比 1:5、1:1、5:1的总内酯纳米粒(acgs-p188-nps)
[0203]
给药方案:选体重20g的昆明小鼠,随机分成7组,每组10只小鼠,雌雄各半,适应性喂养2天后,给药前一天禁食不禁水12h,分别单次灌胃给予 60、80、110、140、170和200mg/kg的按照实施例8制备的药载比为1:5的 acgs-nsps(其配制采用等比稀释法)以及p188空白辅料(200mg/kg)。
[0204]
选体重20g的昆明小鼠,随机分成7组,每组10只小鼠,雌雄各半,适应性喂养2天后,给药前一天禁食不禁水12h,分别单次灌胃给予60、80、110、 140、170和200mg/kg的按照实施例8的制备的药载比为1:1的acgs-nsps(其配制采用等比稀释法)以及p188空白辅料(200mg/kg)。
[0205]
同时选体重20g的昆明小鼠,随机分成7组,每组10只小鼠,雌雄各半,适应性喂养2天后,给药前一天禁食不禁水12h,分别单次灌胃给予30、40、 60、80、110、140、170mg/kg的按照实施例8的制备的药载比为5:1中的 acgs-nsps(其配制采用等比稀释法)以及p188空白辅料(200mg/kg)。
[0206]
考察指标:观察给药后小鼠的生理状态和中毒反应情况,记录死亡时间与数量,每2天对小鼠体重进行检测,持续观察2周。
[0207]
结果见表5~7:
[0208]
表5药载比1:5的acgs-p188-nps小鼠急性毒性实验死亡率表(n=10, mean
±
sd)
[0209][0210]
由表5可以看出,药载比1:5的acgs-p188-nps高剂量组在1h内出现中毒症状,小鼠行动逐渐迟缓、停止饮食,死亡前期表现出轻微抽搐,后期逐渐出现四肢僵硬等现象。但辅料组在200mg/kg的剂量下,小鼠未见有不良反应和异常表现。由表1中小鼠死亡率计算ld
50
值为36.86mg/kg,与番荔枝内酯原料药ld
50
值19.21mg/kg相比,提高1.9倍,是最高给药有效剂量(1mg/kg)的37 倍。说明将番荔枝内酯制备成纳米粒在一定程度上降低药物毒性。
[0211]
表6药载比1:1的acgs-p188-nsps小鼠急性毒性实验死亡率表(n=10, mean
±
sd)
[0212][0213][0214]
由表6可知,药载比1:1的p188-acgs纳米粒高剂量组也在1h内即出现中毒症状,小鼠行动逐渐迟缓、停止饮食、呼吸急促,死亡前期表现出轻微抽搐,后期逐渐出现四肢僵硬等现象。辅料组在200mg/kg的剂量下,小鼠同样未见有不良反应和异常表现。由表6小鼠死亡率计算ld
50
值为135.51mg/kg,与番荔枝内酯原料药ld
50
值19.21mg/kg相比,提高6.3倍。说明以p188制备的药载比1:1的纳米粒可以显著降低acgs的口服毒性。对比小鼠急毒实验的ld
50
数据可知,辅料相同、粒径相似的情况下,不同药载比的纳米粒,可能因为纳米粒结构、表面性质、与肠道上皮细胞的作用方式有异等原因,导致毒性也有较大差别。存活小鼠平均体重持续增长,提示较高剂量对小鼠的毒副作用持续时间较短。
[0215]
表7药载比5:1的acgs-p188-nsps小鼠急性毒性实验死亡率表(n=10, mean
±
sd)
[0216][0217]
由表7可知:死亡率与剂量成正相关,其中最高剂量组死亡率达90%,最低剂量组和辅料组无死亡。bliss软件计算acgs-p188-nps对小鼠的ld
50
值为125.51mg/kg,而本研究中acgs-p188-nps口服3mg/kg抑瘤率即超过60%,与 ld
50
值相差超过44倍,说明以p188制备的药载比5:1的番荔枝内酯纳米粒,也显著扩展了治疗窗口。
[0218]
在本实施例中,纳米粒均以泊洛沙姆p188为辅料,粒径也相似,只是因为药载比分别为1:5、1:1、5:1,导致小鼠口服ld
50
分别为36.86mg/kg、 135.51mg/kg、121.51mg/kg。首次发现药载比不同会影响纳米粒口服急毒的ld
50
这一事实。
[0219]
实施例17
[0220]
番荔枝总内酯纳米粒(pcl2000-mpeg2000为载体)口服急性毒性实验研究。
[0221]
参照实施例10中的方法,取番荔枝总内酯acgs和相同重量的 peg2000-pcl2000制备药载比1:1的pcl-peg-acgs纳米粒。
[0222]
选体重20g的昆明小鼠,随机分成6组,每组10只小鼠,雌雄各半,适应性喂养2天后,给药前一天禁食不禁水12h,在预实验基础上分别单次灌胃给予15、26.15、37.5、48.75和60mg/kg的以peg2000-pcl2000为辅料的 pcl-peg-acgs纳米粒(药载比1:1)(其配制采用等比稀释法)以及p188空白辅料 (60mg/kg)。
[0223]
考察指标:观察给药后小鼠的生理状态和中毒反应情况,记录死亡时间与数量,每2天对小鼠体重进行检测,持续观察2周。小鼠死亡率情况见表8。
[0224]
表8以pcl2000-mpeg2000为辅料制备的番荔枝总内酯纳米粒小鼠急性毒性实验死亡率表
[0225]
[0226][0227]
根据表8计算得知pcl-peg-acgs纳米粒的ld
50
值为58.25mg/kg。
[0228]
实施例18
[0229]
番荔枝总内酯纳米粒口服对人恶性胶质瘤u87-mg荷瘤鼠的体内抑瘤作用。
[0230]
于体外培养人恶性胶质瘤细胞u87-mg至对数生长期,用胰酶将贴壁细胞消化,用无菌pbs调整细胞悬浮液浓度至6
×
107个/ml。皮下接种0.2ml上述细胞悬浮液于balb/c裸鼠(6周龄,雌性)右侧腋下,待肿瘤体积达到100mm3左右时,筛选肿瘤大小相对一致的40只小鼠进行实验。
[0231]
将筛选出来的荷瘤小鼠随机分成4组,每组10只,除正常饮食外,按照以下分组,阳性药组每2天静脉注射市售紫杉醇注射液10mg/kg,阴性对照组每天灌胃0.2ml生理盐水,实验组每天给药灌胃给予药载比1:1的pcl-peg 总内酯纳米粒(60μg/kg)和番荔枝种子乙醇回流提取物的pcl-peg纳米粒(药载比1:1)(200μg/kg),实验时长12天。每天观察小鼠有无异常及死亡情况;每两天测一次每组小鼠的体重和肿瘤体积(v=ab2/2;a为长边,b为短边)。给药第 12天脱颈椎处死小鼠,解剖小鼠获取各组肿瘤并按下式计算抑瘤率:
[0232]
抑瘤率=(1-给药组瘤重/生理盐水组瘤重)
×
100%
[0233]
实验结果表明:60μg/kg的低剂量下口服给药,总内酯纳米粒对人恶性胶质瘤u87-mg荷瘤鼠的抑瘤率达到65%;提取物纳米粒在200μg/kg口服给药对人恶性胶质瘤u87-mg荷瘤鼠的抑瘤率达到71%,显示出对人恶性胶质瘤的高效抗肿瘤作用。同时,各组小时体重与生理盐水组相比没有差异,整个试验过程中实验组小鼠无一死亡,且状态良好,提示在给药剂量下,具有较好的安全性。
[0234]
实施例19
[0235]
番荔枝总内酯纳米粒口服对人黑色素瘤sk-mel-28荷瘤鼠的体内抑瘤作用。
[0236]
于体外培养人黑色素瘤细胞sk-mel-28至对数生长期,用胰酶将贴壁细胞消化,用无菌pbs调整细胞悬浮液浓度至6
×
106个/ml。皮下接种0.2ml上述细胞悬浮液于balb/c裸鼠(5周龄,雌性)右侧腋下,待肿瘤体积达到100mm3左右时,筛选肿瘤大小相对一致的40只小鼠进行实验。
[0237]
将筛选出来的荷瘤小鼠随机分成4组,每组10只,除正常饮食外,按照以下分组,阳性药组每2天静脉注射市售紫杉醇注射液10mg/kg,阴性对照组每天灌胃0.2ml生理盐水,实验组每天给药灌胃给予药载比1:1的pcl-peg 总内酯纳米粒(0.1mg/kg)和番荔枝种子乙醇回流提取物的pcl-peg纳米粒(药载比1:1)(0.3mg/kg),实验时长12天。每天观察小鼠有无异常及死亡情况;每两天测一次每组小鼠的体重和肿瘤体积(v=ab2/2;a为长边,b为短边)。给药第 12天脱颈椎处死小鼠,解剖小鼠获取各组肿瘤并按下式计算抑瘤率:
[0238]
抑瘤率=(1-给药组瘤重/生理盐水组瘤重)
×
100%
[0239]
实验结果表明:0.1mg/kg的低剂量下口服给药,总内酯纳米粒对人恶性黑色上路瘤u87-mg荷瘤鼠的抑瘤率达到63%;提取物纳米粒在0.3g/kg口服给药对人恶性胶质瘤
u87-mg荷瘤鼠的抑瘤率达到71%,显示出对人恶性胶质瘤的高效抗肿瘤作用。同时,各组小时体重与生理盐水组相比没有差异,整个试验过程中实验组小鼠无一死亡,且状态良好,提示在给药剂量下,具有较好的安全性。
[0240]
实施例20
[0241]
热稳定性考察
[0242]
将实施例6得到的番荔枝总内酯有效部位开口放在60℃的烘箱内,放置10 天,分别于第5和10天取样,精密称取适量,乙腈溶解后检测番荔素的含量,考察湿度对番荔素稳定性的影响。
[0243]
结果如图13所示,图13表明:番荔枝总内酯中各指标成分在60℃条件下含量未发生显著变化,在100℃高温下放置12h后,这四种成分的含量均降低到30%以下。提示在提取物、有效部位的制备过程中,处理温度不宜过高,建议不超过70度,最好在60度以下。
[0244]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1