铜蓝蛋白联合运铁蛋白的应用的制作方法
本发明属于生物药品应用领域,铜蓝蛋白联合运铁蛋白,在制备预防或/和改善或/和治疗阿尔茨海默症的药物中的应用;或/和在制备益智类补充剂或药物方面的应用;以及包括铜蓝蛋白和运铁蛋白的组合物。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)又称老年性痴呆,是一种由神经元丢失导致的脑中枢神经系统退行性疾病,在老年人群中该病的发病率约为4%-8%。1906年,德国神经病理学家阿尔茨海默首次报告了一例具有进行性记忆力下降表现的51岁女性患者。1910年,以命名和分类大脑疾病著称的精神病学家emilkraepelin提议将此病命名为阿尔茨海默病。该病常见的临床表现为进行性记忆力和认知力减退、语言障碍、精神运动异常等,对患者的正常生活造成严重影响,同时也给家庭和社会带来沉重的负担。2010年,who报道全球痴呆患者为3500万,中国为540万。自2010年起,全世界痴呆总人口每20年将翻一倍。《世界阿尔茨海默病2015报告》指出,到2050年,全球ad的患病人数将增加至1.3亿。ad的发病机制复杂,包括淀粉样蛋白沉淀,脑内金属离子动态失衡,线粒体功能障碍等引起的神经递质减少以及神经元凋亡,涉及多种分子信号通路。
运铁蛋白(又称转铁蛋白,英文名称serotransferrin或transferrin,简写为tf)为临床上治疗ad主要药物,通过抑制胆碱酯酶增加乙酰胆碱水平而延缓ad中早期病状进展和改善早期ad临床病状为主,迄今尚无逆转或阻止病情进展的有效药物。
近年来有研究把来自于年轻小鼠的血浆重复的注射进老年小鼠,发现血浆可以通过调节参与海马认知的经典分子通路而提高记忆功能。而血浆组成极其复杂,包括蛋白质、脂类、无机盐、糖、氨基酸、代谢废物以及大量的水。
因此,目前的科研和实践中,需要找出血浆中具有改善学习记忆能力以及治疗老年性痴呆的成分;而且目前尚无将铜蓝蛋白和运铁蛋白联用于上述用途的报道。
技术实现要素:
本发明的目的在于提供一种铜蓝蛋白与运铁蛋白的联合应用。
本发明的目的是通过以下技术方案实现的:
铜蓝蛋白联合运铁蛋白,在制备预防或/和改善或/和治疗痴呆和/或认知功能障碍的药物中的应用;或/和在制备益智类补充剂或药物方面的应用;优选地,所述痴呆和/或认知功能障碍为阿尔茨海默症或轻度认知障碍。
一种包含铜蓝蛋白的组合物,包括:铜蓝蛋白和运铁蛋白;优选地,所述铜蓝蛋白和所述运铁蛋白以混合物的形式使用,或者所述铜蓝蛋白和所述运铁蛋白分别独立使用。
在优选的实施方式中,所述组合物包括:铜蓝蛋白1-5质量份,运铁蛋白1-5质量份;优选地,铜蓝蛋白1质量份,运铁蛋白1质量份。
在优选的实施方式中,所述铜蓝蛋白和运铁蛋白的制备原料均包括健康人血清。
所述转铁蛋白的制备方法依次包括:预处理液制备步骤,疏水层析纯化步骤;优选地,还包括浓缩置换步骤。
在优选的实施方式中,所述预处理液制备步骤中,将血浆cohniv组分依次经过第一次复溶处理,第一次离心处理,第一次过滤处理,调节ph处理,去除杂质蛋白处理,第二次离心处理,第二次过滤处理,得到预处理液;所述疏水层析纯化步骤中,将所述预处理液经过缓冲液置换处理,疏水层析处理,得到纯化转铁蛋白;优选地,所述纯化转铁蛋白的纯度为大于等于95%;优选地,所述浓缩置换步骤中,将所述纯化转铁蛋白进行超滤处理、置换处理,得到转铁蛋白。
在优选的实施方式中,所述预处理液制备步骤中,所述第一次复溶处理,采用pbs缓冲液复溶,所述血浆cohniv组分与所述pbs缓冲液的质量体积比为1:(2-10),优选为1:3.5;优选地,所述pbs缓冲液为:10-50mmol/lpbs,ph6.0-8.0,更优选为20mmol/lpbs,ph7.5;所述第一次离心处理,转速为4,000-15,000rpm,温度为0-10℃,优选为10,000rpm,4℃,保留上清液用于所述第一次过滤处理;所述第一次过滤处理,采用孔径为0.1-1.0μm,优选为0.45μm滤膜,过滤后取滤液用于所述调节ph处理;所述调节ph处理,将所述滤液的ph值调节为6.5-7.5,优选为7.0;更优选采用1mol/l柠檬酸钠溶液作为ph调节剂;所述去除杂质蛋白处理,向调节ph后的滤液中加入蛋白沉淀剂去除杂质蛋白;更优选地,所述蛋白沉淀剂选自:peg4000和/或乙醇溶液;进一步优选地,所述peg4000与调节ph后的滤液的质量体积比为10-20%,优选为15%;所述乙醇溶液的体积百分浓度为90-98%,优选为96%,温度为0至零下10℃,优选为零下4℃;所述第二次离心处理,转速为4,000-10,000rpm,温度为0-10℃,优选为10000rpm,4℃,保留上清液用于第二次过滤处理;所述第二次过滤处理,采用孔径为0.1-1.0μm,优选为0.45μm滤膜,得到的滤液作为预处理液。
在优选的实施方式中,所述缓冲液置换处理,采用hitrapdesalting脱盐柱,采用的平衡缓冲液为:10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4的浓度为0.5-3mol/l,优选为20mmol/lpbs,ph7.0,(nh4)2so4浓度为1.5mol/l;所述疏水层析处理,先将所述平衡缓冲液平衡所述辛基疏水柱,再用所述平衡缓冲液淋洗所述辛基疏水柱,再用洗脱缓冲液洗脱;所述疏水层析柱为辛基疏水柱,用octylsepharose4fastflow装填;所述平衡缓冲液为:10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为1.5-3mol/l,优选为20mmol/lpbs,ph7.0,(nh4)2so4浓度为1.5mol/l;所述洗脱缓冲液为:10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为0.9-1.4mol/l,优选为20mmol/lpbs,ph7.0,(nh4)2so4浓度为1.2mol/l;优选地,所述超滤处理,采用1kd-10kd,优选为3kd超滤膜;所述置换处理,采用的置换缓冲液为:10-50mmol/lpbs,ph7.0-7.4,优选为20mmol/lpbs,ph7.2。
所述组合物在制备预防或/和改善或/和治疗痴呆和/或认知功能障碍的药物中的应用;或/和在制备益智类补充剂或药物方面的应用;优选地,所述痴呆和/或认知功能障碍为阿尔茨海默症或轻度认知障碍。
相比于现有技术,本发明具有如下有益效果:
1、本发明中血浆中参与调节体内金属离子平衡的铜蓝蛋白能提高运铁蛋白治疗动物痴呆模型的自理能力以及学习和记忆能力,可以起到增强记忆力、提高认知功能的作用。发明人发现铜蓝蛋白联合运铁蛋白能够显著促进神经细胞的生长,并且能够显著改善痴呆动物模型的学习记忆能力。筑巢实验结果表明铜蓝蛋白联合运铁蛋白能够提高痴呆动物模型的筑巢能力,提示痴呆动物的自理能力提高。水迷宫实验结果表明铜蓝蛋白能够提高痴呆动物模型的学习记忆能力。
2、本发明还提供一种运铁蛋白制备方法,该法能从目前常用的nitschmann-kistler或cohn6法或cohn6+9法生产血液制品时废弃物cohniv组分里提取运铁蛋白,故可以充分、合理地利用了有限的血浆,减少了血浆资源的浪费。
3、本发明运铁蛋白的制备方法较为简单,而且可以直接工业化放大生产,大规模地应用于制药工业。
附图说明
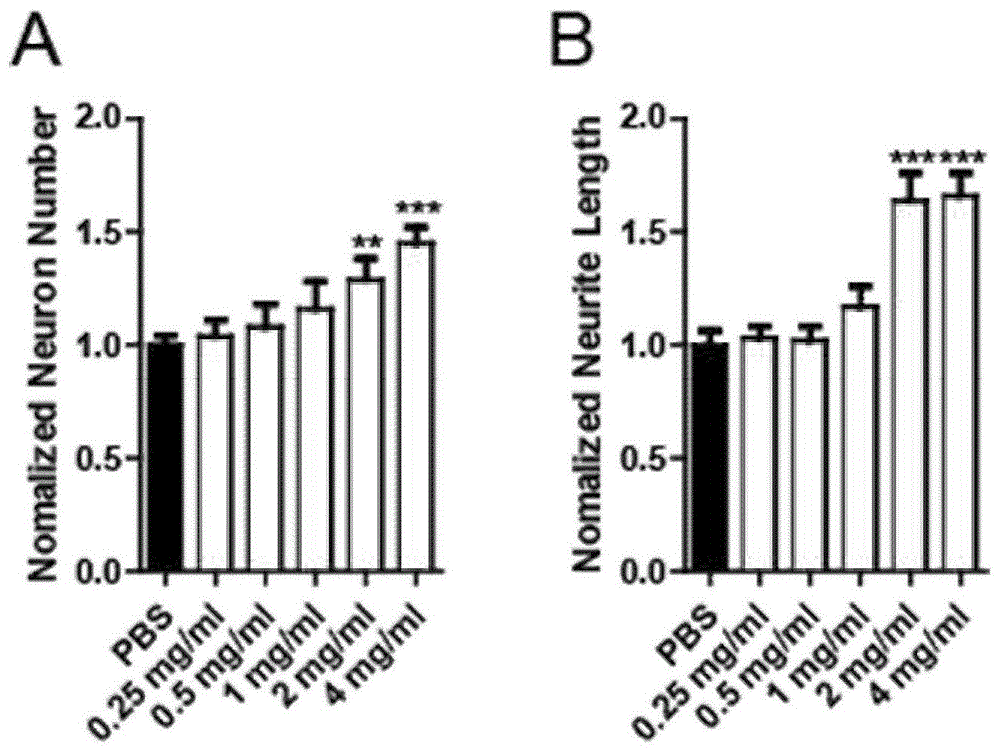
图1:检测例1中光镜检测不同浓度的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)处理原代培养海马神经元作用图,a部分为海马神经元数量柱状图,b部分为海马神经元突起长度柱状图。
图2:检测例1中mtt法检测不同浓度的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)处理原代培养海马神经元后改善aβ25-35对原代培养海马神经元的损伤。
图3:检测例2中筑巢行为学实验检测铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)处理小鼠前后筑巢行为得分。
图4:检测例2中水迷宫行为学实验检测铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)处理小鼠的记忆改善情况。其中,a部分为小鼠在隐藏平台训练阶段上台时间,b部分为小鼠在测试阶段在目标象限所处时间百分比。
具体实施方式
为了更好地对本发明的技术特征和效果进行说明,下面采用具体实施方式对本发明进行详细说明,但本发明并不限于此。
第一方面,本发明提供铜蓝蛋白(英文名ceruloplasmin或covellinealbumen,简写为cp)联合运铁蛋白,在制备预防或/和改善或/和治疗痴呆和/或认知功能障碍的药物中的应用;或/和在制备益智类补充剂或药物方面的应用。
本发明所述铜蓝蛋白来自哺乳动物;优选为来自健康人的血清。
所述痴呆和/或认知功能障碍为阿尔茨海默症或轻度认知障碍。
阿尔茨海默病(ad)是一种起病隐匿的进行性发展的神经系统退行性疾病。
轻度认知障碍(mci)是介于正常衰老和痴呆之间的一种中间状态,是一种认知障碍症候群。
本发明发现血浆中参与调节体内金属离子平衡的铜蓝蛋白能改善啮齿类痴呆模型的认知能力,提示该蛋白可应用于临床治疗老年性痴呆。同时作为亚铁氧化酶,铜蓝蛋白能通过催化二价铁氧化为三价,从而促进铁与运铁蛋白的结合。一方面,运铁蛋白能提高血红蛋白水平从而改善痴呆患者的贫血症状,另一方面,运铁蛋白能调节痴呆患者金属离子平衡。值得注意的是,流行病学研究表明老年痴呆患者中运铁蛋白含量显著下降。因为本发明将铜蓝蛋白与转铁蛋白联合使用用于制备治疗老年痴呆的药物。
在本发明两种蛋白联合用药时,所述铜蓝蛋白和所述运铁蛋白可以混合物的形式使用,或者所述铜蓝蛋白和所述运铁蛋白分别独立使用。
本发明在细胞水平验证了不同浓度铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)对原代海马神经元生长的影响,并通过mtt法检测不同浓度的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg,运铁蛋白的纯度为95%)处理原代培养海马神经元后改善aβ25-35对原代培养海马神经元的损伤,试验结果表明,在2-4mg/ml的浓度范围内,铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)促进海马突触长度增长的作用明显,其可以显著改善aβ25-35对原代培养海马神经元的毒性损伤。另外,发明人从动物试验水平检测了铜蓝蛋白与运铁蛋白混合物对5×fad转基因(app)小鼠的记忆力改善情况,结果表明,铜蓝蛋白联合运铁蛋白可以进一步明显改善痴呆模型小鼠的记忆力。
第二方面,本发明提供一种包含铜蓝蛋白的组合物,该组合物包括:铜蓝蛋白和运铁蛋白。其中,所述组合物包括:铜蓝蛋白1-5质量份(例如1、2、3、4、5质量份),运铁蛋白1-5质量份(例如1、2、3、4、5质量份);优选地,铜蓝蛋白1质量份,运铁蛋白1质量份。
示例性地,该组合物可以包括:铜蓝蛋白1质量份和运铁蛋白5质量份,铜蓝蛋白5质量份和运铁蛋白1质量份,铜蓝蛋白1质量份和运铁蛋白3质量份,铜蓝蛋白3质量份和运铁蛋白1质量份,铜蓝蛋白1质量份和运铁蛋白4质量份,铜蓝蛋白4质量份和运铁蛋白1质量份,铜蓝蛋白1质量份和运铁蛋白2质量份,铜蓝蛋白2质量份和运铁蛋白1质量份,铜蓝蛋白4质量份和运铁蛋白5质量份,铜蓝蛋白5质量份和运铁蛋白4质量份,等等。
所述组合物还包括药学上可接受的载体。上述药学上可接受的载体包括:药学上可接受的抛射剂、缓冲液、明胶、单糖、多糖、氨基酸、螯合剂、糖醇、聚乙二醇、以及表面活性剂中的一种或多种。
所述组合物中的几种成分,可以分别单独使用,也可以混合后再共同使用。
所述转铁蛋白可以是采用目前任何方法制备的人转铁蛋白,优选是采用如下方法制备的转铁蛋白,其采用人血浆cohniv组分作为原料,得到的转铁蛋白的sds-page变性胶电泳图中清晰可见1条分子量约为79kd的条带,人血浆cohniv组分是指按nitschmann-kistler法,或cohn6法,或cohn6+9法生产人血液制品时的废弃物——cohniv组分;该转铁蛋白也可以通过基因重组表达的方式获得;也可以采用市售产品。
上述转铁蛋白的具体制备方法如下:依次包括以下步骤:预处理液制备,疏水层析纯化,浓缩置换。
步骤一、预处理液制备:本步骤的目的为复溶人血浆cohniv组分沉淀中的蛋白质,去除助滤剂,并去除复溶后的一些杂蛋白。
分步骤一、第一次复溶处理:将cohniv组分固体溶解到pbs缓冲液中,混合均匀,得到第一次复溶液。
上述人血浆cohniv组分与pbs缓冲液的质量体积比(w/v)为1:(2-10),优选为1:3.5;上述pbs缓冲液为:10-50mmol/lpbs,ph6.0-8.0,优选为20mmol/lpbs,ph7.5。
分步骤二、第一次离心处理:将上述第一次复溶液离心,保留上清液,作为第一次上清液。
上述离心的转速为4,000-15,000rpm,温度为0-10℃,优选为10,000rpm,4℃。
分步骤三、第一次过滤处理:将上述第一次上清液用0.1-1.0μm,优选为0.45μm的滤膜过滤,得到滤液,作为第一次过滤液。
分步骤四、调节ph处理:在上述第一次过滤液中加入1mol/l的柠檬酸钠溶液,得到调节ph值后的过滤液,其ph值为6.5-7.5,优选为7.0。
分步骤五、去除杂质蛋白处理:搅拌上述调节ph值后的过滤液同时向其中缓慢加入蛋白沉淀剂至沉淀自动沉降变实(此处的变实指:上清和沉淀有明显的分界线,上清变得透亮,沉淀数量不再增多),之后取上清液,作为去除杂质蛋白液,以备下一步的离心。
上述蛋白沉淀剂优选为聚乙二醇4000(peg4000),peg4000与调节ph值后的过滤液的质量体积比为10-20%,优选为15%。
上述蛋白沉淀剂也可以为体积百分浓度为90-98%、优选为96%,温度为零下10℃,优选为零下4℃的乙醇溶液;由于采用乙醇溶液在沉淀过程中会产热,所以乙醇溶液要保持低温。
本分步骤可以有效去除一部分杂质蛋白,同时还可以沉淀病毒,提高产品的安全性。
分步骤六、第二次离心处理:将上述去除杂质蛋白液离心,保留上清液,作为第二次上清液。
上述离心的转速为4000-15000rpm,温度为0-10℃,优选为10000rpm,4℃。
分步骤七、第二次过滤处理:将上述第二次上清液用0.1-1.0μm,优选为0.45μm的滤膜过滤,得到滤液,作为人血浆cohniv组分预处理液。
步骤二、疏水层析纯化:本步骤的目的是从人血浆cohniv组分预处理液中去除其他蛋白杂质,分离得到纯化转铁蛋白。
分步骤一、缓冲液置换处理:
本分步骤中,选用hitrapdesalting脱盐柱,置换上述人血浆cohniv组分预处理液,使其初始盐浓度和ph与平衡缓冲液(10-50mmol/lpbs,ph6.0-8.0,0.5-3mol/l(nh4)2so4,优选为20mmol/lpbs,ph7.0,1.5mol/l(nh4)2so4)相同。具体的操作为:(1)将hitrapdesalting脱盐柱预先用5-10倍柱体积的平衡缓冲液(10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为0.5-3mol/l,优选为20mmol/lpbs,ph7.0,其中(nh4)2so4浓度为1.5mol/l)来平衡,直至电导率检测器显示流出的液体的ph值和该平衡缓冲液的一致。(2)再将适量的上述人血浆cohniv组分预处理液进料到hitrapdesalting柱。(3)再用平衡缓冲液(包括10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为0.5-3mol/l,优选为20mmol/lpbs,ph7.0,其中(nh4)2so4浓度为1.5mol/l)对hitrapdesalting柱进行淋洗,根据uv280峰图收集蛋白溶液,得到置换缓冲液的cohniv蛋白溶液。
分步骤二、疏水层析处理:
本分步骤中,选用辛基疏水柱(octylsepharose4fastflow装填)。
具体的操作为:(1)预先用5-10倍柱体积的平衡缓冲液(10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为1.5-3mol/l,优选为20mmol/lpbs,ph7.0,其中(nh4)2so4浓度为1.5mol/l)平衡辛基疏水柱,直至电导率检测器显示流出的液体的ph值和该平衡缓冲液的一致。(2)然后将适量的上述置换缓冲液的cohniv蛋白溶液进料到辛基疏水柱。(3)再用平衡缓冲液(10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为1.5-3mol/l,优选为20mmol/lpbs,ph7.0,其中(nh4)2so4浓度为1.5mol/l)进行淋洗,使目标成分充分与辛基疏水柱结合,根据uv280峰图收集流穿液(又名穿透液)。(4)再用洗脱缓冲液(10-50mmol/lpbs,ph6.0-8.0,其中(nh4)2so4浓度为0.9-1.4mol/l,优选为20mmol/lpbs,ph7.0,其中(nh4)2so4浓度为1.2mol/l)进行洗脱,得到的洗脱液即为纯化转铁蛋白。
作为优选的实施方式,上述制备方法还包括:
步骤三、浓缩置换步骤:
分步骤一、浓缩处理:将上述纯化转铁蛋白采用1kd-10kd,优选为3kd的超滤膜浓缩,得到浓缩液。上述步骤二的层析过程会稀释样品,本分步骤的目的为将样品浓缩达到可以使用的程度。
分步骤二、置换处理:采用置换缓冲液通过透析或超滤的方法,将上述浓缩液中的高浓度盐(主要是硫酸铵)置换到置换缓冲液中,取透析膜内的蛋白溶液或超滤膜上的蛋白溶液即为转铁蛋白。本分步骤的目的是将浓缩液含有的高浓度盐(主要是硫酸铵)的缓冲液置换到pbs缓冲液中。
其中采用的置换缓冲液为10-50mmol/lpbs,ph7.0-7.4,优选为20mmol/lpbs,ph7.2。
采用透析时:优选上述置换缓冲液作为透析缓冲液,透析时间为20-72h,优选为24h,透析体积比是1:(100-10000),优选为1:500,保留透析膜内的蛋白溶液,即为转铁蛋白。
采用超滤时:优选上述置换缓冲液作为超滤缓冲液,超滤膜的规格为1-10kd,优选为3kd,压力为0.1-0.3mpa,优选为0.1mpa,保留超滤膜上的蛋白溶液,即为转铁蛋白。
本发明中涉及的质量体积比(w/v)是指:固体的质量(g)与液体体积(ml)之间的比例,如:上述人血浆cohn组分与pbs缓冲液的质量体积比(w/v)为1:3.5,是指人血浆cohniv组分量取1g时,pbs缓冲液则量取3.5ml。
本发明所用铜蓝蛋白是根据论文《铜蓝蛋白的分离纯化及其性质与功能基团研究》(褚波,2006)中描述的方法所得。所得铜蓝蛋白活性为1.02unit/mg。
下面通过实施例对本发明铜蓝蛋白的制备、鉴定和应用进行说明。以下实施例中涉及的分子生物学操作如未注明具体试验条件和方法,请参照sambrookj等主编,科学出版社,2017,分子克隆实验指南(第四版)或相应产品的说明书。以下实施例中使用的原代海马细胞是按照如下参考文献培养的:guo,w.,y.ji,etal.(2014)."neuronalactivityaltersbdnf-trkbsignalingkineticsanddownstreamfunctions."jcellsci127(pt10):2249-2260。
实施例1
本实施例为运铁蛋白的制备方法,包括以下步骤:
s1:人血浆cohniv组分预处理液制备:
(1)第一次复溶:将按nitschmann-kistler法生产血液制品时的废料——人血浆cohniv组分固体溶解到20mmol/lpbs溶液(ph7.5)中,按照1:3.5(w/v)溶解后,用磁力搅拌器,混合均匀,得到第一次复溶液。
(2)第一次离心:将第一次复溶液于10000rpm,4℃离心,得到第一次上清液。
(3)第一次过滤:将第一次上清液用0.45μm滤膜过滤,得到第一次过滤液。
(4)调节ph:将第一次过滤液用1mol/l柠檬酸钠将ph值调到7.0。
(5)去除杂质蛋白:在第一次过滤液中加入15%(w/v)的peg4000,需要在搅拌的同时缓慢加入,peg4000完全溶解后待沉淀变实,取上清,作为去除杂质蛋白液。
(6)第二次离心:将去除杂质蛋白液于10000rpm,4℃离心,得到第二次上清液。
(7)第二次过滤:将第二次上清液用0.45μm滤膜过滤,获得人血浆cohniv组分预处理液。
s2:人血浆cohniv组分预处理液疏水层析纯化:
(1)缓冲液置换处理:
a)将hitrapdesalting脱盐柱(1×8cm)预先用5-10倍柱体积的平衡缓冲液(20mmol/lpbs,ph7.0,1.5mol/l(nh4)2so4)平衡,直至电导率检测器显示流出的液体的电导值和该平衡缓冲液的一致。
b)将适量的上述人血浆cohniv组分预处理液进料到hitrapdesalting柱。
c)用平衡缓冲液(20mmol/lpbs,ph7.0,1.5mol/l(nh4)2so4)对hitrapdesalting柱进行淋洗,根据uv280峰图收集蛋白溶液,得到置换缓冲液的cohniv蛋白溶液。
(2)疏水层析处理:
a)预先用5-10倍柱体积的平衡缓冲液(20mmol/lpbs,ph7.0,1.5mol/l(nh4)2so4)平衡辛基疏水柱(octylsepharose4fastflow装填),直至电导率检测器显示流出的液体的电导值和该平衡缓冲液的一致。
b)将适量的上述置换缓冲液的cohniv蛋白溶液进料到辛基疏水柱。
c)用平衡缓冲液(20mmol/lpbs,ph7.0,1.5mol/l(nh4)2so4)进行淋洗,根据uv280峰图收集穿透液。
d)用洗脱缓冲液(20mmol/lpbs,ph7.0,1.2mol/l(nh4)2so4)进行淋洗,根据uv280峰图收集洗脱液,即为纯化转铁蛋白。
s3:浓缩置换:
(1)浓缩:利用3kd超滤膜,将纯化转铁蛋白浓缩得到浓缩液。
(2)置换:将浓缩液采用透析的方式,时间为24h,体积比为1:500,透析缓冲液为20mmol/lpbs(ph7.2),取透析膜内蛋白溶液作为转铁蛋白。
s4:灭菌:
将上述转铁蛋白采用过滤除菌,滤膜为0.22μm低蛋白吸附的pvdf膜,压力为5bar,得到灭菌后的转铁蛋白。
实施例2
本实施例是铜蓝蛋白与运铁蛋白联用。
对于同一实验动物,同一次注射的铜蓝蛋白+运铁蛋白组合物中,铜蓝蛋白与运铁蛋白的质量比为1:1。其中,铜蓝蛋白活性为1.02unit/mg,运铁蛋白的纯度为95%
上述运铁蛋白是实施例1步骤s4得到的灭菌后的运铁蛋白(tf溶液)。上述铜蓝蛋白是参考上述论文第17-32页的方法得到,将3.1.5.1的猪血清替换为健康人的血清,得到透析液;再将透析液经过deae-sepharose(方法如3.1.5.2所述)、羟基磷灰石吸附层析(方法如3.1.5.3所述)、superdex-200凝胶过滤层析(方法如3.1.5.4所述)后获得的比活性最高的组分作为铜蓝蛋白纯品。再将该铜蓝蛋白纯品采用过滤除菌,滤膜为0.22μm低蛋白吸附的pvdf膜,压力为5bar,得到灭菌后的铜蓝蛋白。
检测例1
本检测例是按上述论文方法得到的灭菌后的铜蓝蛋白(cp溶液)与运铁蛋白按质量比1:1的混合物(实施例2的混合物)对原代海马神经元生长的作用检测,对铜蓝蛋白与运铁蛋白混合物处理原代培养海马神经元后改善aβ25-35对原代培养海马神经元的损伤的检测。
检测1:原代海马神经元培养及铜蓝蛋白与运铁蛋白混合物处理。
(1)利用0.1%的poly-l-lysine包被48孔培养板,放入37℃培养箱中包被2小时以上。
(2)在冰的hbss-buffer中解剖0天初生小鼠,取出海马体。用1×pbs清洗3次。加0.25%trypsin,37℃消化15分钟。
(3)用完全dmem终止消化,并用1ml枪轻吹吸海马细胞16-20次,没有明显组织块即可,再用40mm滤网过滤,1000rpm,离心3min。
(4)离心后弃上清,加完全dmem重悬细胞。并将神经元种植在细胞培养板中,种植密度为3×104cells/cm2。
(5)第二天无血清neurobasal培养基全换液;第三天处理:将灭菌后的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)加入到不同的培养板孔内,终浓度为0.25mg/ml、0.5mg/ml、1mg/ml、2mg/ml、4mg/ml,每种浓度设置24孔/6板/3批的重复(即:共3批,每批细胞有2板,每个板有4个孔重复),并采用1×pbs作为对照;第五天:利用cell-iq相差显微镜进行拍照。
检测结果参见图1:其中,a部分为海马神经元数量柱状图,b部分为海马神经元突起长度柱状图;a和b部分的柱从左至右均是分别为pbs,0.25mg/ml、0.5mg/ml、1mg/ml、2mg/ml、4mg/ml。a部分中,pbs处理:1.00±0.04au(arbitraryunit),0.25mg/ml处理:1.04±0.07au,0.5mg/ml处理:1.08±0.10au,1mg/ml处理:1.16±0.12au,2mg/ml处理:1.29±0.09au(p<0.01vs.pbs处理),4mg/ml处理:1.45±0.07au(p<0.0001vs.pbs处理)。b部分中,pbs处理:1.00±0.06au,0.25mg/ml处理:1.03±0.05au,0.5mg/ml处理:1.02±0.06au,1mg/ml处理:1.17±0.09au,2mg/ml处理:1.64±0.12au(p<0.0001vs.pbs处理),4mg/ml处理:1.66±0.10au(p<0.0001vs.pbs处理)。
以上说明在2-4mg/ml的浓度范围内,铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)对促进海马神经元生长作用明显;在2-4mg/ml的浓度范围内,铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg,运铁蛋白纯度为95%)促进海马神经元突起生长作用明显。
检测2:铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg,运铁蛋白纯度为95%)对aβ引起的原代海马神经元损伤的保护作用,其可以显著改善aβ25-35对原代培养海马神经元的毒性损伤。淀粉样肽aβ具有细胞毒作用,如果能拮抗aβ神经毒,即可望达到抗ad的目的。
(1)aβ25-35溶解于灭菌的双蒸水中,使其终浓度为1mg/ml,在37℃放置7天进行老化,老化的aβ25-35分装后于-20℃冻存。
(2)利用0.1%的poly-l-lysine包被96孔培养板,放入37℃培养箱中包被2小时以上。
(3)在冰的hbss-buffer中解剖0天初生小鼠,取出海马体。用1×pbs清洗3次。加0.25%trypsin,37℃消化15分钟。
(4)用完全dmem终止消化,并用1ml枪轻吹吸海马细胞16-20次,没有明显组织块即可,再用40mm滤网过滤,1000rpm,离心3min。
(5)离心后弃上清,加完全dmem重悬细胞。并将神经元种植在细胞培养板中,种植密度为2×105cells/cm2。
(6)第二天无血清neurobasal培养基(含10μm阿糖胞苷)全换液;第五天、第八天无血清neurobasal培养基半换液。
(7)第八天换液后,将灭菌后的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)加入到不同的培养板孔内,终浓度为0.25mg/ml、0.5mg/ml、1mg/ml、2mg/ml、4mg/ml,每种浓度设置18孔/3板/3批的重复(即:共3批,每批细胞有1板,每个板有6个孔重复)。
图2中,最左边的control为不加aβ而加入1×pbs的对照(阴性对照),左起第二个柱为加入aβ和1×pbs的对照(模型对照),这两个对比是检测ad细胞模型是否造模成功;左起3-7的5个柱是加入aβ和不同浓度的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg;分别为0.25mg/ml、0.5mg/ml、1mg/ml、2mg/ml、4mg/ml),用来研究在ad细胞模型中药物的作用。
(8)37℃孵育24小时后,加入老化的aβ25-35,终浓度为30μm。
(9)37℃孵育24小时后,加10μl5mg/ml的mtt。
(10)37℃孵育4小时后,去除上清,加入150μldmso于酶联免疫测定仪上以测定波长570nm,参比波长630nm测定吸光值。
检测结果参见图2:图中从左至右,第1-7柱分别编号为bar1-7,bar2表明30μm老化的aβ25-35与原代海马神经元孵育24小时后,与bar1相比细胞mtt还原明显降低,细胞存活率降低到70.1±6.7%(p<0.01),而bar5-7用1mg/ml、2mg/ml、4mg/ml的铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)预处理24小时可以改善aβ25-35对细胞的毒性损伤,并且随着药物剂量的增加,这种改善作用越明显,其中2mg/ml和4mg/ml的铜蓝蛋白与运铁蛋白混合物最显著(细胞存活率分别为99.7±10.8%,p<0.05vs.模型对照组,119.4±8.7%,p<0.0001vs.模型对照组)。bar3-5用0.25mg/ml、0.5mg/ml、1mg/ml的铜蓝蛋白预处理24小时不能显著改善aβ25-35对细胞的毒性损伤(细胞存活率分别为72.2±8.2%,p>0.05vs.模型对照组,73.5±2.9%,p>0.05vs.模型对照组,80.2±5.4%,p>0.05vs.模型对照组)。
以上说明在2-4mg/ml的浓度范围内,铜蓝蛋白与运铁蛋白混合物(质量比为1:1;铜蓝蛋白活性为1.02unit/mg)可以显著改善aβ25-35对原代培养海马神经元的毒性损伤。
检测例2
本检测例是实施例2所述的铜蓝蛋白(cp溶液)单独、实施例2所述的运铁蛋白单独、以及铜蓝蛋白和运铁蛋白按质量比1:1的混合物对处理后5xfad模型鼠筑巢能力和学习记忆能力的检测。
检测1:筑巢行为学实验检测:
(1)厨房纸剪成细的长条后揉皱,空笼中加入1cm左右高的木屑垫料,在垫料上均匀撒入3-4g剪碎的厨房纸,放入一只5×fad转基因(app)小鼠或野生型(wt)对照小鼠。
(2)48小时后观察筑巢情况并评分。评分标准如下:
0分:小鼠没有动过筑巢材料,筑巢材料保持放入时原样。
1分:虽然筑巢材料被小鼠动过,但在笼中没有明显形成巢的位置,筑巢材料分散在笼中。
2分:有明显巢的位置,巢扁平,中间没有明显凹陷。
3分:有明显巢的位置,巢中间稍有凹陷,高度低于小鼠背部弓起后1/2。
4分:有明显巢的位置,巢中间有凹陷,高度为小鼠背部弓起后1/2。
5分:有明显巢的位置,巢中间有凹陷,高度高于小鼠背部弓起后1/2。
(3)将小鼠分为以下5组,每组15只小鼠。
第一组(wt_pbs):野生型(wt)对照小鼠,其尾静脉按照体重注射20mmol/lpbs(ph7.2);本组为空白对照;
第二组(tg_pbs):5×fad转基因(app)小鼠,该组5×fad转基因小鼠的尾静脉按照体重注射20mmol/lpbs(ph7.2);本组为模型对照;
第三组(tg_cp):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的铜蓝蛋白(30mg/kg铜蓝蛋白);
第四组(tg_tf):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的运铁蛋白(30mg/kg运铁蛋白);
第五组(tg_cptf低剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(6mg/kg铜蓝蛋白与运铁蛋白混合物);
第六组(tg_cptf中剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(15mg/kg铜蓝蛋白与运铁蛋白混合物);
第七组(tg_cptf高剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(30mg/kg铜蓝蛋白与运铁蛋白混合物);
上述7组每隔两天注射一次,共注射8次;之后再按照(1)和(2)步骤进行筑巢行为实验。
测试结果见图3。第一组(wt_pbs)得分为4.40±0.21,第二组(tg_pbs)得分为0.71±0.31,第三组(tg_cp)得分为3.01±0.45(p<0.001vs.tg_pbs),第四组(tg_tf)得分为1.79±0.39(p<0.05vs.tg_pbs),第五组(tg_cptf低剂量)得分为1.26±0.37,第六组(tg_cptf中剂量)得分为2.23±0.33(p<0.01vs.tg_pbs),第七组(tg_cptf高剂量)得分为4.11±0.27(p<0.001vs.tg_pbs),可见对于阿尔茨海默症模型小鼠来说,注射单独铜蓝蛋白和单独运铁蛋白高剂量可以显著提高筑巢行为;注射铜蓝蛋白与运铁蛋白混合物在同样剂量下,比单独注射铜蓝蛋白和单独运铁蛋白更能够明显提高筑巢行为。
小鼠的筑巢能力转化到人类指人类对日常生活的自理能力,由此可见,注射铜蓝蛋白可以明显改善阿尔茨海默症模型小鼠日常生活的自理能力。
检测2:morris水迷宫测试(水迷宫行为学实验检测)。
(1)将小鼠分为以下5组,每组15只小鼠。
第一组(wt_pbs):野生型(wt)对照小鼠,其尾静脉按照体重注射20mmol/lpbs(ph7.2);本组为空白对照;
第二组(tg_pbs):5×fad转基因(app)小鼠,该组5×fad转基因小鼠的尾静脉按照体重注射20mmol/lpbs(ph7.2);本组为模型对照;
第三组(tg_cp):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的铜蓝蛋白(30mg/kg铜蓝蛋白);
第四组(tg_tf):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的运铁蛋白(30mg/kg运铁蛋白);
第五组(tg_cptf低剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(6mg/kg铜蓝蛋白与运铁蛋白混合物);
第六组(tg_cptf中剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(15mg/kg铜蓝蛋白与运铁蛋白混合物);
第七组(tg_cptf高剂量):5×fad转基因小鼠,该组5×fad转基因小鼠的尾静脉均注射灭菌后的蛋白混合物(30mg/kg铜蓝蛋白与运铁蛋白混合物);
上述5组每隔两天注射一次,共注射8次;之后进行morris水迷宫训练。
(2)水迷宫实验记录潜伏期的长短测定小鼠的空间辨别能力。水迷宫装置由直径120cm、高50cm的圆形水池和可移动的直径10cm的平台组成,水池的上方装有摄像头并与电脑自动记录仪连接,水温保持(22±3)℃。
(3)第1-5天训练为隐藏平台训练,平台放置于固定位置并低于水面1cm,加入钛白粉使平台不可见,将小鼠头朝池壁轻轻随机放入水池中4个象限之一,每次试验每只小鼠游泳60s,让其找到水中平台,让其停留5s;若小鼠入水后未能找到平台,则将时间记录为60s,并且将其人为放置在平台上20s,每只小鼠每天重复4次试验。
(4)最后一次定位航行实验结束后24h,撤出平台,将小鼠放入水中追踪器运动轨迹60s,测试小鼠60s内的运动轨迹、潜伏期及穿过原先放置平台位置象限次数及时间作为空间记忆形成指标,并进行组间对比。
注意:整个测试过程中保持实验室内灯光、物品摆放等室内环境一致,以排除环境的干扰。
测试结果见图4。其中,a部分为小鼠在隐藏平台训练阶段上台时间,b部分为小鼠在测试阶段在目标象限所处时间百分比。
a部分中,在隐藏平台训练阶段,对比wt_pbs组,tg_pbs和tg-cptf低剂量组组学习曲线(逃离潜伏期)第2,3,4天差异显著,后面趋于一致,wt_pbs组和tg-cp组、tg-tf组、tg-cptf中剂量组、tg_cptf高剂量组学习曲线(逃离潜伏期)相近。所有小鼠在测试之前都学会记住隐藏平台的位置。
b部分中,各组在目标象限所处时间百分比依次为:第一组(wt_pbs)为33.9±0.33,第二组(tg_pbs)为19.2±2.9,第三组(tg_cp)为30.2±1.8(p<0.01vs.tg_pbs),第四组(tg_tf)为26.1±1.9,第五组(tg_cptf低剂量)为21.5±3.2,第六组(tg_cptf中剂量)为27.8±2.2(p<0.05vs.tg_pbs),第七组(tg_cptf高剂量)为34.8±1.1(p<0.001vs.tg_pbs)。可见对于阿尔茨海默症模型小鼠来说,注射单独铜蓝蛋白和单独运铁蛋白高剂量可以显著提高5×fad转基因(app)小鼠在目标象限所处时间;注射铜蓝蛋白与运铁蛋白混合物在同样剂量下,比单独注射铜蓝蛋白和单独运铁蛋白更能够明显提高5×fad转基因(app)小鼠在目标象限所处时间。
由此可见,注射上述铜蓝蛋白与运铁蛋白混合物可以明显改善阿尔茨海默症模型小鼠的认知水平。
- 还没有人留言评论。精彩留言会获得点赞!