用于治疗脑癌的化合物的制作方法
本申请是申请日为2015年3月26日、发明名称为“用于治疗脑癌的化合物”的中国专利申请no.201580029183.2的分案申请。
发明领域
本发明涉及对脑癌的新治疗方法,所述脑癌在过去对于治疗特别有抗性,即星形胶质细胞脑肿瘤,脑癌(转移性癌症)和原发性cns淋巴瘤。
发明背景
癌症是最具有生命威胁的疾病之一。癌症是其中身体一部分中的细胞经历失控生长的病症。根据来自美国癌症协会的最新数据,估计在2014年美国有167万新增癌症病例。癌症是美国第二大死因(仅次于心脏病)并且估计在2014年夺去超过585,000条生命。实际上,预计生活在美国的所有男性中的50%和所有女性中的33%在他们的有生之年都将发展某种类型的癌症。因此,癌症构成重大的公共健康负担并且在美国导致了显著成本。这些数字在其他地方在全球大多数国家中反映,尽管癌症的类型和发展癌症的群体的相对比例取决于许多不同因素(如包括遗传和饮食)而变化。
世界卫生组织(who)将原发性脑肿瘤分成四类。whoi和ii级是低级胶质瘤,而间变性星形细胞瘤和间变性少突神经胶质瘤(whoiii级)以及胶质母细胞瘤(gbms)(whoiv级)总称为恶性胶质瘤。大多数原发性和继发性脑肿瘤的预后是极坏的,因为缺乏有效的治疗剂。它们是儿童中由于实体瘤导致的死亡的首因并且是年龄在15-34岁的青少年和成人中癌症导致的死亡的第三大原因(jemal等,cacancerjclin592009225-249)。
在恶性胶质瘤中,gbm是最常见的和致命的肿瘤,代表所有胶质瘤的约50%。gbm的预后令人沮丧,突出了对新治疗策略的需要。外科手术接着是烷基化剂替莫唑胺(tmz)和放疗的组合疗法是对于患有gbm的患者的标准治疗。tmz的主要作用机制是通过dna碱基的异常甲基化引发的,特别是dna中的o6-甲基鸟嘌呤(verbeek等,brmedbul,85,2008,17-33)。然而,许多患者对tmz具有抗性或者仅显示弱反应。这已经显示是由o6-甲基鸟嘌呤-dna甲基转移酶(mgmt)介导的错配修复(mmr)赋予的(参见weller等,natrevneurol,6,2010,39-51)。具有该修复系统的患者具有‘mgmt阳性gbm’。mtor/dnapkc途径的激活也被认为发挥作用。迄今还未开发出针对mgmt阳性gbm具有活性的化疗剂。mgmt的活性在其他星形胶质细胞的脑肿瘤(即弥漫性星形细胞瘤(whoii级)和间变性星形细胞瘤(whoiii级))中也是重要的。这些至gbm的进展主要通过mgmt的甲基化来介导。因此可以看出,针对mgmt阳性星形细胞瘤具有活性的治疗剂在防止这些弥漫性和间变性星形细胞瘤进展为gbm方面将是理想的。
因此,关键的是急切开发一种具有优异抗肿瘤活性的新治疗剂,其不仅针对mgmt阴性gbm还针对mgmt阳性gbm(以及其他星形胶质细胞的脑肿瘤),显示优异的cns穿透并且具有可耐受的毒性性质。
转移性脑肿瘤作为癌症起始于身体别处并扩散至脑。乳腺癌、肺癌、黑素瘤、结肠癌和肾癌通常转移。经常地,在原发性肿瘤之前发现转移性脑肿瘤。转移性脑肿瘤是成人中所有脑肿瘤中最常见的。估计每年可能存在高达170,000例新病例。尽管比gbm稍微好点,但是转移性脑癌的预后通常是差的。再次,采用外科手术、治疗和化疗的组合,这些选项之中的确切组合取决于转移癌的本性和发展阶段(以及患者的健康)。外科手术(当可能时)和放疗是应用的标准治疗。有时候使用化疗。不幸的是,迄今还未有很大成功。这部分是由于需要化疗剂显示优异的cns穿透(当然,还有优异的抗肿瘤活性和可耐受的毒性性质)。许多现有的化疗剂显示对血脑屏障的差的穿透。急切需要解决这些问题的新治疗剂。
原发性中枢神经系统(cns)淋巴瘤源自淋巴细胞,但是应当认为是脑肿瘤,因为其位置仅在脑中并且治疗挑战类似于其他脑肿瘤的那些。具体地,药物递送被血脑屏障阻碍并且脑毒性限制当前治疗的使用。大多数原发性cns淋巴瘤是弥漫性大b-细胞淋巴瘤(约90%)。尽管其相对稀少,但是其发病率和流行程度正在增加。当前,使用现有治疗方案的中值存活率为44个月。对于该病症还未建立特别有效的治疗方案。当前优选的化疗剂是甲氨蝶呤。然而,其对血脑屏障的穿透并不令人满意,并且不得不以极高的剂量施用。使用放疗的组合疗法可以改善结果,但是副作用可能是非常严重的。因此,需要一种改进的化疗剂,其具有更大的穿透血脑屏障的能力并且还显示针对原发性cns淋巴瘤的优异的抗肿瘤活性。
在wo-a-2010/085377中,公开了以下式i的化合物。它是首创一类(first-in-class)双功能烷基化-hdaci融合分子,其有效地抑制hdac途径。
生物学测定显示,式i的化合物有效地抑制1类和2类hdac酶(例如hdac1,ic50为9nm),并且已经显示具有针对多发性骨髓瘤细胞系的优异的体外活性。此外,其通过显著下调fancd2,brca1,brca2,和ts(胸苷酸合成酶)抑制dna修复,可能涉及hdac6和hdac8抑制。在nci-60细胞系中的细胞毒性测定已经显示其具有极强的抗癌活性,与苯达莫司汀(bendamustine)的72μm相比,其ic50中值为2.2μm。wo-a-2013/113838包括了显示式i的化合物(在说明书中称为nl-101)针对许多细胞系的活性的数据,所述细胞系包括一些成胶质细胞瘤细胞系。然而,考虑的细胞系中的每一种都是mgmt阴性gbm肿瘤细胞系。
发明概述
在本发明的第一方面,提供用于治疗脑癌的式i的化合物或其药用盐:
所述脑癌选自mgmt阳性星形胶质细胞脑肿瘤、转移性脑癌和原发性cns淋巴瘤。
在临床前体外和体内研究中,已经显示式i的化合物不仅针对mgmt阴性gbm肿瘤具有活性,而且对于mgmt阳性gbm肿瘤具有活性。由此,还可以预期其对于其他mgmt阳性星形胶质细胞肿瘤具有活性。已经发现,式i的化合物能够非常好地穿透血脑屏障,使得其不仅针对mgmt阳性星形胶质细胞肿瘤而且针对其他脑肿瘤的治疗应用理想。特别是,已经进一步发现其具有非常好的针对转移性脑癌以及原发性cns淋巴瘤的活性。
在本发明的第二方面,提供了式i的化合物或其药用盐在制备药物中的应用,所述药物用于治疗选自mgmt阳性星形胶质细胞脑肿瘤、转移性脑癌和原发性cns淋巴瘤的脑癌。
在本发明的第三方面,提供了一种在需要其的患者中治疗脑癌的方法,所述脑癌选自mgmt阳性星形胶质细胞脑肿瘤、转移性脑癌和原发性cns淋巴瘤,所述方法包括将式i的化合物或其药用盐施用于所述患者。
附图描述
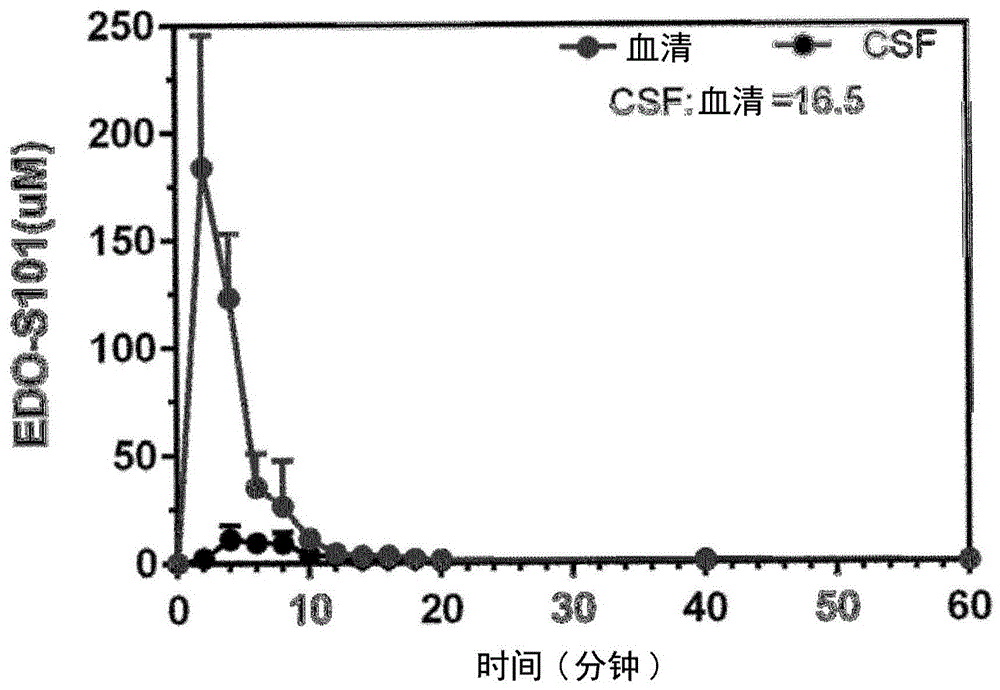
图1是在脑脊液和血液中edo-s101浓度(μm)对时间的图表;
图2是在施用替莫唑胺之后,12种测试的gbm细胞系的ic50的图表;
图3是在施用替莫唑胺和伏林司他(vorinostat)之后,12种测试的gbm细胞系的ic50的图表;
图4是在施用苯达莫司汀之后,12种测试的gbm细胞系的ic50的图表;
图5是在施用苯达莫司汀和伏林司他后,12种测试的gbm细胞系的ic50的图表;
图6是对于12种测试的细胞系的每一种,细胞存活百分比针对edo-s101(μm)浓度的图表;
图7a是作为注射后gbm12细胞生长测量值的发光针对时间的图表;
图7b是存活百分比针对时间的图表,显示了edo-s101针对苯达莫司汀和对照的存活的延长。
图8是对于移植了用edo-s101处理的u251肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图9是对于移植了用edo-s101处理的u87肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图10是对于仅用放疗处理、用放疗和2.5μmedo-s101(在图中显示为nl-101)和5μmedo-s101edo-s101处理的u251,u87和t98g细胞,存活分数针对放疗剂量(gy)的图表;
图11是对于移植了用对照、放疗和edo-s101处理的u251肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图12是对于移植了用对照、放疗和替莫唑胺、edo-s101以及放疗和edo-s101处理的u251肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图13是对于移植了用对照、放疗和edo-s101处理的u87肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图14是对于移植了用对照、放疗和替莫唑胺、edo-s101、以及放疗和edo-s101处理的u87肿瘤的小鼠,进展时间(ttp)概率(%)针对时间的图表;
图15和16是在用对照载体、edo-s101、替莫唑胺、以及放疗和替莫唑胺处理后,原位荧光素酶-转染的u251gbm小鼠的生物发光图像;
图17是在用对照载体、放疗、edo-s101、替莫唑胺、以及放疗和替莫唑胺处理后,对于原位荧光素酶-转染的u251gbm小鼠存活概率(%)针对时间的图表;
图18是对于移植了用对照、苯达莫司汀和edo-s101处理的oci-ly10cns淋巴瘤的小鼠,存活百分比针对时间的图表;和
图19是对于在用mb-468乳腺癌细胞转染后具有脑的三阴性转移性乳腺癌的小鼠,存活百分比针对时间的图表,所述mb-468乳腺癌细胞用对照、苯达莫司汀和edo-s101处理。
发明详述
在本发明中,使用许多通用术语和措词,其应该如下解释。
星形胶质细胞脑肿瘤是源自于脑内星形的胶质细胞(星形胶质细胞)的肿瘤。它们分为低级(i和ii)和高级(iii和iv)。已知ii级星形胶质细胞肿瘤为弥漫性星形细胞瘤。尽管这些生长较慢,但是它们可以发展成为恶性原发性肿瘤。已知iii级星形胶质细胞肿瘤为间变性星形细胞瘤。这些是恶性肿瘤;它们生长更快并且倾向于侵入附近健康组织。已知iv级星形胶质细胞肿瘤是多形性成胶质细胞瘤(gbm)。这些是高度恶性的,生长快速,容易扩散到附近组织,并且非常难以用常规治疗来治疗。
目前的标准化疗治疗是使用替莫唑胺(tmz)。然而,许多患者对于反应具有抗性或者仅显示弱反应。已经显示这是通过o6-甲基鸟嘌呤-dna甲基转移酶(mgmt)介导的错配修复(mmr)赋予的(参见weller等,natrevneurol,6,2010,39-51)。具有该修复系统的患者具有‘mgmt阳性gbms’。gbms因此分成mgmt阴性gbms和mgmt阳性gbms,这取决于它们是否表达mgmt基因。已经显示本发明式i的化合物或其药用盐不仅具有针对mgmt阴性的gbms的活性,而且具有针对mgmt阳性gbms的活性。
mgmt活性在其他星形胶质细胞脑肿瘤中也是重要的,所述其他星形胶质细胞脑肿瘤即弥漫性星形细胞瘤(whoii级)和间变性星形细胞瘤(whoiii级)。这些至gbms的进展主要是通过mgmt导致的甲基化介导的。因此可以看到,因为式i的化合物及其药用盐具有针对mgmt阳性星形细胞瘤的活性,因此它也能够预防这些弥漫性和间变性星形细胞瘤至gbms的进展。
转移性脑肿瘤是作为身体内其他地方的癌症起始并且扩散到脑的脑肿瘤。乳腺癌、肺癌、黑素瘤、系统性淋巴瘤、肉瘤、结肠癌、胃肠癌和肾癌通常转移。
在本发明上下文中的原发性cns淋巴瘤是源自脑内的淋巴细胞、由所述淋巴细胞形成的恶性细胞的淋巴瘤。因此,认为其为脑肿瘤,因为其位置和治疗挑战类似于其他脑肿瘤的那些。
“药用盐”是指本发明化合物的盐,其是药学上可接受的,如上定义,并且具有所需的药理学活性。这些盐包括与无机酸或与有机酸形成的酸加成盐。药用盐还包括碱加成盐,其当存在的酸性质子能够与无机或有机碱反应时可以形成。通常,这样的盐例如通过将游离酸或碱形式的这些化合物与化学计算量的适当的碱或酸在水中或在有机溶剂中或在这两者的混合物中反应来制备。通常,优选非水性介质如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。酸加成盐的实例包括无机酸加成盐,如例如盐酸盐,氢溴酸盐,氢碘酸盐,硫酸盐,硫酸氢盐,氨基磺酸盐,硝酸盐,磷酸盐,和有机酸加成盐,如例如乙酸盐,三氟乙酸盐,马来酸盐,富马酸盐,柠檬酸盐,草酸盐,琥珀酸盐,酒石酸盐,水杨酸盐,甲苯磺酸盐,乳酸盐,萘磺酸盐,苹果酸盐,扁桃酸盐,甲磺酸盐和对甲苯磺酸盐。碱加成盐的实例包括无机盐,如例如,钠、钾、钙和铵盐,和有机碱盐,如例如乙二胺、乙醇胺、n,n-二亚烷基乙醇胺、三乙醇胺和碱性氨基酸盐。
在本发明中,式i的化合物的药用盐可以优选为盐酸盐,氢溴酸盐,氢碘酸盐,硫酸盐,硫酸氢盐,氨基磺酸盐,硝酸盐,磷酸盐,柠檬酸盐,甲磺酸盐,三氟乙酸盐,谷氨酸盐,葡糖醛酸盐,戊二酸盐,苹果酸盐,马来酸盐,琥珀酸盐,富马酸盐,酒石酸盐,甲苯磺酸盐,水杨酸盐,乳酸盐,萘磺酸盐或乙酸盐,并且更优选乙酸盐。
在本发明中,当将式i的化合物或其药用盐用于治疗mgmt阳性星形胶质细胞脑肿瘤时,这优选选自mgmt阳性多形性成胶质细胞瘤、弥漫性(whoii级)星形细胞瘤和间变性(whoiii级)星形细胞瘤,并且最优选为mgmt阳性多形性成胶质细胞瘤。
在本发明中,当将式i的化合物或其药用盐用于治疗转移性脑癌时,这优选选自转移性乳腺癌、转移性系统性淋巴瘤、转移性肺癌、转移性黑素瘤、转移性肉瘤和转移性胃肠癌,并且最优选转移性乳腺癌。
根据本发明第一、第二和第三方面施用于患者的式i的化合物或其药用盐和包含其的药物的治疗有效量是以下量,所述量以适用于任何药物治疗的合理的效益/风险比赋予对所治疗的受试者根据本发明的治疗效果。治疗效果可以是客观的(即,通过某种测试或标记可测量的)或主观的(即,受试者给出效果指示或感觉)。认为根据本发明的式i的化合物或其药用盐的有效量是这样的量,其中以0.1至70mg/kg患者体重(例如,0.5至50mg/kg体重,如1,5,10,20,30,40or50mg/kg体重)的剂量范围包括式i的化合物或其药用盐。
对于任何具体患者的特定治疗有效剂量水平将取决于各种因素,所述因素包括被治疗的病症和病症严重性;使用的具体化合物的活性;使用的具体组合物;患者的年龄,体重,整体健康,性别和饮食;给药时间,给药途径和使用的具体化合物的排泄率;治疗持续时间;与使用的具体化合物组合或同时使用的药物;和医药领域公知的类似因素。
根据本发明第一、第二和第三方面的式i的化合物或其药用盐和包含它们的药物的给药形式的适当实例非限制性地包括口服、局部、肠胃外、舌下、直肠、阴道、经眼和鼻内。肠胃外给药包括皮下注射,静脉内、肌内、胸骨内注射或输注技术。优选地,将式(i)的化合物或其药用盐和包含它们的药物肠胃外施用,并且最优选静脉内施用。
优选地,将式i的化合物或其药用盐以0.1mg/kg至70mg/kg患者体重的剂量水平静脉内施用于需要其的患者,并且最优选以0.5mg/kg至50mg/kg患者体重的剂量水平静脉内施用于需要其的患者。
已经发现,在本发明的第一、第二和第三方面中,可以优选将式i的化合物或其药用盐或包含它们的药物在治疗周期的第1天、第8天和第15天、在治疗周期的第1天和第8天或仅在治疗周期的第1天施用于需要其的患者。
在本发明第一、第二和第三方面的另一个优选实施方案中,出人意料地发现式i的化合物及其药用盐当与放疗联合施用时显著更有效,并且实际上在体内和体外研究中似乎与放疗都具有协同效应。因此,在本发明第一、第二和第三方面中,可以将式i的化合物或其药用盐或包含它们的药物用于治疗需要其的患者,其中在用所述式i的化合物或其药用盐或包含它们的药物治疗之前或之后,还为需要其的患者提供放疗。优选地,在用所述式i的化合物或其药用盐或包含它们的药物治疗之前,为所述患者提供放疗治疗。可以以连续5天1至5gy并且优选以连续5天2gy的剂量提供放疗。
在本发明第一、第二和第三方面的另一个优选实施方案中,所述治疗进一步包括向需要其的患者施用血管内皮生长因子(vegf)抑制剂,并且所述式i的化合物或其药用盐和所述血管内皮生长因子(vegf)抑制剂可以同时、顺序或分开施用,并且优选同时施用。优选地,所述血管内皮生长因子(vegf)抑制剂是贝伐珠单抗。
在本发明第一、第二和第三个实施方案的另一个优选实施方案中,所述治疗还包括向需要其的患者施用聚adp核糖聚合酶(parp)抑制剂,并且所述式i的化合物或其药用盐和所述聚adp核糖聚合酶(parp)抑制剂可以同时、顺序或分开施用,并且优选同时施用。优选地,所述聚adp核糖聚合酶(parp)抑制剂选自rucaparib、奥拉帕利(olaparib)和veliparib。
在本发明第一、第二和第三个实施方案的另一个优选实施方案中,所述治疗还包括向需要其的患者施用pd-1/pdl-1(免疫检查点)抑制剂,并且所述式i的化合物或其药用盐和所述pd-1/pdl-1(免疫检查点)抑制剂可以同时、顺序或分开施用,并且优选同时施用。优选地,所述pd-1/pdl-1(免疫检查点)抑制剂是伊匹木单抗。
当意欲用于口服给药时,本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物可以是固体或液体形式,其中半固体、半液体、混悬液和凝胶形式被包括在本文中考虑为固体或液体的形式内。
本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物可以使用药学领域公知的方法制备用于给药。适当的药物制剂和载体的实例描述在e.w.martin的"remington'spharmaceuticalsciences"中。
作为用于口服给药的固体组合物,本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物可以配制成粉末、颗粒、压缩片剂、药丸、胶囊、口香糖、糯米纸囊剂(wafer)等形式。该固体组合物典型地含有一种或多种惰性稀释剂,作为包含所有活性剂的单一片剂或作为各自包含本发明的组合的单一活性剂的多个分开的固体组合物(在试剂盒的情形中)。另外,可以存在以下中的一种或多种:粘合剂如羧甲基纤维素,乙基纤维素,微晶纤维素,或明胶;赋形剂,如淀粉,乳糖或糊精,崩解剂,如海藻酸,海藻酸钠,玉米淀粉等;润滑剂,如硬脂酸镁;助流剂,如胶体二氧化硅;甜味剂,如蔗糖或糖精;调味剂如薄荷油,水杨酸甲酯或橙味调味剂;和着色剂。
当本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物是胶囊形式(例如,明胶胶囊)时,除了上述类型的材料以外,它还可以含有液体载体,如聚乙二醇,环糊精或脂肪油。
本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物可以是液体形式,例如酏剂、糖浆、溶液剂、乳剂或混悬剂。该液体可以用于口服给药或者用于通过注射递送。当意欲用于口服给药时,本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物可以包含甜味剂、防腐剂、染料/着色剂和增香剂中的一种或多种。在用于通过注射给药的本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物中,还可以包括表面活性剂、防腐剂、润湿剂、分散剂、悬浮剂、缓冲剂、稳定剂和等张剂中的一种或多种。
优选的给药途径是肠胃外给药,包括但不限于,皮内,肌内,腹膜内,静脉内,皮下,鼻内,硬膜外,鼻内,脑内,心室内,鞘内,阴道内或透皮。优选的给药方式留待执业医生判断,并且将部分取决于医学病症的部位(如癌症部位)。在更优选的实施方案中,静脉内施用本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物。
本发明第一、第二和第三方面的液体的式i的化合物或其药用盐或包含它们的药物,无论它们是溶液、混悬液或其他类似形式,还可以包括以下中的一种或多种:无菌稀释剂,如注射用水,盐水溶液,优选生理盐水,林格氏溶液,等张氯化钠,固定油,如合成甘油单酯或二酯,聚乙二醇,甘油,或其他溶剂;抗细菌剂,如苯甲醇,或对羟基苯甲酸甲酯;和用于调节张力的试剂,如氯化钠或右旋糖。肠胃外组合或组合物可以被包封在由玻璃、塑料或其他材料制成的安瓿管、一次性注射器或多剂量小瓶中。生理盐水是优选的辅剂。
可以通过任何便利的途径,例如通过输注或推注,通过上皮或皮肤黏膜衬里吸收,并且优选通过推注,施用本发明第一、第二和第三方面的式i的化合物或其药用盐或包含它们的药物。
实施例
在以下实施例中,将具有下式i的化合物称为edo-s101。
如wo-a-2010/085377的实施例6所述,制备edo-s101。将edo-s101溶解在dmso(100x母液)中并保存在4℃,之后在使用日悬浮在介质中。
实施例1在sprague-dawley大鼠中edo-s101的cns药物代谢动力学分析
在以40mg/kg尾静脉注射edo-s101后在大鼠中确定cns药物代谢动力学。通过微透析探针以18时间间隔从血液和脑室中收集微透析液样品。用uv检测(ce-uv),通过毛细管电泳,确定这些样品中的药物浓度,接着计算各种药物代谢动力学参数。
使用气态异氟烷(在20%氧和80%氮气的混合物中的1%异氟烷)将六只大鼠麻醉,并且固定在立体定位的框架(kopfinstruments,tujunga,ca)中。在整个程序中保持麻醉。将每个引导套管(cmamicrodialysisinc.,acton,ma)立体定位地植入侧脑室(ap-0.9,l1.6,v3.4,相对于前囟和头骨),然后通过螺钉和牙科粘合剂固定头骨。在外科手术后,将每只大鼠单独收容,随意提供食物和水3天,以从插管手术中恢复。在清醒的自由移动的大鼠上进行微透析实验。在实验当日,将引导套管中的管心针用微透析探针(cma/11,具有4mm膜,cmamicrodialysisinc.,acton,ma)替换,并且将血管微透析探针(cma/20,具有4mm膜,cmamicrodialysisinc.,acton,ma))植入颈静脉。所述探针具有进口管,所述进口管与注射器连接以递送人工脑脊髓液(146mmnacl,1.2mmcacl2,3mmkcl,1mmmgcl2,1.9mmna2hpo4,0.1mmnah2po4,ph7.4)到脑室中并且将dulbecco’s磷酸盐缓冲盐水(d-pbs)递送到血液中,流速为0.5μl/min。出口管与微级分收集器连接,以在4℃收集微透析液。在剂量给药之前,允许大鼠恢复至少24小时。在(静脉内)注射edo-s101之后,在3小时内收集十八个样品。将所有样品加样至毛细管电泳,用uv检测(ce-uv)以确定脑脊髓液(csf)和血液中的edo-s101的浓度。在实验后用co2吸入将大鼠处死。在每个实验结束时通过目检证实探针的位置。
通过ce-uv(agilent3dce)测量微透析液中的edo-s101。简而言之,用1m氢氧化钠将毛细管预先处理2分钟,用水预先处理2分钟和用运行缓冲液[100mmol/l乙酸铵溶液(用乙酸调节至ph3.1)-乙腈(50∶50,v/v)]预先处理3分钟。将样品以0.7psi的压力注射5s并且注射体积约为5nl。在注射后,将edo-s101在50μmi.d.和50/65cm长度(有效长度/总长度)的熔融二氧化硅毛细管中在15kv和25℃下分离。以uv在300nm检测来自edo-s101的吸光度。在光电倍增管(pmt)上收集发射。
为了对数据进行统计学分析,使用双向重复测量anova,接着是tukey’s检验。认为p<0.05是显著的。作为csf和血液曲线下面积(auc)的比率,确定cns穿透。
在分析结果后,发现edo-s101以16.5%的cns穿透,很好地穿过血脑屏障(参见图1)。其可以以11.2μm的cmax获得高cns浓度。因此,edo-s101对于脑肿瘤的治疗应用是理想的。还显示其具有非常短的在血液中约6分钟和在脑中约9分钟的半衰期。由于药物浓度是基于edo-s101在300nm的uv波长下的吸光度确定的,所以所有测量值是关于未代谢化的edo-s101的。结果总结在以下表1中。
表1
实施例2edo-s101和已知化合物对于各种mgmt阳性和阴性细胞系的体外活性测试
设计体外实验,其中使用一系列代表mgmt阴性和mgmt阳性肿瘤细胞的gbm细胞系。
化合物:1-100μmedo-s101,1-50μm替莫唑胺(tmz),1-50μm替莫唑胺+500nm伏林司他,1-40μm苯达莫司汀,1-40μm苯达莫司汀和500nm伏林司他。
细胞系:a172,ln229,snb19,sw1783,u251,u373和u87:mgmt阴性细胞系;ln18,mz54,t98g,u138,u118:mgmt阳性细胞系
使用了十二种代表iii级和iv神经胶质瘤并且具有不同mgmt表达、药物和放疗敏感性的成胶质细胞瘤细胞系和五种患者来源的成胶质细胞瘤干细胞(参见以上)。将四种来源于患者的成胶质细胞瘤干细胞(由hotchkissbraininstitute,医学系,universityofcalgary,calgary,alberta,加拿大的j.gregorycairncross,和samuelweiss友情提供)和一种来自米兰universitylabicocca的angelovescovi教授的转染荧光素酶的ptc#8在成分确定的无血清培养基(sfm)中和以非贴壁球体培养的方式培养。将细胞重悬浮于无血清的补充有20ng/ml表皮生长因子(sigma-aldrich),20ng/ml碱性成纤维细胞生长因子(sigma-aldrich),b-27补充剂1x(gibco,lifetechnologies)和抗生素的dmem/f12培养基中。在将3×103个细胞铺平板于具有干细胞培养基的96孔平板中之后,直接加入edo-s101处理。在倒置显微镜下以×4放大率,在处理后5天对球体计数。如果球体具有至少15个细胞,将球体计数。
将细胞以2x104个细胞/ml的密度接种到24孔平板中。将细胞留下贴壁并在5%fcsdmem中培养24小时。此刻之后,将细胞在适当的培养条件下维持。每天用倒置相差显微照相机(nikondiaphot,东京,日本)进行形态学控制,之后将细胞用胰蛋白酶处理并计数。将用胰蛋白酶处理并重悬浮在1.0ml盐水中的细胞用nucleocountertmnc-100(自动细胞计数系统,chemotec,cydevang,dk)计数,以便评估细胞生存力。所有实验一式三份进行。通过grafit方法(erithacussoftwarelimited,staines,uk)计算ic50值。使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑鎓溴化物(mtt;sigma-aldrich)测定测量细胞生存力。
还如上所述测定所有十二种细胞系针对苯达莫司汀和伏林司他的ic50和ic20值。接下来,进行使用固定剂量的伏林司他(ic20值)和改变剂量的苯达莫司汀的组合测定。计算苯达莫司汀当与伏林司他组合时的新ic50值。
如从图2可以看出的,u251,u373,sw1783,a172和u87gbm细胞系对于tmz高度敏感,而ln229,snb19和u138中等敏感。然而,mgmt阳性gbm细胞系ln18,mz54,t98g和u118对于tmz具有抗性。
在分开的实验中,将tmz与500nm伏林司他组合使用。已知伏林司他与tmz在gbm细胞系中具有协同作用。如从图3张可以看出,尽管mgmt阳性gbm细胞系ln18和u118对于该组合时敏感的,但是t98g和mz54仍然是极具抗性的。t98g的ic50被降低,但是其并非在人中可以实现的剂量范围。
图4显示gbm细胞系中没有一种对于苯达莫司汀高度敏感,但是ln18,ln229,snb19,u138,u251,u373,sw1783和u87gbm细胞系对于苯达莫司汀中度敏感,而a172,mz54,t98g和u118对苯达莫司汀具有抗性。如从图5中可以看出,当苯达莫司汀与500nm伏林司他组合时,获得了与tmz和伏林司他非常类似的结果,即所有细胞系(除了mz54和t98g以外)是高度敏感的,而t98g的ic50降低,它不是人中可实现的剂量范围。
与其他单一化合物和组合比较,图6张十二种测试的细胞系的ic50曲线显示了所有十二种细胞系,包括所有mgmt阳性细胞系,对于edo-s101是高度敏感的。这显示edo-s101是针对mgmt阴性和mgmt阳性gbms二者的高度有希望的治疗剂。
对于不同细胞系的ic50值的总结显示在以下表2中。
表2
实施例3edo-s101在小鼠模型中对于多形性成胶质细胞瘤的体内评估
基于通过生物发光成像确定的肿瘤生长和通过kaplan-meier分析确定的存活分析,在鼠脑肿瘤模型中确定edo-s101针对gbm的治疗活性。
使用立体定位平台,在麻醉下在无胸腺小鼠中通过脑内注射3x105个转染荧光素酶的gbm12细胞,产生鼠脑肿瘤模型。gbm12是mgmt阴性肿瘤细胞系。在外科手术之前,将十八周龄的无胸腺小鼠进行最少7天适应/隔离。在无菌条件下在层流净化罩中进行外科手术。给予tylenol300mg/kgpo,以用于在外科手术前镇痛24小时,手术后持续48小时。通过吸入1-2%异氟烷实现麻醉。在小鼠变得完全被麻醉后,将其置于kopf立体定位仪器中。将少量bnp抗生素软膏(杆菌肽,新霉素和多粘菌素的混合物)涂抹在其眼睛上以防止手术期间的感染和角膜损伤。将一条软织物放在小鼠身体和尾巴上以防止手术期间过度热损失。头皮区域用2%聚维酮碘(betadine)清洁并用棉尖涂药器干燥。在头皮中进行中线矢状切割。
根据通过参考franklin和paxinos的小鼠脑地图测定的坐标(ap:0.5mm,lm:2.5mm),在左头骨上用外科钻头(kopf)或dremel钻头钻一个小的钻孔。将硬脑脊膜外科暴露,并将具有26s-号倾斜针头的10μl–hamilton注射器放低到左脑半球中直至3mm的深度,并缓慢输入(0.5μl/min)5μl的3x105个转染了荧光素酶的gbm12细胞肿瘤细胞。将针头放置原位达5分钟以防止回流,然后缓慢取出。用伤口夹密封皮肤。在外科手术后,将小鼠在温暖环境中康复并且当运动能力恢复时返回至它们的笼子中。将笼子放在加热垫顶部以最小化康复期间的身体热损失。在手术后监视小鼠,至少一天两次,共5天,或直至康复完成。在脑内肿瘤细胞移植后+4天开始,然后随后在第+11天和第+18天,通过尾静脉施用edo-s101(60mg/kg体重)或苯达莫司汀(50mg/kg体重)。将肢体麻痹作为存活分析的终点。
在脑内注射gbm细胞后,将所有小鼠进行生物发光成像(bli),从脑内注射后第4天开始,一周两次,以监视实时体内肿瘤生长。使用xenogenlumina光学成像系统(caliperlifesciences,hopkinton,ma)进行bli。用异氟烷将小鼠麻醉,之后以150mg/kg的剂量进行荧光素的腹膜内注射,提供荧光素酶的饱和底物浓度。在荧光素注射后10分钟记录到峰值发光信号。使用livingimage软件(xenogen,alameda,ca)限定涵盖颅内信号区域的目标区域,并且记录总光子/s/立体弧度/cm2。
使用anova来确定每个时刻实验组之间的差异的统计学显著性。使用prism4软件(graphpadsoftware,lajollaca)产生kaplan-meier存活曲线,以对数秩检验得出曲线之间的统计学差异。认为p<0.05是显著的。
在gbm(gbm12)的该患者衍生的异种移植物模型中,将edo-s101以iv60mg/kg每周一次在脑内移植肿瘤细胞后+4,+11,+18天施用(mtd剂量)。将苯达莫司汀以iv50mg/kg在+4,+11,+18天给予(mtd剂量)。发现edo-s101具有显著的治疗活性,抑制肿瘤生长和延长存活,中值存活为66天,相比之下,苯达莫司汀为58天,并且在非处理对照中为52天(参见图7a和7b)。edo-s101具有优异的针对该mgmt阴性多形性成胶质细胞瘤的治疗活性。
使用细胞系u87g和u251g,以类似的方式采用上述步骤。再次,通过尾静脉静脉内施用edo-s101(60mg/kg),但是在这些实验中,将其在第1,8和15天施用。替代苯达莫司汀,施用tmz作为比较,16mg/kg,连续5天,po。在28天之后处死小鼠。
对于已经植入u251肿瘤的小鼠,在图8中进展时间(ttp)概率(%)针对时间的图表显示,对于用edo-s101处理的小鼠的ttp显著长于对于对照小鼠和用tmz处理的那些观察到的。对于移植了u87肿瘤的小鼠观察到了类似的ttp的显著增加,edo-s101的ttp显著长于对照和tmz两者(参见图9)。
实施例4在多形性成胶质细胞瘤的鼠模型中对于放疗和替莫唑胺(单独或组合)edo-s101(单独或与放疗组合)的体内评估
在第一个实验中,将u251,u87和t98g细胞系用单独放疗或用放疗和edo-s101处理。
对于克隆存活,将指数生长的细胞(70%汇合)在常规培养基中培养并用适当浓度的edo-s101或载体(0.1%的dmso终浓度)处理24小时。使用6mv线性加速器elektasynergy,使用临床上校准的30×30cm的辐射面积进行肿瘤细胞辐射。在完全装填培养基的细胞培养瓶之上和之下放置两cm厚的有机玻璃板以补偿积累效应(build-upeffect)。除了辐射暴露以外,以与辐射的细胞一样处理非辐射对照。在处理之后,将细胞以适当浓度(1,000个细胞)稀释并且再接种在新的100mm组织培养皿中(一式三份)并温育14天。在第14天,去除培养基,并将克隆用甲醇∶乙酸(10∶1,v/v)固定,并用结晶紫染色。计数含有超过50个细胞的克隆。计算平板效率(pe)为观察到的克隆数/铺平板的细胞数。计算存活分数为与对照中形成的数目相比在处理的平皿中形成的克隆数。根据线性-二次公式:s(d)/s(o)=exp-(ad+bd2),通过加权的、分层的线性回归拟合数据,使用spss(chicago,il)统计软件分析存活曲线。
对于mgmt阴性u251mg成胶质细胞瘤细胞系,测量的ic50对于edo-s101为6.60μm(相比之下,对于苯达莫司汀为30μm,并且对于替莫唑胺为20μm)。
对于mgmt阴性u87g成胶质细胞瘤细胞系,测量的ic50对于edo-s101为1.36μm(相比之下,对于苯达莫司汀为50μm,并且对于替莫唑胺为20μm)。
对于mgmt阳性t98g成胶质细胞瘤细胞系,测量的ic50对于edo-s101为7.70μm(相比之下,对于苯达莫司汀为52μm,并且对于替莫唑胺为>100μm)。
如从图10可以看出,在所有3种gbm细胞系中,与单独放疗相比,当放疗与一个剂量的edo-s101(2.5μm或5μm)联用时,成胶质细胞瘤细胞的%存活率显著降低。
接下来,采用实施例3的步骤,使用gbm细胞系u251和u87,在小鼠中制备gbms皮下(s.c.)异种移植物模型。
将如上制备的u251小鼠进行放疗(2gy,连续5天),用edo-s101(60mg/kg,静脉内,在治疗周期的第1,8和15天)或仅对照处理。在任何辐射之前,小鼠用氯胺酮(25mg/ml)/甲苯噻嗪(5mg/ml)的混合物麻醉。麻醉的携带肿瘤的小鼠以2gy的剂量接收病灶辐射,连续5天。使用x-射线线性加速器以200cgy/min的剂量速率在室温递送辐射。将所有小鼠用特别设计的铅装置屏蔽,以允许辐射到右后肢。将小鼠保持在这些条件下直至所有辐射完成。
根据实施例3的步骤进行gbm的进展研究。进展时间概率(%)针对时间的图表显示在图11中。从这很明显,用edo-s101处理的小鼠的进展时间要显著长于对于放疗处理的肿瘤所观察到的。
在后续实验中,将以相同方式制备的u251小鼠进行以下处理:当前的放疗和替莫唑胺的金标准处理(2gy,连续5天,和16mg/kg,连续5天,po),用edo-s101(60mg/kg,静脉内,在治疗周期的第1,8和15天)处理,用edo-s101和放疗(2gy,连续5天,和60mg/kg,静脉内,在治疗周期的第1,8和15天)或对照处理。在图12中显示了进展时间概率(%)针对时间的图表。从这很明显,用edo-s101和放疗处理的小鼠的进展时间要显著长于用单独edo-s101处理的肿瘤所观察到的。此外,对于放疗和edo-s101的组合的进展时间要显著长于对于用放疗和替莫唑胺(当前的金标准处理)处理的肿瘤所观察到的。
遵照相同的实验顺序,但是这次是使用gbm细胞系u87在小鼠中制备的gbm的皮下异种移植物模型。在第一个实验中,将如上制备的u87小鼠进行以下处理:放疗(2gy,连续5天),用edo-s101(60mg/kg,静脉内,在治疗周期的第1,8和15天)或仅对照处理。进行gbm进展的研究。图13中显示了进展时间概率(%)针对时间的图表。从这很明显,用edo-s101(在图13中称为nl101)处理的小鼠的进展时间要显著长于对于放疗处理的肿瘤所观察到的。
在与关于u251小鼠所用类似的后续实验中,将以相同方式制备的u87小鼠进行以下处理:当前的的金标准处理-放疗和替莫唑胺(2gy,连续5天,和16mg/kg,连续5天,po),用edo-s101(60mg/kg,静脉内,在治疗周期的第1,8和15天)处理,用edo-s101和放疗(2gy,连续5天,和60mg/kg,静脉内,在治疗周期的第1,8和15天)或对照处理。图14中显示了进展时间概率(%)针对时间的图表。从这很明显,用edo-s101和放疗处理的小鼠的进展时间要显著长于对于用单独edo-s101处理的肿瘤所观察到的。此外,对于放疗和edo-s101的组合的进展时间要显著长于对于放疗和替莫唑胺(当前的金标准处理)所观察到的。还应当注意,对于用单独edo-s101处理的u87小鼠观察到的进展时间确实要大于用组合的放疗和替莫唑胺处理所取得的进展时间。
肿瘤的进展时间从对于u251g小鼠异种移植物模型的对照的约17-18天增加至对于放疗和替莫唑胺的组合的42天,到对于单独的edo-s101的超过50天(显著性p=0.924),到对于edo-s101和放疗的组合的显著超过50天(显著性p=0.0359)。
发现肿瘤的进展时间从对于u87g小鼠异种移植物模型的对照的约15天增加至对于放疗和替莫唑胺的组合的35天,到对于单独的edo-s101的40天(显著性p=2372),到对于edo-s101和放疗的组合的显著超过50天(显著性p=0.0001)。
实施例5肿瘤的组织学评估:u251-转染荧光素酶的细胞的原位移植模型
将按照实施例3的步骤用u251-荧光素酶同位素地(isotopically)转染的小鼠用以下处理:放疗(2gy,连续5天),替莫唑胺(16mg/kg,连续5天,po),放疗和替莫唑胺(2gy,连续5天和16mg/kg,连续5天,po),edo-s101(60mg/kg,静脉内,在治疗周期的第1,8和15天)或对照载体。
使用hamamatsu成像系统(caliperlifesciences,hopkinton,ma,usa)监视颅内肿瘤生长。将小鼠用2%至4%异氟烷(baxter,deerfield,il,usa)麻醉,接着腹膜内注射150mg/kgd-荧光素(invivoimagingsolutions)。同时测量五只动物,并且将发光照相机设置为1分钟曝光,中等合并(mediumbinning),1f/光圈(stop),封闭激发滤镜,和开启发射滤镜。将照相机设置为2s曝光,中等合并,和8f/光圈。将视野设定为22cm以一次捕获五只小鼠。使用相同的设定,以一周一次的基础获取系列图像。使用livingimage软件(caliperlifesciences)定量生物发光强度。
在任何辐射之前,将小鼠用氯胺酮(25mg/ml)/甲苯噻嗪(5mg/ml)的混合物麻醉。麻醉的携带肿瘤的小鼠以2gy的剂量接收病灶辐射,连续5天。使用x-射线线性加速器以200cgy/min的剂量速率在室温递送辐射。将所有小鼠用特别设计的铅装置屏蔽,以允许辐射到右后肢。将小鼠保持在这些条件下直至所有辐射完成。
使用下列顺序获得横平面的所有图像:横向t2-加权涡轮自旋回波(turbospin-echo,tse)顺序(重复时间[tr]微秒/回波时间[te]微秒)6766/120,获得信号数量4,192x192矩阵),应用的切片厚度0.9mm,交叉间隙(intersectiongap)0.0mm,和倾倒角160°。视野为36x60mm2,其整体包括在肿瘤中,获得的三维像素尺寸为0.3x0.3x1.0mm3。
连续变量总结为平均值和标准偏差(sd)或中值和中值的95%ci。对于非正态分布的连续变量,通过进行kruskal-wallis检验建立对照和处理组之间的统计学比较。对于正态分布的连续变量,通过对未成对数据(对于两个比较)进行anova检验或进行studentt检验,建立对照和处理组之间的统计学比较。
在开始不同治疗方案后50天,处死小鼠并在用对照、edo-s101、替莫唑胺、以及放疗和替莫唑胺进行处理的小鼠中,将最终颅内损伤可视化。结果显示在图15和16中。使用edo-s101和替莫唑胺研究获得类似的结果,两者都显示13只小鼠中5只(38.5%)具有某个级别的肿瘤,与此对比,在对照中11只小鼠中8只(72.7%)具有某个级别的肿瘤。然而,edo-s101处理的13只小鼠中仅有1只显示大的损伤,而13只替莫唑胺处理的小鼠中有2只显示大的损伤。在放疗和替莫唑胺研究中,11只小鼠中仅2只(18.2%)在研究结束时显示损伤,尽管这些两者都是大损伤。从这可以得出结论,edo-s101在预防gbms扩散方面高度有效。
edo-s101在预防gbms扩散方面的功效进一步在图17中强调,该图显示了存活概率(%)针对时间(天)的图表。用edo-s101处理的小鼠的存活概率显著大于关于用放疗或替莫唑胺处理的那些的存活概率。仅用放疗和替莫唑胺的组合处理的小鼠显示了与单独edo-s101相比更高的总存活概率。
实施例6edo-s101在原发性cns淋巴瘤鼠模型中的体内评估
重复实施例3的步骤,除了用1x105个转染了荧光素酶的oci-ly10b淋巴瘤细胞建立鼠模型,产生原发性cns淋巴瘤模型。在脑内移植oci-ly10b淋巴瘤细胞后第+4,+11和+18天,将edo-s101(60mg/kg体重),苯达莫司汀(50mg/kg体重)和对照通过尾静脉静脉内施用于分开的测试小鼠组。edo-s101和苯达莫司汀两者都显著抑制肿瘤生长并且延长存活,中值存活分别为62天和54天,与此对比,非处理对照为48天(参见图18)。因此,edo-s101似乎是原发性cns淋巴瘤的有希望的治疗。
实施例7edo-s101在脑的三阴性转移性乳腺癌(triplemetastaticbreastcancer)的小鼠模型中的体内评估
重复实施例3的步骤,除了用1x105个转染了荧光素酶的mb-468乳腺癌细胞建立小鼠模型,产生原发性cns淋巴瘤模型。在脑内移植mb-468乳腺癌细胞后第+4天,将edo-s101(60mg/kg体重),苯达莫司汀(50mg/kg体重)和对照通过尾静脉静脉内施用于分开的测试小鼠组。edo-s101显示了显著的治疗活性,抑制肿瘤生长并且延长存活,中值存活为71天,与此对比,苯达莫司汀为62天,并且非处理对照为55天(参见图19)。因此,edo-s101似乎是转移性脑癌的特别有希望的治疗。
总之,实验显示了edo-s101穿过血脑屏障的能力是非常好的。这使得它成为治疗脑癌的有希望的候选物。实验数据进一步显示,其不仅具有针对mgmt阴性gbms的活性,而且具有针对mgmt阳性gbms的活性,使得其高度有希望作为治疗mgmt阳性gbms和其他mgmt阳性星形胶质细胞脑肿瘤的治疗剂,因为对于这些还未开发出疗法。还显示了它在原发性cns淋巴瘤和转移性脑癌中都显著延长中值存活,再次使得它是两种病症的非常有希望的候选治疗剂。数据还显示,当将edo-s101与放疗组合施用时,则它在gbm的治疗中显示了与单独edo-s101相比显著改善的活性。
- 还没有人留言评论。精彩留言会获得点赞!