一种用于髋关节软骨修复的复合支架及其制备方法与流程
本发明涉及组织工程关节软骨修复技术领域,具体涉及一种用于髋关节软骨修复的复合支架及制备方法。
背景技术:
近年来,骨关节炎和运动导致关节软骨损伤的发病率逐渐上升。由于软骨组织无血液供应和神经支配,并且软骨细胞的低代谢活性以及高密度的细胞外基质限制了软骨细胞向缺损区域移行,在受损后自我修复能力有限,因此组织工程在软骨修复中具有极大的应用前景。
关节软骨修复的理想状态是受损的软骨能够持续生成透明状软骨,新生组织与周围组织融合,并能够符合关节软骨的生物学和力学特性。由于关节软骨的特殊结构,一旦受损便为软骨层、软骨下骨层一同受损。同时,每一层具有不同的复杂结构以及性质,层与层之间应具有较好的层间结合力。因此,如何制备满足上述要求的软骨组织工程支架是研究的热点与难点。
在软骨下骨结构中,发现钙化界面层是非常重要的生理解剖结构,在正常软骨中,钙化界面层起到很好隔离软骨与软骨下骨微环境的作用。一方面其阻止软骨下骨血管的侵入而避免软骨细胞过度钙化的发生,与此同时,防止关节液渗透入到软骨下骨进而影响成骨细胞的活性,从而保证两者有独立和不同的生存环境。在骨性关节炎的患者中常发现钙化界面层的破坏,导致软骨微环境被破坏,软骨下骨中的细胞因子扩散进入软骨微环境,促进软骨骨化,从而加重骨性关节炎的病情。
为此,有研究者尝试通过结构仿生,利用水凝胶材料通过离子交联模拟钙化界面层,但单纯水凝胶的力学性质难以满足钙化界面层、软骨下骨层的力学支撑要求;也有报道将无机材料经前期结构设计,借助3d一体化打印技术,经烧结后制备出陶瓷钙化界面层,但该产品的脆性高,也难以满足临床对钙化界面层的力学需求;还有报道通过高分子自组装或原位聚合,再借助层层干燥方法,制备出模拟钙化界面层的软骨结构,但该工艺的钙化界面层结构不够致密,难以实现对软骨微环境和成骨微环境的有效隔离,且力学强度无法满足临床力学支撑要求。
技术实现要素:
为解决上述技术问题,本发明提供了一种用于髋关节软骨修复的复合支架及制备方法。
为实现上述发明目的,本发明采用以下技术方案:
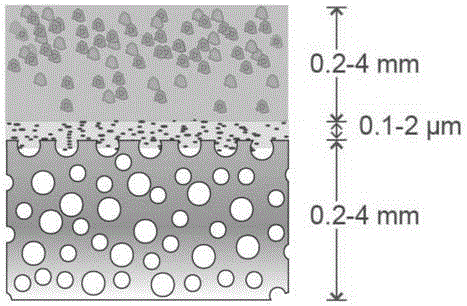
一种用于髋关节软骨修复的复合支架,所述支架由下而上依次为由生物陶瓷包裹的多孔镁支架层和高分子水凝胶层,所述水凝胶层装载有软骨细胞,植入体内后分别形成软骨下骨层、钙化界面层和软骨层三层结构。
上述技术方案中,进一步地,所述多孔镁支架的孔隙及表面原位固化生物陶瓷颗粒形成包裹住多孔镁支架层的生物陶瓷层;所述高分子水凝胶层与生物陶瓷层以生物胶粘连为一体。
上述技术方案中,进一步地,所述生物陶瓷包裹的多孔镁支架中装载有间充质干细胞。
上述技术方案中,进一步地,所述多孔镁支架表面覆盖有钙磷涂层;钙磷涂层的成分组成为羟基磷灰石(ha)、磷酸八钙(ocp)或磷酸三钙(tcp)的磷酸盐涂层;磷酸涂层厚度在3-20μm。
上述技术方案中,进一步地,所述多孔镁支架的形状由患者髋关节ct重构的股骨头形状尺寸确定;所述多孔镁支架的组成成分为纯镁或者镁合金。
上述技术方案中,进一步地,所述生物陶瓷颗粒的材质为磷酸钙基陶瓷或硫酸钙陶瓷中的一种或多种混合物;磷酸钙基陶瓷包括纳米羟基磷灰石陶瓷、磷酸钙陶瓷、磷酸二钙陶瓷、磷酸三钙陶瓷和磷酸八钙陶瓷的一种或一种以上混合物。
上述技术方案中,进一步地,所述水凝胶材料包括海藻酸盐。
上述技术方案中,进一步地,所述水凝胶材料还包括胶原、透明质酸中的一种或两种。
上述技术方案中,进一步地,所述多孔镁支架层的孔隙率为50-80%,所述高分子水凝胶的孔隙率为60%-90%。
上述技术方案中,进一步地,所述多孔镁支架层的厚度为0.2mm-4mm,所述生物陶瓷层的厚度为0.1-2mm,所述水凝胶层的厚度0.2mm-4mm。
本发明提供了髋关节软骨修复的复合支架的制备方法,所述制备方法包括以下步骤:
(1)制备多孔镁或多孔镁合金,采用渗流铸造法或3d打印法制备多孔结构的镁支架,制备好的多孔镁支架灭菌备用;
所述渗流铸造法为:将球形氯化钠晶体颗粒进行烧结,得到开孔多孔氯化钠预制结构;将镁合金熔液浇入放有氯化钠预制体的模腔,进行压力渗流铸造;除去氯化钠-镁合金复合结构外表皮,水洗滤除氯化钠,得到多孔镁合金;
所述3d打印法工艺参数为:铺粉厚度为30-50μm,激光功率为80-120w,曝光时间20-50μs,激光扫描点间距30-60μm,线间距30-60μm;
(2)在步骤(1)制备的多孔镁支架上在无菌环境下涂覆生物陶瓷浆料,生物陶瓷浆料由生物陶瓷粉末与所用溶剂以体积比5:1-1:10配制而成;支架孔隙中接种106-108细胞数量的间充质干细胞;
(3)制备高分子水凝胶:以海藻酸钠的终浓度10g/l-50g/l,胶原的终浓度0g/l-50g/l,透明质酸终浓度在0g/l-50g/l配制成水凝胶溶液,水凝胶溶液与软骨细胞混合后细胞密度在106-108/ml,通过交联剂交联制备成水凝胶膜,所述细胞密度在106-108/ml;
(4)将步骤(3)制备的水凝胶膜以生物胶与步骤(2)支架粘合成一体,即制备成多层软骨复合支架;所述生物胶包括但不限于纤维蛋白粘合剂。
上述技术方案中,进一步地,所述海藻酸钠的交联剂为二价阳离子,或者三价阳离子,其中,二价阳离子为ca2+、cu2+、fe2+、sr2+、zn2+或ba2+;三价阳离子为fe3+或ga3+。
上述技术方案中,进一步地,对步骤(1)制备的多孔镁或多孔镁合金进行钙磷涂层;所述钙磷涂层的工艺为水热反应方法,工艺参数为:反应溶液含有0.025m的kh2po4和0.025mca(no3)2,反应温度为80℃,反应时间12小时。
本发明的有益效果:本发明复合支架在体内应用时,遇到体内组织微环境的体液后,支架中的多孔镁成分将发生氧化反应产生氢气,产生的气体受表面陶瓷膜的限制无法立即扩散,在局部形成气膜,从而形成稳定的隔离层,起到隔离作用,将成骨微环境与软骨微环境隔离开来,防止下方的成骨微环境中细胞、细胞因子进入软骨微环境,从而阻止软骨骨化发生,有效保持了软骨微环境的稳定。在此基础上,在多孔镁复合陶瓷膜支架的上方再覆盖模拟软骨层的水凝胶膜,二者交联成一体,用于髋关节软骨大面积缺损的仿生构建,本发明复合支架适用于大面积软骨修复,修复面积直径大于1厘米。
附图说明
图1是本发明的实施例中复合支架的结构示意图;
图2是本发明的实施例中复合支架用于髋关节软骨缺损大动物模型的修复过程的结构示意图;
图3是本发明的实施例1中复合支架用于髋关节软骨缺损大动物模型的修复后的组织学标本染色图片;其中,a是he染色;b是甲苯胺蓝染色;c是番红o染色;d是二型胶原免疫组化染色。
具体实施方式
以下结合具体实施例对本发明作进一步说明,但不以任何方式限制本发明。
实施例1
渗流铸造法制备多孔镁支架的实施例步骤:将尺寸为700~800μm球形氯化钠晶体颗粒放入内径为50mm,高50mm的模具,将模具放入真空热处理炉在700℃下恒温烧结12h,随炉冷却得到开孔多孔氯化钠预制体;将mg-3wt.%nd-0.2wt.%zn-0.5wt.%zr合金熔液浇入放有开孔多孔氯化钠预制体的模腔,在压力为2mpa下进行压力渗流铸造;利用车床除去氯化钠-镁合金复合结构外表皮,自来水冲洗1h可得开孔多孔镁合金,进一步通过机械加工,加工成锅盖型多孔镁合金。
多孔镁支架表面钙磷涂层的实施例步骤:将上述多孔镁合金放入含有0.025m的kh2po4和0.025mca(no3)2的反应溶液中,将反应溶液放入干燥箱在80℃反应12h;在超声清洗机中利用超纯水清洗10min去除残留反应溶液,得到表面均匀覆盖钙磷涂层的多孔镁合金。
将注射型人工骨caso4(75%)/capo4(25%)(wright公司,prodense)按照产品说明配制成浆料,取约2克均匀涂布在上述支架表面,形成1mm厚的涂层,40分钟后浆料固化在多孔镁支架表面。
将上述支架环氧乙烷熏蒸灭菌,无菌保存备用。
无菌条件下将15mg/ml的海藻酸钠溶液1ml与107的p3代软骨细胞均匀混合,以20mg/mlcacl2溶液为交联剂,流延法制成内部载有软骨细胞的2mm厚,12mm直径的海藻酸钙水凝胶膜,软骨细胞培养基培养。
12月龄山羊以鹿眠宁肌肉注射,麻醉成功后,以羊右后肢的股骨大转子为中心,局部剪毛,备皮,碘伏消毒,铺无菌巾单。取右髋关节前外侧切口,逐层切开皮肤、皮下及阔筋膜,切开部分臀肌,暴露并切开关节囊,将股骨头脱位,显露股骨头,在股骨头的前外侧负重区,用电钻(钻头直径12mm)剥离羊股骨头负重区域的软骨及软骨下骨,直到松质骨,形成骨软骨缺损模型。缺损区深度为4mm。
将水凝胶膜生理盐水清洗后,无菌滤纸吸取表面水,在水凝胶膜外缘环形滴加纤维蛋白粘合生物胶,在股骨头缺损区迅速覆盖到已经固定好多孔镁/陶瓷支架的表面,与缺损区周围组织紧密粘合(如图2所示)。
待生物胶凝固后,检查水凝胶膜已牢固的粘合到股骨头缺损区域,生理盐水冲洗关节腔,复位股骨头,缝合修复关节囊,逐层缝合肌肉、阔筋膜、皮肤,关闭切口,再次消毒。
术毕肌注青霉素40万u/d,持续5d,4周后拆除外固定架。术后24周,处死实验羊,取股骨头标本,行大体观察,结果显示修复区平整,无凸出或凹陷,色泽均匀,与周围正常软骨连接良好,无间隙。接下来进行组织学评价:切取其中的缺损修补区软骨-软骨下骨标本,采用40g/l多聚甲醛固定,10%edta脱钙,蜡块包埋,5μm切片,脱蜡后进行he、甲苯胺蓝、番红o和ⅱ型胶原免疫组化染色,以观察关节骨软骨全层缺损的修复情况。图3结果显示:软骨表面光滑,软骨细胞呈圆形或椭圆形,包被在软骨陷窝内,且呈柱形定向排列,垂直于软骨表面,并且呈现明显的二型胶原表达。
实施例2
3d打印法制备多孔镁支架的实施例步骤:3d打印工艺参数为:镁粉为球形粉末,粒径为15~45μm,铺粉厚度为30μm,激光功率为80w,曝光时间20μs,激光扫描点间距30μm,线间距30μm,打印过程在氩气保护下进行。
多孔镁支架表面钙磷涂层的实施例步骤:将上述制备的多孔镁合金放入含有0.025m的kh2po4和0.025mca(no3)2的反应溶液中,将反应溶液放入干燥箱在80℃反应12h;在超声清洗机中利用超纯水清洗10min去除残留反应溶液,得到表面均匀覆盖钙磷涂层的多孔镁合金。
将纳米羟基磷灰石粉配制成浆料,取约2.5克均匀涂布在上述制备的支架上表面,形成1mm厚的涂层,高温炉烧结固化。
将上述支架环氧乙烷熏蒸灭菌,无菌保存备用。
无菌条件下将终浓度为40mg/ml的海藻酸钠与5mg/ml胶原的混合溶液1ml在4度条件下与107的p3代软骨细胞均匀混合,以30mg/mlcacl2溶液为交联剂,流延法制成内部载有软骨细胞的2mm厚,12mm直径的海藻酸钙水凝胶膜,同时经过37度2小时实现混合液中胶原凝胶化,制备成海藻酸钙与胶原互穿网络的水凝胶,并在二氧化碳培养箱中用软骨细胞培养基培养。
12月龄山羊以鹿眠宁肌肉注射,麻醉成功后,以羊右后肢的股骨大转子为中心,局部剪毛,备皮,碘伏消毒,铺无菌巾单。取右髋关节前外侧切口,逐层切开皮肤、皮下及阔筋膜,切开部分臀肌,暴露并切开关节囊,将股骨头脱位,显露股骨头,在股骨头的前外侧负重区,用电钻(钻头直径12mm)剥离羊股骨头负重区域的软骨及软骨下骨,直到松质骨,形成骨软骨缺损模型。缺损区深度为4mm。
将107的p3代骨髓间充质干细胞滴加到步骤[4]制备的载有多孔镁/陶瓷支架内部,并将其扣在股骨头缺损区深部。
将水凝胶膜生理盐水清洗后,无菌滤纸吸取表面水,在水凝胶膜外缘环形滴加纤维蛋白粘合生物胶,在股骨头缺损区迅速覆盖到已经固定好多孔镁/陶瓷支架的表面,与缺损区周围组织紧密粘合(如图2所示)。
待生物胶凝固后,检查水凝胶膜已牢固的粘合到股骨头缺损区域,生理盐水冲洗关节腔,复位股骨头,缝合修复关节囊,逐层缝合肌肉、阔筋膜、皮肤,关闭切口,再次消毒。
术毕肌注青霉素40万u/d,持续5d,4周后拆除外固定架。术后24周,处死实验羊,取股骨头标本,行大体观察,结果显示修复区平整,无凸出或凹陷,色泽均匀,与周围正常软骨连接良好,无间隙。接下来进行组织学评价:切取其中的缺损修补区软骨-软骨下骨标本,采用40g/l多聚甲醛固定,10%edta脱钙,蜡块包埋,5μm切片,脱蜡后进行he、甲苯胺蓝、番红o和ⅱ型胶原免疫组化染色,以观察关节骨软骨全层缺损的修复情况。结果显示:软骨表面光滑,软骨细胞呈圆形或椭圆形,包被在软骨陷窝内,且呈柱形定向排列,垂直于软骨表面,并且呈现明显的二型胶原表达。
实施例3
渗流铸造法制备多孔镁支架的实施例步骤:将尺寸为700~800μm球形氯化钠晶体颗粒放入内径为50mm,高50mm的模具,将模具放入真空热处理炉在700℃下恒温烧结12h,随炉冷却得到开孔多孔氯化钠预制体;将mg-3wt.%nd-0.2wt.%zn-0.5wt.%zr合金熔液浇入放有开孔多孔氯化钠预制体的模腔,在压力为2mpa下进行压力渗流铸造;利用车床除去氯化钠-镁合金复合结构外表皮,自来水冲洗1h可得开孔多孔镁合金,进一步通过机械加工,加工成锅盖型多孔镁合金。
多孔镁支架表面钙磷涂层的实施例步骤:将上述制备的多孔镁合金放入含有0.025m的kh2po4和0.025mca(no3)2的反应溶液中,将反应溶液放入干燥箱在80℃反应12h;在超声清洗机中利用超纯水清洗10min去除残留反应溶液,得到表面均匀覆盖钙磷涂层的多孔镁合金。
将注射型人工骨caso4(75%)/capo4(25%)(wright公司,prodense)按照产品说明配制成浆料,取约3克均匀涂布在上述制备的支架上下表面,形成各1mm厚的涂层,将支架包裹其中,40分钟后浆料固化在多孔镁支架表面。
将上述制备的支架环氧乙烷熏蒸灭菌,无菌保存备用。
无菌条件下将终浓度为10mg/ml的海藻酸钠、8mg/ml明胶与/5mg/ml透明质酸的混合溶液1ml加热到60度,待混合液澄清透明后降温到38度与107的p3代软骨细胞均匀混合后,继续降至室温,再以10mg/mlcacl2溶液为交联剂,流延法制成内部载有软骨细胞的2mm厚,12mm直径的海藻酸钙-明胶-透明质酸互穿网络的水凝胶膜,并在二氧化碳培养箱中用软骨细胞培养基培养。
12月龄山羊以鹿眠宁肌肉注射,麻醉成功后,以羊右后肢的股骨大转子为中心,局部剪毛,备皮,碘伏消毒,铺无菌巾单。取右髋关节前外侧切口,逐层切开皮肤、皮下及阔筋膜,切开部分臀肌,暴露并切开关节囊,将股骨头脱位,显露股骨头,在股骨头的前外侧负重区,用电钻(钻头直径12mm)剥离羊股骨头负重区域的软骨及软骨下骨,直到松质骨,形成骨软骨缺损模型。缺损区深度为4mm。
将107的p3代骨髓间充质干细胞滴加到上述制备的载有多孔镁/陶瓷支架内部,并将其扣在股骨头缺损区深部。
将制备的水凝胶膜生理盐水清洗后,无菌滤纸吸取表面水,在水凝胶膜外缘环形滴加纤维蛋白粘合生物胶,在股骨头缺损区迅速覆盖到已经固定好多孔镁/陶瓷支架的表面,与缺损区周围组织紧密粘合(如图2所示)。
待生物胶凝固后,检查水凝胶膜已牢固的粘合到股骨头缺损区域,生理盐水冲洗关节腔,复位股骨头,缝合修复关节囊,逐层缝合肌肉、阔筋膜、皮肤,关闭切口,再次消毒。
术毕肌注青霉素40万u/d,持续5d,4周后拆除外固定架。术后24周,处死实验羊,取股骨头标本,行大体观察,结果显示修复区平整,无凸出或凹陷,色泽均匀,与周围正常软骨连接良好,无间隙。接下来进行组织学评价:切取其中的缺损修补区软骨-软骨下骨标本,采用40g/l多聚甲醛固定,10%edta脱钙,蜡块包埋,5μm切片,脱蜡后进行he、甲苯胺蓝、番红o和ⅱ型胶原免疫组化染色,以观察关节骨软骨全层缺损的修复情况。结果显示:软骨表面光滑,软骨细胞呈圆形或椭圆形,包被在软骨陷窝内,且呈柱形定向排列,垂直于软骨表面,并且呈现明显的二型胶原表达。
对于任何熟悉本领域的技术人员而言,在不脱离本发明技术方案范围情况下,都可利用上述揭示的技术内容对本发明技术方案作出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均应仍属于本发明技术方案保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!