一种具有免疫调节和抗肿瘤作用的药物的制作方法
本发明属于医药治疗领域,特指一种具有免疫调节和抗肿瘤作用的药物,具体涉及小分子药物阿尼芬净及其在制备对pd-l1抑制、实现免疫抗肿瘤作用药物中的用途。
背景技术:
肿瘤的发生发展伴随着肿瘤的免疫逃逸,肿瘤细胞可通过调整自身和微环境状态来抑制免疫细胞的活性,抑制了机体的正常免疫状态,最终逃避机体的免疫监视,营造出有利于肿瘤生长的环境,从而大量繁殖危害生命。传统的“手术+放疗+化疗”手段应答率低,靶向性差,具有严重的不良反应。近年来,肿瘤免疫治疗成为近年肿瘤治疗领域的研究热点,主要通过增强免疫原性和抑制免疫检查点两个方面,包括肿瘤疫苗,car-t疗法和免疫检查点抑制剂等。其中,与肿瘤疫苗和细胞疗法不同,免疫检查点抑制剂是通过阻断肿瘤免疫检查点激发肿瘤特异性t细胞功能,从而改善抗肿瘤免疫达到抗肿瘤效果。
程序性死亡受体1(programmeddeath1,pd-1,cd279)及其配体(programmeddeath1ligand,pd-l1,cd274)是目前研究最为广泛的免疫检查点,pd-1表达于t细胞表面,当机体被肿瘤入侵时,肿瘤表面会高表达pd-l1,这时处于肿瘤微环境中的t细胞上的pd-1会肿瘤表面的pd-l1结合,从而抑制t细胞的活化,下调ifn-γ,il-4等免疫相关因子的表达,从而造成肿瘤的免疫逃逸。目前已有大量针对此免疫检查点研究获得的单克隆抗体出现。2016年,第一个靶向免疫检查点pd-1的单克隆抗体抑制剂pembrolizumab上市用于晚期黑色素瘤和非小细胞肺癌的治疗。随后,针对pd-1/pd-l1的单克隆抗体包括nivolumab,atezolizumab,avelumab以及durvalumab相继上市,对肾细胞癌、尿路上皮癌以及非小细胞肺癌具有显著治疗效果。然而,目前上市的免疫检查点抑制剂都为单克隆抗体,虽然能够很好地靶向到肿瘤细胞表面,却存在半衰期长、口服生物利用度低、储存运输困难以及生产成本较高等缺点,而且因其特异性强,往往在治疗后期会激活其它免疫检查点导致单药有效率低。因此,开发结构多样性的小分子化合物代替大分子抗体有望解决上述问题,具有重要实际意义。
阿尼芬净(anidulafungin),是一种棘白菌素类抗真菌药,其结构如下:
阿尼芬净能抑制真菌中葡聚糖合成酶,从而抑制真菌中的主要成分1,3,β-d葡聚糖的合成,对念珠菌、曲霉菌有抗菌活性,对器官移植后长期使用免疫抑制剂所诱发的真菌感染具有显著效果,其在血浆中缓慢降解,最后经胆汁由粪便排泄,对肝脏肾脏影响极小。但目前未有阿尼芬净可以抑制pd-l1,具有免疫抗肿瘤作用的报道。
本发明提供了阿尼芬净的新用途,通过结合抑制pd-l1,实现免疫抗肿瘤作用。
技术实现要素:
本发明提供了一种具有免疫抗肿瘤作用的药物,该药物为fda批准上市的抗真菌药物阿尼芬净。
本发明还提供了阿尼芬净作为pd-l1小分子抑制剂,激活免疫以及抗肿瘤相关的活性,该化合物与免疫检查点pd-l1蛋白具有体外结合能力,其结合亲和力kd=7.69×10-5m。该化合物对人肺腺癌细胞a549以及小鼠肺癌细胞llc均具有一定的抑制作用,其ic50分别为170.6μg/ml和160.9μg/ml。并且该化合物对于llc-荷瘤小鼠具有一定的体内抗肿瘤作用,且毒作用较小,当阿尼芬净浓度为25mg/kg和50mg/kg时,荷瘤小鼠体内的肿瘤体积和重量均显著小于空白组(p<0.01)。此外,阿尼芬净可作为潜在pd-l1抑制剂激活免疫系统产生抗肿瘤作用,当浓度为5mg/kg和25mg/kg时,荷瘤小鼠体内的ifnγ浓度显著高于空白组和对照组(p<0.01)。本发明提供的小分子药物阿尼芬净能在体内和体外产生良好的抗肿瘤效果,并且具有结合pd-l1产生抑制作用从而激活免疫抗肿瘤通路的潜在功能。
附图说明
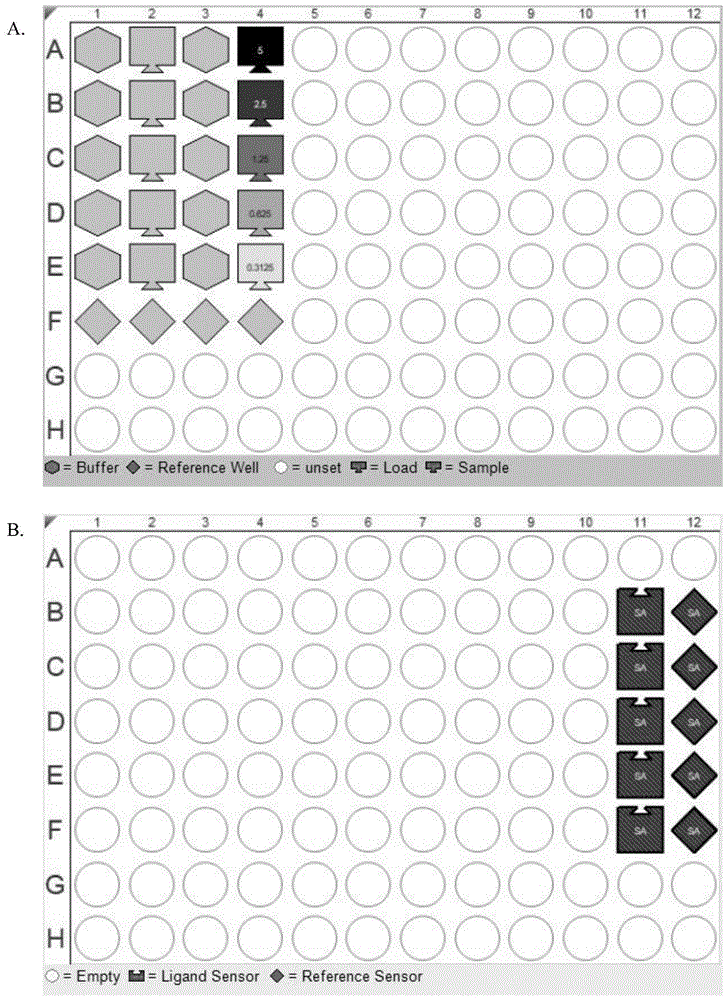
图1为配制好的样品溶液和蛋白溶液加料顺序示意图。图a和图b分别代表了同一个96孔板上的溶液加料和传感器的位置顺序。
图2为pd-l1与阿尼芬净的体外相互作用动力学过程图。曲线前半段为小分子与pd-l1的体外结合阶段,后半段为解离阶段,图中曲线从上到下依次是阿尼芬净浓度2.5、1.25、0.625、0.3125μm时与pd-l1蛋白结合-解离的动态过程。
图3为阿尼芬净对人肺腺癌细胞a549的体外抑制效果图。其中,阿尼芬净的浓度依次为5、25、50、100、200μg/ml,经计算得ic50为170.6μg/ml。
图4为阿尼芬净对小鼠肺癌细胞llc的体外抑制效果图。其中,阿尼芬净的浓度依次为5、25、50、100、200μg/ml,经计算得ic50为160.9μg/ml。
图5为阿尼芬净对llc-荷瘤小鼠的体内肿瘤抑制效果图。以空白对照为参考,对各给药组的小鼠肿瘤体积进行统计学分析,考察阿尼芬净与对照药物的体内抑瘤效果差异。“***”表示给药组与空白对照组相比具有显著性差异(p<0.05)。
图6为阿尼芬净对llc-荷瘤小鼠的体重影响图。以空白对照为参考,对各给药组的小鼠体重进行统计学分析,考察阿尼芬净与对照药物对小鼠体重的影响差异。“***”表示给药组与空白对照组相比具有显著性差异(p<0.05)。
图7为阿尼芬净对llc-荷瘤小鼠的血液ifnγ表达的影响图。以空白对照为参考,对各给药组的小鼠血液ifnγ表达量进行统计学分析,考察阿尼芬净与对照药物对免疫因子ifnγ表达的影响差异。“***”表示阿尼芬净组与阳性对照组的ifnγ表达与空白对照组相比具有显著性差异(p<0.05)。
具体实施方式
以下结合附图,通过具体的实施例对本发明作进一步描述,这些实施例仅用于说明本发明,并不是对本发明保护范围的限制。
本发明首先在体外用生物膜干涉分子间相互作用分析系统(fortebiooctetred96e)分析了体外阿尼芬净与pd-l1的相互作用。接下来用阿尼芬净分别处理人肺腺癌细胞a549以及小鼠肺癌细胞llc,之后构建了体内llc-荷瘤小鼠模型,用阿尼芬净、阳性对照药物durvalumab以及阴性对照5-fu分别处理,并采用elisa试剂盒对小鼠血浆中的ifnγ表达进行了测定。
实施例1阿尼芬净与pd-l1体外结合实验
为了测定阿尼芬净与pd-l1的体外结合,本发明采用fortebiooctetred96e系统,该系统运用生物膜层反射光干涉(bio-layerinterferometry,bli)原理,即生物分子结合在传感器表面形成一层生物膜,生物膜对透过传感器的光波造成干涉现象,干涉现象以相位移动的方式被检测,从而可以实时监测传感器上生物分子的变化。基于此原理,本发明的实验步骤如下:
(1)实验材料
生物素(d-biotin)化后的人源pd-l/b7-h1/cd2741蛋白冻干粉(histag)购自北京神州义翘生物科技有限公司,化合物阿尼芬净购自天津狄克特科技有限公司,黑色96孔板,蛋白分子相互作用仪以及sa传感器均由fortebio公司提供。
(2)溶液配制
分析物缓冲液:1%dmso的1×pbs缓冲液(包含0.1%bsa和0.02%tween20)
蛋白缓冲液:1×pbs缓冲液(包含0.1%bsa和0.02%tween20)
化合物(分析物):阿尼芬净溶解于dmso中配制成浓度为500μm的母液,再用pbs缓冲液(0.1%bsa和0.02%tween20)稀释成5、2.5、1.25、0.625、0.3125μm。
蛋白:蛋白缓冲液溶解pd-l1冻干粉,配制成10μg/ml的pd-l1蛋白溶液
(3)实验方法与结果
开机后将传感器在蛋白缓冲液中预湿15min,将配制好的样品溶液和蛋白溶液按如图1顺序加入96孔板中,每孔200μl,采用双扣除法排除传感器和96孔板对实验结果的影响,其中a1-e1、a2-e2、a3-e3、a4-e4分别为蛋白缓冲液、蛋白溶液、分析物缓冲液、分析物(从上到下浓度递减);f1-f4为空白对照;设置检测传感器在a11-f11的上方,空白传感器在a12-e12的上方。
接下来按照如下表1进行pd-l1蛋白与阿尼芬净的相互作用检测:
表1pd-l1蛋白与阿尼芬净相互作用实验程序
经软件分析,得到如下结果,阿尼芬净在实验浓度范围内与pd-l1存在梯度结合与解离,且存在线性关系(图2),阿尼芬净与pd-l1的结合亲和力为7.69×10-5m(表2),且pd-l1与小分子化合物阿尼芬净的结合呈现快结合与快解离的结合模式(表2,kon1/(ms),4.08×102;koff1/s,3.14×10-2),表明阿尼芬净与pd-l1具有一定的结合能力,提示阿尼芬净可能会阻断肿瘤中的pd-l1与t细胞pd-1的结合,从而激活免疫达到抑制肿瘤的效果。
表2.阿尼芬净与pd-l1蛋白结合的动力学分析
实施例2阿尼芬净体外抑制人肺腺癌细胞(a549)及小鼠肺癌细胞(llc)的增殖实验
为了初步检测阿尼芬净的体外抗肿瘤活性,本发明使用人肺腺癌细胞a549以及小鼠肺癌细胞llc作为细胞模型对其进行考察,其方法与结果如下:
细胞收集:人肺腺癌细胞株(a549)和小鼠肺癌细胞(llc)(中科院上海细胞库)用完全培养基(含有10%体积胎牛血清和1%体积青霉素-链霉素双抗的dmem培养基)接种于25t的培养瓶中,在37℃,5%co2条件下培养48小时后,显微镜观察细胞生长状态,待细胞密度达到大约80%-90%时从培养箱取出;用移液枪吸出培养基,加入1ml预热至室温的胰酶消化液,37℃孵箱消化5分钟;加入5ml预热至37℃的完全培养基终止消化,吹打使细胞脱落形成细胞悬液;将细胞悬液转入15ml离心管中,1000rpm转速离心5min后吸出上清,加入10ml完全培养基重悬细胞。
细胞接种:取96孔板一块,将两种细胞接种于板中,每种细胞50个孔,每孔100μl,边缘不接种,之后将96孔板放回37℃培养箱中继续培养24h使细胞贴壁。
加药处理:用二甲基亚砜(dmso)配制100mg/ml的阿尼芬净母液,再用完全培养基(含有10%体积胎牛血清和1%体积青链双抗的dmem培养基)按比例稀释成5、25、50、100、200μg/ml的阿尼芬净溶液待用;吸出每孔中原有培养基,按照浓度梯度依次加入稀释后的阿尼芬净溶液,每孔100μl,每个浓度设置3个复孔。其余每孔加入100μl新的完全培养基作为空白对照,之后将96孔板放进培养箱培养48h。
细胞增殖活性检测:用完全培养基稀释细胞活性检测试剂cck-8(cellcountingkit-8),配制成5%-10%体积分数的cck-8待用,吸出每孔中原有的培养基,之后向各孔加入100μl稀释后的cck-8,充分振摇孔板后放回37℃孵箱继续培养2h;
用酶标仪在450nm波长处读取各孔od值,计算阿尼芬净的对a549和llc的ic50。
结果显示,阿尼芬净对于a549以及llc均显示一定的抗肿瘤作用,且ic50分别为170.6μg/ml和160.9μg/ml(图3,图4)。
实施例3阿尼芬净对llc-荷瘤小鼠的免疫激活与体内抑制肿瘤作用
使用llc在雄性c57bl/6小鼠中建立了小鼠肺癌模型(llc-荷瘤小鼠模型)来考察阿尼芬净的体内抗肿瘤与免疫激活作用,其方法与结果如下:
材料与分组:选取5-6周(体重16-18g)的雄性c57bl/6小鼠36只(江苏大学动物中心),分为六组进行实验分别为阿尼芬净高浓度组(a-1,50mg/kg)、阿尼芬净中浓度组(a-2,25mg/kg)、阿尼芬净低浓度组(a-3,5mg/kg)、阳性对照durvalumab(上海蓝木化工有限公司)组(0.5mg/kg)、阴性对照5-fu(25mg/kg)组、空白对照组、正常组。
llc-荷瘤小鼠模型构建:培养llc细胞,并用1×pbs收集8ml浓度为5×106个/ml的llc细胞,按照0.2ml/只的体积皮下接种于c57bl/6小鼠的左侧腋下,大约8天在小鼠胸部或者肺部位置出现凸起,即造模成功。
给药处理:待肿瘤生长到体积大概1cm3时,各组开始给药,2d/次,一共给药10天,每天记录小鼠体重并测量各组肿瘤体积。
摘眼球取血:给药停止2天之后,摘取小鼠眼球取血备用。
处死解剖:测量肿瘤体积,之后处死小鼠,取出肿瘤,称重。结果表明各实验组肿瘤体积与空白对照相比均有显著差异(p<0.05),表明阿尼芬净具有减缓肿瘤生长速度的作用,当浓度为50mg/kg时,可观察到肿瘤体积有减小趋势(图5)。另外,阿尼芬净组的小鼠体重并未出现下降趋势,而5-fu组的小鼠体重有明显下降(图6),表明阿尼芬净较5-fu毒性小,对小鼠体重不造成显著影响,相对安全。
elisa测定血清中免疫因子ifnγ的表达:摘取小鼠眼球取血之后4℃放置过夜,待分层之后放入高速离心机,5000r离心20min,取上清,用elisa试剂盒检测每组血清中ifnγ的表达情况,按照标准曲线计算每组ifnγ的浓度,阿尼芬净在低浓度(5mg/kg)与中浓度(25mg/kg)时的ifnγ浓度显著高于空白组和正常组,并且与一般的抗肿瘤化疗药物5-fu相比,也具有显著差异(图7),结合阿尼芬净与pd-l1的体外相互作用数据(图2,表2),表明阿尼芬净具有抑制pd-l1从而激活荷瘤小鼠免疫系统达到抗肿瘤作用的功能。
- 还没有人留言评论。精彩留言会获得点赞!