一种应用于植入医疗器械的医用涂层及其制备方法与流程
本发明涉及一种医用涂层,具体是一种应用于植入医疗器械的医用涂层及其制备方法。
背景技术:
随着我国整体经济发展水平的提高、医疗健康需求的增加以及国家政策的指引,国内植入性医疗器械市场规模持续扩大,展现出巨大的发展潜力。根据《医疗器械分类规则》的定义,植入医疗器械是指:任何借助外科手术,器械全部或者部分进入人体或自然腔道中;在手术过程结束后长期留在体内,或者这些器械部分留在体内至少30天以上,这些器械被认为是植入器械。例如:冠脉血管支架、外周血管支架、前列腺支架,骨钉骨板、人工关节、封堵器、心脏起搏器等。植入医疗器械属于第三类较高风险的高端产品,是医疗器械产业中重要的产品门类。
一款植入医疗器械产品临床应用是否安全有效的最本质的关键因素是生物医用材料的选择。生物医用材料是指:用来对生物体进行诊断、治疗、修复或替换其病损组织、器官或增进其功能的材料。生物医用材料按材料的组成和性质可以分为:生物医用金属材料、生物陶瓷、生物医用高分子材料、生物医用复合材料、生物衍生材料等。为了方便医生诊断和治疗,外科植入性医疗器械通常会被要求设计有具备x光机可识别的显影标记物,但标记物显影标记物容易产生脱落,会增加冠脉远端毛细血管的异物堵塞临床风险。
常用的植入医疗器械的生物医用材料是金属或合金,这类材料具有高的机械强度和抗疲劳性能,是临床应用最广泛的承力植入材料。目前,已经用于临床的医用金属材料主要有纯金属钛、不锈钢、镍钛记忆合金、钴基合金和钛基合金等。其中,大部分植入医用金属材料中都含有不同比例的镍、钴、铬、钒、铝等致敏致癌元素。
研究表明,金属材料本体不会导致人体发生变态反应和致癌性,但是金属离子及其形成的有机金属化合物和无机金属盐可能对人体造成生物毒性,其中金属离子释放主要是由于腐蚀和磨损腐蚀造成。金属离子对人体的有害反应主要是有毒性、致癌性、基因毒性和致敏性。生物医用金属材料在体液中发生多种类型的腐蚀,如缝隙腐蚀、疲劳腐蚀、微动磨损腐蚀、均匀腐蚀、点腐蚀、电偶腐蚀、晶间腐蚀和应力腐蚀。医用金属材料中合金元素产生金属离子多具有强负电性,易与人体体液内的有机物或无机物结合形成复杂的有机或无机化合物,其中的一些化合具有强的毒性,所以一般要求,金属离子在人体内允许浓度非常低。金属离子进入体液后会引发许多生物反应,如血液反应和组织反应等。由于人体血液中血小板、血细胞和蛋白质等带负电性,因此大量负电性金属离子的溶出易引发血栓症状。金属离子在人体部分组织或体液内的富集会加重其毒性反应。通常ni镍离子易富集于血液、滑液和关节囊中,al、v、cr和co在尿液、血液、滑液和关节囊内的浓度都会增加。在人体组织肺内cr、al和v离子浓度易与增加,在肾、心脏、肝脏和脾脏内co和al易与聚集。
在人体内的金属盐细胞毒性的强弱按照co﹥v﹥ni﹥cr﹥ti﹥fe的顺序降低,体外实验结果表面co、ni、cr还有致敏反应和致癌倾向。al和v都是常用医用钛合金ti6al4v中的有害元素。在生物体内长期植入ti6al4v合金会释放出al离子和v离子,对人体产生毒害。al元素会引起骨软化、贫血和神经紊乱。铝元素与无机磷结合,会致使磷缺失,会诱发老年痴呆症等。钒元素在人体内易与形成钒酸盐(vo33-,v5+)和钒氧阳离子(vo32+,v4+),他们进入细胞后被还原物质还原,并同磷酸盐、蛋白质、乳酸和柠檬酸等配位体结合。钒酸盐和钒阳离子在人体内积累于肝肾、骨、脾等器官,其毒性作用与磷酸盐的代谢有关,通过影响钾、钠、氢和钙离子的atp酶发生作用,其毒性可能超过铬和镍,引起致癌。
镍元素ni是医用镍钛记忆合金材料的主要成分之一,超量的ni离子具有细胞毒性,会导致局部组织刺激或组织坏死,甚至会导致呼吸功能障碍和过敏反应,ni离子也会抑制细胞增殖,存在潜在的致癌性。研究表明,在人体内二价镍离子进入细胞后,与细胞质的配合基结合,不会在细胞核内聚集,因此不会引起癌变,但是镍的化合物可能致癌。
临床数据表明,植入医疗器械均会产生不同程度的感染。如人工关节的平均感染率为8%,其中二次翻修的感染率高达大于50%;创伤骨科的平均感染为5%,其中开放性骨折感染率高到35%;颅骨修复板所用的聚醚醚酮材料,修复后的感染率为13.83%;因此,在植入体的表面增加抗菌涂层进行表面修饰,具有重要的临床应用价值。
技术实现要素:
为了解决上述问题,本发明提供了一种具备复合功能,应用于金属植入医疗器械的医用涂层及其制备方法。该医用涂层主要利用了金属元素钽(ta)优良的“生物”惰性,利用了金属元素银(ag)优良的广谱杀菌效果,利用了金属元素锌(zn)优良的促进愈合的作用,利用了金属元素钇(y)优良的合金调剂作用;利用金属元素镁(mg)促进成骨细胞合成酶的生成作用;集中了各个元素的特有属性,利用pvd技术加工成型了一种复合功能合金涂层。
本发明提供了一种应用于植入医疗器械的医用涂层,包括钛-钇涂层、氮化钛-钇的合金层、钽-钇涂层、钽-锌-银涂层,所述钛-钇涂层涂覆在所述植入医疗器械基材的外层,所述氮化钛-钇的合金层涂覆在钛-钇涂层的外层,所述钽-钇涂层涂覆在氮化钛-钇的合金层的外层;所述钽-锌-银涂层涂覆在钽-钇涂层的外层。
本发明的另一种实施方式,所述钽-锌-银涂层替换为钽-镁-银涂层。
优选地,所述钛-钇涂层厚度为100nm-1500nm,所述钛-钇涂层中钛、钇的质量百分数分别为90%、10%。
优选地,所述氮化钛-钇的合金层厚度为50nm-1500nm。
优选地,所述钽-钇涂层厚度为50nm-500nm,所述钽-钇涂层中钽、钇的质量百分数分别为93%、7%。
优选地,所述钽-锌-银涂层厚度为50nm-1000nm,所述钽-锌-银涂层中钽、锌、银的质量百分数分别为92%、5%、3%。
优选地,所述钽-镁-银涂层厚度为50nm-1000nm,所述钽-镁-银涂层中钽、镁、银的质量百分数分别为92%、5%、3%。
本发明还提供了一种具备复合功能应用于植入医疗器械的医用涂层的制备方法,按照如下步骤进行:
(1)针对植入医疗器械的材料学应用的五类共性问题,进行靶向设计:
a.有害金属离子释放;
b.生物相容性差;
c.感染、炎症、血栓;
d.x光机透视显影性;
e.耐腐蚀性;
f.机械疲劳寿命;
g.难愈合
(2)针对(1)的上述问题,主要利用pvd物理气相沉积技术,将钽、银、锌、镁、钇等亲生物属性的元素沉积于植入医疗器械表面,从而达到临床使用目的。
所述钛-钇涂层用99.999%的钛和钇高纯靶材进行真空溅射,形成厚度为100nm-1500nm的钛-钇金属薄膜涂层;所述钛-钇涂层中钛、钇的质量百分数分别为90%、10%;
所述氮化钛-钇的合金层用99.999%的钛和钇的高纯靶材进行真空溅射,在其沉积过程中混入高纯氮气,形成厚度为50nm-500nm的氮化钛-钇金属薄膜;
所述钽-钇涂层用99.999%的钽和钇的高纯靶材,进行真空溅射,形成厚度为50nm-500nm的钽-钇金属薄膜,所述钽-钇涂层中钽、钇的质量百分数分别为93%、7%。
所述钽-锌-银涂层用99.999%的钽、锌和银的高纯靶材,进行真空溅射,形成厚度为50nm-1000nm的钽-锌-银金属薄膜,所述钽-锌-银涂层中钽、锌、银的质量百分数分别为92%、5%、3%。
上述钽-锌-银涂层可以变换为钽-镁-银涂层,钽-镁-银涂层用99.999%的钽、镁和银的高纯靶材,进行真空溅射,形成厚度为50nm-1000nm的钽-镁-银金属薄膜,所述钽-镁-银涂层中钽、镁、银的质量百分数分别为92%、5%、3%。
本发明的有益效果:
1.利用传统行业的pvd技术,把具备亲生物属性的钽、银、锌、钇等无害金属进行了医用涂层设计,从而有效的解决了原有金属植入物面临的材料学难题,包括有害金属离子释放、生物相容性差、炎症和血栓、难愈合、x光机透视显影效果差等。
2.利用该技术形成纳米级别的金属薄膜,再保证改善原有金属植入物表面生物改性的前提下,最大程度的节约了材料使用成本,高效环保。
3.提供一种具备复合功能,应用于金属植入医疗器械的医用涂层制备方法。该医用涂层的主要功能有:对于生物医用金属材料的有害金属离子进行包埋、耐腐蚀电位提高、血液和组织生物相容性提高;抗菌、抗炎症,创伤愈合能力提高,疲劳强度提高,增强显影性能,屏蔽金属植入物的电磁性实现ct诊断;对生物医用高分子材料,可实现表面亲生物改性,增加x光机透视显影功能。
4.利用该工艺技术制备的金属膜层,有效的解决了异种金属结合力不好的问题,膜层和基材有很好的塑性变形能力,使得膜层坚固耐用,符合人体复杂力学环境的应用需求。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
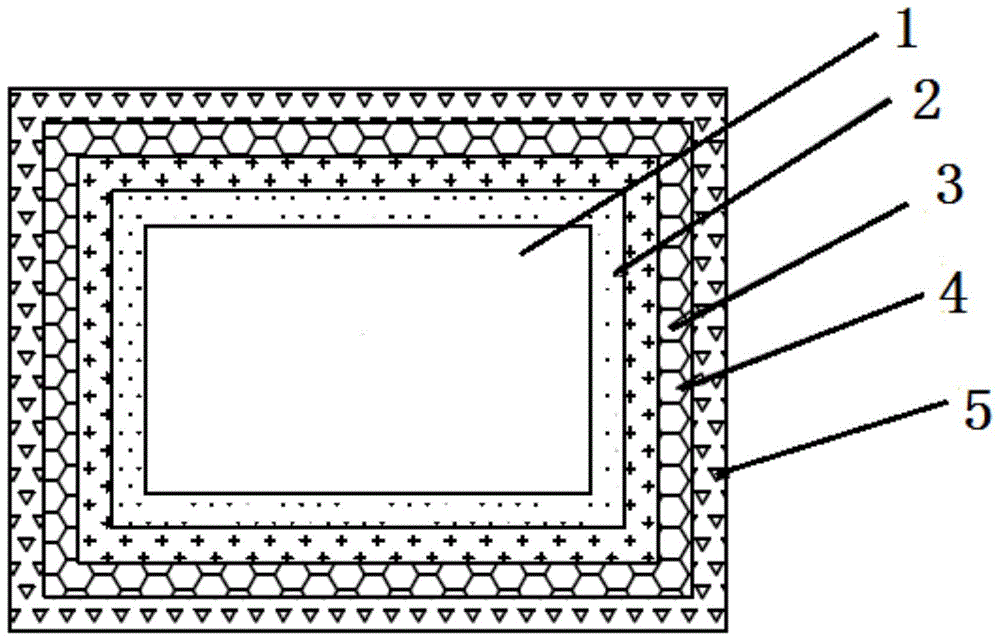
图1为本发明应用于植入医疗器械的医用涂层结构示意图;
图2为未含钇的医用涂层的sem电镜图;其中(a)为涂层分层、不连续的电镜图;(b)为涂层破裂的电镜图;
图3为本发明含钇的医用涂层的sem电镜图;
图4为本发明医用涂层的sem电镜形貌检测结果图;其中(a)(b)(c)(d)为不同放大情况下的电镜形貌检测结果图;
图5为本发明医用涂层的sem电镜厚度检测结果图;
图6为本发明医用涂层能谱检测结果图;
图7为涂覆有本发明医用涂层的镍钛记忆合金外周支架图;
图8为涂覆有本发明医用涂层的镍钛记忆合金脑血管支架图;
图9为涂覆有本发明医用涂层的316不锈钢心血管支架图;
图10为涂覆有本发明医用涂层的镍钛合金丝编制支架图;
图11为涂覆有本发明医用涂层的导丝芯轴图;
图12为涂覆有本发明医用涂层的钛合金骨钉骨板图;
图13为涂覆有本发明医用涂层的钛合金骨板图;
图14为涂覆有本发明医用涂层的镍钛记忆合金骨环抱器图。
图中:1、基材,2、钛-钇涂层,3、氮化钛-钇的合金层,4、钽-钇涂层,5、钽-锌-银涂层。
具体实施方式
为使得本发明的发明目的、特征、优点能够更加的明显和易懂,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本发明一部分实施例,而非全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。
请参阅图1所示,在本发明的一个实施例中,在基材1上依次包括钛-钇涂层2、氮化钛-钇的合金层3、钽-钇涂层4、钽-锌-银涂层5,所述钛-钇涂层2涂覆在所述基材1的外层,所述氮化钛-钇的合金层3涂覆在钛-钇涂层2的外层,所述钽-钇涂层4涂覆在氮化钛-钇的合金层3的外层;所述钽-锌-银涂层5涂覆在钽-钇涂层4的外层。
所述钛-钇涂层2的厚度为100nm-1500nm,所述钛-钇涂层2中钛、钇的质量百分数分别为90%、10%。所述氮化钛-钇的合金层3厚度为50nm-1500nm。所述钽-钇涂层4的厚度为50nm-500nm,所述钽-钇涂层4中钽、钇的质量百分数分别为93%、7%。所述钽-锌-银涂层5厚度为50nm-1000nm,所述钽-锌-银涂层5中钽、锌、银的质量百分数分别为92%、5%、3%。
在本发明的另一个实施例中,将上述实施例中的钽-锌-银涂层5替换为钽-镁-银涂层,所述钽-镁-银涂层厚度为50nm-1000nm,所述钽-镁-银涂层中钽、镁、银的质量百分数分别为92%、5%、3%。
利用pvd物理气相沉积技术将元素沉积于基材表面,pvd物理气相沉积设备参数设置如表1所示。
表1
本发明通过对现有金属植入医疗器械的有害元素进行剖析,从而靶向设计出对应功能的保护涂层。利用pvd设备制备钛-钇金属薄膜,涂层厚度为100nm-1500nm,消除了基材和涂层沉积过程中的残余应力,使得涂层有很好的塑性变形能力,从而使得涂层和基材结合力增大,膜层牢固可靠、不脱落。利用pvd设备制备氮化钛-钇金属薄膜,涂层厚度为50nm-1500nm,涂层的静态剪切强度大于40mp,静态拉伸强度大于40mp,涂层牢固度,参照gb9286-1998进行测试小于1级。利用pvd设备制备钽-钇涂层金属薄膜,涂层厚度为50nm-1500nm,涂层成分比例为:钽:钇=93%:7%,涂层的机械性能按照yy/t0988.11和yy/t0988.12的方法测试,静态剪切强度大于40mp,静态拉伸强度大于40mp,涂层牢固度按照gb9286-1998进行测试小于1级。利用pvd设备制备钽-锌-银金属薄膜,涂层厚度为50nm-1000nm,涂层成分比例为:钽:锌:银=92%:5%:3%,涂层抗菌性能按照gb/t21510-2008附录c进行试验,试验菌种采用金黄色葡萄球菌和大肠杆菌的方法测试抗菌率≥99%;涂层的机械性能按照yy/t0988.11和yy/t0988.12的方法测试,静态剪切强度大于40mp,静态拉伸强度大于40mp,涂层牢固度按照gb9286-1998的方法测试小于1级。
如果本发明的医用涂层不添加金属钇,涂层如图2-3所示,会出现分层、不连续甚至破裂的现象。添加金属钇后如图4所示,涂层连续,均质,牢固。可见添加金属钇使涂层连续,均质且牢固。本发明医用涂层的sem电镜厚度检测结果图如图5所示;本发明医用涂层能谱检测结果图如图6所示。
本发明可以应用于如图7-14所示的植入器械的涂层,分别为镍钛记忆合金外周支架、镍钛记忆合金脑血管支架、316不锈钢心血管支架、镍钛合金丝编制支架、导丝芯轴、钛合金骨钉骨板、钛合金骨板、镍钛记忆合金骨环抱器。
以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!