一种难溶性药物口服缓释组合物及其制备方法与流程
本发明属于医药领域,具体涉及一种口服缓释组合物,特别是一种低剂量难溶性药物口服缓释组合物及其制备方法。
背景技术:
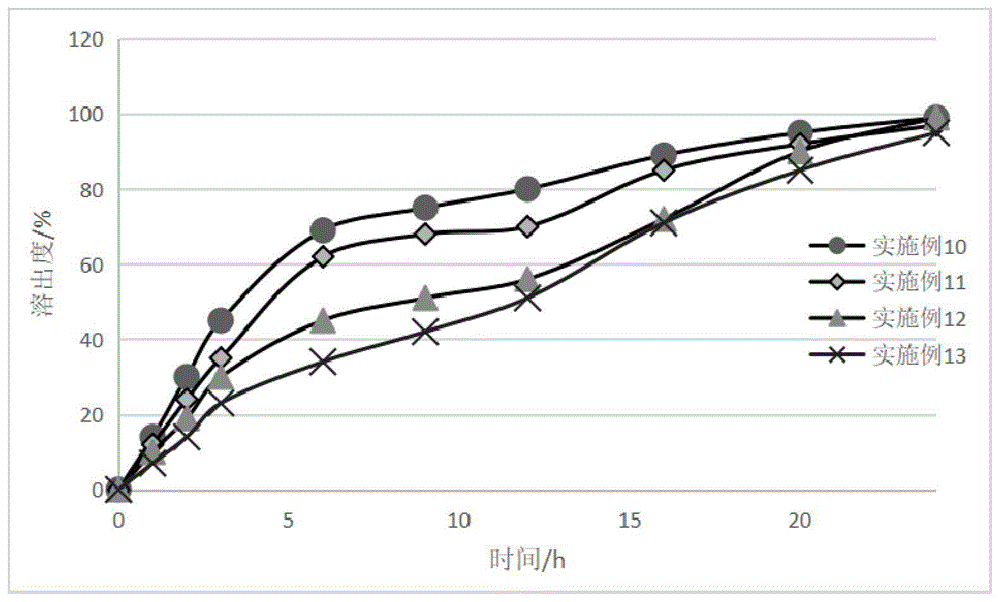
:在制药领域,目前已经有不少药品被开发为持续缓释、多级释放的控释制剂以便达到稳定血药浓度、减少用药次数,达到增加患者服药的依从性,提高用药安全、疗效及降低副反应等目的。高活性药物在临床中使用剂量低,表现出良好的治疗效果,但有时也因血药浓度高低水平以及波动带来毒副作用。故低剂量的高活性药物很大比例存在开发成缓释、控释制剂的需要。目前最成熟的口服缓控释技术包括骨架缓释、膜控缓释、渗透泵控释等,而这些技术仍很难满足一些难溶性药物的缓释制剂开发,其问题主要表现为工艺制备复杂,成本高,还包括释放速度和程度控制不佳、释放不充分等方面。在《oralcontrolledreleaseformulationdesignanddrugdelivery》(hongwen)中提到食物由口到盲肠大概3~7h,其中胃部ph值在1~5左右,十二指肠ph值在5-7,而在结肠阶段转运将持续10~24h,而结肠的平均ph值为6.8左右。结肠ph值相对较高,而且停留时间长,给药物吸收提供了一个重要的窗口。缓慢释放和定位释放技术结合可以做到药物的持续释放。cn107405311中公布一种基质型缓释片剂i与包衣定位释放片剂ii组合形成的难溶性药物缓释制剂,该组合需要单独制备两种片剂,并通过灌装胶囊实现合并,制剂产业化上存在较高复杂度。cn103442698提供了一种控释胃滞留系统,通过不同组合搭配实现在胃部较大程度的滞留形成缓释效果,为难溶性药物的缓释开发提供更多方案。常见结肠定位技术包括肠溶材料包衣、肠溶材料骨架,其中采用溶剂蒸发法和热熔挤出将肠溶材料与药物制备成微球或颗粒是常用的肠溶材料骨架制备手段。fahimam.hashem等在《invitroandinvivoevaluationofcombinedtimeandph-dependentoralcolonictargetedprednisolonemicrospheres》报道使用100、乙基纤维素和药物配制成甲醇溶液后分散在石蜡中,利用乳化剂80形成细小的微球,再洗脱、干燥,获得强的松龙微球制剂,可定位结肠给药强的松龙。kiranprakashsawant等在《extendedreleasedeliverysystemofmetoprololsuccinateusinghot-meltextrusion:effectofreleasemodifieronmethacrylicacidcopolymer》中公开使用s100和l100与一定量脱模改性剂polyoxtmwsr303和l100-55结合,采用热熔挤出(hme)技术制造琥珀酸美托洛尔的缓释剂型。采用肠溶材料与原料药,或进一步加入其它调整释放的材料制备成缓释或者定位释放是一种较好的处方工艺,但采用溶剂蒸发法制备骨架微球工艺繁琐,制备条件苛刻,质量可控性差;采用热熔挤出制粒的方式需要有热熔挤出的专用设备,且该工艺生产效率较低,不利于大规模的产业化。cn1204895公开一种含依托泊甙的药物组合物,其中包括采用肠溶材料作为固体分散载体,采用有机溶剂将主药溶解分散与载体中再进行干燥、粉碎,该固体分散物再和骨架型缓(控)释材料进行混合制粒压片、肠溶包衣获得缓控释制剂。但该专利所述方法内容适合于类似依托泊甙的高溶解度的化合物,很大一部分难溶性药物需要使用大量的有机溶剂来溶解,后续干燥也会带来制备时间过长的问题,而且所述固体分散体制备方法的工业化难度大,效率低。一些慢性疾病、肿瘤等用药患者,如低剂量的免疫调节剂阿普斯特、来那度胺、托法替布,抗凝药阿哌沙班等,长期服药而且每日可能服用多次药物,缓释制剂将有利于控制血药浓度,降低副作用,减少服药次数,因此,开发出一种适用于低剂量难溶性药物的口服缓控释组合物及其制备方法临床需求大。发明人在研究过程中发现采用难溶性药物与缓控释材料物理混合,或进一步制粒,再压片,易出现溶出过快或最终溶出不完全的问题,无法获得满意的缓控释制剂开发处方工艺。发明人后续发现采用肠溶材料与小粒径的难溶性化合物配制成混悬液可以有效分散原料药,不仅可以有效控制药物在低ph值溶液下的溶出速度,也可以确保在高ph值溶液下药物能够充分溶出,这一性质可很好的用于难溶性药物的缓控释制剂开发中。技术实现要素:发明目的:本发明提供一种低剂量难溶性药物的口服缓释组合物及其制备方法,通过将含药混悬液喷洒到液体强吸附载体上快速制备含肠溶材料的缓控释颗粒,提高药物含量均匀度,制备工艺使用溶剂量少,生产效率高;与亲水凝胶骨架材料组合,形成多重缓控释效果,达到持续缓释的效果。技术方案:本发明提供的口服缓释组合物由缓控释颗粒和凝胶骨架两部分构成,凝胶骨架包裹缓控释颗粒形成双重缓控释体系,其中缓控释颗粒包含难溶性药物、肠溶材料、液体强吸附载体,凝胶骨架部分包含亲水性凝胶骨架材料。所述缓控释颗粒通过将难溶性药物与含有肠溶材料的液体物质制备成含药混悬液后喷洒到液体强吸附载体上获得。本发明所述口服缓释组合物中难溶性药物占缓控释颗粒重量的2%~15%,难溶性药物与肠溶材料的重量比例为1:2~1:4,液体强吸附载体占缓控释颗粒重量的35%~75%,缓控释颗粒占口服缓释组合物重量的40%~70%,亲水性凝胶骨架材料用量占口服缓释组合物重量的20%~50%。本发明所述难溶性药物在口服缓释组合物中重量占比小于10%。本发明所述低剂量难溶性药物包括阿普斯特、来那度胺、托法替布、阿哌沙班。所述难溶性药物粒径控制在d90小于20微米;优选d90小于10微米;最优选d90小于5微米。难溶性药物粒径越小,越容易被肠溶材料包裹形成缓控释,也更利于后期的溶出。本发明所述肠溶材料是指在ph值6~8范围内可溶解的系列高分子材料,可以确保被肠溶材料包裹的药物在结肠部位能完全释放出来。所述肠溶材料包括甲基丙烯酸和甲基丙烯酸甲酯共聚物(甲基丙烯酸与甲基丙烯酸甲酯摩尔比范围为1:0.5~1:2)、甲基丙烯酸和丙烯酸甲酯和甲基丙烯酸甲酯(1:1:1)共聚物中的任意一种;常用的包括甲基丙烯酸和甲基丙烯酸甲酯(1:2)共聚物、甲基丙烯酸和甲基丙烯酸甲酯(1:1)共聚物、甲基丙烯酸和丙烯酸甲酯和甲基丙烯酸甲酯(1:1:1)共聚物,优选甲基丙烯酸和甲基丙烯酸甲酯(1:1)共聚物、甲基丙烯酸和丙烯酸甲酯和甲基丙烯酸甲酯(1:1:1)共聚物。商业化的肠溶材料产品中,甲基丙烯酸和甲基丙烯酸甲酯(1:2)共聚物为丙烯酸树脂2号、尤特奇l100等;甲基丙烯酸和甲基丙烯酸甲酯(1:1)共聚物为丙烯酸树脂3号、尤特奇s100等;甲基丙烯酸和丙烯酸甲酯和甲基丙烯酸甲酯(1:1:1)共聚物为尤特奇fs30d等。本发明所述缓控释颗粒中肠溶材料以液体形式加入。含有肠溶材料的液体物质为水分散体形式或有机溶剂溶液形式。肠溶材料水分散体可以自行制备,也有商业化产品,一些实施例中包括商业化产品有尤特奇fs30d等。所述肠溶材料的有机溶剂溶液通过采用有机溶剂溶解肠溶材料获得。肠溶材料水分散体制备过程中除肠溶材料、水外,还需加入碱性物质。碱性物质包括氨水、氢氧化钠、氢氧化钾。肠溶材料有机溶剂溶液可以采用丙酮、乙醇、四氯化碳、异丙醇溶解肠溶材料获得。所述肠溶材料的液体物质在使用前,还可加入抗粘剂、增塑剂、表面活性剂等。抗粘剂包括微粉硅胶、滑石粉、单硬脂酸甘油酯(gms);增塑剂包括单硬脂酸甘油酯(gms)、柠檬酸三乙酯(tec)、聚乙二醇;表面活性剂包括脂肪酸山梨坦(司盘)、聚山梨酯(吐温)、十二烷基硫酸钠。本发明中难溶性药物可采用搅拌、高速剪切匀浆、高速涡旋、超声分散等多种方式分散到含有肠溶材料的液体物质得到含药混悬液,也可以将难溶性药物提前与溶剂混合分散后再加入含有肠溶材料的液体物质中进行混合均匀得到含药混悬液。所述含药混悬液中固含量为10-35%,优选为15-25%。本发明中所述液体强吸附载体为水不溶性但液体吸附量大的一类物质,可以满足含药混悬液快速喷洒过程中及时吸附多余的溶剂,减少过湿而出现的颗粒增长过快过大、制粒不均匀现象,从而快速、顺利实现肠溶材料液体制粒成缓控释颗粒的过程。所述液体强吸附载体包括微晶纤维素、交联羧甲基纤维素钠、交联羧甲基纤维素、交联聚维酮、羧甲基淀粉钠、低取代羟丙纤维素、淀粉、预胶化淀粉,优选微晶纤维素、交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠、低取代羟丙纤维素。本发明所述缓控释颗粒中还可加入缓控释颗粒重量0~5%比例的粘合剂,以便于获得成粒效果较好的缓控释颗粒。所述粘合剂包括聚乙烯吡咯烷酮、羟丙甲纤维素、羟丙基纤维素、羧甲基纤维素、卡拉胶、海藻酸、阿拉伯胶、果胶、黄原胶、西黄蓍胶中的任意一种或几种。所述含有肠溶材料的液体物质在使用前,可选地加入缓控释颗粒重量0~8%的抗粘剂、0~8%的增塑剂、0~3%的表面活性剂中的任意一种或几种的组合,其中,所述抗粘剂选自微粉硅胶、滑石粉、单硬脂酸甘油酯;所述增塑剂选自单硬脂酸甘油酯、柠檬酸三乙酯、聚乙二醇;所述表面活性剂选自脂肪酸山梨坦、聚山梨酯、十二烷基硫酸钠。本发明所述缓控释颗粒可加入到凝胶骨架部分的组分中共同制粒,也可以将凝胶骨架部分单独制粒后再与制备的缓控释颗粒共同混合,或者缓控释颗粒可直接与凝胶骨架部分组分混合。本发明所述的口服缓释组合物,其中凝胶骨架部分含有亲水性凝胶骨架材料,还可含有其它药用辅料,包括填充剂、粘合剂、助流剂、润滑剂。所述亲水性凝胶骨架材料包括阿拉伯胶、黄蓍胶、聚乙烯基吡咯烷酮(pvp或聚维酮)、羟丙基甲基纤维素(hpmc)、虫胶、羟丙基纤维素(hpc)、羟乙基纤维素(hec)、海藻酸盐、甲基纤维素(mc)、卡拉胶、羧甲基纤维素及钠盐、卡波姆、聚乙烯醇(pva)等。本发明中所述亲水凝胶材料可实现快速水化形成凝胶层,达到控制前期溶出速率的目的。通过调整亲水性凝胶骨架种类和用量,可实现片剂在一定时间内完成溶蚀,缓控释颗粒部分在溶蚀过程将离开片剂,形成独立的缓控释单元。本发明中亲水性凝胶骨架材料用量占制剂重量的20%~50%,优选的20%~40%。随着亲水性凝胶骨架材料用量超过50%左右时,其缓释作用变化幅度显著降低,反而增加物料成本。所述凝胶骨架部分中可选地加入填充剂、粘合剂、润滑剂和助流剂。本发明所述凝胶骨架部分中填充剂包括但不限于纤维素衍生物和淀粉衍生物中的任意一种或两种,如包括乳糖、甘露醇、木糖醇、果糖、蔗糖、糊精、微晶纤维素、预胶化淀粉、羧甲基淀粉钠、甲基纤维素、羟丙基淀粉等;更优选为乳糖、甘露醇、糊精、微晶纤维素、预胶化淀粉中的一种或几种。本发明中亲水性凝胶骨架材料用量占制剂重量的0%~35%。填充剂主要作用为提高可压性、流动性、颗粒形成性等效果,填充剂的用量可根据目标产品的需要作出调整,起到一定的辅助作用。所述粘合剂包括但不限于聚乙烯吡咯烷酮、淀粉浆、羟丙甲纤维素、羟丙基纤维素、羧甲基纤维素、糊精、卡拉胶、海藻酸、阿拉伯胶、果胶、黄原胶、西黄蓍胶。粘合剂主要作用是快速成粒以及提高可压性。本发明中粘合剂用量占口服缓释组合物总重的0%~10%。所述润滑剂包括但不限于硬脂酸镁、硬脂酸钙、硬脂酸钠、硬脂酸、硬脂富马酸钠、滑石粉、山嵛酸甘油酯、氢化植物油和硬脂醇。本发明中润滑剂用量占口服缓释组合物总重的0%~5%。所述助流剂包括但不限于滑石粉、微粉硅胶、二氧化硅、月桂基硫酸钠和硬脂酸及其金属盐。本发明中助流剂用量占口服缓释组合物总重的0%~5%。在一个优选的实施方式中,所述口服缓释组合物包含缓控释颗粒和凝胶骨架两部分,其中缓控释颗粒部分包含阿普斯特、肠溶材料、液体强吸附载体,凝胶骨架部分包含亲水性凝胶骨架材料;其中所述肠溶材料为尤特奇s100、尤特奇fs30d;所述液体强吸附载体包括微晶纤维素、交联羧甲基纤维素钠、交联羧甲基纤维素、交联聚维酮、羧甲基淀粉钠、低取代羟丙纤维素;所述亲水性凝胶骨架材料包括阿拉伯胶、黄蓍胶、聚乙烯基吡咯烷酮(pvp或聚维酮)、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、海藻酸盐、甲基纤维素(mc)、卡拉胶、羧甲基纤维素及钠盐、卡波姆、聚乙烯醇(pva);其中阿普斯特与肠溶材料重量比为1:2~1:4;所述缓控释颗粒是通过将难溶性药物与肠溶材料的制备成混悬液后喷洒到液体强吸附载体上获得。本发明提供的口服缓释组合物是将难溶性药物分散在含有肠溶材料的液体物质得到的混悬液喷洒到液体强吸附载体上形成缓控释颗粒部分,再与凝胶骨架部分物料组合加工,获得总混颗粒再进行压片获得。本发明提供的口服缓释组合物中缓控释颗粒可采用湿法制粒工艺获得,如高剪切制粒、流化床制粒、侧喷制粒;凝胶骨架部分可采用粉末直接混合、湿法制粒工艺、干法制粒工艺获得。本发明提供的口服缓释组合物制备过程可以将制备好的缓控释颗粒加入到凝胶骨架部分的组分中共同制粒,也可以将凝胶骨架部分单独制粒后再与制备的缓控释颗粒共同混合,再进行后续压片工艺。本发明供的口服缓释组合物中缓释颗粒部分被凝胶骨架包裹形成多重缓控释体系。本发明中缓控释颗粒可形成速释、缓释、定位控释的三种溶出释放效果,其中原料药被肠溶材料未包裹部分呈现速释效果,而快速制粒干燥过程会形成一部分孔洞,从而在酸性介质中出现肠溶材料骨架缓释效果,而完全被包裹的一部分原料药则表现出肠溶定位释放效果,缓控释颗粒中速释部分因外层被凝胶骨架包裹后可有效形成缓释,而且凝胶缓释层可以有效抵抗在十二指肠、空肠、回肠等部位的高ph环境,确保一部分被肠溶材料完全包裹有效成分到达盲肠、结肠再释放,释放完全,形成稳定有效的定位释放效果。本发明所述缓控释颗粒的在酸性介质中的溶出度可评估检测原料药被肠溶材料的包裹程度以及对药物释放的控制程度。参考中国药典2015年版四部通则〈0931〉第二法,转速75rpm,以氯化钠的盐酸溶液(ph1.2),体积900ml为释放介质,温度37℃±0.5℃进行缓控释颗粒溶出度检测。取120min溶出度称之为酸溶出度。本发明中所述缓控释颗粒酸溶解度目标控制范围为33%~80%;较优的,控制范围为50%~80%。本发明的口服缓释组合物参考中国药典2020年版四部通则〈0941〉含量均匀度检查法。取缓释片10个,测定每一个单剂以标示量为100的相对含量xi,求其均值和标准差s以及标示量与均值之差的绝对值a,计算a+2.2s,当a+2.2s小于15时,可认为含量均匀度合格。本发明的口服缓释组合物可持续释放24小时,其中2小时溶出不大于30%,12小时溶出50%~80%并且20小时释放80%以上。本发明的口服缓释组合物参考中国药典2020年版四部通则〈0931〉第二法,转速75rpm,温度37℃±0.5℃进行溶出度检测。取样品6个单位剂量平行检测,以氯化钠的盐酸溶液(ph1.2),体积750ml为释放介质,120min后取样检测溶出度,上述酸液中加入温度为37℃±0.5℃的0.3mol/l磷酸钠溶液150ml,继续运转10h,然后在上述酸液中加入温度为37℃±0.5℃的0.5mol/l磷酸钠溶液100ml(必要时用2mol/l盐酸溶液或2mol/l氢氧化钠溶液调节ph值至7.8),或按各品种项下规定的时间,在规定取样点吸取溶出液适量,滤过,自取样至滤过应在30秒钟内完成。按各品种项下规定的方法测定,计算每片(粒)的缓冲液中溶出量。有益效果:与现有技术相比,本发明公开了缓释颗粒部分被凝胶骨架包裹形成双重缓控释体系技术,所制备的低剂量难溶性药物口服缓释组合物具有如下优点:(1)制备工艺简单、使用溶剂少,效率高:原料药与肠溶材料共同分散成混悬液体物质,提高载药量,减少溶剂用量,利用液体吸附量大的材料作为载体,实现快速喷洒制粒、干燥,获得缓控释颗粒;(2)原料药以混悬液进行喷雾形式加入到其它物料中,分散均匀,减少混合均匀度风险,保证药物的含量均匀度;(3)多重缓控释体系,延长释放时间,溶出完全:本发明中缓控释颗粒可形成速释、缓释、定位控释的三种溶出释放效果,缓控释颗粒多层次的释放配合凝胶骨架缓释作用可有效延长释放时间,而且在肠道溶出完全。附图说明图1实施例10~13溶出曲线;图2实施例14~17溶出曲线;图3实施例18~20溶出曲线。具体实施方式下面结合实施例对本发明做进一步的详细说明。实施例1~4实施例1~4所用的组方和用量比例如下表1所示,每批次的物料总量为500g(不计溶剂重量):表1*溶剂在加工过程将被干燥去除。实施例1~4制备工艺步骤:1)将尤特奇s100溶于适量乙醇(95%)中;阿普斯特、滑石粉和柠檬酸三乙酯加入适量乙醇(95%)中,用匀浆机匀化约10分钟,然后倒入尤特奇s100溶液中,在制粒过程中用搅拌器不断搅拌混悬液;2)将步骤1)混悬液通过wbf-2g流化床顶喷制粒方式喷洒在微晶纤维素中,过程中控制雾化压力在0.5~2.0bar(每10min上调0.5bar,到最大值为止)和喷速5~15g/min(每10min上调5g/min,到最大值为止)、风量90m3/h,进风温度45℃,完成喷液后,在采用50~60℃进行干燥20min,去除残留溶剂,获得干燥颗粒;3)将步骤2)所得干燥颗粒采用孔径40目筛网进行干整粒,获得缓控释颗粒。取样检测缓控释颗粒酸溶出度,每份样品中含有阿普斯特约60mg。实施例5~8实施例5~8所用的组方和用量比例如下表2所示,其中阿普斯特所用原料药粒径分布d90为7.4微米,每批次的物料总量为500g(不计溶剂重量)。表2*以尤特奇水分散体中固体物质重量计。**纯化水用量包括尤特奇水分散体中水量和外加水量,纯化水在加工过程会被干燥去除。处方中除液体强吸附载体、粘合剂外其它组分与所述溶剂配制成混悬液,所用溶剂用量为所述混悬液中固含量为20%~25%左右。实施例5~8制备工艺步骤:1)将抗粘剂、增塑剂、表面活性剂、主药加到一定量溶剂热水(70℃~80℃)中,用高剪切匀化机匀化10分钟,获得混悬液,持续搅拌备用;2)将步骤1)混悬液通过wbf-2g流化床顶喷制粒方式喷洒在微晶纤维素中,过程中控制雾化压力在0.5~2.0bar(每10min上调0.5bar,到最大值为止)和喷速5~15g/min(每10min上调5g/min,到最大值为止)、风量90m3/h,进风温度45℃,完成喷液后,在采用50~60℃进行干燥20min,去除残留溶剂,获得干燥颗粒;3)将步骤2)所得干燥颗粒采用孔径30目筛网进行干整粒,获得缓控释颗粒。取样检测缓控释颗粒酸溶出度,每份样品中含有阿普斯特约60mg。实施例9实施例9所用的组方和用量比例如下表3所示,其中阿普斯特所用原料药粒径分布d90为15微米,每批次的物料总量为500g(不计溶剂重量)。表3*处方中除液体强吸附载体、粘合剂外其它组分与所述溶剂配制成混悬液,所用溶剂用量为所述混悬液中固含量为25.4%,纯化水在加工过程会被干燥去除。实施例9制备工艺步骤:1)将肠溶材料尤特奇l100缓慢倒入水中,搅拌5-10分钟。待肠溶材料完全润湿,后缓慢加入氢氧化钠粉末或溶液并不停搅拌,最后再继续搅拌30分钟。然后加入原料药、增塑剂和抗粘剂,持续搅拌均匀后用40目筛过滤,获得混悬液,保持搅拌备用;2)将步骤1)混悬液通过wbf-2g流化床顶喷制粒方式喷洒在微晶纤维素中,过程中控制雾化压力在0.5~2.0bar(每10min上调0.5bar,到最大值为止)和喷速5~15g/min(每10min上调5g/min,到最大值为止)、风量90m3/h,进风温度45℃,完成喷液后,在采用50~60℃进行干燥20min,去除残留溶剂,获得干燥颗粒;3)将步骤2)所得干燥颗粒采用孔径20目筛网进行干整粒,获得缓控释颗粒。取样检测缓控释颗粒酸溶出度,每份样品中含有阿普斯特约60mg。实施例10~13实施例10~13所用的组方和用量比例如下表4所示,每批次的总混颗粒重量为400g。表4实施例10~13制备工艺步骤:1)将缓控释颗粒与亲水凝胶材料、润滑剂混合10min,获得总混颗粒;2)将总混颗粒倒入压片机中,选择φ11mm的圆形冲模进行,按照目标片重进行压片,获得缓控释片剂。实施例10~13制备所得片剂溶出情况如下表5,溶出曲线可见图1。表5溶出度(%)时间/小时01236912162024实施例100143045697580899599实施例110122435626870859297实施例120101930455156729099实施例13071423344251718595实施例14~17实施例14~17所用的组方和用量比例如下表6所示,每批次的总混颗粒重量为400g:表6实施例14~17制备工艺步骤:1)将缓控释颗粒与亲水凝胶材料、润滑剂混合10min,获得总混颗粒;2)将总混颗粒倒入压片机中,选择胶囊型冲模按照目标片重进行压片,获得缓控释片剂。实施例14~17制备所得片剂溶出情况如下表7,溶出曲线可见图2。表7溶出度(%)时间/小时01236912162024实施例140152945657378899599实施例150132738556870849499实施例160102332495559799198实施例17082129434751738595实施例18实施例18所用的组方和用量比例如下表8所示,其中阿哌沙班的粒径分布为d90为4.3微米,总混颗粒重量为500g。表8*以尤特奇水分散体中固体物质重量计。**纯化水用量包括尤特奇水分散体中水量和外加水量,纯化水在加工过程会被干燥去除。处方中除液体强吸附载体、粘合剂外其它组分与所述溶剂配制成混悬液,所用溶剂用量为所述混悬液中固含量为30%左右。实施例18制备工艺步骤:1)将抗粘剂、增塑剂、表面活性剂、主药加到一定量溶剂热水(70℃~80℃)中,用高剪切匀化机匀化10分钟,获得混悬液的固体含量约30%,持续搅拌备用;2)将步骤1)混悬液慢慢地倒入肠溶材料尤特奇fs30d中,同时用普通搅拌机中速搅拌,再将混悬液用40目筛过滤,备用;3)将粘合剂、液体强吸附载体加入emg2-6高剪切制粒机中预混合5min混合均匀后,再将步骤2)所得混悬液在1~3min内喷洒到制粒机中物料中,继续搅拌2min,得到润湿程度适宜软材;4)将步骤3)的软材采用摇摆制粒机40目进行湿整粒;5)将步骤4)得到物料进行干燥,所得干燥颗粒采用孔径15目筛网进行干整粒,获得缓控释颗粒。6)凝胶骨架部分采用高剪切制粒工艺制备。将亲水凝胶材料、填充剂加入高剪切制粒机中混合均匀后,将溶剂纯化水喷洒到制粒机中物料中,继续搅拌,得到润湿程度适宜软材;7)将步骤2)的软材采用旋转式comil粉碎机在8*8mm方孔筛下进行湿整粒;8)将步骤3)得到物料进行干燥,所得干燥颗粒采用孔径20目筛网进行干整粒,获得凝胶骨架颗粒;9)将缓控释颗粒、凝胶骨架颗粒、润滑剂在混合桶中混合20min,获得总混颗粒;10)将总混颗粒采用高速旋转压片机进行压片,选择φ10mm圆形冲模,每片含有阿哌沙班10mg,获得阿哌沙班缓释片。实施例18中取一定量缓控释颗粒(含阿哌沙班约10mg)的酸溶出度为60%,制备所得片剂溶出情况如下表11,溶出曲线可见图3。实施例19实施例19所用的组方和用量比例如下表9所示,其中来那度胺的粒径分布为d90为7.5微米,总混颗粒重量为500g。表9*溶剂在加工过程会被干燥去除。实施例19制备工艺步骤:1)缓控释颗粒部分的制备工艺参考实施例1;2)凝胶骨架部分采用流化床制粒工艺制备。将亲水凝胶材料、填充剂加入制粒流化床中混合10min后,将溶剂纯化水喷洒到制粒机中物料中,控制物料温度在40℃左右,风量控制在1103m/h进行制粒,喷液完成后干燥30min,得到干燥颗粒;3)将步骤2)所得干燥颗粒采用孔径20目筛网进行干整粒,获得凝胶骨架颗粒;4)将缓控释颗粒、凝胶骨架颗粒、润滑剂在混合桶中混合20min,获得总混颗粒;5)将总混颗粒采用高速旋转压片机进行压片,选择φ12mm圆形冲模,按照目标片重进行压片,获得来那度胺缓释片素片;6)将胃溶包衣层物料分散在纯化水中得到10%固含量的混悬液,将素片放于高效多孔包衣机中喷入混悬液进行包衣,按照片芯重量的3%增重进行包衣,获得来那度胺缓释片。实施例19中缓控释颗粒的酸溶出度为68%,制备所得片剂溶出情况如下表11,溶出曲线可见图3。实施例20实施例20所用的组方和用量比例如下表10所示,其中托法替布的粒径分布为d90为10微米,总混颗粒重量为500g。表10*以尤特奇水分散体中固体物质重量计。**该纯化水用量包括尤特奇水分散体中水量和外加水量,纯化水在加工过程会被干燥去除。处方中除液体强吸附载体、粘合剂外其它组分与所述溶剂配制成混悬液,所用溶剂用量为所述混悬液中固含量为20%~25%左右。实施例20制备工艺步骤:1)缓控释颗粒部分的制备工艺参考实施例1;2)凝胶骨架部分采用高剪切制粒工艺制备。将缓控释颗粒、亲水凝胶材料、填充剂加入高剪切制粒机中混合均匀后,将溶剂纯化水喷洒到制粒机中物料中,进行制粒,将溶剂纯化水喷洒到制粒机中物料中,继续搅拌,得到润湿程度适宜软材;3)将步骤2)的软材采用旋转式comil粉碎机在8*8mm方孔筛下进行湿整粒;4)将步骤3)得到物料进行干燥,所得干燥颗粒采用孔径20目筛网进行干整粒,获得整粒颗粒;5)将步骤4)所得整粒颗粒、润滑剂在混合桶中混合20min,获得总混颗粒;6)将总混颗粒采用高速旋转压片机进行压片,选择φ11mm圆形冲模,按照目标片重进行压片获得托法替布缓释片。实施例20中取一定量缓控释颗粒(含托法替布约22mg)的酸溶出度为66%,制备所得片剂溶出情况如下表11,溶出曲线可见图3。表11溶出度(%)时间/小时01236912162024实施例18071221405572899599实施例19081632556570829199实施例200102129465259829398对比例1为了区分本发明与公开技术的差别,发明人参考cn1204895公开固体分散体制备工艺,采用本发明实施例1中缓控释颗粒相似的处方来制备样品进行对比。(1)参考cn1204895方法制备阿普斯特固体分散体,首先将阿普斯特10g与尤特奇s100粉末20g溶解于乙醇中需要乙醇大于15l;而本发明中实施例1处方来计算,制备同样10g阿普斯特样品使用乙醇小于1l,显著减少有机溶剂用量。(2)由于cn1204895骨架型片剂中固体分散体制备方法未充分公开,故采用常用的烘干法将上述装有溶液a200ml的烧杯采用60℃下烘箱蒸发溶剂48h发现固体物质未完全干燥,继续干燥将耗费大量的时间;而本发明中实施例1采用常见的流化床制粒机通过喷雾方式将混悬液快速喷到液体强吸附载体上完成制粒操作,时间可控制在60min以内,干燥效果好。故与cn1204895记录方法相比,本发明可显著减少有机溶剂用量,缩短干燥时间,节能环保,效率高。对比例2对比例2参考本发明实施例5中缓控释颗粒相似的处方来制备样品,不同之处在于采用液体吸附力差的乳糖更换其中的液体强吸附载体微晶纤维素,所得缓控释颗粒采用实施例14处方工艺获得片剂。试验过程中,发现缓控释颗粒制粒过程颗粒大小不一,容易出现分层现象。对样品进行检测,对比例2的缓控释颗粒的酸溶出度为91%,超过控制目标上限80%;片剂的含量均匀度a+2.2s为16.2,超过合格限度15;片剂溶出也明显过快,具体情况如下表12。表12溶出度(%)时间/小时01236912162024对比例20213549678292959797对比例3~4对比例3、对比例4参考本发明实施例6中缓控释颗粒处方和实施例15处方进行片剂制备,其中对比例3的缓控释颗粒处方不单独制粒而采用粉末混合方式混合后再与羟丙甲纤维素k15mphdc、乳糖、硬脂酸镁混合后再进行压片,获得对比例3片剂;对比例4的缓控释颗粒处方制粒时,将原料药先与聚维酮k30、羧甲基淀粉钠混合,肠溶材料、抗粘剂、增塑剂、表面活性剂单独制备成混悬液,后续的喷雾制粒、压片工艺参考实施例15进行,得到对比例4片剂。对样品进行检测,对比例3、对比例4的片剂的含量均匀度a+2.2s分别为17.2、18.3,超过合格限度15;对比例3片剂溶出也明显过快,对比例4出现终溶出不完全的情况,溶出度具体情况如下表13。表13溶出度(%)时间/小时01236912162024对比例30223545647685919295对比例40193241556468747679相比较对比例3、对比例4,采用本
发明内容的实施例15有效保证片剂的含量均匀度在合格范围内,而且片剂溶出缓慢持久,最终溶出完全(20小时溶出大于80%)。综上所述,本发明公开的一种低剂量难溶性药物缓释口服组合物通过采用高ph敏感的肠溶材料对原料药制备成混悬液采用喷洒方式制备成具有速释、缓释、控释综合的缓控释颗粒,再通过亲水凝胶材料进一步缓释,对药物形成多重缓控释;同时通过肠溶材料的分散和控释作用,可有效保证难溶性药物的充分溶出,避免难溶性药物中出现的溶出不完全现象。本发明所制备的样品含量均匀度好,溶出释放时间长,工艺简单,实用性强。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1