铁皮石斛多糖在制备靶向肿瘤相关巨噬细胞治疗肿瘤药物中的应用的制作方法
本发明属于植物药物技术领域,具体涉及铁皮石斛多糖在制备靶向识别肿瘤相关巨噬细胞治疗肿瘤药物中的应用。
背景技术:
肿瘤是机体在各种致瘤因素作用下,局部组织的细胞在基因水平上失去对其生长的调控,导致克隆性异常增生而形成的新生物,常表现局部肿块。近年来,肿瘤的发病率和死亡率逐渐上升,已成为人类健康的主要威胁之一。据2019年全球癌症统计报告显示,全球每年新增病例1810万例,死亡病例960万例,其中我国是癌症高发的国家,目前我国每年新增病例约占全球的21%,死亡病例约占24%。全球新发癌症发病率最高的依次为:肺癌(11.6%)、乳腺癌(11.6%)、结直肠癌(10.2%)、前列腺癌(7.1%)、胃癌(5.7%);全球死亡率最高的癌症依次为:肺癌(18.4%)、结直肠癌(9.2%)、胃癌(8.2%)、肝癌(8.2%)、乳腺癌(6.6%)。肿瘤的治疗一直是困扰医学界的难题,目前肿瘤的治疗多采用手术加化疗、放疗相结合的治疗方法,但效果不理想,传统抗肿瘤药物的毒副作用大,在杀伤患者体内肿瘤细胞的同时,也破坏机体正常细胞和免疫细胞,导致多种组织及器官受损,预后恢复较差,恶性进展迅速。因此,亟待研发新的、靶向性强的癌症治疗方法和药物,以提高癌症患者的生存质量和生存时间,寻找安全、高效、特异、低毒的天然抗肿瘤新药逐渐成为中外科研工作者的目标。
在肿瘤微环境(tme,tumormicroencironment)中的肿瘤部位招募的固有性和适应性免疫细胞中巨噬细胞最为丰富,并称其为肿瘤相关巨噬细胞(tams,tumor-associatedmacrophage),约占细胞总数的30-50%。tams是众多细胞因子的重要来源,在肿瘤进展中发挥核心的关键调控作用。多项临床硏究表明,肿瘤中的tams的数量和密度与多种肿瘤患者的临床不良预后呈正相关。tams是具有高度可塑性和异质性的一个多样化的细胞群体,可根据不同的环境刺激而相应地改变自身表型分化成为具有不同表型标志物和功能特征的细胞亚群,主要分为经典激活的m1型巨噬细胞和替代激活的m2型巨噬细胞两种极化类型。m1型巨噬细胞可由ifn-γ或lps诱导产生,其主要特点是通过高表达和分泌inos、il-12、il-23、tnf-α、il-13、cxcl-9等免疫激活因子调节th1细胞免疫应答,发挥抗肿瘤免疫监视功能;m2型巨噬细胞可由il-4、il-13、m-csf和糖皮质激素等诱导产生,其主要特点是通过高表达il-10、tgf-β、arg1、cd206、vegf、ccl2、mmp9等免疫抑制因子调节th2细胞的体液免疫应答,发挥促肿瘤免疫逃逸功能,从而促进组织重塑、血管生成和肿瘤发生。改变tams中m1/m2极化平衡可有效抑制肿瘤的发生发展,因此,tams正成为抗肿瘤治疗的新靶点。
铁皮石斛(dendrobiumofficinalekimuraetmigo)为兰科(orchidaceae)石斛属多年生附生草本植物,作为2020年版《中国药典》收录且单列的正品石斛之一,是目前公认的药食同源植物,久服可厚肠胃、增强机体免疫力。现代研究表明,多糖是铁皮石斛中发挥功效的主要活性成分,铁皮石斛多糖在抗肿瘤、提高免疫力、抗氧化等方面都具有显著疗效,尤其是在抑制肿瘤方面,铁皮石斛多糖显示出潜在的治疗价值,具有良好的应用前景。目前有关铁皮石斛多糖抗肿瘤的研究多为体外细胞实验或动物实验,评价机制多数与肿瘤细胞抑制率和细胞凋亡相关,而对于多糖在体内发挥抗肿瘤作用的具体机制尚不明确。迄今尚未有关于铁皮石斛多糖均一组分靶向tams治疗肿瘤中的报道,显而易见,靶向tams的铁皮石斛多糖将为肿瘤治疗提供一种新策略。
技术实现要素:
本发明的目的是提供一种铁皮石斛多糖(dop)在制备靶向tams治疗肿瘤药物中的应用,实现dop在tme中通过特异性结合tlr2靶向调控tams由m2型向m1型转化发挥抗肿瘤作用。
dop在制备靶向tams治疗肿瘤药物上的应用。
所述靶向tams的dop,是通过特异性识别tams上的模式受体tlr2的药物。
所述dop是通过靶向识别tams表面上的toll-like2受体(tlr2)介导其由m2型细胞向m1型细胞极化,进而促进细胞毒性t细胞(cd8+t)的肿瘤杀伤活性,抑制调节性t细胞(tregs)产生的免疫逃逸,最终启动免疫激活效应抑制肿瘤生长。
本发明利用不同肿瘤细胞系构建了移植型荷瘤鼠模型,对其口服灌胃不同剂量的dop,分析dop对荷瘤小鼠的治疗效果。本发明所提供的铁皮石斛(dendrobiumofficinalekimuraetmigo)为兰科草本植物,是一种从铁皮石斛干燥茎中经免疫活性导向分离出的多糖,具有抗肿瘤活性。所述肿瘤细胞系分别为小鼠肝癌hepa1-6细胞、lewis肺癌llc细胞、前胃癌mfc细胞、结直肠癌ct26细胞。
本发明公开了dop靶向启动tams发挥抗肿瘤免疫效应的调节机制,证明dop口服用药途径可发挥抗肿瘤疗效,本发明对靶向tams的肿瘤治疗具有重要意义。
本发明中,所述dop是与tams表面的tlr2靶向结合。
本发明中,所述dop促进tams由m2型向m1型转化,并且这种转化是基于tlr2受体介导。
本发明的有益效果体现在:
本发明的dop是经免疫活性导向分离筛选出的具有高免疫活性的结构均一多糖,其在不同荷瘤小鼠模型中均具有显著的抑瘤活性,表现出广谱的抗肿瘤作用。通过小动物活体成像仪证明了dop经口服后可以进入血液到达tme。通过体外结合体内实验发现dop可通过靶向识别tme中tams表面上的tlr2受体促进tams由m2型向m1型极化,进而促进cd8+t细胞的肿瘤杀伤活性,抑制tregs细胞产生的免疫逃逸,最终启动免疫激活效应抑制肿瘤生长。本发明以dop靶向tams调控的抗肿瘤免疫响有望成为肿瘤治疗的重要技术手段。
附图说明
图1为dop对肝癌hepa1-6荷瘤小鼠的抑瘤作用图;
图2为dop对肺癌llc、胃癌mfc、结直肠癌ct26荷瘤小鼠的抑瘤作用图;
图3为dop对肝癌hepa1-6荷瘤小鼠tme中免疫细胞比例的影响图;
图4为dop对
图5为dop对cd8+t-/-荷瘤小鼠的抗肿瘤免疫调节作用图;
图6为dop对tregs-/-荷瘤小鼠的抗肿瘤免疫调节作用图;
图7为小动物活体荧光成像观察dop在荷瘤小鼠体内的时间动态分布图;
图8为dop与
图9为dop与tlr2受体结合的验证图;
图10为tlr2受体的鉴定图;
图11为tlr2对dop调控tams极化的影响图;
图12为tlr2对dop调控cd8+t细胞和tregs分化的影响图;
具体实施方式
下面结合具体实施例对本发明做进一步说明,但不限于此。
实施例1:铁皮石斛多糖的制备
铁皮石斛(dendrobiumofficinalekimuraetmigo)采自霍山,取其鲜条于70℃干燥至恒重并粉碎备用。准确称取100g干燥的铁皮石斛粉末,按料液比1:60加入80%的乙醇,室温搅拌浸提24h后,于5000g条件下离心10min,收集沉淀,沉淀经干燥除去乙醇后,按1:60液比加入蒸馏水,80℃条件下搅拌浸提2h,纱布过滤收集上清液,残渣重复水提两次,最后合并三次滤液,提取滤液经减压浓缩(65℃)、80%乙醇醇沉、sevag法脱蛋白、透析(3500da,24h)、冷冻干燥后得到铁皮石斛粗多糖。铁皮石斛粗多糖经deae-cellulose阴离子交换柱(1.6cm×60cm)初步分离纯化后,依次用40%、60%、80%的乙醇分级醇沉,最后经sephacryls-200凝胶柱纯化得均一组分多糖dop。
实施例1制备的dop的基本理化性质如表1所示,dop为均一多糖,分子量为1.543×104da,主要由葡萄糖和甘露糖组成,摩尔比为1:4.5,连接方式为:主链主要由β-(1→4)-d-manp、β-(1→4)-d-glcp和β-(1→3,6)-d-manp重复构成,支链由β-(1→4)-d-manp、β-(1→4)-d-glcp和β-1-d-glcp连接组成,其中β-(1→4)-d-manp的2-位被乙酰基基团取代。
表1dop的理化性质
实施例2:dop抗肿瘤活性评价
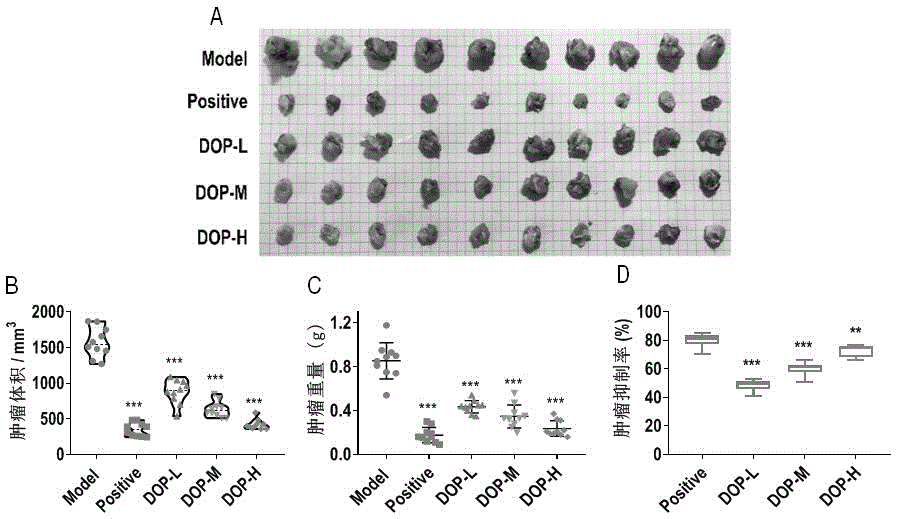
小鼠经适应性饲养一周后,选取150只雄性c57bl/6j小鼠,除正常组外(normal,10-15只),其余小鼠接种hepa1-6肝癌细胞,用1ml微量注射器抽取处于生长对数期的hepa1-6细胞悬液(2×106个/ml),接种于消毒后的100只c57bl/6j小鼠右侧腋下,每只各接种0.2ml(2×106个/ml),并压迫注射点,防止细胞外漏,建模期间密切观察小鼠成瘤情况,3-7天后待瘤生长至可触摸时(肿瘤长至0.5cm×0.5cm左右),用游标卡尺测量肿瘤的长径(a)和短径(b),排除瘤块过大或过小者,实验最终将符合标准的荷瘤小鼠随机分成5组:模型组(model,灌胃无菌生理盐水);阳性组(positive,灌胃5-氟尿嘧啶,20mg/kg·dbw);dop低剂量组(dop-l,50mg/kg·dbw)、dop中剂量组(dop-m,100mg/kg·dbw)、dop高剂量组(dop-h,200mg/kg·dbw),其中配置positive和dop组的溶剂为无菌生理盐水。每组10-15只,每组每日1次经口灌胃给药,灌胃体积按照0.1ml/10g,连续灌胃30天,经co2窒息处死小鼠并进行相关指标检测。
为进一步验证dop对其他肿瘤细胞系构建的荷瘤小鼠同样具有抗肿瘤活性,利用llc、mfc、ct26三株细胞系分别构建肺癌、胃癌、结肠癌荷瘤小鼠模型,以dop高剂量组口服灌胃给药,从荷瘤小鼠的基础生理指标、抑瘤作用方面对dop的抗肿瘤活性进行检验,简要步骤为:随机取雄性c57bl/6j小鼠用于dop体内抗肿瘤活性验证实验,按上述方法分别构建肺癌llc、胃癌mfc、结直肠癌ct26细胞荷瘤小鼠模型,实验随机分设正常组(normal),llc模型组(llc)、llc阳性组(llc+5-fu)、llcdop给药组(llc+dop,200mg/kg·dbw);mfc模型组(mfc)、mfc阳性组(mfc+5-fu)、mfcdop给药组(mfc+dop,200mg/kg·dbw);ct26模型组(ct26)、ct26阳性组(ct26+5-fu)、ct26dop给药(ct26+dop,200mg/kg·dbw)每组10-15只,每组每日1次灌胃给药,灌胃体积按照0.1ml/10g,灌胃30d后,经co2窒息处死小鼠并进行相应指标检测。
如图1a-c所示,与模型组相比,dop的低、中、高剂量处理组均显著抑制hepa1-6荷瘤小鼠的肿瘤体积和重量。图1d显示,dop的低、中、高剂量处理组对hepa1-6荷瘤小鼠的肿瘤抑制率分别为:48.31%±3.81、59.96%±4.87、72.61%±4.16,呈剂量依赖性,说明dop具有显著抗肿瘤活性。
如图2a-c所示,经dop灌胃给药处理30天后,llc+dop、mfc+dop、ct26+dop组的肿瘤体积和重量均显著低于llc、mfc、ct26模型组(p<0.001)。图2d显示,dop对llc、mfc、ct26的抑瘤率分别为67.97%±4.18、73.50%±4.42、71.83%±3.69,说明dop在给药期间可以显著减缓llc、mfc、ct26荷瘤小鼠肿瘤体积和重量增长。上述结果dop对hepa1-6、llc、mfc、ct26细胞系构建的荷瘤小鼠均具有显著的抑瘤作用。
实施例3:dop抗肿瘤的免疫调节效应
取出各组肿瘤组织称重后,分别置于含适量5%胎牛血清的pbs(fbs,0.01m,ph7.4)缓冲液的无菌平皿中,用眼科手术剪在冰上将肿瘤组织剪碎(1mm),每100mg肿瘤组织中加入2ml含iv型胶原酶(1.5mg/ml,500u/mg)和dnase-i(0.5mg/ml,3000u/mg)的消化液,在37℃,120rpm/mim条件下消化60min后,转移至冰上加入含20%胎牛血清的pbs缓冲液终止消化,200目纱布过滤,收集细胞滤液,4℃条件下,400g离心5min,弃上清收集沉淀,fbs缓冲液重悬沉淀后,按照1:3比例加入红细胞裂解液,冰上裂解15min,4℃条件下,400g离心5min,弃上清,同样条件下用fbs缓冲液洗涤沉淀一次并重悬细胞,得肿瘤组织单细胞悬液,用fbs缓冲液调整细胞浓度为1×106个/ml,加入cd16/32抗体封闭20min后,分别向肿瘤单细胞悬液中依次加入荧光素标记的偶联抗体,采用anti-mousecd3-apc、anti-mousecd4-pe、anti-mousecd8a-fitc抗体组合分析cd4+t和cd8+t细胞,anti-mousecd4-pe、anti-mousecd25-fitc、anti-mousefoxp3-alexa
实验结果如图3h所示,相比于模型组,dop显著调控了tme中tams、cd8+t细胞和tregs的浸润比例。其中图3a显示cd8+t(cd4+cd8+)增加了28.66%、图3b显示tregs(cd4+cd25+foxp3+)降低了53.94%、图3f显示m1(f4/80+cd11c+)增加了106.80%、图3g显示m2(f4/80+cd206+)减少了45.83%。而图3c-f显示,与模型组相比,dop对b细胞(cd45+b220+)、dc(cd11c+mhcii+)和nk(nk1.1+perforin+)的调节均无显著差异(p>0.05)。上述结果表明dop基于tams、cd8+t和tregs的免疫响应发挥抗肿瘤作用。
实施例4:tams对dop抗肿瘤免疫应答的影响
为了进一步研究tams、cd8+t和tregs这三种关键免疫细胞分别对dop抗肿瘤免疫应答的影响,利用氯膦酸盐脂质体(clodronateliposome)、anti-cd8a、anti-cd25分别清除hepa1-6荷瘤小鼠体内的巨噬细胞
实验结果如图4至图6所示,其中图4a-e显示,当
实施例5:dop体内靶向性研究
小动物活体成像系统检测dop的肿瘤靶向性:对dop的还原末端进行荧光标记,制备dop-fitc。随机取经适应性饲养一周后的balb/cnu/nu(雄性,6-8周,20±2g)小鼠,将处生长对数期的能稳定表达荧光素酶基因的hepa1-6-luc细胞(1×106个/ml)皮下接种于小鼠右肢前侧,建模期间密切观察小鼠成瘤情况,用游标卡尺测量肿瘤的长径(a)和短径(b),待肿瘤生长至800mm3左右时,单次经口灌胃dop-fitc(200mg/kg),分别在灌胃dop-fitc前0h和灌胃后1、2、3、和4h,使用ivis体内成像系统监测荷瘤小鼠的肿瘤生物发光成像和dop-fitc在体内的荧光成像,以获得连续的光谱图像追踪dop在荷瘤小鼠体内的分布。如图7所示,dop经口灌胃1h后,在小鼠体内检测到dop的荧光信号值,并且几乎分布于小鼠全身部位,在0-4h内随着时间的增加,dop在荷瘤小鼠体内荧光信号值逐渐减弱,说明dop在体内4h后可被代谢。其中在0-2h内观察到dop在肿瘤部位的信号增强,在2h时肿瘤部位荧光达到最强,2h之后dop在肿瘤部位的信号值逐渐减弱,说明dop进入血液之后可以被富集到肿瘤部位。
实施例6:dop与
1、共聚焦显微镜观察dop与
取对数生长期raw264.7细胞,调整细胞浓度为1×105个/ml,接种到含有盖玻片的24孔细胞培养板中,每孔500μl细胞悬液,置于含5%二氧化碳(co2)的37℃培养箱中贴壁12h后,弃去培养基,每孔加入溶于完全培养基的dop-fitc(终浓度200μg/ml),4℃避光孵育1h,弃去培养基,pbs清洗细胞2次,每次5min,然后向细胞中加入4%多聚甲醛,每孔500μl,室温固定30min,吸弃固定液后pbs清洗细胞3次,每次5min,最后加入dapi染料(10μg/ml),室温核染15min,pbs清洗细胞3次,每次5min,将贴有细胞的盖玻片取出倒扣在滴有抗荧光猝灭封片剂的载玻片上,在激光共聚焦显微镜下观察拍照。结果参见图8a,表明dop与
2、流式细胞仪检测
处于生长对数期的raw264.7细胞经胰酶消化计数后,调整细胞悬液浓度为5×106个/ml,分别向100μl细胞悬液中加入终浓度为25、50、100、200、400μg/ml的dop-fitc,于4℃下避光共孵育1h后,pbs清洗细胞,重复清洗3遍,利用流式细胞仪检测dop与raw264.7细胞结合的饱和性;另取一份细胞悬液(100μl)与dop-fitc(100μl,200μg/ml)于4℃下分别孵育15、30、60、120min后,利用流式细胞仪检测dop与raw264.7细胞结合的快速性;取两份100μl细胞悬液,一份与dop-fitc于4℃下避光共孵育1h,另一份先于葡聚糖于4℃下避光共孵育1h,再与dop-fitc于同样条件下孵育1h,利用流式细胞仪检测dop与raw264.7细胞结合特异性;另取2份细胞悬液,一份先与终浓度为200μg/ml的dop-fitc共孵育1h,再与未标记的终浓度为100μg/ml的dop共孵育1h。另一份先与终浓度为200μg/ml的dop-fitc共孵育1h,再与未标记的终浓度为200μg/ml的dop共孵育1h,利用流式细胞仪检测dop与细胞结合的可逆性。在流式检测以上结合性质时,各组设置3个重复平行,同时设置空白细胞悬液对照组和游离的fitc(10μg/ml)与细胞悬液孵育的对照组,上机前细胞悬液均经300目细胞筛过滤。
如图8b所示,与control组和游离的fitc相比,dop-fitc在25-400μg/ml浓度范围内,dop-fitc与raw264.7细胞结合的荧光强度均明显高于control和free-fitc组,且随着dop-fitc浓度的升高,dop-fitc与raw264.7细胞结合的荧光强度也在逐渐增加,当dop-fitc的浓度达到200μg/ml时,结合的荧光强度趋于稳定,说明dop与raw264.7细胞膜表面结合具有饱和性。图8c显示,当与dop-fitc与raw264.7细胞孵育15min时,dop-fitc与raw264.7细胞结合荧光强度明显高于control,说明dop-fitc已经与raw264.7细胞发生结合,且随着孵育时间的延长,dop-fitc的结合强度越高,当孵育时间为60min时,dop-fitc结合的荧光强度达到最大,说明dop与raw264.7细胞膜表面结合具有快速性。图8d和图8e结果显示,dop-fitc与100或200μg/ml未标记的dop发生竞争性结合,而dextran对dop-fitc与raw264.7细胞的结合物竞争性抑制效应。以上结果表明dop与
实施例7:dop与
1、dop与raw264.7细胞结合的受体筛选
取100μlraw264.7细胞悬液(5×106个/ml)先分别与anti-tlr2、tlr4、cr3、dectin-1、mr或同型对照anti-iggmab(10μg/ml)4℃孵育1h,再与dop-fitc(终浓度为200μg/ml)于4℃避光孵育1h,同时取等体积的空白细胞悬液,及游离的fitc(10μg/ml)与raw264.7细胞孵育作为对照,孵育结束后,用pbs洗2遍,300目细胞筛过滤,经流式细胞仪检测。
2、dop与raw264.7细胞结合的受体鉴定
(1)dop亲和磁珠的制备
称取30mg酰肼基磁珠(配置浓度为30mg/ml),加入1mledta(1mm)溶液,分装至两个1.5ml的ep管中,置于磁珠分离器上分离3min,吸弃上清,取下含有磁珠的离心管,加入1.5ml乙酸钠-乙酸偶联缓冲液(ph4.5,0.1m)预处理磁珠,在漩涡振荡器上混合均匀后,置于磁性分离架上分离3min,吸弃上清液,用偶联缓冲液重复处理磁珠三次后,重悬于1.5ml乙酸钠-乙酸偶联缓冲液中,加入dop(终浓度200μg/ml)置于37℃800rpm的摇床上偶联反应16h。反应结束后,收集混合液置于磁珠分离器上分离,吸弃上清,加入双蒸水冲洗磁珠,重复5次,最终得到dop亲和磁珠。
(2)受体靶蛋白的分离与鉴定
首先,利用膜蛋白抽提试剂盒提取raw264.7细胞膜蛋白(总膜蛋白,totalprotein),将膜蛋白溶液(1mg/ml)先于未偶联dop的磁珠在37℃孵育1h(除去非特异性结合蛋白),然后置于磁珠分离器上分离3min,吸取上清后平分成两份,一份保留跑电泳(未偶联蛋白,proteinknockout1)另一份再与dop亲和磁珠在37℃孵育1h,置于磁珠分离器中分离3min,吸取上清保留后(proteinknockout2),向磁珠中加入1mlglycine-hcl洗脱缓冲液(ph2.2,0.2m),洗脱10min后立即加入1mltris-hcl(1.5m,ph8.8)进行中和,收集含有目的蛋白的溶液,利用3kda超滤管对其进行浓缩(4000g,40min)最终获得靶蛋白(targetprotein)。
接下来对上述分离的totalprotein、proteinknockout1、proteinknockout2和targetprotein进行sds-page,根据标准蛋白marker的分子量,分析鉴定经dop-磁珠纯化后的靶蛋白分子量及纯度,初步分析受体类型;同时利用亲和电泳检测dop与靶蛋白结合的专一性,电泳前先将目的蛋白与dop或dextran或anti-tlr2抗体于37℃孵育处理1h,同时设置不做处理的目的蛋白为对照,然后进行非变性电泳,观察比较目的蛋白在凝胶中的迁移情况;最后利用anti-tlr2(1:1000)抗体作western-blotting进一步鉴定受体蛋白。
(3)dop与raw264.7细胞结合的受体验证
流式细胞仪筛选出dop结合的受体后,利用激光共聚焦进一步验证,首先采用受体的抗体中和受体的抑制剂阻断,即raw264.7细胞悬液依次分别用anti-tlr2抗体(终浓度10μl/ml)、tlr2受体抑制剂(c29,终浓度10μm)进行预处理(4℃孵育1h),以干预tlr2的表达,然后加入dop(200μg/ml)继续孵育1h,同时设置anti-tlr2的同型抗体igg对照和空白组对照,各组细胞经清洗、固定、核染色后于激光共聚焦显微镜下观察拍照。其次利用rna干扰实验即选用特异性干扰tlr2基因表达的rna干扰试剂盒,按照试剂盒说明书对raw264.7细胞进行转染,沉默tlr2靶基因,设置无特异性靶向的非同源序列sirna(c-sirna)转染细胞为阴性对照,将转染的细胞培养24h后,再与dop-fitc(终浓度为200μg/ml)于4℃避光孵育1h,流式细胞仪和激光共聚焦检测确认dop是否通过tlr2与raw264.7细胞结合。为进一步观察dop与tlr2结合的位点,将dop-fitc与raw264.7细胞在4℃避光孵育1h,经4%多聚甲醛固定后,加入3%bsa,室温封闭30min,吸弃封闭液,加入anti-tlr2(5μg/ml)4℃孵育过夜后,置于脱色摇床上晃动洗涤3次,每次5min,然后加入pe标记的anti-rabbitigg二抗,室温孵育50min,pbs清洗细胞后加入dapi进行核染15min,于激光共聚焦显微镜下观察拍照。
获得结果如下:
如图9a所示,流式细胞仪分析结果显示anti-tlr4+f-dop、anti-cr3+f-dop、anti-dectin-1+f-dop和anti-mr+f-dop与f-dop的荧光强度相近,说明anti-tlr4、anti-cr3、anti-dectin-1和anti-mr抗体对dop与
为进一步确认dop靶向识别raw264.7膜表面的受体蛋白,接下来,本实验通过构建dop亲和磁珠分离纯化出与dop结合的靶蛋白,经sds-page鉴定,如图10a所示,经dop亲和磁珠分离的目标靶蛋白分子量约89kda,接近tlr2蛋白分子量。图10b亲和电泳显示,分离的目标靶蛋白与dop共孵育后,在凝胶迁移中发生阻滞现象,而与dextran共孵育后在凝胶迁移中不受影响,说明dop可以特异性直接结合目标蛋白,同时,靶蛋白与anti-tlr2抗体孵育后也发生阻滞迁移现象。图10c中anti-tlr2抗体的westernblotting进一步验证了靶蛋白是tlr2。以上结果揭示tlr2是
实施例8:dop通过靶向识别tlr2介导tams极化发挥抗肿瘤免疫应答
1、dop通过调控tams极化对cd8+t细胞和tregs的免疫调节效应分析
取小鼠骨髓来源的bmdm细胞以5×104个/cm2接种于含有条件培养基cm(hepa1-6细胞上清)的24孔transwell小室(0.4μmporediameter)上层,与此同时,取小鼠脾细胞以5×104个/ml接种于transwell小室下层,置于含5%co2的37℃培养箱中培养48h,建立共培养体系。在含有bmdm单细胞层的共培养体系上顶层室中加入dop(200μg/ml),等体积的培养液作空白对照,于37℃、5%co2培养箱中刺激培养24h。培养结束后,分别收集上层和下层中基底侧细胞,流式细胞仪检测上层细胞中m1型巨噬细胞(f4/80+cd11b+cd11c+)、m2型巨噬细胞(f4/80+cd11b+cd206+)比例变化和下层细胞中cd8+t细胞(cd3+cd8+)和tregs(cd4+cd25+foxp3+)细胞比例。
结果如图11和12所示,与空白培养基处理的对照组相比,dop显著刺激了上层bmdm细胞中m1型细胞比例(图11a和图11c),抑制了m2型细胞比例(图11b和图11d),并且在dop刺激上层bmdm细胞后显著促进了下层脾细胞中cd8+t细胞的比例(图12a和图12c),降低了tregs比例(图12b和图12d)。
2、tlr2被干预后dop对共培养体系中tams极化和关键因子含量的测定
共培养体系中处于上顶层的bmdm细胞依次分别用anti-tlr2抗体(终浓度10μl/ml)、tlr2sirna(50μm)、tlr2受体抑制剂(c29,终浓度10μm)进行预处理,以干预tlr2的表达,同时设置anti-tlr2的同型抗体igg、c-sirna对照组和空白对照,培养处理24h后,加入dop(200μg/ml)共同继续孵育24h,培养结束后分别收集上层和下层细胞,流式细胞仪检测细胞中m1型、m2型、cd8+t和tregs细胞比例变化。
结果参见图11和图12,当bmdm细胞中的tlr2受体分别经anti-tlr2抗体中和或sitlr2基因沉默或c29抑制剂抑制干预处理后,再给予dop刺激作用24h,流式细胞仪观察分析发现,dop刺激上层bmdm细胞向m1型巨噬细胞分化的比例明显降低(图11a和图11c),同时抑制m2型巨噬细胞细胞分化能力减弱(图11b和图11d),并且在下层中cd8+t和tregs细胞的比例与control组相比均无显著差异(图12a-d)。这些结果揭示dop通过tlr2介导tams由m2型向m1型极化进而促进cd8+t细胞增殖分化,抑制tregs细胞分化。
- 还没有人留言评论。精彩留言会获得点赞!