胰岛素受体部分激动剂的制作方法
本申请是申请日为2015年11月19日,申请号为201580074165.6,发明名称为“胰岛素受体部分激动剂”的发明专利申请的分案申请。
本发明涉及在胰岛素受体处作为部分激动剂起作用的胰岛素二聚体和胰岛素类似物二聚体。
背景技术:
胰岛素是i型糖尿病(t1dm)患者和许多ii型糖尿病患者(t2dm)的基本疗法,在过去的十年中在所有抗糖尿病药物使用者中开处方给接近1/3的美国患者。胰岛素的全球市场在2013年是204亿美元,并且正在以比所有其它抗糖尿病剂之和更快的速度增长。但是,当前胰岛素疗法的挑战(包括狭窄的ti至低血糖症和体重增加)限制了它们的更广采用和患者实现理想血糖控制的潜力。
除了响应于膳食的膳食胰岛素分泌以外,胰腺以“基础”速率释放胰岛素,所述“基础”速率主要由血糖水平控制以维持适当的空腹葡萄糖调节。这主要通过内源性胰岛素的肝偏好作用控制肝葡萄糖释放来实现。现代胰岛素类似物包括快速起作用的胰岛素和基础胰岛素、以及这两种的混合物。开发了快速起作用的胰岛素类似物(raa)来控制膳食后高血糖症,而具有延长的作用持续时间的胰岛素调节基础葡萄糖水平。长效胰岛素被所有t1dm使用(与膳食注射剂组合),并且大多数t2dm患者从基础产品开始他们的胰岛素疗法。基础胰岛素消费随着全世界糖尿病人口(特别是t2dm)猛增而快速增加。
尽管在过去的数十年中做出了连续的开发努力,可利用的长效胰岛素与生理学基础胰岛素相比仍然没有得到优化。这部分地因为,主要焦点是在改善这些类似物的pk平坦,而不是固定周围组织的相对过度胰岛素疗法,后者会促进增加的低血糖症风险。所以,低血糖症仍然是给患者造成巨大负担的关键医学风险并造成显著的发病率和死亡率。
技术实现要素:
本发明提供了包含两个胰岛素分子的化合物,所述两个胰岛素分子共价地连接以形成可以活化胰岛素受体的胰岛素分子二聚体,其具有常规的胰岛素样效能,但是具有降低的最大活性。这些化合物是胰岛素受体部分激动剂(ipra):它们像其它胰岛素类似物一样起作用以有效地降低葡萄糖,但是具有更低的低血糖症风险。
提供了胰岛素受体部分激动剂共价胰岛素二聚体,其被配制为与当前护理标准(soc)基础胰岛素相比表现出改善的治疗指数(ti)的新颖的和可转化的基础胰岛素(每天1次施用)。在一个实施方案中,本发明的ipra可以在糖尿病微型猪中有效地降低葡萄糖,具有降低的低血糖症风险,且具有每天1次(qd)基础胰岛素的性能。改善的ti可以使从业人员能够更侵袭性地施用本发明的irpa以实现控制空腹葡萄糖的靶目标。irpa对空腹葡萄糖和hba1c的紧密控制可以允许它充当:1)在t2dm中具有增强的效力和安全性概况的独立长效胰岛素,和2)在t1dm(和一些t2dm)中改善的根本基础胰岛素,其用于与额外的膳食快速起作用的胰岛素类似物(raa)给药一起使用。因而,本发明提供了下述实施方案。
本发明提供了一种胰岛素受体部分激动剂或胰岛素二聚体,其包含第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;且其中所述a-链多肽和所述b-链多肽的至少一个氨基端共价地连接至取代基,前提条件是,所述连接部分不包括二硫键。在特定方面,至少所述第一胰岛素或胰岛素类似物的a-链多肽和b-链多肽的氨基端共价地连接至取代基。
在胰岛素受体部分激动剂或胰岛素二聚体的特定方面,每个a-链多肽和每个b-链多肽的氨基端共价地连接至取代基。在特定方面,所述第一胰岛素或胰岛素类似物的a-链多肽和b-链多肽的氨基端和所述第二胰岛素或胰岛素类似物的a-链多肽和b-链多肽的氨基端各自共价地连接至取代基。在其中所述第一和第二胰岛素或胰岛素类似物的氨基端共价地连接至取代基的实施方案中,在所述第一胰岛素或胰岛素类似物的a-链和b-链多肽的氨基端上的取代基可以与在所述第二胰岛素或胰岛素类似物的a-链和b-链多肽的氨基端上的取代基相同。在其中所述第一和第二胰岛素或胰岛素类似物的氨基端共价地连接至取代基的实施方案中,在所述第一胰岛素或胰岛素类似物的a-链和b-链多肽的氨基端上的取代基可以不同于在所述第二胰岛素或胰岛素类似物的a-链和b-链多肽的氨基端上的取代基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述第一和第二胰岛素或胰岛素类似物异源二聚体是相同的,或其中所述第一和第二胰岛素或胰岛素类似物异源二聚体是不同的。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述连接部分经由在它们各自的b-链多肽的羧基端处或附近的赖氨酸残基的ε氨基共价地连接所述第一胰岛素或胰岛素类似物异源二聚体和所述第二胰岛素或胰岛素类似物异源二聚体。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,每个a-链多肽独立地包含氨基酸序列gx2x3eqccx8sicslyqlx17nx19cx23(seqidno:3),且每个b-链多肽独立地包含氨基酸序列x25lcgx29x30lvealylvcgergfx27ytx31x32(seqidno:4)或x22vnqx25x26cgx29x30lvealylvcgergfx27ytx31x32x33x34x35(seqidno:5),其中x2是异亮氨酸或苏氨酸;x3是缬氨酸、甘氨酸或亮氨酸;x8是苏氨酸或组氨酸;x17是谷氨酸或谷氨酰胺;x19是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸;x23是天冬酰胺或甘氨酸;x22是苯丙氨酸或脱氨基-苯丙氨酸;x25是组氨酸或苏氨酸;x26是亮氨酸或甘氨酸;x27是苯丙氨酸或天冬氨酸;x29是丙氨酸、甘氨酸或丝氨酸;x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;x31是天冬氨酸、脯氨酸或赖氨酸;x32是赖氨酸或脯氨酸;x33是苏氨酸、丙氨酸或不存在;x34是精氨酸或不存在;且x35是精氨酸或不存在;前提条件是,x31或x32中的至少一个是赖氨酸。
在胰岛素受体部分激动剂或胰岛素二聚体的特定方面,所述第一和第二胰岛素或胰岛素类似物独立地是天然人胰岛素、赖脯胰岛素、门冬胰岛素、desb30胰岛素或甘精胰岛素。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在另一个方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
本发明还提供了一种胰岛素受体部分激动剂或胰岛素二聚体,其包含式
d1-l-d2
其中d1和d2各自独立地是胰岛素或胰岛素类似物多肽,其中每个胰岛素多肽是包含通过链间二硫键连接在一起的a-链多肽和b-链多肽的异源二聚体;l是连接部分,其中所述接头部分的一个末端连接至在d1的羧基处或附近的氨基酸残基,且所述接头部分的另一个末端连接至在d2的羧基末端处或附近的氨基酸残基,前提条件是,l不包括二硫键;且其中所述第一和第二胰岛素或胰岛素类似物多肽包括连接至所述a-链多肽和所述b-链多肽的氨基端的取代基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,d1和d2是相同的,或其中d1和d2是不同的。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分经由在d1和d2的羧基端处或附近的赖氨酸残基的ε氨基共价地连接d1和d2。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,每个a-链多肽独立地包含氨基酸序列gx2x3eqccx8sicslyqlx17nx19cx23(seqidno:3),且每个b-链多肽独立地包含氨基酸序列x25lcgx29x30lvealylvcgergfx27ytx31x32(seqidno:4)或x22vnqx25x26cgx29x30lvealylvcgergfx27ytx31x32x33x34x35(seqidno:5),其中x2是异亮氨酸或苏氨酸;x3是缬氨酸、甘氨酸或亮氨酸;x8是苏氨酸或组氨酸;x17是谷氨酸或谷氨酰胺;x19是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸;x23是天冬酰胺或甘氨酸;x22是苯丙氨酸或脱氨基-苯丙氨酸;x25是组氨酸或苏氨酸;x26是亮氨酸或甘氨酸;x27是苯丙氨酸或天冬氨酸;x29是丙氨酸、甘氨酸或丝氨酸;x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;x31是天冬氨酸、脯氨酸或赖氨酸;x32是赖氨酸或脯氨酸;x33是苏氨酸、丙氨酸或不存在;x34是精氨酸或不存在;且x35是精氨酸或不存在;前提条件是,x31或x32中的至少一个是赖氨酸。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,其中d1和d2独立地是天然人胰岛素、赖脯胰岛素、门冬胰岛素、desb30胰岛素或甘精胰岛素。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
还提供了组合物,其包含前述胰岛素受体部分激动剂或胰岛素二聚体中的任一种和药学上可接受的载体。
本发明还提供了一种胰岛素受体部分激动剂或胰岛素二聚体,其包含第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;且任选地,其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基,前提条件是,(1)所述连接部分不包括二硫键,和(2)当所述胰岛素或胰岛素类似物不是人胰岛素或胰岛素类似物且所述a-链多肽和所述b-链多肽的氨基端不包括取代基时,那么所述连接部分不是草酰基(c2)部分、辛二酰基(c8)部分或十二烷二酰基(c12)部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述第一和第二胰岛素或胰岛素类似物异源二聚体是相同的,或其中所述第一和第二胰岛素或胰岛素类似物异源二聚体是不同的。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分经由在它们各自的b-链多肽的羧基端处或附近的赖氨酸残基的ε氨基共价地连接所述第一胰岛素或胰岛素类似物异源二聚体和所述第二胰岛素或胰岛素类似物异源二聚体。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述第一和第二胰岛素或胰岛素类似物独立地是天然人胰岛素、赖脯胰岛素、门冬胰岛素、desb30胰岛素或甘精胰岛素。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,每个a-链多肽独立地包含氨基酸序列gx2x3eqccx8sicslyqlx17nx19cx23(seqidno:3),且每个b-链多肽独立地包含氨基酸序列x25lcgx29x30lvealylvcgergfx27ytx31x32(seqidno:4)或x22vnqx25x26cgx29x30lvealylvcgergfx27ytx31x32x33x34x35(seqidno:5),其中x2是异亮氨酸或苏氨酸;x3是缬氨酸、甘氨酸或亮氨酸;x8是苏氨酸或组氨酸;x17是谷氨酸或谷氨酰胺;x19是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸;x23是天冬酰胺或甘氨酸;x22是苯丙氨酸或脱氨基-苯丙氨酸;x25是组氨酸或苏氨酸;x26是亮氨酸或甘氨酸;x27是苯丙氨酸或天冬氨酸;x29是丙氨酸、甘氨酸或丝氨酸;x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;x31是天冬氨酸、脯氨酸或赖氨酸;x32是赖氨酸或脯氨酸;x33是苏氨酸、丙氨酸或不存在;x34是精氨酸或不存在;且x35是精氨酸或不存在;前提条件是,x31或x32中的至少一个是赖氨酸。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分是c2-c20酰基部分。
在特定方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
还提供了组合物,其包含前述胰岛素受体部分激动剂或胰岛素二聚体中的任一种和药学上可接受的载体。
本发明还提供了一种胰岛素受体部分激动剂或胰岛素二聚体,其包含式
d1-l-d2
其中d1和d2各自独立地是胰岛素或胰岛素类似物多肽,其中每个胰岛素多肽是包含通过链间二硫键连接在一起的a-链多肽和b-链多肽的异源二聚体;l是连接部分,其中所述接头部分的一个末端连接至在d1的羧基处或附近的氨基酸残基,且所述接头部分的另一个末端连接至在d2的羧基末端处或附近的氨基酸残基,前提条件是,l不包括二硫键;且任选地,其中d1或d2中的至少一个包括与d1或d2的a-链多肽或b-链多肽的氨基端连接的取代基;前提条件是,(1)所述连接部分不包括二硫键,和(2)当所述a-链多肽和所述b-链多肽的氨基端不包括取代基时,那么所述连接部分不是草酰基(c2)部分、辛二酰基(c8)部分或十二烷二酰基(c12)部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,d1和d2是相同的,或其中d1和d2是不同的。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分经由在d1和d2的羧基端处或附近的赖氨酸残基的ε氨基共价地连接d1和d2。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,d1和d2独立地是天然人胰岛素、赖脯胰岛素、门冬胰岛素、desb30胰岛素或甘精胰岛素。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,每个a-链多肽独立地包含氨基酸序列gx2x3eqccx8sicslyqlx17nx19cx23(seqidno:3),且每个b-链多肽独立地包含氨基酸序列x25lcgx29x30lvealylvcgergfx27ytx31x32(seqidno:4)或x22vnqx25x26cgx29x30lvealylvcgergfx27ytx31x32x33x34x35(seqidno:5),其中x2是异亮氨酸或苏氨酸;x3是缬氨酸、甘氨酸或亮氨酸;x8是苏氨酸或组氨酸;x17是谷氨酸或谷氨酰胺;x19是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸;x23是天冬酰胺或甘氨酸;x22是苯丙氨酸或脱氨基-苯丙氨酸;x25是组氨酸或苏氨酸;x26是亮氨酸或甘氨酸;x27是苯丙氨酸或天冬氨酸;x29是丙氨酸、甘氨酸或丝氨酸;x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;x31是天冬氨酸、脯氨酸或赖氨酸;x32是赖氨酸或脯氨酸;x33是苏氨酸、丙氨酸或不存在;x34是精氨酸或不存在;且x35是精氨酸或不存在;前提条件是,x31或x32中的至少一个是赖氨酸。
在所述胰岛素受体部分激动剂或胰岛素二聚体的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂或胰岛素二聚体的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂或胰岛素二聚体的另一个方面,所述连接部分是c2-c20酰基部分。
在特定方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
本发明还提供了一种胰岛素类似物二聚体,其包含:
第一胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;其中所述胰岛素类似物选自赖脯胰岛素、门冬胰岛素和甘精胰岛素;且任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基,前提条件是,所述连接部分不包括二硫键。
在所述胰岛素受体部分激动剂的另一个方面,所述第一和第二胰岛素或胰岛素类似物异源二聚体是相同的,或其中所述第一和第二胰岛素或胰岛素类似物异源二聚体是不同的。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分经由在它们各自的b-链多肽的羧基端处或附近的赖氨酸残基的ε氨基共价地连接所述第一胰岛素或胰岛素类似物异源二聚体和所述第二胰岛素或胰岛素类似物异源二聚体。
在所述胰岛素受体部分激动剂的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂的另一个方面,所述第一和第二胰岛素或胰岛素类似物中的至少一个还缀合至聚乙二醇、糖部分或杂环。
在所述胰岛素受体部分激动剂的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分是c2-c20酰基部分。
在特定方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
本发明还提供了一种胰岛素类似物二聚体,其包含式
d1-l-d2
其中d1和d2各自独立地是胰岛素或胰岛素类似物多肽,其中每个胰岛素多肽是包含通过链间二硫键连接在一起的a-链多肽和b-链多肽的异源二聚体;l是连接部分,其中所述接头部分的一个末端连接至在d1的羧基处或附近的氨基酸残基,且所述接头部分的另一个末端连接至在d2的羧基末端处或附近的氨基酸残基,前提条件是,l不包括二硫键;其中所述胰岛素类似物选自赖脯胰岛素、门冬胰岛素和甘精胰岛素;且任选地,其中d1或d2中的至少一个包括与d1或d2的a-链多肽或b-链多肽的氨基端连接的取代基;前提条件是,所述连接部分不包括二硫键。
在所述胰岛素受体部分激动剂的另一个方面,d1和d2是相同的,或其中d1和d2是不同的。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分经由在d1和d2的羧基端处或附近的赖氨酸残基的ε氨基共价地连接d1和d2。
在所述胰岛素受体部分激动剂的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分是c2-c20酰基部分。
在特定方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
本发明提供了一种胰岛素受体部分激动剂,其包含第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基;且其中所述胰岛素受体部分激动剂对人胰岛素受体(ir)的最大应答是天然人胰岛素对ir的最大应答的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%,如通过功能性磷酸化测定所确定的;或者
第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基;且其中所述胰岛素受体部分激动剂对人胰岛素受体(ir)的最大应答是天然人胰岛素对ir的最大应答的20%至70%、40%至70%、50%至70%、40%至60%、或20%至40%,如通过功能性磷酸化测定所确定的;或者
第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基;且其中所述胰岛素受体部分激动剂对人胰岛素受体(ir)的最大应答是天然人胰岛素对ir的最大应答的至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%,如通过功能性磷酸化测定所确定的;或者
第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基;且其中所述胰岛素受体部分激动剂对人胰岛素受体(ir)的最大应答小于天然人胰岛素对ir的最大应答的70%,如通过功能性磷酸化测定所确定的;或者
第一胰岛素或胰岛素类似物异源二聚体和第二胰岛素或胰岛素类似物异源二聚体,每个异源二聚体包括a-链多肽和b-链多肽,其中所述a-链多肽和所述b-链多肽通过链间二硫键连接在一起;其中所述第一和第二胰岛素或胰岛素类似物异源二聚体通过连接部分共价地连接在一起,所述连接部分连接在两个b-链多肽各自的羧基端处或附近的氨基酸的侧链;任选地其中所述第一胰岛素多肽或第二胰岛素多肽的a-链多肽和b-链多肽中的至少一个的氨基端共价地连接至取代基;且其中所述胰岛素受体部分激动剂对人胰岛素受体(ir)的最大应答是天然人胰岛素对ir的最大应答的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%,如通过功能性磷酸化测定所确定的。
在以上实施方案中,所述功能性磷酸化测定可以是胰岛素受体(ir)akt-磷酸化测定。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分不包括二硫键,且当所述a-链多肽和所述b-链多肽的氨基端不包括取代基时,所述连接部分不是草酰基(c2)部分、辛二酰基(c8)部分或十二烷二酰基(c12)部分。
在所述胰岛素受体部分激动剂的另一个方面,所述第一和第二胰岛素或胰岛素类似物异源二聚体是相同的,或其中所述第一和第二胰岛素或胰岛素类似物异源二聚体是不同的。
在所述胰岛素受体部分激动剂的另一个方面,其中所述连接部分经由在它们各自的b-链多肽的羧基端处或附近的赖氨酸残基的ε氨基共价地连接所述第一胰岛素或胰岛素类似物异源二聚体和所述第二胰岛素或胰岛素类似物异源二聚体。
在所述胰岛素受体部分激动剂的再一个方面,所述取代基具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、peg、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基选自乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基、异丁基、甲氧基乙酰基、甘氨酸、氨基乙基葡萄糖(aeg)、aeg-c6、peg1、peg2、n-二甲基和烷氧基羰基。
在所述胰岛素受体部分激动剂的另一个方面,所述第一和第二胰岛素或胰岛素类似物独立地是天然人胰岛素、赖脯胰岛素、门冬胰岛素、desb30胰岛素或甘精胰岛素。
在所述胰岛素受体部分激动剂的特定方面,每个a-链多肽独立地包含氨基酸序列gx2x3eqccx8sicslyqlx17nx19cx23(seqidno:3),且每个b-链多肽独立地包含氨基酸序列x25lcgx29x30lvealylvcgergfx27ytx31x32(seqidno:4)或x22vnqx25x26cgx29x30lvealylvcgergfx27ytx31x32x33x34x35(seqidno:5),其中x2是异亮氨酸或苏氨酸;x3是缬氨酸、甘氨酸或亮氨酸;x8是苏氨酸或组氨酸;x17是谷氨酸或谷氨酰胺;x19是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸;x23是天冬酰胺或甘氨酸;x22是苯丙氨酸或脱氨基-苯丙氨酸;x25是组氨酸或苏氨酸;x26是亮氨酸或甘氨酸;x27是苯丙氨酸或天冬氨酸;x29是丙氨酸、甘氨酸或丝氨酸;x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;x31是天冬氨酸、脯氨酸或赖氨酸;x32是赖氨酸或脯氨酸;x33是苏氨酸、丙氨酸或不存在;x34是精氨酸或不存在;且x35是精氨酸或不存在;前提条件是,x31或x32中的至少一个是赖氨酸。
在所述胰岛素受体部分激动剂的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在所述胰岛素受体部分激动剂的再一个方面,所述连接部分是酰基部分、-c(o)rc(o)-,其中r是烷基链、聚(乙二醇)(peg)链、含有酰胺的链、含有三唑的链、含有环辛炔的部分、被取代的酰基链或聚乙二醇(peg)链。
在所述胰岛素受体部分激动剂的另一个方面,所述连接部分是c2-c20酰基部分。
在特定方面,所述连接部分是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45,包括、但不限于草酰基(c2)部分、琥珀酰基(c4)部分、已二酰基(c6)部分、辛二酰基(c8)部分、癸二酰基(c10)部分、十二烷二酰基(c12)部分、十四烷二酰基(c14)部分或十六烷二酰基(c16)部分。
本发明还提供了一种胰岛素二聚体,其包含具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys和具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys,所述lys通过选自以下的双功能接头缀合在一起:接头1、接头2、接头3、接头10、接头11、接头12、接头13、接头14、接头15、接头16、接头17、接头18、接头19、接头20、接头21、接头22、接头23、接头24、接头25、接头26、接头27、接头28、接头29、接头30、接头31、接头32、接头33、接头34、接头35、接头36、接头37、接头38、接头39、接头40、接头41、接头42、接头43、接头44、接头45、接头46、接头47、接头48、接头49和接头50,前提条件是,当所述双功能接头是接头10、接头11、接头12、接头13或接头14时,所述第一或第二a-链或b-链多肽中的至少一个在它的n-端氨基酸处缀合至取代基,或至少所述第一胰岛素异源二聚体分子的n-端氨基酸缀合至取代基,或所述第一胰岛素异源二聚体和第二胰岛素异源二聚体的n-端氨基酸缀合至取代基。
在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖。在特定实施方案中,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
本发明还提供了一种胰岛素二聚体,其包含与选自接头5和接头7的第一接头缀合的具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys和与选自接头4、接头6、接头8和接头9的第二接头缀合的具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys,它们经由所述第一接头和所述第二接头缀合在一起。
在另一个实施方案中,本发明提供了一种胰岛素类似物二聚体,其包含与选自接头5和接头7的第一接头缀合的具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys和与选自接头5和接头7的第二接头缀合的具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys,其中所述第一和第二接头经由具有以下结构的桥连接头缀合在一起
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。
在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖。在特定实施方案中,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
在另一个实施方案中,本发明提供了一种胰岛素类似物二聚体,其包含与选自接头4、接头6、接头8和接头9的第一接头缀合的具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys和与选自接头4、接头6、接头8和接头9的第二接头缀合的具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys,其中所述第一和第二接头经由具有以下结构的桥连接头缀合在一起
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。
在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖。在特定实施方案中,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
本发明还提供了组合物,其包含本文中公开的胰岛素受体部分激动剂中的任一种和药学上可接受的盐。
本发明提供了一种用于治疗糖尿病的方法,所述方法包括给具有糖尿病的个体施用治疗有效量的包含前述胰岛素受体部分激动剂中的任一种的组合物。在特定方面,所述糖尿病是i型糖尿病、ii型糖尿病或妊娠糖尿病。
本发明提供了包含前述胰岛素受体部分激动剂中的任一种的组合物用于治疗糖尿病的用途。在特定方面,所述糖尿病是i型糖尿病、ii型糖尿病或妊娠糖尿病。
本发明提供了本文中公开的胰岛素受体部分激动剂中的任一种用于制备药物的用途,所述药物用于治疗糖尿病。在特定方面,所述糖尿病是i型糖尿病、ii型糖尿病或妊娠糖尿病。
定义
胰岛素-本文使用的该术语是指胰腺的活性成分,其影响动物体内碳水化合物的代谢,且其在糖尿病的治疗中具有价值。该术语包括合成的和通过生物技术衍生出的产物,所述产物在结构、用途和预期效果方面与天然存在的胰岛素相同或类似,并且在糖尿病的治疗中具有价值。该术语是表示51氨基酸异源二聚体的通用词,所述异源二聚体包含具有seqidno:1所示的氨基酸序列的a-链肽和具有seqidno:2所示的氨基酸序列的b-链肽,其中在a链的位置6和11处的半胱氨酸残基通过二硫键连接,在a链的位置7和b链的位置7处的半胱氨酸残基通过二硫键连接,且在a链的位置20和b链的位置19处的半胱氨酸残基通过二硫键连接。
胰岛素类似物或类似物-本文使用的该术语包括含有天然a-链肽和/或b-链肽的一个或多个修饰的任何异源二聚体类似物或单链类似物。修饰包括、但不限于:用一个氨基酸置换选自a4、a5、a8、a9、a10、a12、a13、a14、a15、a16、a17、a18、a19、a21、b1、b2、b3、b4、b5、b9、b10、b13、b14、b15、b16、b17、b18、b20、b21、b22、b23、b26、b27、b28、b29和b30的位置处的天然氨基酸;删除位置b1-4和b26-30中的任一个或全部;或直接地或通过聚合的或非聚合的接头缀合一个或多个酰基、聚乙基甘氨酸(peg)或糖部分(多个糖部分);或它们的任意组合。如本文中公开的n-连接的糖基化胰岛素类似物所举例说明的,该术语还包括已经经过修饰以具有至少一个n-连接的糖基化位点的任何胰岛素异源二聚体和单链类似物,和尤其是其中n-连接的糖基化位点连接至n-聚糖或被n-聚糖占据的实施方案。胰岛素类似物的例子包括、但不限于在公布的国际申请wo20100080606、wo2009/099763和wo2010080609(其公开内容通过引用并入本文)中公开的异源二聚体和单链类似物。单链胰岛素类似物的例子也包括、但不限于在公布的国际申请wo9634882、wo95516708、wo2005054291、wo2006097521、wo2007104734、wo2007104736、wo2007104737、wo2007104738、wo2007096332、wo2009132129;美国专利号5,304,473和6,630,348以及kristensen等人,biochem.j.305:981-986(1995)(它们的公开内容各自通过引用并入本文)中公开的那些。
该术语还包括单链和异源二聚体多肽分子,所述分子对胰岛素受体几乎不具有或根本不具有可检测的活性,但是其已经经过修饰以包括一个或多个氨基酸修饰或置换从而对胰岛素受体具有的活性是天然胰岛素对胰岛素受体的活性的至少1%、10%、50%、75%或90%,且其还包括至少一个n-连接的糖基化位点。在特定方面,所述胰岛素类似物是部分激动剂,所述部分激动剂与天然胰岛素相比对胰岛素受体具有小于80%(或70%)的活性。这些胰岛素类似物(其对胰岛素生长激素受体具有降低的活性且对胰岛素受体具有增强的活性)包括异源二聚体和单链类似物。
单链胰岛素或单链胰岛素类似物-本文使用的该术语包括一组在结构上相关的蛋白,其中a-链肽或功能类似物和b-链肽或功能类似物通过2-35个氨基酸的肽或多肽或非肽聚合的或非聚合的接头共价地连接,且其对胰岛素受体具有的胰岛素活性是天然胰岛素的至少1%、10%、50%、75%或90%。单链胰岛素或胰岛素类似物还包括三个二硫键:第一个二硫键是在a-链或其功能类似物的位置6和11处的半胱氨酸残基之间,第二个二硫键是在a-链或其功能类似物的位置7和b-链或其功能类似物的位置7处的半胱氨酸残基之间,且第三个二硫键是在a-链或其功能类似物的位置20和b-链或其功能类似物的位置19处的半胱氨酸残基之间。
连接肽或c-肽-本文使用的该术语表示单链前胰岛素原-样分子的b-c-a多肽序列的连接部分“c”。具体地,在天然的胰岛素链中,c-肽连接在b-链的位置30处的氨基酸和在a-链的位置1处的氨基酸。该术语可以表示天然胰岛素c-肽、猴c-肽和将b-链连接至a-链的3-35个氨基酸的任意其它肽,因而意在包括在单链胰岛素类似物(参见例如,美国公开的申请号20090170750和20080057004和wo9634882)中和在胰岛素前体分子(诸如公开于wo9516708和美国专利号7,105,314中)中将b-链肽连接至a-链肽的任何肽。
氨基酸修饰-本文使用的该术语表示氨基酸的置换,或者通过向/从氨基酸添加和/或除去化学基团而对氨基酸的衍生化,并且包括用在人蛋白质中常见的20种氨基酸中的任一种以及非典型的或非天然存在的氨基酸置换。非典型氨基酸的商业来源包括sigma-aldrich(milwaukee,wi),chempepinc.(miami,fl)和genzymepharmaceuticals(cambridge,ma)。非典型氨基酸可以购自商业供应商、从头合成、或者从天然存在的氨基酸进行化学修饰或衍生化。
氨基酸置换–如本文使用的,表示用不同的氨基酸残基替换一个氨基酸残基。
保守的氨基酸置换-本文使用的该术语在本文中被定义为以下五组中的一组内的互换:
i.小脂族的、非极性的或弱极性的残基:
ala、ser、thr、pro、gly;
ii.极性的、带负电荷的残基和它们的酰胺:
asp、asn、glu、gln、半胱磺酸和高半胱磺酸;
iii.极性的、带正电荷的残基:
his、arg、lys;鸟氨酸(orn)
iv.大的、脂族的、非极性的残基:
met、leu、ile、val、cys、正亮氨酸(nle)、高半胱氨酸
v.大的、芳族残基:
phe、tyr、trp、乙酰基苯丙氨酸
治疗-本文使用的术语“治疗”表示将本发明的irpa施用给有此需要的受试者,其目的是减轻、解除、改变、改善、提高或影响病症(例如,糖尿病)、病症的一种或多种症状(例如,高血糖症)或向病症的倾向。例如,本文使用的术语“治疗糖尿病”一般表示将血糖水平维持在正常水平附近,且可以包括根据给定的情形增加或降低血糖水平。
药学上可接受的载体-本文使用的该术语包括适合用于施用给有需要的个体或由有需要的个体施用的任何标准的药用载体,诸如磷酸盐缓冲盐水溶液、水、乳剂(诸如油/水或水/油乳剂)和各种类型的润湿剂。该术语还包括美国联邦政府管理机构批准或美国药典中列出的用于动物(包括人类)的任何试剂。
药学上可接受的盐-本文使用的该术语表示保留母体化合物的生物活性的化合物的盐,并且其在生物学或其它方面不是不希望的。本文公开的许多化合物能够通过氨基和/或羧基或其类似基团的存在而形成酸式盐和/或碱式盐。
可以从无机和有机碱制备药学上可接受的碱加成盐。仅作为示例,从无机碱衍生出的盐包括钠盐、钾盐、锂盐、铵盐、钙盐、锌盐和镁盐。从有机碱衍生的盐包括但不限于伯胺、仲胺和叔胺的盐。
可以从无机和有机酸制备药学上可接受的酸加成盐。从无机酸衍生出的盐包括盐酸、氢溴酸、硫酸、硝酸、磷酸等的盐。从有机酸衍生出的盐包括乙酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯-磺酸、水杨酸等的盐。
有效量或治疗有效量–如本文使用的,表示无毒的、但是足量的胰岛素类似物以提供期望的作用。例如,一种预期作用会是高血糖症的预防或治疗。“有效”的量随受试者不同而变化,取决于个体的年龄和一般状况、施用模式等。因而,不总是可能指定确切的“有效量”。不总是可能在施用给有此需要的个体或由有此需要的个体施用之前确定最佳的有效量。但是,本领域普通技术人员使用例行实验可以确定在任何个例中的适当“有效”量。
胃肠外的-本文使用的该术语是指不通过消化道,而是通过某些其它途径,诸如鼻内、吸入、皮下、肌肉内、椎管内或静脉内。
附图说明
图1显示了当以0.69nmol/kg施用给糖尿病微型猪时,二聚体24、18和40相对于rhi的葡萄糖降低效应。
图2a显示了将化合物a与rhi(humulin)进行对比的小鼠中的胰岛素耐量测试(itt)的结果。以72u/kg的剂量和300u/kg的剂量施用化合物a,并以18u/kg的剂量和72u/kg的剂量施用humulin。
图2b显示了将化合物b与rhi(humulin)进行对比的小鼠中的胰岛素耐量测试(itt)的结果。以72u/kg的剂量和300u/kg的剂量施用化合物b,并以18u/kg的剂量和72u/kg的剂量施用humulin。
图2c显示了将二聚体24与rhi(humulin)进行对比的小鼠中的胰岛素耐量测试(itt)的结果。以72u/kg的剂量和300u/kg的剂量施用二聚体24,并以18u/kg的剂量和72u/kg的剂量施用humulin。
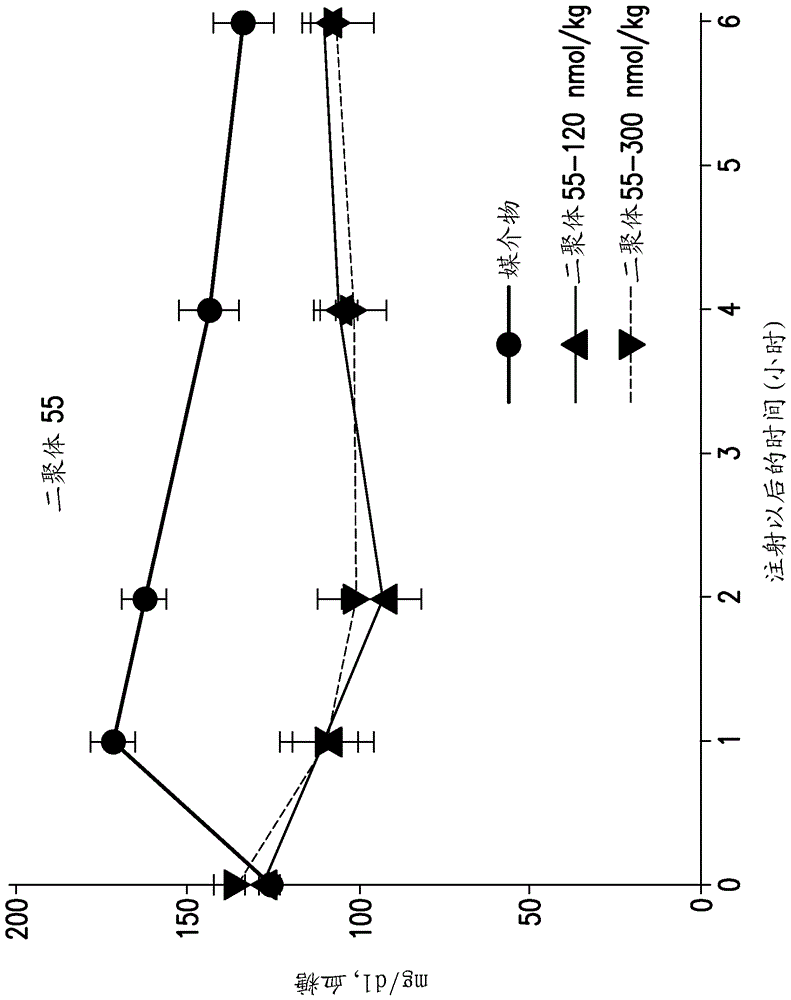
图2d显示了二聚体55在小鼠的胰岛素耐量测试(itt)中的结果。以120nmol/kg的剂量和300nmol/kg的剂量施用二聚体55。
图2e显示了二聚体58在小鼠的胰岛素耐量测试(itt)中的结果。以60nmol/kg的剂量和300nmol/kg的剂量施用二聚体58。
图2f显示了二聚体60在小鼠的胰岛素耐量测试(itt)中的结果。以72nmol/kg的剂量和300nmol/kg的剂量施用二聚体60。
图2g显示了二聚体67在小鼠的胰岛素耐量测试(itt)中的结果。以120nmol/kg的剂量和300nmol/kg的剂量施用二聚体67。
图3表明,通过在没有谷胱甘肽(gsh)存在下与大鼠肾细胞膜(rkcm)一起温育2小时,化合物a胰岛素二聚体被降解成胰岛素单体。由于电离效率的电位差,母体值的百分比仅仅是半定量的。
图4表明,通过在有谷胱甘肽(gsh)存在下与大鼠肾细胞膜(rkcm)一起温育2小时,化合物a胰岛素二聚体被降解成胰岛素单体。由于电离效率的电位差,母体值的百分比仅仅是半定量的。
图5表明,通过在没有谷胱甘肽(gsh)存在下与大鼠肾细胞膜(rkcm)一起温育2小时,二聚体24丢失一些a-链多肽,但是没有降解成单体。由于电离效率的电位差,母体值的百分比仅仅是半定量的。
图6表明,通过在有谷胱甘肽(gsh)存在下与大鼠肾细胞膜(rkcm)一起温育2小时,二聚体24丢失一些a-链多肽,但是没有降解成单体。由于电离效率的电位差,母体值的百分比仅仅是半定量的。
图7a显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体4、5、7、8和9相对于rhi的葡萄糖降低效应。
图7b显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体18、19、20、21和22相对于rhi的葡萄糖降低效应。
图7c显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体23、24、26、27和28相对于rhi的葡萄糖降低效应。
图7d显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体29、32、37、38和39相对于rhi的葡萄糖降低效应。
图7e显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体40、41、43、44和48相对于rhi的葡萄糖降低效应。
图7f显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体55、57、58、60和61相对于rhi的葡萄糖降低效应。
图7g显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体62、64、67、69和71相对于rhi的葡萄糖降低效应。
图7h显示了当以0.69nmol/kg施用给糖尿病微型猪时二聚体72、77和78相对于rhi的葡萄糖降低效应。
具体实施方式
本发明提供了包含两个胰岛素分子的化合物,所述两个胰岛素分子共价地连接以形成可以活化胰岛素受体的共价地连接的胰岛素二聚体,其具有常规的胰岛素样效能和降低的最大活性。这些化合物是胰岛素受体部分激动剂(irpa):它们像其它胰岛素类似物一起起作用以有效地降低葡萄糖,但是具有更低的低血糖症风险。
胰岛素二聚体已经公开在:brandenburg等人的美国专利号3,907,763(1973);tatnell等人,biochemj.216:687-694(1983);shüttler和brandenburg,hoppe-seyler’sz.physiol.chem,363,317-330,1982;weiland等人,procnatl.acad.sci.(usa)87:1154-1158(1990);deppe等人,naunyn-schmiedeberg'sarchpharmacol(1994)350:213-217;brandenburg和havenith的美国专利号6,908,897(b2)(2005);knudsen等人,plosone7:e51972(2012);dimarchi等人的wo2011/159895;dimarchi等人的wo2014/052451;和herrera等人,wo2014141165。近年来,胰岛素二聚体已经描述在brant-synthesisandcharacterizationofinsulinreceptorpartialagonistsasaroutetoimproveddiabetestherapy,ph.d.dissertation,indianauniversity(april2015)以及zaykov和dimarchi,posterp212-explorationofthestructuralandmechanisticbasisforpartialagonismofinsulindimers,americanpeptidesymposium,orlandofl(june20-25(2015)。但是,本发明的发明人已经发现,所述二聚体的胰岛素活性和部分激动剂活性的水平随所述二聚体的结构、胰岛素类似物的序列、二聚化接头的长度和连接两个胰岛素多肽的二聚化位点而变化。发明人已经发现,与以高剂量施用的天然胰岛素或其它胰岛素类似物相比,以高剂量施用的本发明的胰岛素二聚体具有降低的促进低血糖症的风险。
本发明提供了部分激动剂共价地连接的胰岛素二聚体,其被配制为与当前护理标准(soc)基础胰岛素相比表现出改善的治疗指数(ti)的新颖的和可转化的基础胰岛素(每天1次施用)。这些分子可以在糖尿病微型猪中有效地降低葡萄糖,具有降低的低血糖症风险,且具有每天1次(qd)基础胰岛素的性能。改善的ti可以使从业人员能够更侵袭性地施用irpa二聚体以实现控制空腹葡萄糖的靶目标。空腹葡萄糖和hba1c的紧密控制可以允许这些分子充当:1)在ii型糖尿病患者(t2dm)中具有增强的效力和安全性概况的独立长效胰岛素,和2)在i型糖尿病患者(t1dm)(和一些t2dm)中改善的根本基础胰岛素,其用于与额外的膳食快速起作用的胰岛素类似物(raa)给药一起使用。
一种理想的长效胰岛素会提供糖尿病患者中的空腹葡萄糖的连续控制,具有非常稳定的和可再现的pk/pd。但是,目前可得到的基础胰岛素(甚至具有改善的pk/pd稳定性和再现性的那些)继续具有狭窄的治疗指数,且低血糖症事件随着葡萄糖水平达到正常血糖目标而增加。这经常可以导致过低剂量给药以避免低血糖症。预见到使用本发明的irpa的治疗会改变该效力:随着剂量增加,通过减弱葡萄糖降低的改变速率,实现低血糖症关联。
胰岛素a和b链
本文中公开了具有胰岛素受体激动剂活性的胰岛素或胰岛素类似物二聚体。所述二聚体的胰岛素活性的水平随所述二聚体的结构、胰岛素类似物的序列、二聚化接头的长度和连接两个胰岛素多肽的二聚化位点而变化。本发明的胰岛素多肽可以包含人胰岛素的天然b和a链序列(分别是seqidno:1和2)或任何已知的其类似物或衍生物,其当在异源双链体中彼此连接时表现出胰岛素激动剂活性。这样的类似物包括,例如,具有a-链和b-链的蛋白,所述a-链和b-链与人胰岛素的a-链和b-链的差别在于具有不会破坏胰岛素类似物的胰岛素活性的一个或多个氨基酸缺失、一个或多个氨基酸置换、和/或一个或多个氨基酸插入。
一类胰岛素类似物,“单体胰岛素类似物”,是本领域众所周知的。这些是人胰岛素的速效类似物,包括,例如,胰岛素类似物,其中:
(a)在位置b28处的氨基酰基残基被asp、lys、leu、val或ala置换,且在位置b29处的氨基酰基残基是lys或pro;
(b)在位置b27和b30中的任一个处的氨基酰基残基被删除或者被非天然氨基酸置换。
在一个实施方案中,提供了一种胰岛素类似物,其包含在位置b28处被置换的asp(例如,门冬胰岛素(novolog);参见seqidno:9)或在位置28处被置换的lys和在位置b29处被置换的脯氨酸(例如,赖脯胰岛素(humalog);参见seqidno:6)。额外的单体胰岛素类似物公开在chance,等人,美国专利号5,514,646;chance,等人,美国专利申请系列号08/255,297;brems,等人,proteinengineering,5:527-533(1992);brange,等人,epo公开号214,826(1987年3月18日公布);和brange,等人,currentopinioninstructuralbiology,1:934-940(1991)。这些公开内容明确地通过引用并入本文用于描述单体胰岛素类似物。
胰岛素类似物还可以具有酸性形式对酰胺化的氨基酸的替换。例如,可以用asp或glu替换asn。同样地,可以用asp或glu替换gln。具体地,可以用asp或glu替换asn(a18)、asn(a21)、或asp(b3)、或那些残基的任意组合。并且,可以用asp或glu替换gln(a15)或gln(b4)或二者。
如本文中公开的,提供了包含人胰岛素的b链和a链或其类似物或衍生物的胰岛素单链类似物,其中所述b链的羧基端经由连接部分连接至所述a链的氨基端。在一个实施方案中,所述a链是氨基酸序列giveqcctsicslyqlenycn(seqidno:1),且所述b链包含氨基酸序列fvnqhlcgshlvealylvcgergffytpkt(seqidno:2)或缺失b30的其羧基缩短序列和那些序列的类似物,其中每个序列被修饰成包含在与选自a5、a8、a9、a10、a14、a15、a17、a18、a21、b1、b2、b3、b4、b5、b9、b10、b13、b14、b20、b22、b23、b26、b27、b28、b29和b30的天然胰岛素位置对应的位置处的1-5个氨基酸置换,前提条件是,b28或b29中的至少一个是赖氨酸。在一个实施方案中,所述氨基酸置换是保守的氨基酸置换。在这些位置处不会不利地影响胰岛素的期望活性的合适氨基酸置换是本领域技术人员已知的,如例如在以下文献中证实的:mayer,等人,insulinstructureandfunction,biopolymers.2007;88(5):687-713,其公开内容通过引用并入本文。
根据一个实施方案,所述胰岛素类似物肽可以包含胰岛素a链和胰岛素b链或其类似物,其中所述a链包含在天然肽的长度上与giveqcctsicslyqlenycn(seqidno:1)具有至少70%序列同一性(例如,70%、75%、80%、85%、90%、95%)的氨基酸序列,且所述b链包含在天然肽的长度上与fvnqhlcgshlvealylvcgergffytpkt(seqidno:2)具有至少60%序列同一性(例如,60%、65%、70%、75%、80%、85%、90%、95%)的氨基酸序列或缺失b30的其羧基缩短序列。
可以将额外氨基酸序列添加至本发明的胰岛素多肽的b链的氨基端或a链的羧基端。例如,可以将一系列带负电荷的氨基酸添加至b链的氨基端,包括例如1-12、1-10、1-8或1-6个氨基酸长度的肽,且其包含一个或多个带负电荷的氨基酸,包括例如谷氨酸和天冬氨酸。在一个实施方案中,所述b链氨基端延伸包含1-6个带电荷的氨基酸。根据一个实施方案,公开的胰岛素多肽包含c-端酰胺或酯替代a链上的c-端羧酸酯。
在不同的实施方案中,所述胰岛素类似物具有相对于人胰岛素已经迁移的等电点。在某些实施方案中,所述等电点的迁移通过向胰岛素a-链肽的n-端和/或胰岛素b-链肽的c-端添加一个或多个精氨酸、赖氨酸或组氨酸残基而实现。这样的胰岛素多肽的例子包括arga0-人胰岛素、argb31argb32-人胰岛素、glya21argb31argb32-人胰岛素、arga0argb31argb32-人胰岛素和arga0glya21argb31argb32-人胰岛素。作为其它例子,甘精胰岛素(lantus;参见seqidno:7和8)是一种示例性的长效胰岛素类似物,其中asna21已经被甘氨酸替换,且两个精氨酸残基已经共价地连接至b-肽的c-端。这些氨基酸变化的效应是转移分子的等电点,由此产生在酸性ph(例如,ph4-6.5)可溶性的、但是在生理ph不溶性的分子。当将甘精胰岛素的溶液注射进肌肉中时,溶液的ph被中和且甘精胰岛素形成在注射以后24小时时段内缓慢地释放甘精胰岛素的微沉淀物,没有显著的胰岛素峰,且因而减小诱导低血糖症的风险。该概况允许每天一次给药以提供患者的基础胰岛素。因而,在某些实施方案中,所述胰岛素类似物包含a-链肽(其中在位置a21处的氨基酸是甘氨酸)和b-链肽(其中在位置b31和b32处的氨基酸是精氨酸)。本发明包括这些突变和本文描述的任意其它突变的所有单一和多个组合(例如,glya21-人胰岛素、glya21argb31-人胰岛素、argb31argb32-人胰岛素、argb31-人胰岛素)。
在所述胰岛素受体部分激动剂的特定方面,所述胰岛素类似物的一个或多个酰胺化的氨基酸被酸性氨基酸或另一种氨基酸替换。例如,天冬酰胺可以被天冬氨酸或谷氨酸或另一种残基替换。同样地,谷氨酰胺可以被天冬氨酸或谷氨酸或另一种残基替换。具体地,asna18、asna21或asnb3、或那些残基的任意组合可以被天冬氨酸或谷氨酸或另一种残基替换。glna15或glnb4或二者可以被天冬氨酸或谷氨酸或另一种残基替换。在所述胰岛素受体部分激动剂的特定方面,所述胰岛素类似物具有在位置a21处的天冬氨酸或另一种残基、或在位置b3处的天冬氨酸或另一种残基、或二者。
本领域技术人员会认识到,可能用其它氨基酸替换胰岛素类似物中的其它氨基酸,同时保留所述分子的生物活性。例如,但不限于,下述修饰也是本领域中广泛接受的:用天冬氨酸替换位置b10的组氨酸残基(hisb10至aspb10);用天冬氨酸替换在位置b1处的苯丙氨酸残基(pheb1至aspb1);用丙氨酸替换在位置b30处的苏氨酸残基(thrb30至alab30);用丙氨酸替换在位置b26处的酪氨酸残基(tyrb26至alab26);和用天冬氨酸替换在位置b9处的丝氨酸残基(serb9至aspb9)。
在不同的实施方案中,所述胰岛素类似物具有延长的作用该黄。因而,在某些实施方案中,所述胰岛素类似物可以被脂肪酸酰化。也就是说,在胰岛素类似物上的氨基和脂肪酸的羧酸基团之间形成酰胺键。所述氨基可以是胰岛素类似物的n-端氨基酸的α-氨基,或可以是胰岛素类似物的赖氨酸残基的ε-氨基。所述胰岛素类似物可以在存在于野生型人胰岛素中的三个氨基中的一个或多个处被酰化,可以在已经引入野生型人胰岛素序列中的赖氨酸残基上被酰化。在所述胰岛素受体部分激动剂的特定方面,所述胰岛素类似物可以在位置a1、b1、或a1和b1二者处被酰化。在某些实施方案中,所述脂肪酸选自肉豆蔻酸(c14)、十五烷酸(c15)、棕榈酸(c16)、十七烷酸(c17)和硬脂酸(c18)。
胰岛素类似物的例子可以参见例如公开的国际申请wo9634882、wo95516708、wo20100080606、wo2009/099763和wo2010080609、美国专利号6,630,348,和kristensen等人,biochem.j.305:981-986(1995),其公开内容通过引用并入本文)。在其它实施方案中,所述体外糖基化的或体内n-糖基化的胰岛素类似物可以被酰化和/或聚乙二醇化。
根据一个实施方案,提供了一种胰岛素类似物,其中胰岛素肽的a链包含序列giveqccx8sicslyqlx17nx19cx23(seqidno:3),且b链包含序列x25lcgx29x30lvealylvcgergffytx31x32(seqidno:4),其中
x8是苏氨酸或组氨酸;
x17是谷氨酸或谷氨酰胺;
x19是酪氨酸、4-甲氧基-苯丙氨酸或4-氨基苯丙氨酸;
x23是天冬酰胺或甘氨酸;
x25是组氨酸或苏氨酸;
x29是丙氨酸、甘氨酸或丝氨酸;
x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;
x31是脯氨酸或赖氨酸;且
x32是脯氨酸或赖氨酸,前提条件是,x31或x32中的至少一个是赖氨酸。
在另一个实施方案中,所述b链包含序列x22vnqx25lcgx29x30lvealylvcgergffyt-x31x32x33x34x35(seqidno:5),其中
x22是苯丙氨酸或脱氨基-苯丙氨酸;
x25是组氨酸或苏氨酸;
x29是丙氨酸、甘氨酸或丝氨酸;
x30是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸;
x31是天冬氨酸、脯氨酸或赖氨酸;
x32是赖氨酸或脯氨酸;
x33是苏氨酸、丙氨酸或不存在;
x34是精氨酸或不存在;且
x35是精氨酸或不存在;
前提条件是,x31或x32中的至少一个是赖氨酸。
连接部分
本文中公开的胰岛素二聚体是在第一和第二胰岛素多肽之间形成,其中每个胰岛素多肽包含a链和b链。所述第一和第二胰岛素多肽可以是双链胰岛素类似物(即,其中所述a和b链仅经由内部半胱氨酸残基之间的链间二硫键相连),其中所述第一和第二胰岛素多肽通过共价键、双功能接头彼此连接以形成二聚体,或使用铜(i)催化的炔烃-叠氮化物环加成(cuaac)点击化学或无铜点击化学连接各个b链上的连接部分。根据一个实施方案,所述第一和第二胰岛素多肽通过双功能接头彼此连接,所述双功能接头将第一胰岛素多肽的b链的b28或b29赖氨酸的侧链连接至第二胰岛素多肽的b链的b28或b29氨基酸的侧链。
在所述胰岛素受体部分激动剂的特定方面,所述连接部分可以是任选地被取代的选自以下的基团:酰基、脂族基、杂脂族基、芳基、杂芳基和杂环。所述连接部分可以是二价的、直链的或支链的、饱和的或不饱和的、任选地被取代的c1-c20烃链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分。
在一个实施方案中,所述连接部分包含peg接头、约2-25个乙二醇单元或2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或25个乙二醇单元和任选的一个或多个氨基酸的短直链聚合物。在所述胰岛素受体部分激动剂的特定方面,所述peg接头包含结构(peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)25。所述peg接头可以是双功能接头,其可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基。与所述第一和第二胰岛素多肽的位置b29或b28处的赖氨酸基团的ε氨基缀合的双功能peg接头的结构可以由以下通式表示
其中n=1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或25,且波浪线指示接头和ε氨基之间的键。将peg缀合至赖氨酸的ε氨基的方法是本领域众所周知的,参见例如,veronese,biomaterials22:405-417(2001)。
在所述胰岛素受体部分激动剂的特定方面,将第一胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基与第二胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基酸缀合的peg连接部分是
其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含含有4、5、6、7、8、9、10、11、12、13、14、15或16个碳的酰基部分。在所述胰岛素受体部分激动剂的特定方面,所述酰基部分是琥珀酰基(4)、已二酰基(c6)、辛二酰基(c8)或十六烷二酰基(c16)部分。所述酰基部分可以包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基。与所述第一和第二胰岛素多肽的位置b29或b28处的赖氨酸基团的ε氨基缀合的双功能酰基接头的结构可以由以下通式表示
其中n=0、1、2、3、4、5、6、7、8、9、10、11或12,且波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在所述胰岛素受体部分激动剂的特定方面,将第一胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基与第二胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基酸缀合的酰基连接部分是
其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在所述胰岛素受体部分激动剂的特定方面,所述双功能酰基接头还可以包括在所述酰基接头的一个或两个末端处的一个或两个氨基酸。例如,在所述胰岛素受体部分激动剂的特定方面,在所述接头的一个或两个末端处的氨基酸是γ谷氨酸(γe),其可以由以下通式表示
其中n=0、1、2、3、4、5、6、7、8、9、10、11或12,且波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含含有酰胺的烷基链双功能接头,所述接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由以下通式表示
其中n=1或2,o=1、2、3、4或5,且波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在一个特定实施方案中,所述连接部分可以具有结构
其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含含有酰胺的烷基链双功能接头,所述接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由以下通式表示
其中n=1、2、3、4或5,o=1或2,p=1、2、3、4或5,且波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在一个特定实施方案中,所述连接部分可以具有结构
其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含含有酰胺的烷基链双功能接头,所述接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,且其可以由以下通式表示
其中n=1或2,o=1、2或3,p=1或2,且波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在一个特定实施方案中,所述连接部分可以具有结构
其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在特定实施方案中,所述连接部分包含环结构,所述环结构给所述连接部分提供刚度。在特定实施方案中,所述环结构包含苄基或饱和的或不饱和的具有3、4、5、6、7或8个碳的脂环族基团。在特定实施方案中,所述脂环族基团包含环丙基、环丁基、环戊基、环己基、环戊基或环辛基。在特定实施方案中,所述不饱和的脂环族基团(环烷烃)包含环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基或环辛烯基。在特定实施方案中,所述环结构还可以包含一个或多个饱和的或不饱和的脂族侧链。在特定实施方案中,所述环结构还可以包含一个或多个脂族侧链,所述脂族侧链包含一个或多个杂原子。在特定实施方案中,所述杂原子是o、s或n。
在特定实施方案中,所述环结构包含杂原子。在特定实施方案中,所述杂原子可以是o、s或n。在特定实施方案中,所述环结构包含苄基或饱和的或不饱和的具有3、4、5、6、7或8个碳的脂环族基团,其中一个或多个碳被选自n、o和s的杂原子置换。包括杂原子的环结构的例子包括、但不限于:环氧乙烷、氮杂环丙烷(ethylenimime)、三甲基氧化物(trimethyloxide)、呋喃、四氢呋喃、噻吩(thiphene)、吡咯烷、吡喃、哌啶、咪唑、噻唑、二噁烷、吗啉、嘧啶、三唑、硫杂环丁烷、1,3-二氮杂环丁烯、2,3-二氢氮杂环丁二烯、1,2-氧杂硫杂环戊烷、异噁唑、噁唑、噻咯(silole)、氧杂环庚烷、thiepine、3,4,5,6-四氢-2h-氮杂环庚三烯、1,4-硫杂氮杂环庚三烯、氮杂环辛烷和thiocane。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,1-二酰基表示
其中r1和r2可以是相同的或不同的,其中r1和r2独立地是键、饱和的或不饱和的c1-c20或c1-c6烷基链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分、聚(乙二醇)(peg)链peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)2,且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,1-二酰基表示
其中n和o独立地是0、1、2、3、4或5,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中r1和r2可以是相同的或不同的,其中r1和r2独立地是键、饱和的或不饱和的c1-c20或c1-c6烷基链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分、聚(乙二醇)(peg)链peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)2,且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中n和o独立地是0、1、2、3、4或5,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,4-二酰基表示
其中r1和r2可以是相同的或不同的,其中r1和r2独立地是键、饱和的或不饱和的c1-c20或c1-c6烷基链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分、聚(乙二醇)(peg)链peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)2,且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,4-二酰基表示
其中n和o独立地是0、1、2、3、4或5,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中m、n和o各自独立地是1或2;r1和r2可以是相同的或不同的,其中r1和r2独立地是键、饱和的或不饱和的c1-c20或c1-c6烷基链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分、聚(乙二醇)(peg)链peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)2,且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中m、n和o各自独立地是1或2;其中p和q独立地是0、1、2、3、4或5,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中m、n和o各自独立地是1或2;其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的环己烷-1,4-二酰基表示
且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的环己烷-1,4-二酰基表示
且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中m和n各自独立地是0、1或2,前提条件是,m和n都不是0;r1和r2可以是相同的或不同的,其中r1和r2独立地是键、饱和的或不饱和的c1-c20或c1-c6烷基链,其中一个或多个亚甲基单元任选地和独立地被-o-、-s-、-n(r)-、-c(o)-、c(o)o-、oc(o)-、-n(r)c(o)-、-c(o)n(r)-、-s(o)-、-s(o)2-、-n(r)so2-、so2n(r)-、杂环基、芳基或杂芳基替代,其中r的每次出现独立地是氢、合适的保护基、酰基部分、芳基烷基部分、脂族部分、芳基部分、杂芳基部分或杂脂族部分、聚(乙二醇)(peg)链peg)2、(peg)3、(peg)4、(peg)5、(peg)6、(peg)7、(peg)8、(peg)9、(peg)10、(peg)11、(peg)12、(peg)13、(peg)14、(peg)15、(peg)16或(peg)2,且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的苯-1,3-二酰基表示
其中m和n各自独立地是1或2;其中p和q独立地是0、1、2、3、4或5,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的1,1-二酰基表示
其中n是1、2、3或4,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在具体实施方案中,所述1,1-二酰基可以具有选自以下的结构
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的1,2-二酰基表示
其中n是1、2、3或4,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在具体实施方案中,所述1,2-二酰基可以具有选自以下的结构
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的1,3-二酰基表示
其中n是1、2或3,其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。在具体实施方案中,所述1,3-二酰基可以具有选自以下的结构
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的1,4-二酰基表示
(1,4-二酰基-c6),其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在另一个实施方案中,所述连接部分包含双功能接头,所述双功能接头可以共价地缀合或连接至所述第一和第二胰岛素多肽的位置b29或b28赖氨酸残基的ε氨基,其可以由具有以下通式的环丁基-1,3-二酰基表示
且其中波浪线指示所述接头与所述胰岛素多肽的位置b29或b28处的赖氨酸的ε氨基之间的键。
在本发明的另一个方面,使用铜催化的叠氮化物-炔烃huisgen环加成(cuaac),特别是cuaac点击化学,可以将所述第一和第二胰岛素多肽缀合到一起。在该方面,所述第一胰岛素多肽的b29或b28赖氨酸的ε氨基缀合至具有近侧端部和远侧端部的接头部分,其中所述接头部分的近侧端部缀合至ε氨基,且所述远侧端部包含叠氮基。在该方面,所述第二胰岛素多肽的b29或b28赖氨酸的ε氨基缀合至具有近侧端部和远侧端部的接头部分,其中所述接头部分的近侧端部缀合至ε氨基,且所述远侧端部包含炔烃基。在有cu2+和还原剂存在下,所述叠氮化物和所述炔烃基将形成包含三唑部分的连续连接部分。参见美国专利号8,129,542,其整体并入本文中,用于描述cuaac点击化学。
在所述胰岛素受体部分激动剂的特定方面,所述第一胰岛素多肽可以具有与b29或b28赖氨酸的ε氨基缀合的具有下式的接头
且所述第二胰岛素多肽可以具有与b29或b28赖氨酸的ε氨基缀合的具有下式的接头
在所述胰岛素受体部分激动剂的特定方面,所述第一胰岛素多肽可以具有与b29或b28赖氨酸的ε氨基缀合的具有下式的接头
其中n=1、2、3、4、5、6、7、8、9或10,且所述第二胰岛素多肽可以具有与b29或b28赖氨酸的ε氨基缀合的具有下式的接头
其中n=1、2、3、4、5、6、7、8、9或10。在有cu2+和还原剂存在下,所述接头化合以提供具有以下结构的连接部分
其中每个n独立地是1、2、3、4、5、6、7、8、9或10。
在另一个方面,所述第一胰岛素多肽和所述第二胰岛素多肽都可以具有与b29或b28赖氨酸的它各自的ε氨基缀合的具有下式的接头
其中每个n独立地是1、2、3、4、5、6、7、8、9或10。通过提供具有以下结构的分子(中间体或桥连接头),可以实现接头的缀合以形成连接部分
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。
在另一个方面,所述第一胰岛素多肽和所述第二胰岛素多肽都可以具有与b29或b28赖氨酸的它各自的ε氨基缀合的具有下式的接头
其中每个n独立地是1、2、3、4、5、6、7、8、9或10。通过提供具有以下结构的分子(中间体或桥连接头),可以实现接头的缀合以形成连接部分
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。
在特定方面,所述第一胰岛素聚合物在b29或b28赖氨酸的ε氨基处缀合至上述的以叠氮化物封端的接头,且所述第二胰岛素多肽在b29或b28赖氨酸的ε氨基处缀合至以环辛炔部分封端的接头,且所述接头使用无铜环加成点击化学缀合以形成接头部分。参见例如,美国专利号7,807,619,其整体并入本文中。
下表显示了可以用于构建本发明的二聚体的示例性接头。显示的二聚体包含用于缀合至b29或b29赖氨酸的ε氨基的2,5-二氧代吡咯烷基。
双功能接头与两个胰岛素或胰岛素类似物分子的b-链多肽的位置b29或b28处的赖氨酸残基的ε氨基缀合以形成通过连接部分连接的胰岛素二聚体可以示意地显示为
其中胰岛素1和胰岛素2分子可以是相同的或不同的,且双功能接头和缀合后产生的连接部分可以具有本文中公开的任何接头和产生的连接部分的结构。
胰岛素多肽的修饰
在某些实施方案中,所述胰岛素受体部分激动剂的a-链多肽或b-链多肽中的至少一个被修饰成包含酰基。所述酰基可以共价地直接连接至胰岛素多肽的氨基酸,或经由间隔物间接连接至胰岛素多肽的氨基酸,其中所述间隔物位于胰岛素多肽的氨基酸和酰基之间。所述胰岛素多肽可以在连接亲水部分的相同氨基酸位置处或在不同的氨基酸位置处被酰化。例如,酰化可以发生在任何位置,包括a-或b-链多肽的任何氨基酸以及在连接部分内的位置,前提条件是,由未酰化的胰岛素多肽表现出的活性在酰化后得到保留。非限制性例子包括在a链的位置a1和b链的位置b1处的酰化。
在本发明的一个具体方面,所述第一和/或第二胰岛素多肽(或其衍生物或缀合物)被修饰成包含通过胰岛素多肽的氨基酸的侧链的胺、羟基或巯基的直接酰化实现的酰基。在某些实施方案中,所述第一和/或第二胰岛素多肽通过氨基酸的侧链胺、羟基或巯基而直接酰化。在这点上,可以提供胰岛素多肽,其已经通过包含侧链胺、羟基或巯基的氨基酸对a-或b-链多肽序列中的一个或多个氨基酸的置换(包括例如在位置a1、a14、a15、b1、b10或b22处或在连接部分的任何位置处)进行修饰。
在某些实施方案中,在所述第一和/或第二胰岛素多肽和所述酰基之间的间隔物是包含侧链胺、羟基或巯基的氨基酸(或包含含有侧链胺、羟基或巯基的氨基酸的二肽或三肽)。在某些实施方案中,所述间隔物包含亲水的双功能间隔物。在一个具体实施方案中,所述间隔物包含氨基聚(烷氧基)羧酸酯。在这点上,所述间隔物可以包含,例如,nh2(ch2ch2o)n(ch2)mcooh,其中m是1-6的任意整数,且n是2-12的任意整数,例如,8-氨基-3,6-二氧杂辛酸,它可商购得自peptidesinternational,inc.(louisville,ky)。在一个实施方案中,所述亲水的双功能间隔物包含两个或更多个反应基团,例如,胺、羟基、巯基和羧基或它们的任意组合。在某些实施方案中,所述亲水的双功能间隔物包含羟基和羧酸酯。在其它实施方案中,所述亲水的双功能间隔物包含胺基和羧酸酯。在其它实施方案中,所述亲水的双功能间隔物包含巯基和羧酸酯。
在某些实施方案中,在所述第一和/或第二胰岛素多肽和所述酰基之间的间隔物是疏水的双功能间隔物。疏水的双功能间隔物是本领域已知的。参见,例如,bioconjugatetechniques,g.t.hermanson(academicpress,sandiego,ca,1996),其通过引用整体并入。在某些实施方案中,所述疏水的双功能间隔物包含两个或更多个反应基团,例如,胺、羟基、巯基和羧基或它们的任意组合。在某些实施方案中,所述疏水的双功能间隔物包含羟基和羧酸酯。在其它实施方案中,所述疏水的双功能间隔物包含胺基和羧酸酯。在其它实施方案中,所述疏水的双功能间隔物包含巯基和羧酸酯。包含羧酸酯和羟基或巯基的合适的疏水的双功能间隔物是本领域已知的,并且包括,例如,8-羟基辛酸和8-巯基辛酸。
根据某些实施方案,所述双功能间隔物可以是合成的或天然存在的包含3-10个原子长度的氨基酸主链的氨基酸(例如,6-氨基己酸、5-氨基戊酸、7-氨基庚酸和8-氨基辛酸)。可替换地,所述间隔物可以是具有3-10个原子(例如,6-10个原子)长度的肽主链的二肽或三肽间隔物。与胰岛素多肽连接的二肽或三肽间隔物的每个氨基酸可以独立地选自天然存在的和/或非天然存在的氨基酸,包括,例如,天然存在的氨基酸(ala、cys、asp、glu、phe、gly、his、ile、lys、leu、met、asn、pro、arg、ser、thr、val、trp、tyr)的任何d或l异构体,或选自以下的非天然存在的氨基酸的任何d或l异构体:β-丙氨酸(β-ala),n-α-甲基-丙氨酸(me-ala),氨基丁酸(abu),α-氨基丁酸(γ-abu),氨基己酸(ε-ahx),氨基异丁酸(aib),氨基甲基吡咯羧酸,氨基哌啶羧酸,氨基丝氨酸(ams),氨基四氢吡喃-4-甲酸,精氨酸n-甲氧基-n-甲基酰胺,β-天冬氨酸(β-asp),氮杂环丁烷羧酸,3-(2-苯并噻唑基)丙氨酸,α-叔丁基甘氨酸,2-氨基-5-脲基-正戊酸(瓜氨酸,cit),β-环己基丙氨酸(cha),乙酰氨基甲基-半胱氨酸,di氨基丁酸(dab),二氨基丙酸(dpr),二羟基苯丙氨酸(dopa),二甲基噻唑烷(dmta),γ-谷氨酸(γ-glu),高丝氨酸(hse),羟脯氨酸(hyp),异亮氨酸n-甲氧基-n-甲基酰胺,甲基-异亮氨酸(meile),4-哌啶甲酸(isn),甲基-亮氨酸(meleu),甲基-赖氨酸,二甲基-赖氨酸,三甲基-赖氨酸,桥亚甲基脯氨酸,甲硫氨酸-亚砜(met(o)),甲硫氨酸-砜(met(o2)),正亮氨酸(nle),甲基-正亮氨酸(me-nle),正缬氨酸(nva),鸟氨酸(orn),对-氨基苯甲酸(paba),青霉胺(pen),甲基苯丙氨酸(mephe),4-氯苯丙氨酸(phe(4-cl)),4-氟苯丙氨酸(phe(4-f)),4-硝基苯丙氨酸(phe(4-no2)),4-氰基苯丙氨酸((phe(4-cn)),苯基甘氨酸(phg),哌啶基丙氨酸,哌啶基甘氨酸,3,4-脱氢脯氨酸,吡咯烷基丙氨酸,肌氨酸(sar),硒代半胱氨酸(sec),u-苄基-磷酸丝氨酸,4-氨基-3-羟基-6-甲基庚酸(sta),4-氨基-5-环己基-3-羟基戊酸(achpa),4-氨基-3-羟基-5-苯基戊酸(ahppa),1,2,3,4,-四氢-异喹啉-3-甲酸(tic),四氢吡喃甘氨酸,噻吩基丙氨酸(thi),u-苄基-磷酸酪氨酸,o-磷酸酪氨酸,甲氧基酪氨酸,乙氧基酪氨酸,o-(双-二甲基氨基-膦酰基)-酪氨酸,酪氨酸硫酸盐四丁基胺,甲基-缬氨酸(meval),1-氨基-1-环己烷羧酸(acx),氨基戊酸,β-环丙基-丙氨酸(cpa),炔丙基甘氨酸(prg),烯丙基甘氨酸(alg),2-氨基-2-环己基-丙酸(2-cha),叔丁基甘氨酸(tbg),乙烯基甘氨酸(vg),1-氨基-1-环丙烷羧酸(acp),1-氨基-1-环戊烷羧酸(acpe),烷基化的3-巯基丙酸,1-氨基-1-环丁烷羧酸(acb)。在某些实施方案中,所述二肽间隔物选自ala-ala、β-ala-β-ala、leu-leu、pro-pro、γ-氨基丁酸-γ-氨基丁酸和γ-glu-γ-glu。
所述第一和/或第二胰岛素多肽可以被修饰成包含通过长链烷烃的酰化得到的酰基。在具体方面,所述长链烷烃包含与胰岛素多肽的羧基或其活化形式反应的胺、羟基或巯基(例如十八烷胺、十四烷醇和十六烷硫醇)。胰岛素多肽的羧基或其活化形式可以是胰岛素多肽的氨基酸(例如,谷氨酸、天冬氨酸)的侧链的组成部分,或可以是肽主链的组成组分。
在某些实施方案中,所述第一和/或第二胰岛素多肽被修饰成包含通过与胰岛素多肽连接的间隔物对长链烷烃的酰化得到的酰基。在具体方面,所述长链烷烃包含与间隔物的羧基或其活化形式反应的胺、羟基或巯基。本文描述了包含羧基或其活化形式的合适间隔物,且包括,例如,双功能间隔物,例如,氨基酸、二肽、三肽、亲水的双功能间隔物和疏水的双功能间隔物。本文中使用的术语“羧基的活化形式”表示具有通式r(c=o)x的羧基,其中x是离去基团,且r是胰岛素多肽或间隔物。例如,羧基的活化形式可以包括、但不限于酰氯、酸酐和酯。在某些实施方案中,所述活化的羧基是具有n-羟基琥珀酰亚胺(nhs)离去基团的酯。
关于其中长链烷烃被肽、胰岛素多肽或间隔物酰化的本发明的这些方面,所述长链烷烃可以具有任意大小且可以包含任意长度的碳链。所述长链烷烃可以是直链的或支链的。在某些方面,所述长链烷烃是c4至c30烷烃。例如,所述长链烷烃可以是c4烷烃、c6烷烃、c8烷烃、c10烷烃、c12烷烃、c14烷烃、c16烷烃、c18烷烃、c20烷烃、c22烷烃、c24烷烃、c26烷烃、c28烷烃或c30烷烃中的任一种。在某些实施方案中,所述长链烷烃包含c8至c20烷烃,例如,c14烷烃、c16烷烃或c18烷烃。
在某些实施方案中,第一和/或第二胰岛素多肽的胺、羟基或巯基被胆固醇酸酰化。在一个具体实施方案中,所述肽通过烷基化的脱氨基cys间隔物(即,烷基化的3-巯基丙酸间隔物)连接至胆固醇酸。经由胺、羟基和巯基的合适肽酰化方法是本领域已知的。参见,例如,miller,biochembiophysrescommun218:377-382(1996);shimohigashi和stammer,intjpeptproteinres19:54-62(1982);和previero等人,biochimbiophysacta263:7-13(1972)(关于通过羟基的酰化方法);和san和silvius,jpeptres66:169-180(2005)(关于通过巯基的酰化方法);bioconjugatechem.“chemicalmodificationsofproteins:historyandapplications”第1,2-12页(1990);hashimoto等人,pharmacueticalres.“synthesisofpalmitoylderivativesofinsulinandtheirbiologicalactivity”第6卷,第2期第171-176页(1989)。
第一和/或第二胰岛素多肽的酰化肽的酰基可以具有任意大小,例如,任意长度碳链,且可以是直链的或支链的。在本发明的某些具体实施方案中,所述酰基是c4至c30脂肪酸。例如,所述酰基可以是c4脂肪酸、c6脂肪酸、c8脂肪酸、c10脂肪酸、c12脂肪酸、c14脂肪酸、c16脂肪酸、c18脂肪酸、c20脂肪酸、c22脂肪酸、c24脂肪酸、c26脂肪酸、c28脂肪酸或c30脂肪酸中的任一种。在某些实施方案中,所述酰基是c8至c20脂肪酸,例如,c14脂肪酸或c16脂肪酸。在某些实施方案中,所述酰基是脲。
在一个替代实施方案中,所述酰基是胆汁酸。所述胆汁酸可以是任意合适的胆汁酸,包括,但不限于,胆酸、鹅去氧胆酸、脱氧胆酸、石胆酸、牛磺胆酸、甘胆酸和胆固醇酸。
本文描述的酰化的第一和/或第二胰岛素多肽可以进一步修饰成包含亲水部分。在某些具体实施方案中,所述亲水部分可以包含聚乙二醇(peg)链。通过任意合适的方式,诸如本文所述的任意方法,可以完成亲水部分的掺入。在某些实施方案中,所述酰化的单链类似物包含选自cys、lys、orn、高-cys或ac-phe的氨基酸,且所述氨基酸的侧链共价地键合至亲水部分(例如,peg)。在一个实施方案中,所述酰基连接至位置a1、a14、a15、b1、b2、b10或b22(根据天然胰岛素的a和b链的氨基酸编号),任选地经由包含cys、lys、orn、高-cys或ac-phe的间隔物。
可替换地,酰化的第一和/或第二胰岛素多肽包含间隔物,其中所述间隔物被酰化和修饰成包含亲水部分。合适的间隔物的非限制性例子包括包含一个或多个选自cys、lys、orn、高-cys和ac-phe的氨基酸的间隔物。
在某些实施方案中,所述胰岛素受体部分激动剂的a-链多肽和b-链多肽中的至少一个的至少一个n-端氨基酸的氨基端被修饰成包含取代基。所述取代基可以共价地直接连接至n-端氨基酸的氨基或经由间隔物间接地连接至所述氨基,其中所述间隔物位于胰岛素多肽的n-端氨基酸的氨基和取代基之间。所述取代基可以是如上面讨论的酰基部分。所述取代基可以具有通式rc(o)-,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团或peg2基团(关于取代基的结构,参见本文中的实施例)。胰岛素的氨甲酰化已经由oimoni等人,nephron46:63-66(1987)公开,且包含在n-端处的氨甲酰基的胰岛素二聚体已经公开在公布的pct申请号wo2014052451(例如,miu-90)中。
在特定实施方案中,至少一个n-端氨基酸经由n2氮缀合至取代基,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团或peg2基团。
在特定实施方案中,与所述第一和第二胰岛素多肽的一个或多个氨基端共价地连接的糖可以是单糖,参见例如二聚体51。在某些实施方案中,所述糖包含一个或多个胺基。在某些实施方案中,所述糖和胺基被c1-c6烷基(例如,c1-c3烷基)隔开。在某些实施方案中,所述糖是氨基乙基葡萄糖(aeg)。在某些实施方案中,糖配体具有“”构型。在其它实施方案中,糖配体具有“l”构型。我们在下面显示了这些示例性糖的结构。本领域技术人员将认识到其它示例性糖。
一般而言,所述糖可以直接地或经由接头间接地缀合至所述第一和第二胰岛素多肽中的一个或多个的氨基端。在特定方面,所述接头是烷基二酰基、-c(o)(ch2)nc(o)-,其中n=0-45、0-20、0-10、或0-5。
与n-端氨基缀合的示例性取代基可以是
其中波浪线指示取代基和n-端氨基之间的键。所述取代基还可以是
示例性的胰岛素二聚体
在特定实施方案中,本发明提供了胰岛素二聚体,其中具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys和具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys通过双功能接头缀合在一起,所述双功能接头选自接头1、接头2、接头3、接头10、接头11、接头12、接头13、接头14、接头15、接头16、接头17、接头18、接头19、接头20、接头21、接头22、接头23、接头24、接头25、接头26、接头27、接头28、接头29、接头30、接头31、接头32、接头33、接头34、接头35、接头36、接头37、接头38、接头39、接头40、接头41、接头42、接头43、接头44、接头45、接头46、接头47、接头48、接头49和接头50,前提条件是,当所述双功能接头是接头10、接头11、接头12、接头13或接头14时,所述第一或第二a-链或b-链多肽中的至少一个在它的n-端氨基酸处缀合至如本文中公开的取代基,或至少所述第一胰岛素异源二聚体分子的n-端氨基酸缀合至如本文中公开的取代基,或所述第一胰岛素异源二聚体和第二胰岛素异源二聚体的n-端氨基酸缀合至取代基。在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
在特定实施方案中,本发明提供了胰岛素二聚体,其中具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys与选自接头5和接头7的第一接头缀合,且具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys与选自接头4、接头6、接头8和接头9的第二接头缀合,它们经由所述第一接头和所述第二接头缀合在一起。在特定实施方案中,所述第一或第二a-链或b-链多肽中的至少一个在它的n-端氨基酸处缀合至如本文中公开的取代基,或至少所述第一胰岛素异源二聚体分子的n-端氨基酸缀合至如本文中公开的取代基,或所述第一胰岛素异源二聚体和第二胰岛素异源二聚体的n-端氨基酸缀合至取代基。在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
在特定实施方案中,本发明提供了胰岛素二聚体,其中具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys与选自接头5和接头7的第一接头缀合,且具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys与选自接头5和接头7的第二接头缀合,其中所述第一和第二接头经由具有以下结构的桥连接头缀合在一起
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。在特定实施方案中,所述第一或第二a-链或b-链多肽中的至少一个在它的n-端氨基酸处缀合至如本文中公开的取代基,或至少所述第一胰岛素异源二聚体分子的n-端氨基酸缀合至如本文中公开的取代基,或所述第一胰岛素异源二聚体和第二胰岛素异源二聚体的n-端氨基酸缀合至取代基。在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
在特定实施方案中,本发明提供了胰岛素二聚体,其中具有第一a-链多肽和第一b-链多肽的第一胰岛素异源二聚体分子的第一个b29或b28lys与选自接头4、接头6、接头8和接头9的第一接头缀合,且具有第二a-链多肽和第二b-链多肽的第二胰岛素异源二聚体的第二个b29或b28lys与选自接头4、接头6、接头8和接头9的第二接头缀合,其中所述第一和第二接头经由具有以下结构的桥连接头缀合在一起
其中r是共价键、碳原子、苯基、杂原子或任选地被取代的选自酰基、脂族基、杂脂族基、芳基、杂芳基和杂环的基团。在特定方面,r是c2、c3、c4、c6、c7、c8、c9或c10酰基或peg2、peg3、peg4、peg5、peg6、peg7、peg8、peg9、peg10、peg11、peg12、peg13或peg25。在特定实施方案中,所述第一或第二a-链或b-链多肽中的至少一个在它的n-端氨基酸处缀合至如本文中公开的取代基,或至少所述第一胰岛素异源二聚体分子的n-端氨基酸缀合至如本文中公开的取代基,或所述第一胰岛素异源二聚体和第二胰岛素异源二聚体的n-端氨基酸缀合至取代基。在特定实施方案中,所述取代基包含与具有通式rc(o)-的基团连接的n-羟基琥珀酰亚胺酯,其中r可以是r’ch2、r’nh、r’o,且r’可以是h、直链烷基链、氨基酸、肽、聚乙二醇(peg)、糖,在特定方面,rc(o)-可以是乙酰基、苯基乙酰基、氨甲酰基、n-烷基氨甲酰基或烷氧基羰基。在特定方面,所述取代基是氨甲酰基、乙酰基、甘氨酸、甲基、甲氧基、二甲基、异丁基、peg1基团、aeg基团、aeg-c6烷基或peg2基团。
在其它实施方案中,所述第一和第二胰岛素异源二聚体可以包含本文中公开的任意胰岛素或胰岛素类似物分子。
本发明也提供了胰岛素二聚体,其选自
其中a-链多肽的cys6和cys11残基之间的二硫键以及a-链的cys7和cys20分别与b-链多肽的cys7和cys19之间的二硫键由之间的实线代表;其中所述连接部分共价地连接至显示的赖氨酸残基的ε氨基酸,其中二聚体1-40、42-52、54-86和88-94的a-链多肽具有在seqidno:1中所示的氨基酸序列;二聚体56的a-链多肽具有关于seqidno:11所示的氨基酸序列;二聚体1-17、21-27、36、37、39-40和42-52、54-82、84-86和88-94的b-链多肽具有在seqidno:2中所示的氨基酸序列;二聚体18和32-35的b-链多肽具有在seqidno:6中所示的氨基酸序列;二聚体19和83的b-链多肽具有在seqidno:9中所示的氨基酸序列;二聚体20、28-31和38的b-链多肽具有在seqidno:10中所示的氨基酸序列;且二聚体53和87的a-链多肽和b-链多肽分别是seqidno:7和seqidno:8。
药物组合物
根据一个实施方案,提供了一种药物组合物,其包含本文中公开的任意新颖的胰岛素二聚体,优选地在至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的纯度水平,和药学上可接受的稀释剂、载体或赋形剂。这样的组合物可以含有在至少0.5mg/ml、1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、18mg/ml、19mg/ml、20mg/ml、21mg/ml、22mg/ml、23mg/ml、24mg/ml、25mg/ml或更高的浓度的如本文中公开的胰岛素二聚体。在一个实施方案中,所述药物组合物包含水溶液,其经过灭菌并任选地储存在不同的包装容器内。在其它实施方案中,所述药物组合物包含低压冻干的粉末。所述药物组合物还可以包装为试剂盒的组成部分,所述试剂盒包括用于将所述组合物施用给患者的一次用弃的装置。所述容器或试剂盒可以带有关于在环境室温或在冷藏温度贮存的标签。
认为公开的胰岛素二聚体适合用于以前关于胰岛素肽已经描述的任何用途。因此,本文中公开的胰岛素二聚体可以用于治疗高血糖症或治疗由高血糖水平引起的其它代谢疾病。因此,本发明包括用于治疗遭受高血糖水平的患者的药物组合物,其包含如本文中公开的胰岛素二聚体和药学上可接受的载体。根据一个实施方案,要使用本文中公开的胰岛素二聚体治疗的患者是驯化的动物,且在另一个实施方案中,要治疗的患者是人。
根据本发明的一种治疗高血糖症的方法包括使用任何标准施用途径将本文公开的胰岛素二聚体施用给患者的步骤,所述施用途径包括胃肠外地诸如静脉内地、腹膜内地、皮下地或肌肉内地、鞘内地、透皮地、直肠地、口服地、鼻地或通过吸入。在一个实施方案中,皮下地或肌肉内地施用所述组合物。在一个实施方案中,胃肠外地施用所述组合物,并且将胰岛素多肽或其前药衍生物预包装在注射器中。
可以单独地或与其它抗糖尿病剂组合地施用本文中公开的胰岛素二聚体。本领域已知的或在研究中的抗糖尿病药物包括天然胰岛素、天然胰高血糖素及其功能类似物,磺酰脲类,诸如甲苯磺丁脲(orinase),醋酸己脲(dymelor),妥拉磺脲(tolinase),氯磺丙脲(diabinese),格列吡嗪(glucotrol),格列本脲(diabeta,micronase,glynase),格列美脲(amaryl),或格列齐特(diamicron);氯茴苯酸类,诸如瑞格列奈(prandin)或那格列奈(starlix);双胍类诸如二甲双胍(glucophage)或苯乙双胍;噻唑烷二酮类诸如罗格列酮(avandia),吡格列酮(actos),或曲格列酮(rezulin),或其它pparγ抑制剂;抑制碳水化合物消化的α葡萄糖苷酶抑制剂,诸如米格列醇(glyset),阿卡波糖(precose/glucobay);艾塞那肽(byetta)或普兰林肽;二肽基肽酶-4(dpp-4)抑制剂诸如维格列汀或西格列汀;sglt(钠依赖性的葡萄糖转运蛋白1)抑制剂;或fbpase(果糖1,6-二磷酸酶)抑制剂。
使用本领域技术人员已知的标准的药学上可接受的载体和施用途径,可以配制并给患者施用包含本文中公开的胰岛素二聚体的药物组合物。因此,本发明也包括药物组合物,其包含与药学上可接受的载体组合的一种或多种本文中公开的胰岛素二聚体或其药学上可接受的盐。例如,包含本文中公开的胰岛素二聚体的药物组合物可以任选地含有锌离子、防腐剂(例如,苯酚、甲酚、对羟基苯甲酸酯)、等渗剂(例如,甘露醇、山梨醇、乳糖、右旋糖、海藻糖、氯化钠、甘油)、缓冲物质、盐、酸和碱以及其它赋形剂。这些物质在每种情况下可以个别地存在,或可替换地作为混合物存在。甘油、右旋糖、乳糖、山梨醇和甘露醇通常以100-250mm的浓度存在于药物制剂中,nacl以至多150mm的浓度存在。缓冲物质,例如,磷酸盐、乙酸盐、柠檬酸盐、精氨酸、甘氨酰甘氨酸或tris(即2-氨基-2-羟基甲基-1,3-丙二醇)缓冲剂和对应的盐,以5-250mm的浓度存在,经常是约10-100mm。其它赋形剂尤其可以是盐或精氨酸。
在一个实施方案中,所述药物组合物包含在约4.0至约7.0的ph在磷酸盐缓冲液系统中的1mg/ml浓度的胰岛素二聚体。所述药物组合物可以包含胰岛素二聚体作为唯一药学活性组分,或所述胰岛素二聚体可以与一种或多种另外的活性剂组合。
本文描述的所有治疗方法、药物组合物、试剂盒和其它类似的实施方案预见到,胰岛素二聚体包括其所有药学上可接受的盐。
在一个实施方案中,给所述试剂盒提供用于将胰岛素二聚体组合物施用给患者的装置。所述试剂盒还可以包括多种容器,例如,小瓶、试管、瓶子等。优选地,所述试剂盒还将包括使用说明书。根据一个实施方案,所述试剂盒的装置是气溶胶分配装置,其中将所述组合物预包装在气溶胶装置内。在另一个实施方案中,所述试剂盒包含注射器和针头,且在一个实施方案中,将所述胰岛素二聚体组合物预包装在所述注射器内。
通过标准合成方法、重组dna技术或制备肽和融合蛋白的任意其它方法,可以制备本发明的化合物。尽管某些非天然的氨基酸不可通过标准重组dna技术来表达,它们的制备技术是本领域已知的。除了适用的标准肽化学反应以外,通过标准有机化学反应可以合成包括非肽部分的本发明的化合物。
以下实施例意图促进对本发明的进一步理解。
实施例
一般程序
所有化学物质购自商业来源,除非另外指出。除非另外指出,否则经常在环境温度或在室温进行反应。使用无水溶剂和试剂在氮气或氩气下进行对水分或空气敏感的反应。通过分析型薄层色谱法(tlc)和超高效液相色谱法-质谱法(uplc-ms)监测反应的进程。在用硅胶60f-254(层厚度0.25mm)预包被的e.mercktlc平板上进行tlc。使用254nmuv和/或通过暴露于钼酸铵铈(cam)或p-茴香醛染色溶液并随后炭化,使平板显影。在watersacquity™uplc®系统上执行超高效液相色谱法(uplc)。
uplc-ms方法a:watersacquity™uplc®behc181.7μm1.0x50mm柱,用梯度10:90-95:5(v/v)ch3cn/h2o+v0.05%tfa历时2.0min;流速0.3ml/min,uv波长215nm;uplc-ms;
方法b:watersacquity™uplc®behc181.7μm2.1x100mm柱,用梯度60:40-100:0(v/v)ch3cn/h2o+v0.05%tfa历时4.0min和100:0-95:5(v/v)ch3cn/h2o+v0.05%tfa历时40秒;流速0.3ml/min,uv波长200-300nm;uplc-ms;
方法c:watersacquity™uplc®behc181.7μm2.1x100mm柱,用梯度20:80-90:10(v/v)ch3cn/h2o+v0.05%tfa历时4.0min和90:10-95:5(v/v)ch3cn/h2o+v0.05%tfa历时0.5min;流速0.3ml/min,uv波长200-300nm;uplc-ms;
方法d:watersacquity™uplc®behc81.7μm2.1x100mm柱,用梯度10:90-55:45(v/v)ch3cn/h2o+v0.05%tfa历时4.0min和55:45-95:5(v/v)ch3cn/h2o+v0.05%tfa历时40秒;流速0.3ml/min,uv波长200-300nm;uplc-ms;
方法e:watersacquity™uplc®beh300c41.7μm2.1x100mm柱,用梯度10:90-50:50(v/v)ch3cn/h2o+v0.05%tfa历时4.3min和50:50-70:30(v/v)ch3cn/h2o+v0.05%tfa历时0.5min;流速0.3ml/min,uv波长200-300nm;uplc-ms;
方法f:watersacquity™uplc®behc81.7μm2.1x100mm柱,用梯度20:80-72.5:27.5(v/v)ch3cn/h2o+v0.05%tfa历时4.3min和72.5:27.5-95:5(v/v)ch3cn/h2o+v0.05%tfa历时0.5min;流速0.3ml/min,uv波长200-300nm,和uplc-ms;
方法g:watersacquity™uplc®behc81.7μm2.1x100mm柱,用梯度20:80-90:10(v/v)ch3cn/h2o+v0.1%tfa历时4.0min和90:10-95:5(v/v)ch3cn/h2o+v0.1%tfa历时0.4min;流速0.3ml/min,uv波长200-300nm。
在具有电喷射电离的waterssq检测器(以阳离子检测模式且质荷比的扫描范围是170-900)或具有电喷射电离的watersmicromass®lctpremier™xe(以阳离子检测模式且质荷比的扫描范围是300-2000)上执行质量分析。通过将理论分子量与使用uplc-ms测量的实验值进行对比,证实产生的胰岛素缀合物或irpa的鉴别。为了确定连接位置,具体地,将胰岛素二聚体进行dtt处理(对于a/b链)或glu-c消化(有或没有还原和烷基化),然后通过lc-ms分析得到的肽。基于测量的质量,推导连接位置。
使用biotageflashchromatography设备(dyaxcorp.)或combiflash®rf仪器(teledyneisco)执行快速色谱法。在指定大小的预填充筒中的硅胶(20-70μm,60å孔径)上进行正相色谱法。在基于硅胶的材料(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å孔径)上进行离子交换色谱法,所述材料具有亲水的、阴离子的聚(2-磺基乙基天冬氨酰胺)的键合涂层。在指定大小的预填充筒中的c18键合的硅胶(20-60μm,60-100å孔径)上进行反相色谱法。使用watersdeltapakc415μm,300å,50x250mm柱或kromasil®c810μm,100å,50x250mm柱,流速85ml/min,用指定的梯度,在gilson333-334二元系统上执行制备级hplc。在旋转蒸发器上在减压下进行溶液的浓缩,或在virtisfreezemobilefreezedryer(spscientific)上冷冻干燥。
缩写:乙腈(accn),水溶液(aq),n,n-二异丙基乙胺或hünig氏碱(dipea),n,n-二甲基甲酰胺(dmf),二甲亚砜(dmso),乙酸乙酯(etoac),n-(3-二甲基氨基丙基)-n’-乙基碳二亚胺盐酸盐(edc),克(g),1-羟基苯并三唑水合物(hobt),小时(h或hr),质谱图(ms或ms),微克(μg),微升(μl),微摩尔(μmol)、毫克(mg),毫升(ml),毫摩尔(mmol),分钟(min),保留时间(rt),室温(rt),饱和的(sat.或sat’d),饱和的氯化钠水溶液(盐水),三乙胺(tea),三氟乙酸(tfa),和n,n,n’,n’-四甲基-o-(n-琥珀酰亚胺基)脲鎓四氟硼酸盐(tstu)。
术语“rhi”表示重组人胰岛素,且用于指示所述胰岛素具有天然野生型人胰岛素的特有氨基酸序列。如本文中在表中使用的,该术语指示,包含所述二聚体的胰岛素的氨基酸序列是天然野生型人胰岛素的氨基酸序列。
实施例1
描述了6-((6-((2,5-二氧代吡咯烷-1-基)氧基)-6-氧代己基)氨基)-6-氧代己酸-2,5-二氧代吡咯烷-1-基酯(接头1;c6+nc6)的合成。
步骤16-((6-(苄氧基)-6-氧代己基)氨基)-6-氧代己酸苄酯
向己二酸单苄基酯(600mg,2.54mmol)和4-甲基苯磺酸6-(苄氧基)-6-氧代己烷-1-铵(aminium)(1.0g,2.54mmol)在dmf(12.71ml)中的混合物中加入hobt(584mg,3.81mmol)、hunig氏碱(888μl,5.08mmol)和edc(731mg,3.81mmol)。搅拌过夜以后,将反应混合物在饱和nahco3和etoac之间分配。将有机相分离,用1.0mhcl和盐水洗涤,经na2so4干燥,并浓缩以得到作为半固体的标题化合物,并不经进一步纯化地用于下一步。uplc-ms方法a:rt=1.26min,m/z=440.3[m+1]
步骤26-((5-羧基戊基)氨基)-6-氧代己酸
将步骤1的产物(1.08g,2.457mmol)和pearlman氏催化剂(20重量%在碳上,173mg,0.246mmol)在meoh(50ml)中的混悬液在50psih2下搅拌过夜。将催化剂滤出并对滤液进行c8相上的反相色谱法(kromasil,c810μm100å,250x50mm;溶剂a=水/0.05%tfa,溶剂b=accn/0.05%tfa),流速=85ml/min,梯度为在30min中5-30%的b在a中的溶液。uplc-ms方法a:rt=0.40min,m/z=260.15[m+1]。
步骤36-((6-((2,5-二氧代吡咯烷-1-基)氧基)-6-氧代己基)氨基)-6-氧代己酸-2,5-二氧代吡咯烷-1-基酯
向步骤2的产物(50mg,0.193mmol)在dmf(964µl)中的溶液中加入tstu(116mg,0.386mmol)。冷却至0℃以后,向混合物中加入三乙胺(53.8µl,0.386mmol)。搅拌45分钟以后,观察到期望的化合物的形成:uplc-ms方法a:rt=0.71min,m/z=453.4[m+1]。将得到的6-((6-((2,5-二氧代吡咯烷-1-基)氧基)-6-氧代己基)氨基)-6-氧代己酸-2,5-二氧代吡咯烷-1-基酯不经纯化作为0.2m的在dmf中的溶液使用。
实施例2
描述了二己酸双(2,5-二氧代吡咯烷-1-基)6,6’-(已二酰基双(氮烷二基))酯(接头2;c6n+c6+nc6)的合成。
步骤16,6'-(已二酰基双(氮烷二基))二己酸二苄酯
向4-甲基苯磺酸6-(苄氧基)-6-氧代己烷-1-铵(aminium)(2.693g,6.84mmol)和己二酸(500mg,3.42mmol)在dmf(17.1ml)中的溶液中加入hunig氏碱(1.793ml,10.26mmol)、hobt(1.572g,10.26mmol)和edc(1.968g,10.26mmol)。搅拌过夜以后,将反应混合物倒入水(500ml)中并搅拌30分钟。将标题化合物通过过滤收集为固体并通过空气抽吸进行干燥。uplc-ms方法a:rt=1.23min,m/z=553.5[m+1]。
步骤2二己酸双(2,5-二氧代吡咯烷-1-基)6,6’-(已二酰基双(氮烷二基))酯
使用与关于实施例1描述的程序类似的程序,在步骤2中用6,6'-(已二酰基双(氮烷二基))二己酸二苄酯替代6-((6-(苄氧基)-6-氧代己基)氨基)-6-氧代己酸苄酯,制备标题化合物。uplc-ms方法a:rt=0.74min,m/z=567.4[m+1]。
实施例3
描述了(2s,2's)-2,2'-(辛烷二酰基双(氮烷二基))双(5-((2,5-二氧代吡咯烷-1-基)氧基)-5-氧代戊酸)(接头3;γ-glu-辛二酸-γ-glu)的合成。
步骤1(s)-5-(苄氧基)-4-(8-(((s)-1-(苄氧基)-4-羧基-1-氧代丁-2-基)氨基)-8-氧代辛烷酰氨基)-5-氧代戊酸
向h-glu-obzl(1.00g,4.21mmol)在dmf(10.5ml)中的溶液中加入三乙胺(5.875ml,42.1mmol),随后加入辛二酸二琥珀酰亚胺基酯(776mg,2.107mmol)。搅拌1小时以后,将反应混合物浓缩,并将得到的残余物在c18柱(isco44g)上纯化,流速=37ml/min;在20min中在含有0.05%tfa的水中的accn梯度:2%-20%,随后保持。低压冻干以后,观察到中间体二-甲酸。uplc-ms方法b:rt=2.66min,m/z=613.3[m+1]。
步骤2(s)-5-(苄氧基)-4-(8-(((s)-1-(苄氧基)-4-羧基-1-氧代丁-2-基)氨基)-8-氧代辛烷酰氨基)-5-氧代戊酸的双-n-羟基琥珀酰亚胺酯
向步骤1的产物(455mg,0.743mmol)在乙腈(7.4ml)中的混悬液中加入tstu(492mg,1.634mmol)固体,随后加入三乙胺(228µl,1.634mmol),在此时混悬液溶解。将反应混合物搅拌1.5小时,并在室温在旋转蒸发器上浓缩。将产物通过c-8相上的反相色谱法纯化(柱kromasil,c810μm100a,大小250x50mm;溶剂a=水/0.05%tfa,溶剂b=accn/0.05%tfa),流速=85ml/min,梯度为在30min中10-80%的b在a中的溶液。将级分低压冻干以后,得到双-nhs酯。uplc-ms方法b:rt=2.77min,m/z=807[m+1]。
步骤3.(2s,2's)-2,2'-(辛烷二酰基双(氮烷二基))双(5-((2,5-二氧代吡咯烷-1-基)氧基)-5-氧代戊酸)
使用作为催化剂的炭载钯(66.0mg,0.031mmol)和作为溶剂的含有0.1%tfa的丙酮(6.2ml),将步骤2的产物(250mg,0.310mmol)在1大气压的氢气下氢化过夜。将催化剂滤出,并将滤液浓缩以得到标题化合物。在高真空泵送过夜。uplc-ms方法c:rt=3.61min,m/z=627.3[m+1]。
实施例4
一般方法a:n6,b29胰岛素缀合物(类似物)的合成
在一个适当大小的容器中,将胰岛素或胰岛素类似物在轻轻搅拌下在室温溶解在混合的溶剂中:2:3(v/v)0.1mna2co3:accn。将混合物澄清以后,使用碱溶液(例如,0.1nnaoh)将ph调至10.5-10.8的值。在单独的瓶中,将活化的酯中间体(连接部分)在室温溶解在有机溶剂(例如,dmso)中。将活化的酯(接头)的溶液的等分试样在一段时间内加入含有胰岛素的溶液中,直到uplc色谱图表明大部分未修饰的胰岛素已经反应并且反应混合物的主要部分已经被转化成b29-缀合的胰岛素。通过加入胺亲核体,例如,2-氨基乙醇,将反应物淬灭。将反应溶液在室温搅拌30分钟。将得到的溶液用冷h2o(20x)在0℃小心地稀释,并使用1nhcl(和0.1nnaoh,如果需要的话)将它的ph调至2.5的最终ph。将溶液首先通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先将浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的b29-缀合物的级分合并,并使用tff系统或amiconultra-15浓缩。然后将得到的溶液通过反相hplc(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)进一步纯化。将含有标题缀合物的级分合并和冷冻干燥,或使用tff系统和/或amiconultra-15进行缓冲液更换以得到标题产物。
实施例5
描述了n6,29b-5-叠氮基-戊酰基desb30胰岛素(a:y19a)(类似物1)的合成。
在20ml闪烁瓶中,将desb30a:y19a胰岛素(112mg,0.020mmol)在轻轻搅拌下在室温溶解在混合溶剂(2ml,2:3(v/v)0.1mna2co3:accn)中。将混合物澄清以后,使用碱溶液(例如,0.1nnaoh)将ph调至10.5-10.8的值。在单独的8ml闪烁瓶中,将5-叠氮基戊酸-2,5-二氧代吡咯烷-1-基酯(接头5;参见实施例6)(4.79mg,0.020mmol)在室温溶解在dmso(500μl)中。将活化的酯的溶液的等分试样在一段时间内加入含有胰岛素的溶液中,直到uplc色谱图表明大部分未修饰的胰岛素已经反应并且反应混合物的主要部分已经被转化成b29-缀合的胰岛素。通过加入胺亲核体,例如,2-氨基乙醇,将反应物淬灭。将反应溶液在室温搅拌30分钟。将得到的溶液用冷h2o(20x)在0℃小心地稀释,并使用1.0nhcl(和0.1nnaoh,如果需要的话)将它的ph调至2.5的最终ph。首先将溶液通过使用具有3k或10kmwco膜的amiconultra-15离心单元的超滤进行浓缩。对浓缩的溶液进行反相hplc(kromasilc8250x50mm,10μm,100å柱,历时20min25-35%的缓冲液b在缓冲液a中的溶液;缓冲液a:0.05%的tfa在水中的溶液;缓冲液b:0.05%的tfa在accn中的溶液)。将含有类似物1的级分合并,然后冷冻干燥。uplc-ms方法d:rt=3.91min,m/z=1435.86[(m+4)/4]。
实施例6
制备n6,29b-酰化的rhi类似物2、类似物3和类似物4用于使用“点击”化学构建二聚体,并如下制备:使用一般方法a,或与关于实施例4描述的程序类似的程序,但是替换重组人胰岛素和
(戊-4-炔酸-2,5-二氧代吡咯烷-1-基酯;接头4);
(叠氮基戊酸-2,5-二氧代吡咯烷-1-基酯;接头5);或
(1-(二环[6.1.0]壬-4-炔-9-基)-3-氧代-2,7,10,13,16-五氧杂-4-氮杂十九烷-19-酸全氟苯基酯)(接头6)以分别制备类似物2、类似物3或类似物4。除了使用uplc-ms方法f表征的类似物5以外,使用uplc-ms方法d表征类似物。
实施例7
描述了n2,1a,n2,1b-双(氨甲酰基)人胰岛素(类似物5)的合成。
向rhi(1g,0.172mmol)在水(50ml)中的混悬液中加入磷酸氢二钾(0.249g,1.429mmol)在水(5.0ml)中的溶液。在室温搅拌30分钟以后,向得到的混合物中加入氰酸钾(0.279g,3.44mmol)。将反应混合物搅拌16小时。为了停止反应,通过使用mwco3k渗滤装置的tff除去未反应的氰酸钾,并通过低压冻干法将产物分离为固体。产物含有约10-35%的a1/b1/b29-三-脲-rhi,将其任选地通过c8相上的反相色谱法除去(柱kromasil,c810μm100å,250x50mm;溶剂a=水/0.05%tfa,溶剂b=accn/0.05%tfa),流速=85ml/min,梯度为在30min中26-34%的b在a中的溶液)。uplc-ms方法d:rt=4.29min,m/z=1474.6(z=4)。n-端取代基具有结构
实施例8
描述了n2,1a,n2,1b-双(氨甲酰基)desb30人胰岛素(类似物6)的合成。
使用与关于实施例7描述的程序类似的程序,用desb30胰岛素替换rhi,制备标题化合物。uplc-ms方法d:rt=4.10min,m/z=1448.9(z=4)。n-端取代基具有结构
实施例9
描述了n2,1a,n2,1b-双(氨甲酰基)赖脯胰岛素(类似物7)的合成。
使用与关于实施例7描述的程序类似的程序,用赖脯胰岛素替换rhi,制备标题化合物。uplc-ms方法d:rt=4.07min,m/z=1473.6(z=4)。n-端取代基具有结构
实施例10
描述了n2,1a-乙酰基人胰岛素(类似物8)的合成。
向rhi(400mg,0.069mmol)在dmso(4.6ml)中的溶液中逐滴加入乙酸-2,5-二氧代吡咯烷-1-基酯
实施例11
描述了n2,1a,n2,1b-双(氨甲酰基)n6,29b-酰化的rhi的合成。
使用一般方法a或与关于实施例4描述的程序类似的程序,制备与叠氮基戊酸-2,5-二氧代吡咯烷-1-基酯(接头5)(以构建类似物9)或戊-4-炔酸-2,5-二氧代吡咯烷-1-基酯(接头4)(以构建类似物10)缀合的类似物5。
实施例12
制备下述n6,29b-酰化的rhi类似物(类似物11、类似物12和类似物13)用于使用“点击”化学构建二聚体。如下制备类似物:使用一般方法a,或与关于实施例4描述的程序类似的程序,但是替换重组人胰岛素(rhi)和选自以下的适当连接部分:
以分别制备类似物11、类似物12或类似物13。除了使用uplc-ms方法f表征的类似物12以外,使用uplc-ms方法d表征类似物。
实施例13
一般方法b:使用有机碱条件合成n6,29b,n6,29b’-胰岛素二聚体
在一个适当大小的容器中,在有碱(例如,tea)存在下将胰岛素或胰岛素类似物在室温悬浮于有机溶剂或混合的水溶液/有机溶剂(例如,dmso)中。将混合物轻轻搅拌直到胰岛素完全溶解。向得到的溶液中加入在有机溶剂(诸如dmso或dmf)的溶液中的活化的酯中间体(接头)。uplc以后,色谱图表明,反应混合物的主要部分已经转化成n6,29b,n6,b29b’-胰岛素二聚体(或n6,28b,n6,28b’-赖脯胰岛素二聚体)。可以将反应混合物直接进行反相hplc纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在去离子水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液),或可以将反应物通过用冷的酸性h2o(20x,ph约3.0)在0℃小心稀释进行淬灭,并将它的ph使用1nhcl(和0.1nnaoh,如果需要的话)调至2.5的最终ph。可以首先将溶液通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先对浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的b29-缀合物的级分合并,并使用tff系统或amiconultra-15进行浓缩。然后对浓缩的溶液进行反相hplc纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在去离子水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)。将含有期望的胰岛素二聚体的级分合并和冷冻干燥或使用tff系统和/或amiconultra-15进行缓冲液更换以得到n6,29b,n6,29b’-胰岛素二聚体。
实施例14
一般方法c:使用水性碱条件合成n6,29b,n6,29b’-胰岛素二聚体.
在一个适当大小的容器中,将胰岛素或胰岛素类似物在轻轻搅拌下在室温溶解在混合溶剂中:2:3(v/v)0.1mna2co3:accn。将混合物澄清以后,使用碱溶液(例如,0.1nnaoh)将ph调至10.5-10.8的值。在单独的瓶中,将活化的酯中间体(接头)在室温溶解在有机溶剂(例如,dmso)中。活化的酯的溶液的等分试样在一段时间内加入含有胰岛素的溶液中,直到uplc色谱图表明,大部分未修饰的胰岛素已经反应,并且反应混合物的主要部分已经转化成n6,b29,n6,b29’-胰岛素二聚体(或n6,28b,n6,28b-赖脯胰岛素二聚体)。通过加入胺亲核体(例如,2-氨基乙醇)将反应物淬灭。将反应溶液在室温搅拌30分钟。将得到的溶液用冷h2o(20x)在0℃小心地稀释,并使用1nhcl(和0.1nnaoh,如果需要的话)将它的ph调至2.5的最终ph。首先将溶液通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先对浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的b29-缀合物的级分合并,并使用tff系统或amiconultra-15浓缩。然后将得到的溶液通过反相hplc进一步纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)。将含有标题胰岛素二聚体的级分合并和冷冻干燥,或使用tff系统和/或amiconultra-15进行缓冲液更换以得到n6,29b,n6,29b’-胰岛素二聚体。
实施例15
本实施例解释了n6,b29,n6,b29’-(2,2’-(乙烷-1,2-二基双(氧基))二乙酰基)双[人胰岛素](二聚体1)的合成.
将rhi(2.6g,0.448mmol)溶解在na2co3(0.1m)(15.8ml)和accn(10.5ml)的混合物中,并加入0.895ml(0.179mmol)0.2m的2,2’-(乙烷-1,2-二基双(氧基))二乙酸双(2,5-二氧代吡咯烷-1-基)酯(接头8)的dmf溶液。将反应混合物搅拌30min并加入0.895ml(0.179mmol)0.2m的2,2’-(乙烷-1,2-二基双(氧基))二乙酸双(2,5-二氧代吡咯烷-1-基)酯的dmf溶液的另外部分,并将反应混合物搅拌另外30min。将反应混合物倒入60ml的20%accn/0.1%tfa/水中,将ph调至2.5,并使用amiconultra-15(具有10kmwco膜)进行渗滤以浓缩直到得到的体积为约10ml。对得到的溶液进行离子交换色谱法(polysulfoethyla柱,250x21mm,5μm,1000å,梯度为历时30min10-80%的缓冲液b在缓冲液a中的溶液;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有标题化合物的级分合并和浓缩。然后对得到的溶液进行反相色谱法(kromasilc8250x50mm,10μm,100å柱;梯度27-35%的含有0.05%的tfa的accn在含有0.05%tfa的水中的溶液)。uplc-ms方法e:rt=2.75min,m/z=1960.4(z=6),1680.4(z=7)。
实施例16
本实施例解释了n2,1a,n2,1a’,n2,1b,n2,1b’-四(氨甲酰基)-n6,b29,n6,b29’-(己烷二酰基)双[人胰岛素](二聚体2)的合成。
将n2,1a,n2,1b-双(氨甲酰基)rhi(150mg,0.025mmol)溶解在dmso(1ml)中并加入三乙胺(0.106ml,0.764mmol),随后逐滴加入溶解在100μldmso中的己二酸二(n-琥珀酰亚胺基)酯(接头12)(4.33mg,0.013mmol)。搅拌1小时并将反应混合物倒入20ml水中。酸化至ph=2并使用10kamiconultra15进行渗滤。将产物使用在24分钟中10-40%的溶剂b在溶剂a中的溶液梯度通过离子交换色谱法纯化,并通过c-8相上的反相色谱法(在30分钟中26-36%的b在a中的溶液梯度)重纯化。uplc-ms方法e:rt=3.75min,m/z=1983.9,(z=6)。
实施例17
表3显示了使用rhi、desb30rhi、赖脯胰岛素、门冬胰岛素、甘精胰岛素或适当的类似物按照指出的一般方法b或一般方法c使用适当的中间体(接头)制备的二聚体。例如,对于具有氨甲酰基化的n-末端的二聚体,使用类似物5或类似物6(desb30);对于具有乙酰化的a1n-末端的二聚体,使用类似物8。使用uplc-ms方法d或uplc-ms方法e表征二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。由连接部分连接在一起的胰岛素和胰岛素的分子对于表3中所示的每种二聚体而言是相同的。
实施例18
一般方法d:使用cu2+催化的点击化学合成n6,29b,n6,29b’-胰岛素二聚体。
在一个适当大小的容器中,将适当的含乙炔的胰岛素中间体(类似物)在轻轻搅拌下在室温溶解在dmso和水性三乙基乙酸铵缓冲液(ph7.0,0.2mm终浓度)的混合溶剂中。在另一个适当大小的容器中,将适当的含叠氮基的胰岛素中间体(类似物)在轻轻搅拌下在室温溶解在dmso和水的混合溶剂中。将两份溶液合并,彻底混合,通过用n2在其中轻轻鼓泡进行脱气。向得到的溶液中加入新鲜制备的抗坏血酸钠或抗坏血酸溶液(终浓度是0.5mm)和彻底混合以后的10mmcuso4和三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺(即,tbta配体)在55%dmso中的溶液。通过用n2在其中轻轻鼓泡脱气和彻底混合以后,将混合物在间歇混合下在室温储存过夜。将反应混合物用混合的溶剂(v/v7:3accn/含有0.05%tfa的水)在0℃小心地稀释,并使用0.1、1.0nhcl(和0.1nnaoh,如果需要的话)将ph调至2.50。首先将溶液通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先对浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的期望产物的级分合并,并使用tff系统或amiconultra-15浓缩。然后将得到的溶液通过反相hplc进一步纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)。将含有期望纯度的期望产物的级分合并和冷冻干燥,或使用tff系统和/或amiconultra-15进行缓冲液更换以得到胰岛素二聚体。
表4列出了按照一般方法d使用适当的中间体制备的二聚体40、41、45、46、47、59、57、79、80、82和84。使用uplc-ms方法d或uplc-ms方法e或uplc-ms方法g表征这些二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。
实施例19
一般方法e:使用cu2+催化的双点击化学合成n6,29b,n6,29b’-胰岛素二聚体.
在一个适当大小的容器中,将适当的含有叠氮基的胰岛素中间体(类似物)在轻轻搅拌下在室温溶解在dmso和水性三乙基乙酸铵缓冲液(ph7.0,0.2mm终浓度)的混合溶剂中。在另一个适当大小的容器中,将适当的含有二乙炔的桥连或中间接头在轻轻搅拌下在室温溶解在dmso和水的混合溶剂中。将两份溶液合并,彻底混合,通过用n2轻轻鼓泡进行脱气。向得到的溶液中加入新鲜制备的抗坏血酸钠或抗坏血酸溶液(终浓度是0.5mm)和彻底混合以后的10mmcuso4和三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺(即,tbta配体)在55%dmso中的溶液。通过用n2气轻轻鼓泡脱气和彻底混合以后,将混合物在间歇混合下在室温储存过夜。将反应混合物用混合的溶剂(v/v7:3accn/含有0.05%tfa的水)在0℃小心地稀释,并使用0.1、1.0nhcl(和0.1nnaoh,如果需要的话)将ph调至2.50。首先将溶液通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先对浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的期望产物的级分合并,并使用tff系统或amiconultra-15浓缩。然后将得到的溶液通过反相hplc进一步纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)。将含有期望纯度的期望产物的级分合并和冷冻干燥,或使用tff系统和/或amiconultra-15进行缓冲液更换以得到胰岛素二聚体。
表5列出了按照一般方法e使用适当的中间体制备的二聚体42-44和54。二-乙炔桥连或中间接头是
使用uplc-ms方法d或uplc-ms方法e表征这些二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。
实施例20
本实施例解释了n2,1a,n2,1a’,n2,1b,n2,1b’-四(乙酰基或peg1或甲氧基乙酰基)-二聚体(二聚体48、55、56、69和70)的合成。
在室温向二聚体40、19或4(21mg,1.777µmol)在dmso(2ml)中的溶液中加入tea(3.96µl,0.028mmol),并然后加入乙酸-2,5-二氧代吡咯烷-1-基酯(2.23mg,0.014mmol)在dmso(100μl)中的溶液或其它适当的n-羟基琥珀酰亚胺活化的酯(2,5-二氧代吡咯烷-1-基甲氧基乙酸酯或2,5-二氧代吡咯烷-1-基peg1乙酸酯)在dmso(100µl)中的溶液。3小时以后,将反应混合物用12ml水/accn=7/3(含有0.1%tfa)的混合物稀释,并调节ph直到2.5。将得到的澄清溶液通过amiconultra15离心过滤器(具有10kmwco膜)浓缩。首先将得到的溶液进行离子交换色谱法(polysulfoethyla,250x21mm,5µm,1000å,15ml/min,梯度在30min中从5%至45%;缓冲液a:0.1%(v/v)h3po4/25%的乙腈在水中的溶液;缓冲液b:0.1%(v/v)h3po4/25%乙腈/0.5m的nacl水溶液)。将含有期望纯度的期望产物的级分合并,并使用amiconultra-15(具有10kmwco膜)浓缩。然后对得到的溶液进行反相hplc(kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05%的tfa在accn/h2o中的溶液;缓冲液b:0.05%accn;流速85ml/min)。将期望的级分合并和冷冻干燥以得到如在表6中所示的二聚体48、55、56、69或70。使用uplc-ms方法f或g。
n-端取代基具有结构
其中波浪线指示取代基和n-端氨基酸的n2氮之间的键。
实施例21
表7显示了二聚体49、50和51,并显示了与n2,a1,n2,b1,n2,a1’和n2,b1’的氨基连接的酰基。使用与关于制备二聚体48描述的程序类似的程序,但是用适当的n-羟基琥珀酰亚胺活化的酯替换乙酸-2,5-二氧代吡咯烷-1-基酯,从二聚体40制备这些二聚体,以产生二聚体49、50和51。活化的酯是2,5-二氧代吡咯烷-1-基fmoc-甘氨酸乙酸酯
使用uplc-ms方法f(二聚体50和51)或uplc-ms方法g(二聚体49)表征这些二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。二聚体显示在表7中。
n-端取代基具有结构
实施例22
本实施例解释了使用无铜点击化学合成二聚体52。
在室温向类似物3(10mg,1.686µmol)在1.0ml3:2(v/v)h2o/accn中的溶液中加入类似物4(10.5mg,1.686μmol)在1.0ml3:2(v/v)h2o/accn中的溶液。在室温搅拌2小时以后,首先对反应混合物进行离子交换色谱法(polysulfoethyla,250x21mm,5µm,1000å,15ml/min,梯度为在30min中从5%至45%;缓冲液a:0.1%(v/v)h3po4/25%的乙腈在水中的溶液;缓冲液b:0.1%(v/v)h3po4/25%乙腈/0.5m的nacl水溶液)。将含有期望纯度的期望产物的级分合并,并使用具有3k或10kmwco膜的amiconultra-15浓缩。然后对得到的溶液进行反相hplc(kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05%的tfa在accn/h2o中的溶液;缓冲液b:0.05%accn;流速85ml/min)。将期望的级分合并和冷冻干燥以得到二聚体52。uplc-ms方法f:rt=3.73min,m/z=1738.59[(m+7)/7+1]。结果显示在表8中。
实施例23
本实施例解释了n2,1a,n2,1a’,n2,1b,n2,1b’-四(二甲基或异丁基)-二聚体(二聚体60、58、65和67)的合成。
将二聚体40、19或4(100mg,8.46µmol)溶解(混悬液)在水(10ml)中并用乙酸溶液调至ph=4.0,然后加入甲醛(0.013ml,0.169mmol)或异丁醛(0.025ml,0.272mmol),随后加入新鲜制备的氰基硼氢化钠(10.63mg,0.169mmol)在水(500µl)中的溶液。形成沉淀。将混合物轻轻搅拌。反应结束以后约1小时,将混合物通过逐滴加入1nhcl至ph2.9小心地酸化。混悬液变成澄清溶液。通过反相制备型hplc纯化混合物(c-8柱,50x250cm,85ml/min,梯度为在25min中从29%至36%)(含有0.1%tfa的水和含有0.05%tfa的mecn)。将期望的级分低压冻干以得到二聚体(19.9mg,1.506µmol,17.80%收率)。uplc-ms方法d:rt=3.31min,m/z=1989.44[(m+6)/6+1]。
n-端取代基具有结构
二聚体显示在表9中。
实施例24
二聚体61、62、63、64和66的合成如下。
描述了6-((2-((2,5-二氧代吡咯烷-1-基)氧基)-2-氧代乙基)氨基)-6-氧代己酸-2,5-二氧代吡咯烷-1-基酯(c6-甘氨酸接头;接头24)的合成。
步骤1己二酸苄基(2,5-二氧代吡咯烷-1-基)酯
在0℃向6-(苄氧基)-6-氧代己酸(5g,21.16mmol)在dmf(10ml)中的溶液中加入n-乙基-n-异丙基丙烷-2-胺(4.44ml,25.4mmol),随后加入tstu(7.01g,23.28mmol)。将反应物在0℃搅拌1小时和在室温搅拌1小时。将混合物倒入冰水/乙醚混合物(1/1,100ml)中。将混合物用乙醚(3x50ml)萃取,用水(2x10ml)和盐水(10ml)洗涤。将有机层经mgso4干燥,穿过硅藻土垫过滤和浓缩以得到作为无色糖浆的标题化合物(5.2g,15.6mmol,74%)。lc-ms2min:rt=1.05min,m/z=334.1[m+1]。
步骤2-((羧甲基)氨基)-6-氧代己酸
向甘氨酸(225mg,3.0mmol)在dmf(2.5ml)中的溶液中逐滴加入步骤1的产物(1.0g,3.0mmol)在dmf(2.5ml)中的溶液,随后加入tea(418µl,3.0mmol)。将反应物在室温搅拌18小时。在减压下除去dmf。将粗制物通过c18反相色谱法纯化(用16个柱体积(cv)的0-40%accn/水洗脱)。将含有期望产物的级分合并,浓缩,并低压冻干以得到中间体(6-(苄氧基)-6-氧代己酰基)甘氨酸。向上面的中间体在水中的溶液(3ml)中,加入pd/c(10%,160mg,0.15mmol)。将反应物在氢气球下在室温搅拌18小时。将混合物穿过硅藻土垫过滤,用meoh/水(1/1,10ml)洗涤。将滤液浓缩和低压冻干以得到标题化合物(400mg,2.2mmol,66%)。lc-ms2min:rt=0.28min,m/z=204.03[m+1]。
步骤3.6-((2-((2,5-二氧代吡咯烷-1-基)氧基)-2-氧代乙基)氨基)-6-氧代己酸-2,5-二氧代吡咯烷-1-基酯
在0℃向步骤2的产物(10mg,0.049mmol)在dmf(0.5ml)中的溶液中加入tea(0.015ml,0.108mmol),随后加入tstu(31.1mg,0.103mmol)。将反应物温热至室温并在该温度搅拌1小时。tlc(etoac/meoh/水/accn:2:1:1:1(v:v:v:v))表明期望产物(rf:0.25)的形成,且没有剩余起始原料。将粗制物质不经纯化地用于构建二聚体。
与上面显示的方法类似地合成接头25(c6-丙氨酸)、接头26(c6-异亮氨酸)、接头27(c6-亮氨酸)和接头28(c6-缬氨酸),其中构成c6-氨基酸接头的氨基酸分别是丙氨酸、异亮氨酸、亮氨酸和缬氨酸。使用制备方法d使用上述接头构建二聚体。结果显示在表10中。
实施例25
二聚体73、89、90、91、92和93的合成如下。
描述了3,3’-(1,3-亚苯基)二丙酸双-2,5-二氧代吡咯烷-1-基酯(二丙基苯基;接头29)的合成。
步骤1.3,3’-(1,3-亚苯基)二丙酸双-2,5-二氧代吡咯烷-1-基酯
在0℃向3,3'-(1,3-亚苯基)二丙酸(21.8mg,0.098mmol)在dmf(0.6ml)中的溶液中加入tea(29ml,0.206mmol),随后加入tstu(62.0mg,0.206mmol)。将反应物温热至室温并在该温度搅拌1小时。tlc(etoac/meoh/水/accn:2/1/1/1)表明期望产物(rf:0.25)的形成,且没有剩余起始原料。uplc-ms方法b:rt=3.47min,m/z=417.19[m+1]。使用方法d使用类似物5将产物不经进一步纯化地用于构建二聚体73。
描述了苯-1,3-二甲酸双(2,5-二氧代吡咯烷-1-基)酯(对苯二甲酸酯;接头34)的合成。
步骤1.苯-1,3-二甲酸双(2,5-二氧代吡咯烷-1-基)酯
在0℃,向对酞酸(100mg,0.602mmol)在thf(2ml)中的溶液中加入2-(2,5-二氧代吡咯烷-1-基)-1,1,3,3-四甲基异脲鎓四氟硼酸盐(371mg,1.234mmol),随后加入n-乙基-n-异丙基丙烷-2-胺(0.222ml,1.234mmol))。30分钟以后,将冰浴除去。将溶液在室温搅拌1小时。加入另外的25mlthf,并将反应物在室温放置过夜。将产物浓缩至约5ml,并将一部分不经进一步纯化地原样用于使用方法d使用rhi构建二聚体89。将剩余的物质用乙酸乙酯(200ml)稀释,并用盐水(10ml)洗涤,将有机层用na2so4干燥,过滤并浓缩。
描述了间苯二甲酸双(2,5-二氧代吡咯烷-1-基)酯(间苯二甲酸酯;接头35)的合成。
步骤1.间苯二甲酸双(2,5-二氧代吡咯烷-1-基)酯
向异酞酸(54mg,0.325mmol)在dmso(1ml)中的溶液中加入tstu(215mg,0.715mmol),随后加入tea(0.137ml,0.975mmol)。lc-ms2min:rt=0.79min,m/z=721.28[2m+1]。将产物不经纯化地用于在方法e中使用rhi使用类似物5和二聚体91构建二聚体90。
描述了4-((叔-丁氧基羰基)氨基)庚烷二酸双(2,5-二氧代吡咯烷-1-基)酯(庚烷二酸酯;接头36)的合成。
步骤1.4-((叔-丁氧基羰基)氨基)庚烷二酸双(2,5-二氧代吡咯烷-1-基)酯
向4-((叔-丁氧基羰基)氨基)庚二酸(16.5mg,0.06mmol)在dmso(0.5ml)中的溶液中加入tstu(39.7mg,0.132mmol),随后加入tea(0.025ml,0.180mmol)。lc-ms2min:rt=0.90min,m/z=470.34[m+1]。将产物不经纯化地用于在方法e中使用rhi使用类似物5和二聚体93构建二聚体92。
结果显示在表11中。
实施例26
二聚体71、72、77、78、81和87的合成如下。描述了(1s,4s)-环己烷-1,4-二甲酸双(2,5-二氧代吡咯烷-1-基)酯(接头30;反式-环己烷1,4-二酸)的合成。
在0℃向(1s,4s)-环己烷-1,4-二甲酸(200mg,1.162mmol)在dcm(11ml)中的溶液中加入tstu(734mg,2.439mmol)和dipea(0.5ml,2.86mmol)。将得到的反应混合物在室温搅拌1小时。产物作为白色固体在反应溶液中析出(crushout);过滤,并用dcm(2x5ml)洗涤;并在真空中干燥以得到标题化合物。c16h18n2o8的uplc-ms计算值,366.11,观察到的m\e:367.16(m+h)+,(rt:3.20/5.00分钟)。uplc-ms方法a.1hnmr(500mhz,dmso):δ2.81-2.89(m;2h);2.80(s;8h);2.02-2.10(m;4h);1.57-1.63(m;4h)。
描述了(1r,4r)-环己烷-1,4-二甲酸双(2,5-二氧代吡咯烷-1-基)酯(接头31;顺式-环己烷1,4-二酸)的合成。
在0℃向(1r,4r)-环己烷-1,4-二甲酸(200mg,1.162mmol)在dcm(11ml)中的溶液中加入tstu(734mg,2.439mmol)和dipea(0.5ml,2.86mmol)。将得到的反应混合物在室温搅拌1小时。将残余物通过硅胶色谱法(0-100%etoac/己烷类)纯化以得到标题化合物。c16h18n2o8的uplc-ms计算值,366.11,观察到的m/z:367.17(m+h)+(rt:3.17/5.00分钟)。uplc-ms方法a.1hnmr(500mhz,dmso):δ3.02-3.08(m;2h);2.80(s;8h);1.80-1.90(m;8h)。
描述了(3r,5s)-哌啶-1,3,5-三甲酸1-(叔丁基)3,5-双(2,5-二氧代吡咯烷-1-基)酯(接头32)的合成。
在0℃向(3r,5s)-1-(叔-丁氧基羰基)哌啶-3,5-二甲酸(200mg,0.734mmol)在dmf(7ml)中的溶液中加入tstu(485mg,1.611mmol)和dipea(0.3ml,1.718mmol)。将得到的反应混合物在室温搅拌2小时。将残余物通过硅胶色谱法(0-100%etoac/己烷类)纯化以得到标题化合物。c20h25n3o10的uplc-ms计算值,467.15,观察到的m\e:468.30(m+h)+,(rt:0.98/2.00分钟)。uplc-ms方法a。
一般方法f:使用有机碱条件合成n6,29b,n6,29b’-胰岛素二聚体
在一个适当大小的容器中,在有碱(例如,tea或1,1,3,3-四甲基胍(tmg))存在下在室温将胰岛素或胰岛素类似物悬浮于有机溶剂或混合的水溶液/有机溶剂(例如,dmso)中。将混合物轻轻搅拌直到胰岛素完全溶解。向得到的溶液中加入活化的酯中间体在有机溶剂(诸如dmso或dmf)中的溶液。uplc以后,色谱图表明,反应混合物的主要部分已经转化成n6,29b,n6,b29b’-胰岛素二聚体(或n6,28b,n6,28b’-赖脯胰岛素二聚体),将反应溶液经由自动移液器转移至含有ipac/mtbe(v/v4:1)(45ml)的50ml离心管。逐滴完成加入。将得到的白色混悬液离心(3000rpm,15分钟,在4c)以产生澄清的上清液和白色沉淀物。将上清液抽出并将白色沉淀物在真空中干燥。然后在0℃将含有粗制中间体的白色沉淀物溶解在2mltfa中并在相同温度搅拌10分钟。脱-boc反应结束后,将反应溶液经由自动移液器转移至含有mtbe(45ml)的50ml离心管。逐滴完成加入。将得到的白色混悬液离心(3000rpm,15分钟,在4℃)以产生澄清的上清液和白色沉淀物。将上清液抽出并将白色沉淀物在真空中干燥,并再溶解在ch3cn/h2o(v/v1:4)溶液中。对反应混合物直接进行反相hplc纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在去离子水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液),或可以通过用冷的酸性h2o(20x,ph~3.0)在0℃小心稀释将反应物淬灭,并使用1nhcl(和0.1nnaoh,如果需要的话)将它的ph调至2.5的最终ph。可以首先将溶液通过超滤进行浓缩,无论是通过切向流过滤(tff)系统还是使用amiconultra-15离心单元(具有1k、3k或10kmwco膜)。经常首先对浓缩的溶液进行离子交换色谱法(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将含有期望纯度的b29-缀合物的级分合并,并使用tff系统或amiconultra-15浓缩。然后对浓缩的溶液进行反相hplc纯化(watersc4250x50mm柱,10μm,1000å柱或kromasilc8250x50mm,10μm,100å柱;缓冲液a:0.05-0.1%的tfa在去离子水中的溶液;缓冲液b:0.05-0.1%的tfa在accn中的溶液)。将含有期望的胰岛素二聚体的级分合并和冷冻干燥,或使用tff系统和/或amiconultra-15进行缓冲液更换以得到n6,29b,n6,29b’-胰岛素二聚体。
表12列出了二聚体71、72、77、78、81和87,其按照一般方法b(二聚体77和78)、一般方法c(二聚体71和72)或一般方法f(二聚体81和87)使用适当的接头制备。使用uplc-ms方法d或uplc-ms方法e表征这些二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。
实施例26
二聚体68和二聚体74的合成如下。
描述了6,6’-((6-氯-1,3,5-三嗪-2,4-二基)双(氮烷二基))二己酸双(2,5-二氧代吡咯烷-1-基)酯(接头33;c6n-氯-1,3,5-三嗪-nc6)的合成。
将2,4,6-三氯-1,3,5-三嗪(80mg,0.434mmol)和6-氨基己酸甲酯(129mg,0.889mmol)hcl盐在ch2cl2(1ml)中的溶液冷却至-30℃。逐滴加入dipea(0.379ml,2.169mmol)在ch2cl2(1ml)中的溶液。将混合物在-30℃至室温搅拌5小时。然后加入ch2cl2(20ml),并用hcl水溶液(1m)(2x10ml)、nahco3水溶液(10ml)和盐水(10ml)洗涤。将有机层经硫酸钠干燥和过滤,真空浓缩以得到6,6'-((6-氯-1,3,5-三嗪-2,4-二基)双(氮烷二基))二己酸二甲酯(135mg,0.336mmol)。
向6,6'-((6-氯-1,3,5-三嗪-2,4-二基)双(氮烷二基))二己酸二甲酯(135mg,0.336mmol)在thf(0.5ml)和甲醇(0.5ml)中的溶液中加入(2m)lioh水溶液(504µl,1.008mmol)。将混合物在室温搅拌1小时,然后在真空中浓缩以产生干燥的残余物。将残余物溶解在水中并用hcl水溶液中和。将沉淀物通过过滤进行收集并用水洗涤它。将固体在真空中干燥以得到6,6'-((6-氯-1,3,5-三嗪-2,4-二基)双(氮烷二基))二己酸。
向6,6'-((6-氯-1,3,5-三嗪-2,4-二基)双(氮烷二基))二己酸(108mg,0.289mmol)在dmf(2889µl)中的溶液中加入tstu(174mg,0.578mmol),随后加入三乙胺(81µl,0.578mmol)。将反应物搅拌1小时。uplc指示期望的物质的形成。uplc-ms方法c:rt=0.99min,m/z=568.2[m+1]。将该试剂(0.1m/dmf)不经进一步纯化地使用。
使用一般方法b(二聚体74)或一般方法c(二聚体68)制备二聚体。使用uplc-ms方法d或uplc-ms方法e表征这些二聚体,表现出在特定保留时间(rt)处的6个带电荷的(即[(m+6)/6])(或7个带电荷的,即[(m+7)/7])母体化合物物质。使用接头33和rhi构建二聚体68。使用接头33和类似物5构建二聚体74。结果显示在表13中。
实施例27
二聚体54的合成如下。
将a1-tfa-rhi(d.liu等人,journalofpeptidesci.,2012,18,336-341)(100mg,0.017mmol)溶解在含有水(5ml)和磷酸氢二钾(24.49mg,0.141mmol)的预混合物中(得到的溶液的ph是约.4)。加入氰酸钾(27.5mg,0.339mmol)并搅拌过夜。将产物通过c-8相上的反相色谱法纯化(柱kromasil,c810um100a,大小250x50mm;溶剂a=水/0.05%tfa,溶剂b=accn/0.05%tfa),流速=85ml/min,梯度为在30min中26-34%的b在a中的溶液。uplc-ms方法f:rt=4.48min,m/z=1486.9[(m+4)/4+1]。
将以上产物(60mg,10.09µmol)溶解在dmso(594µl)中并加入三乙胺(28.1µl,0.202mmol),随后加入接头辛二酸二琥珀酰亚胺基酯(1.858mg,5.04µmol)溶解在100μldmso中的溶液。搅拌3小时。uplc指示反应结束。将整个反应混合物加入氢氧化铵(2105µl,15.13mmol)中(逐滴,预期的放热)。轻轻搅拌2小时并证实tfa基团的去保护。将混合物用20ml水稀释,并通过使用10kamicon试管渗滤除去大部分的氢氧化铵。将ph调至约3并通过渗滤除去盐。将产物通过离子交换色谱法纯化(polysulfoethyla柱,polylcinc.,250x21mm,5μm,1000å;缓冲液a:0.1%(v/v)h3po4/25%accn;缓冲液b:0.1%(v/v)h3po4/25%accn/0.5mnacl)。将产物通过c-8相上的反相色谱法重纯化(柱kromasil,c810µm100a,大小250x50mm;溶剂a=水/0.05%tfa,溶剂b=accn/0.05%tfa)。结果显示在下面。结果显示在表14中。
实施例28
如下执行胰岛素受体结合测定。
使用从过表达人ir(b)的cho细胞制备的细胞膜以384-孔形式在闪烁迫近测定(spa)中进行ir结合测定,所述cho细胞培养在含有10%fbs和抗生素(g418、青霉素/抗生蛋白链菌素)的f12培养基中。在含有5mmmgcl2的50mmtris缓冲液(ph7.8)中制备细胞膜。测定缓冲液含有50mmtris缓冲液(ph7.5)、150mmnacl、1mmcacl2、5mmmgcl2、0.1%bsa和蛋白酶抑制剂(complete-mini-roche)。将细胞膜加给wgapvtpeispa珠子(5mg/ml终浓度),随后以适当的浓度加入胰岛素二聚体分子。在室温温育5-15min以后,以0.015nm终浓度加入125[i]-胰岛素至50μl的最终总体积。将混合物在室温摇动下温育1-12小时,随后闪烁计数以确定对ir的125[i]-胰岛素结合和胰岛素二聚体分子对该相互作用的滴定效应。
实施例29
如下执行胰岛素受体(ir)akt-磷酸化测定。
irakt-磷酸化测定:通过测量akt蛋白的磷酸化(胰岛素受体信号传递级联中的一个关键步骤),可以评估胰岛素受体活化。将过表达人ir的cho细胞系用在htrf夹心elisa测定试剂盒(cisbio“磷酸-akt(ser473)和磷酸-akt(thr308)细胞测定试剂盒”)中。将细胞在补充了10%fbs、400μg/mlg418和10mmhepes的f12培养基中培养。在测定之前,将细胞在无血清的培养基中温育2-4小时。可替换地,可以将细胞冷冻并并预先等分在含有20%dmso的培养基中,并在融化后用在测定中,离心并重新悬浮。将细胞以10,000个细胞/孔铺板在384-孔平板内的20μl无血清的f12培养基中。在测试化合物的每个平板上运行humulin和甘精胰岛素对照。将滴定的化合物加给细胞(2μl/孔,终浓度=1000nm,以1:5倍稀释度滴定至0.512pm),并在37℃温育30min。将细胞用提供在cisbio试剂盒中的8μl制备的裂解缓冲液裂解并在25℃温育1小时。根据试剂盒说明书制备稀释的抗体试剂(抗-akt-d2和抗-pakt-eu3/穴状化合物),并然后将10μl加入细胞裂解物的每个孔中,随后在25℃温育3.5-5小时。用envision平板读数器(激发=320nm;发射=665nm)读出平板以关于每种化合物的效能和最大应答确定irpakt激动剂活性。可替换地,在有1.6nmhumulin存在下以相同方式测试化合物以确定每种化合物是否能够竞争胰岛素的完全激动剂活性。
实施例30
表15显示了胰岛素二聚体对胰岛素受体(ir)的体外生物活性。通过如在实施例28中描述的配体竞争测定或如在实施例29中描述的功能性akt-磷酸化测定,测量活性。
实施例31
在该实施例中,将本发明的几种胰岛素受体部分激动剂的体内效应与在deppe等人,nauyn-schmiedeberg’sarch.pharmacol.350:213-217(1994)中公开的化合物a(在公布的pct申请号wo2014052451中公开的胰岛素二聚体miu-90)和化合物b(b29,b29’-辛二酰基-(胰岛素)2)进行对比,但是在腹膜内胰岛素耐量测试(ip-itt)测定(在成年雄性精瘦的c57bl/6ntac小鼠中执行)中使用rhi替代牛胰岛素。
按重量(平均约30克)将每组n=6-8只动物的组随机化。在研究之前2天,为5ml/kg给药体积的0.9%氯化钠溶液的腹膜内注射处理小鼠。在研究的早晨,在研究之前2或4小时除去食物。在t=0min(基线)使用血糖仪确定血糖浓度。然后经由腹膜内注射给小鼠施用5ml/kg的媒介物、二聚体24、二聚体55、二聚体58、二聚体60、二聚体67、化合物a、化合物b或humulin(rhi)(关于使用的剂量,参见表16)。从给药后30-360分钟之间采集的尾血确定血糖水平。
结果显示在图2a、2b、2c、2d、2e、2f和2g中。结果表明,二聚体24、二聚体55、二聚体58、二聚体60和二聚体67的葡萄糖概况在测试的两种剂量是基本上相同的,而增加化合物a和b的剂量会造成增加的葡萄糖降低效能,从而指示所述二聚体相对于rhi或化合物a和b而言更小的高血糖风险潜力。
实施例32
如下在diabeticyucatan微型猪(d微型猪)中将二聚体24、18和40的葡萄糖降低效应与rhi进行了对比。
按照sinclairresearchcenter(auxvasse,mo)开发的专有方案,通过四氧嘧啶注射使yucatan微型猪患上i型糖尿病。如果基础葡萄糖水平超过150mg/dl,认为诱导是成功的。在这些实验中利用具有大约300mg/dl的血糖水平的d微型猪。
在这些研究中使用雄性yucatan微型猪,其配有两个颈静脉血通路(vascularaccessport)(vap)。在过夜禁食以后研究当天,将微型猪放在吊索中,并使用vap用于输注和取样。在t=0min,和收集两个基线血液样品用于血糖测量(t=-30分钟和t=0分钟)以后,以0.69nmol/kg给微型猪施用humulin(重组人胰岛素,rhi)或irpa作为单次静脉内推注。将humulin和irpa以69nmol/ml配制在缓冲液中,所述缓冲液含有:甘油,16mg/ml;间甲酚,1.6mg/ml;苯酚,0.65mg/ml;无水磷酸氢二钠,3.8mg/ml;用hcl将ph调至7.4。给药以后,继续取样480分钟;样品收集的时间点是-30min、0min、8min、15min、30min、45min、60min、90min、120min、150min、180min、210min、240min、270min、300min、330min、360min、420min、480min。将血液收集在补充了10µg/ml抑肽酶的k3-edta试管中,并保持在冰上直到处理,所述处理发生在收集的30分钟内。在3000rpm、4℃离心8min以后,收集血浆并等分用于葡萄糖测量(使用beckmancoulterau480chemistry分析仪)和用于化合物水平测量。
图1表明,在0.69nmol/kg浓度,rhi将血清葡萄糖水平降低到50mg/dl以下,而胰岛素二聚体没有。该结果表明,胰岛素二聚体存在比rhi更小的促进低血糖症的风险。
实施例33
如下在diabeticyucatan微型猪(d微型猪)中将二聚体4、5、7、8、9、18-29、32、37-41、43、44、48、55、57、58、60、61、62、64、67、69、71、72、77和78的葡萄糖降低效应与rhi进行了对比。
按照sinclairresearchcenter(auxvasse,mo)开发的专有方案,通过四氧嘧啶注射使yucatan微型猪患上i型糖尿病。如果基础葡萄糖水平超过150mg/dl,认为诱导是成功的。在这些实验中利用具有大约300-400mg/dl的血糖水平的d微型猪,其配有两个颈静脉血通路(vap)。在过夜禁食以后研究当天,将微型猪放在吊索中,并访问vap用于输注和取样。在t=0min,和收集两个基线血液样品用于血糖测量(t=-30分钟和t=0分钟)以后,以0.69nmol/kg给微型猪施用humulin(重组人胰岛素,rhi)或其它二聚体作为单次静脉内推注(对于化合物#78,0.35nmol/kg)。将humulin和二聚体以69nmol/ml配制在缓冲液中,所述缓冲液含有:甘油,16mg/ml;间甲酚,1.6mg/ml;苯酚,0.65mg/ml;无水磷酸氢二钠,3.8mg/ml,用hcl将ph调至7.4。给药以后,继续取样480分钟;样品收集的时间点是-30分钟、0分钟、8分钟、15分钟、30分钟、45分钟、60分钟、90分钟、120分钟、150分钟、180分钟、210分钟、240分钟、270分钟、300分钟、330分钟、360分钟、420分钟和480分钟。将血液收集在补充了10µg/ml抑肽酶的k3-edta试管中,并保持在冰上直到处理,所述处理发生在收集的30分钟内。在3000rpm、4℃离心8min以后,收集血浆并等分用于葡萄糖测量(使用beckmancoulterau480chemistry分析仪)。结果显示在图7a-7h中。所述图表明,在0.69nmol/kg浓度,rhi将血清葡萄糖水平降低至50mg/dl以下,而胰岛素二聚体没有。该结果表明,胰岛素二聚体存在比rhi更小的促进低血糖症的风险。
实施例34
该实验将化合物a的二硫键连接部分的稳定性与二聚体24的辛二酰基(c8)连接部分进行了对比。
在有或没有5mm谷胱甘肽(gsh)存在下将1µm化合物a和二聚体24各自分别在大鼠肾细胞膜(rkcm)中温育。得到时间0和时间2小时样品,并将反应物用1体积的10%meoh在含有0.1%甲酸的accn中的溶液淬灭。然后将淬灭的样品离心并在分析之前冷冻。然后将样品融化和使用thermoorbivelos系统进行分析。在10ppm窗口使用来自2种电荷状态的3种同位素用提取的离子色谱图(extractedionchromatogram,xic)执行靶向metid分析。
在没有gsh和具有gsh的rkcm中检测化合物a代谢物。如在图3中所示,通过2小时温育,单体是母体(化合物a的储备溶液)的约1%。如在图4中所示,通过2小时温育,单体是母体(化合物a的储备溶液)的约6.5%。结果表明二硫键随时间断裂。在化合物a的0小时对照中或在储备溶液中没有观察到代谢物。
二聚体24产生了在rkcm中检测到的代谢物,但是,尽管观察到由于a-链多肽和b-链多肽之间的二硫键的断裂引起的a-链多肽的损失,没有检测到单体。图5表明,在没有gsh时,a-链多肽的损失小于母体(二聚体24的储备溶液)的1%。图6表明,在有gsh时,a-链多肽的损失小于母体(二聚体24的储备溶液)的1%。在二聚体24的0小时对照中或在储备溶液中没有观察到代谢物。使用酸性条件的新淬灭程序适当地停止二硫键交换。
尽管在本文中参考说明性实施方案描述了本发明,但是应当理解,本发明不限于此。具有本领域普通技术且有权使用本文教导的人员将认识到在其范围内的另外改变和实施方案。因此,本发明仅由本文所附的权利要求书限制。
序列表
<110>lin,songnian
yan,lin
huo,pei
pissarnitski,dmitri
feng,danqing
nargund,ravi
zhu,yuping
kekec,ahmet
madsen-duggan,christinab
shi,zhi-cai
wu,zhicai
mu,yingjun
<120>胰岛素受体部分激动剂
<130>23876
<160>11
<170>patentin3.5版
<210>1
<211>21
<212>prt
<213>智人
<400>1
glyilevalgluglncyscysthrserilecysserleutyrglnleu
151015
gluasntyrcysasn
20
<210>2
<211>30
<212>prt
<213>智人
<400>2
phevalasnglnhisleucysglyserhisleuvalglualaleutyr
151015
leuvalcysglygluargglyphephetyrthrprolysthr
202530
<210>3
<211>21
<212>prt
<213>人工序列
<220>
<223>胰岛素a链突变蛋白
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa是异亮氨酸或苏氨酸
<220>
<221>misc_feature
<222>(3)..(3)
<223>xaa是缬氨酸、甘氨酸或亮氨酸
<220>
<221>misc_feature
<222>(8)..(8)
<223>xaa是苏氨酸或组氨酸
<220>
<221>misc_feature
<222>(17)..(17)
<223>xaa是谷氨酸或谷氨酰胺
<220>
<221>misc_feature
<222>(19)..(19)
<223>xaa是酪氨酸、4-甲氧基-苯丙氨酸、丙氨酸或4-氨基苯丙氨酸
<220>
<221>misc_feature
<222>(21)..(21)
<223>xaa可以是任意天然存在的氨基酸
<220>
<221>misc_feature
<222>(23)..(23)
<223>xaa是天冬酰胺或甘氨酸
<400>3
glyxaaxaagluglncyscysxaaserilecysserleutyrglnleu
151015
xaaasnxaacysxaa
20
<210>4
<211>25
<212>prt
<213>人工序列
<220>
<223>胰岛素b链变体
<220>
<221>misc_feature
<222>(1)..(1)
<223>xaa是组氨酸或苏氨酸
<220>
<221>misc_feature
<222>(1)..(25)
<223>前提条件是,24或25中的至少一个是赖氨酸
<220>
<221>misc_feature
<222>(5)..(5)
<223>xaa是丙氨酸、甘氨酸或丝氨酸
<220>
<221>misc_feature
<222>(6)..(6)
<223>xaa是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸
<220>
<221>misc_feature
<222>(21)..(21)
<223>xaa是脯氨酸或赖氨酸
<220>
<221>misc_feature
<222>(24)..(24)
<223>xaa是脯氨酸或赖氨酸
<220>
<221>misc_feature
<222>(25)..(25)
<223>xaa是脯氨酸或赖氨酸
<400>4
xaaleucysglyxaaxaaleuvalglualaleutyrleuvalcysgly
151015
gluargglyphexaatyrthrxaaxaa
2025
<210>5
<211>32
<212>prt
<213>人工序列
<220>
<223>胰岛素b链变体
<220>
<221>misc_feature
<222>(1)..(1)
<223>xaa是苯丙氨酸或脱氨基-苯丙氨酸
<220>
<221>misc_feature
<222>(1)..(32)
<223>前提条件是,28或29中的至少一个是赖氨酸
<220>
<221>misc_feature
<222>(5)..(5)
<223>xaa是组氨酸或苏氨酸
<220>
<221>misc_feature
<222>(6)..(6)
<223>xaa是甘氨酸或亮氨酸
<220>
<221>misc_feature
<222>(9)..(9)
<223>xaa是丙氨酸、甘氨酸或丝氨酸
<220>
<221>misc_feature
<222>(10)..(10)
<223>xaa是组氨酸、天冬氨酸、谷氨酸、高半胱磺酸或半胱磺酸
<220>
<221>misc_feature
<222>(25)..(25)
<223>xaa是苯丙氨酸或天冬氨酸
<220>
<221>misc_feature
<222>(28)..(28)
<223>xaa是天冬氨酸、脯氨酸或赖氨酸
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa是赖氨酸或脯氨酸
<220>
<221>misc_feature
<222>(30)..(30)
<223>xaa是苏氨酸、丙氨酸或不存在
<220>
<221>misc_feature
<222>(31)..(31)
<223>xaa是精氨酸或不存在
<220>
<221>misc_feature
<222>(32)..(32)
<223>xaa是精氨酸或不存在
<400>5
xaavalasnglnxaaxaacysglyxaaxaaleuvalglualaleutyr
151015
leuvalcysglygluargglyphexaatyrthrxaaxaaxaaxaaxaa
202530
<210>6
<211>30
<212>prt
<213>人工序列
<220>
<223>赖脯胰岛素b链
<400>6
phevalasnglnhisleucysglyserhisleuvalglualaleutyr
151015
leuvalcysglygluargglyphephetyrthrlysprothr
202530
<210>7
<211>21
<212>prt
<213>人工序列
<220>
<223>甘精胰岛素a链
<400>7
glyilevalgluglncyscysthrserilecysserleutyrglnleu
151015
gluasntyrcysgly
20
<210>8
<211>32
<212>prt
<213>人工序列
<220>
<223>甘精胰岛素b链
<400>8
phevalasnglnhisleucysglyserhisleuvalglualaleutyr
151015
leuvalcysglygluargglyphephetyrthrprolysthrargarg
202530
<210>9
<211>30
<212>prt
<213>人工序列
<220>
<223>门冬胰岛素b链
<400>9
phevalasnglnhisleucysglyserhisleuvalglualaleutyr
151015
leuvalcysglygluargglyphephetyrthrasplysthr
202530
<210>10
<211>29
<212>prt
<213>人工序列
<220>
<223>des30b链
<400>10
phevalasnglnhisleucysglyserhisleuvalglualaleutyr
151015
leuvalcysglygluargglyphephetyrthrprolys
2025
<210>11
<211>21
<212>prt
<213>人工序列
<220>
<223>a链y19a
<400>11
glyilevalgluglncyscysthrserilecysserleutyrglnleu
151015
gluasnalacysasn
20
- 还没有人留言评论。精彩留言会获得点赞!