一种抗肿瘤疫苗分子及其制备方法和应用与流程
本发明涉及抗肿瘤疫苗领域,具体涉及一种抗肿瘤疫苗分子及其制备方法和应用。
背景技术:
细胞生物学和生物化学的广泛研究表明,肿瘤相关抗原(tacas,例如muc1糖蛋白)是免疫治疗的理想靶点,在免疫治疗抗癌策略的发展中被大力追求。
迄今为止,免疫疗法已被证明是最有前途的癌症治疗方法之一,提供了许多可能性。
然而,由于常用的肿瘤相关抗原作为自身抗原,抗原性差,免疫调节耐受性差的原因,导致不能引起有效的免疫应答。因此,提高肿瘤相关抗原的免疫原性,成为急需解决的问题。
大量的研究都努力去获得更好的免疫原性的肿瘤相关抗原,以及将抗原连接到不同免疫刺激组分的连接体:完全合成的含内置佐剂的两组分抗癌疫苗,含th细胞表位和内置佐剂的三组分抗癌疫苗或具有th、tc细胞表位和内置佐剂的多组分抗癌疫苗,其中常用的佐剂包括toll样受体2脂肽配体(pam3csk4)、单磷酰脂质a(mpla)、cpg、nkt细胞激动剂(αgalcer)等。动物实验结果表明,随着疫苗组分数量的增加,小鼠对肿瘤相关抗原的免疫应答可能逐渐增强,但合成难度进一步加剧。
进一步地,也有研究公开疫苗配备了优化的未共价连接的muc1或尼古丁抗原和αgalcer,显著提高了抗原的免疫原性。
另外,半合成抗癌疫苗通常为肿瘤相关抗原与不同的载体蛋白结合,然后与佐剂混合组成疫苗,其中载体蛋白包括牛血清白蛋白(bsa)、crm197(白喉毒素无毒突变体)、破伤风类毒素(ttox)和钥孔血蓝蛋白(klh)。鉴于载体蛋白具有多个tc和th表位,可以增强抗原的提呈,进而能够容易地提高疫苗的免疫反应。
然而,为了开发更有效的抗肿瘤免疫治疗策略,目前的挑战仍然存在。
并且,toll样受体(tlr)是一种细胞内模式识别受体,能够识别多种病原体高度保守的成分,诱导宿主的先天和适应性免疫反应。其次,具有调节抗原呈递细胞活化的潜能,加强共刺激分子和许多细胞因子的分泌。
技术实现要素:
本发明的目的是为了克服现有技术存在的肿瘤相关抗原免疫原性差的问题。
为了实现上述目的,本发明的第一方面提供一种具有式(i)所示结构的抗肿瘤疫苗分子,在所述式(i)中,a为佐剂,b为抗原,且m个所述a分别通过共价连接臂与所述蛋白共价连接,以及n个所述b分别通过共价连接臂与所述蛋白共价连接,所述蛋白中的氨基酸分子数大于等于100;所述式(i)中的m为大于等于1的整数,n为大于等于1的整数;
am-蛋白-bn式(i)。
本发明的第二方面提供一种制备前述第一方面所述具有式(i)所示结构的抗肿瘤疫苗分子的方法,该方法包括:
将抗原与蛋白进行第一偶联,并将得到的第一中间体与佐剂进行第二偶联;或者
将佐剂与蛋白进行第三偶联,并将得到的第二中间体与抗原进行第四偶联。
本发明的第三方面提供前述第一方面所述具有式(i)所示结构的抗肿瘤疫苗分子在抗肿瘤疫苗中的应用。
用于疫苗的多肽和蛋白质在结构、制备和性质上有明显的区别:(1)多肽的组成氨基酸个数少(<100,一般使用的多肽<50个氨基酸)、分子量小;蛋白质组成氨基酸个数多(>100)、分子量大、体积大;(2)多肽一般通过化学合成,可修饰位点较少,容易在化学合成过程中或合成后修饰,可用hplc提纯;蛋白质一般通过生物合成,可修饰位点多,主要在合成后水相中修饰,不能用hplc提纯;(3)多肽体积小,易扩散,不易在淋巴组织富集,所含th和tc表位一般少于3个,免疫原性较弱;蛋白质体积大,不易扩散,容易在淋巴组织富集,所含th和tc表位多,免疫原性较强。
本发明提供的内嵌佐剂蛋白偶联物策略的设计是设计高效免疫治疗抗癌疫苗的有效策略。与传统疫苗策略相比,本发明中的抗肿瘤疫苗是新的抗肿瘤分子,免疫性能好,能够产生较高滴度的igg抗体和较强的细胞免疫能力,热稳定性好,易于保存和运输。
附图说明
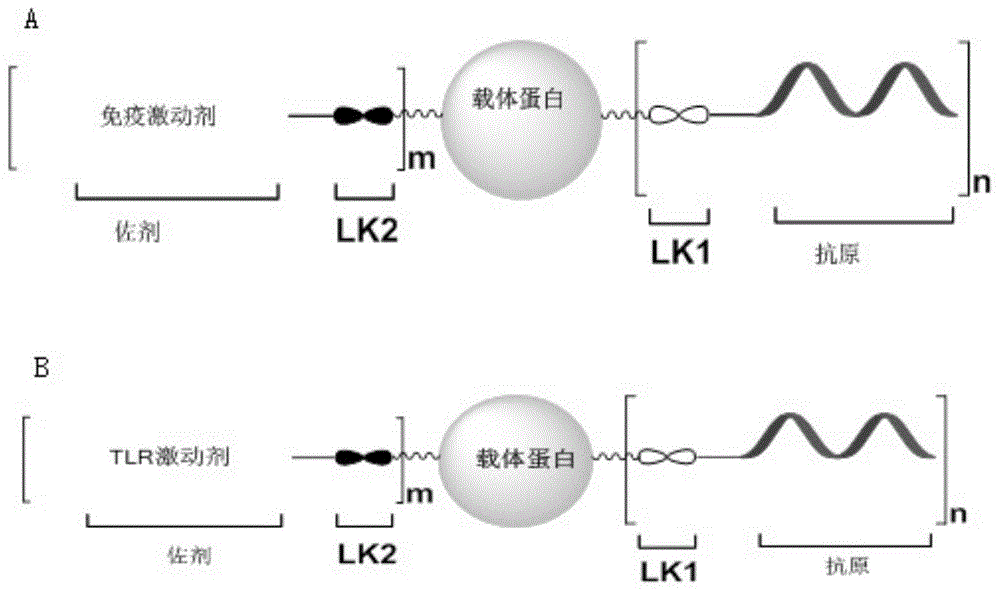
图1为本发明的优选的具体实施方式抗肿瘤疫苗分子,其中,图1a表示根据本发明的优选的具体实施方式所述的抗肿瘤疫苗分子,在图1a中,免疫激动剂为佐剂,lk1和lk2均表示共价连接臂;图1b表示根据本发明的另一个更优选的具体实施方式所述的抗肿瘤疫苗分子,在图1b中,tlr激动剂为佐剂,lk1和lk2均表示共价连接臂。
图2表示实施例9中所述的对于第一次免疫后2h取的血清,细胞因子ifn-γ和il-6测试。
图3表示实施例10中所述的三免针对muc1的igg抗体滴度测试结果。
图4表示实施例10中所述的一免、二免、三免针对muc1的igg抗体滴度测试结果对比。
图5表示实施例10中所述的一免、二免、三免针对muc1的igm抗体滴度测试结果对比。
图6表示实施例10中所述的三免针对muc1的igg亚型抗体滴度测试结果对比。
图7表示实施例11中所述的三免针对bsa的igg抗体滴度测试结果对比。
图8表示实施例12中所述的用mtt法测定mcf-7细胞的存活率。
图9表示实施例13中所述的用流式细胞仪测定疫苗诱导抗血清与mcf-7细胞的结合情况。
图10表示实施例15中所述的mcf-7细胞的裂解率。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
如前所述,本发明的第一方面提供了一种具有式(i)所示结构的抗肿瘤疫苗分子,在所述式(i)中,a为佐剂,b为抗原,且m个所述a分别通过至少一个共价连接臂与所述蛋白共价连接,以及n个所述b分别通过至少一个共价连接臂与所述蛋白共价连接所述蛋白中的氨基酸分子数大于等于100;所述式(i)中的m为大于等于1的整数,n为大于等于1的整数;
am-蛋白-bn式(i)。
根据第一种优选的具体实施方式,所述式(i)中的m为1,n为大于等于1的整数;例如m为1,n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等。
根据第二种优选的具体实施方式,所述式(i)中的m为1,n为大于等于2的整数;例如m为1,n为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等。
根据第三种优选的具体实施方式,所述式(i)中的m为大于等于2的整数,n为大于等于1的整数;例如m为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等,n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等。
根据第四种优选的具体实施方式,所述式(i)中的m为大于等于2的整数,n为大于等于2的整数;例如m为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等,n为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20等。
在本发明中,所述佐剂和所述蛋白能够通过任意可共价连接的位点彼此共价连接,并且,所述抗原和所述蛋白也能够通过任意可共价连接的位点彼此共价连接。
优选地,所述抗原包括肿瘤相关抗原、肿瘤特异性抗原、病原体抗原、生物毒素和生物分子抗原中的至少一种。
本发明所述肿瘤相关抗原是指在肿瘤细胞或正常细胞上存在的抗原分子,例如包括:胚胎性蛋白、糖蛋白抗原、鳞状细胞抗原等,常用于临床肿瘤的诊断。肿瘤相关抗原并非肿瘤细胞所特有,正常细胞可微量合成,而在肿瘤细胞增殖时高度表达,因此称为“相关抗原”。
本发明所述肿瘤特异性抗原指仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原,故又称独特肿瘤抗原。
优选地,所述肿瘤相关抗原选自肿瘤相关多肽抗原、肿瘤相关糖肽抗原和肿瘤相关糖抗原中的至少一种。
优选地,所述抗原中含有选自muc1、muc16、ny-eso-1、mage-a1/3/4、wt1、stat3、her2和gp100中的至少一种多肽或糖肽。
本发明所述muc1为一种糖基化修饰、高分子量(mr>200×103)的黏蛋白1,是跨膜分子,其跨膜序列如棒状插入细胞膜,并有一个由69个氨基酸残基组成的尾延伸到细胞质中。
本发明所述muc16又名ca125,是一种表达于各类上皮细胞表面的高分子量糖蛋白,主要发挥保护和修复上皮的作用。
本发明所述ny-eso-1表示纽约食管鳞状细胞癌1(ny-eso-1),是一种癌症-睾丸抗原(cta),在许多肿瘤中再表达。
本发明所述mage-a1/3/4表示检测肿瘤-睾丸抗原(cta)黑色素抗原a(mage-a)。
本发明所述wt1表示wilms肿瘤蛋白,由人类wt1基因表达。
本发明所述stat3表示信号传导与活化转录因子3。
本发明所述her2表示人表皮生长因子受体-2(her2)。
本发明所述gp100表示黑色素相关抗原。
优选地,所述抗原中含有muc1,更优选所述muc1抗原选自以下结构中的至少一种:
其中,在含有muc1的所述抗原的结构中,各个r1、r2、r3、r4和r5所连接的均为氨基酸残基修饰基团,且各个r1、r2、r3、r4和r5各自独立地选自氢和以下所示的糖结构:
优选地,所述肿瘤相关糖抗原选自以下结构中的至少一种:
在本发明所述的抗肿瘤疫苗分子中,所述蛋白优选选自牛血清白蛋白(bsa)、鸡卵白蛋白(ova)、匙孔血蓝蛋白(klh)、破伤风类毒素(tt)、白喉类毒素(dt)、流感嗜血杆菌d蛋白、b群脑膜炎球菌外膜蛋白复合体(omp)、百日咳类毒素、伤寒杆菌鞭毛、肺炎球菌溶血素(ply)和无毒性的白喉毒素突变体(crm197)中的至少一种。
优选情况下,在本发明所述的抗肿瘤疫苗分子中,所述佐剂为模式识别受体激动剂。
优选地,所述模式识别受体激动剂选自toll样受体激动剂和nkt激动剂中的至少一种;更优选地,所述toll样受体激动剂选自tlr7激动剂、tlr8激动剂、tlr9激动剂、tlr3激动剂、tlr2激动剂和tlr4激动剂中的至少一种。
特别优选情况下,tlr7激动剂的代表性结构如下所示:
其中,
在上述tlr7激动剂的代表性结构中,r1选自以下结构中的任意一种:
在上述tlr7激动剂的代表性结构中,r2选自以下结构中的任意一种:
在其他优选的情况下,tlr7激动剂的代表性结构如下所示:
特别优选情况下,tlr8激动剂的代表性结构如下:
特别优选情况下,tlr9激动剂为cpg-odn,代表性结构如下:
其中,5-(p=s)tccatgacgttcctgacgt表示核酸序列。
特别优选情况下,tlr3激动剂为poly(i:c)和poly-iclc,代表性结构如下:
poly(i:c)为聚肌胞甘酸,为聚肌甘酸-聚胞甘酸,是双链rna的类似物,一条链是poly(i),另一条链是poly(c)。
poly-iclc是一种用聚赖氨酸和羧甲基纤维素(lc)稳定的合成双链聚核糖肌苷-聚核糖胞苷酸poly(i:c)。
特别优选情况下,tlr2激动剂的代表性结构如下:
特别优选情况下,tlr4激动剂的代表性结构如下:
r3代表氢原子或者磷酸基;
r4、r5、r6、r7各自独立地代表1-20碳个数的脂肪酰基;
r8代表氢原子或磷酸基;
r9代表羟基、氨基或羧基;
a、b、c、d代表1-20碳个数的烷基。
特别优选情况下,tlr4激动剂的代表性结构如下:
r8代表氢原子或者磷酸基;
r9代表羟基、氨基、羧基、磷酸基;
r10代表氢原子或者甲基,包括r/s构型;
r11和r12各自独立地代表羟基、氨基、羧基;
r13、r14和r15各自独立地代表1-20碳个数的脂肪酰基;
x代表氧或硫或硒原子或者氨基;
z代表氧或氨基;
e、f和g代表1-20碳个数的烷基;
h、i、j和k各自独立地代表0-6的整数。
特别优选情况下,nkt细胞激动剂代表性结构如下所示:
优选情况下,在本发明所述的抗肿瘤疫苗分子中,各个所述共价连接臂的结构各自独立地选自以下结构:
-co-、-o-co-、-nh-co-、-nh(c=nh)-、-so2-、-o-so2-、-nh-、-nh-co-ch2-、-ch2-、-c2h4-、-c3h6-、-c4h8-、-c5h10-、-c6h12-、-c7h14-、-c8h16-、-c9h18-、-c10h20-、-ch(ch3)-、-c[(ch3)2]-、-ch2-ch(ch3)-、-ch(ch3)-ch2-、-ch(ch3)-c2h4-、-ch2-ch(ch3)-ch2-、-c2h4-ch(ch3)-、-ch2-c[(ch3)2]-、-c[(ch3)2]-ch2-、-ch(ch3)-ch(ch3)-、-c[(c2h5)(ch3)]-、-ch(c3h7)-、-(ch2-ch2-o)p-ch2-ch2-、-co-ch2-、-co-c2h4-、-co-c3h6-、-co-c4h8-、-co-c5h10-、-co-c6h12-、-co-c7h14-、-co-c8h16-、-co-c9h18-、-co-c10h20-、-co-ch(ch3)-、-co-c[(ch3)2]-、-co-ch2-ch(ch3)-、-co-ch(ch3)-ch2-、-co-ch(ch3)-c2h4-、-co-ch2-ch(ch3)-ch2-、-co-c2h4-ch(ch3)-、-co-ch2-c[(ch3)2]-、-co-c[(ch3)2]-ch2-、-co-ch(ch3)-ch(ch3)-、-co-c[(c2h5)(ch3)]-、-co-ch(c3h7)-或-co-(ch2-ch2-o)p-ch2-ch2-;
其中,在所述共价连接臂的结构中,
各个x各自独立地选自1-60的整数;
各个y各自独立地选自-nh-、-o-、-s-和-s-s-中的至少一种;
各个p各自独立地选自1-60的整数。
本发明对制备前述抗肿瘤疫苗分子的方法没有特别的限定,本领域技术人员可以结合本领域抗肿瘤疫苗分子的结构特点和本领域的常规合成方法确定合适的方法来制备所述抗肿瘤疫苗分子,并且,本发明的实例部分示例性地列举了部分抗肿瘤疫苗分子的具体制备方法,本领域技术人员也能够结合本发明示例性列举的制备方法来确定本发明所有抗肿瘤疫苗分子的具体制备方法,但是,本领域技术人员不应理解为这是对本发明的限制。
同样地,本发明所述抗肿瘤疫苗分子中的佐剂、抗原和蛋白既可以通过采用现有的方法合成获得,也可以通过商购获得,本发明对此没有限制。
优选情况下,如前所述,本发明的第二方面提供了一种制备本发明前述第一方面所述的抗肿瘤疫苗分子的方法,该方法包括:
将抗原与蛋白进行第一偶联,并将得到的第一中间体与佐剂进行第二偶联;或者
将佐剂与蛋白进行第三偶联,并将得到的第二中间体与抗原进行第四偶联。
需要说明的是,前述“第一”、“第二”、“第三”、“第四”等仅仅是用于区分,这表示上述定义不是同一个过程,但是并不表示先后次序,本领域技术人员不应理解为这是对本发明的限制。
如前所述,本发明制备所述抗肿瘤疫苗分子的方法至少有两种。第一种为:将抗原与蛋白进行第一偶联,并将得到的第一中间体与佐剂进行第二偶联。第二种为:将佐剂与蛋白进行第三偶联,并将得到的第二中间体与抗原进行第四偶联。
本发明对各个偶联的具体条件没有特别的限制,本领域技术人员能够结合本发明的上下文以及本领域的常规确定合适的条件。
如前所述,本发明的第三方面提供了本发明前述第一方面中所述的抗肿瘤疫苗分子在抗肿瘤疫苗中的应用。
以下提供本发明的几种优选的具体实施方式。
在本发明的一个优选的实施方式中,本发明提供图1a所示结构的抗肿瘤疫苗分子,在该抗肿瘤疫苗分子中,抗原分子和佐剂分子与同一个蛋白(也即为载体蛋白)共价连接后,得到内嵌佐剂三合一蛋白偶联物,作为抗肿瘤疫苗分子时能够产生高滴度igg抗体的免疫反应。如图1a所示,该抗肿瘤疫苗分子的结构式中,lk1和lk2均表示共价连接臂。在该优选的实施方式中,佐剂、抗原、蛋白、共价连接臂均如前文所述。
特别地,本发明的发明人发现,在应用tlr7激动剂作为佐剂时,能够明显更好地增强免疫刺激活性并减少副作用。因此,在本发明的另一个更优选的实施方式中,采用tlr7激动剂作为佐剂,bsa作为蛋白,与肿瘤相关糖肽抗原muc1三组分共价结合组成佐剂-蛋白-抗原疫苗分子,该疫苗分子的具体结构如图1b所示,其中lk1和lk2均表示共价连接臂。在该优选的实施方式中,抗原、蛋白、共价连接臂均如前文所述。该抗肿瘤疫苗分子不仅产生显著的igg抗体,并且诱导相对高水平的igg2a,导致抗体类型偏向于th1型细胞免疫。
本发明提供了结构新颖的三合一蛋白结合疫苗策略,即将佐剂共价结合到结合了抗原的载体蛋白上,该方案首次应用于抗癌(即抗肿瘤)疫苗领域。
优选实施方式下,本发明还具有如下具体的优点:
(1)由于结合的tlr7激动剂在载体蛋白结合抗原的结合物上的簇状排列,将大大改变药物动力学特性,促进结合物运输到淋巴结,增强免疫刺激活性并减少副作用。
(2)激活抗原呈递细胞(apcs)和激活t细胞。
(3)产生高亲和力的针对抗原的igg抗体和较高的igg2a抗体。
(4)产生的抗体能识别癌细胞,能够通过激活例如兔血清的补体依赖性细胞毒性(cdc)来启动对已识别的癌细胞的溶解。
(5)激发细胞毒性t淋巴细胞杀伤效应(ctl),介导更强的t细胞免疫。
本发明提供的三合一蛋白结合物(也即所述抗肿瘤疫苗分子)是设计高效免疫治疗抗癌疫苗的有效策略。
以下将通过实例对本发明进行详细描述。以下实例中,所使用的试验方法,如无特殊说明,均为常规方法。下述实例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:tlr7激动剂的制备
合成化合物2:将2-氯腺嘌呤(5.4g,31.8mmol)和钠(5.0g,217mmol)在乙二醇单甲醚(235ml,3.1mol)中混合,将混合物在140℃下搅拌回流10h。然后加入25ml水,加1mol/l盐酸至ph值=7,浓缩,再水洗抽滤,得到化合物2,不提纯直接进行下一步。
合成化合物3:将化合物2(0.7g,3.34mmol)、碳酸钾(3.2g,23.44mmol)、4-溴甲基苯甲酸甲酯(1.5g,6.68mmol)加入到10ml干燥n,n-二甲基甲酰胺(dmf)中,在60℃下搅拌回流8h。然后加入质量分数为5%的柠檬酸水溶液至无气泡产生,使用氯仿萃取,盐水洗,mgso4干燥,过滤,浓缩,反应混合物通过柱层析提纯,得到白色固体3。1hnmr(400mhz,dmso-d6)δ(ppm)8.10(s,1h),7.95(d,j=8.0hz,2h),7.43(s,1h),7.42(d,j=8.1hz,2h,2×苯环),7.30(s,2h,2×苯环),5.38(s,2h,nh2),4.32(t,j=4.7hz,2h,2h,ch2-o),3.85(s,3h,ch3-o),3.61(t,j=4.7hz,2h,2h,ch2-o),3.28(s,3h,ch3-o).13cnmr(101mhz,dmso-d6)δ(ppm)166.40(c=o),161.82(c2),157.23(c6),151.66(c4),142.93(c8),140.03,130.02,129.38,128.23(苯),115.59(c5),70.74(o-ch2-),65.82(-ch2-o),58.55(-och3),52.64(-och3),46.18(ch2-c6h4cooh).hrms计算值c17h20n5o4+[m+h]+:358.1510.实测值:358.1513.
合成化合物4:将化合物3(0.8g,2.2mmol)加入到氯仿(10ml)中,加入溴单质(227μl,4.4mmol),室温搅拌8h。然后加入饱和na2s2o3除去过量的溴,用氯仿萃取,有机相采用盐水洗,mgso4干燥,过滤,浓缩,反应混合物通过柱层析提纯,得到白色固体4。1hnmr(400mhz,dmso-d6)δ(ppm):7.96(d,j=8.1hz,2h,2×苯环),7.50(s,2h,nh2),7.36(d,j=8.1hz,2h,2×苯环),5.36(s,2h,ch2-c6h4co2ch3),4.33(t,j=4.7hz,2h,ch2-o),3.85(s,3h,ch3-o),3.61(t,j=4.7hz,2h,ch2-o),3.29(s,3h,ch3-o).13cnmr(101mhz,dmso-d6)δ(ppm):166.34(c=o),161.86(c2),156.20(c6),152.92(c4),141.78,130.13,129.51,127.82(苯),124.29(c8),115.87(c5),70.68(o-ch2-),66.02(-ch2-o),58.56(-och3),52.66(-och3),46.59(ch2-c6h4cooh).hrms计算值c17h19brn5o4+[m+h]+:436.0615,实测值:436.0619。
合成化合物5(定义为tlr7a):将化合物4(0.5g)加入到20ml的6m的naoh:meoh=4:1(v/v)中,100℃下搅拌回流4h。然后加1mol/l盐酸调节至ph值=7,浓缩后加水洗,将固体用甲醇溶解,反应混合物通过柱层析提纯,得到化合物5。1hnmr(400mhz,dmso-d6)δ(ppm):10.09(s,1h,co2h),7.90(d,j=7.9hz,2h,2×苯环),7.37(d,j=7.9hz,2h,2×苯环),6.53(s,2h,nh2),4.92(s,2h,ch2-c6h4co2h),4.24(t,j=4.7hz,2h,ch2-o),3.56(t,j=4.8hz,2h,ch2-o),3.25(s,3h,ch3-o).13cnmr(101mhz,dmso-d6)δ(ppm):167.58(c=o),160.35(c2),152.71(c6),149.59(c4),148.29(c8),142.48,130.41,130.07,127.90(苯),98.86(c5),70.67(o-ch2-),65.79(-ch2-o),58.52(-och3),42.64(ch2-c6h4cooh).hrms计算值c16h19n5o5+[m+h]+:360.1302.实测值:360.1304。
实施例2:tlr7激动剂与载体蛋白bsa偶联的制备
合成化合物14:在氩气保护下,将化合物5(0.03mmol)和edci(0.09mmol)溶解在dmf(1ml)中,最后加入nhs(n-羟基丁二酰亚胺)(0.09mmol),25℃下搅拌3h;然后将所得混合物用油泵旋干,得到化合物13。
bsa(0.3μmol,购自武汉出城正茂科技工程有限公司牌号为cc1050003)用pbs(2ml)溶解,将化合物13(0.006mmol)加入dmf中溶解,将两种溶液混合,在摇床上25℃下反应48h。得到的化合物14(定义为tlr7a-bsa)用超滤管(milliporeufc91009615m,10kd)离心过滤纯化并冻干。用maldi-tof-ms测试,经分析计算tlr7a与bsa共价连接的平均个数为6至7个。
实施例3:抗原muc1的制备
化合物8采用手动固相合成,操作步骤如下:
(1)rinkamideam(购自吉尔生化(上海)有限公司)树脂的活化
称取rinkamideam树脂306mg(0.2mmol)放入固相合成反应管中,使用干燥的二氯甲烷(dcm)(4ml)在氮气保护下溶胀30min。洗涤:使用干燥的dcm(3×3ml)和干燥(
(2)fmoc基团脱保护
氮气搅动下,在反应管中加入20%哌啶/dmf溶液(3ml,3×5min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(3)kaiser-测试
kaiser-测试通过观察树脂显色情况,判断氨基是否脱保护。显色剂成分主要是茚三酮,苯酚和吡啶。
用干净的药勺蘸取几颗树脂颗粒于干净的试管中,依次加入显色剂茚三酮,苯酚和吡啶各两滴,然后使用120℃热风枪加热1min,观察树脂颗粒的颜色。若变成蓝色,则说明氨基裸露,fmoc保护基脱去;若没有明显的颜色变化,说明,fmoc保护基没有脱去,即氨基未裸露。
(4)氨基酸的偶联
在样品瓶(10ml)中,称取氨基酸fmoc-aa-oh(3.0当量),pybop(3.0当量)加入干燥的dmf溶剂(2-3ml),使氨基酸完全溶解。然后加入dipea(6.0当量)混合均匀,加入清洗干净且溶胀好的树脂中,在氮气的保护下室温反应2h左右。
(5)kaiser-测试:加显色剂,热风枪加热,观察没有明显颜色变化,说明反应完全。
(6)重复(1)、(2)、(3)、(4)、(5)的步骤,直到氨基酸连接完毕。
(7)乙酰基团的脱除
氮气搅动下,加入水合肼:dmf:甲醇=1:1:1(v/v/v,3ml,2×15min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(8)将肽链从树脂上切除。
肽链合成完毕以后,用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护两小时,油泵旋干,乙醚沉淀,得到粗产品化合物8的白色粗产品固体。
(9)粗产品分析、鉴定、提纯。
通过306mg的rinkeamideam树脂进行多肽固相合成,肽链完全合成后,直接用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护,反应2h,油泵旋干,乙醚沉淀,得到化合物8。通过hplc、hrms(ei)和nmr鉴定。hplc色谱条件:5-90%d液(ch3cn)在e液(h2o+0.1%tfa)中,经30min,λ=220nm,保留时间为6.699min。化合物8的hrms(ei数据,计算值c59h98n18o23,计算值[m+h+na]2+,计算值m/z=725.3509.实测值:725.3215。1hnmr(600mhz,d2o)δ(ppm):4.87(d,1h,h1),4.64–4.63(m,2h,dα,rα),4.59–4.57(m,2h,aα),4.54–4.43(m,6h,pα,sα,tα),4.29–4.27(m,1h,vα),4.11–4.09(m,4h,tβ),4.05–4.02(m,1h,h3),3.99–3.88(m,5h,gα,h5),3.86–3.63(m,12h,sβ,pδ,h2,h4,h6),3.50–3.23(m,2h,rδ),2.96–2.79(m,2h,dβ),2.34–2.29(m,3h,pβ1),2.16–2.08(m,1h,vβ),2.05–2.01(m,6h,pβ2,ac-nh),2.00–1.87(m,6h,pγ),1.73–1.71(m,4h,rβ,rγ),1.42–1.33(m,6h,aβ),1.27–1.23(m,6h,tγ),0.99–0.97(m,6h,vγ).13cnmr(151mhz,d2o)δ(ppm):174.79,174.08,173.73,173.70,173.48,173.45,173.16,173.05,172.65,171.47,171.07,170.95,170.74,167.22,163.05(15×c=o),156.65(rζ),98.52(c1),75.36(c5),71.32(c4),68.45(c3),67.96,67.94(tβ),66.96(c6),61.26(sβ),60.97,60.65,60.27(pα),59.88(vα),59.56,58.87(tα),57.04(sα),55.15(c2),51.13(rα),50.22(dα),49.59,47.83,47.74(pδ),47.68,47.58(aα),41.99(rδ),40.40,40.26(gα),36.30(dβ),30.09(vβ),29.34(rβ),29.22,29.17,27.28(pβ),24.64(rγ),24.56,24.50,24.08(pγ),22.25(ac-nh),18.68,18.32(tγ),17.37(vγ),15.43,15.09(aβ)。
实施例4:抗原muc1方酸单酰胺的制备
化合物10采用人工固相合成,操作步骤如下:
(1)树脂7的fmoc基团脱保护
氮气搅动下,在反应管中加入20%哌啶/dmf溶液(3ml,3×5min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(2)kaiser-测试
kaiser-测试通过观察树脂显色情况,判断氨基是否脱保护。显色剂成分主要是茚三酮,苯酚和吡啶。
用干净的药勺蘸取几颗树脂颗粒于干净的试管中,依次加入显色剂茚三酮,苯酚和吡啶各两滴,然后使用120℃热风枪加热1min,观察树脂颗粒的颜色。若变成蓝色,则说明氨基裸露,fmoc保护基脱去;若没有明显的颜色变化,说明,fmoc保护基没有脱去,即氨基未裸露。
(3)氨基酸的偶联
在样品瓶(10ml)中,称取氨基酸fmoc-gly-oh(3.0当量),pybop(3.0当量)加入干燥的dmf溶剂(2-3ml),使氨基酸完全溶解。然后加入dipea(6.0当量)混合均匀,加入清洗干净且溶胀好的树脂中,在氮气的保护下室温反应2h左右。
(4)kaiser-测试:加显色剂,热风枪加热,观察没有明显颜色变化,说明反应完全。
(5)重复(1)、(2)步骤。
(6)乙酰基团的脱除
氮气搅动下,加入水合肼:dmf:甲醇=1:1:1(v/v/v,3ml,2×15min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(7)方酸二乙酯(6.0当量),dipea(6.0当量)加入干燥的dmf溶剂(2-3ml)混合均匀在氮气的保护下室温反应2h左右。
(8)将肽链从树脂上切除。
肽链合成完毕以后,用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护两小时,油泵旋干,乙醚沉淀,得到粗产品化合物10的白色粗产品固体。
(9)粗产品分析、鉴定、提纯。
通过306mg的rinkeamideam树脂进行多肽固相合成,肽链完全合成以后,直接用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护,反应两个小时,油泵旋干,乙醚沉淀,得到化合物10。通过hplc、hrms和nmr鉴定。hplc色谱条件:5-90%d液(ch3cn)在e液(h2o+0.1%tfa)中,经30min,λ=220nm,保留时间为7.152min。化合物10的hrms(ei)数据,计算值c67h105n19o27,[m+2h]2+计算值m/z=805.3803.实测值:805.3833。[m+h+na]2+计算值m/z=816.3713.实测值:816.3729。1hnmr(600mhz,cd4o)δ(ppm):4.81(d,1h,h1),4.77–4.71(m,2h,dα,rα),4.63–4.56(m,2h,aα),4.48–4.45(m,2h,-ch2-),4.43–4.34(m,6h,pα,sα,tα),4.23–4.21(m,2h,vα),4.17(m,1h,tβ),4.12–4.08(m,1h,h3),3.99–3.83(m,7h,gα,h5),3.81–3.60(m,12h,sβ,pδ,h2,h4,h6),3.26–3.17(m,2h,rδ),2.95–2.83(m,3h,dβ),2.27–2.20(m,3h,pβ1),2.13–2.11(m,1h,vβ),2.07–1.99(m,6h,pβ2,ac-nh),1.99–1.86(m,6h,pγ),1.70–1.67(m,4h,rβ,rγ),1.47–1.43(m,3h,ch3-),1.42–1.33(m,6h,aβ),1.26–1.18(m,6h,tγ),1.00–0.98(m,6h,vγ).13cnmr(151mhz,cd4o)δ(ppm):188.92,183.79,177.49,174.25,173.78,173.56,173.10,173.04,173.00,172.65,172.60,172.23,172.09,172.05,171.96,170.84,170.67,170.62,170.30(18c=o),160.71,160.46(c=c),157.11(rζ),98.56(c1),74.25(c5),71.62(c4),69.56(c3),69.50,68.86(tβ),68.70(c6),66.69(-ch2-),61.48(sβ),61.35,60.72,59.83(pα),56.91(vα),56.33,56.19(tα),56.05(sα),55.91(c2),55.76(rα),55.31(dα),50.57,50.57,50.04(pδ),49.83,48.15(aα),46.03(rδ),42.00,41.84,40.62(gα),34.71(dβ),30.00(vβ),29.11(rβ),29.03,28.96,27.99(pβ),24.76(rγ),24.70,24.52,24.42(pγ),22.05(ac-nh),18.36,18.17(tγ),15.99,15.86(vγ),15.74,15.30(aβ)。
实施例5:抗原muc1方酸单酰胺与载体蛋白bsa偶联的制备
合成化合物12:将化合物10(0.03mmol)和bsa(0.06μmol)溶于ph值=9.5的5ml的0.07m的na2b4o7/0.035mkhco3缓冲液中。在摇床上25℃下反应48h,得到的化合物12(定义为bsa-muc1)用超滤管(milliporeufc91009615m,10kd)离心过滤纯化并冻干。用maldi-tof-ms测试,经分析计算muc1与bsa共价连接的平均个数为9至11个。
实施例6:bsa-muc1偶联物与tlr7激动剂偶联的制备,定义该抗肿瘤疫苗分子为tlr7a-bsa-muc1。
合成化合物15:将bsa-muc1(化合物12)(0.12μmol)溶于pbs(1ml)中,加入用dmf溶解的化合物13(0.006mmol),在摇床上25℃下反应48h,得到的化合物15(tlr7a-bsa-muc1)用超滤管(milliporeufc91009615m,10kd)离心过滤纯化并冻干。用maldi-tof-ms测试,经分析计算tlr7a与bsa-muc1共价连接的平均个数为6至7个。
实施例7:包被抗原生物素-muc1的制备
化合物11采用手动固相合成,操作步骤如下:
(1)树脂9的fmoc基团脱保护
氮气搅动下,在反应管中加入20%哌啶/dmf溶液(3ml,3×5min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(2)kaiser-测试
kaiser-测试通过观察树脂显色情况,判断氨基是否脱保护。显色剂成分主要是茚三酮,苯酚和吡啶。
用干净的药勺蘸取几颗树脂颗粒于干净的试管中,依次加入显色剂茚三酮,苯酚和吡啶各两滴,然后使用150℃热风枪加热2min,观察树脂颗粒的颜色。若变成蓝色,则说明氨基裸露,fmoc保护基脱去;若没有明显的颜色变化,说明,fmoc保护基没有脱去,即氨基未裸露。
(3)生物素的偶联
在样品瓶(10ml)中,称取氨基酸生物素(3.0当量),hatu(2.0当量)和hoat(2.0当量)加入干燥的dmf溶剂(2-3ml),使氨基酸完全溶解。然后加入dipea(6.0当量)混合均匀,加入清洗干净且溶胀好的树脂中,在氮气的保护下室温反应2h左右。
(4)kaiser-测试:加显色剂,热风枪加热,观察没有明显颜色变化,说明反应完全。
(5)乙酰基团的脱除
氮气搅动下,加入水合肼:dmf:甲醇=1:1:1(v/v/v,3ml,2×15min),洗涤:使用dcm(3×3ml)和dmf(3×3ml)交替反复冲洗树脂。
(6)将肽链从树脂上切除。
肽链合成完毕以后,用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护两小时,油泵旋干,乙醚沉淀,得到粗产品化合物11的白色粗产品固体。
(7)粗产品分析、鉴定、提纯。
通过306mg的rinkeamideam树脂进行多肽固相合成,肽链完全合成以后,直接用tfa/tips/h2o(95:2.5:2.5,v/v/v)完全脱保护,反应2h,油泵旋干,乙醚沉淀,得到化合物11。通过hplc、hrms和nmr鉴定,hplc色谱条件:5-60%d液(ch3cn)在e液(h2o+0.1%tfa)中,经20min,λ=220nm,保留时间为8.498min。生物素-muc1糖肽11的hrms(ei)数据:计算值c71h115n21o26s,[m+h+na]2+计算值m/z=866.9004.实测值:866.8993.[m+2na]2+计算值m/z=877.8914,实测值:877.8909.1hnmr(600mhz,cd4o)δ(ppm):4.80(d,1h,h1),4.77–4.74(m,2h,h13,h14),4.62–4.55(m,2h,dα,rα),4.51–4.41(m,6h,pα,sα,tα),4.37–4.25(m,5h,vα,tβ),4.21–4.19(m,1h,h3),4.00–3.87(m,7h,gα,h5),3.87–3.65(m,12h,sβ,pδ,h2,h4,h6),3.65–3.60(m,1h,h13),3.24–3.18(m,2h,rδ),2.95–2.91(m,2h,dβ),2.87–2.69(m,2h,h12),2.32–2.29(m,2h,h7),2.26–2.18(m,3h,pβ1),2.12–2.10(m,vβ),2.05–1.87(m,12h,pβ2,ac-nh,pγ),1.87–1.84(m,1h,h10’),1.75–1.73(m,2h,h8),1.70–1.67(m,4h,rβ,rγ),1.48–1.46(m,2h,h9),1.33–1.30(m,1h,h10’),1.25–1.20(m,6h,tγ),1.01–0.98(m,6h,vγ).13cnmr(151mhz,cd4o)δ(ppm):176.71,174.78,174.32,174.27,174.22,173.94,173.87,173.82,173.48,173.32,173.19,172.47,172.13,172.11,171.92,171.86,171.54,165.97(18c=o),158.34(rζ),99.80(c1),75.48(c5),72.84(c4),70.08(c3),69.91,67.88(tβ),63.04(c6),62.56(c13),61.94(sβ),61.49,61.19,61.05(pα),60.23(c14),58.14(vα),57.41,57.28(tα),57.13(sα),56.99(c11),56.76(c2),56.55(rα),54.40(dα),51.80,51.27,51.05(pδ),49.77,49.37(aα),43.61(rδ),43.46,43.06,41.85(gα),40.85(c12),36.20(c7),35.95(dβ),31.17(vβ),30.34,30.26,30.19(pβ),29.43(c9),29.23(c10),26.35(c8),25.99(rγ),25.94,25.75,25.65(pγ),23.28(ac-nh),19.88,19.59(tγ),18.73(vγ),16.58,16.54(aβ)。
实施例8:小鼠免疫
购买6至8周大的雌性balb/c小鼠35只(购自华中农业大学动物实验中心)。具体的免疫时间进程分别为第1天,第15天和第29天,注射方式为腹腔注射。取血方式为断尾取血,取血时间:免疫前取空白血,第一次免疫2h后取血,以及每次免疫注射14天后取血,其中最后一次(第42天)为眼眶取血。血液取出后经离心机离心后取出血清,存储在-80℃。
表1:各组疫苗的组成
实施例9:体内细胞因子的测定
(1)抗原包被:每孔加入稀释的捕捉抗体(用包被液稀释200倍)100μl,加液完成后用保鲜膜将96孔板封好在4℃冰箱温育过夜。
(2)洗涤:将96孔板从冰箱中取出恢复到室温(25℃,以下相同),甩出包被液,用吸水纸轻轻吸干残留液体。每孔加入200μl的pbst溶液,甩出洗涤液,用吸水纸吸干。重复4次。
(3)填充蛋白:每孔加200μl的1%的bsa的pbs溶液(w/v),加液完成后用保鲜膜将其封好置于室温摇晃1h,洗涤同上。
(4)加入标准品/血清:
a)按照试剂盒说明书加入按浓度梯度稀释的标准品。
b)血清用稀释液稀释20倍,每孔加入100μl,设置两个复孔。用保鲜膜将其封好置于室温摇晃2h。洗涤同上。
(5)加入检测抗体:每孔加入100μl稀释的检测抗体(用稀释液稀释200倍)。加液完成后用保鲜膜将其封好置于室温摇晃1h。洗涤。
(6)加入avidin-hrp:每孔加入100μl稀释的avidin-hrp(用稀释液稀释1000倍)。加液完成后用保鲜膜将其封好置于室温摇晃30min。
(7)洗涤每孔加入200μl的pbst溶液静置30min后,甩出洗涤液,用吸水纸吸干。重复5次。
(8)底物显色反应:将显色液a和显色液b等体积混匀后,每孔100μl加入96孔板中。将96孔板置于室温下避光摇晃30min。最后每孔还需加入100μl终止液。将96孔板立刻放入酶标仪中,测450nm时的吸光值。用标准品的吸光度值绘制标准曲线,将血清的吸光度值代入标准曲线中求得血清中细胞因子的含量。
图2表示第一次免疫后2h取的血清分别用于ifn-γ和il-6测定,每个柱状代表5只小鼠的含量平均值,每只小鼠的血清独立重复三次,三次数值取平均数值,误差棒标识的是平均数标准误差(sem)。显著性差异相对于pbs组:**p<0.01;****p<0.0001;ns,显著性差异不明显。疫苗之间相互比较:**p<0.01;****p<0.0001;ns,显著性差异不明显。
实施例10:间接法非竞争elisa测定血液中抗体的含量
(1)包被:包被抗原生物素-muc1与亲和素(avidin)摩尔比4:1混合,用ph值=9.5包被液稀释,抗原(muc1)浓度为0.1μg/ml,每孔100μl,置于4℃冰箱过夜。
(2)洗涤:将96孔板从冰箱中取出恢复到室温,甩出包被液,用吸水纸吸干残留液体。每孔加入200μl的pbst溶液,甩出洗涤液,用吸水纸吸干。重复3次。
(3)封闭:每孔加入100μl的1%酪蛋白的pbs缓冲液(pbs缓冲液的浓度均为质量百分数,下同),37℃恒温箱温育1h,洗涤同上。
(4)抗原抗体特异性结合:用0.1%酪蛋白的pbs缓冲液稀释血清,稀释倍数为200、400、800、1600、3200、64000、128000、256000、512000、1024000、2048000、4096000、8192000、16384000。每孔加入100μl稀释液,设置空白和阴性对照。37℃恒温箱温育1h。洗涤同上。
(5)加入二抗:将羊抗鼠igg-hrp溶于pbst缓冲液中,用pbst缓冲液稀释至5000倍,混匀,每孔加入100μl稀释液,37℃恒温箱温育1h。加入二抗(igm-hrp,igg2a-hrp、igg2b-hrp、igg1-hrp、igg3-hrp、iga-hrp、ige-hrp)操作与此相同。洗涤同上。
(6)显色:每孔加入100μl显色液(一块板子需要底物缓冲液9.5ml+0.5mlf液(2mg/mltmb/无水乙醇)+32ulg液(35%过氧化氢尿素/水溶液)),震荡混匀,室温下避光保存5min。
(7)终止:每孔加入50μl终止液(2m的硫酸),放入酶标仪中混匀后读数,在450nm波长处测定各孔的吸光度值。
图3为对于第3次免疫后获得的血清,疫苗产生的抗muc1滴度评价(igg抗体滴度测试结果)。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。显著性差异相对于pbs组:**p<0.01;***p<0.001;ns,显著性差异不明显。疫苗之间相互比较:**p<0.01;***p<0.001;ns,显著性差异不明显。
图4表示对于第1、2、3次免疫后获得的血清,疫苗产生的抗muc1的igg滴度评价。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。
图5表示对于第1、2、3次免疫后获得的血清,疫苗产生的抗muc1的igm滴度评价。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。
图6表示对于第3次免疫后获得的血清,疫苗产生的抗muc1抗体亚型评价。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。显著性差异相对于pbs组:ns,显著性差异不明显;****p<0.0001。
实施例11:间接法非竞争elisa测定血液中抗体的含量
(1)包被:包被抗原bsa,用ph值=9.5包被液稀释,抗原(bsa)浓度为1.16μg/ml,每孔100μl,置于4℃冰箱过夜。
(2)洗涤:将96孔板从冰箱中取出恢复到室温,甩出包被液,用吸水纸吸干残留液体。每孔加入200μl的pbst溶液,甩出洗涤液,用吸水纸吸干。重复3次。
(3)封闭:每孔加入100μl1%酪蛋白的pbs缓冲液,37℃恒温箱温育1h,洗涤同上。
(4)抗原抗体特异性结合:用0.1%酪蛋白的pbs缓冲液稀释血清,稀释倍数为200、400、800、1600、3200、64000、128000、256000、512000、1024000、2048000、4096000、8192000、16384000。每孔加入100μl稀释液,设置空白和阴性对照。37℃恒温箱温育1h。洗涤同上。
(5)加二抗:将羊抗鼠igg-hrp溶于pbst缓冲液中,用pbst缓冲液稀释至4000倍,混匀,每孔加入100μl稀释液,37℃恒温箱温育1h。洗涤同上。
(6)显色:每孔加入100μl显色液(一块板子需要底物缓冲液9.5ml+0.5ml的f液(2mg/mltmb/无水乙醇)+32ul的g液(35%过氧化氢尿素/水溶液)),震荡混匀,室温下避光保存5min。
(7)终止:每孔加入50μl终止液(2m的硫酸),放入酶标仪中混匀后读数,在450nm波长处测定各孔的吸光度值。
图7表示对于第3次免疫后获得的血清,采用bsa包被板子,疫苗产生的抗bsa滴度评价。每个柱状代表5只小鼠的滴度平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。显著性差异相对于pbs组:*p<0.05;**p<0.01;****p<0.0001。疫苗之间相互比较:*p<0.05;****p<0.0001;ns,显著性差异不明显。
实施例12:mtt法测定mcf-7细胞活力
本实施例旨在探讨抗体是否能够通过激活cdc介导补体裂解。
(1)将mcf-7细胞用胰蛋白酶消化下来,加入10体积%的fbs/dmem吹打均匀,转移到96孔细胞培养板上(每孔8000个细胞)。
(2)然后用pbs洗涤3次,加入1:50稀释小鼠血清1%bsa/pbs(50μl/孔)。继续放在在孵育箱中2h。
(3)然后加入兔补体(1:50稀释)1%bsa/pbs(rc表示兔补体;hirc表示高温灭活的兔补体)(50μl/孔)孵化4h。
(4)准备0.5%的mtt/pbs溶液中添加(20μl/孔)并在37℃孵化2h。
(5)最后吸走上清液,加入dmso添加(150μl/孔)后反复吹打数次混均匀,在490nm波长下测定吸光度。mcf-7细胞的细胞存活率测定公式如下:
细胞存活率(%)=(实验/对照)×100%
图8为对于第3次免疫后获得的血清,mtt实验评价mcf-7细胞存活率。每个柱状代表5只小鼠平均值,而且每个数值独立重复三次,误差棒标识的是平均数标准误差。显著性差异相对于pbs组:*p<0.05;***p<0.001,****p<0.0001,ns,显著性差异不明显。疫苗之间相互比较:*p<0.05;****p<0.0001。
实施例13:流式细胞仪(facs)测定抗体与mcf-7细胞结合
检测候选疫苗诱导的抗体与mcf-7细胞结合,用荧光二抗染色细胞,然后进行流式细胞仪(facs)分析。
(1)将mcf-7细胞用胰蛋白酶消化下来,然后加入培养基转移到不同的锥形离心管(1×106细胞/管)中,用离心机1500g离心2min,吸出上清液。
(2)加入洗涤液(1%bsa/pbs)(300μl/管),离心,使细胞沉降在离心管底部,吸出上清液,重复3次。将小鼠血清样品(5只老鼠的混合血)用facs溶液稀释50倍(250μl/管),0℃孵育60min。
(3)离心吸出上清液。加入洗涤液(300μl/管),离心,使细胞沉降在离心管底部,吸出上清液,重复3次。将荧光标记的二抗用facs溶液稀释50倍(100μl/管),0℃孵育30min。
(4)离心吸出上清液。加入洗涤液(300μl/管),离心,使细胞沉降在离心管底部,吸出上清液,重复3次。最后每管用250μlfacs溶液溶解,混匀。
(5)通过流式细胞仪测定荧光强度。
图9表示免疫小鼠抗血清与mcf-7癌细胞结合的流式细胞仪(facs)分析。以pbs组(黑)为对照。这些图像是五个独立实验的代表。
实施例14:共聚焦显微镜法测定抗体与mcf-7细胞的结合
用小鼠血清染色mcf-7细胞,以确定其识别muc1靶点的潜力。
(1)首先,将mcf-7细胞用胰蛋白酶消化下来加入培养基,然后将其转移到共聚焦小皿中(1×106个细胞/皿),放入细胞培养箱12h。
(2)吸出培养基,用1%的bsa/pbs溶液清洗3次,然后用1%bsa/pbs溶液将小鼠血清稀释50倍(500μl/皿)于0℃孵育1h。
(3)吸出上清液,用1%的bsa/pbs溶液清洗3次,将荧光标记二抗用1%bsa/pbs溶液稀释50倍(500μl/皿)于0℃孵育30min。
(4)用1%的bsa/pbs溶液清洗3次,再用pbs洗涤2次,最后加入500μlpbs用共聚焦显微镜(leicatcssp8,wetzlar,germany)63倍油镜观察mcf-7细胞并拍照。
实施例15:ctl实验
(1)各组balb/c小鼠(n=5)分别于第1天、第15天和第29天皮下注射候选疫苗,免疫3次。第三次免疫后14天,取小鼠脾脏制成单细胞悬液,作为效应细胞进行ctl检测。
(2)将新鲜分离的脾细胞(1×106个细胞/孔)加入rpmi-1640中,与mcf-7细胞(1×106个细胞/孔)共孵育12h。然后采用乳酸脱氢酶(ldh)检测效应细胞对靶细胞的细胞毒性。
(3)到预定的检测时间点前1h,从细胞培养箱里取出细胞培养板,在“样品最大酶活性对照孔”中加入ldh释放剂(原有培养液体积的10%),加入ldh释放剂后反复吹打数次混均匀,然后继续在培养箱中孵育1h。
(4)到达预定时间后,将细胞培养板用多孔离心机250g离心机离心4min。然后分别吸取个孔的上清液120μl到另一个96孔酶标板,再加入ldh检测工作液(60μl/孔)。将96孔板在室温条件下避光孵育30min,在490nm波长下测定吸光度。同时,单独孵育mcf-7细胞和单独孵育脾细胞,测定自发ldh释放值。将mcf-7细胞置于不含fbs裂解液的rpmi-1640中孵育,测定ldh的最大释放值。细胞裂解率按下式计算:
细胞毒性(%)=(实验组-靶细胞自发/细胞最大酶活性的吸光度-靶细胞自发)×100%
图10表示ctl实验评价第3次免疫后脾细胞对mcf-7细胞的体外细胞毒性。每个柱状代表5只小鼠平均值,误差棒标识的是平均数标准误差。疫苗之间相互比较:*p<0.05;**p<0.01。
由上述疫苗免疫测试结果得知,本发明提供的抗肿瘤疫苗分子产生了显著高亲和力的针对肿瘤相关抗原或特异性抗原的igg抗体。产生的抗体能识别癌细胞,通过激活兔血清的补体依赖性细胞毒性(cdc)来启动对已识别的癌细胞的溶解。这些结果表明,本发明提供的内嵌佐剂蛋白偶联物策略的设计是设计高效免疫治疗抗癌疫苗的有效策略。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!