一种布渣叶提取物及其制备方法和应用与流程
[0001]
本发明涉及一种布渣叶提取物及其制备方法和应用。
背景技术:
[0002]
布渣叶,为椴树科植物破布叶(microcos paniculata l.)的干燥叶,其味微酸、性凉。《中国药典(一部)》称其“具有消食化积、清热利湿的功效,用于饮食积滞、感冒发热、湿热黄疸”。现代研究表明,布渣叶富含黄酮类、生物碱、三萜类、有机酸等多种生物活性成分,其中黄酮类化合物为其主要活性成分。黄酮类化合物具有调血脂、降血糖、抗血栓、清除体内自由基、增强肌体免疫功能等功效,黄酮类物质还可以改善糖脂代谢、保护肝肾组织、治疗心血管疾病,并且具有抗氧化和延缓衰老的作用。黄酮类成分主要包括牡荆苷、异牡荆苷、水仙苷等。
[0003]
目前,布渣叶黄酮的提取方法主要有:常压蒸煮法、索氏提取法、溶剂回流提取法、超声波提取法、微波辅助提取法等。上述提取方法存在活性成分提取率低、提取时间长、有机溶剂残留等缺点。目前,布渣叶提取物在食品和保健品领域的应用已有相关报道,其功效研究多围绕抗氧化、抗衰老等方面。但布渣叶提取物在化妆品领域应用研究仍有较大空间,尤其是布渣叶提取物在抑制皮肤色素沉积、美白、抗炎症损伤等方面的功效研究较少。
技术实现要素:
[0004]
基于上述现有技术的缺陷,本发明提供了一种布渣叶提取物,并提供了其制备方法和应用。本发明布渣叶提取物总黄酮含量提升,提取过程避免有机溶剂残留,提高了产品安全使用系数,从而使得布渣叶提取物得以充分利用。同时,本发明布渣叶提取物具有抗氧化、抗炎症损伤、抑制皮肤黄褐色素沉积和祛黄、抗雾霾的功效。
[0005]
本发明所要解决的技术问题是通过以下技术方案来实现的:本发明首先提供了一种布渣叶提取物,所述布渣叶提取物中总黄酮含量为1.04-4.07 mg/ml。
[0006]
根据本发明的一些优选实施方案,所述布渣叶提取物中总黄酮含量为1.95-4.07 mg/ml。
[0007]
根据本发明,所述布渣叶提取物采用微压提取工艺制备。
[0008]
根据本发明,所述布渣叶提取物在高温高压提取设备中进行即可。
[0009]
根据本发明,所述布渣叶提取物在高压蒸汽锅中进行。
[0010]
根据本发明,所述布渣叶提取物通过包括下述步骤的方法制备得到:将布渣叶粗粉过筛与水混合,在一定温度压力下提取,过滤得布渣叶提取物。
[0011]
根据本发明,所述提取温度为110-135℃。
[0012]
根据本发明,所述提取压力为0.07-0.19 mpa。
[0013]
根据本发明,所述提取时间为20-120 min。
[0014]
根据本发明的一些具体实施方案,所述提取温度为121℃-135℃。
[0015]
根据本发明的一些具体实施方案,所述提取压力为0.13-0.19 mpa。
[0016]
根据本发明的一些具体实施方案,所述提取时间为30-120 min。
[0017]
根据本发明的又一些具体实施方案,所述提取温度为135℃。
[0018]
根据本发明的又一些具体实施方案,提取压力为0.19 mpa。
[0019]
根据本发明的又一些具体实施方案,提取时间为30 min。
[0020]
根据本发明,所述布渣叶与水的料液比为1:20-1:60(m/m),例如1:20(m/m)、1:21(m/m)、1:22(m/m)、1:23(m/m)、1:24(m/m)、1:25(m/m)、1:30(m/m)、1:35(m/m)、1:40(m/m)、1:45(m/m)、1:50(m/m)、1:55(m/m)、1:60(m/m),以及上述数值之间的点值,限于篇幅限制及简明的要求,不再赘述。
[0021]
根据本发明的一些具体实施方案,所述布渣叶与水的料液比为1:20-1:40(m/m)。
[0022]
根据本发明的又一些具体实施方案,所述布渣叶与水料液比为1:30(m/m)。
[0023]
根据本发明,所述提取次数为1-2次。
[0024]
根据本发明,所述提取次数为2次。
[0025]
根据本发明,所用的水优选为去离子水。
[0026]
根据本发明,所述布渣叶提取物的制备方法还包括布渣叶粗粉过10-24目筛 (10目筛下24目筛上,备用)。
[0027]
根据本发明,所述布渣叶提取物的制备方法还包括过滤步骤。
[0028]
本发明再一方面提供了所述布渣叶提取物在护肤品和/或化妆品中的应用。
[0029]
本发明另一方面提供了布渣叶提取物的制备方法。
[0030]
根据本发明,所述布渣叶提取物制备方法包括以下步骤:将布渣叶粗粉过筛与水混合,在提取温度为110℃-135℃、提取压力为0.07 mpa-0.19 mpa下,提取20-120 min,得布渣叶提取物。
[0031]
根据本发明,所述布渣叶提取物在高温高压提取设备中进行即可。
[0032]
根据本发明,所述布渣叶提取物在高压蒸汽锅中进行。
[0033]
根据本发明的一些具体实施方案,所述提取温度为121℃-135℃。
[0034]
根据本发明的一些具体实施方案,所述提取压力为0.13-0.19 mpa。
[0035]
根据本发明的一些具体实施方案,所述提取时间为30-120 min。
[0036]
根据本发明的又一些具体实施方案,所述提取温度为135℃。
[0037]
根据本发明的又一些具体实施方案,提取压力为0.19 mpa。
[0038]
根据本发明的又一些具体实施方案,提取时间为30 min。
[0039]
根据本发明,所述布渣叶与水的料液比为1:20-1:60(m/m),例如1:20(m/m)、1:21(m/m)、1:22(m/m)、1:23(m/m)、1:24(m/m)、1:25(m/m)、1:30(m/m)、1:35(m/m)、1:40(m/m)、1:45(m/m)、1:50(m/m)、1:55(m/m)、1:60(m/m),以及上述数值之间的点值,限于篇幅限制及简明的要求,不再赘述。
[0040]
根据本发明的一些具体实施方案,所述布渣叶与水的料液比为1:20-1:40(m/m)。
[0041]
根据本发明的又一些具体实施方案,所述布渣叶与水料液比为1:30(m/m)。
[0042]
根据本发明,所述提取次数为1-2次。
[0043]
根据本发明,所述提取次数为2次。
[0044]
根据本发明,所用的水优选为去离子水。
[0045]
根据本发明,所述布渣叶提取物的制备方法还包括布渣叶粗粉过10-24目筛 (10目筛下24目筛上,备用)。
[0046]
根据本发明,所述布渣叶提取物的制备方法还包括过滤步骤。
[0047]
根据本发明,所述制备方法制备得到的布渣叶提取物中总黄酮得率为5.37%-8.17%。
[0048]
根据本发明一些具体实施方案,所述制备方法制备得到的布渣叶提取物中总黄酮得率为6.09%-8.17%。
[0049]
本发明再一方面提供了上述制备方法制备所得布渣叶提取物在护肤品和/或化妆品中的应用。
[0050]
本发明再一方面提供了包含上述布渣叶提取物和/或上述制备方法得到布渣叶提取物的制剂。
[0051]
根据本发明,所述制剂为固体制剂和/或液体制剂。
[0052]
根据本发明,所述液体制剂,其包括所述的布渣叶提取物、液体分散剂和护色剂。
[0053]
根据本发明,所述液体制剂通过向布渣叶提取物中加入活性炭脱色,过滤浓缩,复配液体分散剂和护色剂制成。
[0054]
根据本发明,所述液体制剂中活性炭添加量为布渣叶提取物的0.2wt%-2.0wt%,例如0.2wt%、0.3wt%、0.4wt%、0.5wt%、0.6wt%、0.7wt%、0.8wt%、0.9wt%、1.0wt%、1.1wt%、1.2wt%、1.3wt%、1.4wt%、1.5wt%、1.6wt%、1.7wt%、1.8wt%、1.9wt%、2.0wt%,以及上述数值之间的点值,限于篇幅限制及简明的要求,不再赘述。
[0055]
根据本发明一些具体实施方案,所述液体制剂中活性炭添加量为布渣叶提取物的0.5wt%。
[0056]
根据本发明,所述液体制剂中液体分散剂为甘油、1,3丙二醇、丁二醇、丙二醇中的一种或几种。
[0057]
根据本发明,所述液体制剂中液体分散剂为甘油。
[0058]
根据本发明,所述液体制剂中液体分散剂添加量为布渣叶提取物的10wt%-50wt%。
[0059]
根据本发明,所述液体制剂中液体分散剂添加量为布渣叶提取物的45wt%。
[0060]
根据本发明,所述固体制剂,其包括所述的布渣叶提取物和固体分散剂。
[0061]
根据本发明,所述固体制剂通过向布渣叶提取物中加入活性炭脱色,过滤浓缩,复配固体分散剂,真空冷冻干燥制成。
[0062]
根据本发明,所述固体制剂中活性炭添加量为布渣叶提取物的0.2wt%-2.0wt%,例如0.2wt%、0.3wt%、0.4wt%、0.5wt%、0.6wt%、0.7wt%、0.8wt%、0.9wt%、1.0wt%、1.1wt%、1.2wt%、1.3wt%、1.4wt%、1.5wt%、1.6wt%、1.7wt%、1.8wt%、1.9wt%、2.0wt%,以及上述数值之间的点值,限于篇幅限制及简明的要求,不再赘述。
[0063]
根据本发明,所述固体制剂中活性炭添加量为布渣叶提取物的0.5wt%。
[0064]
根据本发明,所述固体制剂中固体分散剂为壳聚糖、海藻糖、β-环糊精、聚乙烯基吡咯烷酮(pvp k30)中的一种或几种。
[0065]
根据本发明,所述固体制剂中固体分散剂为β-环糊精。
[0066]
根据本发明,所述固体制剂中固体分散剂添加量为布渣叶提取物的20wt%。
[0067]
本发明又一方面提供了所述布渣叶提取物液体制剂或固体制剂在护肤品中的应
用。
[0068]
根据本发明,所述布渣叶提取物或其液体制剂或其固体制剂可作为活性成分应用于制备具有抗氧化、抗衰老功效的护肤品中。
[0069]
根据本发明,所述布渣叶提取物或其液体制剂或其固体制剂可作为活性成分应用于制备抗炎症损伤功效护肤品中。
[0070]
根据本发明,所述布渣叶提取物或其液体制剂或其固体制剂可作为活性成分应用于制备抑制皮肤黄褐色素沉积或祛黄功效护肤品中。
[0071]
根据本发明,所述布渣叶提取物或其液体制剂或其固体制剂可作为活性成分应用于制备抗雾霾功效护肤品中。
[0072]
本发明有益效果:1. 本发明通过微压提取工艺制备布渣叶提取物,该制备方法提高了布渣叶黄酮得率,避免了有机溶剂的残留,缩短了提取时间,节约了生产周期。解决了现有技术中布渣叶总黄酮得率低,存在溶剂残留等问题。
[0073]
2. 经实验证实,本发明制备的布渣叶提取物具有抗氧化、抗炎症损伤、抑制皮肤黄褐色素沉积和祛黄、抗雾霾等功效;该布渣叶提取物和/或含布渣叶提取物的组合物可作为活性成分应用于抗氧化和/或抗衰老和/或抗炎症损伤和/或抗雾霾和/或祛黄功效化妆品中。
[0074]
附图说明
[0075]
图1是布渣叶提取物对蛋白非酶糖基化抑制率结果图;图2是布渣叶液体制剂对thp-1细胞存活率影响结果图;图3是布渣叶液体制剂对thp-1细胞炎症因子il-1β分泌量影响结果图。
具体实施方式
[0076]
下面结合具体实施例对本发明进行进一步阐述,但本发明并不局限于此。
[0077]
本领域的普通技术人员应当认识到,本发明并不限于实施例,任何对本发明的变换、变型都落入本发明的保护范围。
[0078]
下面实施例所述的实验方法,如无特殊说明,均为常规方法;所述的实验材料和试剂,如无特殊说明,均可从商业途径获得。
[0079]
下列实施例中,所用原料:布渣叶购于亳州市君源堂药材站。
[0080]
本发明中使用的仪器如表1所示。
[0081]
表1试验仪器1.提取溶剂筛选以粉碎过10-24目筛(10目筛下24目筛上,备用)的布渣叶为原料,选用数控超声波提取
设备,固定超声频率为40 khz,温度45℃,超声功率400 w,超声30 min,料液比为1:20 (m/m),以纯水、95%乙醇、丙酮、乙酸乙酯为提取溶剂,筛选提取布渣叶黄酮的提取溶剂,结果见表2。
[0082]
表2不同提取溶剂的对比 从表2可知,不同溶剂提取布渣叶总黄酮得率,乙醇最佳,纯水次之,丙醇和乙酸乙酯的最差。结合生产安全需求,乙醇用量较大,易引发爆炸、有机溶剂残留、刺激肌肤等问题,而水无毒,安全且易再生利用,故后续试验均以纯水为提取溶剂。
[0083]
2.总黄酮测试方法采用nano
2-al(no3)3比色法测试布渣叶提取物中的总黄酮得率(参考标准:gb/t 20574-2006蜂胶中总黄酮含量的测定方法 分光光度比色法)。
[0084]
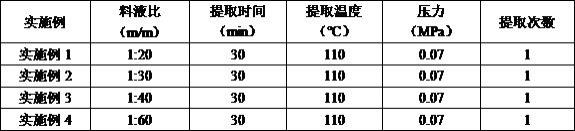
实施例1-4将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:20-1:60(m/m)比例添加去离子水,在提取温度110℃和提取压力0.07mpa条件下提取30 min,过滤得布渣叶提取物。实施例1-4微压制备工艺具体料液比(m/m)、提取时间(min)、提取温度(℃)、提取压力(mpa)和提取次数如表3所示。
[0085]
表3 微压制备工艺料液比参数优化实施例5-8将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:30(m/m)比例添加去离子水,在提取温度121℃和提取压力0.13mpa条件下提取20-120 min,过滤得布渣叶提取物。实施例5-8微压制备工艺具体料液比(m/m)、提取时间(min)、提取温度(℃)、提取压力(mpa)和提取次数如表4所示。
[0086]
表4 微压制备工艺提取时间参数优化
实施例9-12将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:30(m/m)比例添加去离子水,在110℃-135℃温度和0.07-0.19mpa压力条件下提取2次,每次30min,合并两次滤液,过滤得布渣叶提取物。实施例9-12微压制备工艺具体料液比(m/m)、提取时间(min)、提取温度(℃)、提取压力(mpa)和提取次数如表5所示。
[0087]
表5 微压制备工艺提取温度及压力参数优化对比例1(常压蒸煮技术)将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:20(m/m)比例添加去离子水,在95-100℃温度下、常压蒸煮2次,每次30 min,合并两次滤液,过滤得布渣叶提取物。
[0088]
对比例2(超声辅助提取法)将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:20(m/m)比例添加去离子水,设定功率为400w、温度为70-75℃,超声辅助提取2次,每次30 min,合并两次滤液,过滤得布渣叶提取物。
[0089]
对比例3将布渣叶粗粉过10-24目筛(10目筛下24目筛上,备用),按1:20(m/m)比例加入去离子水,设定对比例3的工艺参数,利用高压蒸汽锅在提取温度105℃、提取压力0.03mpa条件下提取时间30 min,提取1次,过滤得布渣叶提取物。
[0090]
实验结果:取原料布渣叶,以水为提取溶剂,通过实施例和对比例工艺提取,并测试提取物中布渣叶总黄酮得率和含量,测试结果如表6所示:表6布渣叶提取物中总黄酮得率和含量序号总黄酮得率(%)总黄酮含量(mg/ml)实施例15.372.69实施例25.861.95实施例36.121.53实施例46.221.04实施例56.092.03实施例66.332.11实施例76.182.06实施例86.212.07实施例98.134.07实施例107.522.51实施例118.122.71
实施例128.172.72对比例15.322.66对比例25.982.99对比例34.732.37根据实施例10-12中布渣叶黄酮测试结果得出,随着微压提取工艺提取温度和压力增大,总黄酮得率逐渐增加,当提取温度达到128℃后,继续增大提取温度,布渣叶黄酮得率基本保持不变;另一方面,提取温度的增加,导致设备耐压强度及安全风险系数增加,故建议微压提取工艺最高温度为135℃,对应压力为0.19 mpa。
[0091]
以总黄酮得率和总黄酮含量为研究目标,采用微压提取工艺制备布渣叶提取物,考察不同料液比(m/m)、提取时间(min)、提取温度(℃)及对应压力(mpa)对目标总黄酮得率和含量的影响,优化较优的制备工艺为:料液比1:20-1:60(m/m),提取时间为20-120 min,提取1-2次,微压提取温度为110-135 ℃,对应压力为0.07-0.19 mpa,此时总黄酮得率为5.37%-8.17%,布渣叶提取物中总黄酮含量为1.04-4.07 mg/ml。
[0092]
微压提取工艺制备布渣叶提取物总黄酮得率高,避免了有机溶剂的残留,缩短了提取时间。
[0093]
实施例13(液体制剂)实施例12得到的布渣叶提取物中加入0.5wt %活性炭脱色,过滤浓缩,复配45wt %液体分散剂甘油和0.12wt %护色剂edta 二钠,得到本发明布渣叶提取物液体制剂。
[0094]
实施例14(固体制剂)实施例12得到的布渣叶提取物中加入0.5wt%活性炭脱色,过滤浓缩,复配20wt%固体分散剂β-环糊精,真空冷冻干燥得到本发明的固体制剂。
[0095]
对比例4(液体制剂)对比例3得到的布渣叶提取物中加入0.5wt %活性炭脱色,过滤浓缩,复配45wt %液体分散剂甘油和0.12wt %护色剂edta 二钠,得到对比例4。
[0096]
对比例5(固体制剂)对比例3得到的布渣叶提取物中加入0.5wt%活性炭脱色,过滤浓缩,复配20wt%固体分散剂β-环糊精,真空冷冻干燥得到对比例5。
[0097]
试验例1:清除自由基清除abts自由基是分析抗氧化剂的一种常规方式。试验中用清除率表示受试物清除自由基的能力,清除率越大,则表示其抗氧化能力越强。具体试验方法:取0.0192 g abts加入5.00 ml去离子水溶解,混匀,制备成7 mmol
·
l-1 的abts储备液。称取0.1892 g过硫酸钾,加入5.000 ml去离子水溶解,混匀,制备成140 mmol
·
l-1
的储备液。将一定量的7 mmol
·
l-1 的abts和140 mmol
·
l-1
的过硫酸钾混合,室温下避光静置一段时间后,形成abts自由基储备液。取一定量的abts自由基储备液,用50%乙醇稀释,使最终测试阴性对照吸光值为0.70
ꢀ±ꢀ
0.02。
[0098]
将实施例13用50%乙醇稀释或溶解成质量浓度为0.5%、0.20%、0.10%、0.05%的测试液1;将实施例14用50%乙醇溶解成质量浓度为0.10%、0.05%、0.02%、0.01%的测试液2。
[0099]
将测试液1或测试液2、abts自由基储备液依次加入,涡旋混匀,置于酶标仪避光孵育,每间隔20 min,用酶标仪在波长734 nm处测定其吸光值。按式(1)计算abts自由基清除
率。
[0100]
式(1)中:a为测试液1或测试液2与abts溶液混合后od值,b为50%乙醇与abts溶液混合后od值,c为50%乙醇与测试液混合后od值。
[0101]
通过abts自由基试验评估布渣叶提取物(液体制剂实施例13、固体制剂实施例14)样品的抗氧化活性,试验结果见表7、表8。
[0102]
表7 实施例13中的布渣叶提取物对abts自由基清除率受试浓度(%)abts自由基清除率(%)0.50910.20680.10410.0519表8实施例14中的布渣叶提取物对abts自由基清除率受试浓度(%)abts自由基清除率(%)0.101000.051000.02660.0137由表7、表8结果可知,本发明制备布渣叶提取物具有清除abts自由基活性的功效,表明其在生化水平上具有抵御氧化损伤的能力。
[0103]
试验例2:抗炎症损伤采用脂多糖(lps)诱导,作用对象为raw264.7,模拟普遍的机体炎症,测试的炎症因子为il-1β。il-1β在免疫调节和炎症反应过程中起重要作用,被认为是炎症反应过程中引起发热反应的主要内源性介质之一,一旦炎症因子在皮肤细胞中含量增加,皮肤温度高于正常温度,将加剧皮肤炎症反应,引发机体炎症级联反应。
[0104]
基于lps诱导raw264.7细胞炎症模型的抗炎检测(il-1β)检测方法:(1)接种:将细胞接种至96孔板中,37℃,5%co2培养箱孵育过夜;(2)配液:根据表9配制受试物和阳性对照;(3)给药:根据表9实验分组和浓度设置,待96孔板中细胞铺板生长24h后,进行分组给药,每个处理组设3个复孔。组1中,空白对照与阴性对照组均加入含1
‰ꢀ
dmso的细胞培养基,阳性对照加入含有0.001%地塞米松的细胞培养基;组2中,空白对照与阴性对照组均加入细胞培养基,样品组加入含有相应浓度样品的细胞培养基,于37℃,5% co2培养箱继续培养24h。
[0105]
表9 实验分组和浓度设置
(4)lps诱导:培养24h后,将板内培养基吸出,均加入pbs轻洗一次,空白对照组加入细胞培养基,阴性对照组、样品组和阳性对照组加入含有lps的细胞培养基,37℃,5% co2培养箱继续培养24h后收集上清液。
[0106]
(5)il-1β含量检测:取各孔细胞上清液,根据elisa试剂盒操作说明,进行细胞炎症因子il-1β含量检测,结果见表10。
[0107]
表10炎症因子il-1β表达检测结果注:方法最低定量限(标曲最低浓度)为12.5 pg/ml,最低检出限为1pg/ml。
[0108]
与lps未诱导(lps-)组相比,lps诱导(lps+)引起炎症因子il-1β表达量极显著升高(p<0.01),表明lps诱导造模成功;与sc(0.1%dmso,lps+)相比,pc(地塞米松)组地塞米松在0.001%给药浓度下,可显著下调il-1β的表达量(p<0.01),表明本次检测结果有效。
[0109]
与nc(lps+)组相比,本发明的布渣叶提取物固体制剂(实施例14)在0.001%浓度下可显著下调il-1β因子含量,且抑制效果与阳性对照(0.001%地塞米松)相当(表10),与对比例5相比,抗炎效果更为显著。
[0110]
试验例3:抑制黄褐色素沉积皮肤老化的一个主要特征就是皮肤变黄和出现老年色斑,其主要原因是脂质过氧化和非酶糖基化反应。生物体内非酶糖基化反应,是指在无酶催化条件下,还原性糖的醛基或酮基与蛋白质等大分子的氨基发生美拉德(maillard)反应,生成黄褐色糖基化终产物(ages)。
[0111]
通过抑制蛋白非酶糖基化,可以反映物质对黄褐色素沉积的抑制作用。待测样品为:实施例12制得布渣叶提取物、对比例3制得布渣叶提取物以及本实验模型所用的阳性对照(vc乙基醚)。具体测试方法如下:将0.5mol/l牛血清白蛋白溶液(bca)与20 mg/ml果糖溶液等体积混合得到bca-果糖反应液。按表11顺序依次加入各种试剂,加完后涡旋混匀。37℃避光孵育5天,之后测试荧光强度,激发波长370 nm,发射波长为440 nm。
[0112]
根据荧光强度(rfu,relative fluorescence unit)按公式(2)计算待测样品对非酶糖基化反应的抑制程度。
[0113]
表11 非酶糖基化试验实验分组及添加量组别待测样品(μl)pbs缓冲液(μl)bca-果糖反应液(μl)待测组2000200阴性对照0200200空白组2002000 非酶糖基化试验结果如图1所示,实施例12制备的布渣叶提取物样品具有优异的抑制蛋白非酶糖基化作用,相同添加量下(1%)对蛋白非酶糖基化抑制率效果优于vc乙基醚(阳性对照)和同浓度下的对比例3,即表明布渣叶提取物在抑制黄褐色斑方面的效果优于vc乙基醚、对比例3。
[0114]
试验例4:抗雾霾测试近年来,国内多地频繁出现“雾霾”天气使人们更加关注环境及环境变化对人体的健康危害。然而空气中的悬浮颗粒物(particulate matters, pms)是导致大气污染的重要因素之一,严重地影响了人类健康。pms 是一种复杂的混合物包含金属、矿物质、有机毒素和微生物。
[0115]
皮肤为外界环境和身体提供了一个有效的生物屏障功能来抵御环境污染的重要组织及器官,有研究表明空气污染可以引起皮肤氧化应激和炎症,导致肌肤屏障功能退化、当雾霾含量超过其保护潜能同时破坏皮肤结构导致皮肤疾病(如红斑、水肿、增生、皮肤衰老、过敏性皮炎、牛皮癣甚至致癌)。
[0116]
本试验采用pm2.5诱导,作用对象是人单核细胞htp-1,考察雾霾对皮肤中il-1β分泌量的影响。
[0117]
(1)基于thp-1细胞安全浓度检测
本次检测样品设置6个浓度,每个浓度设置3个重复孔,同时,试验设置空白对照孔。本试验采用cck-8检测方法,筛选细胞给药的最大安全浓度。具体操作步骤如下:a.接种:取对数生长期thp-1细胞接种至96孔板,每孔加入100 μl;b.加药:按表12浓度设置,配制不同浓度的受试物,再加入不同浓度的受试物,轻轻吹打均匀。将培养板放置在37℃、5%的co2培养箱中孵育培养24 h。
[0118]
表12样品细胞毒性浓度设定样品名称样品浓度(w/v,%)实施例130.00125、0.0025、0.005、0.01、0.02、0.04对比例40.00125、0.0025、0.005、0.01、0.02、0.04 c.检测:细胞培养24 h后,每孔加入10 μl cck-8,轻轻混匀,37℃避光孵育1h。孵育结束后,用酶标仪读取od450nm值。
[0119]
d.计算公式:根据图2可知,确保实施例13制得布渣叶液体制剂在thp-1细胞存活率为85%以上,可知:确定实施例13中布渣叶液体制剂的最大安全给药浓度为0.04%,基于最大安全给药浓度测试,采用elisa法测试pm2.5对thp-1细胞炎症因子1l-1β分泌量的影响。
[0120]
(2)基于pm2.5诱导thp-1细胞炎症因子il-1β分泌量测试a接种:取对数生长期细胞接种至96孔板,每孔加入100 μl;b加药:按表13中浓度设置,配制不同浓度的受试物,再加入不同浓度的受试物,轻轻吹打均匀。将培养板放置在37℃、5%的co2培养箱中孵育培养4 h。
[0121]
c加刺激物:空白对照组加入1640培养基,阴性对照组、样品组加入含有pm
2.5
的细胞培养基,37 ℃,5%co2培养箱继续培养24 h后收集上清液。
[0122]
dil-1β含量检测:取各孔细胞转移至1.5 ml洁净ep管中,离心取上清液,根据elisa试剂盒操作说明,进行细胞炎症因子il-1β含量检测。
[0123]
e数据处理:试验中取得的各项数据经过excel软件进行处理与作图。用spss 17.0进行统计学分析,组间比较采用单因素方差分析(anova),p<0.05时判断为差异显著。
[0124]
表13 试验分组和浓度设置
抗雾霾测试结果(见图3所示)可知,实施例13制得布渣叶液体制剂具有优异抑制pm2.5+刺激源引发的thp-1细胞炎症因子il-1β分泌量,且效果优于对比例4,表明本发明的布渣叶提取物在抗雾霾功效化妆品上对肌肤防护效果优于对比例4。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1