还原型谷胱甘肽的冻干制剂的制作方法
1.本发明涉及化妆品领域,具体涉及一种含有还原型谷胱甘肽的用于皮肤护理的冻干制剂。
背景技术:
2.还原型谷胱甘肽(glutathione,gsh)是由l
‑
谷氨酸、l
‑
半胱氨酸和甘氨酸组成的含活性硫基的三肽。内含的活性硫基同自由基具有比较强的化学亲和力,可清除机体中超氧离子和自由基,最终达到抗氧化的作用。还原型谷胱甘肽在生物体内广泛存在且具有多种重要的生理功能,如解毒、消除疲劳、预防糖尿病等。因此,还原型谷胱甘肽在临床上广泛应用于酒精、药物(化疗药、抗肿瘤药、抗结核药等)及其他各种原因导致的肝损伤的辅助治疗。
3.近年来,随着医疗美容行业的迅猛发展,还原型谷胱甘肽与vc、传明酸等美白成分在国外常被用于美白针。而在国内医美行业,文献《调q红宝石点阵激光、还原性谷胱甘肽联合维生素c对黄褐斑患者的作用及面部美容的影响》(潘振玉等)和文献《皮内注射谷胱甘肽及氨甲环酸治疗黄褐斑的研究》(冯超等)中提到了还原型谷胱甘肽以皮内注射的形式与点阵激光等联合使用于黄褐斑的治疗应用。除此之外,根据文献《谷胱甘肽的制备及其应用》(江洁等)所述,还原型谷胱甘肽也被广泛的应用在食品工业。例如,其可作为抗氧化剂被添加到酸奶、婴儿食品以及蔬菜食品中,防止食品发生氧化、褐变等不良反应,保持其原有的营养价值。
4.然而,还原型谷胱甘肽的固体较稳定,而还原型谷胱甘肽水溶液在外界环境中容易受到光照、ph、温度等影响,极易氧化而产生氧化型谷胱甘肽。氧化型谷胱甘肽是由两分子还原型谷胱甘肽脱氢后通过二硫键相连的二聚体。氧化型谷胱甘肽不具有抗氧化性,只有还原型谷胱甘肽才能发挥重要的生理功能。而且,还原型谷胱甘肽在水溶液中氧化成氧化型谷胱甘肽后,其结构中的活性硫基或产生特征性的臭鸡蛋味,以上两点都大大限制了还原型谷胱甘肽在传统化妆品剂型中的应用。
5.现有技术亦公开了经过酰基化的还原型谷胱甘肽用于局部皮肤制剂,专利cn103167864a,cn103327958a,cn104814882a提到了s
‑
棕榈酰谷胱甘肽的局部组合物用于改善皮肤的皱纹和细纹、干燥、暗哑或缺乏光泽的外观。经过酰基化的谷胱甘肽增强了皮肤渗透性和经皮吸收从而改善皮肤状态。但是并未验证其稳定性和气味等问题,同时这种结构属于新物质,目前还不在《已使用化妆品原料名称目录》(2015版)中,对于新物质的申请、注册、以及审批时间都还有很长的路要走,而且存在审批不下来的风险。
6.本发明意外发现,采用冻干制剂加独立小包装后,能将还原型谷胱甘肽稳定于产品配方中,其生理活性高比例地保留到消费者使用时释放。同时,无水的配方剂型解决了还原型谷胱甘肽遇水极易氧化释放特征性臭味的问题,使还原型谷胱甘肽在配方中的添加量可真正达到起效量而不影响产品的使用感。
技术实现要素:
7.一方面,本发明提供了一种冻干制剂,其包含还原型谷胱甘肽和甘露醇,所述还原型谷胱甘肽与甘露醇的重量比为1:10至1:30。在优选的实施方式中,冻干制剂中还原型谷胱甘肽与甘露醇的重量比为1:15至1:20。
8.在优选的实施方式中,冻干制剂包含8
‑
72mg还原型谷胱甘肽和150
‑
1350mg甘露醇。
9.在优选的实施方式中,冻干制剂还包含聚乙烯吡咯烷酮。
10.在优选的实施方式中,冻干制剂还包含透明质酸钠。
11.在一个具体的实施方式中,冻干制剂包含15质量份的甘露醇,0.5质量份的pvp,0.12质量份的透明质酸钠和0.8质量份的还原型谷胱甘肽。
12.在优选的实施方式中,冻干制剂不含水。
13.另一方面,本发明还提供了一种制备冻干制剂的方法,包括:
14.a.将甘露醇以及任选的聚乙烯吡咯烷酮和透明质酸溶解在水中以获得溶液;
15.b.将还原型谷胱甘肽溶解在上述溶液中以获得还原型谷胱甘肽/甘露醇溶液;以及
16.c.对还原型谷胱甘肽/甘露醇溶液进行冻干。
17.在优选的实施方式中,冻干步骤在
‑
196℃下进行。
18.又一方面,本发明还提供了冻干制剂在制备用于皮肤护理的产品中的用途。
19.在优选的实施方式中,用于皮肤护理的产品是独立包装的冻干片的形式。
20.附图简要说明
21.图1显示了受试者的测试区域的皮肤亮度ita
°
值的变化趋势。
22.图2显示了受试者的测试区域的皮肤亮度ita
°
值的变化率。其中,显著性标注方法如下:“n.s.”表示无统计学差异,p>0.05;“*”表示有显著性差异,0.01≤p<0.05,“**”表示有显著性差异,0.001≤p<0.01;“***”表示有显著性差异,p<0.001。
23.图3显示了受试者的测试区域的皮肤弹性q1值的变化趋势。
24.图4显示了受试者的测试区域的皮肤弹性q1值的变化率。其中,显著性标注方法如下:“n.s.”表示无统计学差异,p>0.05;“*”表示有显著性差异,0.01≤p<0.05,“**”表示有显著性差异,0.001≤p<0.01;“***”表示有显著性差异,p<0.001。
25.图5显示了受试者的测试区域的皮肤纹理度ra值的变化趋势。
26.图6显示了受试者的测试区域的皮肤纹理度ra值的变化率。其中,显著性标注方法如下:“n.s.”表示无统计学差异,p>0.05;“*”表示有显著性差异,0.01≤p<0.05,“**”表示有显著性差异,0.001≤p<0.01;“***”表示有显著性差异,p<0.001。
具体实施方式
27.除非另有定义,本文所用的所有技术和科学术语具有本发明所属领域普通技术人员共同理解的相同含义。虽然与本文所述相似或等同的任何方法和材料可用于实施或测试本发明,但本文描述的是优选的方法和材料。对于本发明的目的,下面定义了以下术语。
28.本文所用术语“约”指与参比品的数量、水平、数值、维度、大小或用量相比,差异可高达30%、20%或10%的数量、水平、数值、维度、大小或用量。本文所使用的百分含量,除非
另有说明,均以重量计。
29.在全篇说明书和权利要求书中,除非另有要求,以下词语“包含”和其变体“含有”和“包括”应理解为意指包括所述的整体或步骤,或一组整体或步骤,但不排除任何其它整体或步骤,或其它一组整体或步骤。
30.发明人出乎意料地发现,在甘露醇存在的情况下冻干还原型谷胱甘肽时,所得冻干的冻干制剂能够承载高含量还原型谷胱甘肽,使得还原型谷胱甘肽能够稳定存在于冻干制剂中。
31.在传统的化妆品剂型中,通常包含水。但是,还原型谷胱甘肽水溶液在外界环境中容易受到光照、ph、温度等因素的影响,极易发生氧化而丧失还原型谷胱甘肽的重要生理学功能。而且,还原型谷胱甘肽在水溶液中氧化成氧化型谷胱甘肽的过程通常会导致特征性的臭鸡蛋味,大大限制了还原型谷胱甘肽在传统化妆品剂型中的应用。
32.因此,本发明的目的是提供一种能稳定地承载高含量的还原型谷胱甘肽的冻干制剂。在具体的实施方式中,所述能稳定地承载高含量的还原型谷胱甘肽的冻干制剂是冻干片的形式。该冻干片具有很好的涂抹肤感,同时解决了还原型谷胱甘肽在含水体系中的气味问题,并且有很好的还原型谷胱甘肽稳定性。
33.本发明提供了一种冻干制剂,其包含还原型谷胱甘肽和甘露醇。
34.在本发明的一些实施方式中,冻干制剂中还原型谷胱甘肽与甘露醇的重量比为约1:10至1:30。在优选的实施方式中,冻干制剂中还原型谷胱甘肽与甘露醇的重量比为约1:15至1:20。在一个具体的实施方式中,冻干制剂中还原型谷胱甘肽与甘露醇的重量比为约1:18.75。
35.在本发明的一些实施方式中,冻干制剂包含约8mg还原型谷胱甘肽和约150mg甘露醇。
36.在本发明的一些实施方式中,冻干制剂包含约16mg还原型谷胱甘肽和约300mg甘露醇。
37.在本发明的一些实施方式中,冻干制剂包含约24mg还原型谷胱甘肽和约450mg甘露醇。
38.在本发明的一些实施方式中,冻干制剂包含约32mg还原型谷胱甘肽和约600mg甘露醇。
39.在本发明的一些实施方式中,冻干制剂包含约40mg还原型谷胱甘肽和约750mg甘露醇。
40.在本发明的一些实施方式中,冻干制剂包含约48mg还原型谷胱甘肽和约900mg甘露醇。
41.在本发明的一些实施方式中,冻干制剂包含约56mg还原型谷胱甘肽和约1050mg甘露醇。
42.在本发明的一些实施方式中,冻干制剂包含约64mg还原型谷胱甘肽和约1200mg甘露醇。
43.在本发明的一些实施方式中,冻干制剂包含约72mg还原型谷胱甘肽和约1350mg甘露醇。
44.在本发明的一些实施方式中,冻干制剂包含8
‑
72mg还原型谷胱甘肽和150
‑
1350mg
甘露醇。
45.在本发明的一些实施方式中,冻干制剂包含8mg或更高含量的还原型谷胱甘肽。在更优选的实施方式中,冻干制剂包含40mg或更高含量的还原型谷胱甘肽。在更优选的实施方式中,冻干制剂包含72mg或更高含量的还原型谷胱甘肽。
46.在本发明的一些实施方式中,冻干制剂包含约200mg还原型谷胱甘肽或更多,如约300mg、400mg、500mg、600mg、700mg或800mg还原型谷胱甘肽。
47.在本发明的一些实施方式中,冻干制剂还包含聚乙烯吡咯烷酮。在优选的实施方式中,冻干制剂包含50mg聚乙烯吡咯烷酮。在优选的实施方式中,冻干制剂包含100、150、200、250、300、350、400、450mg或更高含量的聚乙烯吡咯烷酮。
48.在本发明的一些实施方式中,冻干制剂还包含透明质酸和/或其钠盐。在优选的实施方式中,冻干制剂包含12mg透明质酸和/或其钠盐。在优选的实施方式中,冻干制剂包含24、36、48、60、72、84、96、108mg或更高含量的透明质酸和/或其钠盐。
49.在一个具体的实施方式中,本发明的冻干制剂包含:15质量份的甘露醇,0.5质量份的pvp,0.12质量份的透明质酸钠和0.8质量份的还原型谷胱甘肽。
50.甘露醇为常用冻干赋性剂,提供冻干片的基础骨架,但是单独甘露醇得到的冻干片脆性大,非常容易碎块。pvp(聚乙烯吡咯烷酮)是高分子聚合物,能保证冻干片的硬度适当,同时提高机械强度,保证片剂的完整性。透明质酸钠是人体内的内源性多糖,利用透明质酸钠在溶液中的螺旋状构型,使谷胱甘肽嵌合到网状结构中,对活性成分起到了增效和缓释的作用。同时,透明质酸钠作为护肤品常用原料,加水崩解后在皮肤表面提供了精华般的柔滑肤感,以及优良的即刻/持久保湿功效。
51.本发明以还原型谷胱甘肽为活性物,还可以额外搭配其他水溶性活性物。例如,本发明可以额外搭配化妆品领域已知的具有改善皮肤功能的活性物。例如,本发明可以额外搭配具有提升皮肤亮度和/或改善皮肤弹性和/或减少皱纹的活性物。
52.在本发明的一些实施方式中,冻干制剂不含或基本不含水。
53.本发明制备得到的冻干制剂中,还原型谷胱甘肽能长期储存在体系中而基本不发生含量降低的现象。而且,冻干制剂的产品外观和气味无明显变化。同时,该冻干制剂在使用过程中具有很好的肤感,能稳定地大量承载还原型谷胱甘肽和/或在水溶液中不易稳定的功效成分。
54.本发明还涉及所述冻干制剂的制备方法,包括:
55.a.将甘露醇溶解在水中以获得包含甘露醇的溶液;
56.b.将还原型谷胱甘肽溶解在所述溶液中以获得还原型谷胱甘肽/甘露醇溶液;以及
57.c.对还原型谷胱甘肽/甘露醇溶液进行冻干。
58.冻干步骤可以通过例如机械制冷或液氮冷却的冷浴中在冷冻干燥瓶中进行。冷冻干燥器可用于更大规模的冻干。通常,冷冻温度是
‑
150℃至
‑
250℃。在本发明的一些实施方式中,冻干步骤在
‑
196℃下进行。
59.本发明还涉及所述冻干制剂在制备用于皮肤护理的产品中的用途。在本发明的一些实施方式中,用于皮肤护理的产品是独立包装的冻干片的形式。本发明采用冻干片配方作为基质,通过独立小包装的形式将还原型谷胱甘肽冻干片隔湿保存。还原型谷胱甘肽在
这种独立小包装的冻干体系中的稳定性能极大提升,同时满足产品气味、外观、涂抹肤感随时间进行而保持无差异现象。
60.下面结合具体实施例,以进一步阐述本发明。有必要在此指出的是,实施例只用于对本发明进行进一步的说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员可以根据上述本发明的内容做出一些非本质的改进和调整。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另有说明,所有的百分比和份数按重量计。
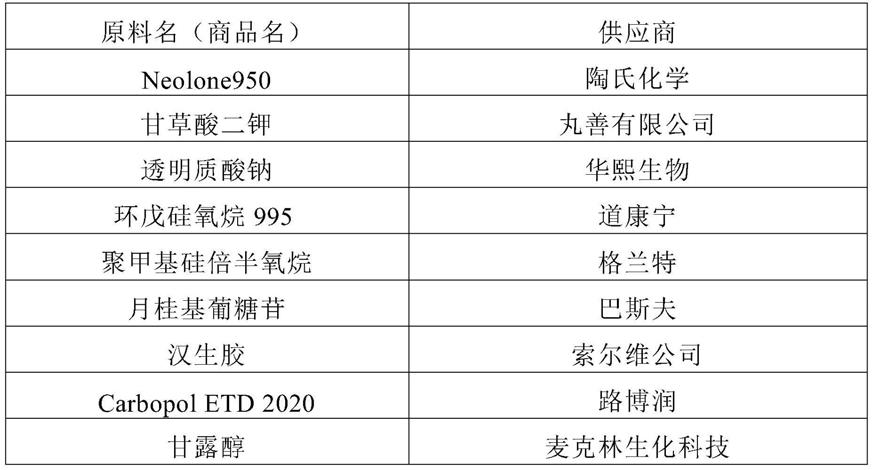
61.(一)实验材料
[0062][0063][0064]
(二)实验仪器
[0065]
1.固定搅拌器ika rw20
[0066]
2.恒温水浴锅上海一恒科学仪器有限公司hws 28型
[0067]
3.称量天平mettler toledo pl602
‑
s
[0068]
测试例1:还原型谷胱甘肽dpph清除能力的测定
[0069]
dpph(二苯代苦味酰基自由基)是一种稳定的长寿命自由基,其乙醇溶液呈深紫色,在517nm附近有强吸收。当有自由基清除剂存在时,由于与其单电子配对而使dpph光吸收减弱。dpph乙醇溶液退色程度与其接受的电子数呈定量关系,借此可评价抗氧化剂清除自由基的能力,或抗氧化活性的大小。
[0070]
准确称取dpph
·
1mg溶于24ml乙醇溶液中,超声振荡5min,充分振摇,避光保存于0~4℃。取dpph
·
溶液1.0ml,移液枪移取不同浓度的还原型谷胱甘肽样品液0.5ml,使混合液总体积1.5ml。充分混合,在室温下静置30min后,以原溶剂为空白调零,用微量比色皿在517nm处测吸光度值(ai)。按照上述操作,每个浓度平行测定3次并取平均值。同时用同法测dpph
·
溶液与0.01ml乙醇溶剂混合后的吸光度(ac),以及0.01ml样品溶液与2ml乙醇溶剂
混合后的吸光度(aj)。样品溶液对dpph
·
自由基的清除率%依下式计算:
[0071]
清除率(%)=〔1
‑
(ai
‑
aj)/ac〕
×
100%
[0072]
其中ai为样品对dpph
·
作用后的吸光度值;ac为未加样品时dpph
·
自身的吸光度值;aj为未加dpph
·
时反应样品自身的吸光度值。
[0073]
待测样品:将还原型谷胱甘肽在去离子水中配成2%质量比浓度的测试液,并进一步稀释成0.2%,0.02%和0.002%。ve作为同批次阳性对照,将样品置于冰箱中。
[0074]
测试结果如表1所示。
[0075]
表1:不同浓度的还原型谷胱甘肽样品的dpph清除率
[0076][0077]
ic50代表达到50%dpph清除率时对应的样品浓度,该值越小代表样品活性越强。同批次阳性对照ve的ic50为0.05mg/ml,测试中gsh的ic50为0.008mg/ml,约等于0.08重量%。因此,在本研究中,为了达成抗氧化功效,配方中gsh的浓度为10倍于ic50的浓度,0.8重量%。
[0078]
实施例1:含还原型谷胱甘肽冻干片
[0079]
在烧杯中加入83.58质量份的去离子水,边搅拌边投入15质量份的甘露醇,0.5质量份pvp,0.12质量份的透明质酸钠,快速搅拌至充分溶解,然后精确称取0.8质量份还原型谷胱甘肽加入溶液,快速搅拌至澄清透明。将溶液精确灌装到0.4ml铁板模具中进行脱气,得到的制剂在定量成型模具中用液氮速冻至
‑
196摄氏度冷冻干燥、除去溶剂后,得到还原型谷胱甘肽冻干精华片,备用。
[0080]
实施例2:含还原型谷胱甘肽压粉片
[0081]
在烧杯中称量83.58质量份的稻米淀粉,15质量份甘露醇,0.5质量份pvp,0.12质量份的透明质酸钠,以及0.8质量份还原型谷胱甘肽,用食品搅拌机快速搅匀,将混合后的粉末在0.4ml模具中压实成片。
[0082]
实施例3:含还原型谷胱甘肽化妆水的制备
[0083]
按照表2所述制备含还原型谷胱甘肽化妆水。
[0084]
表2
[0085][0086]
实施例4:含还原型谷胱甘肽精华液的制备
[0087]
按照表3所述制备含还原型谷胱甘肽精华液。
[0088]
表3
[0089][0090]
[0091]
测试例2:稳定性考察中还原型谷胱甘肽的含量跟踪
[0092]
将实施例1
‑
4的样品分别放置在4摄氏度,25℃(rt)和48摄氏度和光照四个稳定的恒温箱,考察两周。在检t0、t1、t3、t6和t14天时测制剂中还原型谷胱甘肽的含量,用液相色谱(hplc)进行定量。方法参照《中国药典》15版中谷胱甘肽的检测方法,用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取磷酸二氢钠6.8g与庚烷磺酸钠2.2g,加水1000ml使溶解,用磷酸调节ph值至3.0)
‑
甲醇(96:4)为流动相;检测波长为210nm。
[0093]
以下表4显示了实施例1冻干片制剂中还原型谷胱甘肽的残留%。
[0094]
表4
[0095][0096]
以下表5显示了实施例2压粉片中还原型谷胱甘肽的残留率%。
[0097]
表5
[0098][0099]
以下表6显示了实施例3化妆水中还原型谷胱甘肽的残留率%。
[0100]
表6
[0101][0102]
以下表7显示了实施例4精华液中还原型谷胱甘肽的残留率%。
[0103]
表7
[0104][0105]
通过对比不同剂型的含还原型谷胱甘肽的皮肤护理产品,经14天稳定性考察并对还原型谷胱甘肽进行跟踪定量验证发现,还原型谷胱甘肽无法稳定存在于含有水分的传统化妆品剂型。
[0106]
测试例3:嗅辩法
[0107]
选取30名闻香人员,这组闻香人员都经过了长期的闻香培训与闻香实验筛选。
[0108]
将实施例1
‑
4样品置于恒温恒湿的房间内,测试人员开始测试前,提前30分钟进入房间预先平衡。
[0109]
首先,测试人员对放置于表面皿中的实施例1
‑
4样品进行气味打分。
[0110]
其次,测试人员根据产品试用方法,对产品在皮肤上涂抹过程中产生的气味打分。根据实施例1&2的使用方法,样品与350mg去离子水混合后,涂抹于皮肤,实施例3&4样品直接涂抹于皮肤,分别在初始、30min、1hr,给皮肤上的产品残留气味打分。
[0111]
a:气味正常,可以接受
[0112]
b:气味不太愉悦,还能忍受
[0113]
c:气味非常不愉悦,无法忍受
[0114]
结果如下所示。
[0115]
表8
[0116]
样品编号初始30min1hr2hr实施例1aaaa实施例2aaaa实施例3bccc实施例4bccc
[0117]
通过对比不同剂型的含还原型谷胱甘肽的皮肤护理产品,样品本身和涂抹到皮肤上产生的残留气味,发现0.8%的还原型谷胱甘肽在含有水基的产品中产生了浓郁强烈的不愉悦的气味,这种气味大大限制了还原型谷胱甘肽作为一款优秀的抗氧化剂在传统化妆品配方中的应用。相比之下,在实施例1
‑
2的无水剂型中,还原型谷胱甘肽经过溶解后快速涂抹于皮肤,水份在人体皮肤快速蒸发,整个过程中还原型谷胱甘肽未曾出现不愉悦气味。因此,我们在后续研究中不再考察含水基的剂型体系。
[0118]
对比例
[0119]
根据现有技术中的两篇冻干赋形剂专利制备对比例。cn 10769810提出了一种操作容易度优异的片剂型冷冻干燥化妆品,cn 103893770提出了一种不含骨架成分的冻干赋
形制剂。根据上述两篇专利中的配方架构,本发明分别将集中的冻干制剂配方作为对比例,进行比较。
[0120]
对比例1:
[0121]
将下表中的成分溶解于去离子水中,使其流入成型模具内,冷冻后进行减压使其升华,从而以残留干燥物的形式得到了片剂型冷冻干燥护肤制剂,备用。
[0122]
表9:对比例1的配方表
[0123]
原料名添加量(%)海藻糖85.2%peg
‑
40010.0%透明质酸钠0.5%黄原胶0.3%peg
‑
13
‑
癸基十四醇聚醚
‑
242.8%还原型谷胱甘肽0.8%尼泊金甲酯0.4%
[0124]
对比例2:
[0125]
参考专利cn 103893770中的冻干剂型配方进行制备。将透明质酸100mg,精确灌装进入0.4ml模具中,精准称量4mg还原型谷胱甘肽溶解于0.4ml的去离子水后,灌注进含有100mg透明质酸的模具中,搅拌使水分散在粉体中,速冻至
‑
196摄氏度,冻干成为护肤固体精华,备用。
[0126]
对比例3:
[0127]
在烧杯中加入93.4质量份的去离子水,边搅拌边投入5质量份的甘露醇,0.8质量份的透明质酸钠,快速搅拌至充分溶解,然后精确称取0.8质量份gsh加入溶液,快速搅拌至澄清透明。将溶液精确灌装到0.4ml铁板模具中进行脱气,得到的制剂在定量成型模具中用液氮速冻至
‑
196摄氏度冷冻干燥、除去溶剂后,得到gsh冻干精华片,备用。
[0128]
对比例4:
[0129]
在烧杯中加入79.1质量份的去离子水,边搅拌边投入20质量份的甘露醇,0.1质量份pvp,快速搅拌至充分溶解,然后精确称取0.8质量份gsh加入溶液,快速搅拌至澄清透明。将溶液精确灌装到0.4ml铁板模具中进行脱气,得到的制剂在定量成型模具中用液氮速冻至
‑
196摄氏度冷冻干燥、除去溶剂后,得到gsh冻干精华片,备用。
[0130]
测试例4:成型性、溶解速度、使用触感、吸收感的评估
[0131]
根据如下方法,对实施例1
‑
2和对比例1
‑
4的冻干片制剂进行评价:
[0132]
<成型性>
[0133]
将制备的样品用手指从模具中取出,肉眼观察外观形貌、光滑度、是否凹陷、裂纹等。
[0134]
a:样品在模具中按模具光滑成型
[0135]
b:样品在模具中基本照模具成型
[0136]
c:样品在模具中成型,但产生了小裂纹
[0137]
d:样品在模具中凹陷,未按成型模具成型
[0138]
e:样品在模具中产生严重碎裂,凹陷,完全无法成型
[0139]
<溶解速度>
[0140]
将制备得到的约50mg样品放在手掌上,滴加0.35ml去离子水后,用手指融合直至样品完全溶解,按下述标准对样品完全溶解所需的时间进行评价。
[0141]
a:样品瞬间2秒内完全溶解
[0142]
b:样品完全溶解,但需要10秒以上的时间
[0143]
c:样品稍微有点不溶解,产生部分残留团块
[0144]
d:样品不易溶解,产生了大块残留
[0145]
e:样品完全无法自行溶解
[0146]
<使用触感>
[0147]
将制备得到的约50mg样品放在手掌上,滴加0.35ml去离子使其完全溶解,将得到的精华液涂抹于一只手手背,另一只手的手指在手背上慢慢打圈按摩直至完全吸收。由10名专业肤感评测小组成员按照下述标准对样品的使用触感进行评价。
[0148]
a:样品溶解后在皮肤表面提供充分湿润感,按摩过程中无黏腻
[0149]
b:样品溶解后在皮肤表面提供一定湿润感,按摩过程后段发粘
[0150]
c:样品溶解后皮肤表面有湿润感,但肤感黏腻
[0151]
d:样品溶解后不滋润,涂抹过程中明显粘感
[0152]
e:样品溶解后肤感严重黏腻,不亲肤不滋润
[0153]
<吸收感>
[0154]
将制备得到的约50mg样品放在手掌上,滴加0.35ml去离子使其完全溶解,将得到的精华液涂抹于于皮肤表面按摩直至完全吸收。由10名专业肤感评测小组成员按照下述标准对样品的吸收感进行评价。
[0155]
a:溶解后的精华液在皮肤表面快速完全吸收,吸收后皮肤表面光滑
[0156]
b:溶解后的精华液在皮肤表面完全吸收,吸收后皮肤表面较光滑
[0157]
c:溶解后的精华液在皮肤表面较慢吸收,吸收后皮肤表面有阻力,不光滑
[0158]
d:样品溶解后在皮肤上吸收很慢,残留感重,皮肤表面发粘
[0159]
e:样品溶解后在皮肤上长时间无法完全吸收
[0160]
测试结果如下所示。
[0161]
表10
[0162]
样品#成型性溶解速度使用触感吸收感实施例1aaaa实施例2eeee对比例1cbab对比例2bdbd对比例3dccd对比例4bbbc
[0163]
对比实施例1
‑
2和对比例1
‑
2,可以发现实施例2的压片干粉剂型作为皮肤护理制剂在各个方面的使用感都很不理想。冻干剂型中,对比例1和4得到的样品成型性较差,表面出现较多裂纹,外观颗粒度较粗;对比例2和3得到的样品溶解速度与吸收感不佳,遇水溶解不彻底且肤感厚重黏腻。相比之下,实施例1中的样品在各方面表现出色,外观细腻均匀,遇
水崩解速度快且肤感吸收快,不粘腻。
[0164]
测试例5:皮肤护理功效临床评估
[0165]
采用实施例1的样品进行功效临床评估。
[0166]
本试验通过临床评判和图像评估的方法,在受试者应用本发明的还原型谷胱甘肽皮肤护理制剂后,对受试者的肤色、皮肤弹性和皮肤纹理度状况进行评判,以评估还原型谷胱甘肽皮肤护理制剂的功效。
[0167]
试验对象:
[0168]
共10名年龄范围在30~55岁的中国健康女性受试者,连续使用测试产品42天。
[0169]
试验方法:
[0170]
受试者随机分为还原型谷胱甘肽冻干精华组(即实施例1的冻干片,记为ga)和空白对照组(记为gd),ga组受试者每天在家根据要求使用产品,gd受试者不使用任何产品。所有受试者在研究期间可以持续使用彩妆产品,可以使用清洁类产品,停用其它面部护肤品。每名受试者在接下来的42天内使用产品并进行观察。受试者按要求在第1天(在第1天进行随机化)、第28天及第42天到达实验室并完成测试。
[0171]
仪器测试:
[0172]
皮肤颜色:皮肤色差测试探头colorimeter cl400(courage&khazaka,德国)在脸颊测试区域测定皮肤颜色3次,取平均值,数据存在显著性差异,支持改善肤色效果的宣称。
[0173]
皮肤弹性:皮肤弹性测试仪cutometer(courage&khazaka,德国)在脸颊测试区域测定皮肤弹性3次,取平均值,数据存在显著性差异,支持提升皮肤弹性效果的宣称。
[0174]
皮肤纹理度分析:皮肤快速光学成像系统derma top在眼角测试区域采集derma top图像1次,并分析皮肤纹理度数据,数据存在显著性差异,支持淡化皱纹效果的宣称。
[0175]
统计学方法:
[0176]
应用excel软件,对各个测量值进行描述性统计,包括数量、均值、标准差、最小值和最大值等。
[0177]
应用spss分析软件,将不同时间点的测量值与基础值比较,采用shapiro
‑
wilk test进行数据改善值正态分布的显著性检验。sig.(双侧)>0.05,则呈正态分布,进行配对t检验,显著性差异水平α取0.05。若sig.(双侧)<0.05,则呈非正态分布,进行wilcoxon符号秩检验,显著性差异水平α取0.05。
[0178]
使用产品后的变化量(
△
差值)=使用后数据
‑
使用前数据
[0179]
使用产品后的提升/改善(变化率)=(使用后数据
‑
使用前数据)/使用前数据
[0180]
临床评估结果如下所示。
[0181]
表11显示了皮肤亮度ita
°
值测试结果。
[0182]
表11
[0183][0184]
受试者的测试区域的皮肤亮度ita
°
值变化趋势及变化率如图1
‑
2所示。
[0185]
结果表明,测试产品ga使用28天后,脸颊皮肤明亮度ita
°
值显著性升高5.82%,说明28天后具有显著性提亮肤色功效。而且,测试产品使用42天后,脸颊皮肤明亮度ita
°
值显著性升高9.96%,说明42天后具有显著性提亮肤色功效。
[0186]
表12显示了脸颊皮肤弹性q1值的测试结果。
[0187]
表12
[0188][0189]
受试者测试区域皮肤弹性q1值变化趋势及变化率如图3
‑
4所示。
[0190]
结果表明,测试产品ga使用28天后,脸颊皮肤弹性q1值显著性升高10.96%,说明28天后具有显著性提升皮肤弹性功效。而且,测试产品使用42天后,脸颊皮肤弹性q1值显著性升高12.54%,说明42天后有显著性提升肌肤弹性功效。
[0191]
表13显示了皮肤纹理度ra值的测试结果。
[0192]
表13
[0193][0194]
受试者测试区域皮肤纹理度ra值化趋势及变化率如图5
‑
6所示。
[0195]
结果表明,测试产品ga使用28天后,眼角皮肤纹理度ra值降低6.68%,说明28天后具有显著性淡化皱纹功效。而且,测试产品使用42天后,眼角皮肤纹理度ra值降低7.49%,说明42天后具有显著性淡化皱纹功效。
[0196]
由上述试验结果可知,使用产品ga 28天和42天后,皮肤亮度均显著性提升,皮肤弹性显著性增加,眼角皱纹显著性减少。因此,本发明具有改善皮肤功能,外用于脸部皮肤后,可提升皮肤亮度,改善皮肤弹性,减少皱纹。
[0197]
而且,在试验过程中,所有受试者均未出现皮肤红斑、浸润、水肿、丘疹、水疱等皮肤不良反应,未出现痤疮、毛孔变粗大、皮肤肤色变暗沉、屏障受损相关症状(包括但不限于皮肤瘙痒、刺痛、发热、紧绷、红肿、红血丝增多等)及过敏性症状等情况。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1